14.08.2019
Kimyasal elementlerin metallerinin ortak özellikleri nelerdir. Kimyasal element olarak metaller
Erken çocukluktan itibaren böyle bir nesnenin metalden yapılmış olduğu ifadesiyle karşılaşıyoruz. Metal nedir?
Metaller, artan güç, iyi termal ve elektriksel iletkenlik, süneklik, süneklik, metalik parlaklık gibi tüm grup için ortak özelliklere sahip belirli bir kimyasal element grubudur (ayrıca alaşımları).
Bilinen tüm kimyasal elementlerin neredeyse% 80'i metallere aittir (118'in 96'sı).
Metallerin fiziksel özellikleri
Civa hariç tüm metaller normalde katıdır. Sertlik açısından, en yumuşak metal sezyumdur (10 noktalı Mohs ölçeğinde 0.2 puan). En zoru tungsten. Sertliği 6 puan. Demirin sertliği 4 puandır.
Metallerin erime sıcaklıkları (sıvı duruma geçiş): cıva için - 39º ila tungsten için 3 410º arasında değişir. Tüm alkali metallerin erime noktaları düşüktür ve kalay ve kurşun olağan olanlardır. Evde bir gaz yakıcıda bile eritilebilirler. Çoğu metal, yüksek sıcaklıklara sahip özel fırınlarda eritilir.
Metallerin kristal kafeslerinde serbest mobil elektronların varlığı nedeniyle, hepsi elektrik ve ısıyı çok iyi iletir. Metallerden en iyi elektrik iletkenleri gümüş, bakır ve alüminyumdur. Elektrik tesisatı yaptıkları son iki metalden olmaları tesadüf değildir.
Metallerin mükemmel termal iletkenliği ile, günlük yaşamda da sıklıkla karşılaşırız. Suyu kaynatmak için metal bir tavaya döküyoruz ve sobaya koyuyoruz. Teng metali ısıtır ve metal neredeyse tüm termal enerjiyi suya aktarır.
Metallerin kimyasal özellikleri
Kimyasal reaksiyonlar sırasında, tüm metaller elektronlarını kolayca bağışlar ve indirgeyici ajan olarak işlev görür.
Hemen hemen tüm metaller oksijen ile oksitlenir. Alkali metaller (lityum, kalsiyum) normal koşullar altında oksijen ile reaksiyona girer. Diğer metallerin oksijenle oksidasyonu yüksek bir sıcaklık gerektirir. Örneğin, bir bakır teli ateşte ısıtırsanız, bakır havadan oksijenle etkileşime girecek ve siyah bir film (bakır oksit) ile kaplanacaktır:
- 2Cu + O 2 → 2CuO
Altın ve platin oksijenle reaksiyona girmez.
Diğer oksitleyici ajanlardan klor ve kükürt metallerle reaksiyona girer. Demir talaşı ve kükürt tozunu karıştırır ve karışımı ısıtırsanız, gözlerimizden önce demir sülfür alırız:
- Fe + S → FeS
Farklı metallerin indirgeme aktivitesi farklıdır. Faaliyetlerinde metaller aşağıdaki gibi dağıtılır:
- Li - K - Ba - Sr - Ca - Na - Mg - Al - Mn - Zn - Cr - Fe - Ca - Co - Ni - Sn - Pb - (H2) - Cu - Hg - Ag - Pt - Au.
Metal bu sırada ne kadar solda kalırsa o kadar aktif olur. Önceki eleman metali sağa kaydırabilir. Örneğin, bir parça demir bir bakır sülfat çözeltisi ile bir test tüpüne yerleştirilirse, kahverengi bir kaplama (bir bakır filmi) ile kaplanacaktır:
- Fe + CuSO4 → FeSO4 + Cu
Hidrojenin (H2) solundaki metaller hidroklorik asitten değiştirebilir. Bir çinko parçası hidroklorik aside indirilirse, hidrojen açığa çıkmaya başlar:
- HCl + Zn → ZnCl2 + H2
Alkali metaller su ile kolayca reaksiyona girer. Bir su kabına bir parça sodyum yerleştirilirse, hidrojen aktif olarak serbest bırakılacak ve alkali oluşacaktır:
- 2Na + 2H2O → 2NaOH + H2
Metal uygulaması
Yararlı özellikleri nedeniyle metaller insan yaşamına sıkıca girmiştir. Bir adam, metallerin gücünü kullanarak, binaların karkaslarını (küçük pavyonlardan büyük gökdelenlere kadar), araba gövdelerini (arabalar, vagonlar, gemiler, takım tezgahları) ve çeşitli araçların çalışma parçalarını yapar.
tanım
Doğada olmak
Metal özellikleri
Karakteristik özellikler metallerden
Fiziksel özellikler metallerden
Metallerin kimyasal özellikleri
Mikroskobik yapı
Alkali metaller
Alkali metallerin genel özellikleri
Alkali metallerin kimyasal özellikleri
Alkali metallerin üretimi
hidroksitler
karbonatlar
rubidyum
Toprak alkali metaller
kalsiyum
stronsiyum
Geçiş metalleri
Geçiş elemanlarının genel özellikleri
Metal uygulaması
İnşaat malzemeleri
Elektrik Malzemeleri
Alet malzemeleri
Hikaye
Maden Çıkarma metalurji
Metal (adı lat. metallum - mine'den gelir) - yüksek termal ve elektrik iletkenliği, pozitif sıcaklık direnci katsayısı, yüksek süneklik, vb. gibi karakteristik metalik özelliklere sahip bir grup element. Metallerin yaklaşık% 70'i metallere aittir.
Metal











![]()





















![]()


![]()





Doğada olmak
Çoğu metal, doğada cevher ve bileşikler şeklinde bulunur. Oksitler, sülfitler, karbonatlar ve diğer kimyasal bileşikler oluştururlar. Saf metalleri ve daha ileri uygulamalarını elde etmek için, bunları cevherlerden izole etmek ve temizlik yapmak gerekir. Gerekirse, alaşımlama ve diğer metal işleme gerçekleştirilir. Bilim bunu inceliyor. metalurji. Metalurji demir cevherlerini ayırır ( bez) ve renk (dahil değildir) demir, toplamda yaklaşık 70 ürün). ve platin değerli metaller için de geçerlidir. Buna ek olarak, küçük miktarlarda deniz suyunda, bitkilerde, canlı organizmalarda bulunurlar (önemli bir rol oynarken).
İnsan vücudunun% 3'ünün metallerden oluştuğu bilinmektedir. Hücrelerimizdeki çoğu, lenfatik sistemlerde konsantre olan kalsiyum ve sodyumdur. Kaslarda ve sinir sisteminde magnezyum birikir, bakır - karaciğerde, - kanda.
Metal özellikleri
Metal
Metallerin karakteristik özellikleri
Metalik parlaklık (grafit formundaki iyot ve karbon hariç. Metalik parlaklığına rağmen, kristalin iyot ve grafit metal olmayanlardır.)
İyi elektriksel iletkenlik (karbon hariç).
Kolay işleme imkanı.
Yüksek yoğunluk (genellikle metaller metal olmayanlardan daha ağırdır.)
Yüksek erime noktası (istisnalar: cıva, galyum ve alkali metaller.)
Yüksek ısı iletkenliği
Reaksiyonlarda, her zaman indirgeyici ajanlardır.
Metallerin fiziksel özellikleri
Katı koşullar altındaki tüm metaller (civa ve şartlı olarak) katı haldedir, ancak farklı sertliklere sahiptirler. Böylece, alkali metaller bir mutfak bıçağıyla kolayca kesilir ve vanadyum, tungsten ve krom gibi metaller en sert ve camı kolayca çizer. Mohs ölçeğinde bazı metallerin sertliği aşağıdadır.
Erime noktaları −39 ° C (cıva) ila 3410 ° C (tungsten) arasındadır. Çoğu metalin erime noktası (alkali hariç) yüksektir, ancak bazı “normal” metaller, örneğin kalay ve kurşungeleneksel bir elektrikli veya gaz sobası üzerinde eritilebilir.
Yoğunluğa bağlı olarak, metaller hafif (yoğunluk 0.53 saat 5 g / cm_) ve ağır (5 saat 22.5 g / cm_) olarak ikiye ayrılır. En hafif metal lityumdur (yoğunluk 0.53 g / cm_). Şu anda en ağır metali adlandırmak imkansızdır, çünkü osmiyum ve iridyumun yoğunlukları - en ağır iki metal - neredeyse eşittir (yaklaşık 22.6 g / cm2 - yoğunluktan tam olarak iki kat daha yüksek) kurşun) ve tam yoğunluklarını hesaplamak son derece zordur: bunun için metalleri tamamen temizlemeniz gerekir, çünkü herhangi bir kirlilik yoğunluğunu azaltır.
Çoğu metal plastiktir, yani metal tel bükülebilir ve kırılmaz. Bunun nedeni, metal atomları katmanlarının aralarındaki bağı kırmadan yer değiştirmesidir. En plastikler altın, gümüş ve bakır. itibaren altın yaldızlı ticari eşyalarda kullanılan 0.003 mm kalınlığında bir folyo yapmak mümkündür. Bununla birlikte, tüm metaller sünek değildir. Şu kaynaktan gelen tel: çinko veya kalay büküldüğünde egzersizi; deformasyon üzerine, manganez ve bizmut neredeyse hiç bükülmez, hemen kırılır. Plastisite ayrıca metalin saflığına da bağlıdır; Bu nedenle, çok saf krom çok plastiktir, ancak küçük kirliliklerle bile kontamine olmuş, kırılgan ve sertleşir.
Tüm metaller elektriği iyi iletir; bunun nedeni, bir elektrik alanının etkisi altında hareket eden mobil elektronların kristal kafeslerindeki varlığından kaynaklanmaktadır. gümüşbakır ve alüminyum en yüksek elektrik iletkenliğine sahip; bu nedenle, son iki metal çoğunlukla teller için bir malzeme olarak kullanılır. Sodyum da çok yüksek bir elektriksel iletkenliğe sahiptir; sodyum iletkenleri sodyum ile doldurulmuş ince duvarlı paslanmaz çelik borular şeklinde kullanma girişimleri deneysel ekipmanlarda bilinmektedir. Sodyumun düşük özgül ağırlığı, eşit dirençli olması nedeniyle, sodyum "telleri" bakırdan çok daha hafif ve hatta alüminyumdan biraz daha hafiftir.
Metallerin yüksek termal iletkenliği, serbest elektronların hareketliliğine de bağlıdır. Bu nedenle, bir dizi termal iletkenlik bir dizi elektriksel iletkenliğe benzer ve elektrik gibi ısının en iyi iletkenidir. Sodyum ayrıca iyi bir ısı iletkeni olarak kullanılır; örneğin, soğutmalarını geliştirmek için otomobil motorlarının valflerinde sodyum kullanımı yaygın olarak bilinmektedir.
Metallerin pürüzsüz yüzeyi çok fazla ışığı yansıtır - bu fenomene metalik parlaklık denir. Bununla birlikte, toz halinde, çoğu metal parlaklıklarını kaybeder; alüminyum ancak magnezyum parlaklıklarını toz içinde tutar. En çok yansıyan ışık, gümüş ve aynalar bu metallerden yapılır. Rodyum bazen olağanüstü yüksek fiyatına rağmen ayna üretimi için kullanılır: gümüş veya hatta paladyumdan çok daha yüksek sertlik ve kimyasal direnç nedeniyle, rodyum tabakası gümüşten çok daha ince olabilir.
Çoğu metalin rengi yaklaşık olarak aynıdır - mavimsi bir renk tonu ile açık gridir. , sırasıyla bakır ve sezyum, sarı, kırmızı ve açık sarıdır.
Metallerin kimyasal özellikleri
Metal
Çoğu metal, dış elektron katmanında (1-3) az miktarda elektrona sahiptir, bu nedenle çoğu reaksiyonda indirgeyici ajan olarak işlev görürler (yani, elektronlarını "geri verir")
1. Basit maddelerle reaksiyonlar
Altın, platin hariç tüm metaller oksijenle reaksiyona girer. Gümüş ile reaksiyon yüksek sıcaklıklarda gerçekleşir, ancak gümüş (II) oksit pratik olarak oluşmaz, çünkü termal olarak kararsızdır. Metale bağlı olarak, çıkış oksitler, peroksitler, peroksitler olabilir:
4Li + O2 \u003d 2Li2O lityum oksit
2Na + O2 \u003d Na2O2 sodyum peroksit
K + O2 \u003d KO2 potasyum süperoksit
Peroksitten oksit elde etmek için peroksit bir metal ile indirgenir:
Na2O2 + 2Na \u003d 2Na2O
Orta ve düşük aktiviteli metallerde, reaksiyon ısıtıldığında gerçekleşir:
3Fe + 2O2 \u003d Fe3O4
Sadece en aktif metaller azotla reaksiyona girer, sadece lityum oda sıcaklığında etkileşerek nitrürler oluşturur:
6Li + N2 \u003d 2Li3N
Isıtıldığında:
3Ca + N2 \u003d Ca3N2
Altın hariç tüm metaller sülfür ile reaksiyona girer ve platin:
Demir ile etkileşir gri ısıtıldığında sülfür oluşturur:
Sadece en aktif metaller hidrojenle, yani Be hariç IA ve IIA gruplarının metalleri ile reaksiyona girer. Reaksiyonlar ısıtılarak gerçekleştirilir ve hidritler oluşur. Reaksiyonlarda, metal bir indirgeyici ajan görevi görür; hidrojenin oksidasyon durumu −1'dir:
Sadece en aktif metaller karbonla reaksiyona girer. Bu durumda, asetilenidler veya metanidler oluşur. Asetilenler, su ile reaksiyona girdiğinde, asetilen, metanidler - metan verir.
2Na + 2C \u003d Na2C2
Na2C2 + 2H20 \u003d 2NaOH + C2H2
Doping, eriyiğe, ana malzemenin mekanik, fiziksel ve kimyasal özelliklerini değiştiren ek elementlerin sokulmasıdır.
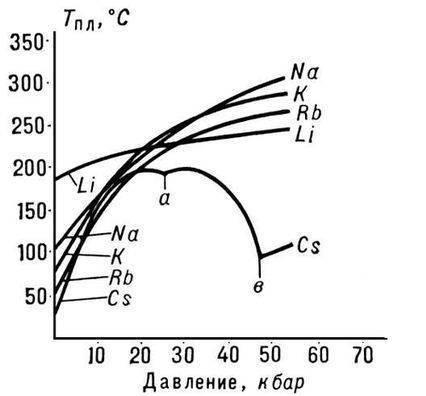
Mikroskobik yapı
Metallerin karakteristik özellikleri, iç yapıları temelinde anlaşılabilir. Hepsinin dış enerji seviyesindeki elektronların (başka bir deyişle değerlik elektronları) çekirdeğe zayıf bir bağlantısı vardır. Bu nedenle, iletkende yaratılan potansiyel fark, kristal kafes içinde çığ benzeri elektronların (iletim elektronları olarak adlandırılır) hareketine yol açar. Bu tür elektronların toplanmasına genellikle elektron gazı denir. Elektronlara ek olarak, fononlar (kafes titreşimleri) termal iletkenliğe katkıda bulunur. Plastisite, çıkıkların hareketine ve kristalografik düzlemlerin kaymasına karşı küçük enerji bariyerinden kaynaklanmaktadır. Sertlik, çok sayıda yapısal kusur (interstisyel atomlar, vb.) İle açıklanabilir.
Elektronların kolay geri tepmesi nedeniyle, metallerin oksidasyonu mümkündür, bu da korozyona ve özelliklerin daha da bozulmasına yol açabilir. Oksitleme yeteneği, metallerin standart aktivite serisi ile tanınabilir. Bu gerçek, metalleri diğer elementlerle (en önemlisi olan alaşım ile birlikte) kullanma ihtiyacını doğrular. çelik), bunların alaşımlanması ve çeşitli kaplamaların uygulanması.
Metallerin elektronik özelliklerinin daha doğru bir açıklaması için kuantum mekaniğinin kullanılması gerekir. Yeterli simetriye sahip tüm katılarda, tek tek atomların elektron enerji seviyeleri çakışır ve izin verilen bantlar oluşturur ve değerlik elektronları tarafından oluşturulan banda değerlik bandı denir. Metallerdeki değerlik elektronlarının zayıf bağı, metallerdeki değerlik bandının çok geniş olmasına ve tüm değerlik elektronlarının tamamen doldurmak için yeterli olmamasına yol açar.
Böyle kısmen doldurulmuş bir bölgenin temel özelliği, minimum uygulanan voltajla bile, değerlik elektronlarının yeniden yapılandırılmasının numunede, yani bir elektrik akımının akmasıdır.
Aynı yüksek elektron hareketliliği, yüksek termal iletkenliğe ve ayrıca elektromanyetik radyasyonu (metallere karakteristik bir parlaklık verir) yansıtma yeteneğine yol açar.
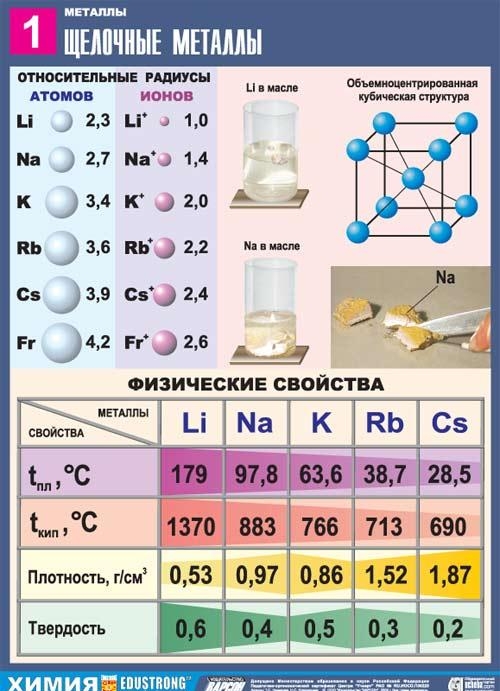
Alkali metaller
Metal
Alkali metaller - DI Dmitry Ivanovich Mendeleev'in kimyasal elementlerinin periyodik sisteminin I grubunun ana alt grubunun elemanları: lityum Li, sodyum Na, potasyum K, rubidyum Rb, sezyum Cs ve France Fr. Bu metallere alkalin denir çünkü bileşiklerinin çoğu suda çözünür. Slav'da, "özüt", "çözün" anlamına gelir ve bu, bu metal grubunun adını belirler. Alkali metaller suda çözündüğünde, alkaliler adı verilen çözünür hidroksitler oluşur.
Alkali metallerin genel özellikleri
Periyodik Sistemde, hemen inert gazları takip ederler; bu nedenle, alkali metal atomlarının yapısının bir özelliği, yeni bir enerji seviyesinde bir elektron içermeleridir: elektronik konfigürasyonları ns1'dir. Alkali metallerin değerlik elektronlarının kolayca çıkarılabileceği açıktır, çünkü bir atomun bir elektron bağışlaması ve etkisiz bir gaz konfigürasyonu edinmesi enerji açısından faydalıdır. Bu nedenle, tüm alkali metaller, indirgeme özellikleri ile karakterize edilir. Bu, iyonlaşma potansiyellerinin (sezyum atomunun iyonizasyon potansiyeli en düşüklerden biridir) ve elektronegatiflik (EO) düşük değerleri ile doğrulanır.
Bu alt grubun tüm metalleri gümüş-beyaz bir renge sahiptir (gümüş-sarı sezyum hariç), çok yumuşaktırlar, neşter ile kesilebilirler. Lityum, sodyum ve potasyum sudan daha hafiftir ve yüzeyinde yüzerek onunla reaksiyona girer.
Alkali metaller doğada tek yüklü katyonlar içeren bileşikler formunda bulunur. Birçok mineral, I grubunun ana alt grubunun metallerini içerir. Örneğin ortoklaz veya feldispat, potasyum alüminosilikat K2'den oluşur, benzer madensodyum - albit içeren - Na2 bileşimine sahiptir. Deniz suyu sodyum klorür NaCl içerir ve toprak potasyum tuzları içerir - sylvin KCl, sylvinite NaCl. KCI, karallit KCI. MgCI2. 6H20, poligalit K2SO4. MgSO4. CaSO4. 2H2O.
Alkali metallerin kimyasal özellikleri
Metal
Su, oksijen, azot bakımından alkali metallerin yüksek kimyasal aktivitesi nedeniyle, bir gazyağı tabakası altında saklanırlar. Reaksiyonu bir alkali metal ile gerçekleştirmek için, istenen boyutta bir parça, katmanın altında bir neşter ile dikkatlice kesilir gazyağıbir argon atmosferinde metal yüzey, hava ile etkileşime giren ürünlerden iyice temizlenir ve ancak bundan sonra numune reaksiyon kabına yerleştirilir.
1. Su ile etkileşim. Alkali metallerin önemli bir özelliği, suya göre yüksek aktiviteleridir. Lityum en sakin (patlama olmadan) su ile reaksiyona girer.
Benzer bir reaksiyonda, sodyum sarı bir alevle yanar ve küçük bir patlama meydana gelir. Potasyum daha da aktiftir: bu durumda patlama çok daha güçlüdür ve alev mor renklidir.
2. Oksijen ile etkileşim. Havadaki alkali metallerin yanma ürünleri, metalin aktivitesine bağlı olarak farklı bir bileşime sahiptir.
Sadece lityum stokiyometrik oksit oluşumu ile havada yanar.
Sodyumun yanması sırasında, Na2O2 peroksit esas olarak küçük bir NaO2 peroksit karışımı ile oluşur.
Potasyum, rubidyum ve sezyumun yanma ürünleri esas olarak süperoksit içerir.
Sodyum ve potasyum oksitleri elde etmek için, hidroksit, peroksit veya süperoksit karışımları oksijen olmadan fazla metal ile ısıtılır.
Aşağıdaki düzenlilik, alkali metallerin oksijen bileşiklerinin karakteristiğidir: alkali metal katyonunun yarıçapı arttıkça, peroksit iyonu O22 ve süperperoksit iyonu O2- içeren oksijen bileşiklerinin stabilitesi artar.
Ağır alkali metaller için, EO3 bileşiminin oldukça kararlı ozonidlerinin oluşumu karakteristiktir. Tüm oksijen bileşikleri farklı bir renge sahiptir, yoğunluğu Li'den Cs'ye bir dizi halinde derinleşir.
Alkali metal oksitler, bazik oksitlerin doğasında bulunan tüm özelliklere sahiptir: su, asit oksitler ve asitlerle reaksiyona girerler.
Peroksitler ve süperoksitler, güçlü oksitleyici ajanların özelliklerini sergiler.
Peroksitler ve süperoksitler, su ile yoğun bir şekilde etkileşerek hidroksitler oluşturur.
3. Diğer maddelerle etkileşim. Alkali metaller birçok metal olmayanla reaksiyona girer. Isıtıldıklarında, halojenlerle hidritler oluşturmak için hidrojen ile birleşirler, gri, azot, fosfor, karbon ve silisyum, sırasıyla halidler, sülfürler, nitrürler, fosfitler, karbürler ve silisitler oluşturur.
Isıtıldığında, alkali metaller diğer metallerle reaksiyona girerek metaller arası bileşikler oluşturabilir. Asitli alkali metaller aktif olarak reaksiyona girer (bir patlama ile).
Alkali metaller sıvı amonyak ve türevleri - aminler ve amidler içinde çözülür.
Sıvı amonyak içinde çözündüğünde, bir alkali metal, amonyak molekülleri tarafından çözülen ve çözeltiye mavi bir renk veren bir elektronu kaybeder. Elde edilen amidler, alkali ve amonyak oluşumu ile su ile kolayca ayrıştırılır.
Alkali metaller, alkoller (alkollerin oluşumu ile) ve karboksilik asitler (tuzların oluşumu ile) ile organik maddelerle etkileşime girer.
4. Alkali metallerin kalitatif tayini. Alkali metallerin iyonlaşma potansiyelleri küçük olduğundan, metal veya bileşikleri bir alevde ısıtıldığında, atom iyonlaşarak alevi belirli bir renkte renklendirir.
Alkali metallerin üretimi
1. alkali metal üretimi için, esas olarak halid eriyiklerinin elektrolizi, çoğunlukla doğal oluşturan klorürler mineraller:
katot: Li + + e → Li
anot: 2Cl- - 2e → Cl2
2. Bazen alkali metaller elde etmek için hidroksit eriyiklerinin elektrolizi gerçekleştirilir:
katot: Na + + e → Na
anot: 4OH- - 4e → 2H2O + O2
Elektrokimyasal voltaj serilerindeki alkali metaller hidrojenin solunda olduğundan, tuz çözeltilerinden elektrolitik hazırlanması imkansızdır; bu durumda, karşılık gelen alkaliler ve hidrojen oluşur.
hidroksitler
Alkali metal hidroksitleri elde etmek için esas olarak elektrolitik yöntemler kullanılır. En büyük ölçek, konsantre bir sulu sodyum klorür çözeltisinin elektrolizi ile sodyum hidroksit üretimidir.
İlk olarak, bir değişim reaksiyonu ile alkali elde edildi.
Bu şekilde elde edilen alkali, Na2C03 soda ile yoğun bir şekilde kontamine olmuştur.
Alkali metal hidroksitler, sulu çözeltileri güçlü bazlar olan beyaz higroskopik maddelerdir. Bazların karakteristik tüm reaksiyonlarına katılırlar - asitler, asidik ve amfoterik oksitler, amfoterik hidroksitler ile reaksiyona girerler.
Isıtıldığında, alkali metal hidroksitler, grup II'nin ana alt grubunun metal hidroksitleri gibi, kalsinasyon üzerine bir okside ve suya ayrışan lityum hidroksit hariç, ayrışma olmadan yüceltilir.
Sodyum hidroksit sabunlar, sentetik deterjanlar, yapay lifler, fenol gibi organik bileşikler yapmak için kullanılır.
karbonatlar
Önemli bir alkali metal ürünü Na2CO3 sodadır. Tüm dünyada soda kütlesi, 20. yüzyılın başında önerilen Solve yöntemine göre üretilir. Yöntemin özü aşağıdaki gibidir: amonyak ilave edilen sulu bir NaCl çözeltisi, 26-30 ° C sıcaklıkta karbon dioksit ile doyurulur. Bu durumda, kabartma tozu olarak adlandırılan az çözünür sodyum bikarbonat oluşur.
Amonyak, çözeltiye karbon dioksit geçirildiğinde ortaya çıkan asidik ortamı nötralize etmek ve sodyum bikarbonatı çöktürmek için gerekli olan HCO3-bikarbonat iyonunu üretmek için eklenir. İçme sodasının ayrılmasından sonra, amonyum klorür içeren çözelti kireçle ısıtılır ve reaksiyon bölgesine geri dönen amonyak açığa çıkar.
Bu nedenle, soda üretmek için amonyak yönteminde, tek atık çözeltide kalan ve sınırlı kullanıma sahip kalsiyum klorürdür.
Sodyum bikarbonat üretme işleminde kullanılan kalsinasyon veya yıkama, Na2C03 soda ve karbon dioksit, sodyum bikarbonatın kalsinasyonuyla elde edilir.
Soda'nın ana alıcısı camdır.
NaHC03'ün az çözünür asit tuzunun aksine, potasyum hidrojen karbonat KHCO3 suda yüksek oranda çözünür, bu nedenle potasyum karbonat veya potas, K2CO3 bir potasyum hidroksit çözeltisi üzerinde karbon dioksitin etkisiyle üretilir.
Potas, cam ve sıvı sabun üretiminde kullanılır.
Lityum, hidrokarbonatın elde edilmediği tek alkali metaldir. Bu fenomenin nedeni, oldukça büyük bir iyon HCO3- tutmasına izin vermeyen çok küçük lityum iyon yarıçapıdır.
lityum
Metal
Lityum - birinci grubun ana alt grubunun bir elemanı, kimyasal elementlerin periyodik sisteminin ikinci periyodu. Mendeleev Dmitry Ivanovich, atom numarası 3'tür. Li (lat. Lityum) sembolü ile gösterilir. Basit madde lityum (CAS numarası: 7439-93-2) gümüş-beyaz renkli yumuşak bir alkalin metaldir.
Lityum 1817'de İsveçli kimyager ve mineralog A. Arfvedson tarafından önce mineral petalitte (Li, Na) ve sonra spodumen LiAl'de ve lepidolit KLi1.5Al1.5'te (F, OH) 2 keşfedildi. Humphrey Davy ilk kez 1825'te lityum metali aldı.
Lityum, adını "taş" (Yunanca. --Ος - taş) içinde bulunmasından dolayı almıştır. Aslen "lithion" olarak adlandırılan modern isim Berzelius tarafından önerildi.
Lityum gümüş-beyaz bir metaldir, yumuşak ve sünektir, sodyumdan daha sert, ancak kurşuntan daha yumuşaktır. Presleme ve haddeleme ile işlenebilir.
Oda sıcaklığında, lityum metal kübik gövde merkezli bir örgü (koordinasyon numarası 8) vardır, bu da soğuk çalıştığında, kübik kapalı paketli bir kübise dönüşür, burada çift küboktahedral koordinasyona sahip her atomun 12 diğer ile çevrilidir. 78 K'nin altında, kararlı bir kristal form, her bir lityum atomunun, küboktahedronun köşelerinde bulunan en yakın 12 komşuya sahip olduğu altıgen kapalı paketli bir yapıdır.
Tüm alkali metallerden lityum en yüksek erime ve kaynama noktaları ile karakterize edilir (sırasıyla 180.54 ve 1340 ° C), tüm metaller arasında oda sıcaklığında en düşük yoğunluğa sahiptir (0.533 g / cm2, suyun yoğunluğunun neredeyse yarısı).
Lityum atomunun küçük boyutu, metalin özel özelliklerinin ortaya çıkmasına neden olur. Örneğin, sodyum ile sadece 380 ° C'nin altındaki sıcaklıklarda karışır ve erimiş potasyum, rubidyum ve sezyum ile karışmazken, diğer alkali metal çiftleri herhangi bir oranda birbirleriyle karışır.
Alkali metal, havada kararsız. Lityum en az aktif alkali metaldir, pratik olarak oda sıcaklığında kuru hava (ve hatta kuru oksijen ile) reaksiyona girmez.
Nemli havada yavaşça oksitlenir, Li3N nitrür, LiOH hidroksit ve Li2CO3 karbonata dönüşür. Oksijen içinde ısıtıldığında yanar ve Li2O okside dönüşür. 100 ° C ila 300 ° C sıcaklık aralığında lityumun yoğun bir oksit film ile kaplanması ve gelecekte oksitlenmemesi ilginç bir özelliktir.
1818'de Alman kimyager Leopold Gmelin, lityum ve tuzlarının, lityumun belirlenmesi için nitel bir işaret olan karmin kırmızısı alevi renklendirdiğini tespit etti. Tutuşma sıcaklığı yaklaşık 300 ° C'dir. Yanma ürünleri nazofarenksin mukoza zarını tahriş eder.
Sessizce, patlama ve ateş olmadan, su ile reaksiyona girerek LiOH ve H2 oluşturur. Ayrıca etil alkol ile reaksiyona girerek bir alkolat, amonyak ve halojenlerle (iyotla - sadece ısıtıldığında) reaksiyona girer.
Lityum, hermetik olarak kapatılmış teneke kutularda petrol eteri, parafin, benzin ve / veya mineral yağda saklanır. Lityum metal cilt, mukoza ve gözlerde yanıklara neden olur.
Demirli ve demirsiz metalurjide, alaşımların oksijeni gidermek ve sünekliğini arttırmak için lityum kullanılır. Lityum bazen metalotermi yöntemleriyle nadir metalleri geri kazanmak için kullanılır.
Lityum karbonat, alüminyum eritme işleminde (elektrolite eklenen) en önemli yardımcı maddedir ve tüketimi her yıl küresel alüminyum üretiminin hacmine (eritilmiş alüminyum ton başına 2.5-3.5 kg lityum karbonat tüketimi) orantılı olarak artar.
Gümüş ve altın içeren lityum alaşımları ve kuprum çok etkili lehimlerdir. Magnezyum, skandiyum, kuprum, kadmiyum ve alüminyum içeren lityum alaşımları, havacılık ve astronotikte yeni umut verici malzemelerdir. Alüminat ve lityum silikat bazlı, oda sıcaklığında sertleşen ve askeri teçhizat, metalurji ve gelecekte termonükleer enerjide kullanılan seramikler yaratıldı. Cam, silikon karbür fiberlerle takviye edilmiş lityum-alüminyum-silikat esaslıdır. Lityum, kurşun alaşımlarını çok etkili bir şekilde sertleştirir ve süneklik ve korozyon direnci sağlar.
Lityum tuzlarının psikotropik bir etkisi vardır ve tıpta bir dizi akıl hastalığının önlenmesi ve tedavisinde kullanılır. Bu kapasitede en yaygın olanı lityum karbonattır. bipolar bozukluktan muzdarip insanların ruh halini ve sık ruh hali değişimlerini dengelemek için psikiyatride kullanılır. Depresyon için maniyi önlemede etkilidir ve intiharı azaltır Sağlık görevlileri, belirli lityum bileşiklerinin (elbette uygun dozlarda) manik depresyondan muzdarip hastalar üzerinde olumlu bir etkisi olduğunu defalarca gözlemlemiştir. Bu etki iki şekilde açıklanmaktadır. Bir yandan, lityumun sodyum ve potasyum iyonlarının hücre dışı sıvıdan beyin hücrelerine transferinde rol oynayan bazı enzimlerin aktivitesini düzenleyebildiği bulunmuştur. Öte yandan, lityum iyonlarının hücrenin iyonik dengesini doğrudan etkilediği gözlenmiştir. Ve hastanın durumu büyük ölçüde sodyum ve potasyum dengesine bağlıdır: hücrelerde aşırı sodyum depresyonlu hastaların karakteristiğidir, eksikliği mani muzdarip olanlar içindir. Sodyum potasyum dengesini hizalayan lityum tuzları, diğerleri ve diğerleri üzerinde olumlu bir etkiye sahiptir.
sodyum
Metal
Sodyum - birinci grubun ana alt grubunun bir öğesi, üçüncü dönem kimyasal elementlerin periyodik sistemi D. I. Dmitry Ivanovich Mendeleevatom numarası 11 ile gösterilmiştir. Na (lat. Natrium) sembolü ile gösterilir. Basit madde sodyumdur (CAS numarası: 7440-23-5) - gümüş-beyaz renkli yumuşak bir alkalin metaldir.
Suda sodyum lityum ile aynı şekilde davranır: reaksiyon hidrojenin hızlı evrimi ile devam eder ve çözeltide sodyum hidroksit oluşur.
Sodyum (ya da daha doğrusu, bileşikleri) eski zamanlardan beri kullanılmaktadır. Örneğin, Mısır'daki soda göllerinin sularında doğal olarak bulunan soda (natron). Eski Mısırlılar, mumyalamak, tuvali ağartmak, yemek pişirmek, boya ve sır yapmak için doğal soda kullandılar. Yaşlı Pliny, Nil delta sodasında (içinde yeterli miktarda kirlilik vardı) nehir suyundan izole edildiğini yazıyor. Gri veya hatta siyah boyalı kömür katkısı nedeniyle büyük parçalar halinde satışa sunuldu.
Sodyum ilk olarak 1807 yılında İngiliz kimyacı Humphrey Davy tarafından katı NaOH elektrolizi ile elde edildi.
"Sodyum" (natrium) adı, Arap natronundan (Yunanca - nitron) gelir ve orijinal olarak doğal soda anlamına gelir. Elemanın kendisine daha önce sodyum (lat. Sodyum) deniyordu.

Sodyum, gümüş-beyaz bir metaldir, mor bir renk tonuna sahip ince katmanlarda, plastiktir, hatta yumuşaktır (bir bıçakla kolayca kesilir), taze bir dilim sodyum parıltı. Sodyumun elektrik iletkenliği ve termal iletkenliği oldukça yüksektir, yoğunluk 0.96842 g / cm2'dir (19.7 ° C'de), erime noktası 97.86 ° C'dir ve kaynama noktası 883.15 ° C'dir.
Havada kolayca oksitlenebilen alkalin metal. Oksijene karşı korunmak için metalik sodyum bir tabaka altında depolanır gazyağı. Sodyum lityumdan daha az aktiftir, bu nedenle sadece ısıtıldığında azot ile reaksiyona girer:
Çok fazla oksijen ile sodyum peroksit oluşur
2Na + O2 \u003d Na2O2
Sodyum metal, hazırlayıcı kimyada yaygın olarak kullanılır ve sanayi metalürji de dahil olmak üzere güçlü bir indirgeyici ajan olarak. Sodyum, enerji yoğun sodyum sülfür pillerinin üretiminde kullanılır. Ayrıca kamyon egzoz valflerinde bir soğutucu olarak kullanılır. Bazen, metalik sodyum çok yüksek akımlara yönelik elektrik telleri için bir malzeme olarak kullanılır.
Potasyumun yanı sıra rubidyum ve sezyum içeren bir alaşımda, yüksek verimli bir ısı transfer ortamı olarak kullanılır. Özellikle,% 12 sodyum, potasyum% 47, sezyum% 41'lik bir bileşime sahip bir alaşımın rekor düşük erime noktası −78 ° C'dir ve iyon roket motorları için bir çalışma ortamı ve nükleer enerji santralleri için bir soğutucu olarak önerilmiştir.
Sodyum ayrıca yüksek ve düşük basınç deşarj lambalarında (NLVD ve NLND) kullanılır. DNaT tipi (Arc Sodium Tubular) NLVD lambalar sokak aydınlatmasında çok yaygın olarak kullanılmaktadır. Parlak sarı bir ışık verirler. DNaT lambaların hizmet ömrü 12-24 bin saattir. Bu nedenle, DNaT tipi deşarj lambaları kentsel, mimari ve endüstriyel aydınlatma için vazgeçilmezdir. Ayrıca DNaS, DNaMT (Ark Sodyum Mat), DNaZ (Ark Sodyum Ayna) ve DNaTBR (Cıva İçermeyen Ark Sodyum Tübüler) lambalar da vardır.
Sodyum metal, organik maddenin nitel analizinde kullanılır. Sodyum alaşımı ve test maddesi etanol ile nötralize edilir, birkaç mililitre damıtılmış su eklenir ve nitrojen, kükürt ve halojenleri (1843) belirlemeyi amaçlayan 3 parçaya ayrılır (J. Lassenya (1843)). test Beilstein)
Sodyum klorür (sofra tuzu), kullanılan en eski aroma ve koruyucu maddedir.
Sodyum azid (Na3N), metalurjide ve kurşun azit üretiminde nitrürleme maddesi olarak kullanılır.
Sodyum siyanür (NaCN), kayalardan altın liçinin hidrometalurjik yönteminde, ayrıca nitrokarbürizasyon çeliğinde ve elektrokaplamada (gümüşleme, yaldızlama) kullanılır.
Sodyum klorat (NaClO3), demiryolu raylarında istenmeyen bitki örtüsünü yok etmek için kullanılır.
potasyum
Kaliy - birinci grubun ana alt grubunun bir öğesi, dördüncü dönem kimyasal elementlerin periyodik sistemi D. I. Mendeleev Dmitry Ivanovich, atom numarası 19 ile. K sembolü ile belirtilir (lat. Kalium). Basit madde potasyumdur (CAS numarası: 7440-09-7) - gümüş-beyaz renkli yumuşak bir alkalin metaldir.
Doğada, potasyum sadece diğer elementlere sahip bileşiklerde, örneğin deniz suyunda ve birçok mineralde bulunur. Havada çok hızlı oksitlenir ve kimyasal olarak, özellikle su ile çok kolay reaksiyona girerek bir alkali oluşturur. Birçok açıdan, potasyumun kimyasal özellikleri sodyuma çok yakındır, ancak biyolojik fonksiyon ve bunların canlı organizma hücreleri tarafından kullanımları açısından hala farklıdırlar.
Potasyum (daha doğrusu bileşikleri) eski zamanlardan beri kullanılmaktadır. Böylece, deterjan olarak kullanılan potas üretimi 11. yüzyılda zaten vardı. Saman veya ahşabın yakılması sırasında oluşan kül su ile muamele edilmiş ve sonuçtaki çözelti (likör) filtrasyondan sonra buharlaştırılmıştır. Kuru tortu, potasyum karbonata ek olarak, potasyum sülfat K2S04, soda ve potasyum klorür KCl içeriyordu.
1807'de İngiliz bir kimyager, Davy, katı kostik potasyumun (KOH) elektrolizi ile potasyumu izole etti ve ona “potasyum” (Latin potasyum; bu isim hala İngilizce, Fransızca, İspanyolca, Portekizce ve Lehçe) olarak kullanılıyor. 1809 yılında, L.V. Gilbert "potasyum" adını önerdi (lat. Kalium, Arapça al-kali - potash). Bu isim, oradan Kuzey ve Doğu Avrupa (Rusça dahil) dillerinin çoğuna kadar Alman diline girdi ve bu öğe için bir sembol seçerken “kazandı” - K.
Potasyum, yeni oluşturulmuş bir yüzey üzerinde karakteristik bir parlaklığa sahip gümüşi bir maddedir. Çok hafif ve eriyebilir. Civada nispeten iyi çözünür, amalgamlar oluşturur. Bir brülörün alevine sokulan potasyum (ve aynı zamanda bileşikleri) alevi karakteristik bir pembe-mor renkte renklendirir.
Potasyum, diğer alkali metaller gibi tipik metalik özellikler gösterir ve kimyasal olarak çok aktiftir, elektronları kolayca verir.
Güçlü bir indirgeyici maddedir. Oksijenle o kadar aktif bir şekilde birleşir ki oksit değil, potasyum süperoksit KO2 (veya K2O4) oluşturur. Bir hidrojen atmosferinde ısıtıldığında, potasyum hidrit KH oluşur. Tüm metal olmayan, halidler, sülfitler, nitrürler, fosfidler, vb.'nin yanı sıra su (reaksiyon bir patlama ile gerçekleşir), çeşitli oksitler ve tuzlar ile iyi etkileşime girer. Bu durumda, diğer metalleri serbest bir duruma indirirler.
Potasyum bir gazyağı tabakası altında saklanır.
Oda sıcaklığında potasyum ve sodyum alaşımından bir sıvı, kapalı sistemlerde, örneğin hızlı nötron atomik enerji santrallerinde soğutucu olarak kullanılır. Ek olarak, rubidyum ve sezyum içeren sıvı alaşımları yaygın olarak kullanılmaktadır. Sodyumun alaşım bileşimi% 12, potasyum% 47, sezyum% 41, rekor düşük erime noktasına −78 ° C'dir.
Potasyum bileşikleri en önemli besindir ve bu nedenle gübre olarak kullanılır.
Potasyum tuzları elektrokaplamada yaygın olarak kullanılır, çünkü nispeten yüksek maliyete rağmen, genellikle karşılık gelen sodyum tuzlarından daha çözünürdürler ve bu nedenle yüksek akım yoğunluklarında elektrolitlerin yoğun çalışmasını sağlarlar.
Potasyum, özellikle bitki dünyasında önemli bir besindir. Toprakta potasyum eksikliği ile bitkiler çok zayıf gelişir ve azalır, bu nedenle ekstrakte edilen potasyum tuzlarının yaklaşık% 90'ı gübre olarak kullanılır.
Potasyum, azot ve fosfor ile birlikte bitki beslenmesinin ana unsurları arasındadır. Bitkilerdeki potasyumun yanı sıra onlar için gerekli diğer elementlerin işlevi kesinlikle spesifiktir. Bitkilerde potasyum iyonik formdadır. Potasyum esas olarak hücre sitoplazmasında ve vakuollerinde bulunur. Potasyumun yaklaşık% 80'i hücre özünde bulunur.
Potasyumun fonksiyonları çok çeşitlidir. Fotosentezin normal seyrini uyardığı, yaprak bıçaklarından diğer organlara karbonhidrat çıkışını ve şekerlerin sentezini arttırdığı bulunmuştur.
Potasyum, meyve ve sebze mahsullerinde monosakkarit birikimini arttırır, kök mahsullerindeki şeker içeriğini arttırır, patateslerde nişasta yapar, tahıl bitkilerinin kamışlarının hücre duvarlarını kalınlaştırır ve ekmeğin lojman direncini arttırır ve keten ve kenevirdeki lif kalitesini arttırır.
Bitki hücrelerinde karbonhidrat birikimine katkıda bulunan potasyum, hücre suyunun ozmotik basıncını arttırır ve böylece bitkilerin soğuk direncini ve don direncini arttırır.
Potasyum bitkiler tarafından katyonlar şeklinde emilir ve açıkçası, bu formda hücrelerde kalır ve en önemli biyokimyasal olarak aktive edilir. süreçler bitki hücrelerinde potasyum, hem büyüme mevsiminde hem de hasat sonrası çeşitli hastalıklara karşı dirençlerini arttırır, meyve ve sebzelerin tutma kalitesini önemli ölçüde artırır.
Potasyum eksikliği bitkilerde birçok metabolik bozukluğa neden olur, bir dizi enzimin aktivitesi zayıflar, karbonhidrat ve protein metabolizması bozulur, maliyetler nefes almak için karbonhidratlar. Sonuç olarak, bitki verimliliği azalır, ürün kalitesi düşer.



rubidyum
Rubidyum, birinci grubun ana alt grubunun bir elementidir, DI Dmitry Ivanovich Mendeleev'in kimyasal elementlerin periyodik sisteminin beşinci periyodu, atom numarası 37'dir. Rb (lat. Rubidyum) sembolü ile gösterilir. Basit madde rubidyumdur (CAS numarası: 7440-17-7) - gümüş-beyaz renkli yumuşak bir alkalin metaldir.
1861'de Alman bilim adamları Robert Wilhelm Bunsen ve Gustav Robert Kirchhoff, spektral analiz kullanarak doğal alüminosilikatlar incelediler, daha sonra spektrumun en güçlü çizgilerinin rengi ile rubidyum olarak adlandırılan yeni bir element keşfettiler.
Rubidyum, taze kesilmiş metalik bir parlaklığa sahip gümüşi beyaz yumuşak kristaller oluşturur. Brinell sertliği 0.2 Mn / mІ (0.02 kgf / mm2). Rubidyum kristal kafesi kübik hacim merkezlidir, а \u003d 5.71 Е (oda sıcaklığında). Atom yarıçapı 2.48 E, iyonun yarıçapı Rb + 1.49 E'dir. Yoğunluk 1.525 g / cm2 (0 ° C), en 38.9 ° C, en 703 ° C'dir. Spesifik ısı 335.2 j / (kg · K), doğrusal genleşme termal katsayısı 9.0 · 10-5 derece-1 (0-38 ° С), elastik modül 2.4 GN / m² (240 kgf / mm²), özgül hacim elektrik özdirenci 11.29 · 10-6 ohm · cm (20 ° C); rubidyum paramanyetiktir.
Havada son derece kararsız olan alkalin metal (ateşleme ile su izleri varlığında hava ile reaksiyona girer). Çoğunlukla çözünür (kloratlar ve perkloratlar biraz çözünür) olan tüm tuz türlerini oluşturur. Rubidyum hidroksit, cam ve diğer yapısal ve kap malzemelerine karşı çok agresif bir maddedir ve erimiş metallerin çoğunu (hatta platin) yok eder.
Rubidyum kullanımı çeşitlidir ve bir dizi uygulama alanında en önemli fiziksel özelliklerinde sezyumdan daha düşük olmasına rağmen, bu nadir alkali metal modern teknolojilerde önemli bir rol oynar. Aşağıdaki rubidyum uygulamaları not edilebilir: kataliz, elektronik sanayi, özel optik, atom, ilaç.
Rubidyum sadece saf formunda değil, aynı zamanda bir dizi alaşım ve kimyasal bileşik formunda da kullanılır. Rubidyumun çok iyi ve elverişli bir hammadde bazına sahip olduğunu belirtmek önemlidir, ancak kaynakların mevcudiyeti ile ilgili durum, sezyum ve rubidyum durumunda, örneğin katalizde (başarılı bir şekilde kendini kanıtladığı yerde) daha da önemli bir rol oynayabilir.
Rubidyum-86 izotopu, gama ışını incelemesinde, ölçüm ekipmanlarında ve ayrıca bir dizi önemli ilaç ve gıda ürününün sterilizasyonunda yaygın olarak kullanılmaktadır. Rubidyum ve sezyumlu alaşımları çok umut verici bir soğutucu ve yüksek sıcaklık türbin üniteleri için bir çalışma ortamıdır (bu bağlamda rubidyum ve sezyum son yıllarda önemli hale gelmiştir ve aşırı yüksek metal maliyeti, türbin ünitelerinin verimliliğini keskin bir şekilde arttırma olasılıkları ile ilgili olarak arka plana düşmüştür. ve daha düşük giderler yakıt ve çevre kirliliği). Isı taşıyıcıları olarak en yaygın kullanılan rubidyum bazlı sistemler üçlü alaşımlardır: sodyum-potasyum-rubidyum ve sodyum-rubidyum-sezyum.
Katalizde rubidyum hem organik hem de inorganik sentezde kullanılır. Rubidyumun katalitik aktivitesi temel olarak bir dizi önemli ürünün rafine edilmesi için kullanılır. Rubidyum asetat, örneğin, metanol ve su gazından bir dizi daha yüksek alkol sentezlemek için kullanılır, bu da kömürün yeraltı gazlaştırılması ve otomobiller ve jet yakıtları için yapay sıvı yakıtların üretimi ile bağlantılı olarak son derece önemlidir. Tellür içeren bir dizi rubidyum alaşımı, spektrumun ultraviyole bölgesinde sezyum bileşiklerinden daha yüksek bir hassasiyete sahiptir ve bu bağlamda, foto-dönüştürücüler için bir malzeme olarak sezyum-133 ile rekabet edebilir. Özel yağlama bileşimlerinin (alaşımları) bir parçası olarak rubidyum, vakumda (roket ve uzay teknolojisi) oldukça etkili bir yağlayıcı olarak kullanılır.
Rubidyum hidroksit, düşük sıcaklıklı ChIT için bir elektrolitin yanı sıra düşük sıcaklıklarda performansını arttırmak ve elektrolit iletkenliğini arttırmak için bir potasyum hidroksit çözeltisine bir katkı maddesi hazırlamak için kullanılır. Hidrit yakıt hücrelerinde metalik rubidyum kullanılır.
Cuprum klorür içeren bir alaşımda rubidyum klorür, yüksek sıcaklıkları (400 ° C'ye kadar) ölçmek için kullanılır.
Rubidyum plazma lazer radyasyonunu uyarmak için kullanılır.
Rubidyum klorür, yakıt hücrelerinde bir elektrolit olarak kullanılır, doğrudan kömür oksidasyonu kullanan yakıt hücrelerinde bir elektrolit olarak çok etkili olan rubidyum hidroksit için de söylenebilir.
sezyum
Sezyum, birinci grubun ana alt grubunun bir elementidir, DI Mendeleev Dmitry Ivanovich'in kimyasal elementlerinin periyodik sisteminin altıncı dönemi, atom numarası 55'tir. Cs (lat. Sezyum) sembolü ile gösterilir. Basit madde sezyumdur (CAS numarası: 7440-46-2) - gümüş-sarı renkli yumuşak bir alkalin metaldir. Sezyum, emisyon spektrumunda (lat. Caesius - gök mavisi) iki parlak mavi çizginin varlığı için adını aldı.
Sezyum 1860 yılında Alman bilim adamları R.V. Bunsen ve G.R. Kirchhoff tarafından Almanya Cumhuriyeti'nde Dürhheim mineral kaynağı sularında optik spektroskopi ile keşfedildi ve böylece spektral analizle keşfedilen ilk unsur haline geldi. Saf haliyle, sezyum ilk olarak 1882'de İsveçli kimyager K. Setterberg tarafından sezyum siyanür (CsCN) ve baryum karışımının bir eriyiğinin elektrolizi sırasında izole edildi.
Ana sezyum mineralleri kirletici ve çok nadir olarak faggrittir (K, Cs). Ek olarak, safsızlıklar şeklinde, sezyum, bir dizi alüminosilikat içine dahil edilir: lepidolit, flogopit, biyotit, amazonit, petalit, beril, sinvalidit, lösit, karpalit. Pollucite ve lepidolite endüstriyel hammadde olarak kullanılır.
Sezyumun bileşikler halinde endüstriyel üretiminde, mineral kirleticiden çıkarılır. Bu, klorür veya sülfat açıklığı ile yapılır. Birincisi, başlangıç \u200b\u200bmineralinin ısıtılmış hidroklorik asit ile işlenmesini, Cs3 bileşiğini çökeltmek için SbCl3 antimon klorür ilave edilmesini ve CsCl sezyum klorür oluşturmak için sıcak su veya amonyak çözeltisi ile yıkanmayı içerir. İkinci durumda, ısıtılmış sülfürik asit ile muamele edilerek CsAl (SO4) 2-12H20 alum sezyum şapı oluşturulur.
Rusya Federasyonu'nda, SSCB'nin yıkılmasından sonra, Sovyet dönemlerinde Murmansk yakınlarındaki Voronoi tundrasında devasa mineral rezervleri keşfedilmesine rağmen, yarı lusitin endüstriyel üretimi yapılmadı. Rus endüstrisi ayağa kalkınca, Kanada lisansının bu alanı geliştirmek için bir lisans aldığı ortaya çıktı. Şu anda, sezyum tuzlarının kirleticiden işlenmesi ve ekstraksiyonu, Novosibirsk'te ZAO Nadir Metaller Fabrikası'nda gerçekleştirilmektedir.
Sezyum üretmek için çeşitli laboratuvar yöntemleri vardır. Elde edilebilir:
vakumda zirkonyum ile krom veya sezyum dikromat karışımının ısıtılması;
sezyum azidin bir vakumda ayrışması;
sezyum klorür ve özel olarak hazırlanmış kalsiyum karışımının ısıtılması.
Tüm yöntemler zaman alıcıdır. İkincisi, yüksek saflıkta metal elde etmenizi sağlar, ancak patlayıcıdır ve birkaç gün boyunca uygulanması gerekir.
Sezyum sadece minerallerinin keşfedildiği ve saf formda üretilmesi için teknolojinin geliştirildiği 20. yüzyılın başında uygulama buldu. Şu anda, sezyum ve bileşikleri elektronik, radyo, elektro, X-ışını, kimya endüstrisi, optik, tıp, nükleer enerjide kullanılmaktadır. Çoğunlukla stabil doğal sezyum-133 kullanılır ve sınırlı bir ölçüde, nükleer santrallerin reaktörlerindeki uranyum, plütonyum, toryum fisyon parçaları toplamından ekstrakte edilen radyoaktif izotop sezyum-137'dir.
Toprak alkali metaller
Alkali toprak metalleri kimyasal elementlerdir: kalsiyum Ca, stronsiyum Sr, baryum Ba, Ra radyumu (bazen berilyum Be ve magnezyum Mg de yanlışlıkla toprak alkali metalleri olarak adlandırılır). Bu şekilde adlandırılırlar çünkü oksitleri - "topraklar" (simyagerlerin terminolojisinde) - suya alkalin reaksiyonu verir. Aluminyum toprak metallerinin tuzları, radyum hariç, doğada mineraller şeklinde yaygın olarak dağılmıştır.
kalsiyum
Kalsiyum, ikinci grubun ana alt grubunun bir elementidir, DI Dmitry Ivanovich Mendeleev'in kimyasal elementlerin periyodik sisteminin dördüncü periyodu, atom numarası 20'dir. Ca (lat. Kalsiyum) sembolü ile gösterilir. Basit kalsiyum maddesi (CAS numarası: 7440-70-2) gümüş-beyaz renkli yumuşak, kimyasal olarak aktif bir alkalin toprak metalidir.
Kalsiyum metali iki allotropik modifikasyonda bulunur. 443 ° C'ye kadar, a-Ca kübik yüz merkezli bir kafesle (parametre a \u003d 0.558 nm) stabildir, β-Ca a-Fe tipinde kübik vücut merkezli bir kafesle (parametre a \u003d 0.448 nm) stabildir. Α → β geçişinin standart entalpisi ΔH0, 0.93 kJ / mol'dür.
Kalsiyum tipik bir toprak alkali metaldir. Kalsiyumun reaktivitesi yüksektir, ancak diğer tüm alkalin toprak metallerinden daha düşüktür. Oksijen, karbondioksit ve hava nemi ile kolayca etkileşime girer, bu nedenle kalsiyum metalinin yüzeyi genellikle donuk gridir, bu nedenle kalsiyum genellikle diğer alkalin toprak metalleri gibi bir laboratuvarda gazyağı veya sıvı parafin tabakası altında sıkıca kapalı bir kavanozda saklanır.
Standart potansiyeller arasında kalsiyum hidrojenin solunda bulunur. Bir çift Ca2 + / Ca0'ın standart elektrot potansiyeli 2.84 V'tur, böylece kalsiyum su ile aktif olarak reaksiyona girer, ancak ateşleme olmadan:
Ca + 2H20 \u003d Ca (OH) 2 + H2 + Q.
Aktif metal olmayanlarla (oksijen, klor, brom), kalsiyum normal koşullar altında reaksiyona girer:
2Ca + O2 \u003d 2CaO, Ca + Br2 \u003d CaBr2.
Havada veya oksijende ısıtıldığında, kalsiyum tutuşur. Daha az aktif metal olmayan maddelerle (hidrojen, bor, karbon, silikon, azot, fosfor ve diğerleri), kalsiyum ısıtıldığında etkileşir, örneğin:
Ca + H2 \u003d CaH2, Ca + 6B \u003d CaB6,
3Ca + N2 \u003d Ca3N2, Ca + 2C \u003d CaC2,
3Ca + 2P \u003d Ca3P2 (kalsiyum fosfid); CaP ve CaP5 bileşimlerinin kalsiyum fosfürleri de bilinmektedir;
2Ca + Si \u003d Ca2Si (kalsiyum silisit); CaSi, Ca3Si4 ve CaSi2 bileşimlerinin kalsiyum silisitleri de bilinmektedir.
Yukarıdaki reaksiyonların seyrine genellikle büyük miktarda ısı salınımı eşlik eder (yani, bu reaksiyonlar ekzotermiktir). Metal olmayan tüm bileşiklerde, kalsiyumun oksidasyon durumu +2'dir. Metal olmayan kalsiyum bileşiklerinin çoğu su ile kolayca ayrıştırılır, örneğin:
CaH2 + 2H2O \u003d Ca (OH) 2 + 2H2,
Ca3N2 + 3H20 \u003d 3Ca (OH) 2 + 2NH3.
Ca2 + iyonu renksizdir. Çözünür kalsiyum tuzları aleve verildiğinde, alev tuğlaya kırmızıya döner.
CaCl2 klorür, CaBr2 bromür, CaI2 iyodür ve Ca (NO3) 2 nitrat gibi kalsiyum tuzları suda kolayca çözünür. Suda çözünmeyen CaF2 florür, CaCO3 karbonat, CaSO4 sülfat, Ca3 (PO4) 2 ortofosfat, CaC2O4 oksalat ve diğerleri.
Önemli olan, kalsiyum karbonat CaCO3'ün aksine, asidik kalsiyum karbonat (bikarbonat) Ca (HCO3) 2'nin suda çözünür olmasıdır. Doğada, bu aşağıdaki süreçlere yol açar. Karbondioksit ile doymuş soğuk yağmur veya nehir suyu yeraltına girdiğinde ve kireçtaşlarına girdiğinde, çözünmeleri gözlenir:
CaCO3 + CO2 + H20 \u003d Ca (HCO3) 2.
Kalsiyum bikarbonat ile doymuş suyun yeryüzüne geldiği ve güneş tarafından ısıtıldığı aynı yerlerde, ters reaksiyon gerçekleşir:
Ca (HCO3) 2 \u003d CaCO3 + CO2 + H20.
Yani doğada büyük miktarda madde transferi var. Sonuç olarak, yeraltında büyük boşluklar oluşabilir ve mağaralarda güzel taş “buz sarkıtları” - sarkıt ve dikitler oluşur.
Suda çözünmüş kalsiyum bikarbonatın varlığı büyük ölçüde suyun geçici sertliğini belirler. Geçici olarak adlandırılır, çünkü su kaynatıldığında hidrokarbonat ayrışır ve CaCO3 çökelir. Bu fenomen, örneğin, su ısıtıcısında zamanla ölçek oluşumuna yol açar.
stronsiyum
Stronsiyum - ikinci grubun ana alt grubunun bir elementi, atom elementleri 38 ile periyodik kimyasal elementlerin periyodik sisteminin beşinci periyodu. I. Mendeleev Dmitry Ivanovich, atom numarası 38'dir. Sr sembolü (lat. Stronsiyum) ile gösterilir. Stronsiyumun basit maddesi (CAS numarası: 7440-24-6) gümüş-beyaz renkli yumuşak, yumuşak ve sünek bir alkalin toprak metaldir. Yüksek kimyasal aktiviteye sahiptir, havadaki nem ve oksijen ile hızla reaksiyona girer, sarı bir oksit filmle kaplanır.
1764'te İskoç Stronshian köyü yakınlarındaki bir kurşun madeninde bulunan mineral strontianitte yeni bir element bulundu ve daha sonra yeni elemente isim verdi. Bu mineralde yeni metal oksit bulunması, yaklaşık 30 yıl sonra William Kruykshenk ve Ader Crawford tarafından kuruldu. 1808'de Sir Humphrey Davy tarafından saf halde tahsis edildi.
Stronsiyum - yumuşak gümüş-beyaz bir metal, süneklik ve süneklik, bir bıçakla kolayca kesilir.
Polimorfik - üç modifikasyonu bilinmektedir. 215 ° C'ye kadar, kübik yüz merkezli bir modifikasyon (α-Sr), 215 ila 605 ° C - altıgen (β-Sr) arasında, 605 ° C'nin üzerinde - kübik hacim merkezli bir modifikasyon (γ-Sr) stabildir.
Erime noktası - 768 ° C, Kaynama noktası - 1390 ° C
Stronsiyum bileşiklerinde daima +2 bir değerlik gösterir. Özellikleri ile stronsiyum kalsiyum ve baryuma yakındır ve aralarında bir ara pozisyon işgal eder.
Elektrokimyasal stres serilerinde stronsiyum en aktif metaller arasındadır (normal elektrot potansiyeli −2.89 V'dir. Hidroksit oluşturmak için su ile enerji ile reaksiyona girer:
Sr + 2H2O \u003d Sr (OH) 2 + H2
Asitlerle etkileşir, ağır metalleri tuzlarından uzaklaştırır. Konsantre asitlerle (H2SO4, HNO3) zayıf reaksiyona girer.
Metalik stronsiyum havada hızla okside olur ve SrO okside ek olarak SrO2 peroksit ve Sr3N2 nitrürün daima mevcut olduğu sarımsı bir film oluşturur. Havada ısıtıldığında tutuşur; havada toz stronsiyum kendiliğinden tutuşmaya eğilimlidir.
Metal olmayan - sülfür, fosfor, halojenler ile kuvvetli reaksiyona girer. Hidrojen (200 ° C'nin üstünde), azot (400 ° C'nin üstünde) ile etkileşir. Pratik olarak alkalilerle reaksiyona girmez.
Yüksek sıcaklıklarda, karbür oluşturmak için CO2 ile reaksiyona girer:
5Sr + 2CO2 \u003d SrC2 + 4SrO
Cl-, I-, NO3- anyonlu az çözünür stronsiyum tuzları. F-, SO42-, CO32-, PO43- anyonlarına sahip tuzlar hafifçe çözünür.
Stronsiyum, cuprum ve bazı alaşımlarının alaşımı için, akü kurşun alaşımlarına giriş yapmak, dökme demirin kükürtlenmesinde, cuprum için kullanılır. çelikler.
baryum
Baryum, atom numarası 56 ile DI Dmitry Ivanovich Mendeleev'in kimyasal elementlerin periyodik sisteminin altıncı periyodu olan ikinci grubun ana alt grubunun bir elementidir. Ba sembolü (lat. Baryum) ile gösterilir. Basit madde baryumdur (CAS numarası: 7440-39-3) - gümüş-beyaz renkli yumuşak, dövülebilir alkali toprak metali. Kimyasal aktivitesi yüksektir.
Baryum, Karl Scheele tarafından 1774'te BaO oksit olarak keşfedildi. 1808'de İngiliz kimyacı Humphrey Davy, ıslak baryum hidroksitin bir cıva katodu ile elektrolizi ile elde edildi. malgama baryum; Civa buharlaştırıldıktan sonra, ısıtma üzerine metalik baryum izole etti.
Baryum gümüş-beyaz dövülebilir bir metaldir. Keskin bir darbe kırıldığında. Baryumun iki allotropik modifikasyonu vardır: 375 ° C'ye kadar, α-Ba kübik gövde merkezli bir kafesle (parametre a \u003d 0.501 nm) stabildir ve β-Ba daha stabildir.
Mineralojik ölçekte 1,25 sertlik; Mohs ölçeğinde 2.
Metal baryum gazyağı içinde veya bir parafin tabakası altında saklanır.
Baryum toprak alkali bir metaldir. Havada yoğun bir şekilde oksitlenir, baryum oksit BaO ve baryum nitrit Ba3N2 oluşturur ve hafif ısıtma ile tutuşur. Baryum hidroksit Ba (OH) 2 oluşturmak için su ile kuvvetli reaksiyona girer:
Ba + 2H20 \u003d Ba (OH) 2 + H2
Seyreltik asitlerle aktif olarak etkileşir. Birçok baryum tuzları suda çözünmez veya az çözünür: baryum sülfat BaSO4, baryum sülfit BaSO3, baryum karbonat BaCO3, baryum fosfat Ba3 (PO4) 2. Baryum sülfür BaS, kalsiyum sülfür CaS'den farklı olarak suda yüksek oranda çözünür.
Halojenlerle halojenlerle kolayca reaksiyona girer.
Hidrojen ile ısıtıldığında, lityum hidrid LiH ile Li kompleksini veren baryum hidrit BaH2 oluşturur.
Amonyakla ısıtıldığında reaksiyon verir:
6Ba + 2NH3 \u003d 3BaH2 + Ba3N2
Baryum nitrür Ba3N2, ısıtıldığında, CO ile etkileşerek siyanür oluşturur:
Ba3N2 + 2CO \u003d Ba (CN) 2 + 2BaO
Sıvı amonyak ile, altın bir parlaklığa sahip olan ve NH3'ün çıkarılmasıyla kolayca ayrışan amonyağın izole edilebileceği koyu mavi bir çözelti verir. Platin katalizör varlığında, amonyak baryum amit oluşturmak için ayrışır:
Ba (NH2) 2 + 4NH3 + H2
Baryum karbür BaC2, bir BaO kömür fırınında ısıtılarak elde edilebilir.
Fosforlu Ba3P2 fosforunu oluşturur.
Baryum, birçok metalin oksitlerini, halidlerini ve sülfürlerini ilgili metale indirger.
Baryum metal, genellikle alüminyum alaşımlı, yüksek vakumlu elektronik cihazlarda bir alıcı (alıcı) olarak kullanılır ve ayrıca boru hatlarına karşı agresifliği azaltmak için sıvı metal soğutuculara (sodyum, potasyum, rubidyum, lityum, sezyum alaşımları) birlikte eklenir. metalurji.
Geçiş metalleri
Geçiş metalleri (geçiş elementleri) atomlarında d- ve f-orbitallerde bulunan atomlarda D. I. Mendeleev Dmitry Ivanovich'in Periyodik Tablosunun yan alt gruplarının elementleridir. Genel olarak, geçiş elemanlarının elektronik yapısı aşağıdaki gibi temsil edilebilir: Ns orbitalleri bir veya iki elektron içerir; kalan değerlik elektronları orbitaller üzerinde bulunur. Değerlik elektronlarının sayısı orbital sayısından belirgin şekilde daha az olduğundan, geçiş elemanlarının oluşturduğu basit maddeler metaldir.
Geçiş elemanlarının genel özellikleri
Tüm geçiş öğeleri aşağıdaki ortak özelliklere sahiptir:
Küçük elektronegatiflik değerleri.
Değişken oksidasyon durumları. Dış ns-alt seviyesi üzerinde 2 değerlik elektronu bulunan atomlarda hemen hemen tüm d-elementleri için, oksidasyon durumu +2 bilinmektedir.
D.I. Kimyasal Elementlerin Periyodik Tablosunun III. Grubunun d-elemanlarından başlayarak, Dmitri Ivanovich Mendeleev, düşük oksidasyon halindeki elementler, en yüksek - asidik, ara - amfoterikte temel özellikler sergileyen bileşikler oluşturur.
demir
Demir, atom numarası 26 olan DI Mendeleev Dmitry Ivanovich'in kimyasal elementlerinin periyodik sisteminin dördüncü periyodunun sekizinci grubunun bir yan alt grubunun bir elementidir. Fe (lat. Ferrum) sembolü ile gösterilir. Yerkabuğundaki en yaygın metallerden biri (alüminyumdan sonra ikinci sırada).
Basit madde demir (CAS numarası: 7439-89-6) yüksek kimyasal reaktiviteye sahip gümüş-beyaz dövülebilir bir metaldir: demir yüksek sıcaklıklarda veya havada yüksek nemde hızla paslanır. Saf oksijen, demir yanar ve ince bir şekilde dağılmış halde kendiliğinden havada tutuşur.
Aslında, demir genellikle saf metalin yumuşaklığını ve sünekliğini koruyan düşük safsızlık içeriğine (% 0.8'e kadar) sahip alaşımları olarak adlandırılır. Ancak pratikte, karbonlu demir alaşımları daha sık kullanılır: (% 2'ye kadar karbon) ve (% 2'den fazla karbon) ve ayrıca alaşım metal katkı maddeleri (krom, manganez, Ni, vb.) Olan paslanmaz (alaşımlı) çelik. Demirin ve alaşımlarının spesifik özelliklerinin birleşimi, onu insanlar için önemi olan “metal No. 1” yapar.
Doğada, demir nadiren saf formunda bulunur, çoğu zaman demir-nikel göktaşlarında bulunur. Yerkabuğunda demir prevalansı% 4.65'tir (O, Si, Al'den sonra 4. sırada). Ayrıca demirin dünyanın çekirdeğinin büyük bir bölümünü oluşturduğuna inanılmaktadır.




Demir tipik bir metaldir, serbest durumunda grimsi bir renk tonu ile gümüş beyazıdır. Saf metal plastiktir, çeşitli safsızlıklar (özellikle karbon) sertliğini ve kırılganlığını arttırır. Belirgin manyetik özelliklere sahiptir. Genellikle "demirin üçlüsü" olarak adlandırılan - üç metal grubu (demir Fe, kobalt Co, Ni Ni), benzer fiziksel özelliklere, atom yarıçaplarına ve elektronegatiflik değerlerine sahiptir.
Demir polimorfizm ile karakterizedir; dört kristal modifikasyonu vardır:
vücut merkezli bir kübik kafes ve ferro-mıknatısın özellikleri ile 769 ° C'ye kadar α-Fe (ferrit) bulunur (769 ° C ≈ 1043 K - Demir için Curie noktası)
769-917 ° C sıcaklık aralığında, sadece vücut merkezli kübik kafes parametrelerinde ve paramanyetin manyetik özelliklerinde α-Fe'den farklı olan β-Fe vardır.
917–1394 ° C sıcaklık aralığında, yüz merkezli bir kübik kafesli γ-Fe (ostenit) vardır
1394 ° C'nin üstünde, δ-Fe hacim merkezli bir kübik kafes ile sabittir
Metalurji β-Fe'yi ayrı bir faz olarak izole etmez ve onu bir tür α-Fe olarak görür. Demir veya çelik Curie noktasının (769 ° C ≈ 1043 K) üzerine ısıtıldığında, iyonların termal hareketi elektron spin manyetik momentlerinin oryantasyonunu bozar, ferromanyet paramagnet haline gelir - ikinci dereceden bir faz geçişi meydana gelir, ancak kristallerin temel fiziksel parametrelerinde bir değişiklikle birinci dereceden faz geçişi gerçekleşmez.
Normal basınçta saf demir için, metalurji açısından, aşağıdaki kararlı değişiklikler mevcuttur:
Mutlak sıfırdan 910 ° C'ye kadar, vücut merkezli bir kübik (bcc) kristal kafes ile α modifikasyonu stabildir. A-demir içindeki katı bir karbon çözeltisine ferrit denir.
910 ila 1400 єC arasında, yüz merkezli kübik (fcc) kristal kafesi ile γ modifikasyonu stabildir. İron-demirdeki katı bir karbon çözeltisine östenit denir.
910 ila 1539 ° C arasında, vücut merkezli bir kübik (bcc) kristal kafes ile δ modifikasyonu stabildir. İron-demirde (ayrıca a-demirde) katı bir karbon çözeltisine ferrit denir. Atomik yapıları aynı olmasına rağmen, yüksek sıcaklıklı δ-ferrit ve düşük sıcaklıklı a-ferrit (veya sadece ferrit) bazen ayırt edilir.
Çelikte karbon ve alaşım elementlerinin varlığı, faz geçişlerinin sıcaklığını önemli ölçüde değiştirir.
Yüksek basınçlar bölgesinde (104 MPa'nın üstünde, 100 bin atmosfer), close-demirin altıgen yakın paketlenmiş (HCP) bir kafesle modifikasyonu ortaya çıkar.
Polimorfizm fenomeni çelik metalurjisi için son derece önemlidir. Kristal kafesin α-γ geçişleri sayesinde çeliğe ısıl işlem uygulanmaktadır. Bu fenomen olmasaydı, çeliğin temeli olarak demir bu kadar yaygın bir şekilde kullanılmazdı.
Demir refrakterdir, orta aktivite metallerini ifade eder. Demirin erime noktası 1539 ° C, kaynama noktası yaklaşık 3200 ° C'dir.
Demir en çok kullanılan metallerden biridir; dünya metalürjik üretiminin% 95'ine karşılık gelir.
Demir, çeliklerin ve dökme demirlerin ana bileşenidir - en önemli yapısal malzemeler.
Demir, diğer metallere dayanan alaşımların bir parçası olabilir - örneğin, nikel.
Manyetik demir oksit (manyetit) uzun süreli bilgisayar bellek cihazlarının üretiminde önemli bir malzemedir: sabit diskler, disketler, vb.
Ultra ince manyetit tozu, siyah beyaz lazer yazıcılarda toner olarak kullanılır.
Bir dizi demir bazlı alaşımın benzersiz ferromanyetik özellikleri, transformatörlerin ve elektrik motorlarının manyetik çekirdekleri için elektrik mühendisliğinde yaygın olarak kullanılmalarına katkıda bulunur.
Demir (III) klorür (ferrik klorür) amatör radyo uygulamasında baskılı devre kartlarının dekapajı için kullanılır.
Bakır sülfatla karıştırılmış demir sülfat (demir sülfat), bahçe ve inşaatta zararlı mantarları kontrol etmek için kullanılır.
Demir, demir-nikel akülerde, demir-hava akülerinde anot olarak kullanılır.
bakır
Bakır, atom numarası 29 olan DI Dmitry Ivanovich Mendeleev'in kimyasal elementlerinin periyodik sisteminin dördüncü periyodu olan birinci grubun bir yan alt grubunun bir elementidir. Cu sembolü (lat. Cuprum) ile gösterilir. Basit madde bakır (CAS numarası: 7440-50-8), altın pembe renkte (oksit filmin yokluğunda pembe renk) plastik bir geçiş metalidir. C uzun zamandır insan tarafından yaygın olarak kullanılmaktadır.



Bakır, havaya hızlı bir şekilde bir oksit filmi ile kaplanmış, ona karakteristik yoğun sarımsı-kırmızı bir ton veren altın-pembe sünek bir metaldir. Bakır yüksek termal ve elektrik iletkenliğine sahiptir (gümüşten sonra elektrik iletkenliğinde ikinci sıradadır). İki kararlı izotop vardır - 63Cu ve 65Cu ve birkaç radyoaktif izotop. En uzun ömürlü olan 64Cu, 12.7 saatlik bir yarı ömre ve çeşitli ürünlerle iki ayrışma seçeneğine sahiptir.
Yoğunluk - 8,94 * 10і kg / mі
20 ° C'de özgül ısı - 390 J / kg * K
20-100 ° C'de elektrik direnci - 1.78 · 10−8 Ohm · m
Erime noktası - 1083 ° C
Kaynama noktası - 2600 ° C
Bir dizi cuprum alaşımları vardır: pirinç - çinko ile cuprum alaşımı, - kalay ile cuprum alaşımı, cupronickel - cuprum ve nikel alaşımı ve diğerleri.
çinko
Çinko, ikinci grubun yan alt grubunun bir elementidir, DI Mendeleev Dmitry Ivanovich'in kimyasal elementlerinin periyodik sisteminin dördüncü periyodu, atom numarası 30'dur. Zn (lat. Zinkum) sembolü ile gösterilir. Normal koşullar altında basit bir madde (CAS numarası: 7440-66-6), mavimsi beyaz bir renge sahip kırılgan bir geçiş metaldir (havada kaybolur, ince bir çinko oksit tabakası ile kaplanır).
Saf haliyle, sünek gümüş-beyaz bir metal. A \u003d 0.26649 nm, c \u003d 0.49468 nm parametrelerine sahip altıgen bir kafese sahiptir. Oda sıcaklığında kırılgandır, plaka büküldüğünde, kristalitlerin sürtünmesinden (genellikle “kalay çığlığından” daha güçlü) çatırtılar duyulur. 100-150 ° C'de çinko plastiktir. Kirlilikler, hatta küçük olanlar bile, çinkonun kırılganlığını keskin bir şekilde arttırır.
Tipik amfoterik metal. Standart elektrot potansiyeli, ütüye kadar bir dizi standart potansiyelde bulunan -0,76 V'tur.
Havada çinko, ince bir ZnO oksit filmi ile kaplanır. Güçlü ısıtma ile amfoterik beyaz ZnO oksit oluşumu ile yanar:
2Zn + O2 \u003d 2ZnO.
Çinko oksit her iki asit çözeltisiyle reaksiyona girer:
ZnO + 2HNO3 \u003d Zn (NO3) 2 + H2O
ve alkaliler:
ZnO + 2NaOH \u003d Na2Zn02 + H20,
Normal saflıkta çinko, asit çözeltileri ile aktif olarak reaksiyona girer:
Zn + 2HCl \u003d ZnCl2 + H2,
Zn + H2SO4 (dekom.) \u003d ZnSO4 + H2
ve alkali çözeltileri:
Zn + 2NaOH + 2H2O \u003d Na2 + H2,
hidroksizinkatlar oluşturur. Çok saf çinko, asit ve alkalilerin çözeltileriyle reaksiyona girmez. Etkileşim birkaç damla cuprum sülfat çözeltisi CuSO4 ilavesiyle başlar.
Isıtıldığında çinko, halojenlerle reaksiyona girerek ZnHal2 halidleri oluşturur. Fosfor ile çinko, Zn3P2 ve ZnP2 fosfürlerini oluşturur. Sülfür ve analogları - selenyum ve tellür - çeşitli kalkogenitler, ZnS, ZnSe, ZnSe2 ve ZnTe.
Çinko hidrojen, azot, karbon, silikon ve bor ile doğrudan reaksiyona girmez. Zn3N2 nitrür, çinkonun amonyak ile 550-600 ° C'de reaksiyonu ile elde edilir.
Sulu çözeltilerde, çinko iyonları Zn2 +, 2+ ve 2+ aquacomplexes'i oluşturur.
Saf metalik çinko, yeraltı liçi (altın, gümüş) ile çıkarılan asil metalleri restore etmek için kullanılır. Ek olarak çinko, gümüş, altın (ve diğer metalleri) ham kurşundan gümüş ve altın ile çinko metaller arası bileşikler ("gümüş köpük" olarak adlandırılır) şeklinde ekstrakte etmek için kullanılır ve bunlar daha sonra geleneksel arıtma yöntemleri ile işlenir.
Çeliği korozyondan korumak için kullanılır (köprüler, tanklar, metal yapılar için mekanik gerilime maruz olmayan yüzeylerin galvanizlenmesi veya metalizasyon). Ayrıca kimyasal akım kaynaklarındaki negatif elektrot için, yani piller ve akümülatörlerde, örneğin: manganez-çinko element, gümüş-çinko pil (EMF 1.85 V, 150 W · h / kg, 650 W · h / dmі, düşük direnç ve devasa deşarj akımları, cıva-çinko element (EMF 1.35 V, 135 W · h / kg, 550-650 W · h / dmі), dioksisülfat-cıva element, iyot-çinko element, bakır oksit galvanik hücre (EMF 0.7-1.6 Volt, 84-127 W · h / kg, 410-570 W · h / dm_), krom-çinko element, çinko-gümüş-gümüş element nt, nikel-çinko pil (EMF 1.82 Volt, 95-118 W · h / kg, 230-295 W · h / dmi), kurşun-çinko element, çinko-klor pil, çinko-bromin pil, vb.). Çinko-hava pillerinde çinkonun rolü çok önemlidir Son yıllarda, çinko-hava-piller, çinko-hava sistemine dayalı olarak bilgisayarlar (dizüstü bilgisayarlar) için yoğun bir şekilde geliştirilmiştir ve bu alanda önemli başarılar elde edilmiştir (lityum pillerden daha büyük, kapasite ve kaynak 3'ten azdır) ayrıca bu sistem motorların çalıştırılması (kurşun akü - 55 W · h / kg, çinko hava - 220-300 W · h / kg) ve elektrikli araçlar (900 km'ye kadar kilometre) için çok umut vericidir. Erime noktalarını azaltmak için birçok lehime dahil edilmiştir. Çinko, pirincin önemli bir bileşenidir. Çinko oksit tıpta antiseptik ve antienflamatuar bir ajan olarak yaygın olarak kullanılmaktadır. Çinko oksit ayrıca boya - çinko oksit üretmek için kullanılır.
Çinko klorür, metallerin lehimlenmesi için önemli bir akıdır ve elyaf üretiminde bir bileşendir.
Tellürid, selenid, fosfit, çinko sülfür yaygın olarak kullanılan yarı iletkenlerdir.
Çinko selenid, orta-kızılötesi aralıkta, örneğin karbondioksit lazerlerinde çok düşük emme katsayısına sahip optik gözlükler yapmak için kullanılır.
cıva
Merkür, atom numarası 80 olan DI Dmitry Ivanovich Mendeleev'in kimyasal elementlerinin periyodik sisteminin altıncı periyodu olan ikinci grubun yan alt grubunun bir elementidir. Hg (lat. Hydrargyrum) sembolü ile gösterilir. Basit madde cıva (CAS numarası: 7439-97-6) bir geçiş metalidir, oda sıcaklığında buharları son derece toksik olan ağır gümüş-beyaz, fark edilir derecede uçucu bir sıvıdır. Civa, basit maddeleri normal koşullar altında sıvı bir agregasyon durumunda olan (ikinci element bromdur) iki kimyasal elementten (ve tek metalden) biridir. Doğada hem doğal bir formda bulunur hem de bir takım mineraller oluşturur. Çoğu zaman, cıva en yaygın mineral - sinabarından indirgeyerek elde edilir. Ölçüm aletleri, vakum pompaları, ışık kaynakları ve diğer bilim ve teknolojilerin imalatında kullanılır.
Civa, oda sıcaklığında bulunan tek metal sıvıdır. Bir diamagnet özelliklerine sahiptir. Birçok metal içeren sıvı alaşımlar oluşturur - amalgamları. Sadece demir, manganez ve Ni.
Civa düşük aktiviteli bir metaldir.
300 ° C'ye ısıtıldığında, cıva oksijen ile reaksiyona girer: 2Hg + O2 → 2HgO Kırmızı cıva oksit (II) oluşur. Bu reaksiyon geri dönüşümlüdür: 340 ° C'nin üstünde ısıtıldığında, oksit basit maddelere ayrışır. Civa oksidin ayrışma reaksiyonu tarihsel olarak oksijen üretimi için ilk yöntemlerden biri olmuştur.
Civa kükürt ile ısıtıldığında, civa (II) sülfür oluşur.
Civa, oksitleyici özelliklere sahip olmayan asit çözeltilerinde çözülmez, ancak aqua regia ve nitrik asitte çözünür ve iki değerlikli cıva tuzları oluşturur. Fazla cıva soğukta nitrik asit içinde çözündüğünde, Hg2 (NO3) 2 nitrat oluşur.
Civa grubunun IIB grubu elemanlarından, çok kararlı bir 6d10 - elektron kabuğunu yok etmek mümkündür, bu da cıva bileşiklerinin var olma olasılığına yol açar (+4). Dolayısıyla, az çözünür Hg2F2 ve suda ayrışan HgF2'ye ek olarak, cıva atomları ile 4 K sıcaklıkta neon ve florin karışımı etkileşimi ile elde edilen HgF4 de vardır.
Civa termometre üretiminde kullanılır; civa-kuvars ve floresan lambalar civa buharı ile doldurulur. Civa kontakları konum sensörü olarak işlev görür. Ek olarak, bir dizi kritik alaşım üretmek için metalik cıva kullanılır.
Daha önce, çeşitli metallerin amalgamları, özellikle altın ve gümüş amalgamları, mücevherlerde, ayna ve diş dolgularının üretiminde yaygın olarak kullanılıyordu. Teknolojide, cıva barometreler ve manometreler için yaygın olarak kullanılmaktadır. Civa bileşikleri, şapka üretiminde vb. Bir antiseptik (mercurik klorür), müshil (kalomel) olarak kullanıldı, ancak yüksek toksisitesi nedeniyle, 20. yüzyılın sonunda bu alanlardan pratik olarak sıkıldı (metallerin, püskürtme ve elektrodepozisyon ile birleştirilmesi diş hekimliğinde dolgular).
Talyum cıva alaşımı düşük sıcaklık termometrelerinde kullanılır.
Metalik cıva, referans voltaj kaynaklarında (Weston hücresi) bazı kimyasal akım kaynaklarında (örneğin, cıva-çinko tipi RC) bir dizi aktif metal, klor ve alkalinin elektrolitik üretimi için bir katot görevi görür. Civa-çinko elementi (emf 1.35 Volt) hacim ve ağırlık bakımından çok yüksek bir enerjiye sahiptir (130 W / h / kg, 550 W / h / dm).
Civa ikincil alüminyum ve altın madenciliğinin geri dönüşümü için kullanılır (amalgam'a bakınız).
Cıva bazen ağır yüklü hidrodinamik yataklarda çalışma sıvısı olarak da kullanılır.
Civa, deniz suyunda gemi gövdelerinin kirlenmesini önlemek için bazı biyosidal boyaların bir parçasıdır.
Radyofarmakolojide Merkür-203 (T1 / 2 \u003d 53 sn) kullanılır.
Civa tuzları da kullanılır:
Civa iyodür yarı iletken radyasyon dedektörü olarak kullanılır.
Civa fulminat ("Patlayıcı civa") uzun süredir patlayıcı madde olarak kullanılmaktadır (Patlayıcılar).
Civa bromür, suyun hidrojene ve oksijene (atomik hidrojen enerjisi) termokimyasal ayrışmasında kullanılır.
Bazı cıva bileşikleri ilaç olarak kullanılır (örneğin, aşıları korumak için merthiolat), ancak esas olarak toksisite nedeniyle, cıvanın 20. yüzyılın ortalarında tıptan (cıva klorür, cıva oksikiyanit - antiseptikler, kalomel - müshil vb.)

alüminyum
Alüminyum, DI Mendeleev Dmitry Ivanovich'in 13 numaralı atomik elementlerin periyodik sisteminin Üçüncü Dönem üçüncü grubunun ana alt grubunun bir elementidir. Atom numarası Al (lat. Alüminyum) ile gösterilir. Hafif metaller grubuna aittir. Yerkabuğundaki en yaygın metal ve üçüncü en yaygın (oksijen ve silikondan sonra) kimyasal element.
Basit madde Alüminyum (CAS numarası: 7429-90-5) - kolayca kalıplanabilen, dökülebilen, işlenebilen hafif, manyetik olmayan gümüş-beyaz metal. Alüminyum, yüzeyi daha fazla etkileşime karşı koruyan güçlü oksit filmlerin hızlı oluşumu nedeniyle yüksek termal ve elektrik iletkenliğine, korozyon direncine sahiptir.
Bazı biyolojik çalışmalara göre, alzheimer hastalığının gelişiminde insan vücuduna alüminyum alımı bir faktör olarak kabul edildi, ancak bu çalışmalar daha sonra eleştirildi ve birinin diğeriyle ilişkisi hakkındaki sonuç reddedildi.
Gümüş-beyaz metal, hafif, yoğunluk 2.7 g / cm2, teknik 658 ° C için erime noktası, yüksek saflıkta alüminyum 660 ° C, kaynama noktası 2500 ° C, dökümün 10-12 kg / mm2 geçici direnci, deforme olabilir 18 -25 kg / mm2, alaşımlar 38-42 kg / mm2.
Brinell sertliği 24-32 kgf / mm2, yüksek süneklik: teknik% 35, saf% 50, ince bir tabakaya ve hatta folyoya sarılmıştır.
Alüminyum, yüksek bir elektriksel iletkenliğe ve termal iletkenliğe sahiptir, Cuprum'un elektriksel iletkenliğinin% 65'i, yüksek bir yansıtıcılığa sahiptir.
Alüminyum hemen hemen tüm Metallerle alaşımlar oluşturur.
Normal şartlar altında, Alüminyum ince ve güçlü bir oksit film ile kaplanır ve bu nedenle klasik oksitleyici ajanlarla reaksiyona girmez: H2O (t °); O2, HNO3 (ısıtma olmadan). Bu nedenle, Alüminyum pratik olarak korozyona duyarlı değildir ve bu nedenle modern endüstri tarafından büyük ölçüde talep görmektedir. Bununla birlikte, oksit filmin imhası sırasında (örneğin, amonyum tuzları NH4 +, sıcak alkaliler veya amalgamasyonun bir çözeltisi ile temas üzerine), Alüminyum aktif bir metal indirgeme maddesi olarak işlev görür.
Basit maddelerle kolayca reaksiyona girer:
oksijen ile:
4Al + 3O2 \u003d 2Al2O3
halojenler ile:
2Al + 3Br2 \u003d 2AlBr3
ısıtıldığında diğer metal olmayanlarla reaksiyona girer:
alüminyum sülfür oluşturan Kükürt ile:
2Al + 3S \u003d Al2S3
azot ile Alüminyum nitrür oluşturmak için:
karbonlu, alüminyum karbür oluşturan:
4Al + 3C \u003d Al4C3
Alüminyum sülfür ve karbür tamamen hidrolize edilir:
Al2S3 + 6H2O \u003d 2Al (OH) 3 + 3H2S
Al4C3 + 12H2O \u003d 4Al (OH) 3+ 3CH4
Karmaşık maddelerle:
su ile (koruyucu oksit filmi çıkardıktan sonra, örneğin, birleşme veya sıcak alkali çözeltileri):
2Al + 6H20 \u003d 2Al (OH) 3 + 3H2
alkaliler ile (tetrahidroksoalüminatlar ve diğer alüminatlar oluşumu ile):
2Al + 2NaOH + 6H2O \u003d 2Na + 3H2
2 (NaOH.H20) + 2Al \u003d 2NaAlO2 + 3H2
Hidroklorik ve seyreltik sülfürik asitlerde kolayca çözünür:
2Al + 6HCl \u003d 2AlCl3 + 3H2
2Al + 3H2SO4 (dec) \u003d Al2 (SO4) 3 + 3H2
Isıtıldığında, asitlerde çözünür - Alüminyumun çözünür tuzlarını oluşturan oksitleyici ajanlar:
2Al + 6H2SO4 (konsantrasyon) \u003d Al2 (SO4) 3 + 3SO2 + 6H2O
Al + 6HNO3 (konsantrasyon) \u003d Al (NO3) 3 + 3NO2 + 3H2O
metalleri oksitlerinden geri yükler (aluminotermi):
8Al + 3Fe3O4 \u003d 4Al2O3 + 9Fe
2Al + Cr2O3 \u003d Al2O3 + 2Cr
Yapısal malzeme olarak yaygın olarak kullanılır. Alüminyumun bu kalitedeki ana avantajları hafiflik, damgalama esnekliği, korozyon direnci (havada, Alüminyum anında daha fazla oksidasyonunu önleyen dayanıklı bir Al2O3 filmi ile kaplanır), yüksek termal iletkenlik, bileşiklerinin toksik olmamasıdır. Özellikle, bu özellikler Alüminyum'u Gıda Endüstrisinde tencere, alüminyum folyo üretiminde ve ambalajlamada son derece popüler hale getirmiştir.
Alüminyumun yapısal bir malzeme olarak ana dezavantajı düşük mukavemeti, bu nedenle genellikle az miktarda Cuprum ve magnezyum (alaşım duralumin olarak adlandırılır) ile kaynaştırılır.
Alüminyumun elektriksel iletkenliği Cuprum'dan sadece 1.7 kat daha az, Alüminyum ise yaklaşık 2 kat daha ucuzdur. Bu nedenle, elektrik mühendisliğinde tel üretimi, ekranlama ve hatta mikroelektronikte cips iletken üretiminde yaygın olarak kullanılmaktadır. Alüminyumun (37 1 / ohm) Cuprum'a (63 1 / ohm) kıyasla daha düşük elektrik iletkenliği, alüminyum iletkenlerin kesitindeki bir artışla telafi edilir. Elektroteknik bir malzeme olarak Alüminyum'un bir dezavantajı, lehimlemeyi zorlaştıran güçlü bir oksit filmidir.
Özellik kompleksi nedeniyle termal ekipmanlarda yaygın olarak dağıtılmaktadır.
Alüminyum ve alaşımları mukavemetini son derece düşük sıcaklıklarda tutar. Bu nedenle, kriyojenik teknolojide yaygın olarak kullanılmaktadır.
Düşük yansıma ve püskürtme kolaylığı ile birlikte yüksek yansıtma özelliği, Alüminyum'u ayna üretimi için ideal bir malzeme haline getirir.
Gaz üreten bir ajan olarak yapı malzemelerinin üretiminde.
Korozyon ve ölçeklendirme, çelik ve diğer alaşımları değiştirmek için kullanılır, örneğin, piston içten yanmalı motor valfleri, türbin kanatları, yağ geri kazanım kuleleri, ısı değişim ekipmanları ve ayrıca galvanizleme yerine.
Alüminyum sülfür, hidrojen sülfür üretimi için kullanılır.
Köpüklü alüminyumun özellikle güçlü ve hafif bir malzeme olarak geliştirilmesi için araştırmalar devam etmektedir.
Alüminyum çok pahalı olduğunda, ondan çeşitli mücevherler yapıldı. Onlar için moda, üretiminin yeni teknolojileri (gelişmeleri) ortaya çıktığında hemen geçti ve bu da birçok kez azaldı. Günümüzde alüminyum bazen mücevher üretiminde kullanılmaktadır.


Diğer Metaller
kurşun
Kurşun, dördüncü grubun ana alt grubunun bir elementidir, DI Dmitry Ivanovich Mendeleev'in kimyasal elementlerin periyodik sisteminin altıncı dönemi, atom numarası 82'dir. Pb (lat. Plumbum) sembolü ile gösterilir. Basit madde Kurşun (CAS numarası: 7439-92-1) dövülebilir, nispeten düşük erime noktalı gri metaldir.
Kurşun oldukça düşük bir ısı iletkenliğine sahiptir, 0 ° C sıcaklıkta 35.1 W / (m · K) 'dir. Metal yumuşak, bıçakla kesilmesi kolaydır. Yüzeyde, genellikle az ya da çok kalın bir oksit filmi ile kaplanır; kesildiğinde, zamanla havada solmayan parlak bir yüzey açılır.
Erime noktası: 327.4 ° C
Kaynama noktası: 1740 ° C
Kurşun nitrat, güçlü karışık patlayıcıların üretimi için kullanılır. Kurşun Azide en yaygın kullanılan kapsül (patlayıcıyı başlatan) olarak kullanılır. Kurşun perklorat, cevherlerin yüzdürme işleminde kullanılan ağır sıvıları (yoğunluk 2.6 g / cm2) hazırlamak için kullanılır; bazen oksitleyici bir ajan olarak güçlü karışık patlayıcılarda kullanılır. Tek başına kurşun florür ve bizmut florür Kuprum, Gümüş ile birlikte kimyasal akım kaynaklarında katot malzemesi olarak kullanılır. Kurşun bizmutfat, PbS Kurşun sülfür, Kurşun iyodür lityum pillerde katot malzemesi olarak kullanılır. Bekleme akım kaynaklarında bir katot malzemesi olarak Kurşun Klorür PbCl2. Kurşun tellür PbTe, termoelektrik jeneratörleri ve termoelektrik buzdolaplarının üretiminde en yaygın kullanılan malzeme olan termoelektrik malzeme (350 μV / K ile termoelektrik güç) olarak yaygın olarak kullanılmaktadır. Kurşun dioksit PbO2 sadece bir kurşun-asit aküde yaygın olarak kullanılmaz, aynı zamanda birçok kurşun kimyasal akım kaynağı, örneğin bir kurşun-klor elementi, bir kurşun-flor elementi vb.
Kurşun beyaz, ana karbonat Pb (OH) 2.PbCO3, yoğun beyaz bir toz, havadaki Kurşundan karbondioksit ve asetik asit etkisi altında elde edilir. Kurşun beyazın renklendirici bir pigment olarak kullanılması, H2S hidrojen sülfürün etkisi altında ayrışmaları nedeniyle şimdi eskisi kadar yaygın değildir. Kurşun badana, çimento ve kurşun-karbonat kağıt teknolojisinde macun üretiminde de kullanılır.
Kurşun arsenat ve arsenit, böcek öldürme teknolojisinde böcekleri - tarımsal zararlıları (eşleştirilmemiş ipekböceği ve pamuk biti) öldürmek için kullanılır. Kurşun Borat Pb (BO2) 2 · Çözünmeyen beyaz bir toz olan H2O, resimleri ve vernikleri ve diğer Metallerle birlikte kurutmak için kullanılır - cam ve porselen kaplamaları olarak. Kurşun Klorür PbCl2, beyaz bir kristal toz, sıcak suda, diğer klorürlerin çözeltilerinde ve özellikle amonyum klorür NH4Cl'de çözünür. Tümörlerin tedavisinde merhemlerin hazırlanması için kullanılır.
Kurşun Kromat PbCrO4, krom sarı boya olarak bilinir, boyaların hazırlanması, porselen ve kumaşların renklendirilmesi için önemli bir pigmenttir. Endüstride, kromat esas olarak sarı pigmentlerin üretiminde kullanılır. Kurşun Nitrat Pb (NO3) 2, suda kolayca çözünür olan beyaz kristal bir maddedir. Sınırlı kullanımı büzücüdür. Endüstride kibrit üretimi, boyama ve tekstil baskı, boyama boynuzları ve gravür işlemlerinde kullanılır. Suda çözünmeyen beyaz bir toz olan kurşun sülfat Pb (SO4) 2, piller, litografi ve baskılı kumaş teknolojisinde pigment olarak kullanılır.
Siyah suda çözünmeyen bir toz olan Kurşun Sülfür PbS, çanak çömlekleri pişirmek ve Kurşun iyonlarını tespit etmek için kullanılır.
Kurşun γ radyasyonu iyi emdiği için, X-ışını tesisatlarında ve nükleer reaktörlerde radyasyondan korunma amacıyla kullanılır. Buna ek olarak, Kurşun ümit verici hızlı nötron reaktörleri projelerinde bir soğutucu olarak kabul edilir.
Kurşun alaşımları önemli uygulamalar bulur. % 85-90 Kalay metal ve% 15-10 Pb içeren Puter (Kalay-kurşun alaşımı) kalıplanmış, ucuzdur ve ev eşyaları üretiminde kullanılır. Elektrik mühendisliğinde% 67 Pb ve% 33 Kalay metal içeren lehim kullanılır. Kurşun ve antimon alaşımları mermi ve tipografi imalatında, Kurşun, antimon ve Kalay alaşımları ise figür döküm ve rulmanlarında kullanılır. Antimon Kurşun alaşımları genellikle kablo kılıfları ve elektrikli akü plakaları için kullanılır. Kurşun bileşikleri boya, boya, böcek ilacı, cam imalatında kullanılır. Ticaret Eşyaları ve benzine tetraetil kurşun (C2H5) 4Pb (orta derecede uçucu bir sıvı) şeklinde katkı maddeleri olarak, düşük konsantrasyonlarda bir çift kesimin tatlı bir meyve kokusu vardır, büyük olanlarda hoş olmayan bir koku vardır; Mp \u003d 130 ° C, mp \u003d 80 ° C / 13 mm RT d.; dens. 1.650 g / cm; nD2v \u003d 1.5198; suda çözünmez, organik çözücülerle karışır; yüksek derecede toksik, cilde kolayca nüfuz eder; MPC \u003d 0.005 mg / m; LD50 \u003d 12.7 mg / Oktan derecesini arttırmak için kg (sıçan, oral)).

kalay
Kalay, dördüncü grubun ana alt grubunun bir elementidir, beşinci kimyasal elementlerin periyodik sistemi DI Mendeleev Dmitry Ivanovich, atom numarası 50'dir. Kalay metal (lat. Stannum) sembolü ile gösterilir. Normal koşullar altında basit bir madde, gümüş-beyaz renkli sünek, dövülebilir ve eriyebilir parlak bir metaldir. Kalay, birkaç allotropik modifikasyon oluşturur: elmas tipi bir kübik kafes ile 13.2 ° C'nin altında sabit α-kalay (gri Kalay), bir tetragonal kristal kafes ile 13.2 ° C'nin üzerinde kararlı β-kalay (beyaz Kalay).
Kalay esas olarak saf formunda veya diğer Metallerle alaşımlarda güvenli, toksik olmayan, korozyona dayanıklı bir kaplama olarak kullanılır. Kalayın ana endüstriyel uygulamaları, gıda ürünleri kaplarının üretimi için teneke (kalaylı Demir), elektronik lehimlerinde, ev boru hatlarında, rulman alaşımlarında ve Kalay ve alaşımlarının kaplamalarındadır. En önemli kalay alaşımı bronz (Cuprum ile). Yemek yapmak için bir başka iyi bilinen alaşım - bir bilgisayar - kullanılır. Son zamanlarda, ağır demir dışı metaller arasında en "çevre dostu" olduğu için Metal kullanımına ilgi yeniden canlandırıldı. Nb3Sn intermetalik bileşiğe dayalı süper iletken teller oluşturmak için kullanılır.
fiyatları 2006 yılında metal Kalay üzerinde ortalama 12-18 $ / kg, yüksek saflıkta yaklaşık 25 $ / kg Kalay dioksit, yüksek saflıkta tek kristal Kalay yaklaşık 210 $ / kg idi.
Kalay ve zirkonyum intermetalik bileşikler yüksek erime noktalarına (2000 ° C'ye kadar) ve havada ısıtıldığında oksidasyon direncine sahiptir ve bir dizi uygulamaya sahiptir.
Kalay, yapısal titanyum alaşımlarının üretiminde en önemli alaşım bileşenidir.
Kalay dioksit, optik cam yüzeyini “bitirmek” için kullanılan çok etkili bir aşındırıcı malzemedir.
Kalay tuzlarının bir karışımı - "sarı bileşim" - daha önce yün boyası olarak kullanılmıştır.
Kalay ayrıca kimyasal akım kaynaklarında anot malzemesi olarak kullanılır, örneğin: manganez-kalay elemanı, oksit-cıva-kalay elemanı. Umut vaat eden bir kurşun-kalay pil Tin kullanın; bu nedenle, örneğin, bir kurşun aküyle eşit voltajda, bir kurşun kalay aküsü birim hacim başına 2.5 kat daha yüksek kapasiteye ve 5 kat daha yüksek enerji yoğunluğuna sahiptir, iç direnci çok daha düşüktür.
Metal Kalay, gıda endüstrisinde kullanılmasına izin veren toksik değildir. 600 ° C'ye kadar sıcaklıklarda eriyik dahil olmak üzere normal depolama ve kullanım koşulları altında Kalay'da bulunan zararlı safsızlıklar, GOST uyarınca izin verilen maksimum konsantrasyonu aşan hacimlerde çalışma alanının havasına salınmaz. Kalay tozuna uzun süreli (15-20 yıl) maruz kalmanın akciğerler üzerinde fibrojenik bir etkisi vardır ve pnömokonyoz ile çalışanların hastalığına neden olabilir.
Metal Uygulaması
İnşaat malzemeleri
Metaller ve alaşımları modern uygarlığın ana yapısal malzemelerinden biridir. Bu öncelikle sıvılara ve gazlara karşı yüksek mukavemeti, homojenliği ve geçirimsizliği ile belirlenir. Ek olarak, alaşımların bileşimini değiştirerek, özelliklerini çok geniş bir aralıkta değiştirmek mümkündür.
Elektrik Malzemeleri
Metaller iyi iletken olarak kullanılır Elektrik gücü (Bakır, Alüminyum) ve dirençler ve elektrikli ısıtma elemanları (nikrom vb.) İçin yüksek dirençli malzemeler olarak.
Alet malzemeleri
Metaller ve alaşımları, aletlerin (çalışma parçalarının) üretiminde yaygın olarak kullanılmaktadır. Bunlar genellikle takım çelikleri ve karbürlerdir. Elmas, bor nitrür ve seramik de alet malzemesi olarak kullanılır.
metalurji
Metalurji veya metalurji, Metallerin, metaller arası bileşiklerin ve alaşımların fiziksel ve kimyasal davranışlarını inceleyen bir malzeme bilimi alanıdır. Metalurji, aynı zamanda, hammaddeler çıkarılmasından bitmiş ürünlerin parasal emisyonuna kadar, Metaller hakkındaki mevcut bilgilerin pratik uygulamasını da içerir.
Metal ve oksit eriyiklerin ve katı çözeltilerin yapı ve fizikokimyasal özelliklerinin incelenmesi, maddenin yoğun hal teorisinin geliştirilmesi;
Termodinamik, kinetik ve metalurjik reaksiyonların mekanizması;
Polimetalik mineral hammaddelerin ve endüstriyel atıkların çevre sorunlarının çözümü ile entegre kullanımı için bilimsel ve teknik ve ekonomik temellerin geliştirilmesi;
Pirometalurjik, elektrotermal, hidrometalurjik ve gaz fazının temelleri teorisinin geliştirilmesi süreçler metal, alaşım, metal tozu ve kompozit malzeme ve kaplama üretimi.
Demirli metaller arasında Demir, Manganez, Krom, Vanadyum bulunur. Geri kalan her şey renklidir. Fiziksel özelliklerine ve amaçlarına göre, demir dışı metaller geleneksel olarak ağır (bakır, kurşun, çinko, kalay, Ni) ve ışığa (alüminyum, magnezyum) ayrılır.
Ana teknolojik sürece göre, pirometalurji (eritme) ve hidrometalurjiye (metallerin kimyasal çözeltilerde ekstraksiyonu) ayrılır. Çeşitli pirometalurji plazma metalurjisidir.
Plazma Metalurjisi - cevherlerden ekstraksiyon, plazmanın etkisi altında metallerin ve alaşımların eritilmesi ve işlenmesi.
Cevherlerin (oksitlerin, vb.) İşlenmesi, plazmada termal ayrışmaları ile gerçekleştirilir. Ters reaksiyonları önlemek için bir indirgeme maddesi (karbon, hidrojen, metan vb.) Veya termodinamik dengeyi ihlal eden plazma akışının keskin bir şekilde soğutulması kullanılır.
Plazma Metalurjisi, metalin cevherden doğrudan indirgenmesini sağlar, metalurjik süreçleri önemli ölçüde hızlandırır, temiz malzemeler elde eder, yakıt tüketimini azaltır (indirgeyici ajan). Plazma metalurjisinin dezavantajı, plazma üretmek için kullanılan yüksek elektrik tüketimidir.

Hikaye
Bir kişinin metalurji ile uğraştığına dair ilk kanıt, MÖ 5-6 bin yıl öncesine dayanmaktadır. e. ve Majdanpek, Pločnik ve Sırbistan'daki diğer yerlerde (Vinca kültürüyle ilgili M.Ö. 5500 bakır balta dahil), Bulgaristan (M.Ö. 5000), Palmele (), İspanya, Stonehenge'de bulundu (). Bununla birlikte, bu kadar uzun süredir devam eden fenomenlerde sıklıkla olduğu gibi, yaş her zaman kesin olarak belirlenemez.
Erken dönem kültüründe, sınırlı metal işlemeye izin veren Gümüş, Bakır, Kalay ve göktaşı Demir vardır. Böylece, “Göksel Hançerler” çok değerliydi - M.Ö. 3000 yıllarında göktaşı demirinden üretilen Mısır silahları. e. Ancak, Bakır ve Kalay madeni kaya M.Ö. 3500 yılında insanlar bronz denilen bir alaşım alırlar. e. Bronz Çağı'na girdi.
Cevherden demir almak ve eritme Metal çok daha zordu. Teknolojinin MÖ 1200 civarında Hititler tarafından icat edildiğine inanılmaktadır. Demir Çağının başlangıcıydı. Madencilik ve üretimin sırrı Demir, Filistin'in egemenliğinde önemli bir faktör haline geldi.
Demirli metalurjinin gelişiminin izleri, birçok geçmiş kültür ve medeniyette izlenebilir. Bu, Orta Doğu ve Orta Doğu'nun eski ve ortaçağ krallıklarını ve imparatorluklarını, eski Mısır ve Anadolu'yu (), Kartaca, eski ve ortaçağ Yunan ve Romalılarını içerir. AvrupaMetalurjinin birçok yöntem, cihaz ve teknolojisinin ilk olarak antik Çin'de icat edildiği ve daha sonra Avrupalıların bu gemiye hakim olduklarını (yüksek fırınları icat ederek, Dökme demir, Çelik, hidrolik kırıcılar vb.). Bununla birlikte, son araştırmalar, Roma teknolojisinin özellikle madencilik ve dövme işleminde daha önce düşünüldüğünden çok daha ileri olduğunu göstermektedir.
Ekstraktif metalurji
Madencilik Metalurjisi, cevherden değerli Metallerin çıkarılmasından ve çıkarılan hammaddelerin saf Metal'e eritilmesinden oluşur. Metalin oksit veya sülfürünü saf metale dönüştürmek için, cevherin fiziksel, kimyasal veya elektrolitik yöntemlerle ayrılması gerekir.
Metalurjistler üç ana bileşenle çalışır: hammaddeler, konsantre (değerli metal oksit veya sülfür) ve atık. Madencilikten sonra, her bir parçacığın değerli bir konsantre veya atık olduğu noktaya kadar büyük cevher parçaları ezilir.
dağ iş cevher ve çevre sızıntıya izin veriyorsa isteğe bağlı. Bu şekilde çözülebilir ve Mineral ile zenginleştirilmiş bir çözelti elde edilebilir.
Cevher genellikle birkaç değerli Metal içerir. Bu durumda, bir İşlemden kaynaklanan atıklar başka bir İşlem için hammadde olarak kullanılabilir.
alaşım
Alaşım, metal bileşenlerin baskın olduğu iki veya daha fazla kimyasal elementin makroskopik olarak homojen bir karışımıdır. Alaşımın ana veya tek fazı, kural olarak, alaşımın temeli olan metaldeki alaşım elementlerinin katı bir çözeltisidir.
Alaşımlar metalik özelliklere sahiptir, örneğin: metalik parlaklık, yüksek elektrik iletkenliği ve termal iletkenlik. Bazen alaşım bileşenleri sadece kimyasal elementler değil, aynı zamanda metalik özelliklere sahip kimyasal bileşikler olabilir. Örneğin, karbürlerin ana bileşenleri tungsten veya titanyum karbürlerdir. Alaşımların makroskopik özellikleri her zaman bileşenlerinin özelliklerinden farklıdır ve çok fazlı (heterojen) alaşımların makroskopik homojenliği, metal matriksindeki safsızlık fazlarının düzgün dağılımı nedeniyle elde edilir.
Alaşımlar genellikle bileşenlerin erimiş halde karıştırılması ve ardından soğutulmasıyla elde edilir. Bileşenlerin yüksek erime sıcaklıklarında, alaşımlar, metal tozlarının sonraki sinterleme ile karıştırılmasıyla üretilir (örneğin, birçok tungsten alaşımı bu şekilde elde edilir).
Alaşımlar ana yapısal malzemelerden biridir. Bunlar arasında en önemlisi Demir ve Alüminyum bazlı alaşımlardır. Karbon, silikon, bor gibi metal olmayan pek çok alaşımın bileşimine sokulabilir ve teknikte 5 binden fazla alaşım kullanılmaktadır.
kaynaklar
http://ru.wikipedia.org/
Yatırımcının ansiklopedisi. 2013 .
eşanlamlılar:- - METAL, metal koca., Lat. krushets; ve küçük bir formda, eritme işleminde: korolek. Günlük yaşamda değerli, pahalı metaller: altın, platin, gümüş; basit: demir, bakır, çinko, kalay, kurşun; Kimya, aşağıdakilerden oluşan neredeyse tüm minerallerin bu prensiplerini keşfetti ... Dahl'ın Açıklayıcı Sözlüğü
Şu anda bilinen kimyasal elementlerin büyük çoğunluğu (117'den 93'ü) metallerdir.
Çeşitli metallerin atomlarının yapıları çok ortaktır ve bunların oluşturduğu basit ve karmaşık maddeler benzer özelliklere (fiziksel ve kimyasal) sahiptir.
Periyodik sistemdeki konumu ve metal atomlarının yapısı.
Periyodik sistemde, metaller bordan astatine geçen koşullu kırık çizginin solunda ve altında bulunur (aşağıdaki tabloya bakın). Hemen hemen tüm s elemanları (H hariç, O) metallere aittir, yaklaşık yarısı r-elementler, hepsi d- ve f-elements ( lantanitler ve aktinitlerden).
Harici enerji seviyesindeki çoğu metal atomu az sayıda (3'e kadar) elektron içerir, sadece bazı p elementli atomlarda (Sn, Pb, Bi, Po) daha fazla (dört ila altı) bulunur. Metal atomlarının değerlik elektronları çekirdeğe zayıf bir şekilde bağlanmıştır (metal olmayan atomlara kıyasla). Bu nedenle, metal atomları nispeten kolay bir şekilde bu elektronları diğer atomlara verir, kimyasal reaksiyonlarda sadece indirgeyici ajanlar olarak hareket eder ve pozitif yüklü katyonlara dönüşür:
Me - ne - \u003d Me n +.
Metal olmayanların aksine, metal atomları sadece +1 ila +8 arasındaki pozitif oksidasyon durumları ile karakterize edilir.
Metal atomlarının değerlik elektronlarını diğer atomlara bağışlama kolaylığı, bu metalin indirgenme aktivitesini karakterize eder. Metal atomu elektronlarını ne kadar kolay verirse, indirgeyici madde o kadar güçlü olur. Metaller, sulu çözeltilerdeki indirgeme kabiliyetlerini azaltmak amacıyla arka arkaya düzenlenirse, metal deplasman serisielektrokimyasal gerilim serileri olarak da adlandırılır (veya yakın aktivite) metaller (aşağıdaki tabloya bakın).
Prevalans mdoğada metaller.
Yerkabuğundaki ilk üç metal (bu, gezegenimizin yaklaşık 16 km kalınlığında yüzey tabakasıdır) alüminyum, demir ve kalsiyumu içerir. Daha az yaygın olan sodyum, potasyum ve magnezyumdur. Aşağıdaki tablo yer kabuğundaki bazı metallerin kütle kısımlarını göstermektedir.
demir ve kalsiyum. Daha az yaygın olan sodyum, potasyum ve magnezyumdur. Aşağıdaki tablo yer kabuğundaki bazı metallerin kütle kısımlarını göstermektedir.
Yerkabuğunda Metallerin Yaygınlığı
| maden | maden | Yerkabuğundaki kütle oranı,% | |
|---|---|---|---|
| Al | 8,8 | Cr | 8,3 ∙ 10 -3 |
| Fe | 4,65 | Zn | 8,3 ∙ 10 -3 |
| Ca | 3,38 | Ni | 8 ∙ 10 -3 |
| na | 2,65 | Cu | 4,7 ∙ 10 -3 |
| K | 2,41 | Pb | 1,6 ∙ 10 -3 |
| mg | 2,35 | Ag | 7 ∙ 10 -6 |
| Ti | 0,57 | Hg | 1,35 ∙ 10 -6 |
| Mn | 0,10 | Au | 5 ∙ 10 -8 |
Yerkabuğundaki kütle oranı% 0.01'den az olan elementlere denir nadir. Nadir metaller, örneğin tüm lantanidleri içerir. Bir element dünyanın kabuğuna konsantre olamıyorsa, yani kendi cevherlerini oluşturmaz, ancak diğer elementlerle safsızlık olarak ortaya çıkarsa, o zaman dalgın öğeleri. Aşağıdaki metaller dağılmıştır, örneğin: Sc, Ga, In, Tl, Hf.
XX yüzyılın 40'larında. Alman bilim adamları Walter ve Ida Nolla bunu önerdiler. kaldırımdaki her parke taşında periyodik sistemin tüm kimyasal elementleri vardır. İlk başta, bu sözler oybirliğiyle onaylanmaktan uzak meslektaşları tarafından karşılandı. Bununla birlikte, gittikçe daha kesin analiz yöntemleri ortaya çıktıkça, bilim adamları bu kelimelerin geçerliliği konusunda gittikçe ikna olmaktadırlar.
Tüm canlı organizmalar çevre ile yakın temas içinde olduğundan, her biri, hepsi olmasa da, periyodik sistemin kimyasal elementlerinin çoğunu içermelidir. Örneğin, bir yetişkinin vücudunda, inorganik maddelerin kütle oranı% 6'dır. Bu bileşiklerdeki metallerden Mg, Ca, Na, K. mevcuttur Vücudumuzdaki enzimlerin ve biyolojik olarak aktif diğer organik bileşiklerin çoğu V, Mn, Fe, Cu, Zn, Co, Ni, Mo, Cr ve diğer bazı metalleri içerir.
Bir yetişkinin vücudu ortalama 140 g potasyum iyonu ve yaklaşık 100 g sodyum iyonu içerir. Gıda ile günlük olarak 1.5 g ila 7 g potasyum iyonu ve 2 g ila 15 g sodyum iyonu tüketiyoruz. Sodyum iyonlarına olan ihtiyaç o kadar büyüktür ki, yiyeceklere özel olarak eklenmesi gerekir. Önemli sodyum iyonu kaybı (idrar ve ter ile NaCl formunda) insan sağlığını olumsuz yönde etkiler. Bu nedenle, sıcak havalarda doktorlar maden suyu içmenizi önerir. Bununla birlikte, yiyeceklerdeki aşırı tuz içeriği iç organlarımızın (başta kalp ve böbrekler) çalışmasını olumsuz yönde etkiler.
Oy kullanabilmek için JavaScript etkin olmalı.Ve diğer kimyasal bileşikler. Saf metalleri ve daha ileri uygulamalarını elde etmek için, bunları cevherlerden izole etmek ve temizlik yapmak gerekir. Gerekirse alaşımlama ve diğer metal işleme. Bilim bunu inceliyor. metalurji . Metalurji demir cevherlerini ayırır ( bez) ve demir dışı (demir içermez, sadece yaklaşık 70 element). Altın, gümüş ve platin ayrıca başvur değerli (asil) metaller . Ayrıca, küçük miktarlarda deniz suyunda, bitkilerde, canlı organizmalarda bulunurlar (önemli bir rol oynarken).
İnsan vücudunun% 3'ünden oluştuğu bilinmektedir. metallerden . Hepsinden önemlisi hücreler kalsiyum ve sodyum konsantre lenfatik sistemler. magnezyum birikir kaslar ve sinir sistemi , bakır - içinde karaciğer , demir - içinde kan.
çıkarma
Metaller genellikle madencilik ile topraktan çıkarılır, sonuç - mayınlı cevherler - gerekli elementlerin nispeten zengin bir kaynağı olarak hizmet eder. Cevherlerin yerini bulmak için cevher araştırmaları ve yatakların araştırılması da dahil olmak üzere özel arama yöntemleri kullanılır. Mevduat genellikle ikiye ayrılır kariyer Madenciliğin, yeraltının yanı sıra ağır ekipman kullanılarak toprağın çıkarılmasıyla gerçekleştirildiği (yüzey cevherleri) mayın.
Metaller, genellikle kimyasal veya elektrolitik indirgeme ile çıkarılan cevherden çıkarılır. pyro cevheri metal hammaddeye dönüştürmek için yüksek sıcaklıklar kullanılır. hidrometalurji aynı amaçla su kimyası için geçerlidir. Kullanılan yöntemler metal tipine ve kirlenme tipine bağlıdır.
Metal cevheri, metal ve metal olmayan bir iyonik bileşik olduğunda, saf metali geri kazanmak için genellikle eritilir - indirgeyici bir madde ile ısıtılır. Gibi birçok yaygın metal demir indirgeyici ajan olarak eritildi karbon (yanan kömürden elde edilir). Bazı metaller, örneğin alüminyum ve sodyum ekonomik olarak uygun bir indirgeyiciye sahip değildir ve elektroliz.
Bazı metallerin Mohs sertliği:
| sertlik | maden |
|---|---|
| 0.2 | sezyum |
| 0.3 | rubidyum |
| 0.4 | potasyum |
| 0.5 | sodyum |
| 0.6 | lityum |
| 1.2 | indiyum |
| 1.2 | talyum |
| 1.25 | baryum |
| 1.5 | stronsiyum |
| 1.5 | galyum |
| 1.5 | kalay |
| 1.5 | kurşun |
| 1.5 | |
| 1.75 | kalsiyum |
| 2.0 | kadmiyum |
| 2.25 | bizmut |
| 2.5 | magnezyum |
| 2.5 | çinko |
| 2.5 | lantan |
| 2.5 | gümüş |
| 2.5 | altın |
| 2.59 | itriyum |
| 2.75 | alüminyum |
| 3.0 | bakır |
| 3.0 | antimon |
| 3.0 | toryum |
| 3.17 | skandiyum |
| 3.5 | platin |
| 3.75 | kobalt |
| 3.75 | palladyum |
| 3.75 | zirkonyum |
| 4.0 | demir |
| 4.0 | nikel |
| 4.0 | hafniyum |
| 4.0 | manganez |
| 4.5 | vanadyum |
| 4.5 | molibden |
| 4.5 | rodyum |
| 4.5 | titan |
| 4.75 | niyobyum |
| 5.0 | iridyum |
| 5.0 | rutenyum |
| 5.0 | tantal |
| 5.0 | teknetyum |
| 5.0 | krom |
| 5.5 | berilyum |
| 5.5 | osmiyum |
| 5.5 | renyum |
| 6.0 | tungsten |
| 6.0 | β-Uranüs |
Elektronların kolay geri tepmesi nedeniyle, metallerin oksidasyonu mümkündür, bu da korozyon ve özelliklerin daha da bozulması. Oksitleme yeteneği, metallerin standart aktivite serisi ile tanınabilir. Bu gerçek, metalleri diğer elementlerle birlikte kullanma ihtiyacını doğrular ( alaşım en önemlisi çelik), bunların alaşımlanması ve çeşitli kaplamaların uygulanması.
Metallerin elektronik özelliklerinin daha doğru bir açıklaması için, kuantum mekaniği . Yeterli katı maddelerde simetri tek tek atomların elektronlarının enerji seviyeleri çakışır ve izin verilen bölgeler oluşturur ve valans elektronlarının oluşturduğu bölgeye denir. değerlik bandı . Metallerdeki değerlik elektronlarının zayıf bağı, metallerdeki değerlik bandının çok geniş olmasına ve tüm değerlik elektronlarının tamamen doldurmak için yeterli olmamasına yol açar.
Böyle kısmen doldurulmuş bir bölgenin temel özelliği, numuneye uygulanan minimum voltajla bile, değerlik elektronlarının yeniden yapılandırılmasının başlaması, yani akmasıdır. elektrik akımı.
Aynı yüksek elektron hareketliliği, yüksek termal iletkenliğe ve ayrıca elektromanyetik radyasyonu (metallere karakteristik bir parlaklık verir) yansıtma yeteneğine yol açar.
Bazı metaller
- Işık:
- diğer:
Metal uygulaması
İnşaat malzemeleri
Alet malzemeleri
Metallerle ilgili fikirlerin gelişim tarihi
İnsanın metallerle tanışması altın , gümüş ve bakır yani, dünya yüzeyinde serbest bir halde bulunan metallerden; daha sonra, doğada önemli ölçüde yaygın olan ve bileşiklerinden kolayca ayırt edilebilen metallerle birleştirildi: kalay , kurşun , demir ve. Bu yedi metal, eski zamanlarda insanlığa aşinaydı. Eski Mısır eserleri arasında, bazı kaynaklara göre, MÖ 3000-4000 yıllık çağa kadar uzanan altın ve bakır ürünler bulunmaktadır. e.
Yedi ünlü metale, sadece orta çağlar eklendi çinko , bizmut , antimon ve XVIII yüzyılın başında arsenik . 18. yüzyılın ortalarından bu yana, keşfedilen metal sayısı hızla artmakta ve 20. yüzyılın başında 65'e, 21. yüzyılın başında 96'ya ulaşmaktadır.
Hiçbir kimya endüstrisi, metallerin üretimi ve işlenmesi ile ilişkili süreçler olarak kimyasal bilginin gelişimine bu kadar katkıda bulunmamıştır; tarihleri \u200b\u200bkimya tarihindeki en önemli anlarla bağlantılıdır. Metallerin özellikleri o kadar karakteristiktir ki, en erken dönemde, altın, gümüş, bakır, kurşun, kalay, demir ve cıva, doğal bir homojen madde grubunu oluşturur ve “metal” kavramı, en eski kimyasal kavramları ifade eder. Bununla birlikte, az ya da çok belirli bir biçimde doğaları hakkındaki görüşler sadece Orta Çağ'da görülür simyacılar . Gerçek fikirler Aristo doğa hakkında: dört elementten (ateş, toprak, su ve hava) var olan her şeyin oluşumu zaten metallerin karmaşıklığını gösterdi; ancak bu fikirler çok belirsiz ve soyuttu. Simyagerler metallerin karmaşıklığı kavramına sahiptir ve bunun sonucunda bazı metalleri başkalarına dönüştürme, yapay olarak oluşturma yeteneğine olan inanç, dünya görüşlerinin temel konseptidir. Bu kavram, o zamana kadar birikmiş metallerin kimyasal dönüşümleri ile ilgili gerçekler kütlesinden doğal bir sonuçtur. Aslında, bir metalin havadaki basit kalsinasyon ve bir metalin bir oksitten tersine çevrilmesi ile onlardan tamamen farklı bir okside dönüşümü, bazı metallerin diğerlerinden çökelmesi, orijinal olarak alınan metallerden başka özelliklere sahip alaşımların oluşumu ve benzeri gibi görünüyordu - tüm bunlar doğalarının karmaşıklığını gösterir.
Metallerin altına dönüşmesi gerçekte, bunun olasılığına olan inanç birçok görünür gerçeğe dayanıyordu. İlk başta, simyagerlerin gözünde, örneğin bakır ve çinkodan, altın benzeri bir renkte alaşımların oluşumu onları zaten altına çeviriyordu. Onlara sadece rengi değiştirmek gerektiğine benziyordu ve metalin özellikleri de farklılaşacaktı. Özellikle, bu altının bir karışımını içeren maddeler bir baz metali altına çevirmek için alındığında, kötü kurulmuş deneyler bu inanca katkıda bulunmuştur. Örneğin, 18. yüzyılın sonunda bir Kopenhag eczacısı, kimyasal olarak saf gümüşün arsenikle kaynaştığında kısmen altına dönüştüğünü iddia etti. Bu gerçek ünlü bir kimyager tarafından doğrulandı. Guiton de Morvo ve çok gürültü yaptı. Kısa süre sonra deney için kullanılan arsenikte gümüş ve altın izleri olduğu gösterilmiştir.
O zamanlar bilinen yedi metalden beri, bazılarının kimyasal dönüşümlere uğraması daha kolaydı, diğerleri daha zor, simyacılar onları asil - mükemmel ve cahil - kusurlu olarak ayırdılar. İlki altın ve gümüşe, ikincisi bakır, kalay, kurşun, demir ve civaya aitti. İkincisi, asil metallerin özelliklerine sahiptir, ancak aynı zamanda sıvı halindeki ve uçuculuğundaki tüm metallerden keskin bir şekilde farklıdır, o zamanın son derece meşgul olan bilim adamları ve bazıları onu özel bir gruba ayırdı; ona gösterilen ilgi o kadar büyüktü ki, metallerin kendilerinden oluştuğu elementler arasında civa düşünmeye başladılar ve tam olarak onun içinde metalik özelliklerin bir taşıyıcısını gördüler. Bazı metallerin başkalarına geçişinin doğasında varlığını kabul eden, mükemmelliğe kusurlu olan simyacılar, sıradan koşullar altında bu dönüşümün yüzyıllar boyunca son derece yavaş olduğunu ve belki de o zamanlar böyle büyük bir rolle ödüllendirilen göksel cisimlerin gizemli katılımı olmadığını varsaydılar. ve insanın kaderinde. Tesadüfen, o zaman bilinen yedi gezegen ve bilinen gezegenler vardı ve bu da aralarında gizemli bir bağlantı olduğunu gösterdi. Simyacılar için metallere genellikle gezegen denir; altın denir Güneş gümüş - Ay bakır - Venüs , teneke - Jüpiter kurşun - Satürn demir - Mars ve cıva - Merkür . Çinko, bizmut, antimon ve arsenik keşfedildiğinde, her bakımdan metallere benzer, ancak metalin en karakteristik özelliklerinden birine sahip olan, dövülebilirlik zayıf gelişti, özel bir grupta seçildiler - yarımetaller. Metallerin metallere ve yarı metallere uygun olarak bölünmesi 18. yüzyılın ortalarında ortaya çıkmıştır.
Metal bileşiminin belirlenmesi başlangıçta tamamen spekülatifti. İlk başta, simyacılar bunların iki unsurdan oluştuğunu kabul ettiler - ve kükürt . Bu görüşün kökeni bilinmiyor, VIII.Yüzyılda zaten var. üzerinde Geberit metallerde cıva varlığının kanıtı, onları çözdüğü ve bu çözümlerde bireyselliklerinin ortadan kalktığı, cıva ile ortak bir şeyleri olmasaydı gerçekleşmeyecek olan cıva tarafından emilir. Ayrıca kurşun içeren cıva kalayla benzer bir şey verdi. Sülfüre gelince, belki görünüşte metallere benzeyen kükürt bileşiklerinin bilindiği için alınmıştır. Gelecekte, muhtemelen yapay olarak metal elde etmek için başarısız girişimler nedeniyle bu basit fikirler son derece karmaşık ve karışık hale geliyor. Simyacıların kavramlarında, örneğin X-XIII yüzyıllarda, metallerin oluştuğu cıva ve kükürt, simyacıların ellerinde bulunan cıva ve kükürt değildi. Özel özelliklere sahip olan sadece onlara benzer bir şeydi; sıradan kükürt ve civada gerçekten var olan bir şey, içlerinde diğer bedenlerden daha fazla ifade edildi. Metallerin bir parçası olan cıva altında, değişmezliklerini, metalik parlaklığını, sünekliğini, bir kelimeyle, metalik tip bir desteğin öngördüğü bir şeyi temsil ettiler; sülfür ile metallerin değişebilirliği, bozunabilirliği ve yanabilirliğinin taşıyıcısı kastedilmiştir. Bu iki element, farklı oranlarda metallerdeydi ve daha sonra söyledikleri gibi, çeşitli şekillerde sabitlendi; ayrıca, farklı saflık derecelerinde olabilirler. Örneğin Geber'e göre altın, en yüksek saflıkta ve en sabit derecede büyük miktarda cıva ve az miktarda sülfürden oluşuyordu; kalayda, aksine, temiz olmayan, zayıf sabitlenmiş ve benzeri olmayan çok fazla kükürt ve az cıva aldılar. Tüm bunlar, elbette, o zamanlar tek güçlü kimyasal maddeye farklı bir metal tutumu ifade etmek istediler - ateş. Bu görüşlerin daha da gelişmesiyle, iki öğe - cıva ve kükürt - simyacıların metallerin bileşimini açıklaması için yeterli görünmüyordu; onlara tuz ve biraz arsenik eklendi. Bununla, metallerin tüm dönüşümleri ile bir şeyin uçucu olmayan, sabit kaldığını göstermek istediler. Doğada “ana metallerin asil metallere dönüşümü yüzyıllar alırsa”, simyacılar bu mükemmeliyet sürecinin, olgunlaşmanın hızlı ve kolay olacağı koşullar yaratmaya çalıştılar. Kimyanın daha sonra tıp ve daha sonra biyoloji ile yakın bağlantısı nedeniyle, metalleri dönüştürme fikri doğal olarak örgütlü cisimlerin büyümesi ve gelişmesi fikri ile tanımlanmıştır: örneğin, kurşunun altına dönüşmesi, toprağa atılan tahıldan bir bitkinin oluşumu ve olduğu gibi, ayrışmış, fermantasyon, bir kişide hasta bir organın iyileşmesi - tüm bunlar ortak bir gizemli yaşam sürecinin, gelişmenin özel fenomenleriydi ve sadece teşviklerden kaynaklandı. Bundan, altın almayı mümkün kılan gizemli prensibin hastalıkları iyileştirmek, eski insan vücudunu genç bir prensibe dönüştürmek olduğunu söylemeye gerek yok. Harika bir filozofun taşı kavramı vardı.
Rolle ilgili filozofun taşı baz metallerin soyluya dönüştürülmesinde, altına dönüşmeleri ile ilgili tüm göstergeler vardır; gümüş elde etmek hakkında çok az şey söylenir. Bazı yazarlara göre, aynı filozofun taşı metalleri gümüş ve altına çevirir; diğerlerine göre, bu maddenin iki çeşidi vardır: biri mükemmel, diğeri daha az mükemmel ve bu son gümüş üretmeye hizmet eder. Dönüşüm için gerekli olan filozofun taş miktarı ile ilgili olarak, yönler de farklıdır. Birinde, 1 kısmı 10.000.000 metali altına, diğerlerinde 100 parçaya ve hatta 2 parçaya çevirebilir. Altın elde etmek için bir miktar baz metal eritildi veya civa alındı \u200b\u200bve orada bir filozofun taşı atıldı; bazıları dönüşümün anında gerçekleştiğinden emin olurken, diğerleri - yavaş yavaş. Metallerin doğası ve dönüşüm yetenekleri hakkındaki bu görüşler, tüm bunları keskin bir şekilde inkar etmeye başladıkları XVII.Yüzyıla kadar yüzyıllar boyunca tutunur, daha da ötesi, bu görüşler, safların altın elde etme umudunu kullanan birçok charlatans'ın ortaya çıkmasına neden oldu. Özellikle simyagerlerin fikirleriyle mücadele etti Boyle “Bilmek istiyorum,” diyor bir yerde, “altının cıva, kükürt ve tuza nasıl ayrıştırılabileceği; Bu deneyimin masraflarını ödemeye hazırım; benim için bunu asla başaramadım. ”
Yüzyıllar boyunca yapay olarak metal üretme girişimlerinden ve 17. yüzyılda biriken gerçeklerin sayısından sonra, örneğin, yanmadaki havanın rolü, oksidasyonda metalin ağırlığındaki artış, bu arada, Geber sekizinci yüzyılda, metalin temel bileşimi sorunu sona çok yakın görünüyordu; ancak kimyada sonucu bir phlogiston teorisi olan yeni bir akım ortaya çıktı ve bu sorunun çözümü hala uzun bir süre ertelendi.
O zamanın bilim adamları yanma olgusu ile çok ilgileniyorlardı. O zamanın felsefesinin temel fikrinden yola çıkarak, bedenlerin özelliklerindeki benzerliklerin aynı prensiplerden, onları oluşturan unsurlardan gelmesi gerektiğinden, yanıcı cisimlerin ortak bir unsur içerdiği varsayılmıştır. Yanma eylemi, ayrışma, elementlere bozunma eylemi olarak kabul edildi; yanıcılık unsuru alev şeklinde gözükürken, diğerleri kalmıştır. Simyacıların üç element, cıva, kükürt ve tuzdan metal oluşumu hakkındaki görüşünü kabul eden ve metaldeki gerçek varlıklarını kabul eden kükürtün yanıcı prensip olarak kabul edilmesi gerekiyordu. Daha sonra metalin diğer bileşeni, açıkçası, metalin kalsinasyonunun geri kalanını tanımak zorundaydı - o zaman dedikleri gibi “toprak”; bu nedenle civa ile ilgisi yoktur. Kükürt ise öte yandan sülfürik asit söylenenlerin birçoğu, sülfürden daha basit bir gövde olarak kabul edildi ve temel organların sayısına dahil edildi. Karışıklık ve çelişki vardı. Becher eski kavramları yenileriyle uzlaştırmak için dünyanın metalinde üç kalitenin varlığını kabul etti: aslında “toprak”, “yanıcı toprak” ve “cıva dünyası”. Bu koşullarda Stahl teorisini önerdi. Onun görüşüne göre, yanıcılığın başlangıcı kükürt veya bilinen başka bir madde değil, onun tarafından adlandırılan bilinmeyen bir şeydir. phlogiston . Metallerin sözde phlogiston ve topraktan oluştuğu; metalin havada kalsinasyonuna phlogiston salınımı eşlik eder; phlogiston açısından zengin bir madde olan kömür kullanarak topraklarından metallerin tersine alınması, phlogiston ile dünyayı birleştirme eylemidir. Birkaç metal olmasına rağmen ve bunların her biri, kalsine edildiğinde kendi toprağını verdi, ikincisi, bir unsur olarak, biriydi, bu yüzden metalin bu bileşeni, flogiston ile aynı varsayımsal nitelikteydi; ancak, Stahl'ın takipçileri bazen metaller kadar “elemental arazi” aldı. ne zaman işlenmiş tütün alınan asitlerde metalleri çözerken hidrojen ve özelliklerini inceledi (yanmayı sürdürememe, hava ile karışımdaki patlayıcılığı, vb.), içindeki Stahl phlogistonunu tanıdı; metaller, kavramlarına göre, hidrojen ve "toprak" tan oluşur. Bu görüş phlogiston teorisinin birçok takipçisi tarafından kabul edilmiştir.
Phlogiston teorisinin görünür uyumuna rağmen, onunla bağlantılı olamayacak önemli gerçekler vardı. Heber ayrıca metallerin yandığında ağırlıklarının arttığını biliyordu; bu arada, Stahl'a göre, phlogiston'u kaybetmelidirler: phlogiston “toprağa” yeniden bağlandığında, elde edilen metalin ağırlığı “toprağın” ağırlığından daha azdır. Böylece, phlogiston'un bazı özel özelliklere sahip olması gerektiği ortaya çıktı - negatif yerçekimi. Bu fenomeni açıklamak için ifade edilen tüm esprili hipotezlere rağmen, anlaşılmaz ve şaşırtıcıydı.
ne zaman Lavoisier yanma sırasında havanın rolünü keşfetti ve yanma sırasında metallerin ağırlığındaki kârın havadan metallere oksijen eklenmesinden geldiğini ve böylece metallerin yanma hareketinin elementlere ayrışma olmadığını, aksine, katılma eyleminin metallerin karmaşıklığı sorununu ortaya çıkardığını gösterdi. olumsuz çözüldü. Lavoisier'in ana fikrinden dolayı basit cisimlerin, basit cisimlerin diğer cisimleri izole etmenin imkansız olduğu fikirleri olduğu için metalleri atandı. Yaratılış ile kimyasal elementlerin periyodik sistemi Mendeleyev metal elemanlar haklı yerlerini aldılar.
Ayrıca bakınız
notlar
referanslar
- S.P. Vukolov: // Brockhaus ve Efron Ansiklopedik Sözlük : 86 ciltte (82 cilt ve 4 ek). - SPb. , 1890-1907. (tarihi bölüm)
| Periyodik tablo | |
|---|---|
| Dmitry Ivanovich Mendeleev · Periyodik yasa · Öğe grupları | |
| formatları | kısa · Bloklarla · genişletilmiş · Büyütülmüş · Elektronik konfigürasyonlar · elektronegatiflik · alternatif · Elementlerin izotopları |
| Öğe listeleri üzerinde | isim ·
etimoloji (yerlerin onuruna, keşifçilerin onuruna) · Açılış zamanı Yükseltgenme durumu · prevalansı (erkekte) · İzotopların stabilitesi · |


