21.07.2019
Alkalilerin asitlerle etkileşimi. Sodyum hidroksit
sodyum "Alkenil", alkali metalleri belirtir ve ilk PSE grubunun ana alt grubunda dağıtılır. DI Mendeleyev. Atomunun çekirdekten nispeten büyük bir mesafede dış enerji seviyesinde, atomların alkali metaller tek başına yüklü katyonlara dönüşerek oldukça kolay bir şekilde verirler; bu alkali metallerin çok yüksek kimyasal aktivitesini açıklar.
Alkalin üretmek için yaygın bir yöntem, erimiş tuzlarının (genellikle klorürler) elektrolizidir.
Sodyum, bir alkali metal olarak, düşük sertlik, düşük yoğunluk ve düşük erime noktaları ile karakterizedir.
Oksijen ile etkileşime giren sodyum esas olarak sodyum peroksit oluşturur
2 Na + O2 Na2O2
Peroksitlerin ve süperperoksitlerin fazla alkali metal ile indirgenmesi oksit üretebilir:
Na2O2 + 2 Na 2 Na2O
Sodyum oksitler su ile etkileşerek hidroksit oluşturur: Na2O + H20 → 2 NaOH.
Peroksitler, alkali oluşumu ile tamamen su ile hidrolize edilir: Na2O2 + 2 HOH → 2 NaOH + H2O2
Tüm alkali metaller gibi, sodyum güçlü bir indirgeyici maddedir ve birçok metal olmayan metalle (azot, iyot, karbon ve asal gazlar hariç) enerjik olarak etkileşime girer:
Bir kızdırma deşarjında \u200b\u200bazot ile son derece kötü reaksiyona girerek çok kararsız bir madde oluşturur - sodyum nitrür
Normal bir metal gibi seyreltik asitlerle etkileşir:
Konsantre oksitleyici asitlerle indirgeme ürünleri açığa çıkar:
Sodyum hidroksit NaOH (kostik alkali) güçlü bir kimyasal bazdır. Endüstride, sodyum hidroksit kimyasal ve elektrokimyasal yöntemlerle elde edilir.
Kimyasal üretim yöntemleri:
Kireç, yaklaşık 80 ° C'lik bir sıcaklıkta bir soda çözeltisinin kireç sütü ile etkileşimini içerir. Bu sürece kostikleşme denir; Reaksiyondan geçer:
Na2C03 + Ca (OH) 2 → 2NaOH + CaCO3
İki aşama içeren ferritik:
Na2C03 + Fe203 → 2NaFeО 2 + CO 2
2NaFeО 2 + xH 2 О \u003d 2NaOH + Fe203 * xH 2 О
Elektrokimyasal olarak sodyum hidroksit, halit çözeltilerinin (esas olarak sodyum klorür NaCl'den oluşan bir mineral) aynı anda hidrojen ve klor üretimi ile elektrolizi ile elde edilir. Bu işlem toplam formülle temsil edilebilir:
2NaCl + 2H20 ± 2- → H2 + Cl2 + 2NaOH
Sodyum hidroksit reaksiyonları:
1) nötralizasyon:
NaOH + HC1 → NaCl + H20
2) Çözelti içindeki tuzlarla değişim:
2NaOH + CuS04 → Cu (OH) 2↓ + Na2S04
3) Metal olmayanlarla reaksiyona girer
3S + 6NaOH → 2Na 2 S + Na 2S03 + 3H20
4) Metallerle Reaksiyonu
2Al + 2NaOH + 6H20 → 3H 2 + 2Na
Sodyum hidroksit çeşitli endüstrilerde, örneğin hamur pişirirken, sabun üretiminde yağların sabunlaştırılması için yaygın olarak kullanılır; dizel yakıt üretiminde kimyasal reaksiyonlar için katalizör olarak kullanılır.
Sodyum karbonatya Na2C03 (soda külü) formunda ya da Na2C03 * 10H20 O kristalin hidrat (kristal soda) formunda veya NaHC03 bikarbonat (içme sodası) formunda üretilir.
Soda çoğunlukla reaksiyona dayanarak amonyak-klorür yöntemiyle üretilir:
NaCl + NH4HC03, NaHC03 + NH4Cl
Birçok endüstri sodyum karbonat tüketir: kimyasal, sabun, kağıt hamuru ve kağıt, tekstil, gıda vb.
Fiziksel özellikler
Sodyum hidroksit
Çözeltilerin termodinamiği
Δ H 0 -44.45 kJ / mol'lük sonsuz seyreltilmiş sulu bir çözelti için çözündürme.
Monohidrat (eşkenar dörtgen), 12.3 - 61.8 ° C'de, erime noktası 65.1 ° C'de sulu çözeltilerden kristalleşir; yoğunluk 1.829 g / cm³; 0H 0 arr 34734.96 kJ / mol), -28 ila -24 ° С - heptahidrat, -24 ila -17.7 ° С - pentahidrat, -17.7 ila -5.4 ° С - tetrahidrat ( α-modifikasyonu), -5.4 ila 12.3 ° C Metanol içindeki çözünürlük 23.6 g / l (t \u003d 28 ° C), etanol 14.7 g / l'dir (t \u003d 28 ° C). NaOH · 3.5H20 (erime noktası 15.5 ° C);
Kimyasal özellikleri
(genel olarak, böyle bir reaksiyon basit bir iyonik denklem ile temsil edilebilir, reaksiyon ısının salınmasıyla devam eder (ekzotermik reaksiyon): OH - + H30 + → 2H20.)
- hem bazik hem de asidik özelliklere sahip amfoterik oksitlerle ve katı alaşımlarda olduğu gibi alkalilerle reaksiyona girme kabiliyeti ile:
ZnO + 2NaOH → Na 2 ZnO 2 + H20
böylece çözümler ile:
ZnO + 2NaOH (çözelti) + H20 → Na2 (çözelti)+ H 2
(Ortaya çıkan anyon tetrahidroksozinkat iyonu olarak adlandırılır ve çözeltiden izole edilebilen tuz sodyum tetrahidroksozinkat olarak adlandırılır. Sodyum hidroksit diğer amfoterik oksitlerle benzer reaksiyonlara girer.)
- asit oksitlerle - tuzların oluşumu ile; bu özellik asit gazlarından kaynaklanan endüstriyel emisyonları temizlemek için kullanılır (örneğin: CO 2, SO 2 ve H2S):
2Na + + 2OH - + Cu 2+ + SO 4 2- → Cu (OH) 2 ↓ + Na 2 SO 4
Sodyum hidroksit, metal hidroksitleri çökeltmek için kullanılır. Örneğin, jel benzeri bir alüminyum hidroksit, sulu bir çözelti içinde alüminyum sülfat üzerinde sodyum hidroksit ile hareket ettirilerek üretilir. Özellikle ince süspansiyonlardan suyu arıtmak için kullanılır.
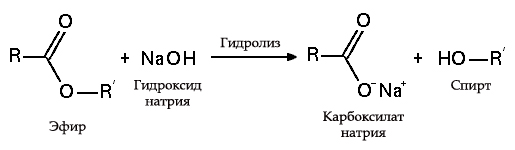
Esterlerin hidrolizi
- yağlarla (sabunlaşma), böyle bir reaksiyon geri dönüşümsüzdür, çünkü alkali ile elde edilen asit sabun ve gliserin oluşturur. Daha sonra gliserin, vakumla buharlaştırma ve elde edilen ürünlerin ilave damıtma saflaştırması yoluyla sabun pedlerinden çıkarılır. Bu sabun elde etme yöntemi 7. yüzyıldan beri Ortadoğu'da bilinmektedir:
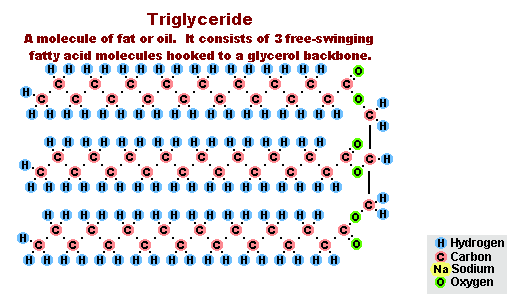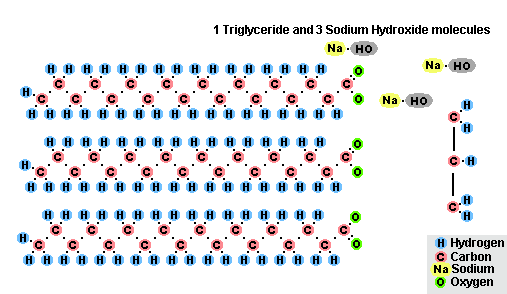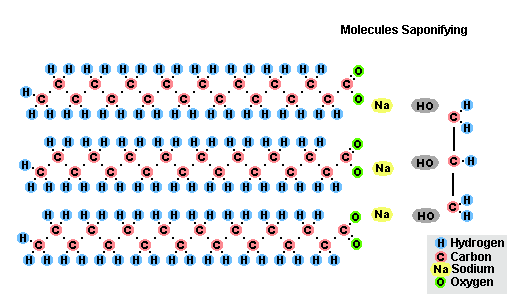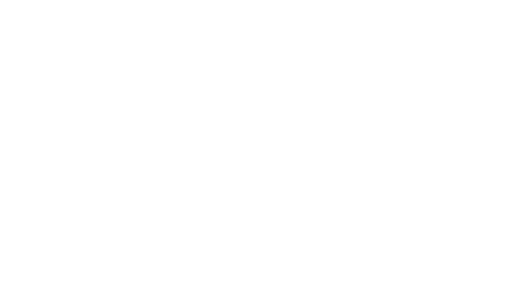
Yağ Sabunlaşma Süreci
Yağların sodyum hidroksit ile etkileşiminin bir sonucu olarak, katı sabunlar elde edilir (çubuk sabun üretmek için kullanılırlar) ve potasyum hidroksit ile, yağın bileşimine bağlı olarak katı veya sıvı sabunlardır.
HO-CH2-CH20H + 2NaOH → NaO-CH2-CH2 -ONa + 2H20
2NaCl + 2H20 \u003d H2 + Cl2 + 2NaOH,Günümüzde, kostik alkali ve klor, üç elektrokimyasal yöntemle üretilmektedir. Bunlardan ikisi katı bir asbest veya polimer katot ile elektrolizdir (diyafram ve membran üretim yöntemleri), üçüncüsü sıvı katot ile elektrolizdir (cıva üretim yöntemi). Elektrokimyasal üretim yöntemleri arasında, en kolay ve en uygun yol bir cıva katodu ile elektrolizdir, ancak bu yöntem buharlaşma ve metalik cıva sızıntısı sonucu çevreye önemli zarar verir. Membran üretim yöntemi en etkili, en az enerji yoğun ve en çevre dostu, aynı zamanda en kaprisli, özellikle daha yüksek saflıkta hammadde gerektirir.
Sıvı bir cıva katodu ile elektroliz ile elde edilen kostik alkali, diyafram yöntemi ile elde edilene göre çok daha temizdir. Bazı endüstriler için bu önemlidir. Bu nedenle, suni liflerin üretiminde, sadece sıvı bir cıva katodu ile elektroliz ile elde edilen kostik kullanılabilir. Dünya pratiğinde, membran elektrolizi oranında bir artışa doğru açık bir eğilim ile, klor ve kostik üretmek için her üç yöntem de kullanılır. Rusya'da, üretilen toplam kostik maddenin yaklaşık% 35'i bir cıva katodu ile elektroliz ve% 65'i katı bir katot ile elektroliz (diyafram ve membran yöntemleri) ile üretilmektedir.
Üretim sürecinin etkinliği sadece kostik soda verimi ile değil, aynı zamanda elektroliz ile elde edilen klor ve hidrojen verimi ile hesaplanır, çıkıştaki klor ve sodyum hidroksit oranı 100 / 110'dur, reaksiyon aşağıdaki oranlarda ilerler:
1.8 NaCl + 0.5 H20 + 2.8 MJ \u003d 1.00 Cl 2 + 1.10 NaOH + 0.03 H2,Çeşitli üretim yöntemlerinin ana göstergeleri tabloda verilmiştir:
| 1 ton NaOH göstergesi | Civa yöntemi | F-stop yöntemi | Membran yöntemi |
|---|---|---|---|
| Klor verimi% | 97 | 96 | 98,5 |
| Elektrik (kWh) | 3 150 | 3 260 | 2 520 |
| NaOH konsantrasyonu | 50 | 12 | 35 |
| Klor saflığı | 99,2 | 98 | 99,3 |
| Hidrojen saflığı | 99,9 | 99,9 | 99,9 |
| Klorda O2'nin kütle oranı,% | 0,1 | 1-2 | 0,3 |
| Cl - NaOH içinde kütle payı,% | 0,003 | 1-1,2 | 0,005 |
Katı katot işlem akış diyagramı
F-stop yöntemi - Katı katot elektrolizörünün boşluğu, gözenekli bir septum - diyafram - katot ve anot boşluğuna bölünür ve burada elektrolizörün katot ve anotu bulunur. Bu nedenle, böyle bir elektrolizöre genellikle diyafram denir ve üretim yöntemine diyafram elektrolizi denir. Doymuş bir anolit akışı sürekli olarak diyafram elektrolizörünün anot boşluğuna girer. Elektrokimyasal işlemin bir sonucu olarak, halitin ayrışması nedeniyle klor anotta, suyun ayrışması nedeniyle katotta hidrojen açığa çıkar. Klor ve hidrojen, karıştırılmadan hücreden ayrı olarak çıkarılır:
2Cl - - 2 e \u003d Cl20, H20 - 2 e - 1/2 O 2 \u003d H2.
Bu durumda, katot bölgesi sodyum hidroksit ile zenginleştirilir. Elektrolitik alkali adı verilen, birleştirilmemiş anolit ve sodyum hidroksit içeren katot bölgesinden gelen çözelti, elektrolizörden sürekli olarak çıkarılır. Bir sonraki aşamada, elektrolitik alkali buharlaştırılır ve içindeki NaOH içeriği standarda göre% 42-50'ye ayarlanır. Halit ve sodyum sülfat artan sodyum hidroksit konsantrasyonu ile çökelir. Bir kostik alkali çözeltisi çökeltiden boşaltılır ve katı bir ürün elde etmek için bitmiş bir ürün olarak depoya veya buharlaştırma aşamasına aktarılır, ardından eritme, ölçeklendirme veya granülasyon yapılır. Kristal halit (ters tuz) elektrolize geri döndürülür ve ters tuzlu su denir. Ters salamura hazırlanmadan önce çözeltilerde sülfat birikmesini önlemek için sülfat çıkarılır. Anolit kaybı, tuz katmanlarının yeraltı liçi ile veya katı halitin çözülmesi ile elde edilen taze tuzlu su ilavesiyle telafi edilir. Taze tuzlu su, ters tuzlu su ile karıştırılmadan önce mekanik süspansiyonlardan ve önemli bir kısmı kalsiyum ve magnezyum iyonlarından temizlenir. Elde edilen klor su buharından ayrılır, sıkıştırılır ve klor içeren ürünlerin üretimine veya sıvılaştırma için beslenir.
Membran yöntemi - diyaframa benzer, ancak anodik ve katodik boşluklar bir katyon değişim membranı ile ayrılır. Membran elektrolizi en temiz kostikleri sağlar.
Teknolojik şema elektroliz.Ana teknolojik aşama elektrolizdir, ana cihaz, iletişim ile birbirine bağlı bir elektrolizör, bir dekomoser ve bir cıva pompasından oluşan bir elektrolitik banyodur. Bir elektrolitik banyoda, cıva, bir elektrolizör ve bir dekomoserden geçen bir cıva pompasının etkisi altında dolaşır. Elektrolizörün katodu bir cıva akımıdır. Anotlar - grafit veya düşük aşınma. Civa ile birlikte, bir anolit akışı - bir halit çözeltisi - sürekli olarak elektrolizörden akar. Halitin elektrokimyasal bozunmasının bir sonucu olarak, anot üzerinde Cl-iyonları oluşur ve klor salınır:
2 Cl - - 2 e \u003d Cl20,
elektrolizörden boşaltılır ve cıva katotunda cıva içinde zayıf bir sodyum çözeltisi oluşur, amalgam:
Na + + e \u003d Na 0 nNa + + nHg - \u003d Na + HgAmalgam sürekli olarak hücreden ayrıştırıcıya akar. Safsızlıklardan iyi temizlenmiş su, dekomosere sürekli olarak su verilir. İçinde, kendiliğinden bir elektrokimyasal işlemin sonucu olarak sodyum amalgam, bir kostik ve hidrojen çözeltisi olan cıva oluşumu ile su ile neredeyse tamamen ayrıştırılır:
Na + Hg + H20 \u003d NaOH + 1/2H2 + HgTicari bir ürün olan bu şekilde elde edilen kostik çözelti, viskoz üretiminde zararlı halit katışkıları içermez. Civa neredeyse tamamen sodyum amalgamdan arındırılır ve hücreye geri döner. Hidrojen tedavi için boşaltılır. Elektrolizörden çıkan anolit taze halit ile doyurulur, bununla birlikte gelen safsızlıklar ondan çıkarılır, ayrıca anotlardan ve yapısal malzemelerden yıkanır ve elektrolize geri döner. Doygunluktan önce içinde çözünmüş klor, iki veya üç aşamalı bir işlemle anolitten çıkarılır.
Laboratuar elde etme yöntemleri
Laboratuvarda sodyum hidroksit, pratikten daha tarihsel kimyasal yöntemlerle elde edilir.
Kalkerli yöntem Sodyum hidroksit elde etmek, bir soda çözeltisinin yaklaşık 80 ° C'lik bir sıcaklıkta kireç sütü ile etkileşmesidir. Bu sürece kostikleşme denir; Reaksiyon ile tanımlanır:
Na2C03 + Ca (OH) 2 \u003d 2NaOH + CaC03Reaksiyonun bir sonucu olarak, bir sodyum hidroksit çözeltisi ve bir kalsiyum karbonat çökeltisi oluşur. Kalsiyum karbonat, yaklaşık% 92 NaOH içeren erimiş bir ürün elde etmek üzere buharlaştırılan çözeltiden ayrılır. Erimiş NaOH, demir tamburlara dökülür ve katılaşır.
Ferritik yöntem iki reaksiyonla tanımlanmıştır:
Na 2 C0 3 + Fe 2 0 3 \u003d Na 2 0 Fe 2 0 3 + C0 2 (1) Na 2 0 Fe 2 0 3 -fH20 \u003d 2 NaOH + Fe203 (2)(1) - 1100-1200 ° C sıcaklıkta soda külü demir oksit ile sinterleme işlemi. Bu durumda sodyum spec ferrit oluşur ve karbondioksit açığa çıkar. Daha sonra kek, reaksiyona (2) göre su ile işlenir (süzülür); bir sodyum hidroksit çözeltisi ve bir Fe203 çökeltisi elde edilir, bu çözeltiden ayrıldıktan sonra işleme geri döner. Çözelti yaklaşık 400 g / l NaOH içerir. Yaklaşık% 92 NaOH içeren bir ürün elde etmek için buharlaştırılır.
Sodyum hidroksit üretmek için kimyasal yöntemlerin önemli dezavantajları vardır: büyük miktarda yakıt tüketilir, üretilen kostik soda safsızlıklar ile kirlenir ve cihazın bakımı zaman alıcıdır. Şu anda, bu yöntemler neredeyse tamamen elektrokimyasal üretim yöntemiyle değiştirilmektedir.
Kostik Soda Pazarı
Dünya kostik soda üretimi, 2005| üretici | Üretim hacmi, milyon ton | Dünya üretimindeki payı |
|---|---|---|
| DOW | 6.363 | 11.1 |
| Occidental Kimya Şirketi | 2.552 | 4.4 |
| Formosa Plastikleri | 2.016 | 3.5 |
| PPG | 1.684 | 2.9 |
| Bayer | 1.507 | 2.6 |
| Akzo nobel | 1.157 | 2.0 |
| Tosoh | 1.110 | 1.9 |
| Arkema | 1.049 | 1.8 |
| Olin | 0.970 | 1.7 |
| Rusya | 1.290 | 2.24 |
| Çin | 9.138 | 15.88 |
| diğer | 27.559 | 47,87 |
| Toplam: | 57,541 | 100 |
TP - katı cıva (lapa lapa);
TD - katı diyafram (kaynaşmış);
PP - cıva çözeltisi;
PX - kimyasal çözelti;
RD - diyafram çözümü.
| Göstergenin adı | TR OKP 21 3211 0400 | TD OKP 21 3212 0200 | RR OKP 21 3211 0100 | PX 1 sınıf OKP 21 3221 0530 | PX 2 sınıfı OKP 21 3221 0540 | RD Üst sınıf OKP 21 3212 0320 | RD Birinci sınıf OKP 21 3212 0330 |
|---|---|---|---|---|---|---|---|
| görünüm | Pullu beyaz kütle. Hafif renklenmeye izin verilir | Kaynaşmış kütle beyazdır. Hafif renklenmeye izin verilir | Renksiz berrak sıvı | Renksiz veya renkli sıvı. Kristalize çökeltiye izin verilir | Renksiz veya renkli sıvı. Kristalize çökeltiye izin verilir | Renksiz veya renkli sıvı. Kristalize çökeltiye izin verilir | |
| Sodyum hidroksitin kütle payı,%, daha az değil | 98,5 | 94,0 | 42,0 | 45,5 | 43,0 | 46,0 | 44,0 |
| İşletmenin adı | 2005 bin ton | 2006 bin ton | % 2005 payı | 2006'daki payı |
|---|---|---|---|---|
| OJSC Kostik Sterlitamak | 239 | 249 | 20 | 20 |
| OJSC "Kostik", Volgograd | 210 | 216 | 18 | 18 |
| Sayanskkhimplast OJSC | 129 | 111 | 11 | 9 |
| LLC Usoliekhimprom | 84 | 99 | 7 | 8 |
| Sibur-Neftekhim OJSC | 87 | 92 | 7 | 8 |
| OJSC "Khimprom", Cheboksary | 82 | 92 | 7 | 8 |
| VOAO Khimprom, Volgograd | 87 | 90 | 7 | 7 |
| CJSC Ilimkhimprom | 70 | 84 | 6 | 7 |
| KCHKhK OJSC | 81 | 79 | 7 | 6 |
| NAC "AZOT" | 73 | 61 | 6 | 5 |
| Khimprom OJSC, Kemerovo | 42 | 44 | 4 | 4 |
| Toplam: | 1184 | 1217 | 100 | 100 |
| İşletmenin adı | 2005 ton | 2006 ton | % 2005 payı | 2006'daki payı |
|---|---|---|---|---|
| OJSC "Kostik", Volgograd | 67504 | 63510 | 62 | 60 |
| OJSC Kostik Sterlitamak | 34105 | 34761 | 31 | 33 |
| Sibur-Neftekhim OJSC | 1279 | 833 | 1 | 1 |
| VOAO Khimprom, Volgograd | 5768 | 7115 | 5 | 7 |
| Toplam: | 108565 | 106219 | 100 | 100 |
uygulama
biyodizel

Cod Lutefisk Norveç Anayasa günü kutlamaları

Alman simit
Kostik soda Çok çeşitli endüstrilerde ve ev ihtiyaçları için kullanılır:
- Kostik, kağıt hamuru ve kağıt endüstrisi kağıt, karton, suni elyaf, sunta üretiminde selülozun delignifikasyonu (Kraft Reaksiyon) için,
- Yağların sabunlaştırılması için sabun, şampuan ve diğer deterjanların üretimi. Antik çağda, yıkama sırasında suya kül ilave edildi ve görünüşe göre, ev hanımları, kül pişirme sırasında ocağa giren yağ içeriyorsa, bulaşıkların iyi yıkandığını fark ettiler. Sabun yapıcı (saponarius) mesleği ilk olarak MS 385 civarında belirtilmiştir. e. Theodore Priscianus. Araplar 7. yüzyıldan beri yağlardan ve sodadan sabun yapıyorlar; bugün, sabunlar 10 yüzyıl önce olduğu gibi üretiliyor.
- kimya endüstrileri - asitleri ve asit oksitleri, reaktif veya vinil veya lastikli giysiler olarak nötralize etmek.
Havadaki sodyum hidroksitin MAC 0.5 mg / m³.
edebiyat
- Genel kimyasal teknoloji. Ed. I.M. Mukhlenova. Üniversitelerin kimyasal ve teknolojik uzmanlıkları için ders kitabı. - M: Yüksek okul.
- Genel Kimyanın Temelleri, cilt 3, B.N. Nekrasov. - M .: Kimya, 1970.
- Genel kimyasal teknoloji. Furmer I.E., Zaitsev V.N. - M .: Yüksek Okul, 1978.
- Rusya Federasyonu Sağlık Bakanlığı'nın 28 Mart 2003 tarihli Kararı N 126 “Etkisinin önleyici amaçlar için süt veya diğer eşdeğer gıda ürünlerinin kullanılması tavsiye edilen zararlı üretim faktörleri listesinin onaylanması üzerine”.
- Rusya Federasyonu 4 Nisan 2003 Baş Devlet Sıhhi Doktoru Kararı N 32 “Demiryolu Taşımacılığı Organizasyonu için Sıhhi Kuralların Yasası Hakkında. SP 2.5.1250-03 ".
- 21 Temmuz 1997 tarihli Federal Yasa N 116-ФЗ “Tehlikeli Üretim Tesislerinin Endüstriyel Güvenliği Hakkında” (18 Aralık 2006'da değiştirildiği şekliyle).
- Rusya Federasyonu Doğal Kaynaklar Bakanlığı'nın 2 Aralık 2002 tarihli Kararı N 786 “Atıkların federal sınıflandırma kataloğunun onaylanması hakkında” (30 Temmuz 2003 tarihinde tadil edilmiş ve eklenmiştir).
- SSCB Devlet Çalışma Komitesi 10.25.1974 N 298 / P-22 Kararı “Zararlı çalışma koşullarına sahip sanayi, mağaza, meslek ve pozisyonlar listesinin onaylanması üzerine, ek izin hakkı ve kısaltılmış çalışma saatleri veren çalışma” (29 Mayıs 1991'de değiştirildiği şekliyle) ).
- 22 Temmuz 1999 Rusya Çalışma Bakanlığı Kararı N 26 “Kimya endüstrisindeki işçiler için özel giysi, özel ayakkabı ve diğer kişisel koruyucu ekipmanların serbest bırakılması için standart endüstri standartlarının onaylanması hakkında”.
- 05.30.2003 N 116 Rusya Federasyonu Baş Devlet Sıhhi Doktoru Kararı GN 2.1.6.1339-03'ün yürürlüğe girmesi hakkında “Nüfuslu alanların atmosferik havasındaki kirleticilerin Tahmini Güvenli Maruz Kalma Düzeyleri (SEC).” (3 Kasım 2005'te değiştirildiği gibi). Resimli Ansiklopedik Sözlük
SODYUM HİDROKSİT - (kostik soda, kostik soda, kostik) NaOH renksiz katı kristal madde, yoğunluk 2130 kg m. t \u003d 320 ° C; suda çözündüğünde, büyük miktarda ısı açığa çıkar; cilt, doku, kağıt, tehlikeli üzerinde yıkıcı etkisi ... ... Büyük Politeknik Ansiklopedi
- (kostik soda, kostik soda), NaOH, güçlü baz (alkali). Renksiz kristaller (teknik ürün beyaz opak kütle). Higroskopik, suda çözünür, büyük miktarda ısı açığa çıkarır. Bir çözeltinin elektrolizi ile alın ... Ansiklopedik Sözlük
sodyum hidroksit - natrio hidroksidas durumu T sritis chemija formulė NaOH atitikmenys: angl. kostik soda; sodyum hidroksit rus. kostik; kostik soda; sodyum hidroksit; sodyum hidroksit ryšiai: sinonimas - natrio šarmas sinonimas - kaustinė soda ... Chemijos terminų aiškinamasis žodynas
- (kostik soda, kostik soda), NaOH, güçlü baz (alkali). Bestsv. kristaller (teknoloji ürünü beyaz opak kütle). Higroskopik, suda çözünür, büyük miktarda ısı açığa çıkarır. Bir sodyum klorür çözeltisinin elektrolizi ile alın ... Doğal Tarih. Ansiklopedik Sözlük
- (kostik soda) NaOH, renksiz. kristaller; 299 ° C'ye kadar eşkenar dörtgen stabildir. modifikasyon (a \u003d 0.33994 nm, c \u003d 1.1377 nm), 299 o С monoklinikten daha yüksek; DH0 polimorfik geçiş 5.85 kJ / mol; t. 323 ° C, t. 1403 ° C; Sıkı. 2,02 g / cm3; ... Kimyasal ansiklopedi
Kostik soda, kostik, NaOH renksiz kristalin. kitle, sıkıca. 2130 kg / m3, t Pl 320 ° С, suda çözünürlük% 52.2 (20 ° C'de). Güçlü baz, hayvan dokusuna zarar verir; N.'nin damlalarını göze almak özellikle tehlikelidir ... ... Büyük Ansiklopedik Politeknik Sözlük
Güçlü alkali, yaygın olarak temizlik maddesi olarak kullanılır. Sodyum hidroksit cildin yüzeyine girdiğinde, ciddi bir kimyasal yanığa neden olur; Bu durumda, etkilenen bölgeyi derhal büyük miktarda cilt ile yıkayın ... ... Tıbbi terimler
SODYUM HİDROKSİT, KOSTİK SODA - (kostik soda) güçlü alkali, yaygın olarak temizlik maddesi olarak kullanılır. Sodyum hidroksit cildin yüzeyine girdiğinde, ciddi bir kimyasal yanığa neden olur; Bu durumda, cildin etkilenen bölgesini hemen yıkayın ... ... Açıklayıcı Tıp Sözlüğü
Hem sodyum hidroksit hem de diğer alkaliler, “kostik alkali” adı, cildi, kağıdı, camı aşındırma ve ciddi yanıklara neden olma yeteneğinden kaynaklanmaktadır. 17. yüzyıla kadar alkali (Fr. alkali) ayrıca sodyum ve potasyum karbonatlar olarak adlandırıldı. Fransızcada, bilim adamı A.L. Duhamel du Monceau ilk önce bu maddeler arasında ayrım yaptı: sodyum hidroksit kostik soda, sodyum karbonat - soda külü (mayınlı Salsola Soda bitkisinden) ve potasyum karbonat - potas olarak adlandırıldı. Şu anda, soda karbonik asidin sodyum tuzları olarak adlandırılmaktadır. İngilizce ve Fransızca'da sodyum kelimesi sodyum, potasyum - potasyum anlamına gelir.
Fiziksel özellikler
Sodyum hidroksit
Çözeltilerin termodinamiği
Δ H 0 -44.45 kJ / mol'lük sonsuz seyreltilmiş sulu bir çözelti için çözündürme.
Monohidrat (eşkenar dörtgen), 12.3 - 61.8 ° C'de, erime noktası 65.1 ° C'de sulu çözeltilerden kristalleşir; yoğunluk 1.829 g / cm³; 0H 0 arr 34734.96 kJ / mol), -28 ila -24 ° С - heptahidrat, -24 ila -17.7 ° С - pentahidrat, -17.7 ila -5.4 ° С - tetrahidrat ( α-modifikasyonu), -5.4 ila 12.3 ° C Metanol içindeki çözünürlük 23.6 g / l (t \u003d 28 ° C), etanol 14.7 g / l'dir (t \u003d 28 ° C). NaOH · 3.5H20 (erime noktası 15.5 ° C);
Kimyasal özellikleri
(genel olarak, böyle bir reaksiyon basit bir iyonik denklem ile temsil edilebilir, reaksiyon ısının salınmasıyla devam eder (ekzotermik reaksiyon): OH - + H30 + → 2H20.)
- hem bazik hem de asidik özelliklere sahip amfoterik oksitlerle ve katı alaşımlarda olduğu gibi alkalilerle reaksiyona girme kabiliyeti ile:
ZnO + 2NaOH → Na 2 ZnO 2 + H20
böylece çözümler ile:
ZnO + 2NaOH (çözelti) + H20 → Na2 (çözelti)+ H 2
(Ortaya çıkan anyon tetrahidroksozinkat iyonu olarak adlandırılır ve çözeltiden izole edilebilen tuz sodyum tetrahidroksozinkat olarak adlandırılır. Sodyum hidroksit diğer amfoterik oksitlerle benzer reaksiyonlara girer.)
- asit oksitlerle - tuzların oluşumu ile; bu özellik asit gazlarından kaynaklanan endüstriyel emisyonları temizlemek için kullanılır (örneğin: CO 2, SO 2 ve H2S):
2Na + + 2OH - + Cu 2+ + SO 4 2- → Cu (OH) 2 ↓ + Na 2 SO 4
Sodyum hidroksit, metal hidroksitleri çökeltmek için kullanılır. Örneğin, jel benzeri bir alüminyum hidroksit, sulu bir çözelti içinde alüminyum sülfat üzerinde sodyum hidroksit ile hareket ettirilerek üretilir. Özellikle ince süspansiyonlardan suyu arıtmak için kullanılır.

Esterlerin hidrolizi
- yağlarla (sabunlaşma), böyle bir reaksiyon geri dönüşümsüzdür, çünkü alkali ile elde edilen asit sabun ve gliserin oluşturur. Daha sonra gliserin, vakumla buharlaştırma ve elde edilen ürünlerin ilave damıtma saflaştırması yoluyla sabun pedlerinden çıkarılır. Bu sabun elde etme yöntemi 7. yüzyıldan beri Ortadoğu'da bilinmektedir:

Yağ Sabunlaşma Süreci
Yağların sodyum hidroksit ile etkileşiminin bir sonucu olarak, katı sabunlar elde edilir (çubuk sabun üretmek için kullanılırlar) ve potasyum hidroksit ile, yağın bileşimine bağlı olarak katı veya sıvı sabunlardır.
HO-CH2-CH20H + 2NaOH → NaO-CH2-CH2 -ONa + 2H20
2NaCl + 2H20 \u003d H2 + Cl2 + 2NaOH,Günümüzde, kostik alkali ve klor, üç elektrokimyasal yöntemle üretilmektedir. Bunlardan ikisi katı bir asbest veya polimer katot ile elektrolizdir (diyafram ve membran üretim yöntemleri), üçüncüsü sıvı katot ile elektrolizdir (cıva üretim yöntemi). Elektrokimyasal üretim yöntemleri arasında, en kolay ve en uygun yol bir cıva katodu ile elektrolizdir, ancak bu yöntem buharlaşma ve metalik cıva sızıntısı sonucu çevreye önemli zarar verir. Membran üretim yöntemi en etkili, en az enerji yoğun ve en çevre dostu, aynı zamanda en kaprisli, özellikle daha yüksek saflıkta hammadde gerektirir.
Sıvı bir cıva katodu ile elektroliz ile elde edilen kostik alkali, diyafram yöntemi ile elde edilene göre çok daha temizdir. Bazı endüstriler için bu önemlidir. Bu nedenle, suni liflerin üretiminde, sadece sıvı bir cıva katodu ile elektroliz ile elde edilen kostik kullanılabilir. Dünya pratiğinde, membran elektrolizi oranında bir artışa doğru açık bir eğilim ile, klor ve kostik üretmek için her üç yöntem de kullanılır. Rusya'da, üretilen toplam kostik maddenin yaklaşık% 35'i bir cıva katodu ile elektroliz ve% 65'i katı bir katot ile elektroliz (diyafram ve membran yöntemleri) ile üretilmektedir.
Üretim sürecinin etkinliği sadece kostik soda verimi ile değil, aynı zamanda elektroliz ile elde edilen klor ve hidrojen verimi ile hesaplanır, çıkıştaki klor ve sodyum hidroksit oranı 100 / 110'dur, reaksiyon aşağıdaki oranlarda ilerler:
1.8 NaCl + 0.5 H20 + 2.8 MJ \u003d 1.00 Cl 2 + 1.10 NaOH + 0.03 H2,Çeşitli üretim yöntemlerinin ana göstergeleri tabloda verilmiştir:
| 1 ton NaOH göstergesi | Civa yöntemi | F-stop yöntemi | Membran yöntemi |
|---|---|---|---|
| Klor verimi% | 97 | 96 | 98,5 |
| Elektrik (kWh) | 3 150 | 3 260 | 2 520 |
| NaOH konsantrasyonu | 50 | 12 | 35 |
| Klor saflığı | 99,2 | 98 | 99,3 |
| Hidrojen saflığı | 99,9 | 99,9 | 99,9 |
| Klorda O2'nin kütle oranı,% | 0,1 | 1-2 | 0,3 |
| Cl - NaOH içinde kütle payı,% | 0,003 | 1-1,2 | 0,005 |
Katı katot işlem akış diyagramı
F-stop yöntemi - Katı katot elektrolizörünün boşluğu, gözenekli bir septum - diyafram - katot ve anot boşluğuna bölünür ve burada elektrolizörün katot ve anotu bulunur. Bu nedenle, böyle bir elektrolizöre genellikle diyafram denir ve üretim yöntemine diyafram elektrolizi denir. Doymuş bir anolit akışı sürekli olarak diyafram elektrolizörünün anot boşluğuna girer. Elektrokimyasal işlemin bir sonucu olarak, halitin ayrışması nedeniyle klor anotta, suyun ayrışması nedeniyle katotta hidrojen açığa çıkar. Klor ve hidrojen, karıştırılmadan hücreden ayrı olarak çıkarılır:
2Cl - - 2 e \u003d Cl20, H20 - 2 e - 1/2 O 2 \u003d H2.
Bu durumda, katot bölgesi sodyum hidroksit ile zenginleştirilir. Elektrolitik alkali adı verilen, birleştirilmemiş anolit ve sodyum hidroksit içeren katot bölgesinden gelen çözelti, elektrolizörden sürekli olarak çıkarılır. Bir sonraki aşamada, elektrolitik alkali buharlaştırılır ve içindeki NaOH içeriği standarda göre% 42-50'ye ayarlanır. Halit ve sodyum sülfat artan sodyum hidroksit konsantrasyonu ile çökelir. Bir kostik alkali çözeltisi çökeltiden boşaltılır ve katı bir ürün elde etmek için bitmiş bir ürün olarak depoya veya buharlaştırma aşamasına aktarılır, ardından eritme, ölçeklendirme veya granülasyon yapılır. Kristal halit (ters tuz) elektrolize geri döndürülür ve ters tuzlu su denir. Ters salamura hazırlanmadan önce çözeltilerde sülfat birikmesini önlemek için sülfat çıkarılır. Anolit kaybı, tuz katmanlarının yeraltı liçi ile veya katı halitin çözülmesi ile elde edilen taze tuzlu su ilavesiyle telafi edilir. Taze tuzlu su, ters tuzlu su ile karıştırılmadan önce mekanik süspansiyonlardan ve önemli bir kısmı kalsiyum ve magnezyum iyonlarından temizlenir. Elde edilen klor su buharından ayrılır, sıkıştırılır ve klor içeren ürünlerin üretimine veya sıvılaştırma için beslenir.
Membran yöntemi - diyaframa benzer, ancak anodik ve katodik boşluklar bir katyon değişim membranı ile ayrılır. Membran elektrolizi en temiz kostikleri sağlar.
Teknolojik şema elektroliz.Ana teknolojik aşama elektrolizdir, ana cihaz, iletişim ile birbirine bağlı bir elektrolizör, bir dekomoser ve bir cıva pompasından oluşan bir elektrolitik banyodur. Bir elektrolitik banyoda, cıva, bir elektrolizör ve bir dekomoserden geçen bir cıva pompasının etkisi altında dolaşır. Elektrolizörün katodu bir cıva akımıdır. Anotlar - grafit veya düşük aşınma. Civa ile birlikte, bir anolit akışı - bir halit çözeltisi - sürekli olarak elektrolizörden akar. Halitin elektrokimyasal bozunmasının bir sonucu olarak, anot üzerinde Cl-iyonları oluşur ve klor salınır:
2 Cl - - 2 e \u003d Cl20,
elektrolizörden boşaltılır ve cıva katotunda cıva içinde zayıf bir sodyum çözeltisi oluşur, amalgam:
Na + + e \u003d Na 0 nNa + + nHg - \u003d Na + HgAmalgam sürekli olarak hücreden ayrıştırıcıya akar. Safsızlıklardan iyi temizlenmiş su, dekomosere sürekli olarak su verilir. İçinde, kendiliğinden bir elektrokimyasal işlemin sonucu olarak sodyum amalgam, bir kostik ve hidrojen çözeltisi olan cıva oluşumu ile su ile neredeyse tamamen ayrıştırılır:
Na + Hg + H20 \u003d NaOH + 1/2H2 + HgTicari bir ürün olan bu şekilde elde edilen kostik çözelti, viskoz üretiminde zararlı halit katışkıları içermez. Civa neredeyse tamamen sodyum amalgamdan arındırılır ve hücreye geri döner. Hidrojen tedavi için boşaltılır. Elektrolizörden çıkan anolit taze halit ile doyurulur, bununla birlikte gelen safsızlıklar ondan çıkarılır, ayrıca anotlardan ve yapısal malzemelerden yıkanır ve elektrolize geri döner. Doygunluktan önce içinde çözünmüş klor, iki veya üç aşamalı bir işlemle anolitten çıkarılır.
Laboratuar elde etme yöntemleri
Laboratuvarda sodyum hidroksit, pratikten daha tarihsel kimyasal yöntemlerle elde edilir.
Kalkerli yöntem Sodyum hidroksit elde etmek, bir soda çözeltisinin yaklaşık 80 ° C'lik bir sıcaklıkta kireç sütü ile etkileşmesidir. Bu sürece kostikleşme denir; Reaksiyon ile tanımlanır:
Na2C03 + Ca (OH) 2 \u003d 2NaOH + CaC03Reaksiyonun bir sonucu olarak, bir sodyum hidroksit çözeltisi ve bir kalsiyum karbonat çökeltisi oluşur. Kalsiyum karbonat, yaklaşık% 92 NaOH içeren erimiş bir ürün elde etmek üzere buharlaştırılan çözeltiden ayrılır. Erimiş NaOH, demir tamburlara dökülür ve katılaşır.
Ferritik yöntem iki reaksiyonla tanımlanmıştır:
Na 2 C0 3 + Fe 2 0 3 \u003d Na 2 0 Fe 2 0 3 + C0 2 (1) Na 2 0 Fe 2 0 3 -fH20 \u003d 2 NaOH + Fe203 (2)(1) - 1100-1200 ° C sıcaklıkta soda külü demir oksit ile sinterleme işlemi. Bu durumda sodyum spec ferrit oluşur ve karbondioksit açığa çıkar. Daha sonra kek, reaksiyona (2) göre su ile işlenir (süzülür); bir sodyum hidroksit çözeltisi ve bir Fe203 çökeltisi elde edilir, bu çözeltiden ayrıldıktan sonra işleme geri döner. Çözelti yaklaşık 400 g / l NaOH içerir. Yaklaşık% 92 NaOH içeren bir ürün elde etmek için buharlaştırılır.
Sodyum hidroksit üretmek için kimyasal yöntemlerin önemli dezavantajları vardır: büyük miktarda yakıt tüketilir, üretilen kostik soda safsızlıklar ile kirlenir ve cihazın bakımı zaman alıcıdır. Şu anda, bu yöntemler neredeyse tamamen elektrokimyasal üretim yöntemiyle değiştirilmektedir.
Kostik Soda Pazarı
Dünya kostik soda üretimi, 2005| üretici | Üretim hacmi, milyon ton | Dünya üretimindeki payı |
|---|---|---|
| DOW | 6.363 | 11.1 |
| Occidental Kimya Şirketi | 2.552 | 4.4 |
| Formosa Plastikleri | 2.016 | 3.5 |
| PPG | 1.684 | 2.9 |
| Bayer | 1.507 | 2.6 |
| Akzo nobel | 1.157 | 2.0 |
| Tosoh | 1.110 | 1.9 |
| Arkema | 1.049 | 1.8 |
| Olin | 0.970 | 1.7 |
| Rusya | 1.290 | 2.24 |
| Çin | 9.138 | 15.88 |
| diğer | 27.559 | 47,87 |
| Toplam: | 57,541 | 100 |
TP - katı cıva (lapa lapa);
TD - katı diyafram (kaynaşmış);
PP - cıva çözeltisi;
PX - kimyasal çözelti;
RD - diyafram çözümü.
| Göstergenin adı | TR OKP 21 3211 0400 | TD OKP 21 3212 0200 | RR OKP 21 3211 0100 | PX 1 sınıf OKP 21 3221 0530 | PX 2 sınıfı OKP 21 3221 0540 | RD Üst sınıf OKP 21 3212 0320 | RD Birinci sınıf OKP 21 3212 0330 |
|---|---|---|---|---|---|---|---|
| görünüm | Pullu beyaz kütle. Hafif renklenmeye izin verilir | Kaynaşmış kütle beyazdır. Hafif renklenmeye izin verilir | Renksiz berrak sıvı | Renksiz veya renkli sıvı. Kristalize çökeltiye izin verilir | Renksiz veya renkli sıvı. Kristalize çökeltiye izin verilir | Renksiz veya renkli sıvı. Kristalize çökeltiye izin verilir | |
| Sodyum hidroksitin kütle payı,%, daha az değil | 98,5 | 94,0 | 42,0 | 45,5 | 43,0 | 46,0 | 44,0 |
| İşletmenin adı | 2005 bin ton | 2006 bin ton | % 2005 payı | 2006'daki payı |
|---|---|---|---|---|
| OJSC Kostik Sterlitamak | 239 | 249 | 20 | 20 |
| OJSC "Kostik", Volgograd | 210 | 216 | 18 | 18 |
| Sayanskkhimplast OJSC | 129 | 111 | 11 | 9 |
| LLC Usoliekhimprom | 84 | 99 | 7 | 8 |
| Sibur-Neftekhim OJSC | 87 | 92 | 7 | 8 |
| OJSC "Khimprom", Cheboksary | 82 | 92 | 7 | 8 |
| VOAO Khimprom, Volgograd | 87 | 90 | 7 | 7 |
| CJSC Ilimkhimprom | 70 | 84 | 6 | 7 |
| KCHKhK OJSC | 81 | 79 | 7 | 6 |
| NAC "AZOT" | 73 | 61 | 6 | 5 |
| Khimprom OJSC, Kemerovo | 42 | 44 | 4 | 4 |
| Toplam: | 1184 | 1217 | 100 | 100 |
| İşletmenin adı | 2005 ton | 2006 ton | % 2005 payı | 2006'daki payı |
|---|---|---|---|---|
| OJSC "Kostik", Volgograd | 67504 | 63510 | 62 | 60 |
| OJSC Kostik Sterlitamak | 34105 | 34761 | 31 | 33 |
| Sibur-Neftekhim OJSC | 1279 | 833 | 1 | 1 |
| VOAO Khimprom, Volgograd | 5768 | 7115 | 5 | 7 |
| Toplam: | 108565 | 106219 | 100 | 100 |
uygulama
biyodizel

Cod Lutefisk Norveç Anayasa günü kutlamaları


