27.07.2019
1 alkali metal. Nasıl olduğunu biliyorsun
9. sınıfta konuyla ilgili kimya dersinin özeti:
"Alkali metal bileşikleri ve kullanımları."
hedefleri: Alkali metaller ve bileşikleri hakkındaki bilgileri genelleştirmek ve sistematize etmek; Bu bileşiklerin günlük yaşamda ve üretimde kullanımı, organizmaların yaşamındaki önemi ile tanışacaklar
Ders hedefleri:
1. Ders sırasında alkali metal bileşiklerinin kimyasal özelliklerinin özümlenmesini, günlük yaşamda ve üretimde kullanılmasını ve organizmaların yaşamındaki önemini sağlamak.
Genel eğitim ve kimyasal reaktif becerilerini geliştirmeye devam edin.
2. Fenomenler arasındaki neden-sonuç ilişkilerinin temel felsefi fikirlerinin oluşumu, bir alkali metal atomunun yapısı - basit bir maddenin özellikleri - alkali metal bileşiklerinin özellikleri ve özelliklerine dayalı uygulamaları.
3. İncelenen gerçekleri karşılaştırma, özetleme, cevaplarken düşüncelerinizi mantıklı bir şekilde ifade etme yeteneğini geliştirin. Yaşamda incelenen fenomenlerin uygulanmasına ilişkin verileri kullanarak okul çocuklarının bilişsel ilgisini geliştirmek.
Ders türü: kombine - BİT kullanarak yeni malzeme çalışması.
ekipman: ders kitabı, tebeşir, yazı tahtası, bilgisayar, medya projektörü, ekran, ders konu sunumu, öğrenciler için ders akış şemaları, kimyasallar (çözümler: sodyum hidroksit, hidroklorik asit, bakır sülfat, çinko hidroksit, fenolftalein) ve laboratuvar cam malzemeleri (test tüpü rafı).
USULÜ
ben Organizasyonel an.
II . Yeni materyal öğrenmek.
1. "Alkalin metaller" konusunda daha önce çalışılmış materyalin doğrulanması.
Bilmeceleri tahmin et:
1. Genellikle gazyağı içinde depolarlar ve su ile akar,
Doğada, şimdi hatırla,
Ücretsiz hiçbir yerde mevcut değil
Tuzlarda açmak mümkündür
Alevler ondan sararır
Ve tuzdan alabilirsiniz
Davy bunu nasıl elde etti.
Hangi unsurdan bahsediyoruz? (Na)
2. Kuvvetle zorlar
Nemden - saf hidrojen,
Onun yerini alıyor
Ve oksijeni sıkıca örüyor.
Bitkilerdeki o element gizlidir
Menekşe rengine göre
Tuzlarda açık olabilir.
Hangi unsurdan bahsediyoruz? (K).
1. Son derste hangi metallerle tanıştık?
2. Neden buna denir?
3. Tüm alkali metallerin atomlarının yapısındaki ortak özellik nedir?
İlgili Test: Alkali Metaller.
1. Alkali metaller için geçerli değildir: a) rubidyum; c) potasyum; b) sezyum; d) bakır.
2. Elektronik formül) 2) 8) 8) 1, a) lityum; c) potasyum; b) sodyum;
3. Ana alt gruptaki grup I elementlerinin artan nükleer yüke sahip atom yarıçapı:
a) periyodik olarak değişir; c) değişmez; b) artar;
4. Alkali metaller çok güçlüdür:
a) oksitleyici özellikler; c) özelliklerin azaltılması; b) amfoterik özellikler;
5. Alkali metallerin fiziksel özellikleri geçerli değildir:
a) gümüş-beyaz; b) yumuşak ve hafif; d) refrakter.
6. Ana alt grubun I grubunun elementlerinin su ile etkileşimlerinde aşağıdakiler oluşur:
a) asit; b) alkali ve hidrojen açığa çıkar; d) tuz.
7. Sodyum ve potasyum kerosende saklanır çünkü bunlar:
a) keskin bir kokuya sahip olmak; b) havada kolayca oksitlenir;
Kendi kendine kontrol: hata yok - "5", 1,2 hata - "4", 3 hata - "3", daha fazla - "2"
Cevaplar: 1 - 2 - in 3 - 4 - in 5 - 6 - 6 7 - b.
Kendi kendine kontrol: hata yok - "5", 1,2 hata - "4", 3,4 hata - "3", daha fazla - "2"
2. Bilginin gerçekleşmesi.
Doğada serbest formda alkali metallerle tanışmak mümkün müdür? Neden?
Doğada hangi bileşikler şeklinde bulunabileceğini varsayalım?
Doğada, alkali metaller sadece bileşikler formunda bulunur.
Na ve K doğal olarak klorürler, sülfatlar, silikatlar vb.
Li, Rb, Cs çeşitli minerallerin bir parçasıdır.
Fr radyoaktif cevherleri Ac ve U'da bulunur.
Masada: alkali metal bileşikleri (soda, tuz, parmak pilleri, sabun) içeren nesneler ve bir soru sorar.
Şu nesnelere bak. Sizce onları birleştiren nedir?
1 Genetik bağlantı nedir?
2. Genetik bir dizi sodyum yapın.
Na → Na20 → 2NaOH → Na2C03
3. Hangi bileşik sınıfları alkali metaller oluşturur? Özelliklerini düşünün.
Materyali açıklama ve slaytları görüntüleme sürecinde, öğrenciler plana göre notlar alırlar, özellikleri ve uygulamaları ortaya koyarlar.
Alkali metal oksitler
sert, beyaz, kolayca çözünür.
b) kimyasal özellikler; Öğrenciler bir defterde yazarlar: alkali metal oksitler tipik bazik oksitlerdir. Tüm bazik oksitler gibi alkali metal oksitler de su, asit oksitler, asitler ile reaksiyona girer.
Tahtadaki ve dizüstü bilgisayardaki çocuklar, örnek olarak sodyum oksit kullanarak kimyasal reaksiyonların denklemlerini yazıyor:
Na20 + H20 → 2NaOH;
Na20 + C02 → Na2C03;
Na2O + H2C03 → Na2C03 + H20
Alkali metal hidroksitler
.
a) fiziksel özellikler; Öğrenciler defter özelliklerine yazarlar: sert, beyaz, iyi çözünür, termal olarak kararlı, paslanmış kumaşlar ve kağıt.
b) kimyasal özellikler
Güvenlik Eğitimi laboratuvar çalışması yaparken.
Sodyum hidroksitin kimyasal özellikleri.
Amaç: Örnek olarak hidroksit kullanarak alkali metallerin kimyasal özelliklerini deneysel olarak kanıtlamak sodyum.
Kullanım kılavuzu
Temiz bir tüpe sodyum hidroksit dökün, birkaç damla fenolftalein ekleyin. Ne gözlemliyorsun?
Aynı tüpe hidroklorik asit çözeltisi ekleyin. Ne gözlemliyorsun? Reaksiyon denklemini yazın.
NaOH + HCl → NaCl + H 2 O Tahtadaki ve dizüstü bilgisayardaki çocuklar kimyasal reaksiyon denklemlerini iyonik formda yazarlar.
Temiz bir tüpe sodyum hidroksit dökün ve bakır sülfat çözeltisi ekleyin. Ne gözlemliyorsun? Reaksiyon denklemini yazın.
2NaOH + CuSO 4 → Na 2S04 + Cu (OH) 2 Tahtadaki ve dizüstü bilgisayardaki çocuklar kimyasal reaksiyon denklemlerini iyonik formda yazarlar.
Alkali metal hidroksitlerin kimyasal özellikleri hakkında bir sonuç çıkarır.
Alkali metal hidroksitler asitler, tuzlar ile reaksiyona girer) uygulama - slayt No. 5.
Sodyum hidroksit - NaOH - kostik soda, kostik soda, kostik.
Potasyum hidroksit - KOH - potasyum hidroksit.
NaOH ve KOH - kostik alkaliler, paslanmış kumaşlar ve kağıt. Öğrenci kaydı:Uygulama: yapay rayon için içinde sabun ve SMS, kozmetik, ilaç vb. üretimi.
Alkali tuzları
.
Fiziksel özellikler. Öğrenciler not defterine özellikler yazar katı kristalin maddeler, neredeyse hepsi suda çözünür.
Ders kitabı metinle bağımsız çalışma.
Uygulama: 5 numaralı slayttan tabloyu doldurma. 56 - 57 ders kitabında çalışma
Tuz formülü
isim
uygulama
NaHCO 3
K 2 CO 3
NaCl
Na2S04-10H20
Na2C03 ∙ 10 H20
Organizmaların yaşamındaki önemi - slayt numarası 6.
Öğrencinin konuyla ilgili mesajı: “Alkali metal bileşiklerinin organizmaların yaşamındaki değeri.”
Sodyum ve potasyum iyonları büyük bir biyolojik rol oynar: Na +, kan ve lenfte bulunan ana hücre dışı iyondur ve K +, ana hücre içi iyonudur. Birlikte çalışın. Bu iyonların konsantrasyonu, canlı bir organizmadaki kan basıncını düzenler ve tuz çözeltilerinin köklerden bitki yapraklarına hareketini sağlar. Potasyum iyonları - kalp kasının çalışmasını destekler, romatizmaya yardımcı olur, bağırsak fonksiyonunu iyileştirir. Potasyum bileşikleri - şişmeyi ortadan kaldırır.
V. sabitleme
VI. Ders özeti. Tesviye.
Ders özeti:
Alkali metallerin oksitleri, hidroksitleri için hangi fiziksel ve kimyasal özellikler karakteristiktir?
Hidroksitler ve alkali metal tuzları nerede kullanılır?
Ek malzeme. Bu ilginç.
Görev: Neden eski Yunanistan'da, sıcak havalarda uzun yolculuklardan önce askerlere bir parça ekmek yemesi, tuzlanması ve suyla yıkanması önerildi?
Elektrolit iyonları kolayca hidratlanır, bu nedenle sodyum klorür suyu vücutta hapseder.
Amaç: Eskimolar neden çok az tuz yer?
Bilimsel teorilerden birine göre, insanlar da dahil olmak üzere dünyada yaşayan tüm hayvanlar, denizde ortaya çıkan ve yaşayan organizmaların torunlarıdır. Bu canlıların vücut sıvısı bileşiminde deniz suyu idi. Karaya taşındıktan sonra, deniz suyunu vücutlarının sıvısı olarak kurtardılar. Ancak doğa, canlı organizmalara doğal formunda yeterli miktarda tuz sağlayamaz. Tuz suda çözündüğünden, önemli bir kısmı yağmur suyuyla topraklardan nehirlere, denizlere ve okyanuslara yıkanır. Sonuç olarak, zeminde büyüyen bitkiler yeterli tuz içermez. Bu yüzden bitkilerle beslenen hayvanların tuza ihtiyacı vardır. Her gün, vücut tuz içeren belirli bir miktarda sıvıyı kaybeder ve bitki gıdaları bunu telafi etmez. Diğer hayvanlarla beslenen hayvanların fazladan tuza ihtiyacı yoktur. İhtiyaç duydukları tuzu kurbanlarının organizmalarından alıyorlar. Eskimolar çoğunlukla et yer, bu yüzden tuz ihtiyacı çok az.
Görev: Son yıllarda İngiltere'de neden serebrovasküler hastalıktan ölümde bir azalma oldu?
Bunun nedeni artan taze meyve ve sebze tüketimidir. Taze sebze ve meyveler her zaman çok fazla potasyum ve biraz sodyum içerir. Sodyum vücutta su tutar, kan basıncını arttırır ve aksine potasyum onu \u200b\u200bazaltmaya yardımcı olur. Bu nedenle sebze, meyve, özellikle elma tüketimindeki artış, serebrovasküler hastalıkların önlenmesi için temel bir önlem olarak düşünülebilir.
İNSANLAR NEREDE TUZA AŞK .
Tuz, yiyecekleri bozulma ve çürümeden korumak için kullanılır. Yiyecekleri kurtarmak için (buzdolabı ve dondurucu olmadığında) tuz kullanıldı. Salamuradan sebze denedikten sonra, insanlar taze sebzeleri tuzlamaya, mayalamaya ve sulamaya başladı. Bir kişi her şeyi tuzlamak için o kadar kullanılır ki, bazı hastalıklara katlanmak için bile hazırdır, sadece tuzsuz bir diyete geçmez. Yavaş yavaş, tüm yiyecekleri denemeden bile tuzlamak için bir alışkanlık geliştirildi.
ÇOK TUZ - KÜÇÜK POTASYUM, KÜÇÜK POTASYUM - ÇOK HASTALIK
Tuz sorunu bir potasyum-sodyum dengesi meselesidir. Vücutta son derece önemlidir. Potasyum ve sodyum, hücrelerde varlığını sürekli tartışmaktadır. Sodyum klorürde potasyum yoktur, tamamen sodyumdur. Vücudumuzun sodyumdan 4 kat daha fazla olması gereken potasyum ihtiyacı var. Vücut her yerde potasyum toplar, ancak aşırı miktarda sofra tuzu kullanımı tüm çabalarını geçersiz kılar. Bu nedenle, aşırı tuz alımı ile, zamanla bir takım rahatsızlıklara yol açan potasyum eksikliği oluşur: fiziksel ve zihinsel yorgunluk, zayıf uyku, kramplar, eklem ağrısı.
Fazla sodyum (tuz) kalbe aşırı yüklenir. Çok fazla tuz yediğinizi öğrenmek mi istiyorsunuz? Aynaya gidin: irisin etrafındaki beyaz bir daire aşırı tuz alımını gösterir.
Potasyum hidroksit
Kostik potasyum, gübre, sentetik kauçuk, piller için elektrolitler, reaktifler üretiminde kullanılır ve ilaç endüstrisinde ve ekonominin diğer sektörlerinde kullanılır.
Kostik potasyum, bu tür taşımalarda yürürlükte olan malların taşınması kurallarına uygun olarak demiryolu ile karayolu ile taşınır.
Kostik potasyum, sıkıca kapalı bir kapta, Havadaki “yayılır”, nemi emer.
Geleneksel adı "kostik potasyum", bu maddenin canlı doku üzerindeki aşındırıcı etkisini yansıtır. Cilde kostik potasyum bulaşırsa, kimyasal yanıklar mümkündür.
Hafif sabunlar, katı ve sıvı yağların kostik potasyum ile sabunlaştırılmasıyla elde edilir. Tüm bu sabunlar yumuşak kremsi bir kıvama sahiptir.
Kostik soda.
En yaygın alkali. Dünyada yılda 57 milyon tondan fazla kostik alkali üretilmekte ve tüketilmektedir.
Kostik soda çok çeşitli endüstrilerde ve evde kullanım için kullanılır:
Kağıt hamuru ve kağıt endüstrisinde kağıt, karton, suni elyaf, ahşap elyaf levha üretiminde.
Sabun, şampuan ve diğer deterjanların üretiminde yağların sabunlaştırılması için.
Kimyasal endüstrilerde - asitleri ve asit oksitleri, kimyasal reaksiyonlarda vb. Bir reaktif veya katalizör olarak nötralize etmek.
Kostik Sodyum (Sodyum Hidroksit) kostik ve aşındırıcı bir maddedir. 2. tehlike sınıfındaki maddeleri ifade eder. Bu nedenle, onunla çalışırken dikkatli olunmalıdır.
Cilt, mukoza ve gözlerle temas etmesi durumunda, ciddi kimyasal yanıklar oluşur. Mukoza yüzeyleri kostik alkali ile temas ederse, etkilenen bölgeyi bir su akışı ile yıkamak ve zayıf bir asetik asit çözeltisi ile temasa geçmek gerekir.
Lityumda - yıldızlara
Cep telefonu, cep aygıtı ve dizüstü bilgisayar üreticileri bu metale çok ihtiyaç duyuyor. Nükleer enerji büyük miktarda lityum (Li) tüketir; teorisyenlerin hesaplamalarına göre, termonükleer enerjinin anahtarını sağlayabilen bu alkali metaldir. Güçlü bir psikotrop madde olan Li, askeri ve uygulamalı psikiyatride kullanılır (ve Li'nin insan ruhu üzerindeki etkisinin doğası tam olarak anlaşılamamıştır). Lityum döteryum, hidrojen bombasında çalışan bir madde ve patlayıcı bir güç regülatörü olarak kullanılır.
Bu metal, derin uzay araştırmaları için de gereklidir.
Öğrenciler için derse iş akışı
Konu: Alkali metal bileşikleri.
test
Hidrürler. Hidrojenin ısıtılmış lityum üzerinden geçirilmesiyle kolayca elde edilebilen en kararlı lityum hidrit. LiH, erime noktası 680 ° C olan beyaz bir kristal tozdur. Yüksek sıcaklıklarda LiH, son derece reaktiftir. Su ile kuvvetli bir şekilde ayrışır:
LiH + H20 \u003d LiOH + H2
Oksitler. En kararlı olanı Li20'dur. Lityum ve sodyum oksitler beyaz, geri kalanı sarıdır. Ayrıca, renk yoğunluğu, elemanın seri sayısının artmasıyla artar.
Peroksitler. Aşırı oksijen içinde metaller yakılarak elde edilirler. Alkali metal peroksitler hidrojen peroksit türevleri olarak kabul edilebilir, çünkü hidrojen peroksit oluşturmak için asitler ve su ile etkileşime girerler:
M202 + H2S04 \u003d M2S04 + H202
M202 + 2H20 \u003d 2MOH + H202
En büyük önemi, kapalı alanlarda oksijen üretmek için kullanılan sodyum peroksittir (örneğin, bir denizaltı):
2Na202 + 2CO2 \u003d 2Na 2CO3 + 2O2
Hidroksitler. Bu teknik kostik alkali, (NaOH - kostik soda, KOH - kostik potasyum) olarak adlandırılır. Bunlar renksiz, eriyebilir maddelerdir. Erimiş halde cam, porselen, platin ile etkileşirler. Bu nedenle, alkalilerin eritilmesi, etkileşmedikleri gümüş veya demir potalarda gerçekleştirilir. Hidroksitler, yüksek ısı üretimi ile suda kolayca çözünür.
Hidroksitler aşağıdaki şekillerde hazırlanır:
a) Metallerin veya oksitlerin su ile etkileşimi:
Li20 + H20 \u003d 2LiOH
Bu reaksiyon sadece çok saf hidroksitler üretmek için kullanılır.
b) Kostikleşme reaksiyonu kostik soda üretimi için bilinen en eski yöntemdir. Bu yöntem, bir soda çözeltisinin kaynatma sırasında kalsiyum hidroksit (sönmüş kireç) ile işlenmesinden oluşur. Elde edilen çözünmeyen kalsiyum karbonat filtrelenir veya ondan berrak bir sıvı dökülür:
Na2C03 + Ca (OH) 2 \u003d 2NaOH + CaCO3
Nihai sodyum hidroksit çözeltisi, vakumla buharlaştırılarak konsantre edildi. Suyu tamamen uzaklaştırmak için katı sodyum hidroksit 500 ° C'de eritildi ve% 3-4 Na2C03 içeren NaOH elde edildi. Bu şekilde elde edilen NaOH'a "kostik soda" denir.
c) Sulu çözelti içinde alkali metal klorürlerin elektrolizi, klor ile aynı anda NaOH ve KOH üretmek için modern bir endüstriyel yöntemdir. Bir NaCl çözeltisi, atıl elektrotlar (platin, grafit) ile elektrolize tabi tutulduğunda, anotta klor ve katotta hidrojen salınır. Na + iyonları ve OH - iyonları, NaOH oluşturan katot boşluğunda birikir.
d) Alkali metal karbonatların oksitlerle füzyonu ve daha sonra alaşımın su buharı ile işlenmesi:
Fe203 + Na2C03 \u003d 2NaFeO2 + C02
2NaFeO 2 + H20 \u003d 2NaOH + Fe203
Alkaliler, boyalar, bardaklar, sabunlar, kağıt, suni elyaflar ve ilaçlar için kimya endüstrisindeki en önemli hammaddedir.
Tuz. NaCl ve KCl, doğada büyük miktarlarda bulunur. NaCl (sofra tuzu) deniz suyunda (ortalama% 2.7) ve birkaç kilometreye kadar kapasiteye sahip yataklarda kaya tuzu şeklinde bulunur. Saf NaCl ve KCl, yeniden kristalleştirme yoluyla doğal klorürlerden elde edilir. Lityum tuzları doğal lityum karbonattan elde edilir. Rubidyum ve sezyum tuzlarının elde edilmesi zorluklar ile ilişkilidir, çünkü çözünürlükleri potasyum tuzlarının çözünürlüğüne çok yakındır. Genellikle, karnallitten sonra kalan ana likörler yeniden kristalleştirilir ve onlardan rubyum ve sezyum yeniden kristalleştirilerek saflaştırılır. Rubidyumun sezyumdan ayrılması, karbonatlarının alkol içindeki farklı çözünürlükleri kullanılarak gerçekleştirilir.
Nitratlardan NaN03 ve KN03, pratik öneme sahiptir. Teknik isimler sodyum nitrat ve potasyum nitrattır. Her iki tuz da mineral gübreler olarak kullanılır. KNO3 ayrıca siyah toz üretimi için de kullanılır (higroskopik olması nedeniyle NaNO3 kullanılmaz).
Karbonik asit H2C03, iki sıra alkali metal karbonat, asidik (MHCO3) ve ortam (M2C03) verir.Asidik karbonatlar (hidrokarbonlar, bikarbonatlar) lityum hariç tüm alkali metaller için bilinir. Lityum karbonat hariç, tüm nötr karbonatlar suda yüksek oranda çözünür. Na2C03 - soda, bazen doğada bazı göllerin sularında ve mineral kaynaklarında bulunur. Soda amonyak yolunu alın: bir sodyum klorür çözeltisi amonyak ve karbon dioksit ile doyurulur. Bu durumda, NaHC03 çöker, çünkü soda NH4CI'den daha kötü çözünür:
NaCl + H20 + C02 + NH3 \u003d NaHC03 ¯ + NH4CI
2NaHCO 3 → Na2C03 + CO2 + H20
K2C03 - potas, higroskopik beyaz toz, suda çözünür. Potasyum hidroksitin karbonizasyonu ile alın:
2KOH + C02 \u003d K2C03 + H20
Potas, sabun ve cam endüstrilerinde, yünün boyanması ve ağartılması için, potasyum siyanür üretiminde, organik sentezde kullanılır.
Sülfürik asit, iki sıra alkali metal sülfat verir - asidik ve orta.
Na2S04, sodyum klorür ve sülfürik asitten hidroklorik asit üretiminde bir yan ürün olarak elde edilir. Sulu çözeltilerden sodyum sülfat, Na2S04 olarak kristalleşir. 10H20, teknikte bu kristalin hidrata Glauber tuzu denir. Tıpta pamuklu kumaşların boyanmasında kullanılır.
· · ·§ 96. Alkalin
Alkali metaller grubu aşağıdaki metal serilerini içerir; Li, Na, K, Rb, Cs, Fr. Periyodik sistem grubunun ana alt grubu I'de bulunurlar.
Tüm bunlar dış elektron tabakasında bir elektrona sahip olmaları bakımından benzerdir (Tablo 18) /.
Alkalin s-elementleridir. Bir alkali metal atomunun dış elektron tabakasının elektronu, aynı dönemin diğer elementleriyle karşılaştırıldığında, çekirdekten en uzak olanıdır, yani, alkali metal atomunun yarıçapı, aynı dönemin diğer elementlerinin atomlarının yarıçapıyla karşılaştırıldığında en büyüktür. Bağlantı halinde
|
Çekirdek şarj |
Enerji seviyelerindeki elektron sayısı |
Atom yarıçapı |
|||||||
bununla, alkali metal atomlarının dış tabakasının değerlik elektronu kolayca parçalanır ve pozitif tek yüklü iyonlara dönüştürülür. Bunun nedeni, diğer elementlere sahip alkali metal bileşiklerinin, iyonik bağ tipine göre yapılandırılmış olmasıdır.
Redoks reaksiyonlarında, güçlü indirgeyici ajanlar olarak davranırlar ve bu yetenek, atom çekirdeğinin artan yüküyle metalden metale artar.
§ 97. Sodyum
Sodyum atomunun elektronik konfigürasyonu ls 2 2s 2 2p 6 3s 1. Dış tabakasının yapısı:
Sodyum doğada sadece tuz formunda bulunur. En yaygın sodyum tuzu sodyum klorür NaCl'nin yanı sıra mineral sylvinite KCl · NaCl ve bazı sülfat tuzlarıdır, örneğin, Hazar Denizi Kara-Boğaz-Gol'de büyük miktarlarda bulunan Glauber tuzu Na2SO4 · 10H2O'dur.
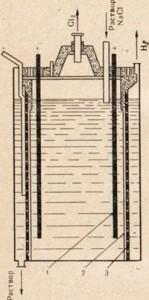
Sodyum metal, bu tuzun eriyiğinin elektrolizi ile sodyum klorürden elde edilir. Elektroliz tesisatı Şek. 76. Elektrotlar erimiş tuz içerisine indirilir. Anot ve katot boşlukları, oluşan reaksiyonu ters reaksiyon oluşmayacak şekilde izole eden bir diyaframla ayrılır. Pozitif bir sodyum iyonu katottan bir elektron alır ve nötr bir sodyum atomuna dönüşür. Nötr sodyum atomları katotta erimiş metal formunda toplanır. Katotta meydana gelen işlem, aşağıdaki şema ile temsil edilebilir:
Na + + Na 0.
Elektronların kabulü katotta meydana geldiğinden ve elektronların bir atom veya iyon tarafından kabulü bir azalma olduğundan, katottaki sodyum iyonları azalır. Anotta, klor iyonları elektronlar, yani oksidasyon süreci ve serbest salınımı bağışlar
aşağıdaki şema ile temsil edilebilen klor gazı:
Cl - - e - → Cl 0
Elde edilen metalik sodyum gümüş-beyaz bir renge sahiptir ve bir bıçakla kolayca kesilir. Kesimden hemen sonra incelenirse, sodyumdaki bir dilim parlak bir metalik parlaklığa sahiptir, ancak metalin aşırı hızlı oksidasyonu nedeniyle hızla kararır.
![]()
Şek. 76. Erimiş sodyum klorürün elektrolizi için montaj şeması.
1 - halka katodu; 2 - anot boşluğundan gazlı klorun uzaklaştırılması için çan
Sodyum, yaklaşık 180 ° sıcaklıkta az miktarda oksijen içinde oksitlenirse, sodyum oksit elde edilir:
4Na + O2 \u003d 2Na2O.
Oksijen içinde yanarken sodyum peroksit elde edilir:
2Na + O2 \u003d Na2O2.
Bu durumda, sodyum göz kamaştırıcı bir sarı alevle yanar.
Sodyumun kolay ve hızlı oksidasyonu nedeniyle, bir gazyağı veya parafin tabakası altında saklanır ve tercih edilir, çünkü yavaşça olmasına rağmen, gazyağı ve sodyum oksidasyonunda belirli bir miktar hava çözünür.
Sodyum, hidrojen-NaH hidrit ile bir bileşik verebilir, burada 1 oksidasyon durumu sergiler. Bu, kimyasal bağın doğası ve oksidasyon derecesinde IV-VII gruplarının ana alt gruplarının elemanlarının uçucu hidridlerinden farklı olan tuz benzeri bir bileşiktir.
Sodyum metal sadece oksijen ve hidrojen ile değil, aynı zamanda birçok basit ve karmaşık madde ile de reaksiyona girebilir. Örneğin, bir harçta kükürt ile öğütülürken, sodyum onunla şiddetli reaksiyona girerek aşağıdakileri oluşturur:
2Na + S \u003d Na2S
Reaksiyona salgınlar eşlik eder, bu nedenle harç gözlerden uzak tutulmalı ve elinize bir havlu sarılmalıdır. Reaksiyon için küçük sodyum parçaları alınmalıdır.
Sodyum, klorin içinde erimiş ve çok sıcak sodyumdan geçirilen bir klor-kalsiyum tüpünde gözlemlenmesi özellikle iyi olan sodyum klorür oluşumu ile kuvvetli bir şekilde yanar:
2Na + Cl2 \u003d 2NaCl
Sodyum sadece basit değil, aynı zamanda çok aktif bir metal olduğu için su ile yer değiştiren karmaşık maddelerle de reaksiyona girer, bir dizi streste hidrojenin solunda çok fazladır ve ikincisini sudan kolayca yer değiştirir:
2Na + 2H2O \u003d 2NaOH + H2
Yanan alkali metal su ile söndürülmemelidir. Soda külü tozu ile doldurmak en iyisidir. Sodyum varlığında, bir gaz brülörünün renksiz alevi sararır.
Sodyum metal, organik sentezde, örneğin bütadienden sentetik kauçuk üretiminde bir katalizör olarak kullanılabilir. Diğer sodyum bileşiklerinin, örneğin sodyum peroksitin hazırlanması için bir başlangıç \u200b\u200bmalzemesi olarak hizmet eder.
■ 27. Metalik sodyum içeren reaksiyonlar metninde verilen reaksiyon denklemlerini indirgeyici ajan olarak davrandığını kanıtlayın.
28. Sodyum neden havada depolanamaz?
29. Öğrenci, tuzu metalden çıkarmayı umarak bir bakır parçasını bir bakır sülfat çözeltisine daldırdı. Kırmızı metal yerine jelatinimsi mavi bir çökelti ortaya çıktı. Meydana gelen reaksiyonları tanımlayın ve denklemlerini moleküler ve iyonik formlarda yazın. Reaksiyon istenen sonuca götürecek şekilde reaksiyon koşulları nasıl değiştirilmelidir? Denklemleri moleküler, tam ve kısaltılmış iyonik formlarda yazın.
30. 2.3 g sodyum metal, 45 ml su içeren bir kaba yerleştirildi. Reaksiyonun sonunda hangi kostik soda oluştu.
31. Yanan bir sodyumun söndürülmesi için hangi ajanlar kullanılabilir? Gerekçeli bir cevap verin.
98. Sodyumun oksijen bileşikleri. Kostik soda
Sodyumun oksijen bileşikleri, daha önce belirtildiği gibi, sodyum oksit Na2O ve sodyum peroksit Na2O2'dir.
Sodyum oksit Na20 özellikle önemli değildir. Su ile kuvvetli reaksiyona girerek kostik soda oluşturur:
Na20 + H20 \u003d 2NaOH
Sodyum peroksit Na202 sarımsı bir tozdur. Bir tür hidrojen peroksit tuzu olarak düşünülebilir, çünkü yapısı H2O2 ile aynıdır. Sodyum peroksit gibi güçlü bir oksitleyici maddedir. Suyun etkisi altında bir alkali oluşturur ve:
Na2O2 + H20 \u003d H202 + 2NaOH
seyreltik asitlerin sodyum peroksit üzerindeki etkisiyle oluşan:
Na2O2 + H2SO4 \u003d H2O2 + Na2SO4
Sodyum peroksitin yukarıdaki tüm özellikleri, mümkün olan tüm malzemeleri ağartmak için kullanılmasına izin verir.
Şek. 77. Sodyum klorür çözeltisinin elektrolizi için kurulum şeması.
1 - anot; 2 - anot ve katot boşluğunu ayıran bir diyafram; 3 katot
Çok önemli bir sodyum bileşiği, sodyum hidroksit veya kostik soda, NaOH'dir. Ayrıca kostik soda veya sadece kostik olarak da adlandırılır.
Kostik soda elde etmek için, sodyum klorür kullanılır - en ucuz doğal sodyum bileşiği, onu elektrolize eder, ancak bu durumda bir eriyik değil, bir tuz çözeltisi kullanılır (Şekil 77). Sodyum klorür çözeltisinin elektrolizinin bir açıklaması için, bakınız § 33. 77, anot ve katot boşluğunun bir diyaframla ayrıldığını gösterir. Bu, oluşturulan ürünlerin birbirleriyle etkileşmesini önlemek için yapıldı, örneğin Сl2 + 2NaOH \u003d NaClO + NaCl + Н20.
Kostik soda - suda mükemmel çözünür, beyaz renkli katı kristal bir madde. Sodyum hidroksit suda çözündüğünde, büyük miktarda ısı açığa çıkar ve çözelti çok sıcaktır. Kostik soda, etkisi altında çok ıslak olabileceği ve karbon dioksitin etkisi altında su buharının penetrasyonundan korumak için iyi kapatılmış kaplarda saklanmalıdır, bunun altında kostik soda yavaş yavaş sodyum karbonata dönüşebilir:
2NaOH + CO2 \u003d Na2C03 + H20.
Kostik soda tipik bir alkalidir, bu nedenle onunla çalışma önlemleri diğer alkalilerle çalışırken olduğu gibidir.
Kostik soda, örneğin petrol ürünlerinin rafine edilmesi, yağlardan sabun üretimi, kağıt endüstrisinde, suni elyaf ve boyaların üretiminde, ilaçların üretiminde vb. Birçok endüstride kullanılır (Şekil 78).
Not defterine kostik soda uygulama alanlarını yazın.
Sodyum tuzlarından, öncelikle sodyum hidroksit ve metalik sodyum için ana hammadde görevi gören sodyum klorür, NaCl (bu tuz hakkında ayrıntılar için, bakınız sayfa 164), Na2CO3 soda (bkz. Sayfa 278), Na2SO4 (bkz. Sayfa 224), NaN03 (bkz. S.250), vb.
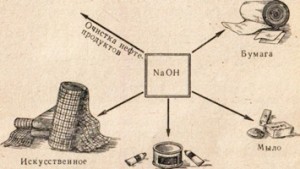
Şek. 78. Kostik soda kullanımı
■ 32. Sodyum klorürün elektrolizi ile kostik soda üretme yöntemini açıklayın.
33. Kostik soda, sönmüş kireç ile sodyum karbonat üzerinde etkili olarak elde edilebilir. Bu reaksiyon için denklemin moleküler ve iyonik bir formunu yapın ve ayrıca 40 kg kostik soda elde etmek için% 95 karbonat içeren ne kadar soda gerektiğini hesaplayın.
34. Zemin tıpalı şişelerde bir kostik soda çözeltisi saklarken, tıkaçlar neden “sıkışmış” ve çıkarılamıyor? Belirli bir süre boyunca şişe su içinde baş aşağı tutulursa, mantar serbestçe çıkarılabilir. Reaksiyon denklemleri göz önüne alındığında, bu durumda ne tür süreçlerin gerçekleştiğini açıklayınız.
35. Reaksiyon denklemlerini tipik bir alkali olarak kostik soda özelliklerini karakterize eden moleküler ve iyonik formlarda yazın.
36. Kostik soda ile çalışırken ne gibi önlemler alınmalıdır? Kostik sodalı yanıklar için hangi ilk yardım önlemleri alınmalıdır?
§ 99. Potasyum
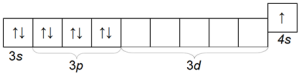
Potasyum K ayrıca atomik yarıçapı (dördüncü periyot) ile sodyumdan farklı olan ve bu nedenle sodyumdan daha fazla kimyasal aktiviteye sahip olan oldukça yaygın bir alkali metaldir. Potasyum atomunun elektronik konfigürasyonu 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1'dir.
Dış elektronik katmanının yapısı
Potasyum, bıçakla iyi kesilmiş yumuşak bir metaldir. Oksidasyonu önlemek için, sodyum gibi, bir kerosen tabakası altında saklanır.
Potasyum su ile sodyumdan daha şiddetli reaksiyona girer, alkali oluşumu ve hidrojen salınımı ile tutuşur:
2K + 2H20 \u003d 2KOH + H2.
Oksijen içinde yanarken (sodyum yakmaktan daha küçük metal parçalarının alınması önerilir), sodyum gibi, potasyum peroksit oluşumu ile çok güçlü bir şekilde yanar.
Potasyumun dolaşımda sodyumdan çok daha tehlikeli olduğuna dikkat edilmelidir. Potasyum keserken bile güçlü bir patlama olabilir, bu yüzden daha da dikkatli bir şekilde tutmanız gerekir.
Potasyum hidroksit veya potasyum hidroksit KOH beyaz kristalli bir maddedir. Kostik potasyum her şekilde kostik sodaya benzer. Sabun endüstrisinde yaygın olarak kullanılırlar, ancak üretimi biraz daha pahalıdır, bu nedenle NaOH gibi bir uygulama bulamaz.
Potasyum tuzları özellikle belirtilmelidir, çünkü bazıları gübre olarak yaygın olarak kullanılmaktadır. Bunlar potasyum klorür KCl, aynı zamanda bir azot gübresi olan potasyum nitrat KNO3'tür.
37. Kostik potasın kimyasal olarak kostik sodadan daha aktif olduğu gerçeğini nasıl açıklayabiliriz?
38. Bir parça potasyum su ile kalıba indirildi. Reaksiyon sona erdikten sonra, buraya beyaz jelatinimsi bir çökelti olarak küçük bir çinko yerleştirildi. Çökelti kayboldu ve çözeltiyi fenolftalein ile test ederken, ikincisi koyu kırmızı bir renge döndü. Burada hangi kimyasal süreçler meydana geldi?
Hangileri çözümde? Gerekçeli bir cevap verin.
39. Potasyum neden tüm alkali metaller gibi s element ailesinin bir üyesidir?
Alkali metaller metal olmayanlarla kolayca reaksiyona girer:
2K + I 2 \u003d 2KI
2Na + H 2 \u003d 2NaH
6Li + N 2 \u003d 2Li 3 N (reaksiyon zaten oda sıcaklığında)
2Na + S \u003d Na 2 S
2Na + 2C \u003d Na2C2
Oksijen ile reaksiyonlarda, her alkali metal bireyselliğini gösterir: havada yanarken lityum oksit, sodyum - peroksit, potasyum - peroksit oluşturur.
4Li + O 2 \u003d 2Li 2 O
2Na + O 2 \u003d Na202
K + O 2 \u003d KO 2
Sodyum oksit elde etme:
10Na + 2NaNO 3 \u003d 6Na 2 O + N 2
2Na + Na202 \u003d 2Na20
2Na + 2NaON \u003d 2Na 2 O + H 2
Su ile etkileşim, alkali ve hidrojen oluşumuna yol açar.
2Na + 2H20 \u003d 2NaOH + H2
Asitlerle Reaksiyon:
2Na + 2HCl \u003d 2NaCl + H2
8Na + 5H2S04 (kons.) \u003d 4Na2S04 + H2S + 4H20
2Li + 3H2S04 (kons.) \u003d 2LiHSO 4 + S02 + 2H20
8Na + 10HNO 3 \u003d 8NaNO 3 + NH 4 NO 3 + 3H20
Amonyak ile etkileşime girdiğinde, amidler ve hidrojen oluşur:
2Li + 2NH 3 \u003d 2LiNH 2 + H 2
Organik bileşiklerle etkileşim:
H ─ C ≡ C ─ H + 2Na → Na ─ C≡C ─ Na + H 2
2CH 3 Cl + 2Na → C2H6 + 2NaCl
2C 6 H 5OH + 2Na → 2C 6 H 5 ONa + H 2
2CH3OH + 2Na → 2 CH3 ONa + H 2
2CH 3 COOH + 2Na → 2CH 3 COOONa + H 2
Alkali metallere kalitatif reaksiyon, alevin katyonları ile renklendirilmesidir. Li + ion renkleri karmin kırmızı alevi, Na + iyon sarısı, K + menekşe
Alkali metal bileşikleri
Oksitler.
Alkali metal oksitler tipik bazik oksitlerdir. Asit ve amfoterik oksitler, asitler, su ile reaksiyona girer.
3Na 2 O + P 2 O 5 \u003d 2Na 3 PO 4
Na20 + Al203 \u003d 2NaAlO2
Na20 + 2HCl \u003d 2NaCl + H20
Na20 + 2H + \u003d 2Na + + H20
Na20 + H20 \u003d 2NaOH
peroksitler.
2Na202 + CO 2 \u003d 2Na 2 CO3 + O 2
Na202 + CO \u003d Na2C03
Na202 + S02 \u003d Na2S04
2Na 2 O + O 2 \u003d 2Na 2 O 2
Na20 + NO + NO 2 \u003d 2 NaNO 2
2Na 2 O 2 \u003d 2Na 2 O + O 2
Na202 + 2H20 (soğuk) \u003d 2NaOH + H202
2Na202 + 2H20 (yatay) \u003d 4NaOH + O 2
Na202 + 2HCl \u003d 2NaCl + H202
2Na202 + 2H2S04 (ayrıştırma Yatay) \u003d 2Na2S04 + 2H202 + O 2
2Na202 + S \u003d Na2S03 + Na20
5Na202 + 8H2S04 + 2KMnO 4 \u003d 5O2 + 2MnSO 4 + 8H20 + 5Na 2S04 + K2S04
Na202 + 2H2S04 + 2NaI \u003d I 2 + 2Na 2S04 + 2H20
Na202 + 2H2S04 + 2 FeS04 \u003d Fe2 (S04) 3 + Na2S04 + 2H20
3Na202 + 2Na 3 \u003d 2Na 2 CrO4 + 8NaOH + 2H20
Baz (alkali).
2NaOH (fazla) + C02 \u003d Na2C03 + H20
NaOH + C02 (fazla) \u003d NaHC03
S02 + 2NaOH (fazla) \u003d Na2S03 + H20
Si02 + 2 NaOH Na2Si03 + H20
2NaOH + Al203 2NaAlO2 + H20
2NaOH + AI203 + 3H20 \u003d 2Na
NaOH + Al (OH) 3 \u003d Na
2NaOH + 2Al + 6H20 \u003d 2Na + 3H2
2KOH + 2N02 + 02 \u003d 2KNO3 + H20
KOH + KHCO 3 \u003d K2C03 + H20
2NaOH + Si + H20 \u003d Na2SiO3 + H2
3KOH + P 4 + 3H20 \u003d 3KH 2 PO 2 + PH 3
2KOH (soğuk) + Cl2 \u003d KClO + KCl + H20
6KOH (sıcak) + 3Cl2 \u003d KClO 3 + 5KCl + 3H20
6NaOH + 3S \u003d 2Na 2 S + Na2S03 + 3H20
2NaNO 3 2NaNO 2 + O 2
NaHC03 + HN03 \u003d NaN03 + C02 + H20
NaI → Na + + I -
katotta: 2Н 2 О + 2e → H 2 + 2OH - 1
anotta: 2I - - 2e → I 2 1
2H20 + 2I - ![]() H2 + 2OH - + I 2
H2 + 2OH - + I 2
2H20 + 2NaI ![]() H2 + 2 NaOH + I 2
H2 + 2 NaOH + I 2
2NaCl ![]() 2Na + Cl 2
2Na + Cl 2
anotta katotta
2Na 2 HPO 4 Na 4 P 2 O 7 + H20
KNO 3 + 4Mg + 6H20 \u003d NH 3 + 4Mg (OH) 2 + KOH
4KClO 3 KCl + 3KClO 4
2KClO 3 ![]() 2KCl + 3O 2
2KCl + 3O 2
KClO 3 + 6HCl \u003d KCl + 3Cl2 + 3H20
Na2S03 + S \u003d Na2S203
Na2S203 + H2S04 \u003d Na2S04 + S ↓ + S02 + H20
2NaI + Br 2 \u003d 2NaBr + I 2
2NaBr + Cl 2 \u003d 2NaCl + Br 2
I Bir grup.
1. Şişeye dökülen kostik soda çözeltisinin yüzeyinden elektrik boşalmaları yapıldı ve şişedeki hava kahverengi bir renk aldı ve bir süre sonra kayboldu. Nihai çözelti, dikkatlice buharlaştırıldı ve katı tortunun, iki tuzun bir karışımı olduğu bulundu. Bu karışım ısıtıldığında, gaz açığa çıkar ve tek madde kalır. Tarif edilen reaksiyonların denklemlerini yazın.
2. Sodyum klorür eriyiğinin elektrolizi sırasında katoda salınan madde oksijen içinde yakıldı. Elde edilen ürün karbon dioksit ile doldurulmuş bir gaz sayacına yerleştirildi. Sonuçtaki madde bir amonyum klorür çözeltisine eklenmiş ve çözelti ısıtılmıştır. Tarif edilen reaksiyonların denklemlerini yazın.
3) Nitrik asit kabartma tozu ile nötralize edildi, nötr çözelti dikkatlice buharlaştırıldı ve tortu kalsine edildi. Elde edilen madde, sülfürik asit ile asitleştirilmiş bir potasyum permanganat çözeltisine sokuldu ve çözelti renksizleştirildi. Azot içeren reaksiyon ürünü sodyum hidroksit çözeltisine konuldu ve çinko tozu ilave edildi ve keskin kokulu bir gaz açığa çıktı. Tarif edilen reaksiyonların denklemlerini yazın.
4) Bir sodyum iyodür çözeltisinin inert elektrotlarla bir elektrolizi sırasında anotta elde edilen madde, potasyum ile reaksiyona sokuldu. Reaksiyon ürünü konsantre sülfürik asit ile ısıtıldı ve oluşan gaz sıcak bir potasyum kromat çözeltisinden geçirildi. Tarif edilen reaksiyonların denklemlerini yazın
5) Bir sodyum klorür eriyiğinin elektrolizi sırasında katotta elde edilen madde oksijen içinde yakıldı. Elde edilen ürün daha sonra kükürt dioksit ve bir baryum hidroksit çözeltisi ile işlendi. Tarif edilen reaksiyonların denklemlerini yazın
6) Beyaz fosfor, havada kendiliğinden tutuşan sarımsak kokusu olan bir gazın gelişmesiyle kostik potasyum çözeltisinde çözünür. Yanma reaksiyonunun katı ürünü, elde edilen beyaz maddenin bir hidrojen atomu içerecek bir oranda sodyum hidroksit ile reaksiyona girdi; ikincisi kalsine edildiğinde sodyum pirofosfat oluşur. Tarif edilen reaksiyonların denklemlerini yazın
7) Oksijeni yakmayan bilinmeyen metal. Reaksiyon ürünü, karbondioksit ile etkileşime girer, iki madde oluşturur: bir hidroklorik asit çözeltisi ile karbondioksit salınımı ile etkileşime giren bir katı ve yanmayı destekleyen gaz halinde basit bir madde. Tarif edilen reaksiyonların denklemlerini yazın.
8) Kahverengi gaz, fazla miktarda hava varlığında fazla potasyum hidroksit çözeltisinden geçirildi. Elde edilen çözeltiye magnezyum talaşları ilave edildi ve ısıtıldı ve nitrik asit açığa çıkan gazla nötralize edildi. Nihai çözelti, dikkatlice buharlaştırıldı ve katı reaksiyon ürünü, kalsine edildi. Tarif edilen reaksiyonların denklemlerini yazın.
9) Manganez dioksit varlığında tuz A'nın termal ayrışması sırasında, ikili tuz B ve yanmayı destekleyen ve havanın bir parçası olan bir gaz oluşur; bu tuz bir katalizör olmadan ısıtıldığında, tuz B ve daha yüksek oksijen içeren asit tuzu oluşur. Tuz A'nın hidroklorik asit ile etkileşimi sırasında, sarı-yeşil bir gaz (basit bir madde) açığa çıkar ve tuz B oluşur, Tuz B, gümüş nitrat çözeltisi ile etkileşime girdiğinde beyaz bir çökelti oluşur. Tarif edilen reaksiyonların denklemlerini yazın.
10) Isıtılmış konsantre sülfürik aside bakır talaşları ilave edildi ve oluşan gaz bir kostik soda çözeltisinden (fazla) geçirildi. Reaksiyon ürünü izole edildi, su içerisinde çözündürüldü ve reaksiyon sonucunda çözünen kükürt ile ısıtıldı. Nihai çözeltiye seyreltilmiş sülfürik asit ilave edildi. Tarif edilen reaksiyonların denklemlerini yazın.
11) Tuz konsantre sülfürik asit ile muamele edildi. Sonuçtaki tuz sodyum hidroksit ile muamele edilmiştir. Elde edilen ürün fazla kömür ile kalsine edildi. Bu durumda açığa çıkan gaz, bir klor katalizörü varlığında reaksiyona girdi. Tarif edilen reaksiyonların denklemlerini yazın.
12) Sodyum hidrojen ile reaksiyona girdi. Reaksiyon ürünü, su içerisinde çözündürüldü, klor ile reaksiyona giren bir gaz oluştu ve nihai çözelti, iki tuzun bir karışımını oluşturmak üzere ısıtıldığında klor ile reaksiyona sokuldu. Tarif edilen reaksiyonların denklemlerini yazın.
13) Sodyum fazla oksijenle yakıldı, elde edilen kristalli madde bir cam tüpe yerleştirildi ve içinden karbon dioksit geçirildi. Tüpten çıkan gaz toplandı ve atmosferinde yanmış fosfor. Nihai materyal, fazla sodyum hidroksit çözeltisi ile nötralize edildi. Tarif edilen reaksiyonların denklemlerini yazın.
14) Reaksiyon tamamlanana kadar ısıtıldığında sodyum peroksitin su ile etkileşimi ile elde edilen çözeltiye bir hidroklorik asit çözeltisi ilave edildi. Oluşan bir tuz çözeltisi inert elektrotlar ile elektroliz edildi. Anotta elektroliz ile üretilen gaz, bir kalsiyum hidroksit süspansiyonu içinden geçirildi. Tarif edilen reaksiyonların denklemlerini yazın.
15) Sülfür gazı, bir orta tuz oluşturmak üzere bir sodyum hidroksit çözeltisinden geçirildi. Nihai çözeltiye, sulu bir potasyum permanganat çözeltisi ilave edildi. Elde edilen çökelti ayrıldı ve üzerinde hidroklorik asit ile etki etti. Açığa çıkan gaz soğuk bir potasyum hidroksit çözeltisinden geçirildi. Tarif edilen reaksiyonların denklemlerini yazın.
16) Bir silika (IV) ve magnezyum metal karışımı kalsine edildi. Sonuçtaki basit madde konsantre bir sodyum hidroksit çözeltisi ile muamele edilmiştir. Açığa çıkan gaz ısıtılmış sodyum üzerinden geçirildi. Elde edilen madde suya yerleştirildi. Tarif edilen reaksiyonların denklemlerini yazın.
17) Lityumun azot ile etkileşiminin ürünü su ile muamele edildi. Elde edilen gaz, kimyasal reaksiyonların sona ermesine kadar bir sülfürik asit çözeltisinden geçirildi. Sonuçtaki çözelti bir baryum klorür çözeltisi ile muamele edilmiştir. Çözelti süzüldü ve süzüntü, bir sodyum nitrat çözeltisi ile karıştırıldı ve ısıtıldı. Tarif edilen reaksiyonların denklemlerini yazın.
18) Sodyum bir hidrojen atmosferinde ısıtıldı. Elde edilen maddeye su eklendiğinde, gaz gelişimi ve berrak bir çözelti oluşumu gözlenmiştir. Bakırın konsantre nitrik asit çözeltisi ile etkileşimi sonucunda elde edilen bu çözeltiden kahverengi gaz geçirildi. Tarif edilen reaksiyonların denklemlerini yazın.
19) Sodyum bikarbonat kalsine edildi. Elde edilen tuz su içinde çözüldü ve bir alüminyum çözeltisi ile karıştırıldı, sonuç olarak bir çökelti oluştu ve renksiz bir gaz açığa çıktı. Çökelti, fazla miktarda nitrik asit çözeltisi ile işlendi ve gaz, bir potasyum silikat çözeltisinden geçirildi. Tarif edilen reaksiyonların denklemlerini yazın.
20) Sodyum, kükürt ile kaynaştırıldı. Nihai bileşik, hidroklorik asit ile işlendi; çıkan gaz, tamamen kükürt dioksit ile reaksiyona sokuldu. Sonuçtaki malzeme konsantre nitrik asit ile muamele edilmiştir. Tarif edilen reaksiyonların denklemlerini yazın.
21) Sodyum fazla oksijenle yandı. Sonuçtaki madde su ile muamele edilmiştir. Elde edilen karışım kaynatıldı, ardından sıcak çözeltiye klor ilave edildi. Tarif edilen reaksiyonların denklemlerini yazın.
22) Potasyum bir azot atmosferinde ısıtıldı. Nihai madde, fazla miktarda hidroklorik asit ile işlendi, daha sonra nihai tuz karışımına bir kalsiyum hidroksit süspansiyonu ilave edildi ve ısıtıldı. Elde edilen gaz memnun radyant bakır oksit (II) geçirilmiş, tarif edilen reaksiyonların denklemlerini yazınız.
23) Potasyum bir klor atmosferinde yakıldı, elde edilen tuz fazla sulu bir gümüş nitrat çözeltisi ile muamele edildi. Oluşan çökelti süzüldü, süzüntü buharlaştırıldı ve karışım dikkatlice ısıtıldı. Nihai tuz, sulu bir bromin çözeltisi ile işlendi. Tarif edilen reaksiyonların denklemlerini yazın.
24) Lityum hidrojen ile reaksiyona girdi. Reaksiyon ürünü, su içerisinde çözündürüldü, brom ile reaksiyona giren bir gaz oluştu ve nihai çözelti, iki tuzun bir karışımını oluşturmak üzere ısıtıldığında klor ile reaksiyona sokuldu. Tarif edilen reaksiyonların denklemlerini yazın.
25) Sodyum havada yanmış. Elde edilen katı, oksijen ve tuz salınımı ile karbondioksiti emer. Son tuz, hidroklorik asit içerisinde çözündürüldü ve nihai çözeltiye, gümüş nitrat çözeltisi ilave edildi. Beyaz bir çökelti düştü. Tarif edilen reaksiyonların denklemlerini yazın.
26) Oksijen, bir ozonizerde elektrik boşalmasına maruz bırakıldı. Elde edilen gaz sulu bir potasyum iyodür çözeltisinden geçirildi, yanma ve solunumu destekleyen renk ve koku olmadan yeni bir gaz açıldı. Sodyum son gazın atmosferinde yakıldı ve bununla elde edilen katı karbon dioksit ile reaksiyona girdi. Tarif edilen reaksiyonların denklemlerini yazın.
I Bir grup.
1. N 2 + O 2 ![]() 2NO
2NO
2NO + O 2 \u003d 2NO 2
2N02 + 2NaOH \u003d NaN03 + NaN02 + H20
2NaNO 3 2NaNO 2 + O 2
2. 2NaCl ![]() 2Na + Cl 2
2Na + Cl 2
anotta katotta
2Na + O 2 \u003d Na202
2Na202 + 2CO2 \u003d 2Na 2C03 + O 2
Na2C03 + 2NH4Cl \u003d 2NaCl + C02 + 2NH3 + H20
3. NaHC03 + HN03 \u003d NaN03 + C02 + H20
2NaNO 3 2NaNO 2 + O 2
5NaNO 2 + 2KMnO 4 + 3H 2 SO 4 \u003d 5NaNO 3 + 2MnSO 4 + K 2 SO 4 + 3H 2 O
NaN03 + 4Zn + 7NaOH + 6H20 \u003d 4Na 2 + NH3
4,2H20 + 2 NaI ![]() H2 + 2 NaOH + I 2
H2 + 2 NaOH + I 2
2K + I 2 \u003d 2KI
8KI + 5H2S04 (kons.) \u003d 4K 2S04 + H2S + 4I2 + 4H20
3H 2 S + 2K2 CrO4 + 2H20 \u003d 2Cr (OH) 3 ↓ + 3S ↓ + 4KOH
5. 2NaCl ![]() 2Na + Cl 2
2Na + Cl 2
anotta katotta
2Na + O 2 \u003d Na202
Na202 + S02 \u003d Na2S04
Na2S04 + Ba (OH) 2 \u003d BaS04 ↓ + 2NaOH
6. P 4 + 3KOH + 3H20 \u003d 3KH 2P02 + PH3
2PH 3 + 4O 2 \u003d P205 + 3H20
P205 + 4NaOH \u003d 2Na 2 HPO 4 + H20


