14.08.2019
Aké sú spoločné vlastnosti chemických prvkov kovov. Kovy ako chemické prvky
Od útleho detstva sa stretávame s frázou, že taký predmet je vyrobený z kovu. Čo je kov?
Kovy sú istou skupinou chemických prvkov (ako aj ich zliatin), ktoré majú spoločné vlastnosti ako celá skupina, ako je zvýšená pevnosť, dobrá tepelná a elektrická vodivosť, ťažnosť, ťažnosť, kovový lesk.
Takmer 80% všetkých známych chemických prvkov patrí do kovov (96 zo 118).
Fyzikálne vlastnosti kovov
Všetky kovy, s výnimkou ortuti, sú zvyčajne pevné. Pokiaľ ide o tvrdosť, najjemnejším kovom je cézium (0,2 bodu na 10-bodovej Mohsovej stupnici). Najťažšie je volfrám. Jeho tvrdosť je 6 bodov. Tvrdosť železa je 4 body.
Teploty topenia (prechod do kvapalného stavu) kovov sa líšia: od - 39 ° pre ortuť do 3 410 ° pre volfrám. Všetky alkalické kovy majú nízke teploty topenia a zvyčajné sú cín a olovo. Môžu sa roztaviť aj doma na plynovom horáku. Väčšina kovov sa taví v špeciálnych peciach s vysokou teplotou.
Kvôli prítomnosti voľných mobilných elektrónov v kryštálových mriežkach kovov všetky dobre vedú elektrinu a teplo. Najlepšie vodiče elektriny z kovov sú striebro, meď a hliník. Nie je náhodou, že elektrické káble vyrábajú z posledných dvoch kovov.
S vynikajúcou tepelnou vodivosťou kovov sa často stretávame aj v každodennom živote. Aby sme vodu uvarili, nalejeme ju do kovovej panvice a položíme ju na sporák. Teng zahreje kov a kov prenáša takmer všetku tepelnú energiu do vody.
Chemické vlastnosti kovov
V priebehu chemických reakcií všetky kovy ľahko darujú svoje elektróny a pôsobia ako redukčné činidlá.
Takmer všetky kovy sú oxidované kyslíkom. Alkalické kovy (lítium, vápnik) reagujú s kyslíkom za normálnych podmienok. Oxidácia iných kovov kyslíkom vyžaduje zvýšenú teplotu. Napríklad, ak zahrievate medený drôt na oheň, med'a bude interagovať s kyslíkom zo vzduchu a zakryje sa čiernym filmom (oxid medi):
- 2Cu + 02 → 2CuO
Zlato a platina nereagujú s kyslíkom.
Z ostatných oxidačných činidiel reaguje chlór a síra s kovmi. Ak zmiešate piliny železa a prášok síry a zmes zahrievate, pred našimi očami dostaneme sulfid železa:
- Fe + S → FeS
Redukčná aktivita rôznych kovov je odlišná. Vo svojej činnosti sa kovy distribuujú takto:
- Li - K - Ba - Sr - Ca - Na - Mg - Al - Mn - Zn - Cr - Fe - Ca - Co - Ni - Sn - Pb - (H2) - Cu - Hg - Ag - Pt - Au.
Čím viac je kov v tejto rade vľavo, tým aktívnejší je. Predchádzajúci prvok môže kov posúvať doprava. Napríklad, ak sa do skúmavky umiestni kúsok železa s roztokom síranu meďnatého, potom sa pokryje hnedým povlakom (film medi):
- Fe + CuSO4 → FeSO4 + Cu
Kovy naľavo od vodíka (H2) ho môžu nahradiť kyselinou chlorovodíkovou. Ak sa časť zinku zníži na kyselinu chlorovodíkovú, vodík sa začne uvoľňovať:
- HCI + Zn → ZnCl2 + H2
Alkalické kovy ľahko reagujú s vodou. Ak sa kúsok sodíka vloží do nádoby s vodou, vodík sa bude uvoľňovať aktívne a vytvorí sa zásada:
- 2Na + 2H20 → 2NaOH + H2
Kovové aplikácie
Vďaka svojim prospešným vlastnostiam kovy pevne vstúpili do ľudského života. Človek využíva pevnosť kovov a robí z nich mŕtve telá budov (od malých pavilónov po veľké mrakodrapy), karosérie automobilov (osobné automobily, vagóny, lode, obrábacie stroje), ako aj pracovné časti rôznych nástrojov.
definícia
Byť v prírode
Vlastnosti kovov
Charakteristické vlastnosti kovov
Fyzikálne vlastnosti kovov
Chemické vlastnosti kovov
Mikroskopická štruktúra
Alkalické kovy
Všeobecné vlastnosti alkalických kovov
Chemické vlastnosti alkalických kovov
Výroba alkalických kovov
hydroxidy
uhličitany
rubídia
Kovy alkalických zemín
vápnik
stroncium
Prechodné kovy
Všeobecné vlastnosti prechodných prvkov
Kovové aplikácie
Stavebné materiály
Elektrické materiály
Materiály nástrojov
Príbeh
extraktívne hutníctvo
Kov je (názov pochádza z lat. metallum - baňa) - skupina prvkov s charakteristickými kovovými vlastnosťami, ako sú vysoká tepelná a elektrická vodivosť, pozitívny teplotný koeficient odporu, vysoká ťažnosť atď. Približne 70% všetkých chemických prvkov patrí do kovov.
Kov je











![]()





















![]()


![]()





Byť v prírode
Väčšina kovov je prítomná v prírode vo forme rúd a zlúčenín. Tvoria oxidy, sulfidy, uhličitany a ďalšie chemické zlúčeniny. Na získanie čistých kovov a ich ďalšiu aplikáciu je potrebné ich izolovať od rúd a vykonať čistenie. Ak je to potrebné, vykonáva sa legovanie a iné spracovanie kovov. Veda to študuje. hutníctvo, Metalurgia rozlišuje železné rudy (na základe žľaza) a farba (nie sú súčasťou balenia) železo, celkom asi 70 položiek). a platina sa vzťahujú aj na drahé kovy. Okrem toho sú v malom množstve prítomné v morskej vode, rastlinách, živých organizmoch (pričom zohrávajú dôležitú úlohu).
Je známe, že ľudské telo pozostáva z 3% z kovov. Najviac zo všetkých v našich bunkách je vápnik a sodík koncentrovaný v lymfatických systémoch. Horčík sa hromadí vo svaloch a nervovom systéme, meď - v pečeni, - v krvi.
Vlastnosti kovov
Kov je
Charakteristické vlastnosti kovov
Kovový lesk (s výnimkou jódu a uhlíka vo forme grafitu. Napriek jeho kovovému lesku sú kryštalický jód a grafit nekovy).
Dobrá elektrická vodivosť (okrem uhlíka).
Možnosť ľahkého obrábania.
Vysoká hustota (kovy sú zvyčajne ťažšie ako nekovy).
Vysoká teplota topenia (s výnimkou: ortuti, gália a alkalických kovov.)
Vysoká tepelná vodivosť
V reakciách sú vždy redukčnými činidlami.
Fyzikálne vlastnosti kovov
Všetky kovy (okrem ortuti a podmienečne) v pevnom stave sú v pevnom stave, ale majú rôznu tvrdosť. Alkalické kovy sa ľahko rezajú kuchynským nožom a kovy ako vanád, volfrám a chróm ľahko poškriabajú najtvrdšie a sklo. Nižšie je uvedená tvrdosť niektorých kovov na Mohsovej stupnici.
Teploty topenia sa pohybujú od -39 ° C (ortuť) do 3410 ° C (volfrám). Teplota topenia väčšiny kovov (s výnimkou alkalických kovov) je vysoká, ale napríklad niektoré „normálne“ kovy cín a olovomôže byť roztavený na konvenčných elektrických alebo plynových sporákoch.
V závislosti od hustoty sa kovy delia na svetlo (hustota 0,53 h 5 g / cm_) a ťažké (5 h 22,5 g / cm_). Najľahším kovom je lítium (hustota 0,53 g / cm_). V súčasnosti nie je možné pomenovať najťažší kov, pretože hustota osmium a irídia - dvoch najťažších kovov - je takmer rovnaká (približne 22,6 g / cm2 - presne dvakrát vyššia ako hustota) olovo) a je veľmi ťažké vypočítať ich presnú hustotu: na to musíte kovy úplne vyčistiť, pretože akékoľvek nečistoty ich hustotu znižujú.
Väčšina kovov je plast, to znamená, že kovový drôt sa môže ohnúť a nebude sa zlomiť. Je to kvôli posunutiu vrstiev atómov kovu bez prerušenia spojenia medzi nimi. Najplastnejšie sú zlato, striebro a meď, z zlato je možné vyrobiť fóliu s hrúbkou 0,003 mm, ktorá sa používa na zlátenie obchodných predmetov. Nie všetky kovy sú však tvárné. Drôt z zinok alebo cín drví sa pri ohnutí; po deformácii sa mangán a bizmut takmer nikdy neohýbajú, ale okamžite sa zlomia. Plasticita tiež závisí od čistoty kovu; Veľmi čistý chróm je teda veľmi plastický, ale kontaminovaný aj malými nečistotami je krehký a tvrdší.
Všetky kovy vedú elektrinu dobre; je to v dôsledku prítomnosti pohyblivých elektrónov pohybujúcich sa pod vplyvom elektrického poľa v ich kryštalických mriežkach. striebromeď a hliník majú najväčšiu elektrickú vodivosť; Z tohto dôvodu sa posledné dva kovy najčastejšie používajú ako materiál na drôty. Sodík má tiež veľmi vysokú elektrickú vodivosť, pokusy používať sodné vodiče vo forme tenkostenných rúr z nehrdzavejúcej ocele naplnených sodíkom sú známe v experimentálnych zariadeniach. Vzhľadom na nízku špecifickú hmotnosť sodíka, s rovnakým odporom, sú „drôty“ sodíka omnoho ľahšie ako meď a dokonca o niečo ľahšie ako hliník.
Vysoká tepelná vodivosť kovov tiež závisí od mobility voľných elektrónov. Preto je rad tepelných vodivostí podobný rade elektrických vodivostí a najlepší vodič tepla, napríklad elektrina, je. Sodík tiež nachádza využitie ako dobrý vodič tepla; je všeobecne známe napríklad použitie sodíka vo ventiloch automobilových motorov na zlepšenie ich chladenia.
Hladký povrch kovov odráža veľa svetla - tento jav sa nazýva kovový lesk. V práškovom stave však väčšina kovov stráca lesk; hliník a horčík si však zachováva lesk v prášku. Najviac odrážajúce svetlo, striebro a zrkadlá sú vyrobené z týchto kovov. Rhodium sa niekedy používa aj na výrobu zrkadiel, napriek jeho mimoriadne vysokej cene: vďaka oveľa vyššej tvrdosti a chemickej odolnosti ako striebro alebo dokonca paládium môže byť vrstva ródia oveľa tenšia ako striebro.
Farba väčšiny kovov je približne rovnaká - svetlo šedá s modrastým odtieňom. , meď a cézium, žltá, červená a svetlo žltá.
Chemické vlastnosti kovov
Kov je
Väčšina kovov má malé množstvo elektrónov na vonkajšej elektrónovej vrstve (1-3), takže vo väčšine reakcií pôsobia ako redukčné činidlá (to znamená, že „vracajú“ svoje elektróny)
1. Reakcie s jednoduchými látkami
Všetky kovy reagujú s kyslíkom, okrem zlata, platiny. Reakcia so striebrom nastáva pri vysokých teplotách, ale oxid strieborný sa prakticky netvorí, pretože je tepelne nestabilný. V závislosti od kovu môžu byť na výstupe oxidy, peroxidy, peroxidy:
4Li + O2 \u003d 2Li20 oxid lítny
2Na + O2 \u003d peroxid sodný Na2O2
K + O2 \u003d KO2 superoxid draselný
Na získanie oxidu z peroxidu sa peroxid redukuje kovom:
Na2O2 + 2Na \u003d 2Na20
Pri kovoch so strednou a nízkou aktivitou dochádza k reakcii pri zahrievaní:
3Fe + 2O2 \u003d Fe304
Iba najaktívnejšie kovy reagujú s dusíkom, iba lítium reaguje pri izbovej teplote a vytvára nitridy:
6Li + N2 \u003d 2Li3N
Pri zahrievaní:
3Ca + N2 \u003d Ca3N2
Všetky kovy reagujú so sírou okrem zlata a platina:
Železo reaguje s šedá po zahriatí vytvára sulfid:
S vodíkom reagujú iba najaktívnejšie kovy, to znamená kovy skupiny IA a IIA okrem Be. Reakcie sa uskutočňujú zahrievaním a tvoria sa hydridy. V reakciách kov pôsobí ako redukčné činidlo, oxidačný stav vodíka je -1:
S uhlíkom reagujú iba najaktívnejšie kovy. V tomto prípade sa tvoria acetylenidy alebo metanidy. Acetylenidy, keď reagujú s vodou, poskytujú acetylén, metanidy - metán.
2Na + 2C \u003d Na2C2
Na2C2 + 2H20 \u003d 2NaOH + C2H2
Doping je zavádzanie ďalších prvkov do taveniny, ktoré modifikujú mechanické, fyzikálne a chemické vlastnosti základného materiálu.
Mikroskopická štruktúra
Charakteristické vlastnosti kovov je možné pochopiť na základe ich vnútornej štruktúry. Všetky majú slabé spojenie elektrónov vonkajšej energetickej úrovne (inými slovami valenčné elektróny) s jadrom. Z tohto dôvodu vedie vytvorený potenciálny rozdiel vo vodiči k lavínovitému pohybu elektrónov (nazývaných vodivé elektróny) v kryštálovej mriežke. Zhromaždenie takýchto elektrónov sa často nazýva elektrónový plyn. Okrem elektrónov prispievajú k tepelnej vodivosti aj fonóny (vibrácie mriežky). Plasticita je spôsobená malou energetickou bariérou pohybu dislokácií a posunom kryštalografických rovín. Tvrdosť sa dá vysvetliť veľkým počtom štrukturálnych defektov (intersticiálne atómy atď.).
Vďaka ľahkému spätnému toku elektrónov je možná oxidácia kovov, čo môže viesť ku korózii a ďalšiemu zhoršeniu vlastností. Schopnosť oxidovať sa dá rozpoznať štandardnou sériou aktivity kovov. Táto skutočnosť potvrdzuje potrebu používať kovy v kombinácii s inými prvkami (zliatina, z ktorých najdôležitejšia je) oceľ), ich legovanie a nanášanie rôznych povlakov.
Pre presnejší opis elektronických vlastností kovov je potrebné použiť kvantovú mechaniku. Vo všetkých tuhých látkach s dostatočnou symetriou sa úrovne elektrónovej energie jednotlivých atómov prekrývajú a vytvárajú povolené pásma a pásmo tvorené valenčnými elektrónmi sa nazýva valenčné pásmo. Slabá väzba valenčných elektrónov v kovoch vedie k tomu, že valenčný pás v kovoch je veľmi široký a všetky valenčné elektróny nestačia na jeho úplné naplnenie.
Hlavným znakom takejto čiastočne naplnenej zóny je to, že aj pri minimálnom privedenom napätí vo vzorke začína reštrukturalizácia valenčných elektrónov, t. J. Prúdi elektrický prúd.
Rovnaká vysoká pohyblivosť elektrónov vedie k vysokej tepelnej vodivosti, ako aj k schopnosti zrkadliť elektromagnetické žiarenie (čo dáva kovom charakteristický lesk).
Alkalické kovy
Kov je
Alkalické kovy - prvky hlavnej podskupiny skupiny I periodického systému chemických prvkov DI Dmitrij Ivanovič Mendeleev: lítium Li, sodík Na, draslík K, rubidium Rb, cézium Cs a Francúzsko Fr. Tieto kovy sa nazývajú alkalické, pretože väčšina ich zlúčenín je rozpustná vo vode. V slovanskom jazyku „vylúhovanie“ znamená „rozpustiť“, a to určovalo názov tejto skupiny kovov. Keď sa alkalické kovy rozpustia vo vode, vytvárajú sa rozpustné hydroxidy nazývané alkálie.
Všeobecné vlastnosti alkalických kovov
V periodickom systéme okamžite nasledujú inertné plyny, a preto je prvkom štruktúry atómov alkalických kovov to, že obsahujú jeden elektrón na novej energetickej úrovni: ich elektronická konfigurácia je ns1. Je zrejmé, že valenčné elektróny alkalických kovov sa dajú ľahko odstrániť, pretože pre atóm je energeticky výhodné darovať elektrón a získať konfiguráciu inertného plynu. Preto sa všetky alkalické kovy vyznačujú redukčnými vlastnosťami. Potvrdzujú to nízke hodnoty ich ionizačných potenciálov (ionizačný potenciál atómu cézia je jedným z najnižších) a elektronegativita (EO).
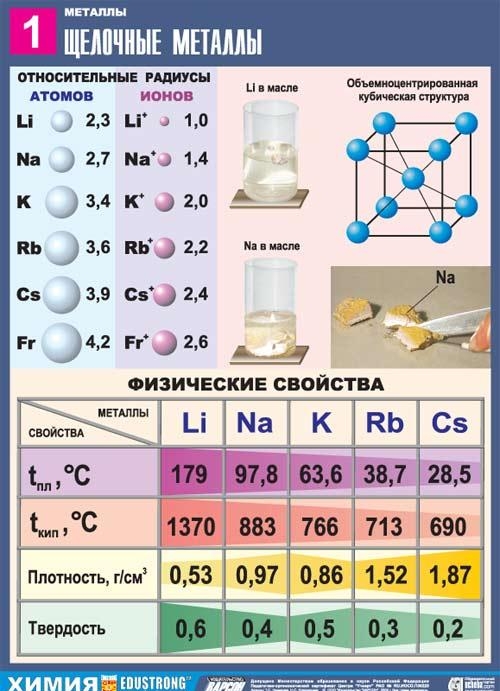
Všetky kovy tejto podskupiny majú strieborno-bielu farbu (s výnimkou strieborno-žltého cézia), sú veľmi mäkké, môžu sa rezať skalpelom. Lítium, sodík a draslík sú ľahšie ako voda a vznášajú sa na povrchu a reagujú s ním.
Alkalické kovy sa vyskytujú v prírode vo forme zlúčenín obsahujúcich jednotlivo nabité katióny. Mnoho minerálov obsahuje kovy hlavnej podskupiny skupiny I. Napríklad ortoklas alebo živec pozostáva z hlinitokremičitanu draselného K2 podobného minerálneobsahujúci sodík - albit - má zloženie Na2. Morská voda obsahuje chlorid sodný NaCl a pôda obsahuje draselné soli - sylvin KCl, sylvinit NaCl. KCl, karnallit KCl. MgCl2. 6H20, polygalit K2SO4. MgSO 4. CaSO4. 2H2O.
Chemické vlastnosti alkalických kovov
Kov je
Vďaka vysokej chemickej aktivite alkalických kovov, pokiaľ ide o vodu, kyslík, dusík, sa skladujú pod vrstvou petroleja. Na uskutočnenie reakcie s alkalickým kovom sa kúsok požadovanej veľkosti opatrne rozreže skalpelom pod vrstvou petrolejV argónovej atmosfére sa kovový povrch dôkladne vyčistí od produktov jeho interakcie so vzduchom a iba potom sa vzorka umiestni do reakčnej nádoby.
1. Interakcia s vodou. Dôležitou vlastnosťou alkalických kovov je ich vysoká aktivita vzhľadom na vodu. Lítium reaguje najmiernejšie (bez výbuchu) s vodou.
Pri podobnej reakcii sodík horí žltým plameňom a dochádza k malej explózii. Draslík je ešte aktívnejší: v tomto prípade je výbuch omnoho silnejší a plameň je sfarbený na fialovú farbu.
2. Interakcia s kyslíkom. Produkty spaľovania alkalických kovov vo vzduchu majú rôzne zloženie v závislosti od aktivity kovu.
Vo vzduchu horí iba lítium s tvorbou stechiometrického oxidu.
Pri horení sodíka sa peroxid Na2O2 tvorí hlavne s malou prímesou peroxidu sodného.
Produkty horenia draslíka, rubídia a cézia obsahujú hlavne superoxid.
Na získanie oxidov sodíka a draslíka sa zmesi hydroxidu, peroxidu alebo superoxidu zahrievajú nadbytkom kovu v neprítomnosti kyslíka.
Pre kyslíkové zlúčeniny alkalických kovov je typická nasledujúca pravidelnosť: so zvyšujúcim sa polomerom katiónu alkalického kovu sa zvyšuje stabilita kyslíkových zlúčenín obsahujúcich peroxidový ión O22 a superperoxidový ión O2–.
Pre ťažké alkalické kovy je charakteristická tvorba pomerne stabilných ozonidov v zložení EO3. Všetky kyslíkové zlúčeniny majú inú farbu, ktorej intenzita sa v sérii prehĺbi od Li po Cs.
Oxidy alkalických kovov majú všetky vlastnosti obsiahnuté v zásaditých oxidoch: reagujú s vodou, oxidmi kyselín a kyselinami.
Peroxidy a superoxidy majú vlastnosti silných oxidačných činidiel.
Peroxidy a superoxidy intenzívne interagujú s vodou a vytvárajú hydroxidy.
3. Liekové a iné interakcie. Alkalické kovy reagujú s mnohými nekovmi. Pri zahrievaní sa kombinujú s vodíkom za vzniku hydridov, s halogénmi, šedádusík, fosfor, uhlík a kremík za vzniku halogenidov, sulfidov, nitridov, fosfidov, karbidov a silicídov.
Pri zahrievaní sú alkalické kovy schopné reagovať s inými kovmi a vytvárať intermetalické zlúčeniny. Alkalické kovy s kyselinami reagujú aktívne (s explóziou).
Alkalické kovy sa rozpúšťajú v tekutom amoniaku a jeho derivátoch - amíny a amidy.
Keď sa alkalický kov rozpustí v tekutom amoniaku, stráca elektrón, ktorý je solvatovaný molekulami amoniaku a dáva roztoku modrú farbu. Výsledné amidy sa ľahko rozložia vodou za vzniku zásady a amoniaku.
Alkalické kovy interagujú s organickými látkami s alkoholmi (s tvorbou alkoholov) a karboxylovými kyselinami (s tvorbou solí).
4. Kvalitatívne stanovenie alkalických kovov. Pretože ionizačné potenciály alkalických kovov sú malé, keď sa kov alebo jeho zlúčeniny zahrievajú v plameni, atóm ionizuje, čím plameň zafarbí v určitej farbe.
Výroba alkalických kovov
1. Na výrobu alkalických kovov, najmä na elektrolýzu tavenín ich halogenidov, najčastejšie tvoria chloridy prírodné minerály:
katóda: Li + + e → Li
anóda: 2Cl- - 2e → Cl2
2. Niekedy sa na získanie alkalických kovov vykonáva elektrolýza ich hydroxidových tavenín:
katóda: Na + + e → Na
anóda: 4OH - 4e → 2H20 + O2
Pretože alkalické kovy v elektrochemickej sérii napätí sú naľavo od vodíka, nie je ich elektrolytická príprava zo soľných roztokov možná; v tomto prípade sa tvoria zodpovedajúce zásady a vodík.
hydroxidy
Na získanie hydroxidov alkalických kovov sa používajú hlavne elektrolytické metódy. Najrozsiahlejšia je výroba hydroxidu sodného elektrolýzou koncentrovaného vodného roztoku chloridu sodného.
Najprv sa alkálie získali výmennou reakciou.
Alkalická látka získaná týmto spôsobom bola silne kontaminovaná sódou Na2C03.
Hydroxidy alkalických kovov sú biele hygroskopické látky, ktorých vodné roztoky sú silné bázy. Zúčastňujú sa na všetkých reakciách charakteristických pre bázy - reagujú s kyselinami, kyslými a amfotérnymi oxidmi, amfotérnymi hydroxidmi.
Pri zahrievaní sa hydroxidy alkalických kovov sublimujú bez rozkladu, s výnimkou hydroxidu lítneho, ktorý sa podobne ako hydroxidy kovov hlavnej podskupiny skupiny II pri kalcinácii rozkladá na oxid a vodu.
Hydroxid sodný sa používa na výrobu mydiel, syntetických detergentov, umelých vlákien, organických zlúčenín, ako je fenol.
uhličitany
Dôležitým výrobkom z alkalických kovov je sóda Na2C03. Prevažná časť sódy na celom svete sa vyrába podľa metódy Solve, ktorá sa navrhuje už začiatkom 20. storočia. Podstata metódy je nasledovná: vodný roztok NaCl, ku ktorému sa pridá amoniak, sa nasýti oxidom uhličitým pri teplote 26 - 30 ° C. V tomto prípade sa tvorí ťažko rozpustný hydrogenuhličitan sodný, nazývaný jedlá sóda.
Amoniak sa pridáva na neutralizáciu kyslého prostredia, ktoré sa vyskytuje pri prechode oxidu uhličitého do roztoku a na výrobu iónu HCO3-bikarbonátu, ktorý je potrebný na vyzrážanie hydrogenuhličitanu sodného. Po oddelení pitnej sódy sa roztok obsahujúci chlorid amónny zahrieva vápnom a uvoľňuje sa amoniak, ktorý sa vracia do reakčnej zóny.
Pri metóde výroby amoniaku je teda jediným odpadom chlorid vápenatý, ktorý zostáva v roztoku a má obmedzené použitie.
Kalcinácia alebo premývanie, uhličitan sodný a oxid uhličitý, používané v procese výroby hydrogenuhličitanu sodného, \u200b\u200bsa získavajú kalcináciou hydrogenuhličitanu sodného.
Hlavným nákupcom sódy je sklo.
Na rozdiel od mierne rozpustnej kyslej soli hydrogenuhličitanu draselného je hydrogenuhličitan draselný KHCO3 vysoko rozpustný vo vode, preto sa uhličitan draselný alebo potaš vyrába K2CO3 pôsobením oxidu uhličitého na roztok hydroxidu draselného.
Potaš sa používa na výrobu skla a tekutého mydla.
Lítium je jediný alkalický kov, pre ktorý nebol získaný uhličitan. Dôvodom tohto javu je veľmi malý polomer lítiového iónu, ktorý mu neumožňuje držať pomerne veľký ión HCO3-.
lítium
Kov je
Lítium - prvok hlavnej podskupiny prvej skupiny, druhé obdobie periodického systému chemických prvkov D. I. Mendeleev Dmitrij Ivanovič, s atómovým číslom 3. Je označený symbolom Li (lat. Lithium). Jednoduchá látka lítium (CAS číslo: 7439-93-2) je mäkký alkalický kov strieborno-bielej farby.
Lítium objavil v roku 1817 švédsky chemik a mineralog A. Arfvedson, najskôr v minerálnom petalite (Li, Na) a potom v spodumene LiAl a lepidolite KLi1.5Al1.5 (F, OH) 2. Humphrey Davy prvýkrát dostal lítny kov v roku 1825.
Lítium dostalo svoje meno vďaka tomu, že sa nachádzalo v „kamenoch“ (grécky. Λίθος - kameň). Moderný názov pôvodne nazývaný „lítium“ navrhol Berzelius.
Lítium je strieborno-biely kov, mäkký a ťažný, tvrdší ako sodík, ale mäkší ako olovo. Môže sa spracovať lisovaním a valcovaním.
Pri izbovej teplote má lítny kov kubickú mriežku zameranú na telo (koordinačné číslo 8), ktorá sa po opracovaní za studena transformuje na kubickú tesnú mriežku, kde každý atóm s dvojitou kvádrovou koordináciou je obklopený 12 ďalšími. Pod 78 K je stabilná kryštalická forma šesťuholníková, úzko zbalená štruktúra, v ktorej má každý atóm lítia 12 najbližších susedov umiestnených vo vrcholoch kvádru.
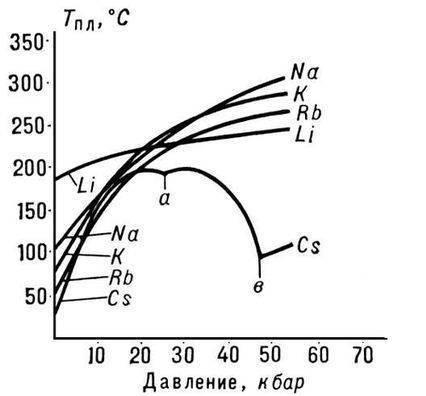
Zo všetkých alkalických kovov je lítium charakterizované najvyššou teplotou topenia a teplotou varu (180,54 a 1340 ° C), má najnižšiu hustotu pri izbovej teplote zo všetkých kovov (0,533 g / cm2, takmer polovica hustoty vody).
Malá veľkosť atómu lítia vedie k vzniku špeciálnych vlastností kovu. Napríklad sa zmieša so sodíkom iba pri teplotách pod 380 ° C a nemieša sa s roztaveným draslíkom, rubídiom a céziom, zatiaľ čo ostatné páry alkalických kovov sa spolu zmiešajú v akomkoľvek pomere.
Alkalický kov, nestabilný na vzduchu. Lítium je najmenej aktívny alkalický kov, pri izbovej teplote prakticky nereaguje so suchým vzduchom (a dokonca ani so suchým kyslíkom).
Vo vlhkom vzduchu sa pomaly oxiduje a premieňa sa na nitrid Li3N, hydroxid LiOH a uhličitan Li2CO3. Po zahriatí v kyslíku horí a premieňa sa na oxid Li2O. Je zaujímavé, že v rozsahu teplôt od 100 ° C do 300 ° C je lítium potiahnuté hustým oxidovým filmom a v budúcnosti nie je oxidované.
V roku 1818 nemecký chemik Leopold Gmelin zistil, že lítium a jeho soli zafarbujú karmínovo červený plameň, čo je kvalitatívnym znakom na stanovenie lítia. Teplota vznietenia je asi 300 ° C. Produkty horenia dráždia sliznicu nosohltanu.
Ticho, bez výbuchu a ohňa, reaguje s vodou a tvorí LiOH a H2. Reaguje tiež s etylalkoholom za vzniku alkoholátu, s amoniakom a halogénmi (s jódom - iba pri zahrievaní).
Lítium sa uchováva v petroléteri, parafíne, benzíne a / alebo minerálnom oleji v hermeticky uzavretých plechových boxoch. Kov lítia spôsobuje popáleniny na pokožke, slizniciach a v očiach.
V metalurgii železných a neželezných kovov sa lítium používa na deoxidáciu a zvýšenie tažnosti a pevnosti zliatin. Lítium sa niekedy používa na získavanie vzácnych kovov metalotermickými metódami.
Uhličitan lítny je najdôležitejšou pomocnou látkou (pridávanou do elektrolytu) pri tavení hliníka a jeho spotreba sa každý rok zvyšuje v pomere k objemu celosvetovej výroby hliníka (spotreba uhličitanu lítneho 2,5 až 3,5 kg na tonu taveného hliníka).
Zliatiny lítia so striebrom a zlatom, rovnako ako meď, sú veľmi účinnými spájkami. Zliatiny lítia s horčíkom, škandiom, meďou, kadmiom a hliníkom sú nové sľubné materiály v letectve a astronautike. Na základe hlinitanu a kremičitanu lítneho sa vytvorili keramiky, ktoré stvrdli pri izbovej teplote a použili sa vo vojenských zariadeniach, hutníctve av budúcnosti v termonukleárnej energii. Sklo je založené na kremičitane lítno-hlinitom vystuženom vláknami karbidu kremíka. Lítium veľmi účinne vytvrdzuje zliatiny olova a poskytuje im ťažnosť a odolnosť proti korózii.
Soli lítia majú psychotropný účinok a používajú sa v medicíne pri prevencii a liečení mnohých duševných chorôb. Najbežnejším v tejto kapacite je uhličitan lítny. používa sa v psychiatrii na stabilizáciu nálady ľudí trpiacich bipolárnou poruchou a častými výkyvmi nálad. Je účinný pri prevencii mánie kvôli depresii a redukuje samovraždy.Lekári opakovane pozorovali, že určité zlúčeniny lítia (samozrejme vo vhodných dávkach) majú pozitívny účinok na pacientov trpiacich manickou depresiou. Tento účinok je vysvetlený dvoma spôsobmi. Na jednej strane sa zistilo, že lítium je schopné regulovať aktivitu určitých enzýmov zapojených do prenosu sodných a draselných iónov z extracelulárnej tekutiny do mozgových buniek. Na druhej strane bolo pozorované, že ióny lítia priamo ovplyvňujú iónovú rovnováhu bunky. A stav pacienta do veľkej miery závisí od rovnováhy sodíka a draslíka: pre depresívnych pacientov je charakteristický nadbytok sodíka v bunkách, nedostatok - pre tých, ktorí trpia mániou. Vyrovnávajúce rovnováhu sodíka a draslíka majú soli lítia na tieto a iné pozitívne účinky.
sodík
Kov je
Sodík - prvok hlavnej podskupiny prvej skupiny, tretej skupiny perióda periodický systém chemických prvkov D. I. Dmitrij Ivanovič Mendeleev, s atómovým číslom 11. Je označený symbolom Na (lat. Natrium). Jednoduchá látka je sodík (CAS číslo: 7440-23-5) - mäkký alkalický kov strieborno-bielej farby.
Vo vode sa sodík správa rovnako ako lítium: reakcia prebieha rýchlym vývojom vodíka a v roztoku sa tvorí hydroxid sodný.
Sodík (alebo skôr jeho zlúčeniny) sa používa už od staroveku. Napríklad sóda (natron), ktorá sa prirodzene vyskytuje vo vodách jazier sódy v Egypte. Starí Egypťania používali prírodnú sódu na balzamovanie, bielenie plátna, varenie jedla, výrobu farieb a glazúr. Pliny starší píše, že v Níl delta sóda (tam bol dostatočný podiel nečistôt) bol izolovaný z riečnej vody. Predaj sa uskutočňoval vo forme veľkých kusov kvôli prímesi uhlia natretého sivou alebo čiernou farbou.
Sodík prvýkrát získal anglický chemik Humphrey Davy v roku 1807 elektrolýzou pevného NaOH.
Názov „sodík“ (natrium) pochádza z arabského natrónu (v gréčtine - nitrónu) a pôvodne sa týka prírodnej sódy. Prvok sám sa predtým nazýval sodík (lat. Sodium).

Sodík je strieborno-biely kov, v tenkých vrstvách s fialovým odtieňom, je plastový, dokonca mäkký (ľahko rezaný nožom), čerstvý plát sodíka sa leskne. Elektrická vodivosť a tepelná vodivosť sodíka sú pomerne vysoké, hustota je 0,96842 g / cm2 (pri 19,7 ° C), teplota topenia je 97,86 ° C a teplota varu je 883,15 ° C.
Alkalický kov vo vzduchu sa ľahko oxiduje. Na ochranu pred kyslíkom sa kovový sodík ukladá pod vrstvu petrolej, Sodík je menej aktívny ako lítium, preto reaguje s dusíkom iba pri zahrievaní:
Pri veľkom prebytku kyslíka sa vytvára peroxid sodný
2Na + 02 \u003d Na2O2
Sodík sa vo veľkej miere používa v preparatívnej chémii a priemysle priemysel ako silné redukčné činidlo, a to aj v metalurgii. Sodík sa používa na výrobu vysoko energeticky náročných sodíkových a sírových batérií. Používa sa tiež vo výfukových ventiloch nákladného vozidla ako chladič. Kovový sodík sa občas používa ako materiál pre elektrické vodiče určené pre veľmi vysoké prúdy.
V zliatine s draslíkom, ako aj s rubídiom a céziom sa používa ako vysoko účinné médium na prenos tepla. Najmä zliatina so zložením 12%, 47% draslíka, 41% cézia má rekordne nízku teplotu topenia -78 ° C a bola navrhnutá ako pracovná tekutina pre iónové raketové motory a ako chladivo pre jadrové elektrárne.
Sodík sa používa aj vo vysokotlakových a nízkotlakových výbojkách (NLVD a NLND). V pouličnom osvetlení sa veľmi často používajú žiarovky NLVD typu DNaT (Arc Sodium Tubular). Dávajú jasne žlté svetlo. Životnosť žiaroviek DNaT je 12 - 24 tisíc hodín. Preto sú výbojky typu DNaT nevyhnutné pre mestské, architektonické a priemyselné osvetlenie. Existujú tiež žiarovky DNaS, DNaMT (Arc Sodium Matte), DNaZ (Arc Sodium Mirror) a DNaTBR (Arc Sodium Tube without Mercury).
Kovový sodík sa používa pri kvalitatívnej analýze organických látok. Zliatina sodíka a testovaná látka sa neutralizujú etanolom, pridá sa niekoľko mililitrov destilovanej vody a rozdelí sa na 3 časti, J. Lassenya (1843), zamerané na stanovenie dusíka, síry a halogénov ( test Beilstein)
Chlorid sodný (stolová soľ) je najstaršie používané ochucujúce a konzervačné činidlo.
Azid sodný (Na3N) sa používa ako nitridačné činidlo v metalurgii a pri výrobe azidu olova.
Kyanid sodný (NaCN) sa používa pri hydrometalurgickej metóde lúhovania zlata z hornín, ako aj v nitrokarbonizačnej oceli a pri elektrolytickom pokovovaní (postriebrenie, zlátenie).
Chlorečnan sodný (NaClO3) sa používa na ničenie nežiaducej vegetácie na železničných tratiach.
draslík
Kaliy - prvok hlavnej podskupiny prvej skupiny, štvrtej perióda periodický systém chemických prvkov D. I. Mendeleev Dmitrij Ivanovič, s atómovým číslom 19. Je označený symbolom K (lat. Kalium). Jednoduchou látkou je draslík (CAS číslo: 7440-09-7) - mäkký alkalický kov strieborno-bielej farby.
Draslík sa v prírode vyskytuje iba v zlúčeninách s inými prvkami, napríklad v morskej vode, ako aj v mnohých mineráloch. Oxiduje veľmi rýchlo na vzduchu a veľmi ľahko chemicky reaguje, najmä s vodou, za vzniku alkálie. V mnohých ohľadoch sú chemické vlastnosti draslíka veľmi blízko sodíku, ale z hľadiska biologických funkcií a ich použitia bunkami živých organizmov sú stále odlišné.
Draslík (presnejšie jeho zlúčeniny) sa používa už od staroveku. Výroba potaše (ktorá sa používa ako detergent) už existovala v 11. storočí. Popol vznikajúci pri horení slamy alebo dreva bol spracovaný vodou a výsledný roztok (lúh) bol po filtrácii odparený. Suchý zvyšok obsahoval okrem uhličitanu draselného síran draselný K2SO4, sódu a chlorid draselný KCl.
V roku 1807 anglický chemik Davy izoloval draslík elektrolýzou pevného hydroxidu draselného (KOH) a nazval ho „draslík“ (latinský draslík; tento názov sa stále používa v angličtine, francúzštine, španielčine, portugalčine a poľštine). V roku 1809 navrhol L. V. Gilbert názov „draslík“ (lat. Kalium, z arabského al-kali - potaše). Tento názov vstúpil do nemeckého jazyka a odtiaľ do väčšiny jazykov severnej a východnej Európy (vrátane ruštiny) a „vyhral“ pri výbere symbolu pre tento prvok - K.
Draslík je strieborná látka s charakteristickým leskom na čerstvo vytvorenom povrchu. Veľmi ľahké a taviteľné. V ortuti sa pomerne dobre rozpúšťa a vytvára amalgámy. Draslík (ako aj jeho zlúčeniny), ktorý je zavedený do plameňa horáka, zafarbí plameň charakteristickou ružovo-fialovou farbou.
Draslík, podobne ako iné alkalické kovy, má typické kovové vlastnosti a je veľmi chemicky aktívny, ľahko uvoľňuje elektróny.
Je to silné redukčné činidlo. Aktívne sa kombinuje s kyslíkom, že nevytvára oxid, ale superoxid draselný KO2 (alebo K2O4). Pri zahrievaní vo vodíkovej atmosfére sa vytvára hydrid draselný KH. Dobre interaguje so všetkými nekovmi, tvoriac halogenidy, sulfidy, nitridy, fosfidy atď., Ako aj so zložitými látkami, ako je voda (reakcia prebieha s explóziou), rôznymi oxidmi a soľami. V tomto prípade redukujú ostatné kovy do voľného stavu.
Draslík sa uchováva pod vrstvou petroleja.
Kvapalina zliatiny draslíka a sodíka pri izbovej teplote sa používa ako chladivo v uzavretých systémoch, napríklad v atómových elektrárňach s rýchlym neutrónom. Ďalej sa široko používajú jej tekuté zliatiny s rubídiom a céziom. Zliatina sodíka je 12%, draslíka 47%, cézia 41% má rekordne nízku teplotu topenia -78 ° C.
Zlúčeniny draslíka sú najdôležitejšou živinou, a preto sa používajú ako hnojivá.
Draselné soli sa široko používajú pri elektrolytickom pokovovaní, pretože napriek relatívne vysokým nákladom sú často rozpustnejšie ako zodpovedajúce sodné soli, a preto poskytujú intenzívnu činnosť elektrolytov pri vysokých prúdových hustotách.
Draslík je nevyhnutnou živinou, najmä vo svete rastlín. Pri nedostatku draslíka v pôde sa rastliny vyvíjajú veľmi zle a klesajú, takže asi 90% extrahovaných draselných solí sa používa ako hnojivo.
Draslík spolu s dusíkom a fosforom patria medzi hlavné prvky výživy rastlín. Funkcia draslíka v rastlinách, ako aj ďalšie potrebné prvky, je prísne špecifická. V rastlinách je draslík v iónovej forme. Draslík sa nachádza hlavne v cytoplazme a vo vakuolách buniek. Asi 80% draslíka je v bunkovej šťave.
Funkcia draslíka je veľmi rôznorodá. Zistilo sa, že stimuluje normálny priebeh fotosyntézy, zvyšuje odtok uhľohydrátov z čepelí listov do iných orgánov, ako aj syntézu cukrov.
Draslík zvyšuje hromadenie monosacharidov v ovocných a zeleninových plodinách, zvyšuje obsah cukru v koreňových kultúrach, škrob v zemiakoch, zahusťuje bunkové steny slamiek obilnín a zvyšuje odolnosť chleba voči prenocovaniu a zlepšuje kvalitu vlákniny v ľane a konope.
Draslík prispieva k akumulácii uhľohydrátov v rastlinných bunkách a zvyšuje osmotický tlak bunkovej šťavy, a tým zvyšuje odolnosť rastlín proti chladu a mrazu.
Draslík je absorbovaný rastlinami vo forme katiónov a samozrejme zostáva v tejto forme v bunkách, čím aktivuje najdôležitejšie biochemické látky. procesy v rastlinných bunkách draslík zvyšuje odolnosť proti rôznym chorobám, a to tak počas vegetačného obdobia, ako aj po zbere úrody, čím sa výrazne zlepšuje kvalita ovocia a zeleniny.
Nedostatok draslíka spôsobuje v rastlinách veľa metabolických porúch, aktivita mnohých enzýmov je oslabená, metabolizmus uhľohydrátov a bielkovín je narušený a náklady uhľohydráty na dýchanie. Výsledkom je, že produktivita rastlín sa znižuje, znižuje sa kvalita výrobkov.



rubídia
Rubidium je prvkom hlavnej podskupiny prvej skupiny, piateho obdobia periodického systému chemických prvkov DI Dmitrija Ivanoviča Mendeleeva, s atómovým číslom 37. Je označený symbolom Rb (lat. Rubidium). Jednoduchou látkou je rubídium (CAS číslo: 7440-17-7) - mäkký alkalický kov strieborno-bielej farby.
V roku 1861 nemeckí vedci Robert Wilhelm Bunsen a Gustav Robert Kirchhoff, študujúci prírodné aluminosilikáty pomocou spektrálnej analýzy, objavili v nich nový prvok, neskôr nazývaný rubídium farbou najsilnejších čiar spektra.
Rubidium vytvára strieborne biele mäkké kryštály, ktoré majú na čerstvom reze kovový lesk. Tvrdosť podľa Brinella 0,2 Mn / ml (0,02 kgf / mm2). Kryštálová mriežka Rubidium sa sústreďuje na kubický objem, а \u003d 5,71 Е (pri izbovej teplote). Atómový polomer je 2,48 E, polomer iónu je Rb + 1,49 E. Hustota je 1,525 g / cm2 (0 ° C), teplota topenia 38,9 ° C, teplota topenia 703 ° C. Merné teplo je 335,2 j / (kg · K), tepelný koeficient lineárnej expanzie je 9,0 · 10-5 deg-1 (0-38 ° С), modul pružnosti je 2,4 GN / m² (240 kgf / mm²), merný elektrický odpor merný objem 11,29 · 10-6 ohm · cm (20 ° C); rubídium je paramagnetické.
Alkalický kov, extrémne nestabilný na vzduchu (reaguje so vzduchom v prípade prítomnosti vody so zapálením). Tvorí všetky typy solí - väčšinou rozpustné (chlorečnany a chloristany sú mierne rozpustné). Hydroxid rubídia je veľmi agresívna látka na sklo a iné štrukturálne a kontajnerové materiály a roztavená látka ničí väčšinu kovov (dokonca aj platiny).
Použitie rubídia je rôznorodé a napriek tomu, že vo viacerých svojich oblastiach použitia je vo svojich najdôležitejších fyzikálnych vlastnostiach horšie ako cézium, tento vzácny alkalický kov však zohráva dôležitú úlohu v moderných technológiách. Môžu sa zaznamenať tieto aplikácie rubídia: katalýza, elektronická priemysel, špeciálna optika, atómová, medicína.
Rubidium sa používa nielen v čistej forme, ale aj vo forme mnohých zliatin a chemických zlúčenín. Je dôležité poznamenať, že rubídium má veľmi dobrú a priaznivú surovinovú základňu, ale situácia s dostupnosťou zdrojov je omnoho priaznivejšia ako v prípade cézia a rubídia môže zohrávať ešte dôležitejšiu úlohu, napríklad pri katalýze (kde sa úspešne osvedčila).
Izotop rubídia-86 sa široko používa pri inšpekciách, meracích zariadeniach, ako aj pri sterilizácii mnohých dôležitých liekov a potravinárskych výrobkov. Rubidium a jeho zliatiny s céziom sú veľmi sľubným chladiacim a pracovným médiom pre vysokoteplotné turbínové jednotky (v tomto ohľade sa rubidium a cézium stali dôležitými v posledných rokoch a extrémne vysoké náklady na kovy sú odsunuté do pozadia v súvislosti s možnosťami prudkého zvýšenia účinnosti turbínových jednotiek, čo znamená a nižšie výdavky znečistenie paliva a životného prostredia). Najčastejšie používanými systémami na báze rubídia ako nosičmi tepla sú ternárne zliatiny: sodík - draslík - rubídium a sodík - rubídium - cézium.
Pri katalýze sa rubídium používa v organickej aj anorganickej syntéze. Katalytická aktivita rubídia sa používa hlavne na rafináciu mnohých dôležitých produktov. Napríklad acetát rubídia sa používa na syntézu metanolu a niekoľkých vyšších alkoholov z vodného plynu, čo je mimoriadne dôležité v súvislosti s podzemným splyňovaním uhlia a výrobou umelých kvapalných palív pre osobné automobily a prúdové palivá. Niekoľko zliatin rubídia s telúrom má vyššiu citlivosť v ultrafialovej oblasti spektra ako zlúčeniny cézia, a v tomto ohľade je v tomto prípade schopná konkurovať céziu-133 ako materiálu pre fotokonvertory. Ako súčasť špeciálnych mazacích zmesí (zliatin) sa rubídium používa ako vysoko účinné mazivo vo vákuu (raketová a kozmická technológia).
Hydroxid rubídia sa používa na prípravu elektrolytu na nízkoteplotný ChIT, ako aj ako prísada do roztoku hydroxidu draselného na zlepšenie jeho účinnosti pri nízkych teplotách a zvýšenie vodivosti elektrolytu. V palivových článkoch z hydridu sa používa kovové rídium.
Chlorid rídia v zliatine s chloridom meďnatým sa používa na meranie vysokých teplôt (do 400 ° C).
Rubidiová plazma sa používa na excitáciu laserového žiarenia.
Chlorid rubídia sa používa ako elektrolyt v palivových článkoch, to isté možno povedať o hydroxide rubidium, ktorý je veľmi účinný ako elektrolyt v palivových článkoch pomocou priamej oxidácie uhlia.
cézium
Cesium je prvkom hlavnej podskupiny prvej skupiny, šiestej periódy periodického systému chemických prvkov DI Mendeleeva Dmitrija Ivanoviča, s atómovým číslom 55. Je označený symbolom Cs (lat. Cesium). Jednoduchou látkou je cézium (CAS číslo: 7440-46-2) - mäkký alkalický kov strieborožltej farby. Cesium dostal meno pre prítomnosť dvoch jasne modrých čiar v emisnom spektre (od lat. Caesius - sky blue).
Cesium objavili v roku 1860 nemeckí vedci R. Bunsen a G. R. Kirchhoff vo vodách minerálneho prameňa Dürhheim v Nemecku prostredníctvom optickej spektroskopie, čím sa stali prvými prvkami objavenými spektrálnou analýzou. Vo svojej čistej forme bolo cézium prvýkrát izolované v roku 1882 švédskym chemikom K. Setterbergom počas elektrolýzy taveniny zmesi kyanidu cézneho (CsCN) a bária.
Hlavnými céznymi minerálmi sú pollucit a veľmi zriedkavý avogadrit (K, Cs). Okrem toho je cézium vo forme nečistôt obsiahnuté v množstve hlinitokremičitanov: lepidolit, phlogopit, biotit, amazonit, petalit, beryl, cinnalit, leucit, karnallit. Ako priemyselné suroviny sa používajú pollucit a lepidolit.
V priemyselnej výrobe cézia vo forme zlúčenín sa extrahuje z minerálneho pollucitu. Toto sa uskutočňuje otváraním chloridu alebo síranu. Prvý zahrnuje ošetrenie východiskového minerálu zahrievanou kyselinou chlorovodíkovou, pridanie chloridu antimonitého SbCl3 na vyzrážanie zlúčeniny Cs3 a premytie horúcou vodou alebo roztokom amoniaku za vzniku chloridu cézneho CsCl. V druhom prípade sa na ňu pôsobí zahrievanou kyselinou sírovou, pričom vznikne kamenec hlinitý cézny CsAl (S04) 2. 12H20.
V Ruskej federácii sa po rozpade ZSSR priemyselná výroba pololucitu nerealizovala, hoci kolosálne zásoby nerastných surovín boli objavené vo Voronojskej tundre pri Murmansku v sovietskych časoch. Keď sa ruský priemysel dokázal postaviť, ukázalo sa, že kanadská licencia získala licenciu na rozvoj tejto oblasti. V súčasnosti sa spracovanie a extrakcia céznych solí z pollucitov uskutočňuje v Novosibirsku v závode na výrobu vzácnych kovov ZAO.
Na výrobu cézia existuje niekoľko laboratórnych metód. Dá sa získať:
zahrievanie zmesi chróm alebo céziumdichromát so zirkónom vo vákuu;
rozklad azidu cézneho vo vákuu;
zahrievanie zmesi chloridu cézneho a osobitne pripraveného vápnika.
Všetky metódy sú časovo náročné. Druhý vám umožňuje získať vysoko čistý kov, ale je výbušný a vyžaduje implementáciu niekoľko dní.
Aplikácia Cesium našla uplatnenie až na začiatku 20. storočia, keď boli objavené jej minerály a bola vyvinutá technológia na jej výrobu. V súčasnosti sa cézium a jeho zlúčeniny používajú v elektronike, rádiu, elektro, röntgenoch, chemickom priemysle, optike, medicíne, jadrovej energii. Používa sa väčšinou stabilné prírodné cézium-133 av obmedzenej miere jeho rádioaktívny izotop cézium-137 extrahovaný zo súčtu štiepnych fragmentov uránu, plutónia a tória v reaktoroch jadrových elektrární.
Kovy alkalických zemín
Kovy alkalických zemín sú chemické prvky: vápnik Ca, stroncium Sr, bárium Ba, rádium Ra (niekedy sa berylium Be a horčík Mg tiež mylne označujú ako kovy alkalických zemín). Nazývajú sa to preto, lebo ich oxidy - „zeminy“ (v terminológii alchymistov) - dodávajú vode zásaditú reakciu. Soli kovov alkalických zemín, s výnimkou rádia, sú v prírode široko distribuované vo forme minerálov.
vápnik
Vápnik je prvkom hlavnej podskupiny druhej skupiny, štvrtej periódy periodického systému chemických prvkov DI Dmitrija Ivanoviča Mendeleeva, s atómovým číslom 20. Je označený symbolom Ca (lat. Calcium). Jednoduchá vápniková látka (CAS číslo: 7440-70-2) je mäkký, chemicky aktívny kov alkalických zemín strieborno-bielej farby.
Vápnikový kov existuje v dvoch alotropických modifikáciách. Až do 443 ° C je a-Ca stabilný s kubickou tvárou orientovanou mriežkou (parameter a \u003d 0,558 nm), P-Ca je stabilný s kubickou mriežkou zameranou na telo typu a-Fe (parameter a \u003d 0,448 nm). Štandardná entalpia A0o a → p prechodu je 0,93 kJ / mol.
Vápnik je typický kov alkalických zemín. Reaktivita vápnika je vysoká, ale nižšia ako všetky ostatné kovy alkalických zemín. Ľahko interaguje s kyslíkom, oxidom uhličitým a vzdušnou vlhkosťou, a preto je povrch kovového vápnika obvykle šedý, takže vápnik sa zvyčajne uchováva v laboratóriu, podobne ako iné kovy alkalických zemín, v tesne uzatvorenej nádobe pod vrstvou petroleja alebo tekutého parafínu.
Medzi štandardnými potenciálmi je vápnik umiestnený naľavo od vodíka. Štandardný elektródový potenciál dvojice Ca2 + / Ca0 je 2,84 V, takže vápnik aktívne reaguje s vodou, ale bez zapálenia:
Ca + 2H20 \u003d Ca (OH) 2 + H2 + Q.
Pri aktívnych nekovoch (kyslík, chlór, bróm) vápnik reaguje za normálnych podmienok:
2Ca + O2 \u003d 2CaO, Ca + Br2 \u003d CaBr2.
Pri zahrievaní na vzduchu alebo v kyslíku sa vápnik vznieti. Pri menej aktívnych nekovoch (vodík, bór, uhlík, kremík, dusík, fosfor a iné) vápnik pri zahrievaní interaguje, napríklad:
Ca + H2 \u003d CaH2, Ca + 6B \u003d CaB6,
3Ca + N2 \u003d Ca3N2, Ca + 2C \u003d CaC2,
3Ca + 2P \u003d Ca3P2 (fosfid vápenatý); sú tiež známe fosfidy vápnika v kompozíciách CaP a CaP5;
2Ca + Si \u003d Ca2Si (silicíd vápenatý), sú tiež známe silicidy vápnika z kompozícií CaSi, Ca3Si4 a CaSi2.
Priebeh vyššie uvedených reakcií je zvyčajne sprevádzaný uvoľňovaním veľkého množstva tepla (to znamená, že tieto reakcie sú exotermické). Vo všetkých zlúčeninách s nekovmi je oxidačný stav vápnika +2. Väčšina zlúčenín vápnika s nekovmi sa ľahko rozloží vodou, napríklad:
CaH2 + 2H20 \u003d Ca (OH) 2 + 2H2,
Ca3N2 + 3H20 \u003d 3Ca (OH) 2 + 2NH3.
Ión Ca2 + je bezfarebný. Keď sa do plameňa dostanú rozpustné vápenaté soli, plameň zmení farbu na tehlovú.
Vápnikové soli, ako je chlorid vápenatý, bromid vápenatý, jodid vápenatý a dusičnan vápenatý, sú ľahko rozpustné vo vode. Nerozpustný vo vode je fluorid CaF2, uhličitan vápenatý, síran vápenatý, ortofosforečnan vápenatý (Ca4O2), oxalát CaC204 a niektoré ďalšie.
Dôležitá je skutočnosť, že na rozdiel od uhličitanu vápenatého CaCO3 je kyslý uhličitan vápenatý (hydrogenuhličitan) Ca (HCO3) 2 rozpustný vo vode. V podstate to vedie k nasledujúcim procesom. Keď studený dážď alebo rieková voda nasýtená oxidom uhličitým preniká do podzemia a vstupuje do vápencov, pozoruje sa ich rozpustenie:
CaC03 + C02 + H20 \u003d Ca (HCO3) 2.
Na tých istých miestach, kde voda nasýtená hydrogenuhličitanom vápenatým prichádza na zemský povrch a je zahrievaná slnkom, dochádza k spätnej reakcii:
Ca (HCO3) 2 \u003d CaC03 + C02 + H20.
Takže v prírode dochádza k prenosu veľkých množstiev látok. Výsledkom je, že sa v podzemí môžu vytvoriť obrovské medzery a v jaskyniach sa vytvoria krásne kamenné „cencúle“ - stalaktity a stalagmity.
Prítomnosť rozpusteného hydrogenuhličitanu vápenatého vo vode do značnej miery určuje dočasnú tvrdosť vody. Nazýva sa dočasný, pretože keď sa voda uvarí, uhľovodík sa rozkladá a zráža sa CaCO3. Tento jav napríklad vedie v priebehu času k tvorbe vodného kameňa v kanvici.
stroncium
Stroncium - prvok hlavnej podskupiny druhej skupiny, piate obdobie periodického systému chemických prvkov D. I. Mendeleev Dmitrij Ivanovič, s atómovým číslom 38. Je označený symbolom Sr (lat. Strontium). Jednoduchá látka stroncia (CAS číslo: 7440-24-6) je mäkký, poddajný a tažný kov alkalických zemín strieborno-bielej farby. Má vysokú chemickú aktivitu, rýchlo reaguje s vlhkosťou a kyslíkom vo vzduchu a zakryje sa vrstvou žltého oxidu.
V minerálnom strontianite sa našiel nový prvok, ktorý sa našiel v roku 1764 v olovenej bani pri škótskej dedine Stronshian, ktorá neskôr pomenovala nový prvok. Prítomnosť nového oxidu kovu v tomto mineráli zistili takmer 30 rokov neskôr William Kruykshenk a Ader Crawford. V čistej forme ho pridelil sir Humphrey Davy v roku 1808.
Stroncium - mäkký strieborno-biely kov, má ťažnosť a ťažnosť, ľahko sa rezá nožom.
Polymorfné - sú známe tri jeho modifikácie. Do 215 ° C je kubická tvárou zameraná modifikácia (a-Sr) stabilná medzi 215 a 605 ° C - hexagonálna (ß-Sr), nad 605 ° C - kubická objemovo orientovaná modifikácia (y-Sr).
Teplota topenia - 768 ° C, teplota varu - 1390 ° C.
Stroncium vo svojich zlúčeninách vždy vykazuje +2 valenciu. Stroncium je svojimi vlastnosťami blízke vápniku a báriu, pričom medzi nimi zaujíma medzipolohu.
V elektrochemickej sérii stresov patrí stroncium medzi najaktívnejšie kovy (jeho normálny elektródový potenciál je –2,89 V. Energeticky reaguje s vodou za vzniku hydroxidu:
Sr + 2H20 \u003d Sr (OH) 2 + H2
Interaguje s kyselinami, odstraňuje ťažké kovy z ich solí. Pri koncentrovaných kyselinách (H2SO4, HNO3) reaguje slabo.
Kovové stroncium rýchlo oxiduje vo vzduchu a vytvára žltkastý film, v ktorom sú okrem oxidu SrO vždy prítomné peroxid Sr02 a nitrid Sr3N2. Pri zahrievaní na vzduchu sa zapáli, práškové stroncium vo vzduchu je náchylné na samovznietenie.
Intenzívne reaguje s nekovmi - síra, fosfor, halogény. Interaguje s vodíkom (nad 200 ° C), dusíkom (nad 400 ° C). Prakticky nereaguje s alkáliami.
Pri vysokých teplotách reaguje s CO2 za vzniku karbidu:
5Sr + 2CO2 \u003d SrC2 + 4SrO
Mierne rozpustné soli stroncia s aniónmi Cl-, I-, NO3-. Soli s aniónmi F-, SO42-, CO32-, PO43- sú mierne rozpustné.
Stroncium sa používa na legovanie meďnatého hliníka a niektorých jeho zliatin, na zavádzanie do olovených zliatin batérií, na odsírenie liatiny, mália a ocele.
bárium
Barium je prvkom hlavnej podskupiny druhej skupiny, šiestej periódy periodického systému chemických prvkov DI Dmitrija Ivanoviča Mendeleeva, s atómovým číslom 56. Je označený symbolom Ba (lat. Barium). Jednoduchou látkou je bárium (CAS číslo: 7440-39-3) - mäkký, kujný kov alkalických zemín strieborno-bielej farby. Má vysokú chemickú aktivitu.
Barium objavil ako oxid BaO v roku 1774 Karl Scheele. V roku 1808 anglický chemik Humphrey Davy získaný elektrolýzou vlhkého hydroxidu bárnatého s ortuťovou katódou amalgám bárnatý; Po odparení ortuti izoloval po zahriatí kovové bárium.
Barium je striebro-biely kujný kov. Keď dôjde k prudkému úderu. Existujú dve alotrópne modifikácie bária: do 375 ° C je α-Ba stabilná s kubickou mriežkou zameranou na kubické telo (parameter a \u003d 0,501 nm); vyššia, β-Ba je stabilná.
Tvrdosť v mineralogickom meradle 1,25; na Mohsovej stupnici 2.
Kovové bárium sa skladuje v petroleji alebo pod vrstvou parafínu.
Bárium je kov alkalických zemín. Intenzívne sa oxiduje na vzduchu, pričom tvorí oxid bárnatý BaO a nitrid bária Ba3N2 a pri miernom zahrievaní sa zapaľuje. Intenzívne reaguje s vodou za vzniku hydroxidu bárnatého Ba (OH) 2:
Ba + 2H20 \u003d Ba (OH) 2 + H2
Aktívne interaguje so zriedenými kyselinami. Mnoho solí bária je vo vode nerozpustných alebo mierne rozpustných: síran bárnatý BaSO4, siričitan bárnatý BaSO3, uhličitan bárnatý BaCO3, fosforečnan bárnatý Ba3 (PO4) 2. Sulfid bárnatý BaS je na rozdiel od síranu vápenatého CaS vo vode veľmi dobre rozpustný.
Ľahko reaguje s halogénmi za vzniku halogenidov.
Pri zahrievaní vodíkom vytvára hydrid bárnatý BaH2, ktorý zase s LiH hydridom lítnym poskytuje Li komplex.
Reakcia pri zahrievaní s amoniakom:
6Ba + 2NH3 \u003d 3BaH2 + Ba3N2
Nitrid bárnatý Ba3N2 po zahriatí reaguje s CO a vytvára kyanid:
Ba3N2 + 2CO \u003d Ba (CN) 2 + 2BaO
S kvapalným amoniakom sa získa tmavomodrý roztok, z ktorého sa dá amoniak izolovať, ktorý má zlatý lesk a ľahko sa rozkladá s odstránením NH3. V prítomnosti platinového katalyzátora sa amoniak rozkladá za vzniku amidu bárnatého:
Ba (NH2) 2 + 4NH3 + H2
Karbid bária BaC2 sa môže získať zahrievaním v uhoľnej peci BaO.
Tvorí fosfor Ba3P2 s fosforom.
Bárium redukuje oxidy, halogenidy a sulfidy mnohých kovov na zodpovedajúci kov.
Kov bária, často v zliatine s hliníkom, sa používa ako getr (getr) vo vysoko vákuových elektronických zariadeniach a tiež sa pridáva spolu so zirkóniom do tekutých chladiacich látok kovov (sodík, draslík, rubídium, lítium, zliatiny cézia) na zníženie agresivity na potrubia av hutníctve.
Prechodné kovy
Prechodné kovy (prechodné prvky) sú prvky vedľajších podskupín periodickej tabuľky chemických prvkov D. I. Mendeleeva Dmitrija Ivanoviča, v atómoch ktorých sa elektróny vyskytujú na d- a f-orbitaloch. Všeobecne možno elektronickú štruktúru prechodných prvkov znázorniť takto: Ns obežníky obsahujú jeden alebo dva elektróny, zvyšné valenčné elektróny sú umiestnené na obežných dráhach. Pretože počet valenčných elektrónov je výrazne menší ako počet orbitálov, jednoduchými látkami tvorenými prechodnými prvkami sú kovy.
Všeobecné vlastnosti prechodných prvkov
Všetky prechodné prvky majú nasledujúce spoločné vlastnosti:
Malé hodnoty elektronegativity.
Variabilné oxidačné stavy. Pre takmer všetky d-prvky, v ktorých atómy sú na vonkajšom ns-podúrovni 2 valenčné elektróny, je známy oxidačný stav +2.
Vychádzajúc z d-prvkov skupiny III periodickej tabuľky chemických prvkov D. I. Dmitrije Ivanoviča Mendeleeva, prvky v stave nižšej oxidácie tvoria zlúčeniny, ktoré vykazujú základné vlastnosti, v najvyššej kyslej, v medziprodukte - amfotérne.
železo
Železo je prvkom bočnej podskupiny ôsmej skupiny štvrtej periódy periodického systému chemických prvkov DI Mendeleeva Dmitrija Ivanoviča, atómové číslo 26. Je označený symbolom Fe (lat. Ferrum). Jeden z najbežnejších kovov v zemskej kôre (druhé miesto po hliníku).
Jednoduché železo (CAS číslo: 7439-89-6) je striebro-biely kujný kov s vysokou chemickou reaktivitou: železo rýchlo koroduje pri vysokých teplotách alebo pri vysokej vlhkosti vzduchu. V čistom kyslíku horí železo a v jemne rozptýlenom stave sa spontánne vznieti vo vzduchu.
V skutočnosti sa železo obvykle nazýva jeho zliatiny s nízkym obsahom nečistôt (až do 0,8%), ktoré si zachovávajú mäkkosť a ťažnosť čistého kovu. V praxi sa však častejšie používajú zliatiny železa s uhlíkom: (do 2% uhlíka) a (viac ako 2% uhlíka), ako aj nehrdzavejúca (legovaná) oceľ s prísadami legujúcich kovov (chróm, mangán, Ni atď.). Kombinácia špecifických vlastností železa a jeho zliatin robí z neho „kov č. 1“ dôležitý pre človeka.
V prírode sa železo zriedka vyskytuje v čistej forme, najčastejšie sa vyskytuje v meteoritoch železa a niklu. Prevencia železa v zemskej kôre je 4,65% (4. miesto za O, Si, Al). Tiež sa predpokladá, že železo tvorí veľkú časť zemského jadra.




Železo je typický kov, vo voľnom stave je strieborno-biela so sivastým odtieňom. Čistý kov je plast, rôzne nečistoty (najmä uhlík) zvyšujú jeho tvrdosť a krehkosť. Má výrazné magnetické vlastnosti. Často emitujú takzvanú „trojicu železa“ - skupinu troch kovov (železo Fe, kobalt Co, ni Ni), ktoré majú podobné fyzikálne vlastnosti, atómové polomery a hodnoty elektronegativity.
Železo sa vyznačuje polymorfizmom a má štyri kryštalické modifikácie:
do 769 ° C existuje α-Fe (ferit) s kubickou mriežkou zameranou na telo a vlastnosťami feromagnetu (769 ° C ≈ 1043 K - Curieov bod pre železo)
v teplotnom rozmedzí 769 - 917 ° C existuje β-Fe, ktorý sa líši od α-Fe iba v parametroch kubickej mriežky zameranej na telo a magnetických vlastnostiach paramagnetu
v teplotnom rozmedzí 917–1394 ° C existuje γ-Fe (austenit) s kubickou mriežkou zameranou na tvár
nad 1394 ° C, 8-Fe je stabilný s objemovo centrovanou kubickou mriežkou
Metalurgia neizoluje β-Fe ako samostatnú fázu a považuje ju za druh α-Fe. Ak je železo alebo oceľ zahrievané nad Curieho bodom (769 ° C ≈ 1043 K), tepelný pohyb iónov narúša orientáciu magnetických momentov elektrónového odstreďovania, feromagnet sa stáva paramagnetom - vyskytuje sa fázový prechod druhého poriadku, ale nedochádza k fázovému prechodu prvého poriadku so zmenou základných fyzikálnych parametrov kryštálov.
Pre čisté železo pri normálnom tlaku z hutníckeho hľadiska existujú tieto stabilné úpravy:
Od absolútnej nuly do 910 ° C je a-modifikácia s kubickou mriežkou (bcc) kryštálovou mriežkou zameranou na telo stabilná. Pevný roztok uhlíka v a-železe sa nazýva ferit.
Od 910 do 1400 ° C je modifikácia γ s kubickou (fcc) krištáľovou mriežkou zameranou na tvár stabilná. Pevný roztok uhlíka v y-železe sa nazýva austenit.
Od 910 do 1539 ° C je δ-modifikácia s kubickou (bcc) kryštalickou mriežkou zameranou na telo stabilná. Pevný roztok uhlíka v ô-železe (ako aj v a-železe) sa nazýva ferit. Niekedy sa rozlišujú vysokoteplotné ô-ferity a a-ferity s nízkou teplotou (alebo len ferity), aj keď ich atómové štruktúry sú rovnaké.
Prítomnosť uhlíka a legujúcich prvkov v oceli významne mení teplotu fázových prechodov.
V oblasti vysokých tlakov (nad 104 MPa, 100 tisíc atmosfér) vzniká modifikácia e-železa hexagonálnou tesnou mriežkou (HCP).
Fenomén polymorfizmu je pre metalurgiu ocele mimoriadne dôležitý. To je vďaka a-y prechodom kryštalickej mriežky, že oceľ je tepelne spracovaná. Bez tohto fenoménu by železo ako základ ocele nebolo také rozšírené.
Železo je žiaruvzdorné, označuje kovy so strednou aktivitou. Teplota topenia železa je 1539 ° C, teplota varu je približne 3200 ° C.
Železo je jedným z najpoužívanejších kovov, predstavuje až 95% svetovej hutníckej výroby.
Železo je hlavnou zložkou ocelí a liatin - najdôležitejších konštrukčných materiálov.
Železo môže byť súčasťou zliatin na báze iných kovov - napríklad niklu.
Magnetický oxid železitý (magnetit) je dôležitým materiálom pri výrobe zariadení s dlhodobou pamäťou počítača: pevné disky, diskety atď.
Ultrajemný magnetitový prášok sa používa ako toner v čiernobielych laserových tlačiarňach.
Jedinečné feromagnetické vlastnosti mnohých zliatin na báze železa prispievajú k ich rozšírenému použitiu v elektrotechnike pre magnetické jadrá transformátorov a elektrických motorov.
Chlorid železitý (chlorid železitý) sa používa v amatérskej rádiovej praxi na morenie dosiek s plošnými spojmi.
Síran železnatý (síran železa) zmiešaný so síranom meďnatým sa používa na ničenie škodlivých húb v záhradníctve a stavebníctve.
Železo sa používa ako anóda v železo-niklových batériách, železo-vzduchových batériách.
meď
Meď je prvkom bočnej podskupiny prvej skupiny, štvrtej periódy periodického systému chemických prvkov DI Dmitrija Ivanoviča Mendeleeva, s atómovým číslom 29. Je označená symbolom Cu (lat. Cuprum). Jednoduchá meď (CAS číslo: 7440-50-8) je plastový prechodný kov zlatohnedej farby (ružová farba v neprítomnosti oxidového filmu). C už dlho používa človek.



Meď je zlatohnedá tvárná hmota, ktorá je vo vzduchu rýchlo potiahnutá oxidovým filmom, ktorý jej dodáva charakteristický intenzívny žltkastočervený odtieň. Meď má vysokú tepelnú a elektrickú vodivosť (po striebre je druhá elektrická vodivosť). Má dva stabilné izotopy - 63Cu a 65Cu a niekoľko rádioaktívnych izotopov. Najdlhšia z nich, 64Cu, má polčas 12,7 hodiny a dve možnosti rozkladu s rôznymi výrobkami.
Hustota - 8,94 * 10і kg / mі
Merné teplo pri 20 ° C - 390 J / kg * K
Elektrický odpor pri 20 - 100 ° С - 1,78 · 10 - 8 Ohm · m
Teplota topenia - 1083 ° C
Teplota varu - 2600 ° C
Existuje množstvo zliatin meďnatých materiálov: mosadz - zliatina meďnatého zinku, - zliatina meďnatého cínu, kupronikel - zliatina meďnatého a niklu a niektoré ďalšie.
zinok
Zinok je prvkom bočnej podskupiny druhej skupiny, štvrtého obdobia periodického systému chemických prvkov DI Mendeleeva Dmitrija Ivanoviča, s atómovým číslom 30. Je označený symbolom Zn (lat. Zinkum). Jednoduchou látkou (CAS číslo: 7440-66-6) je za normálnych podmienok krehký prechodný kov modrastobielej farby (mizne na vzduchu a je pokrytý tenkou vrstvou oxidu zinočnatého).
Vo svojej čistej forme je to skôr tvárny strieborno-biely kov. Má hexagonálnu mriežku s parametrami a \u003d 0,26649 nm, c \u003d 0,49468 nm. Pri izbovej teplote je krehká, keď je doska ohnutá, praskanie je počuť trením kryštalitov (zvyčajne silnejšie ako „cínový plač“). Pri 100 - 150 ° C je zinok plast. Nečistoty, aj malé, výrazne zvyšujú krehkosť zinku.
Typický amfotérny kov. Štandardný elektródový potenciál je -0,76 V, ktorý sa nachádza v sérii štandardných potenciálov až po železo.
Vo vzduchu je zinok potiahnutý tenkou vrstvou oxidu zinočnatého. Pri silnom zahrievaní horí a vytvára amfotérny biely oxid ZnO:
2Zn + O2 \u003d 2ZnO.
Oxid zinočnatý reaguje s obidvoma kyselinovými roztokmi:
ZnO + 2HNO3 \u003d Zn (N03) 2 + H20
a zásady:
ZnO + 2NaOH \u003d Na2ZnO2 + H20,
Zinok normálnej čistoty aktívne reaguje s kyslými roztokmi:
Zn + 2HCl \u003d ZnCl2 + H2,
Zn + H2SO4 (rozklad) \u003d ZnSO4 + H2
a alkalické roztoky:
Zn + 2NaOH + 2H20 \u003d Na2 + H2,
formovanie hydroxyzincatov. Veľmi čistý zinok nereaguje s roztokmi kyselín a zásad. Interakcia sa začína pridaním niekoľkých kvapiek roztoku síranu meďnatého CuSO4.
Pri zahrievaní zinok reaguje s halogénmi za vzniku halogenidov ZnHal2. S fosforom zinok tvorí fosfidy Zn3P2 a ZnP2. Sírou a jej analógmi - selén a telúr - rôzne chalkogenidy, ZnS, ZnSe, ZnSe2 a ZnTe.
Zinok nereaguje priamo s vodíkom, dusíkom, uhlíkom, kremíkom a bórom. Nitrid Zn3N2 sa získava reakciou zinku s amoniakom pri 550 - 600 ° C.
Vo vodných roztokoch tvoria zinočnaté ióny Zn2 + aquakomplexy 2+ a 2+.
Čistý kovový zinok sa používa na obnovu vzácnych kovov ťažených podzemným vylúhovaním (zlato, striebro). Okrem toho sa zinok používa na extrakciu striebra, zlata (a iných kovov) zo surového olova vo forme intermetalických zlúčenín zinku so striebrom a zlatom (tzv. Strieborná pena), ktoré sa potom spracúvajú konvenčnými spôsobmi rafinácie.
Používa sa na ochranu ocele pred koróziou (galvanizácia povrchov, ktoré nie sú vystavené mechanickému namáhaniu alebo metalizácie - pre mosty, nádrže, kovové konštrukcie). Používa sa tiež ako materiál pre zápornú elektródu v zdrojoch chemického prúdu, tj v batériách a akumulátoroch, napríklad: mangán-zinkový prvok, strieborno-zinkový akumulátor (EMF 1,85 V, 150 W · h / kg, 650 W · h / dmі, nízky odpor a obrovské prietokové prúdy, ortuť-zinkový prvok (EMF 1,35 V, 135 W · h / kg, 550-650 W · h / dmі), dioxisulfát-ortuťový prvok, jodičnan zinočnatý, oxid meďnatý galvanický článok (EMF 0,7 - 1,6 V, 84 - 127 W · h / kg, 410 - 570 W · h / dm_), chróm-zinkový prvok, zinok-striebro-strieborný prvok nt, nikel-zinková batéria (EMF 1,82 Volt, 95-118 W · h / kg, 230-295 W · h / dmi), olovo-zinkový prvok, zinkovo-chlórová batéria, zinkovo-brómová batéria atď.). Úloha zinku v zinkových vzduchových batériách je veľmi dôležitá.V posledných rokoch sa zinkovo-vzduchové batérie pre počítače (laptopy) intenzívne vyvíjali na základe systému zinok-vzduch a v tejto oblasti sa dosiahol významný úspech (väčšie ako lítiové batérie, kapacita a zdroje sú menšie ako 3). Tento systém je veľmi sľubný pre naštartovanie motorov (olovená batéria - 55 W · h / kg, zinok-vzduch - 220-300 W · h / kg) a pre elektrické vozidlá (počet najazdených kilometrov do 900 km). Zahrnuté v mnohých spájkach na zníženie teploty topenia. Zinok je dôležitou súčasťou mosadze. Oxid zinočnatý sa v medicíne často používa ako antiseptické a protizápalové činidlo. Oxid zinočnatý sa tiež používa na výrobu farby - oxid zinočnatý.
Chlorid zinočnatý je dôležitým tavivom na spájkovanie kovov a súčasťou výroby vlákien.
Telurid, selenid, fosfid, sulfid zinočnatý sú bežne používané polovodiče.
Selenid zinočnatý sa používa na výrobu optických skiel s veľmi nízkym absorpčným koeficientom v strednom infračervenom pásme, napríklad v laseroch na báze oxidu uhličitého.
ortuť
Ortuť je prvkom bočnej podskupiny druhej skupiny, šiestej periódy periodického systému chemických prvkov DI Dmitrija Ivanoviča Mendeleeva, s atómovým číslom 80. Je označená symbolom Hg (lat. Hydrargyrum). Jednoduchá ortuťová látka (CAS číslo: 7439-97-6) je prechodný kov, pri izbovej teplote je to ťažká strieborno-biela, viditeľne prchavá kvapalina, ktorej výpary sú mimoriadne toxické. Ortuť je jedným z dvoch chemických prvkov (a jediným kovom), ktorých jednoduché látky sú za normálnych podmienok v kvapalnom stave agregácie (druhým prvkom je bróm). V prírode sa vyskytuje v natívnej forme a tvorí množstvo minerálov. Ortuť sa najčastejšie získava redukciou zo svojho najbežnejšieho minerálu - rumelky. Používa sa na výrobu meracích prístrojov, vákuových čerpadiel, svetelných zdrojov av iných oblastiach vedy a techniky.
Ortuť je jedinou kovovou tekutinou pri izbovej teplote. Má vlastnosti diamagnetu. Vytvára tekuté zliatiny s mnohými kovmi - amalgámy, Iba železo, mangán a ni.
Ortuť je kov s nízkou aktivitou.
Po zahriatí na 300 ° C ortuť reaguje s kyslíkom: 2Hg + O2 → 2HgO Vznikne červený oxid ortuti (II). Táto reakcia je reverzibilná: pri zahrievaní nad 340 ° C sa oxid rozkladá na jednoduché látky. Rozkladná reakcia oxidu ortuťnatého je historicky jednou z prvých metód výroby kyslíka.
Keď sa ortuť zahreje sírou, vytvorí sa sulfid ortutnatý.
Ortuť sa nerozpúšťa v roztokoch kyselín, ktoré nemajú oxidačné vlastnosti, ale rozpúšťa sa v aqua regia a kyseline dusičnej, čím sa tvoria soli dvojmocnej ortuti. Keď sa prebytok ortuti rozpustí v kyseline dusičnej za studena, vytvorí sa dusičnan Hg2 (NO3) 2.
Z prvkov skupiny IIB skupiny ortuti je možné zničiť veľmi stabilný obal elektrónov 6d10, čo vedie k možnosti existencie zlúčenín ortuti (+4). Takže okrem ťažko rozpustného Hg2F2 a HgF2 rozpadajúceho sa vo vode je tu tiež HgF4 získaný interakciou atómov ortuti a zmesi neónov a fluóru pri teplote 4 K.
Ortuť sa používa na výrobu teplomerov: ortuťový kremeň a žiarivky sú naplnené ortuťovými parami. Ortuťové kontakty slúžia ako snímače polohy. Okrem toho sa kovová ortuť používa na výrobu celého radu kritických zliatin.
Doteraz sa v šperkoch, pri výrobe zrkadiel a zubných výplní hojne používali rôzne amalgámy kovov, najmä amalgámy zlata a striebra. V technológii sa ortuť bežne používa pre barometre a manometre. Zlúčeniny ortuti sa používali ako antiseptikum (chlorid ortutnatý), preháňadlo (kalomel), pri výrobe klobúkov atď., Ale kvôli svojej vysokej toxicite boli do konca 20. storočia prakticky vytlačené z týchto oblastí (nahradenie amalgamácie striekaním a elektrolytickým nanášaním kovov, polymér výplne v stomatológii).
Zliatina ortuti tália sa používa pre teplomery s nízkou teplotou.
Kovová ortuť slúži ako katóda na elektrolytickú výrobu množstva aktívnych kovov, chlóru a alkálií v niektorých zdrojoch chemického prúdu (napríklad ortuť-zinok - typ RC), v referenčných zdrojoch napätia (Westonova bunka). Ortuťovo-zinkový prvok (EMF 1,35 V) má objemovo a hmotnostne veľmi vysokú energiu (130 W / h / kg, 550 W / h / dm).
Ortuť sa používa na recykláciu druhotnej ťažby hliníka a zlata (pozri amalgám).
Ortuť sa niekedy používa aj ako pracovná tekutina vo vysoko zaťažených hydrodynamických ložiskách.
Ortuť je súčasťou niektorých biocídnych farieb, aby sa zabránilo znečisteniu lodných trupov v morskej vode.
V rádiofarmakológii sa používa ortuť-203 (T1 / 2 \u003d 53 sec).
Soli ortuti sa tiež používajú:
Jodid ortuti sa používa ako detektor polovodičového žiarenia.
Fulminát ortuti („výbušná ortuť“) sa už dlho používa ako iniciačná výbušnina (detonátory).
Bromid ortuti sa používa pri termochemickom rozklade vody na vodík a kyslík (atómová vodíková energia).
Niektoré zlúčeniny ortuti sa používajú ako lieky (napríklad mertiolát na konzerváciu vakcín), ale hlavne kvôli toxicite bola ortuť nahradená v medicíne (chlorid ortutnatý, oxykyanid ortuti - antiseptiká, kalomel - preháňadlá atď.) V polovici konca 20. storočia.

hliník
Hliník je prvkom hlavnej podskupiny tretej skupiny tretieho obdobia periodického systému chemických prvkov DI Mendeleeva Dmitrija Ivanoviča, atómové číslo 13. Je označený symbolom Al (lat. Aluminium). Patrí do skupiny ľahkých kovov. Najbežnejší kov a tretí najbežnejší (po kyslíku a kremíku) chemický prvok v zemskej kôre.
Jednoduchá hmota Hliník (CAS-číslo: 7429-90-5) - ľahký nemagnetický kov striebro-biely, ktorý sa dá ľahko formovať, odlievať a obrábať. Hliník má vysokú tepelnú a elektrickú vodivosť, odolnosť proti korózii vďaka rýchlej tvorbe silných oxidových filmov, ktoré chránia povrch pred ďalšou interakciou.
Podľa niektorých biologických štúdií sa príjem hliníka do ľudského tela považoval za faktor rozvoja Alzheimerovej choroby, tieto štúdie sa však neskôr kritizovali a záver o vzťahu jedného k druhému sa vyvrátil.
Strieborno-biely kov, ľahký, hustota 2,7 g / cm2, teplota topenia pre technické 658 ° C, hliník vysokej čistoty 660 ° C, bod varu 2500 ° C, dočasný odpor odliatku 10 - 12 kg / mm2, deformovateľný 18 -25 kg / mm2, zliatiny 38 až 42 kg / mm2.
Tvrdosť podľa Brinella je 24-32 kgf / mm2, vysoká ťažnosť: technická 35%, čistá 50%, stočená do tenkej fólie a rovnomerne do fólie.
Hliník má vysokú elektrickú vodivosť a tepelnú vodivosť, 65% elektrickej vodivosti Cuprum, má vysokú odrazivosť.
Hliník tvorí zliatiny s takmer všetkými kovmi.
Za normálnych podmienok je hliník potiahnutý tenkým a silným oxidovým filmom, a preto nereaguje s klasickými oxidačnými činidlami: s H2O (t °), O2, HNO3 (bez zahrievania). Z tohto dôvodu nie je hliník prakticky náchylný na koróziu, a preto ho moderný priemysel vo veľkej miere požaduje. Avšak počas deštrukcie oxidového filmu (napríklad pri kontakte s roztokmi amónnych solí NH4 +, horúcimi alkáliami alebo v dôsledku amalgámovania) hliník pôsobí ako aktívne redukčné činidlo kovu.
Ľahko reaguje s jednoduchými látkami:
s kyslíkom:
4Al + 3O2 \u003d 2Al203
s halogénmi:
2Al + 3Br2 \u003d 2AlBr3
pri zahrievaní reaguje s inými nekovmi:
so sírou za vzniku sulfidu hlinitého:
2Al + 3S \u003d Al2S3
s dusíkom za vzniku nitridu hlinitého:
s uhlíkom, tvoriaci karbid hliníka:
4Al + 3C \u003d Al4C3
Sulfid hlinitý a karbid sú úplne hydrolyzované:
Al2S3 + 6H20 \u003d 2Al (OH) 3 + 3H2S
Al4C3 + 12H20 \u003d 4Al (OH) 3+ 3CH4
S komplexnými látkami:
s vodou (po odstránení ochranného filmu oxidu, napríklad zlúčenie alebo roztok horúcej alkálie):
2Al + 6H20 \u003d 2Al (OH) 3 + 3H2
s alkáliami (s tvorbou tetrahydroxoaluminátov a iných hlinitanov):
2Al + 2NaOH + 6H20 \u003d 2Na + 3H2
2 (NaOH.H20) + 2Al \u003d 2NaA102 + 3H2
Ľahko rozpustný v kyseline chlorovodíkovej a zriedenej kyseline sírovej:
2Al + 6HCl \u003d 2AlCl3 + 3H2
2Al + 3H2SO4 (dec) \u003d Al2 (S04) 3 + 3H2
Pri zahrievaní sa rozpustí v kyselinách - oxidačných činidlách, ktoré tvoria rozpustné soli hliníka:
2Al + 6H2SO4 (konc.) \u003d Al2 (S04) 3 + 3SO2 + 6H20
Al + 6HN03 (konc.) \u003d Al (N03) 3 + 3NO2 + 3H20
obnovuje kovy z ich oxidov (aluminotermia):
8Al + 3Fe304 \u003d 4Al203 + 9Fe
2Al + Cr203 \u003d Al203 + 2Cr
Široko používaný ako konštrukčný materiál. Hlavnými výhodami hliníka v tejto kvalite sú ľahkosť, flexibilita lisovania, odolnosť proti korózii (na vzduchu je hliník okamžite potiahnutý odolným filmom Al2O3, ktorý bráni jeho ďalšej oxidácii), vysoká tepelná vodivosť, netoxita jeho zlúčenín. Vďaka týmto vlastnostiam sa hliník stal mimoriadne populárnym pri výrobe riadu, hliníkovej fólie v potravinárskom priemysle a pri balení.
Hlavnou nevýhodou hliníka ako stavebného materiálu je jeho nízka pevnosť, preto je zvyčajne tavený s malým množstvom meďnatého hliníka a horčíka (zliatina sa nazýva duralová).
Elektrická vodivosť hliníka je iba 1,7-krát menšia ako vodivosť Cuprum, zatiaľ čo hliník je približne 2-krát lacnejší. Preto sa v elektrotechnike bežne používa na výrobu drôtov, ich tienenie a dokonca aj v mikroelektronike na výrobu vodičov v čipoch. Nižšia elektrická vodivosť hliníka (37 l / ohm) v porovnaní s meďou (63 l / ohm) je kompenzovaná zvýšením prierezu hliníkových vodičov. Nevýhodou hliníka ako elektrotechnického materiálu je silný oxidový film, ktorý sťažuje spájkovanie.
Vďaka svojmu komplexu vlastností je široko distribuovaný v tepelných zariadeniach.
Hliník a jeho zliatiny si zachovávajú svoju pevnosť pri extrémne nízkych teplotách. Z tohto dôvodu je široko používaný v kryogénnej technológii.
Vďaka vysokej odrazivosti v kombinácii s nízkymi nákladmi a ľahkým postrekom je hliník ideálnym materiálom na výrobu zrkadiel.
Pri výrobe stavebných materiálov ako plynotvorného činidla.
Korózia a odstraňovanie okovín sa používajú na zmenu ocele a iných zliatin, napríklad ventilov piestových motorov s vnútorným spaľovaním, lopatiek turbín, veží na spätné získavanie oleja, zariadení na výmenu tepla a tiež na náhradu galvanizácie.
Sulfid hlinitý sa používa na výrobu sírovodíka.
Prebieha výskum zameraný na vývoj penového hliníka ako zvlášť silného a ľahkého materiálu.
Keď bol hliník veľmi drahý, vyrobili sa z neho rôzne šperky. Móda pre nich okamžite prešla, keď sa objavili nové technológie (vývoj) svojej výroby, ktoré sa mnohokrát znížili. V súčasnosti sa hliník niekedy používa na výrobu šperkov.


Ostatné kovy
olovo
Olovo je prvkom hlavnej podskupiny štvrtej skupiny, šiestej periódy periodického systému chemických prvkov DI Dmitrija Ivanoviča Mendeleeva, s atómovým číslom 82. Je označený symbolom Pb (lat. Plumbum). Jednoduchá látka Olovo (číslo CAS: 7439-92-1) je tvárny šedý kov s relatívne nízkou teplotou topenia.
Olovo má pomerne nízku tepelnú vodivosť, je 35,1 W / (m · K), pri teplote 0 ° C. Kov je mäkký, ľahko sa dá rezať nožom. Na povrchu je zvyčajne pokrytý viac alebo menej hrubým filmom oxidov, pri rezaní sa otvára lesklý povrch, ktorý v priebehu času mizne vo vzduchu.
Teplota topenia: 327,4 ° C
Teplota varu: 1740 ° C
Dusičnan olovnatý sa používa na výrobu silných zmiešaných výbušnín. Olovnatý azid sa používa ako najrozšírenejší detonátor (iniciuje výbušninu). Chloristan olovnatý sa používa na prípravu ťažkých kvapalín (hustota 2,6 g / cm2) používaných pri flotačnom spracovaní rúd, niekedy sa používa ako silná zmesná výbušnina ako oxidačné činidlo. Olovnatý fluorid samotný, ako aj spolu s fluoridom bizmutitým, Kuprum, Silver, sa používa ako katódový materiál v chemických zdrojoch prúdu. Ako katódový materiál v lítiových batériách sa používa bismutan olovnatý, PbS sulfid olova, jodid olovnatý. Chlorid olovnatý PbCl2 ako katódový materiál v záložných prúdových zdrojoch. Olovnatý telurid PbTe sa široko používa ako termoelektrický materiál (termoelektrický výkon s 350 μV / K), najbežnejšie používaný materiál pri výrobe termoelektrických generátorov a termoelektrických chladničiek. Oxid olovnatý PbO2 sa široko používa nielen v olovenej batérii, ale na jej základe sa vyrába aj veľa rezervných zdrojov chemického prúdu, napríklad olovo-chlórový prvok, olovo-fluórový prvok atď.
Olovo biela, hlavný uhličitan Pb (OH) 2.PbCO3, hustý biely prášok, sa získava z olova na vzduchu pod vplyvom oxidu uhličitého a kyseliny octovej. Použitie olovnatej bielej farby ako farbiaceho pigmentu nie je teraz také časté ako predtým, v dôsledku ich rozkladu pôsobením sírovodíka H2S. Olovené vápno sa tiež používa na výrobu tmelu, v technológii cementu a uhličitanu olovnatého papiera.
Olovo arzeničnan a arzenit sa používajú v insekticídnej technológii na ničenie hmyzu - poľnohospodárskych škodcov (nepárový priadka morušová a bavlník obyčajný). Olovnatý boritan Pb (BO2) 2 · H2O, nerozpustný biely prášok, sa používa na sušenie farieb a lakov a spolu s ostatnými kovmi - ako povlaky zo skla a porcelánu. Chlorid olovnatý PbCl2, biely kryštalický prášok, je rozpustný v horúcej vode, v roztokoch iných chloridov a najmä chloridu amónneho NH4CI. Používa sa na prípravu mastí na liečenie nádorov.
Chromát olovnatý PbCrO4 je známy ako chrómovo žlté farbivo, je to dôležitý pigment na prípravu farieb, na farbenie porcelánu a tkanín. V priemysle sa chromát používa hlavne na výrobu žltých pigmentov. Dusičnan olovnatý Pb (NO3) 2 je biela kryštalická látka ľahko rozpustná vo vode. Je to zviera s obmedzeným využitím. V priemysle sa používa na výrobu zápaliek, farbenie a tlač textilu, farbenie rohov a rytie. Olovnatý síran Pb (S04) 2, vo vode nerozpustný biely prášok, sa používa ako pigment v batériách, litografii a v technológii tlačených tkanín.
Olovnatý sulfid PbS, čierny vo vode nerozpustný prášok, sa používa na vypaľovanie keramiky a na detekciu iónov olova.
Pretože olovo dobre absorbuje žiarenie γ, používa sa na ochranu pred žiarením v röntgenových zariadeniach av jadrových reaktoroch. Okrem toho sa olovo považuje za chladivo v projektoch sľubných rýchlych neutrónových reaktorov.
Olovené zliatiny nachádzajú významné uplatnenie. Puter (zliatina cínu a olova), obsahujúci 85 - 90% cínového kovu a 15 - 10% Pb, je formovaný, lacný a používa sa na výrobu domácich potrieb. V elektrotechnike sa používa spájka obsahujúca 67% Pb a 33% cínu. Olovo a zliatiny antimónu sa používajú pri výrobe guľiek a typografie a zliatiny olova, antimónu a cínu sa používajú na odlievanie figúr a ložiská. Zliatiny antimónu olova sa bežne používajú pre plášte káblov a dosky elektrických batérií. Olovené zlúčeniny sa používajú pri výrobe farbív, farieb, insekticídov, skla Obchodné položky a ako prísady do benzínu vo forme tetraetylovaného olova (C2H5) 4Pb (mierne prchavá kvapalina, pár rezov v nízkych koncentráciách má sladký ovocný zápach, vo veľkých je nepríjemný zápach; teplota topenia \u003d 130 ° C, teplota topenia \u003d 80 ° C / 13 mm RT) Hustota: 1650 g / cm; nD2v \u003d 1 198, nerozpustný vo vode, zmieša sa s organickými rozpúšťadlami, vysoko toxický, ľahko preniká do pokožky; MPC \u003d 0,005 mg / m; LD50 \u003d 12,7 mg / kg (potkan, orálne)) na zvýšenie oktánového čísla.

cín
Cín je prvkom hlavnej podskupiny štvrtej skupiny, piatej periódy periodického systému chemických prvkov DI Mendeleev Dmitrij Ivanovič, s atómovým číslom 50. Je označený symbolom cínový kov (lat. Stannum). Za normálnych podmienok je jednoduchou látkou tažný, kujný a taviteľný lesklý kov strieborno-bielej farby. Cín tvorí niekoľko alotrópnych modifikácií: pod 13,2 ° C stabilný a-cín (sivý cín) s kubickou mriežkou diamantového typu, nad 13,2 ° C stabilný β-cín (biely cín) s tetragonálnou kryštálovou mriežkou.
Cín sa používa hlavne ako bezpečný, netoxický povlak odolný proti korózii v čistej forme alebo v zliatinách s inými kovmi. Hlavné priemyselné aplikácie cínu sú v pocínovanom plechu (pocínované železo) na výrobu nádob na potraviny, v spájkach na elektroniku, v domácich potrubiach, v ložiskových zliatinách av povlakoch z cínu a jeho zliatin. Najdôležitejšou zliatinou cínu je bronz (s Cuprum). Na výrobu jedál sa používa ďalšia známa zliatina - počítač. Nedávno sa oživil záujem o používanie kovu, pretože je medzi „ťažkými neželeznými kovmi“ najekologickejší pre životné prostredie. Používa sa na vytvorenie supravodivých vodičov založených na intermetalickej zmesi Nb3Sn.
ceny na kovový cín v roku 2006 predstavoval priemerne 12-18 $ / kg, oxid cínu o vysokej čistote asi 25 $ / kg, monokryštálový cín o vysokej čistote asi 210 $ / kg.
Intermetalické zlúčeniny cínu a zirkónia majú vysoké teploty topenia (až do 2000 ° C) a odolnosť proti oxidácii, keď sú zohriate na vzduchu a majú mnoho aplikácií.
Cín je najdôležitejšou legujúcou zložkou pri výrobe štruktúrnych titánových zliatin.
Oxid cíničitý je veľmi účinný abrazívny materiál používaný na „konečnú úpravu“ povrchu optického skla.
Zmes cínových solí - „žltá kompozícia“ - sa predtým používala ako farbivo na vlnu.
Cín sa tiež používa v zdrojoch chemického prúdu ako materiál anódy, napríklad: prvok mangán-cín, oxid-ortuť-cín. Sľubné je použitie cínu v olovenej batérii; Napríklad pri rovnakom napätí s olovenou batériou má olovo-cínová batéria 2,5-krát vyššiu kapacitu a 5-krát vyššiu hustotu energie na jednotku objemu, jej vnútorný odpor je oveľa nižší.
Kovový cín je netoxický, čo umožňuje jeho použitie v potravinárskom priemysle. Škodlivé nečistoty obsiahnuté v cíne sa za normálnych podmienok skladovania a používania, vrátane taveniny pri teplotách do 600 ° C, neuvoľňujú do ovzdušia pracovného priestoru v objemoch, ktoré presahujú najvyššiu povolenú koncentráciu podľa GOST. Dlhodobé (15–20 rokov) pôsobenie cínového prachu má fibrogénny účinok na pľúca a môže spôsobiť ochorenie osôb pracujúcich s pneumokoniózou.
Kovové aplikácie
Stavebné materiály
Kovy a ich zliatiny sú jedným z hlavných stavebných materiálov modernej civilizácie. To je primárne určené ich vysokou pevnosťou, rovnomernosťou a nepriepustnosťou pre kvapaliny a plyny. Okrem toho, zmenou zloženia zliatin je možné meniť ich vlastnosti vo veľmi širokom rozsahu.
Elektrické materiály
Kovy sa používajú ako dobré vodiče Elektrická energia (Meď, hliník) a ako materiály s vysokým odporom pre odpory a elektrické vykurovacie telesá (nichróm atď.).
Materiály nástrojov
Kovy a ich zliatiny sa široko používajú na výrobu nástrojov (ich pracovných častí). Sú to hlavne nástrojové ocele a karbidy. Diamant, nitrid bóru a keramika sa tiež používajú ako nástrojové materiály.
hutníctvo
Hutníctvo alebo metalurgia je oblasť materiálovej vedy, ktorá študuje fyzikálne a chemické správanie kovov, intermetalických zlúčenín a zliatin. Hutníctvo zahŕňa aj praktické využitie existujúcich poznatkov o kovoch - od ťažby surovín po peňažné emisie hotových výrobkov.
Štúdium štruktúry a fyzikálno-chemických vlastností tavenín a tuhých roztokov kovov a oxidov, vývoj teórie kondenzovaného stavu hmoty;
Štúdium termodynamiky, kinetiky a mechanizmu metalurgických reakcií;
Vývoj vedeckých, technických a ekonomických základov pre integrované využívanie polymetalických nerastných surovín a priemyselného odpadu s riešením problémov životného prostredia;
Vývoj teórie základov pyrometalurgickej, elektrotermálnej, hydrometalurgickej a plynnej fázy procesy výroba kovov, zliatin, kovových práškov a kompozitných materiálov a povlakov.
Železné kovy zahŕňajú železo, mangán, chróm, vanád. Všetky ostatné sú zafarbené. Podľa ich fyzikálnych vlastností a účelu sa neželezné kovy bežne delia na ťažké (meď, olovo, zinok, cín, Ni) a ľahké (hliník, horčík).
Podľa hlavného technologického procesu sa delí na pyrometalurgiu (tavenie) a hydrometalurgiu (ťažba kovov v chemických roztokoch). Rôzne pyrometalurgie je plazmová metalurgia.
Plazmová metalurgia - extrakcia z rúd, tavenie a spracovanie kovov a zliatin pod vplyvom plazmy.
Spracovanie rúd (oxidov atď.) Sa vykonáva ich tepelným rozkladom v plazme. Aby sa zabránilo spätným reakciám, používa sa redukčné činidlo (uhlík, vodík, metán atď.) Alebo ostré ochladzovanie plazmového prúdu, čo narúša termodynamickú rovnováhu.
Plazmová metalurgia umožňuje priamu redukciu kovu z rudy, výrazne urýchľuje metalurgické procesy, získava čisté materiály a znižuje náklady na palivo (redukčné činidlo). Nevýhodou plazmovej metalurgie je vysoká spotreba elektriny použitej na výrobu plazmy.

Príbeh
Prvý dôkaz o tom, že sa osoba zaoberala metalurgiou, sa datuje do 5 až 6 tisícročí pred Kristom. e. a boli nájdené v Majdanpeku, Pločniku a ďalších miestach v Srbsku (vrátane medenej sekery 5500 pred Kr., ktorá sa týka kultúry Vinca), Bulharska (5 000 pred Kr.), Palmele (), Španielska, Stonehenge (). Avšak, ako sa často stáva pri takýchto dlhodobých javoch, vek nie je možné vždy presne určiť.
V skorej kultúre sú striebro, meď, cín a meteorit železo, ktoré umožňujú obmedzené spracovanie kovov. Preto boli vysoko hodnotené „nebeské dýka“ - egyptské zbrane vyrobené z meteoritového železa 3000 rokov pred Kristom. e. Ale po tom, čo som sa naučil ťažiť meď a cín rock a dostanú zliatinu s názvom bronz, ľudia v roku 3500 pred naším letopočtom. e. vstúpil do doby bronzovej.
Získanie železa z rudy a tavenia kovu bolo oveľa ťažšie. To je veril, že technológia bola vynájdená Hetejcami okolo roku 1200 pred Kristom. to bol začiatok železnej doby. Tajomstvo ťažby a výroby železa sa stalo kľúčovým faktorom vlády Filištínov.
V mnohých minulých kultúrach a civilizáciách je možné sledovať stopy vývoja železnej metalurgie. Patria sem staroveké a stredoveké kráľovstvá a ríše na Blízkom východe a na Strednom východe, staroveký Egypt a Anatólia (), Kartágo, Gréci a Rimania starovekých a stredovekých. Európy, Čína atď. Malo by sa poznamenať, že v starovekej Číne bolo pôvodne vynájdených veľa metód, zariadení a technológií metalurgie, a potom si Európania osvojili toto remeslo (vymýšľali vysoké pece, Liatina, Oceľ, hydraulické kladivá atď.). Nedávny výskum však naznačuje, že rímska technológia bola oveľa vyspelejšia, ako sa pôvodne predpokladalo, najmä v oblasti baníctva a kovania.
Ťažobná metalurgia
Ťažobná metalurgia spočíva v ťažbe cenných kovov z rudy a tavení extrahovaných surovín na čistý kov. Na premenu oxidu alebo sulfidu kovu na čistý kov musí byť ruda separovaná fyzikálnymi, chemickými alebo elektrolytickými metódami.
Metalurgovia pracujú s tromi hlavnými zložkami: surovinami, koncentrátmi (hodnotný oxid alebo sulfid kovu) a odpadom. Po ťažbe sa veľké kúsky rudy rozdrvia na miesto, kde každá častica je buď cenným koncentrátom alebo odpadom.
horský práce voliteľné, ak ruda a životné prostredie umožňujú vylúhovanie. Týmto spôsobom je možné rozpustiť a získať roztok obohatený minerálmi.
Ruda často obsahuje niekoľko cenných kovov. V tomto prípade môže byť odpad z jedného procesu použitý ako surovina pre iný proces.
zliatina
Zliatina je makroskopicky homogénna zmes dvoch alebo viacerých chemických prvkov s prevahou kovových zložiek. Hlavnou alebo jedinou fázou zliatiny je spravidla pevné riešenie legovacích prvkov v kovu, ktoré je základom zliatiny.
Zliatiny majú kovové vlastnosti, napríklad: kovový lesk, vysokú elektrickú vodivosť a tepelnú vodivosť. Zliatinové komponenty môžu niekedy byť nielen chemické prvky, ale aj chemické zlúčeniny s kovovými vlastnosťami. Napríklad hlavnými zložkami karbidov sú karbidy volfrámu alebo titánu. Makroskopické vlastnosti zliatin sa vždy líšia od vlastností ich zložiek a makroskopická homogenita viacfázových (heterogénnych) zliatin sa dosahuje vďaka rovnomernému rozdeleniu fáz nečistôt v kovovej matrici.
Zliatiny sa zvyčajne získavajú zmiešaním zložiek v roztavenom stave a následným ochladením. Pri vysokých teplotách topenia zložiek sa zliatiny vyrábajú zmiešaním práškov kovov s následným spekaním (takto sa získa napríklad veľa zliatin volfrámu).
Zliatiny sú jedným z hlavných konštrukčných materiálov. Medzi nimi sú najdôležitejšie zliatiny na báze železa a hliníka. Do zloženia mnohých zliatin sa môžu zavádzať nekovy ako uhlík, kremík, bór atď. V technike sa používa viac ako 5 000 zliatin.
zdroje
http://ru.wikipedia.org/
Encyklopédia investora. 2013 .
synonymá:- - KOV, kovový manžel, Lat. krushets; a v malej podobe, v hute: malý kráľ V každodennom živote cenné drahé kovy: zlato, platina, striebro; jednoduché: železo, meď, zinok, cín, olovo; chémia objavila také princípy takmer všetkých minerálov pozostávajúcich z ... ... Dahlov vysvetľujúci slovník
Prevažnú väčšinu (93 zo 117) v súčasnosti známych chemických prvkov tvoria kovy.
Atómy rôznych kovov majú veľa spoločnej štruktúry a jednoduché a komplexné látky, ktoré tvoria, majú podobné vlastnosti (fyzikálne a chemické).
Poloha v periodickom systéme a štruktúra atómov kovov.
V periodickom systéme sú kovy umiestnené vľavo a pod podmienenou prerušovanou čiarou prechádzajúcou od bóru k astatínu (pozri tabuľku nižšie). Takmer všetky S-prvky (s výnimkou H, He) patria do kovov, asi polovica r-elementy, všetky d- a f-elementy ( lantanoidy a actinides).
Väčšina atómov kovu na vonkajšej energetickej úrovni obsahuje malé množstvo elektrónov (až 3), iba niektoré atómy p-elementu (Sn, Pb, Bi, Po) majú viac (štyri až šesť). Valenčné elektróny kovových atómov sú slabo (v porovnaní s nekovovými atómami) viazané k jadru. Atómy kovov preto relatívne ľahko dodávajú tieto elektróny iným atómom, pôsobiac pri chemických reakciách iba ako redukčné činidlá a premieňajúce sa na pozitívne nabité katióny:
Me - ne - \u003d Me n +.
Na rozdiel od nekovov sa atómy kovov vyznačujú iba pozitívnymi oxidačnými stavmi od +1 do +8.
Ľahkosť, s akou kovové atómy darujú svoje valenčné elektróny iným atómom, charakterizuje redukčnú aktivitu tohto kovu. Čím ľahší je atóm kovu svojim elektrónom, tým silnejšie je redukčné činidlo. Ak sú kovy usporiadané v rade v poradí znižovania ich redukčnej schopnosti vo vodných roztokoch, dostaneme séria výtlačkov z kovu, ktorý sa tiež nazýva elektrochemická séria napätí (alebo blízko aktivity) kovy (pozri tabuľku nižšie).
Prevalencia mkovy v prírode.
Prvé tri najbežnejšie kovy v zemskej kôre (to je povrchová vrstva našej planéty s hrúbkou asi 16 km) zahŕňajú hliník, železo a vápnik. Menej časté sú sodík, draslík a horčík. Nasledujúca tabuľka ukazuje hmotnostné frakcie niektorých kovov v zemskej kôre.
železo a vápnik. Menej časté sú sodík, draslík a horčík. Nasledujúca tabuľka ukazuje hmotnostné frakcie niektorých kovov v zemskej kôre.
Prevalencia kovov v zemskej kôre
| kov | kov | Hmotnostný zlomok v zemskej kôre,% | |
|---|---|---|---|
| Al | 8,8 | Cr | 8,3 ∙ 10 -3 |
| fe | 4,65 | zn | 8,3 ∙ 10 -3 |
| Ca | 3,38 | ni | 8 ∙ 10 -3 |
| na | 2,65 | Cu | 4,7 ∙ 10 -3 |
| K | 2,41 | pb | 1,6 ∙ 10 -3 |
| mg | 2,35 | ag | 7 ∙ 10 -6 |
| tí | 0,57 | Hg | 1,35 ∙ 10 -6 |
| Mn | 0,10 | au | 5 ∙ 10 -8 |
Nazývajú sa prvky, ktorých hmotnostný zlomok v zemskej kôre je nižší ako 0,01% vzácny, Medzi vzácne kovy patria napríklad všetky lantanidy. Ak sa prvok nedokáže sústrediť v zemskej kôre, t. J. Netvorí svoje vlastné rudy, ale vyskytuje sa ako nečistota s inými prvkami, potom sa označuje ako roztržitý prvky. Nasledujúce kovy sú rozptýlené napríklad: Sc, Ga, In, Tl, Hf.
V 40. rokoch 20. storočia. Nemeckí vedci Walter a Ida Nolla to navrhli. že v každom dlažebnom kameni na chodníku sú všetky chemické prvky periodického systému. Spočiatku tieto slová stretli ich kolegovia zďaleka jednomyseľným súhlasom. Avšak, ako sa objavujú stále presnejšie metódy analýzy, vedci sú stále viac presvedčení o platnosti týchto slov.
Keďže všetky živé organizmy sú v úzkom kontakte s životným prostredím, mal by každý z nich obsahovať, ak nie všetky, väčšinu chemických prvkov periodického systému. Napríklad v tele dospelých je hmotnostný podiel anorganických látok 6%. Z kovov v týchto zlúčeninách sú prítomné Mg, Ca, Na, K. Mnohé z enzýmov a iných biologicky aktívnych organických zlúčenín v našom tele obsahujú V, Mn, Fe, Cu, Zn, Co, Ni, Mo, Cr a niektoré ďalšie kovy.
Telo dospelých obsahuje v priemere asi 140 g draslíkových iónov a asi 100 g sodných iónov. Pri potravinách konzumujeme denne od 1,5 g do 7 g draslíkových iónov a od 2 g do 15 g sodných iónov. Potreba sodíkových iónov je taká veľká, že sa musia špeciálne pridávať do potravín. Významná strata sodíkových iónov (vo forme NaCl s močom a potom) nepriaznivo ovplyvňuje zdravie ľudí. Preto lekári za horúceho počasia odporúčajú piť minerálnu vodu. Nadmerný obsah soli v potrave však negatívne ovplyvňuje činnosť našich vnútorných orgánov (predovšetkým srdca a obličiek).
Na hlasovanie musíte mať povolený JavaScript.A ďalšie chemické zlúčeniny. Na získanie čistých kovov a ich ďalšiu aplikáciu je potrebné ich izolovať od rúd a vykonať čistenie. Ak je to potrebné zlievanie a iné spracovanie kovov. Veda to študuje. hutníctvo , Metalurgia rozlišuje železné rudy (na základe žľaza) a neželezných kovov (neobsahujú železo, iba asi 70 prvkov). Zlato, striebro a platina platí aj pre drahé (ušľachtilé) kovy , Okrem toho sú v malom množstve prítomné v morskej vode, rastlinách, živých organizmoch (pričom zohrávajú dôležitú úlohu).
Je známe, že ľudské telo pozostáva z 3% kovov , Najviac zo všetkého v našom bunky vápnik a sodík koncentrované v lymfatické systémy. magnézium akumuluje sa v svaly a nervový systém , meď - v pečeň , železo - v krvný.
ťažba
Kovy sa často ťažia zo zeme ťažbou, výsledné rudy slúžia ako pomerne bohatý zdroj potrebných prvkov. Na zistenie polohy rúd sa používajú špeciálne metódy vyhľadávania, vrátane prieskumu rúd a prieskumu ložísk. Vklady sa všeobecne delia na kariéra (povrchové rudy), v ktorých sa ťažba uskutočňuje ťažbou pôdy pomocou ťažkých zariadení, ako aj pod zemou baňa.
Kovy sa získavajú z rúd, obvykle chemickou alebo elektrolytickou redukciou. pyro vysoké teploty sa používajú na premenu rudy na kovové suroviny v roku 2007 hydrometalurgie použiť na rovnaký účel chémiu vody. Použité metódy závisia od druhu kovu a typu kontaminácie.
Ak je kovová ruda iónovou zlúčeninou kovu a nekovu, zvyčajne sa taví - zahrieva redukčným činidlom -, aby sa získal čistý kov. Mnoho bežných kovov ako železo roztavené použitím ako redukčné činidlo uhlík (získané spaľovaním uhlia). Niektoré kovy, ako napr hliník a sodík nemajú žiadne ekonomicky životaschopné redukčné činidlo a získajú sa pomocou elektrolýza.
Mohsova tvrdosť niektorých kovov:
| tvrdosť | kov |
|---|---|
| 0.2 | cézium |
| 0.3 | rubídia |
| 0.4 | draslík |
| 0.5 | sodík |
| 0.6 | lítium |
| 1.2 | indium |
| 1.2 | tálium |
| 1.25 | bárium |
| 1.5 | stroncium |
| 1.5 | gálium |
| 1.5 | cín |
| 1.5 | olovo |
| 1.5 | |
| 1.75 | vápnik |
| 2.0 | kadmium |
| 2.25 | bizmut |
| 2.5 | magnézium |
| 2.5 | zinok |
| 2.5 | lantánu |
| 2.5 | striebro |
| 2.5 | zlato |
| 2.59 | ytrium |
| 2.75 | hliník |
| 3.0 | meď |
| 3.0 | antimón |
| 3.0 | tórium |
| 3.17 | skandium |
| 3.5 | platina |
| 3.75 | kobalt |
| 3.75 | paládium |
| 3.75 | zirkón |
| 4.0 | železo |
| 4.0 | nikel |
| 4.0 | hafnium |
| 4.0 | mangán |
| 4.5 | vanádium |
| 4.5 | molybdén |
| 4.5 | ródium |
| 4.5 | titán |
| 4.75 | niobium |
| 5.0 | irídium |
| 5.0 | ruténium |
| 5.0 | tantal |
| 5.0 | technécium |
| 5.0 | chróm |
| 5.5 | berýlium |
| 5.5 | kovový prvok |
| 5.5 | rénium |
| 6.0 | volfrám |
| 6.0 | β-Urán |
Vďaka ľahkému spätnému toku elektrónov je možná oxidácia kovov, čo môže viesť korózie a ďalšie zhoršovanie vlastností. Schopnosť oxidovať sa dá rozpoznať štandardnou sériou aktivity kovov. Táto skutočnosť potvrdzuje potrebu používať kovy v kombinácii s inými prvkami ( zliatina z ktorých najdôležitejšie je oceľ), ich legovanie a nanášanie rôznych povlakov.
Pre presnejší opis elektronických vlastností kovov je potrebné použiť kvantová mechanika , Vo všetkých pevných látkach s dostatkom symetria energetické úrovne elektrónov jednotlivých atómov sa prekrývajú a vytvárajú povolené zóny a nazýva sa zóna tvorená valenčnými elektrónmi valenčný pás , Slabá väzba valenčných elektrónov v kovoch vedie k tomu, že valenčný pás v kovoch je veľmi široký a všetky valenčné elektróny nestačia na jeho úplné naplnenie.
Základným znakom takejto čiastočne naplnenej zóny je to, že aj pri minimálnom privedenom napätí vo vzorke začína reštrukturalizácia valenčných elektrónov, t. elektrický prúd.
Rovnaká vysoká pohyblivosť elektrónov vedie k vysokej tepelnej vodivosti, ako aj k schopnosti zrkadliť elektromagnetické žiarenie (čo dáva kovom charakteristický lesk).
Niektoré kovy
- light:
- iné:
Kovové aplikácie
Stavebné materiály
Materiály nástrojov
História vývoja myšlienok o kovoch
Začalo sa poznávanie človeka s kovmi zlato , striebro a meď , tj z kovov nachádzajúcich sa vo voľnom stave na zemskom povrchu; následne sa k nim pridali kovy, ktoré sú vo svojej podstate bežné a dajú sa ľahko odlíšiť od ich zlúčenín: cín , olovo , železo a. Týchto sedem kovov bolo ľudstvu známe v staroveku. Medzi staroegyptské artefakty patria výrobky zo zlata a medi, ktoré sa podľa niektorých zdrojov datujú do obdobia vzdialeného 3000 až 4000 rokov pred naším letopočtom. e.
K siedmim slávnym kovom, iba v stredovek boli pridané zinok , bizmut , antimón a na začiatku XVIII storočia arzén , Od polovice 18. storočia sa počet objavených kovov rýchlo zvyšuje a dosahuje 65 na začiatku 20. storočia a 96 na začiatku 21. storočia.
Žiadny z chemického priemyslu neprispel tak k rozvoju chemických znalostí, ako procesy spojené s výrobou a spracovaním kovov; ich história je spojená s najdôležitejšími momentmi v dejinách chémie. Vlastnosti kovov sú také charakteristické, že už v najranejšej dobe zlato, striebro, meď, olovo, cín, železo a ortuť tvorili jednu prirodzenú skupinu homogénnych látok a pojem „kov“ \u200b\u200bsa vzťahuje na najstaršie chemické pojmy. Názory na ich povahu sa však viac či menej špecificky prejavujú až v stredoveku alchymisti , Skutočné nápady Aristoteles o prírode: vytvorenie všetkého, čo existuje zo štyroch prvkov (oheň, zemina, voda a vzduch) už naznačovalo zložitosť kovov; ale tieto myšlienky boli príliš vágne a abstraktné. Alchymisti majú koncepciu zložitosti kovov a v dôsledku toho je viera v schopnosť premeniť niektoré kovy na iné, umelo ich tvoriť, základnou koncepciou ich svetonázoru. Táto koncepcia je prirodzeným záverom z množstva faktov týkajúcich sa chemických premien kovov, ktoré sa v tom čase akumulovali. V skutočnosti sa transformácia kovu na oxid úplne odlišná od nich jednoduchou kalcináciou na vzduchu a spätnou výrobou kovu z oxidu, zrážaním niektorých kovov z iných, vytváraním zliatin s inými vlastnosťami ako pôvodne braných kovov atď. - toto všetko sa zdalo byť naznačujú zložitosť ich povahy.
Pokiaľ ide o skutočnú konverziu kovov na zlato, viera v možnosť tohto bola založená na mnohých viditeľných faktoch. Najprv tvorba zliatin vo farbe podobnej zlate, napríklad z medi a zinku, v očiach alchymistov ich už zmenila na zlato. Zdalo sa im, že je potrebné iba zmeniť farbu a vlastnosti kovu by sa tiež zmenili. K tejto viere prispeli najmä zle stanovené experimenty, keď sa látky obsahujúce prímesi tohto zlata použili na premenu základného kovu na zlato. Napríklad už na konci 18. storočia kodanský lekárnik tvrdil, že chemicky čisté striebro sa po fúzii s arzénom čiastočne premieňa na zlato. Túto skutočnosť potvrdil známy chemik. Guiton de Morvo a urobili veľa hluku. Čoskoro sa ukázalo, že arzén použitý v experimente obsahoval stopy striebra a zlata.
Od tých siedmich známych kovov sa niektoré ľahšie podrobili chemickým transformáciám, iné ťažšie, alchymisti ich rozdelili na ušľachtilé - dokonalé a zapálené - nedokonalé. Bývalý patril do zlata a striebra, druhý do medi, cínu, olova, železa a ortuti. Ten, ktorý mal vlastnosti vzácnych kovov, ale zároveň sa výrazne líšil od všetkých kovov v tekutom stave a volatilite, bol v tom čase extrémne okupovaným vedcom a niektorí ho rozdelili do osobitnej skupiny; pozornosť, ktorá ju priťahovala, bola taká veľká, že začali zvažovať ortuť medzi prvkami, z ktorých sa vytvorili samotné kovy, a práve v nej videli nosič kovových vlastností. Akceptujúc existenciu charakteru prechodu niektorých kovov na iné, nedokonalých až dokonalých, alchymisti predpokladali, že za normálnych podmienok je táto transformácia extrémne pomalá, po stáročia a možno nie bez záhadnej účasti nebeských telies, ktoré boli v tom čase pripisované takej veľkej úlohe. a osudom človeka. Zhodou okolností existovalo sedem známych kovov, ako aj známe planéty, čo ďalej naznačovalo záhadné spojenie medzi nimi. Pre alchymistov sa kovy často nazývajú planéty; nazýva sa zlato Slnko striebro - Mesiac meď - venuša , cín - jupiter viesť - Saturn železo - mars a ortuť - ortuť , Keď sa objavili zinok, bizmut, antimón a arzén, telá, ktoré sú vo všetkých ohľadoch podobné kovom, ale ktoré majú jednu z najcharakteristickejších vlastností kovu, kujnosť, sú slabo vyvinuté, boli vybrané v osobitnej skupine - polokovy, Už v polovici 18. storočia existovalo rozdelenie kovov na vlastné kovy a semimetaly.
Stanovenie zloženia kovu bolo spočiatku čisto špekulatívne. Alchymisti spočiatku pripustili, že boli tvorené dvoma prvkami - a síra , Pôvod tohto pohľadu nie je známy, existuje už v VIII. Storočí. na Geberit Dôkazom prítomnosti ortuti v kovoch je to, že ich rozpúšťa a v týchto riešeniach ich individualita zmizla, absorbuje ortuť, čo by sa nestalo, keby nemali s ortuťou niečo spoločné. Okrem toho ortuť s olovom poskytla niečo podobné cínu. Pokiaľ ide o síru, možno sa to vzalo preto, že sú známe zlúčeniny síry, ktoré majú podobný vzhľad ako kovy. V budúcnosti sa tieto jednoduché nápady, pravdepodobne kvôli neúspešným pokusom o umelé získavanie kovov, stanú mimoriadne komplikovanými a zmätenými. V pojmoch alchymistov, napríklad v storočiach X-XIII, neboli ortuť a síra, z ktorých sa tvoria kovy, ortuť a síra, ktoré mali alchymisti vo svojich rukách. Bolo to len niečo podobné im, ktoré malo zvláštne vlastnosti; niečo, čo skutočne existovalo v bežnej síre a ortuti, bolo v nich vyjadrené vo väčšej miere ako v iných telách. Pod ortuťou, ktorá je súčasťou kovov, predstavovali niečo, čo stanovovalo ich nemeniteľnosť, kovový lesk, tažnosť, jedným slovom, kovovej podpory; Sírou sa myslí nosič premenlivosti, odbúrateľnosti a horľavosti kovov. Tieto dva prvky boli v kovoch v rôznych pomeroch a, ako už bolo povedané, rôznymi spôsobmi fixované; okrem toho môžu mať rôznu čistotu. Podľa Gebera napríklad zlato pozostávalo z veľkého množstva ortuti a malého množstva síry s najvyššou úrovňou čistoty a najstabilnejšou; naopak, v cíne naopak predpokladali veľa síry a malú ortuť, ktoré neboli čisté, zle zafixované atď. To všetko samozrejme chceli vyjadriť odlišný postoj kovov k jednému silnému chemickému činiteľu v tej dobe - ohňu. S ďalším rozvojom týchto názorov sa zdalo, že dva prvky - ortuť a síra - nie sú pre alchymistov dostatočné na vysvetlenie zloženia kovov; do nich sa pridala soľ a trochu arzénu. Chceli tým naznačiť, že pri všetkých premenách kovov zostáva niečo neprchavé, konštantné. Ak v prírode „premena základných kovov na ušľachtilé kovy trvá storočia“, alchymisti sa snažili vytvoriť podmienky, za ktorých by tento proces dokonalosti, dozrievania bol rýchly a ľahký. Kvôli úzkemu prepojeniu chémie s vtedajšou medicínou a potom s biológiou bola myšlienka transformácie kovov prirodzene identifikovaná s myšlienkou rastu a rozvoja organizovaných telies: prechod, napríklad, olova na zlato, formovania rastliny z obilia vyhodeného do zeme a, ako to bolo, rozkladu, fermentácie, uzdravenie chorého orgánu u človeka - to všetko boli konkrétne javy jedného spoločného tajomného životného procesu, zlepšenia a boli spôsobené iba stimulmi. Z toho je zrejmé, že záhadným princípom, ktorý umožňuje získavať zlato, bolo liečiť choroby, zmeniť staré ľudské telo na mladé a tak ďalej. Takže existoval koncept nádherného kameňa filozofa.
Pokiaľ ide o úlohu kameň filozofa pri premene základných kovov na ušľachtilé sú náznaky ich premeny na zlato, málo sa hovorí o získavaní striebra. Podľa niektorých autorov kameň toho istého filozofa premieňa kovy na striebro a zlato; podľa iných existujú dva druhy tejto látky: jeden dokonalý, druhý menej dokonalý a ten posledný slúži na výrobu striebra. Pokiaľ ide o množstvo kameňa filozofa potrebného na transformáciu, smery sú tiež odlišné. V jednej, jednej časti je schopná premeniť 10 000 000 dielov kovu na zlato, v iných - 100 dieloch a dokonca iba 2 dieloch. Na získanie zlata sa roztavil nejaký základný kov alebo sa odobrala ortuť a hodil sa tam kameň filozofa; niektorí ubezpečili, že k transformácii dochádza okamžite, zatiaľ čo iní - kúsok po kúsku. Tieto názory na povahu kovov a na ich schopnosť transformovať sa držia spravidla mnoho storočí až do XVII. Storočia, keď to všetko začnú ostro popierať, najmä preto, že tieto pohľady spôsobili objavenie sa mnohých šarlatánov, ktorí využili nádej dôveryhodných na zlato. Obzvlášť bojoval s myšlienkami alchymistov Boyle „Chcel by som vedieť,“ hovorí na jednom mieste, „ako možno zlato rozložiť na ortuť, síru a soľ; Som ochotný uhradiť náklady za túto skúsenosť; pre mňa by som to nikdy nemohol dosiahnuť. “
Po storočiach neúspešných pokusov o umelú výrobu kovov as množstvom faktov, ktoré sa nahromadili v 17. storočí, napríklad úloha vzduchu pri spaľovaní, zvýšenie hmotnosti kovu pri oxidácii, ktoré, mimochodom, Geber v ôsmom storočí sa otázka elementárneho zloženia kovu zdala byť veľmi blízko ku koncu; ale v chémii sa objavil nový prúd, ktorého výsledkom bola teória flogistónu, a riešenie tejto otázky bolo ešte dlho odložené.
Vedci tej doby sa veľmi zaujímali o javy spaľovania. Vychádzajúc zo základnej myšlienky tej doby, že podobnosti vo vlastnostiach telies by mali vychádzať z rovnakých princípov, z prvkov, ktoré ich tvoria, sa predpokladalo, že horľavé telá obklopujú spoločný prvok. Akt horenia sa považoval za akt rozkladu, rozpad na prvky; zatiaľ čo prvok horľavosti vynikal vo forme plameňa, zatiaľ čo iné zostali. Síra, ktorá uznáva pohľad alchymistov na tvorbu kovov z troch prvkov, ortuť, síra a soľ, a akceptuje ich skutočnú existenciu v kove, musela byť uznaná za horľavý princíp. Potom druhá zložka kovu, samozrejme, musela rozpoznať zvyšok kalcinácie kovu - „zem“, ako to vtedy hovorili; preto s ortuťou nemá nič spoločné. Na druhej strane síra vyhorí kyselina sírová , ktoré sa na základe toho, čo už bolo povedané, považovali za jednoduchšie telo ako síra a boli zahrnuté do počtu základných telies. Vyskytol sa zmätok a rozpor. Becher aby zladil staré koncepty s novými, akceptoval existenciu troch stupňov zemského kovu: v skutočnosti „zem“, „horľavá zem“ a „ortuťová zem“. Za týchto podmienok Stahl navrhol jeho teóriu. Začiatok horľavosti podľa jeho názoru nie je síra alebo akákoľvek iná známa látka, ale niečo neznáme, ktoré pomenoval phlogiston , Kovy sú pravdepodobne tvorené z flogistónu a zeme; kalcinácia kovu vo vzduchu je sprevádzaná uvoľňovaním flogistónu; spätný príjem kovov z jeho pôdy pomocou uhlia - látky bohatej na phlogistón - je aktom kombinácie phlogistónu so zemou. Hoci tam bolo niekoľko kovov a každý z nich, keď bol kalcinovaný, dal svoju vlastnú pôdu, posledne menovaná bola ako jeden prvok, takže táto zložka kovu mala rovnakú hypotetickú povahu ako phlogistón; Stahlovi nasledovníci však niekedy brali toľko „elementárnej pôdy“ ako boli kovy. keď Cavendish pri rozpúšťaní kovov v prijatých kyselinách vodík a študoval jeho vlastnosti (neschopnosť udržať horenie, jeho výbušnosť v zmesi so vzduchom atď.), v ňom rozpoznal Stahlov flogistón; kovy podľa jeho koncepcií pozostávajú z vodíka a „zeme“. Tento názor akceptovali mnohí stúpenci teórie flogistónov.
Napriek zjavnej harmónii teórie flogistónov existovali hlavné skutočnosti, ktoré s tým nemohli súvisieť. Heber tiež vedel, že kovy pri horení zvyšujú hmotnosť; Medzitým musia podľa Stahla stratiť phlogistón: keď je phlogiston znovu spojený so „zemou“, hmotnosť získaného kovu je nižšia ako hmotnosť „zeme“. Ukázalo sa teda, že phlogiston musí mať určitú zvláštnu vlastnosť - negatívnu gravitáciu. Napriek všetkým vtipným hypotézam, ktoré vysvetlili tento jav, to bolo nepochopiteľné a záhadné.
keď Lavoisier zistil úlohu vzduchu pri spaľovaní a ukázal, že zisk v hmotnosti kovov pri horení pochádza z pridávania kyslíka zo vzduchu do kovov, a tak sa zistilo, že akt horenia kovov nie je rozklad na prvky, ale naopak akt spájania, otázka zložitosti kovov bolo vyriešené negatívne. Kovy boli priradené k jednoduchým chemickým prvkom, na základe hlavnej myšlienky Lavoisiera, že jednoduché telá sú tie, od ktorých nebolo možné izolovať iné telá. S vytvorením periodický systém chemických prvkov Mendelejev kovové prvky v tom zaujali svoje správne miesto.
Pozri tiež
poznámky
referencie
- S. P. Vukolov: // Encyklopedický slovník Brockhaus a Efron : V 86 zväzkoch (82 zväzkov a 4 ďalšie). - SPb. , 1890-1907. (historická časť)
| Periodická tabuľka | |
|---|---|
| Dmitrij Ivanovič Mendeleev · Periodické právo · Skupiny položiek | |
| formáty | krátky · Po blokoch · rozšírená · Zväčšené · Elektronické konfigurácie · electronegativity · alternatívne · Izotopy prvkov |
| Zoznamy položiek na | názov ·
etymológia (na počesť miest, na počesť objaviteľov) · Otváracia doba Oxidačný stav · prevaha (u človeka) · Stabilita izotopov · |


