30.08.2019
Výrobná technológia hliníka. Technologický proces výroby hliníka
1.1 Získanie oxidu hlinitého z rúd
Alumina sa vyrába tromi spôsobmi: zásaditou, kyslou a elektrolytickou. Alkalická metóda sa najčastejšie používa (metóda K. I. Bayera, ktorá sa v Rusku vyvinula na konci storočia pred posledným a používa sa na spracovanie vysokokvalitného bauxitu s malým množstvom (až 5 - 6%) oxidu kremičitého). Od tej doby sa jeho technická implementácia výrazne zlepšila. Schéma výroby oxidu hlinitého podľa Bayerovej metódy je znázornená na obr. 1.
Podstata metódy spočíva v tom, že roztoky hliníka sa rýchlo rozložia, keď sa do nich zavedie hydroxid hlinitý, a roztok, ktorý zostane po rozklade po odparení za intenzívneho miešania pri 169 až 170 ° C, môže znovu rozpustiť oxid hlinitý obsiahnutý v bauxite. Táto metóda pozostáva z nasledujúcich základných operácií:
Príprava bauxitu pozostávajúceho z jeho drvenia a mletia v mlynoch; do mlynov sa privádza bauxit, žieravina a malé množstvo vápna, čo zlepšuje uvoľňovanie A1203; výsledná buničina sa privádza na vylúhovanie;
Vylúhovanie bauxitu (nedávno používané okrúhle autoklávové bloky boli čiastočne nahradené tubulárnymi autoklávmi, v ktorých k vyluhovaniu dochádza pri teplotách 230 - 250 ° C (500 - 520 K)), ktoré spočíva v jeho chemickom rozklade z interakcie s vodným alkalickým roztokom; hydráty oxidu hlinitého pri kontakte s alkáliami prechádzajú do roztoku vo forme hlinitanu sodného:
AlOOH + NaOH → NaA102 + H20
Al (OH) 3 + NaOH → NaA102 + 2H20;
Si02 + 2NaOH → Na2Si03 + H20;
v roztoku hlinitan sodný a kremičitan sodný nerozpustný hlinitokremičitan sodný; oxidy titánu a železa prechádzajú do nerozpustného zvyšku, čím sa zvyšok stáva červeným; tento zvyšok sa nazýva červené bahno. Po dokončení rozpúšťania sa výsledný hlinitan sodný zriedi vodným alkalickým roztokom, pričom sa teplota zníži o 100 ° C;
Oddelenie roztoku hlinitanu od červeného bahna sa zvyčajne vykonáva praním v špeciálnych zahusťovadlách; v dôsledku toho sa červené bahno usadí a roztok hlinitanu sa vypustí a potom sa prefiltruje (vyčíri). Kal sa v obmedzenom množstve používa napríklad ako prísada do cementu. Podľa stupňa bauxitu predstavuje 1 - 1 t oxidu hlinitého 0,6 - 1,0 t červeného bahna (sušina);
Rozklad roztoku hlinitanu. Prefiltruje sa a prečerpá do veľkých nádob so zmiešavačmi (rozkladače). Po ochladení na 60 ° C (330 K) a za stáleho miešania sa z presýteného roztoku extrahuje hydroxid hlinitý Al (OH) 3. Pretože tento proces prebieha pomaly a nerovnomerne a počas jeho ďalšieho spracovania je veľmi dôležitá tvorba a rast kryštálov hydroxidu hlinitého, do rozkladača sa pridáva veľké množstvo pevného hydroxidu:
Na20 ּ AI203 + 4H20 → AI (OH) 3 + 2NaOH;
Priradenie hydroxidu hlinitého a jeho klasifikácia; k tomu dochádza v hydrocyklónoch a vo vákuových filtroch, kde sa z roztoku hlinitanu izoluje zrazenina obsahujúca 50 - 60% Al (OH) častíc. Významná časť hydroxidu sa vracia do procesu rozkladu ako očkovací materiál, ktorý zostáva v obehu v konštantných množstvách. Zvyšok po premytí vodou prejde na kalcináciu; filtrát sa tiež vracia do obehu (po skoncentrovaní v odparovačoch, na vylúhovanie nového bauxitu);
Dehydratácia hydroxidu hlinitého (kalcinácia); toto je posledná operácia výroby oxidu hlinitého; vykonáva sa v rúrkových rotačných peciach a nedávno aj v peciach s turbulentným pohybom materiálu pri teplote 1150 - 1300 ° C; Surový hydroxid hlinitý, ktorý prechádza rotačnou pecou, \u200b\u200bsa vysuší a dehydratuje; pri zahrievaní sa postupne vyskytujú tieto štrukturálne transformácie:
| Al (OH) 3 → AlOOH → y-Al203 → a-Al203 |
V konečne kalcinovanej alumíne obsahuje 30 - 50% a-AI203 (korund), zvyšok je y-AI203.
Táto metóda extrahuje 85 až 87% z celkového množstva získaného oxidu hlinitého. Výsledný oxid hlinitý je silná chemická zlúčenina s teplotou topenia 2050 ° C.
1.2 Získanie hliníka z jeho oxidu
Elektrolytická redukcia oxidu hlinitého rozpusteného v tavenine na báze kryolitu sa uskutočňuje pri 950 - 970 ° C v elektrolyzéri. Článok sa skladá z kúpeľa obloženého uhlíkovými blokmi, do ktorého dna sa dodáva elektrický prúd. Kvapalný hliník uvoľňovaný na dne slúžiaci ako katóda je ťažší ako roztavená soľ elektrolytu, preto sa zhromažďuje na uhoľnej báze, odkiaľ sa pravidelne čerpá (obrázok 2). Zhora sú uhlíkové anódy ponorené do elektrolytu, ktorý v atmosfére kyslíka uvoľňovaného z oxidu hlinitého horí, čím uvoľňuje oxid uhoľnatý (CO) alebo oxid uhličitý (CO2). V praxi sa používajú dva typy anód:
a) samovypaľovacie Zederbergove anódy pozostávajúce z brikiet, tzv. „bochníkov“ zederbergovej hmoty (uhlie s nízkym obsahom popola s 25 - 35% smoly čiernouhoľného dechtu) plnené do hliníkovej schránky; pod vplyvom vysokej teploty je anódová hmota spálená (spekaná);
b) žíhané alebo „nepretržité“ anódy z veľkých uhoľných blokov (napríklad 1900 × 600 × 500 mm s hmotnosťou približne 1,1 tony).
Prúdová sila na elektrolyzéroch je 150 000 A. Sú pripojené k sieti v sérii, to znamená, že sa získa systém (séria) - dlhá séria elektrolyzérov.
Prevádzkové napätie v kúpeli, ktoré je 4 až 5 V, je výrazne vyššie ako napätie, pri ktorom dochádza k rozkladu oxidu hlinitého, pretože počas prevádzky sú nevyhnutné straty napätia v rôznych častiach systému. Bilancia surovín a energie pri výrobe 1 tony hliníka je uvedená na obr. 3.
Elektrolýza chloridu hlinitého (metóda Alcoa)
V reakčnej nádobe sa najprv oxid hlinitý premení na chlorid hlinitý. Potom sa v husto izolovanom kúpeli uskutoční elektrolýza AlCl3 rozpusteného v roztavenej soli KCl, NaCl. Chlór uvoľňovaný počas tohto procesu sa odsáva a dodáva na druhotné použitie; hliník sa nanáša na katódu.
Výhody tohto spôsobu oproti existujúcej elektrolýze tekutej taveniny kryolitu-aluminy (Al203, rozpustenej v kryolite Na3AlF6) sú: úspora až 30% energie; možnosť použitia oxidu hlinitého, ktorý nie je vhodný pre tradičnú elektrolýzu (napríklad AI203 s vysokým obsahom kremíka); nahradenie drahého kryolitu lacnejšími soľami; vymiznutie nebezpečenstva uvoľňovania fluoridov.
Redukcia chloridu hlinitého pomocou mangánu (Toth - metóda)
Ak sa mangán redukuje z chloridu hlinitého, uvoľňuje sa hliník. Kontrolovanou kondenzáciou sa z prúdu chloridu mangánu uvoľňujú kontaminanty súvisiace s chlórom. Pri uvoľňovaní chlóru sa chlorid mangánu oxiduje na oxid mangánu, ktorý sa potom redukuje na recyklovateľný mangán. Informácie v existujúcich publikáciách sú veľmi nepresné, takže v tomto prípade musíte opustiť hodnotenie metódy.
Jedna veľmi pochybná legenda hovorí, že k rímskemu cisárovi Tiberiovi (42 pnl - 37 nl) prišiel raz muž s kovovou nerozbitnou miskou. Materiál misky bol údajne získaný z oxidu hlinitého (Al203), a preto musel byť hliník. Tiberius, ktorý sa obával, že taký hlinený kov dokáže znehodnotiť zlato a striebro, prikázal mužovi, aby bol odrezaný len pre prípad. Samozrejme, tento príbeh je ťažko uveriteľný: natívny hliník sa v prírode nevyskytuje a počas doby Rímskej ríše nemohli existovať žiadne technické prostriedky, ktoré by umožňovali získavanie hliníka z jeho zložiek.
Z hľadiska výskytu v prírode je hliník na prvom mieste medzi kovmi; jej obsah v zemskej kôre je 7,45%. Napriek rozšírenému výskytu v prírode bol hliník do konca 19. storočia jedným z vzácnych kovov. V čistej forme sa hliník nevyskytuje z dôvodu vysokej chemickej aktivity. Nachádza sa hlavne vo forme zlúčenín s kyslíkom a kremičitohlinitokremičitanmi.
Hliníkové rudy môžu slúžiť iba horninám bohatým na oxid hlinitý (Al 2 O 3) a vyskytujúcim sa vo veľkých množstvách na povrchu Zeme. Medzi tieto horniny patrí bauxit, nefelín - (Na, K) 20 O, AI203, 2Si02, alunity - (Na, K) 2S04, A 2 (S04) 3 4 AI (OH) 3 a kaolíny (hlina), pole. spar (ortoklasa) - K20 ּ Al203 ּ6Si02.
Hlavnou rudou na výrobu hliníka je bauxit. Hliník v nich je obsiahnutý vo forme hydroxidov Al (OH), AlOOH, korundu AI2O3 a kaolinitu AI2O3 ּ2SÍO2 ּ2H20. Chemické zloženie komplex bauxitu: 28-70% aluminy; 0,5 - 20% oxidu kremičitého; 2-50% oxidu železa; 0,1 až 10% oxidu titaničitého. Nedávno sa ako ruda používali nefelín a alunit.
Veľké ložiská bauxitu sa nachádzajú v Uralu, v oblasti Tikhvin v oblasti Leningrad, na území Altaj a Krasnojarsk.
Nephelín (K ּ Na 2 O ּ Al 2 O 3 ּ 2 SiO 2) je súčasťou hornín apatitonefelínu (na polostrove Kola).
Prvýkrát vo voľnej forme bol hliník izolovaný v roku 1825 dánskym fyzikom Oerstedom pôsobením amalgámu draselného na chlorid hlinitý. V roku 1827 Nemecký chemik Weller vylepšil Oerstedovu metódu nahradením draselného amalgámu kovovým draslíkom:
AlCl3 + 3K → 3KCl + Al (Reakcia prebieha s uvoľňovaním tepla).
V roku 1854 St. Clair Deville vo Francúzsku prvýkrát uplatnila Welerovu metódu na priemyselnú výrobu hliníka, pričom namiesto draslíka použila lacnejší sodík a namiesto hygroskopického chloridu hlinitého, stabilnejšieho dvojitého chloridu hlinitého a sodíka. V roku 1865 ruský fyzik-chemik NN Beketov ukázal možnosť vytesnenia hliníka horčíkom z roztaveného kryolitu. Táto reakcia sa použila v roku 1888 na výrobu hliníka v prvom nemeckom závode v Gmelingene. Výroba hliníka týmito tzv. „Chemickými“ metódami sa uskutočňovala v rokoch 1854 až 1890. Za 35 rokov sa pomocou týchto metód získalo celkom asi 20 ton hliníka.
Na konci 80. rokov minulého storočia nahradili elektrolytické metódy chemické metódy, ktoré umožnili výrazne znížiť náklady na hliník a vytvorili predpoklady pre rýchly rozvoj odvetvia výroby hliníka. Zakladatelia modernej elektrolytickej metódy na výrobu hliníka, Eru vo Francúzsku a Hall v USA podali v roku 1886 nezávisle rovnaké prihlášky na patentovanie spôsobu výroby hliníka elektrolýzou aluminy rozpustenej v roztavenom kryolite. Od zavedenia patentov Eru a Hall sa začal moderný priemysel hliníka, ktorý sa za viac ako 115 rokov svojej existencie rozrástol na jedno z najväčších v metalurgii.
Postup výroby hliníka pozostáva z troch hlavných etáp:
1). Získanie oxidu hlinitého (Al203) z hliníkových rúd;
2). Získanie hliníka z aluminy;
3). Rafinovanie hliníka.
Získanie oxidu hlinitého z rúd.
Alumina sa vyrába tromi spôsobmi: zásaditou, kyslou a elektrolytickou. Alkalická metóda sa najčastejšie používa (metóda K. I. Bayera, ktorá sa v Rusku vyvinula na konci storočia pred posledným a používa sa na spracovanie vysokokvalitného bauxitu s malým množstvom (až 5 - 6%) oxidu kremičitého). Od tej doby sa jeho technická implementácia výrazne zlepšila. Schéma výroby oxidu hlinitého podľa Bayerovej metódy je znázornená na obr. 1.
Podstata metódy spočíva v tom, že roztoky hliníka sa rýchlo rozložia, keď sa do nich zavedie hydroxid hlinitý, a roztok, ktorý zostane po rozklade po odparení za intenzívneho miešania pri 169 až 170 ° C, môže znovu rozpustiť oxid hlinitý obsiahnutý v bauxite. Táto metóda pozostáva z nasledujúcich základných operácií:
1). Príprava bauxitu pozostávajúceho z jeho drvenia a mletia v mlynoch; do mlynov sa privádza bauxit, žieravina a malé množstvo vápna, čo zlepšuje uvoľňovanie A1203; výsledná buničina sa privádza na vylúhovanie;
2). Vylúhovanie bauxitu (nedávno používané okrúhle autoklávové bloky sú čiastočne nahradené tubulárnymi autoklávmi, v ktorých k vyluhovaniu dochádza pri teplotách 230 - 250 ° C (500 - 520 K)), ktoré spočíva v jeho chemickom rozklade z interakcie s vodným alkalickým roztokom; hydráty oxidu hlinitého pri kontakte s alkáliami prechádzajú do roztoku vo forme hlinitanu sodného:
AlOOH + NaOH → NaA102 + H20
Al (OH) 3 + NaOH → NaA102 + 2H20;
Si02 + 2NaOH → Na2Si03 + H20;
v roztoku hlinitan sodný a kremičitan sodný nerozpustný hlinitokremičitan sodný; oxidy titánu a železa prechádzajú do nerozpustného zvyšku, čím sa zvyšok stáva červeným; tento zvyšok sa nazýva červené bahno. Po dokončení rozpúšťania sa výsledný hlinitan sodný zriedi vodným alkalickým roztokom, pričom sa teplota zníži o 100 ° C;
3). Oddelenie roztoku hlinitanu od červeného bahna sa zvyčajne vykonáva praním v špeciálnych zahusťovadlách; v dôsledku toho sa červené bahno usadí a roztok hlinitanu sa vypustí a potom sa prefiltruje (vyčíri). Kal sa v obmedzenom množstve používa napríklad ako prísada do cementu. Podľa stupňa bauxitu predstavuje 1 - 1 t oxidu hlinitého 0,6 - 1,0 t červeného bahna (sušina);
4). Rozklad roztoku hlinitanu. Prefiltruje sa a prečerpá do veľkých nádob so zmiešavačmi (rozkladače). Po ochladení na 60 ° C (330 K) a za stáleho miešania sa z presýteného roztoku extrahuje hydroxid hlinitý Al (OH) 3. Pretože tento proces prebieha pomaly a nerovnomerne a počas jeho ďalšieho spracovania je veľmi dôležitá tvorba a rast kryštálov hydroxidu hlinitého, do rozkladača sa pridáva veľké množstvo pevného hydroxidu:
Na20 ּ AI203 + 4H20 → AI (OH) 3 + 2NaOH;
5). Priradenie hydroxidu hlinitého a jeho klasifikácia; k tomu dochádza v hydrocyklónoch a vo vákuových filtroch, kde sa z roztoku hlinitanu izoluje zrazenina obsahujúca 50 - 60% Al (OH) častíc. Významná časť hydroxidu sa vracia do procesu rozkladu ako očkovací materiál, ktorý zostáva v obehu v konštantných množstvách. Zvyšok po premytí vodou prejde na kalcináciu; filtrát sa tiež vracia do obehu (po skoncentrovaní v odparovačoch, na vylúhovanie nového bauxitu);
6). Dehydratácia hydroxidu hlinitého (kalcinácia); toto je posledná operácia výroby oxidu hlinitého; vykonáva sa v rúrkových rotačných peciach a nedávno aj v peciach s turbulentným pohybom materiálu pri teplote 1150 - 1300 ° C; Surový hydroxid hlinitý, ktorý prechádza rotačnou pecou, \u200b\u200bsa vysuší a dehydratuje; pri zahrievaní sa postupne vyskytujú tieto štrukturálne transformácie:
| Al (OH) 3 → AlOOH → y-Al203 → a-Al203 | |||
| 200 o C– | 950 ® | 1200 o S. | |
V konečne kalcinovanej alumíne obsahuje 30 - 50% a-AI203 (korund), zvyšok je y-AI203.
Táto metóda extrahuje 85 až 87% z celkového množstva získaného oxidu hlinitého. Výsledný oxid hlinitý je silná chemická zlúčenina s teplotou topenia 2050 ° C.
Získanie hliníka z jeho oxidu
Elektrolýza oxidu hlinitého
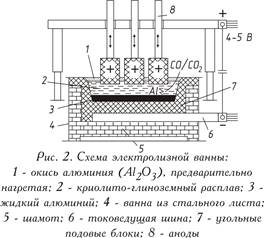 Elektrolytická redukcia oxidu hlinitého rozpusteného v tavenine na báze kryolitu sa uskutočňuje pri 950 - 970 ° C v elektrolyzéri. Článok sa skladá z kúpeľa obloženého uhlíkovými blokmi, do ktorého dna sa dodáva elektrický prúd. Kvapalný hliník vyzrážaný na dne slúžiaci ako katóda je ťažší ako tavenina elektrolytu, preto sa zhromažďuje na uhoľnej báze, odkiaľ sa periodicky čerpá (obrázok 2). Zhora sú uhlíkové anódy ponorené do elektrolytu, ktorý v atmosfére kyslíka uvoľňovaného z oxidu hlinitého horí, čím uvoľňuje oxid uhoľnatý (CO) alebo oxid uhličitý (CO2). V praxi sa používajú dva typy anód:
Elektrolytická redukcia oxidu hlinitého rozpusteného v tavenine na báze kryolitu sa uskutočňuje pri 950 - 970 ° C v elektrolyzéri. Článok sa skladá z kúpeľa obloženého uhlíkovými blokmi, do ktorého dna sa dodáva elektrický prúd. Kvapalný hliník vyzrážaný na dne slúžiaci ako katóda je ťažší ako tavenina elektrolytu, preto sa zhromažďuje na uhoľnej báze, odkiaľ sa periodicky čerpá (obrázok 2). Zhora sú uhlíkové anódy ponorené do elektrolytu, ktorý v atmosfére kyslíka uvoľňovaného z oxidu hlinitého horí, čím uvoľňuje oxid uhoľnatý (CO) alebo oxid uhličitý (CO2). V praxi sa používajú dva typy anód:
a) samovypaľovacie Zederbergove anódy pozostávajúce z brikiet, tzv. „bochníkov“ zederbergovej hmoty (uhlie s nízkym obsahom popola s 25 - 35% smoly čiernouhoľného dechtu) plnené do hliníkovej schránky; pod vplyvom vysokej teploty je anódová hmota spálená (spekaná);
b) žíhané alebo „nepretržité“ anódy z veľkých uhoľných blokov (napríklad 1900 × 600 × 500 mm s hmotnosťou približne 1,1 tony).
Prúdová sila na elektrolyzéroch je 150 000 A. Sú pripojené k sieti v sérii, to znamená, že sa získa systém (séria) - dlhá séria elektrolyzérov.
Prevádzkové napätie v kúpeli, ktoré je 4 až 5 V, je výrazne vyššie ako napätie, pri ktorom dochádza k rozkladu oxidu hlinitého, pretože počas prevádzky sú nevyhnutné straty napätia v rôznych častiach systému. Bilancia surovín a energie pri výrobe 1 tony hliníka je uvedená na obr. 3.
Elektrolýza chloridu hlinitého (metóda Alcoa)
 V reakčnej nádobe sa najprv oxid hlinitý premení na chlorid hlinitý. Potom sa v husto izolovanom kúpeli uskutoční elektrolýza AlCl3 rozpusteného v roztavenej soli KCl, NaCl. Chlór uvoľňovaný počas tohto procesu sa odsáva a dodáva na druhotné použitie; hliník sa nanáša na katódu.
V reakčnej nádobe sa najprv oxid hlinitý premení na chlorid hlinitý. Potom sa v husto izolovanom kúpeli uskutoční elektrolýza AlCl3 rozpusteného v roztavenej soli KCl, NaCl. Chlór uvoľňovaný počas tohto procesu sa odsáva a dodáva na druhotné použitie; hliník sa nanáša na katódu.
Výhody tohto spôsobu oproti existujúcej elektrolýze tekutej taveniny kryolitu-aluminy (Al203, rozpustenej v kryolite Na3AlF6) sú: úspora až 30% energie; možnosť použitia oxidu hlinitého, ktorý nie je vhodný pre tradičnú elektrolýzu (napríklad AI203 s vysokým obsahom kremíka); nahradenie drahého kryolitu lacnejšími soľami; vymiznutie nebezpečenstva uvoľňovania fluoridov.
Redukcia chloridu hlinitého pomocou mangánu (Toth - metóda)
 Ak sa mangán redukuje z chloridu hlinitého, uvoľňuje sa hliník. Kontrolovanou kondenzáciou sa z prúdu chloridu mangánu uvoľňujú kontaminanty súvisiace s chlórom. Pri uvoľňovaní chlóru sa chlorid mangánu oxiduje na oxid mangánu, ktorý sa potom redukuje na recyklovateľný mangán. Informácie v existujúcich publikáciách sú veľmi nepresné, takže v tomto prípade musíte opustiť hodnotenie metódy.
Ak sa mangán redukuje z chloridu hlinitého, uvoľňuje sa hliník. Kontrolovanou kondenzáciou sa z prúdu chloridu mangánu uvoľňujú kontaminanty súvisiace s chlórom. Pri uvoľňovaní chlóru sa chlorid mangánu oxiduje na oxid mangánu, ktorý sa potom redukuje na recyklovateľný mangán. Informácie v existujúcich publikáciách sú veľmi nepresné, takže v tomto prípade musíte opustiť hodnotenie metódy.
Získanie rafinovaného hliníka
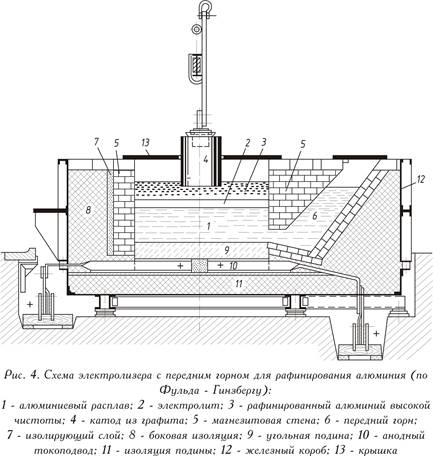
V prípade hliníka nie je možné rafinovať elektrolýzu rozkladom vodných solí. Pretože na niektoré účely stupeň čistenia priemyselného hliníka (Al 99,5 - Al 99,8) získaný elektrolýzou taveniny kryolitu a oxidu hlinitého je nedostatočný, rafináciou sa z čistého priemyselného hliníka alebo kovového odpadu získa ešte čistejší hliník (Al 99, 99 R). Najznámejšou rafinačnou metódou je trojvrstvová elektrolýza.
Trojvrstvová elektrolytická rafinácia
Rafinačný kúpeľ, ktorý je vybavený oceľovým plechom pracujúcim na jednosmerný prúd (pozri obrázok 4 - pozri vyššie), pozostáva z uhoľného krbu s elektrickými prívodmi a tepelne izolujúceho magnezitového obloženia. Na rozdiel od elektrolýzy taveniny kryolitu a oxidu hlinitého je tu obvykle anódou roztavený rafinovaný kov (spodná anódová vrstva). Elektrolyt sa skladá z čistých fluoridov alebo zo zmesi chloridu bárnatého a fluoridov hliníka a sodíka (stredná vrstva). Hliník rozpustený z anódovej vrstvy v elektrolyte sa uvoľňuje nad elektrolyt (horná katódová vrstva). Čistý kov slúži ako katóda. Prúd je dodávaný do katódovej vrstvy grafitovou elektródou.
Kúpeľ pracuje pri 750 až 800 ° C, spotreba energie je 20 kWh / h na 1 kg čistého hliníka, t.j. o niečo vyššia ako pri konvenčnej elektrolýze hliníka.
Kov anódy obsahuje 25 - 35% Cu; 7-12% Zn; 6-9% Si; až 5% Fe a malé množstvo mangánu, niklu, olova a cínu, zvyšok (40 - 55%) je hliník. Všetky ťažké kovy a kremík počas rafinácie zostávajú vo vrstve anódy. Prítomnosť horčíka v elektrolyte vedie k nežiaducim zmenám v zložení elektrolytu alebo k jeho silnej troske. Na odstránenie horčíka sa troska obsahujúca horčík spracováva tavivom alebo plynným chlórom.
Výsledkom rafinácie je získanie čistého hliníka (99,99%) a produktov segregácie (produkt Zager), ktoré obsahujú ťažké kovy a kremík a uvoľňujú sa vo forme alkalického roztoku a kryštalického zvyšku. Alkalickým roztokom je odpad a tuhý zvyšok sa používa na deoxidáciu.
Rafinovaný hliník má obvykle nasledujúce zloženie,%: Fe 0,0005-0,002; Si 0,002 - 0,005; Cu 0,0005-0,002; Zn 0,0005-0,002; Stopy Mg; Všetci ostatní.
Rafinovaný hliník sa spracúva na polotovar v stanovenom zložení alebo legovaný horčíkom (pozri tabuľku. 1.2.).
TABUĽKA 1.2. Chemické zloženie hliníka vysokej čistoty a primárneho hliníka podľa DIN 1712 , hárok 1.
| značka | číslo | Prípustné nečistoty *,% | |||||||
| iba | vrátane | ||||||||
| si | fe | tí | Cu | zn | ostatné | ||||
| A199,99R | 3.0400 | 0,01 | 0,006 | 0,005 | 0,002 | 0,003 | 0,005 | 0,001 | |
| A199,9H | 3.0300 | 0,1 | 0,050 | 0,035 | 0,006 | 0,005 | 0,04 | 0,003 | |
| A199,8H | 3.0280 | 0,2 | 0,15 | 0,15 | 0,03 | 0,01 | 0,06 | 0,01 | |
| A199,7H | 3.0270 | 0,3 | 0,20 | 0,25 | 0,03 | 0,01 | 0,06 | 0,01 | |
| A199,5H ** | 3.0250 | 0,5 | 0,30 | 0,40 | 0,03 | 0,02 | 0,07 | 0,03 | |
| A199H | 3.0200 | 1,0 | 0,5 | 0,6 | 0,03 | 0,02 | 0,08 | 0,03 | |
* Pokiaľ je to možné stanoviť konvenčnými výskumnými metódami. ** Čistý hliník pre elektrotechniku \u200b\u200b(hliníkové vodiče) sa dodáva vo forme primárneho hliníka 99,5, obsahujúci najviac 0,03% (Ti + Cr + V + Mn); v tomto prípade označený E-A1, číslo materiálu 3.0256. Inak vyhovuje VDE-0202. |
|||||||||
Rafinovanie zlúčeninami organohlinitých komplexov a tavenie zón
Hliník s čistotou vyššou ako A1 A1 99,99 R sa môže získať rafináciou elektrolýzy čistého alebo technicky čistého hliníka s použitím komplexných zlúčenín hliníka a organohliníka ako elektrolytu. Elektrolýza sa uskutočňuje pri teplote asi 1000 ° C medzi tuhými hliníkovými elektródami a je v zásade podobná rafinovanej elektrolýze medi. Povaha elektrolytu určuje potrebu pracovať bez vzduchu a pri nízkej prúdovej hustote.
Tento typ rafinačnej elektrolýzy, pôvodne používaný iba v laboratórnom meradle, sa už vykonáva v malom rozsahu výroby - ročne sa vyprodukuje niekoľko ton kovu. Nominálny stupeň čistenia výsledného kovu je 99,999 - 99,9999%. Potenciálne aplikácie pre kov tejto čistoty sú kryogénne elektrotechnika a elektronika.
Pri elektrolytickom pokovovaní je možné použiť uvažovanú metódu rafinácie.
Ešte vyššiu čistotu - nominálne až do A1 99,99999 - je možné získať následným roztavením kovu v zóne. Pri spracovaní hliníka vysokej čistoty na polotovary, plechy alebo drôty sa musia vziať do úvahy osobitné bezpečnostné opatrenia, berúc do úvahy nízku teplotu rekryštalizácie kovu. Pozoruhodnou vlastnosťou rafinovaného kovu je jeho vysoká elektrická vodivosť v oblasti kryogénnych teplôt.
Získanie sekundárneho hliníka
Spracovanie druhotných surovín a produkčného odpadu je ekonomicky realizovateľné. Výsledné sekundárne zliatiny uspokojujú asi 25% celkového dopytu po hliníku.
 Najdôležitejšou oblasťou aplikácie sekundárnych zliatin je výroba odliatkov v tvare hliníka. V norme DIN 1725, list 2, spolu so štandardnými druhmi zliatin je uvedené množstvo zliatin vyrábaných zlievarňami. Zoznam zliatin vyrábaných v týchto závodoch obsahuje okrem štandardu aj niektoré neštandardné zliatiny.
Najdôležitejšou oblasťou aplikácie sekundárnych zliatin je výroba odliatkov v tvare hliníka. V norme DIN 1725, list 2, spolu so štandardnými druhmi zliatin je uvedené množstvo zliatin vyrábaných zlievarňami. Zoznam zliatin vyrábaných v týchto závodoch obsahuje okrem štandardu aj niektoré neštandardné zliatiny.
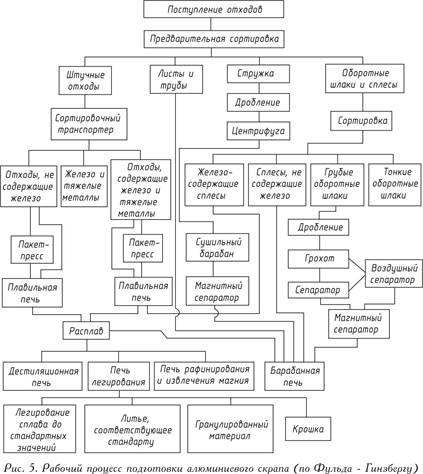
Bezchybnú prípravu hliníkového šrotu v rôznych pomeroch je možné vykonávať iba v špeciálne vybavených taviarňach. Myšlienka komplexného pracovného postupu v takomto závode je uvedená na obr. 5.
Odpad sa pretavuje po hrubom predtriedení. Železo, nikel alebo meď obsiahnuté v týchto odpadoch, ktorých teplota topenia je vyššia ako teplota topenia hliníka, v ňom zostáva počas tavenia v prahovej peci tavenia a taví sa hliník. Na odstránenie nekovových inklúzií z odpadov, ako sú oxidy, nitridy, karbidy alebo plyny, sa roztavený kov spracuje so soľami alebo (racionálnejší) plyn sa vyfukuje chlórom alebo dusíkom.
Na odstraňovanie kovových nečistôt z taveniny sú známe rôzne spôsoby, napríklad pridanie a evakuácia horčíka - Beckscheho metóda; zinok alebo ortuťové prísady s následnou evakuáciou - subhalogénna metóda. Odstránenie horčíka je obmedzené na zavedenie chlóru do roztaveného kovu. Zavedením prísad presne určených zložením taveniny sa získa vopred stanovená zliatina zliatiny.
Výroba hliníka priemyselnej kvality
Elektrolytická metóda je jedinou metódou používanou na svete na výrobu kovového hliníka technickej čistoty. Všetky ostatné metódy (zinkové, karbidotermálne, subchloridové, nitridové atď.), Pomocou ktorých je možné hliník extrahovať z hliníkových rúd, boli vyvinuté v laboratórnom a pilotnom meradle, ale zatiaľ nenašli praktické uplatnenie.
Na získanie zliatin hliníka a kremíka sa úspešne používa elektrotermálna metóda, ktorá bola prvýkrát vyvinutá a implementovaná v priemyselnom meradle v ZSSR. Skladá sa z dvoch stupňov: v prvej etape sa primárna zliatina hliníka a kremíka s obsahom 60 až 63% hliníka získa priamou redukciou hliník-kremíkových rúd v rudných tepelných elektrických peciach; v druhej fáze sa primárna zliatina zriedi technickým hliníkom, čím sa získa kremík a iné zliatiny hliníka a kremíka liate a tvárnené. Prebiehajú štúdie zamerané na získavanie technického hliníka z primárnej zliatiny.
Vo všeobecnosti výroba hliníka elektrolytickou metódou zahŕňa výrobu aluminy (oxidu hlinitého) z hliníkových rúd, výrobu fluoridových solí (kryolit, fluorid hlinitý a fluorid sodný), výrobu uhlíkovej anódovej hmoty, kalcinovanej uhlíkovej anódovej a katódovej blokády a ďalších poťahových materiálov, ako aj skutočná elektrolytická výroba hliníka, ktorá je poslednou etapou modernej metalurgie hliníka.
Pre výrobu aluminy, fluoridových solí a uhlíkových produktov je charakteristická požiadavka na maximálny stupeň čistoty týchto materiálov, pretože taveniny kryolitu a aluminy, ktoré sú podrobené elektrolýze, by nemali obsahovať nečistoty prvkov, ktoré sú viac elektrospektívne ako hliník, ktoré by, ak by boli emitované na katóde, boli predovšetkým škodlivé metal.
V oxidoch hlinitých G-00, G-0 a G-1, ktoré sa používajú hlavne v elektrolýze, je obsah Si02 0,02 až 0,05%, aFe203 - 0,03 až 0,05%. Kryolit v priemere obsahuje 0,36 až 0,38% Si02 a 0,05 až 0,16% Fe203 a fluorid hlinitý 0,30 až 0,35% (Si02 + Fe203). Hmota anódy obsahuje nie viac ako 0,25% Si02 a 0,20% Fe203.
Najdôležitejšia hliníková ruda, z ktorej sa ťaží oxid hlinitý, bauxit. V bauxite je hliník prítomný vo forme hydroxidu hlinitého. V Sovietskom zväze sa okrem bauxitu používa na výrobu oxidu hlinitého aj nefelínová hornina - hlinitokremičitan sodný a draselný, ako aj alunitová hornina, v ktorej je hliník vo forme síranu. Surovinami na výrobu anódovej hmoty a kalcinovaných anódových blokov sú uhlíkové materiály - ropa alebo smola, koks a uhoľný decht ako spojivo a fluorid vápenatý (kazivica) na výrobu kryolitu a iných solí fluoridov.
Počas elektrolytickej výroby hliníka sa alumina Al203 rozpustená v roztavenom kryolite Na3AlF6 elektrochemicky rozloží pri vypúšťaní katiónov hliníka na katódu (tekutý hliník) a kyslík obsahujúce ióny (kyslíkové ióny) na uhlíkovú anódu.
Podľa moderných konceptov sa kryolit v roztavenom stave rozdeľuje na ióny a: a oxid hlinitý na komplexné ióny a: ![]() ktoré sú v rovnováhe s jednoduchými iónmi:
ktoré sú v rovnováhe s jednoduchými iónmi: ![]() ,
, ![]() .
.
Hlavným procesom prebiehajúcim na katóde je redukcia trojmocných hliníkových iónov: Al 3+ + 3 e → Al (I).
Spolu s hlavným procesom je možný neúplný výboj trojmocných hliníkových iónov s tvorbou jednomocných iónov: Al 3+ + 2 e → Al + (II) a nakoniec vypúšťanie jednomocných iónov s uvoľňovaním kovu: Al + + e → Al (III).
Za určitých podmienok (relatívne vysoká koncentrácia iónov Na +, vysoká teplota atď.) Môže pri uvoľňovaní kovu dochádzať k úniku sodných iónov: Na + + e → Na (IV). Reakcie (II) a (IV) spôsobujú pokles prúdu hliníka.
Kyslíkové ióny sa vypúšťajú na uhlíkovú anódu: 2O 2–4 e → O 2. Kyslík sa však neuvoľňuje vo svojej voľnej forme, pretože oxiduje uhlík anódy za vzniku zmesi C02 a CO.
Celková reakcia prebiehajúca v elektrolyzéri môže byť predstavovaná rovnicou Al203 + x C \u003d 2Al + (2 x –3) CO + (3– x) C02.
Zloženie elektrolytu priemyselných elektrolytických článkov z hliníka, okrem hlavných zložiek - kryolitu, fluoridu hlinitého a aluminy, obsahuje malé množstvá (celkom až 8 - 9%) niektorých ďalších solí - CaF 2, MgF 2, NaCl a LiF (prísady), ktoré zlepšujú niektoré fyzikálno-chemické vlastnosti elektrolytu a tým zvýšiť účinnosť elektrolytických článkov. Maximálny obsah aluminy v elektrolyte je obvykle 6 až 8% a počas elektrolýzy sa znižuje. Keď sa elektrolyt vyčerpá z oxidu hlinitého, zavádza sa do neho ďalšia časť oxidu hlinitého. Pri normálnej prevádzke elektrolyzérov hliníka sa pomer NaF: AlF3 v elektrolyte udržuje v rozmedzí 2,7 až 2,8, pričom sa pridávajú podiely kryolitu a fluoridu hlinitého.
Pri výrobe hliníka sa používajú elektrolyzéry so samovoľnými uhlíkovými anódami a prívodom bočného alebo horného prúdu, ako aj elektrolyzéry s uhlíkovými anódami s vopred vypaľovaným uhlom. Najsľubnejšia konštrukcia elektrolytických článkov s vypálenými anódami, ktorá umožňuje zvýšiť výkon jednotky, znížiť špecifickú spotrebu elektrickej energie jednosmerným prúdom pre elektrolýzu, získať čistší kov, zlepšiť hygienické a hygienické pracovné podmienky a znížiť emisie škodlivých látok do atmosféry.
Hlavné technické parametre a ukazovatele výkonu hliníkových elektrolyzérov rôznych typov sú uvedené v tabuľke. 1.3.
TABUĽKA 1.3
ZÁKLADNÉ TECHNICKÉ PARAMETRE A UKAZOVATELE PRÁCE HLINÍKOVÝCH ELEKTROLYZÉROV
| Parametre a ukazovatele | S anódami na pečenie | S spálenými anódami | |
postranné prívod prúdu |
najvyšší prúd | ||
| Prúdová sila, kA | 60-120 | 60-155 | 160-255 |
| Denná produktivita elektrolyzéra, t | 0,42-0,85 | 0,40-1,10 | 1,10-1,74 |
| Hustota anódového prúdu, A / cm2 | 0,80-0,90 | 0,65-0,70 | 0,70-0,89 |
| Priemerné napätie v článku, V | 4,45-4,65 | 4,50-4,70 | 4,30-4,50 |
| Aktuálny výstup,% | 85-88 | 84-86 | 85-89 |
| Pomery spotreby na 1 tonu hliníka: | |||
| jednosmerná elektrina, kW ּ h | 15100-16200 | 15500-17300 | 14500-15500 |
| alumina, kg | 1920-1940 | 1920-1940 | 1920-1940 |
| hmotnosť anódy, kg | 520-560 | 560-620 | - |
| spálené anódy, kg | - | - | 540-600 |
| Fluoridové soli vyjadrené ako fluór, kg | 20-30 | 25-35 | 15-25 |
Primárny hliník extrahovaný z elektrolytických článkov (surový hliník) obsahuje množstvo nečistôt, ktoré možno rozdeliť do troch skupín: nekovové (fluoridové soli, α- a y-alumina, karbid hliníka a nitrid, častice uhlia mechanicky unášané počas liatia kovu z elektrolyzéra); kov (železo, kremík) prechádzajúci zo surovín, uhoľných materiálov a konštrukčných prvkov elektrolyzéra; plynný - hlavne vodík, ktorý sa v kove vytvára v dôsledku elektrolytického rozkladu vody, ktorá vstupuje do elektrolytu so surovinami.
Z kovových nečistôt je okrem železa a kremíka obsiahnuté najväčšie množstvo gália, zinku, titánu, mangánu, sodíka, vanádu, chrómu a medi. Obsah týchto a niektorých ďalších kovových stopových prvkov v elektrolytický hliník uvedené nižšie,%:
Hlavným zdrojom kovových nečistôt v hliníku je alumina, ktorá môže v závislosti od druhu suroviny obsahovať gálium, zinok, draslík, fosfor, síru, vanád, titán a chróm. Uhlíkové materiály (anódová hmota, kalcinované anódy, katódové produkty) slúžia ako zdroj takých mikročastíc, ako napríklad vanád, titán, mangán, zinok.
Elektrolýzou tavenín kryolitu a oxidu hlinitého za predpokladu, že sa použijú čisté suroviny (predovšetkým alumina a uhlíkové materiály), je možné získať surový hliník triedy A85 a A8 (99,85 a 99,80%). Najväčší podiel kovov týchto tried (60 - 70% z celkovej produkcie) sa dosahuje na elektrolyzéroch s vypálenými anódami, ako aj na elektrolyzéroch s dodávkou bočného prúdu (až 70% z celkovej výroby). Na elektrolyzéroch s vlastnými vypaľovacími anódami a olovom s najvyšším prúdom je výroba surového hliníka triedy A8 nízka (1 - 3%) a kov triedy A85 sa nedá získať v dôsledku významných nečistôt železa vstupujúcich do hliníka z nespracovaných zdrojov (anódové kolíky, liatinové časti plynových kolektorov) , technologický nástroj, montáž katód).
Roztavený primárny hliník extrahovaný z elektrolyzérov pomocou vákuovej naberačky vstupuje do zlievárenskej komory na rafináciu nekovových a plynných nečistôt a na ďalšie spracovanie na komerčné výrobky (ingoty, valcové a ploché ingoty, drôtené drôty atď.). Pred odliatím sa surový hliník udržuje v roztavenom stave v elektrických odporových peciach (mixéri) alebo v plynových reflexných peciach. V týchto peciach sa uskutočňuje nielen racionálne dávkovanie šarží tekutého hliníka rôzneho zloženia, ale tiež sa čiastočne čistí nekovových inklúzií, oxidových filmov a sodíka.
Hliník sa nalieva z miešačky do ingotov pomocou odlievacích strojov dopravného typu; valcové a ploché ingoty sa vyrábajú metódou polokontinuálneho liatia a na získanie drôtu sa používajú špeciálne kombinované odlievacie a valcovacie jednotky.
Pri domácich odliatkoch hliníka sa hliník prichádzajúci z mixéra do formy odlievacieho stroja podrobuje najjednoduchšiemu spôsobu rafinácie - filtrovanie taveniny cez sklenenú sieťku s veľkosťou ôk od 0,6 × 0,6 do 1,7 × 1,7 mm. Táto metóda umožňuje čistiť hliník iba z veľmi hrubých oxidových inklúzií; dokonalejší spôsob filtrovania taveniny cez sklolaminát v protiprúdovom smere. Pri tomto spôsobe filtrovania sa častice oxidačných inklúzií, ktoré sa zrážajú s mriežkou, nezachytávajú prúdom taveniny, ale sa usadzujú na dne odlievacieho žľabu.
Na súčasné čistenie hliníka, tak z nekovových nečistôt, ako aj od vodíka, sa úspešne používa metóda filtrácie cez filter toku v kombinácii s preplachovaním dusíkom. Ako tavidlo môžete použiť kyslý elektrolyt elektrolytických článkov hliníka. V dôsledku tohto čistenia sa obsah vodíka v hliníku zníži z 0,22 na 0,16 cm3 na 100 g kovu.
V primárnom hliníku použitom na výrobu zliatin Al-Mg by obsah sodíka nemal prekročiť 0,001%. Je to spôsobené skutočnosťou, že prítomnosť sodíka v týchto zliatinách zhoršuje mechanické a iné prevádzkové vlastnosti výrobkov používaných v mnohých odvetviach národného hospodárstva.
Najviac efektívna metóda Súčasným rafináciou hliníka zo sodíkových, vodíkových a nekovových nečistôt je čistenie roztaveného kovu plynnou zmesou dusíka s 2 až 10% chlóru, zavádzané do taveniny vo forme malých bublín pomocou špeciálnych zariadení. Tento spôsob rafinácie umožňuje znížiť obsah sodíka v hliníku na 0,0003 až 0,00% s prietokom plynnej zmesi z 0,8 do 1,5 m3 / t kovu.
Spotreba elektrickej energie na výrobu 1 tony predajného hliníka zo surového kovu pri používaní elektrických pecí je 150 - 200 kWh; nezvratné straty kovov v zlievárni sa rovnajú 1,5 - 5% v závislosti od typu obchodovateľných výrobkov.
Získanie hliníka vysokej čistoty
Aby sa získal vysoko čistý hliník (triedy A995-A95), primárny hliník technickej čistoty sa elektrolyticky rafinuje. To umožňuje znížiť obsah kovových a plynných nečistôt v hliníku a tým výrazne zvýšiť jeho elektrickú vodivosť, ťažnosť, odrazivosť a odolnosť proti korózii.
Elektrolytická rafinácia hliníka sa vykonáva elektrolýzou roztavených solí trojvrstvovou metódou. Podstata metódy je nasledovná. V rafinačnej komore sú tri roztavené vrstvy. Dolná, najťažšia, leží na vodivom krbe a slúži ako anóda; Nazýva sa anódová zliatina a je to zliatina rafinovaného hliníka s meďou, ktorá sa zavádza, aby sa vrstva stala ťažšou. Stredná vrstva je roztavený elektrolyt; jeho hustota je menšia ako hustota anódovej zliatiny a vyššia ako hustota čistého rafinovaného (katódového) hliníka umiestneného nad elektrolytom (horná, tretia vrstva kvapaliny).
Počas anodického rozpúšťania sú všetky nečistoty elektropozitívnejšie ako hliník (Fe, Si, Ti, Cu, atď.) A zostávajú v anodickej zliatine bez toho, aby prešli do elektrolytu. Anodicky sa rozpustí iba hliník, ktorý vo forme iónov Al 3+ prechádza do elektrolytu: Al– 3 e → Al 3+.
Počas elektrolýzy sa ióny hliníka prenášajú na katódu, na ktorej sú vybité: Al 3+ + 3 e → Al. V dôsledku toho sa na katóde hromadí vrstva roztaveného rafinovaného hliníka.
Ak sú v anódovej zliatine prítomné nečistoty, ktoré sú viac elektronegatívne ako hliník (napríklad Ba, Na, Mg, Ca), môžu sa na anóde elektrochemicky rozpustiť spolu s hliníkom a prechádzajú do elektrolytu vo forme iónov. Pretože obsah elektroegatívnych nečistôt v surovom hliníku je malý, nezhromažďujú sa v elektrolyte vo významnom množstve. K výboju týchto iónov na katóde nedochádza prakticky, pretože ich elektródový potenciál je elektronegatívny ako hliník.
Ako elektrolyt pri elektrolytickej rafinácii hliníka v Sovietskom zväze a vo väčšine krajín sa používa elektrolyt fluorid-chlorid, ktorého zloženie je 55 - 60% BaCl2, 35 - 40% AlF4 + NaF a 0-4% NaCl. Molárny pomer NaF: AlF3 podporuje 1,5 až 2,0; teplota topenia elektrolytu 720 - 730 ° C; teplota procesu elektrolýzy je asi 800 ° C; hustota elektrolytu je 2,7 g / cm3.
Anódová zliatina je pripravená z primárneho hliníka a čistej medi (99,90 - 99,95% Cu), ktorá sa do kovu zavádza v množstve 30 až 40%. Hustota tekutej anódovej zliatiny tejto kompozície je 3 až 3,5 g / cm3; hustota čistého roztaveného katodického hliníka je 2,3 g / cm3. S týmto pomerom hustôt sa vytvárajú podmienky potrebné na dobré oddelenie troch roztavených vrstiev.
V kvartérnom systéme Al-Cu-Fe-Si, ku ktorému patrí anódová zliatina, sa vytvorí eutektikum s teplotou topenia 520 ° C. Po ochladení anódovej zliatiny obsahujúcej nečistoty železa a kremíka v množstvách vyšších ako eutektické koncentrácie je možné separovať železo a kremík do tuhej fázy vo forme intermetalických zlúčenín FeSiAl5 a Cu2 FeAl7. Pretože teplota anódovej zliatiny vo vreckách elektrolyzéra je o 30–40 ° C nižšia ako teplota anódovej zliatiny v pracovnom priestore kúpeľa, uvoľní sa v nich pevné intermetalické zrážanie (keď sa v anódovej zliatine hromadí železo a kremík). Pravidelne odstraňujú tieto usadeniny a čistia anódovú zliatinu (bez jej aktualizácie) od nečistôt železa a kremíka. Pretože gálium je koncentrované v anódovej zliatine, môžu byť zdrojom tohto kovu zrazeniny extrahované z elektrolyzéra (30 - 40 kg na 1 tonu hliníka).
Na elektrolytickú rafináciu sa používajú elektrolyzéry, ktoré sa v dizajne podobajú elektrolyzérom s vypálenými anódami na elektrolytickú výrobu primárneho hliníka, ale majú odlišné pólové pripojenie: nístej slúži ako anóda a horný rad elektród ako katóda. Moderné elektrolyzéry na elektrolytickú rafináciu hliníka sú určené pre prúdy do 75 kA.
Nižšie sú uvedené hlavné technické a ekonomické ukazovatele elektrolyzérov za rok 1979, ktoré dosiahli domáce (1, 2, 3) podniky.
Účinnosť elektrochemického prúdu vypočítaná kovom vytekajúcim z elektrolyzéra je 97 až 98%. Skutočná prúdová účinnosť vypočítaná podľa množstva predajného kovu je 92 - 96%.
| Prúdová sila, kA | 23,5 | 62,9 | 69,8* |
| Priemerné napätie, V | 5,43 | 5,68 | 5,69 |
| Aktuálny výstup,% | 95,7 | 93,0 | 92,7 |
| Spotreba jednosmerného prúdu, kW ּ h / t | 17 370 | 18 700 | 19 830 |
| Celková AC elektrina, kW ּ h / t | 18 670 | 19 590 | 20 780 |
| Úrovne, cm | |||
| katódový hliník | 16,6 | 12,9 | 14,6 |
| elektrolyt | 13,3 | 11,6 | 14,2 |
| anódová zliatina | 40,1 | 29,5 | 30,0 |
| Spotreba, kg / t: | |||
| chlorid bárnatý | 40,5 | 41,5 | 27,0 |
| kryolit | 27,7 | 21,0 | 16,5 |
| fluorid hlinitý | 6,7 | 13,1 | 3,8 |
| chlorid sodný | 1,0 | 4,8 | - |
| surový hliník | 1020 | 1028 | 1032 |
| grafit | 11,9 | 11,5 | 16,6 |
| meď | 9,8 | 15,5 | 16,4 |
| Výroba hliníka vysokej čistoty,% akosti: | |||
| A995 | 47,8** | 3,5 | 2,1 |
| A99 | 30,4 | 67,1 | 54,2 |
| A97 | 8,3 | 21,5 | 43,7 |
| A95 | 10,4 | 7,9 | - |
| pod A95 | 3,1 | - | - |
* Vysoká miera výroby hliníka. ** Stupeň pre elektrolyzéry bez rozšírenia. |
|||
Hlavným faktorom, ktorý znižuje prúdovú účinnosť, okrem strát jednosmerného prúdu pri vypúšťaní elektrónových iónov, strát kovu v dôsledku oxidácie a mechanických strát hliníka, je prevádzka elektrolyzérov s uvoľňovaním netriedeného kovu, ktorý sa opäť vracia do anódovej zliatiny na ďalšie rafinovanie. Tieto obdobia prevádzky buniek prebiehajú počas spúšťania buniek a pri porušovaní technologického režimu.
Elektrolytická rafinácia hliníka je energeticky veľmi náročná výroba. Spotreba elektrickej energie v striedavom prúde, vrátane energie spotrebovanej na prípravu elektrolytu a anódovej zliatiny, na prevádzku vetracích zariadení a vozidiel, ako aj na stratu premeny striedavého prúdu na jednosmerný prúd, predstavuje 18,5 - 21,0 tis. KWh na 1 tonu hliníka. Energetická účinnosť rafinačných elektrolyzérov nepresahuje 5 až 7%, t. J. 93 až 95% energie sa spotrebuje vo forme tepelných strát generovaných hlavne vo vrstve elektrolytu (približne 80 až 85% celkového tepelného príkonu). Preto hlavné spôsoby, ako ďalej znižovať špecifickú spotrebu energie pri elektrolytickom rafinácii hliníka, sú zlepšenie tepelnej izolácie elektrolyzéra (najmä hornej časti štruktúry) a zníženie vrstvy elektrolytu (zníženie vzdialenosti medzi elektródami).
Čistota hliníka, rafinovaná podľa trojvrstvovej metódy, 99,995%; určuje sa rozdielom piatich hlavných nečistôt - železa, kremíka, medi, zinku a titánu. Množstvo kovu vyrobené touto značkou môže predstavovať 45 - 48% z celkovej produkcie (bez jej rozšírenia o nižšie stupne).
Malo by sa však poznamenať, že v elektrolyticky rafinovanom hliníku sú nečistoty iných kovov obsiahnuté v menšom množstve, čo znižuje absolútnu čistotu tohto hliníka. Rádioaktívna analýza umožňuje detekciu až 30 nečistôt v elektrolyticky rafinovanom hliníku, ktorého celkový obsah je približne 60 ּ 10–4%. Čistota rafinovaného hliníka na rozdiel od týchto nečistôt je teda 99,994%.
Okrem nečistôt poskytnutých spoločnosťou GOST (pozri tabuľku. 1.1), najbežnejšia trieda (A99) obsahuje elektrolyticky rafinovaný hliník,%: Cr 0,00016; V 0,0001; Ga 0,0006; Pb 0,002; Sn 0,00005; Ca 0,002 - 0,003; Na 0,001 - 0,008; Mn 0,001 - 0,007; Mg 0,001 - 0,007; ako<0,0001; Sb<0,00002; Bi<0,00001; Cd<0,000001; S 0,0007.
Jedným zo zdrojov katódového znečistenia hliníka sú grafitové vodiče obsahujúce oxid železa a kremíka, ktoré sú neustále v kontakte s rafinovaným hliníkom. Ak sa prúd privádza priamo do katódového hliníka pomocou hliníkových tyčí a použije sa veľmi čistý grafitový nástroj, je možné získať kov s čistotou 99,999% na rozdiel od určených nečistôt (Fe, Si, Cu, Zn a Ti). Taký kov obsahuje priemerne% Si: 0,0002; Fe 0,00032; Cu 0,0002; Zn 0,0002 a Ti 0,00005. Avšak kvôli technickým ťažkostiam tento spôsob dodávania prúdu zatiaľ nenašiel široké priemyselné využitie.
Výroba vysoko čistého hliníka
Hliník vysokej čistoty (stupeň A999) je možné získať tromi spôsobmi: tavenie v zóne, destilácia pomocou subhalidov a elektrolýza hliníkovo-organických zlúčenín. Z vyššie uvedených spôsobov výroby vysoko čistého hliníka sa v ZSSR získal praktický spôsob tavenia zón.
Princíp topenia zóny je viacnásobný priechod roztavenej zóny pozdĺž hliníkového ingotu. Hodnota distribúcie K \u003d C televízia / S w (kde C tv je koncentrácia nečistôt v pevnej látke a C g - v kvapalnej fáze), ktoré do značnej miery určujú účinnosť čistenia od nečistôt, možno tieto nečistoty rozdeliť do troch skupín. Prvá skupina obsahuje nečistoty, ktoré znižujú teplotu topenia hliníka K<1 V priebehu topenia zóny sa koncentrujú v roztavenej zóne a prenášajú sa do konečnej časti ingotu. Tieto nečistoty zahŕňajú Ga, Sn, Be, Sb, Ca, Th, Fe, Co, Ni, Ce, Te, Ba, Pt, Au, Bi, Pb, Cd, In, Na, Mg, Cu, Si, Ge. , Zn. Druhá skupina obsahuje nečistoty, ktoré zvyšujú teplotu topenia hliníka; sú charakterizované K\u003e 1 a počas topenia zón sa koncentrujú v tuhej (počiatočnej) časti ingotu. Tieto nečistoty zahŕňajú Nb, Ta, Cr, Ti, Mo, V. Tretia skupina obsahuje nečistoty s distribučným koeficientom veľmi blízkým jednote (Mn, Sc). Tieto nečistoty sa pri tavení hliníka v zóne prakticky neodstránia.
Hliník určený na tavenie v zóne sa podrobuje určitej úprave, ktorá spočíva vo filtrovaní, odplynení a leptaní. Filtrácia je potrebná, aby sa z hliníka odstránil žiaruvzdorný a silný oxidový film dispergovaný v kovu. Oxid hlinitý prítomný v roztavenom hliníku môže, keď stuhne, vytvárať kryštalizačné centrá, čo vedie k tvorbe polykryštalického ingotu a k narušeniu redistribúcie nečistôt medzi pevným kovom a roztavenou zónou. Hliník sa filtruje vo vákuu (zvyškový tlak 0,1 až 0,4 Pa) otvorom v spodnej časti grafitového téglika s priemerom 1,5 až 2 mm. Predbežné odplynenie hliníka pred roztavením zóny (tiež zahrievanie vo vákuu) sa uskutočňuje, aby sa zabránilo striekaniu kovu počas roztavenia zóny v prípade procesu vo vysokom vákuu. Posledným stupňom prípravy hliníka na roztavenie zóny je leptanie jeho povrchu zmesou koncentrovanej kyseliny chlorovodíkovej a kyseliny dusičnej.
Pretože hliník má významnú chemickú aktivitu a najmä čistý grafit sa používa ako hlavný materiál pre kontajnery (člny), tavenie hliníka v zóne sa vykonáva vo vákuu alebo v atmosfére inertného plynu (argón, hélium).
Tavenie zón vo vákuu zaisťuje vysokú čistotu hliníka v dôsledku prchavosti niektorých nečistôt počas vákua (horčík, zinok, kadmium, kovy alkalických kovov a kovov alkalických zemín) a eliminuje sa aj kontaminácia vyčisteného kovu nečistotami v dôsledku použitia ochranných inertných plynov. Tavenie hliníka vo vákuu sa môže uskutočňovať počas nepretržitého čerpania kremennej trubice, kde je umiestnená grafitová loď s hliníkovým ingotom, ako aj v utesnených kremenných ampulkách, z ktorých sa vzduch predbežne čerpá na zvyškový tlak asi 1 ּ 10–3 Pa.
Aby sa vytvorila roztavená zóna na hliníkovom ingote počas tavenia zóny, môže sa zahrievať pomocou malých odporových pecí alebo vysokofrekvenčných prúdov. Na napájanie elektrických odporových pecí nie je potrebné zložité zariadenie, pece sa ľahko ovládajú. Jedinou nevýhodou tohto spôsobu zahrievania je malý prierez ingotu z čisteného hliníka.
Indukčné vykurovanie vysokofrekvenčnými prúdmi je ideálnym spôsobom, ako vytvoriť roztavenú zónu na ingote počas tavenia zóny. Spôsob vysokofrekvenčného zahrievania (okrem umožnenia tavenia zón ingotov veľkých prierezov) umožňuje dôležitú výhodu, že roztavený kov je v zóne kontinuálne miešaný; to uľahčuje difúziu atómov nečistôt z frontu kryštalizácie hlboko do taveniny.
Po prvý krát bola priemyselná výroba vysokočistého hliníka pomocou tavenia v zóne zvládnutá v závode na výrobu hliníka vo Volchove v roku 1965 pomocou inštalácie UZPI-3 vyvinutej vami. Toto zariadenie bolo vybavené štyrmi kremennými retortami s indukčným ohrevom, zatiaľ čo induktory boli pohyblivé a nádoby s kovom boli nehybné. Jeho produktivita bola 20 kg kovu na cyklus čistenia. Následne bola v roku 1972 vo Volkhovskom hliníkovom závode vytvorená a uvedená do komerčnej prevádzky výkonnejšia celokovová inštalácia UZPI-4.
Účinnosť čistenia hliníka počas tavenia v zóne môže byť charakterizovaná nasledujúcimi údajmi. Ak je celkový obsah nečistôt v elektrolyticky rafinovanom hliníku (30–60) ּ 10–4%, potom po roztavení zóny klesne na (2,8–3,2) - 10–4%, t. J. 15–20 krát. To zodpovedá zvyškovému elektrickému odporu hliníka ρ ○ (pri teplote kvapalného hélia 4,2 K), respektíve (20–40) - 10–10 a (1,8–2,1) ּ 10–10 alebo čistote 99,997–99,994% a 99,9997%. V tabuľke. 1.4 (pozri nižšie) ukazuje údaje rádioaktívnej analýzy o obsahu niektorých nečistôt v zóne čistenom hliníku a elektrolyticky rafinovanom. Tieto údaje naznačujú výrazné zníženie obsahu väčšiny nečistôt, hoci nečistoty, ako sú mangán a skandium, sa počas tavenia zón prakticky neodstránia.
VAMI v posledných rokoch vyvinula a testovala v priemyselných podmienkach technológiu výroby hliníka s čistotou 99,9999% kaskádovým tavením. Podstata spôsobu tavenia kaskádových zón spočíva v tom, že čistenie východiskového hliníka s čistotou A999 sa uskutočňuje postupným opakovaním cyklov (kaskád) pásika zóny. V tomto prípade je východiskovým materiálom každej nasledujúcej kaskády stredná, najčistejšia časť ingotu získaná v dôsledku predchádzajúceho čistiaceho cyklu.
TABUĽKA 1.4
| nečistota | Zdrojový hliník (elektrolyticky rafinovaný 99,993 - 99,994%) | Zliatina hliníka v zóne | |
| grafit, vákuum | vždy vzduch | ||
| meď | 1,9 | 0,02 | 0,08 |
| arzén | 0,15 | 0,0015 | 0,001 |
| antimón | 1,2 | 0,03 | 0,02 |
| urán | 0,002 | - | - |
| železo | 3 | ≤0,2 | ≤0,3 |
| gálium | 0,3 | 0,02 | 0,05 |
| mangán | 0,2-0,3 | 0,1-0,2 | 0,15 |
| skandium | 0,4-0,5 | 0,4-0,5 | 0,4-0,5 |
| ytrium | 0,02-0,04 | <<0,001 | <<0,001 |
| lutécium | 0,002-0,004 | <<0,0001 | <<0,0001 |
| holmium | 0,005-0,01 | <<0,0001 | <<0,0001 |
| kovový prvok | 0,02-0,04 | <<0,01 | <<0,01 |
| terbium | 0,003-0,006 | <<0,001 | <<0,001 |
| samárium | 0,05-0,01 | <<0,0001 | <<0,0001 |
| neodým | 0,1-0,2 | <<0,01 | <<0,01 |
| prazeodým | 0,05-0,1 | <<0,001 | <<0,001 |
| minerál | 0,3-0,6 | <<0,01 | <<0,01 |
| lantánu | 0,01 | <<0,001 | <<0,001 |
| nikel | 2,3 | - | <1 |
| kadmium | 3,5 | <<0,01 | 0,02-0,07 |
| zinok | 20 | <<0,05 | 1 |
| kobalt | 0,01 | <<0,01 | <<0,01 |
| sodík | 1-2 | <0,2 | <0,2 |
| draslík | 0,05 | 0,01 | 0,01 |
| bárium | 6 | - | - |
| chlór | 0,01 | <0,01 | <0,01 |
| fosfor | 3 | 0,04 | - |
| síra | 15 | 0,5-1,5 | - |
| uhlík | 1-2 | - | 1-2 |
| Pozn. Množstvá telúru, bizmutu, striebra, molybdénu, chrómu, zirkónia, vápnika, stroncia, rubídia, céru, india, selénu a ortuti v hliníku po roztavení zóny sú nižšie ako citlivosť rádioaktívnej analýzy. | |||
V tabuľke. 1.5 (pozri nižšie) zobrazuje výsledky hmotnostnej spektrálnej analýzy a merania R 293 K / R 4,2 K hliníka získaného kaskádovým topením. Z vyššie uvedených údajov je možné vyvodiť záver, že čistota takého hliníka, stanovená rozdielom desiatich základných nečistôt (Si, Fe, Mg, Mn, Ti, Cu, Cr, Zn, Na a V), je\u003e 99,9999%. Tento záver je nepriamo potvrdený hodnotou R 293 K / R 4,2 K, čo vo všetkých vzorkách bolo\u003e 30 ּ 103.
Na získanie kovu s čistotou 99,9999% stačí vykonať dve kaskády topenia zón (pozri tabuľku. 1.5). Ďalšie zvýšenie počtu kaskád nezvyšuje čistotu hliníka, hoci zvyšuje celkový výťažok kovu s čistotou 99,9999%.
Ďalším možným spôsobom na získanie vysoko čistého hliníka je jeho destilácia pomocou subhalogenidov, najmä pomocou fluoridu hlinitého.
Tlak nasýtených pár kovového hliníka nie je dostatočne vysoký na to, aby ho priamo destiloval v prakticky prijateľných množstvách. Keď sa však zahrieva vo vákuu (pri 1000 - 1050 ° C) s AlF3, hliník tvorí prchavý subfluorid AlF, ktorý sa destiluje do studenej zóny (800 ° C), kde sa opäť rozkladá (neprimerane) s uvoľňovaním čistého hliníka:
Možnosť hlbokého čistenia hliníka od nečistôt je spôsobená hlavne skutočnosťou, že pravdepodobnosť tvorby hliníkových podzlúčenín je oveľa vyššia ako pravdepodobnosť tvorby čiastkových zlúčenín nečistôt.
TABUĽKA 1.5
VÝSLEDKY HMOTNEJ SPEKTRÁLNEJ ANALÝZY A MERANIA R 293 K / R 4,2 K KLINOVÁ HADICA Z HLINÍKOVEJ ZÓNY.
| Počet kaskád | Obsah nečistôt × 10–4% | ||||||
| si | fe | mg | Mn | tí | suma | ||
| rodič | 18,3 | 0,210 | <0,103 | 0,89 | <0,061 | 0,069 | 1,544 |
| A999 | |||||||
| 2 | 36,5 | <0,062 | <0,103 | 0,006 | <0,061 | 0,017 | 0,460 |
| 2 | 38,0 | <0,062 | <0,103 | 0,006 | <0,061 | 0,017 | 0,460 |
| 2 | 39,5 | 0,073 | <0,103 | 0,045 | <0,061 | 0,07 | 0,563 |
| 3 | 32,0 | 0,204 | <0,103 | 0,006 | <0,061 | 0,017 | 0,502 |
| 3 | 30,0 | 0,073 | 0,100 | 0,006 | 0,020 | 0,07 | 0,480 |
| 3 | 32,0 | 0,052 | 0,100 | 0,006 | 0,061 | 0,07 | 0,500 |
| 4 | 40,0 | <0,021 | <0,103 | 0,006 | 0,061 | 0,07 | 0,472 |
| 4 | 30,5 | 0,031 | 0,100 | 0,006 | 0,061 | 0,07 | 0,479 |
| 5 | 34,0 | 0,104 | <0,060 | 0,006 | 0,061 | 0,017 | 0,459 |
| Poznámky: 1. Množstvo nečistôt sa uvádza s prihliadnutím na ďalšie nečistoty, ktorých obsah vo všetkých vzorkách bol × 10–4%:<0,071 Cu; <0,038 Cr; 0,048 Zn; 0,017 Na; 0,037 V. 2. При подсчете суммы примесей принимали их максимальное значение, равное пределу чувствительности анализа, например <0,061 считали как 0,061. | |||||||
Obsah nečistôt v hliníku destilovanom subfluoridom nepriamo súvisí s hmotnosťou získaných ingotov. V ingotoch s hmotnosťou 1,5 - 1,7 kg je celkový obsah nečistôt (Si, Fe, Cu, Mg) 11 ּ 10–4% a obsah plynu je 0,007 cm 3/100 g. Špecifický zvyškový odpor (ρ ○) pri teplote kvapalného hélia pre taký kov je (1,7 ÷ 2,0) ּ 10–10 Ohmov ּ cm. Destilácia hliníka subfluoridom má niekoľko nevýhod (relatívne nízka produktivita, nedostatočné hĺbkové čistenie z horčíka atď.), Preto spôsob nepriniesol priemyselný rozvoj.
Boli tiež vyvinuté spôsoby výroby vysoko čistého hliníka elektrolýzou komplexných zlúčenín organohliníka, ktoré sa líšia zložením elektrolytov. Napríklad v Nemecku sa používa spôsob elektrolýzy 50% roztoku NaF-2AI (C2H5) 3 v toluéne. Rafinácia sa uskutočňuje pri 100 ° C, napätie v komore 1,0 - 1,5 V a prúdová hustota 0,3 - 0,5 A / DM2 pomocou hliníkových elektród. Katódový prúdový výstup 99%. Elektrochemická rafinácia v organohliníkových elektrolytoch významne znižuje obsah mangánu a skandia, ktoré sa pri čistení zón prakticky neodstránia. Nevýhodou tejto metódy je nízka produktivita a vysoké nebezpečenstvo požiaru.
Na hlbšie čistenie hliníka a získanie kovu s čistotou 99,99999% alebo vyššou sa môže použiť kombinácia vyššie uvedených metód: elektrolýza organických zlúčenín hliníka alebo sublimácia subfluoridom s následným roztavením získaného hliníka v zóne. Napríklad čistením hliníka vo viacerých zónach získaného elektrolýzou organohlinitých zlúčenín je možné získať kov vysokej čistoty s obsahom nečistôt 10 - 9%: Fe 50; si<500; Cu 10; Mg 30; Mn5; Ti <500; Cr 20; Zn <50; Co <1; Ag <5; Sb <1 и Se 3.
prihláška
Kombinácia fyzikálnych, mechanických a chemických vlastností hliníka určuje jeho široké využitie takmer vo všetkých oblastiach techniky, najmä vo forme zliatin s inými kovmi. V elektrotechnike hliník úspešne nahrádza meď, najmä pri výrobe pevných vodičov, napríklad v nadzemných vedeniach, vysokonapäťových kábloch, rozvádzačoch, transformátoroch (elektrická vodivosť hliníka dosahuje 65,5% elektrickej vodivosti medi a je viac ako trikrát ľahšia ako meď; s prierezom, ktorý poskytuje rovnakú vodivosť, je hmotnosť hliníkových drôtov polovičná ako hmotnosť medi). Ultračistý hliník sa používa na výrobu elektrických kondenzátorov a usmerňovačov, ktorých účinok je založený na schopnosti filmu oxidu hlinitého prenášať elektrický prúd iba v jednom smere. Ultra čistý hliník čistený zónovým tavením sa používa na syntézu polovodičových zlúčenín typu A III B V používaných na výrobu polovodičových zariadení. Čistý hliník sa používa pri výrobe rôznych druhov zrkadiel. Hliník vysokej čistoty sa používa na ochranu kovových povrchov pred atmosférickou koróziou (opláštenie, hliníková farba). S relatívne nízkym prierezom absorpcie neutrónov sa hliník používa ako konštrukčný materiál v jadrových reaktoroch.
Vo veľkokapacitných hliníkových nádržiach sa skladujú a prepravujú kvapalné plyny (metán, kyslík, vodík atď.), Kyselina dusičná a octová, čistá voda, peroxid vodíka a jedlé oleje. Hliník sa široko používa v zariadeniach a prístrojoch potravinárskeho priemyslu, na balenie potravinárskych výrobkov (vo forme fólie), na výrobu rôznych druhov výrobkov pre domácnosť. Spotreba hliníka sa výrazne zvýšila na dekoráciu budov, architektonických, dopravných a športových zariadení.
V metalurgii je hliník (okrem zliatin na báze) jedným z najbežnejších legovacích prísad v zliatinách na báze Cu, Mg, Ti, Ni, Zn a Fe. Hliník sa tiež používa na deoxidáciu ocele pred jej naliatím do formy, ako aj v procesoch výroby určitých kovov aluminotermickou metódou. Na báze hliníka bol SAP (spekaný hliníkový prášok) vytvorený práškovou metalurgiou, ktorá má vysokú tepelnú odolnosť pri teplotách nad 300 ° C.
Hliník sa používa na výrobu výbušnín (amoniak, aluminotol). Široko sa používajú rôzne zlúčeniny hliníka.
Výroba a spotreba hliníka neustále rastie a výrazne prevyšuje výrobu ocele, medi, olova, zinku.
DIN (DeutschIndustrienorm) - priemyselný štandard Nemecka.
Technologický proces výroby hliníka zahŕňa tri hlavné etapy:
1. tvorba oxidu hlinitého z hliníkových rúd;
2. Vytvorenie hliníka z aluminy;
3. Proces rafinácie hliníka.
Zároveň je potrebné použitie takéhoto vybavenia:
vybavenie pre centrálny systém distribúcie oxidu hlinitého;
vaňo;
katódová prípojnica;
zariadenia na úpravu suchého plynu;
montážne, technologické a zlievarenské žeriavy;
sacie jednotky;
zlievarenské vybavenie;
vybavenie anódovej montážnej haly;
kovové konštrukcie výrobných budov.
Tvorba oxidu hlinitého z rúd - etapa výroby hliníka
Oxid hlinitý sa dá získať tromi spôsobmi: kyslou, zásaditou a elektrolytickou. Najobľúbenejšia je alkalická metóda. Podstata metódy spočíva v tom, že roztoky hliníka sa začínajú veľmi rýchlo rozpadávať zavedením hydroxidu hlinitého a roztok, ktorý zostane z rozkladu po odparení za intenzívneho miešania pri teplote 170 ° C, môže opäť rozpustiť oxid hlinitý obsiahnutý v bauxite. Táto metóda má tieto hlavné etapy:
1. Príprava bauxitu, ktorý zahŕňa drvenie a mletie v špeciálnych mlynoch. Do mlynov sa posiela lúhový lúh, bauxit a trochu vápna. Buničina, ktorá sa ukázala, sa posiela na vylúhovanie.
2. Vylúhovanie bauxitu znamená jeho chemický rozklad zo zlúčeniny s vodným roztokom zásady. V tomto prípade hydráty oxidu hlinitého v kombinácii s alkáliami prechádzajú do roztoku vo forme hlinitanu sodného a oxid kremičitý obsiahnutý v bauxite, ktorý sa spája s alkáliami, prechádza do roztoku vo forme kremičitanu sodného. V roztoku tieto zlúčeniny: hlinitan sodný a kremičitan sodný tvoria nerozpustný hlinitokremičitan sodný. Do tohto zvyšku prechádzajú oxidy železa a titánu, ktoré zvyšujú červený odtieň. Takýmto zvyškom je červené bahno. Po ukončení rozpúšťania získaného hlinitanu sodného sa roztok zriedi vodným roztokom zásady, pričom sa teplota zníži na 100 ° C.
3. Oddelenie roztoku červeného bahna a hlinitanu navzájom od seba je výsledkom premývania zahusťovadlami. Potom sa červené bahno usadí a zostávajúci roztok hlinitanu sa filtruje.
4. Rozklad roztoku hlinitanu. Filtruje sa a odosiela sa do veľkých nádob s miešačmi. Z tohto roztoku sa ochladením na 60 ° C a miešaním neustále uvoľňuje hydroxid hlinitý. Pretože proces je nerovnomerný a veľmi pomalý a rast kryštálov hydroxidu hlinitého je pri ďalšom spracovaní veľmi dôležitý, rozkladače stále pridávajú do týchto nádob s miešačmi veľa pevného hydroxidu.
5. Výroba hydroxidu hlinitého sa uskutočňuje vo vákuových filtroch a hydrocyklonoch. Väčšina hydroxidu ako očkovacieho materiálu sa vracia do procesu rozkladu. Po premytí vodou je zvyšok poslaný na kalcináciu; a filtrát sa tiež vracia do procesu.
6. Dehydratácia hydroxidu hlinitého - záverečná fáza výroby oxidu hlinitého. Uskutočňuje sa v rúrkových, neustále sa otáčajúcich peciach. Surový hydroxid hlinitý, keď prechádza pecou, \u200b\u200bje úplne vysušený a dehydratovaný.
Výroba hliníka z výroby oxidu hlinitého sa tiež uskutočňuje v niekoľkých etapách.
1. Elektrolýza oxidu hlinitého sa uskutočňuje pri teplote v článku - 970 ° C. Bunka má kúpeľ obložený uhlíkovými blokmi, ku ktorým je pripojený elektrický prúd. Uvoľnený tekutý hliník sa zhromažďuje na uhoľnej báze a odtiaľ sa pravidelne prečerpáva. Anódy uhlíka sú ponorené do elektrolytu zhora, horia v atmosfére kyslíka, ktorý sa uvoľňuje z oxidu hlinitého a uvoľňuje sa oxid uhoľnatý alebo oxid uhličitý.
2. Elektrolýza chloridu hlinitého sa uskutočňuje konverziou oxidu hlinitého v reakčnej nádobe na chlorid hlinitý. Potom je v izolovanom kúpeli elektrolýza chloridu hlinitého. Chlór, ktorý sa v tomto prípade uvoľňuje, sa odsáva a odosiela na recykláciu. A hliník sa zráža na katóde.
3. Redukcia chloridu hlinitého mangánu, zatiaľ čo sa uvoľňuje hliník. Kvôli riadenej kondenzácii sa z toku chloridu mangánu uvoľňujú kontaminanty spojené s chlórom. Po uvoľnení chlóru sa chlorid mangánu premení na oxid mangánu, ktorý sa potom redukuje na recyklovateľný stav mangánu.
Proces rafinácie hliníka pri výrobe hliníka
Rafinácia elektrolýzy rozkladom vodných soľných roztokov na hliník nie je možná. Pretože stupeň čistenia priemyselného hliníka, ktorý sa získa elektrolýzou taveniny kryolitu a oxidu hlinitého, bude na určité účely nepostačujúci, hliník je vďaka rafinácii ešte čistejší z kovových a priemyselných odpadov hliníka. Najbežnejšou rafinačnou metódou je trojvrstvová elektrolýza.
Hliník sa používa na výrobu výbušnín (alumotol, amoniak). Používajú sa rôzne zlúčeniny hliníka. Výroba a spotreba hliníka neustále rastie, oveľa rýchlejšie ako výroba medi, ocele, zinku a olova.
Na získanie medi sa používajú medené rudy, ako aj medené odpady a ich zliatiny. Rudy obsahujú 1 - 6% medi. Ruda obsahujúca menej ako 0,5% medi sa nespracováva, pretože pri súčasnej technologickej úrovni je získavanie medi z nej nerentabilné.
V rudách je meď vo forme zlúčenín síry (CuFeS 2 - chalkopyrit, Cu2S - chalkosín, CuS - covelín), oxidov (CuO, CuO) a hydrogenuhličitanov.
Ruda rias sa skladá z pyritu (FeS 2), kremeňa (Si02), rôznych zlúčenín obsahujúcich Al203, MgO, CaO a oxidy železa.
Rudy niekedy obsahujú značné množstvo iných kovov (zinok, zlato, striebro a iné).
Existujú dva spôsoby výroby medi z rúd:
- hydro;
- pyrometalurgickými.
Hydrometalurgikum nenašlo široké uplatnenie z dôvodu neschopnosti extrahovať drahé kovy spolu s meďou.
Pyrometalurgická metóda je vhodná na spracovanie všetkých rúd a zahŕňa tieto operácie:
- príprava rúd na tavenie;
- matné topenie;
- matná konverzia;
- rafinácia medi.
Príprava rúd na tavenie
Príprava rúd spočíva v obohatení a pražení. Obohatenie medených rúd sa uskutočňuje flotáciou. Výsledkom je koncentrát medi obsahujúci až 35% medi a až 50% síry. Koncentráty sa obvykle spaľujú v peciach s fluidným lôžkom, aby sa obsah síry znížil na optimálne hodnoty. Počas spaľovania sa síra oxiduje pri teplote 750 - 800 ° C, časť síry sa odstráni plynmi. Výsledkom je produkt nazývaný škvára.
Tavenie na matné
Matný materiál sa taví v reflexných alebo elektrických peciach pri teplote 1250 - 1300 ° C. Tavené koncentráty medených rúd vstupujú do procesu tavenia, počas ktorého prebiehajú redukčné reakcie oxidu medi a vyšších oxidov železa
6CuO + FeS \u003d 3Cu20 + FeO + S02
FeS + 3Fe304 + 5Si02 \u003d 5 (2FeO · Si02) + S02
V dôsledku interakcie Cu20 s FeS sa Cu2S vytvorí reakciou:
Cu20 + FeS \u003d Cu2S + FeO
Sulfidy medi a železa spájané spolu tvoria matný a roztavené kremičitany železa, ktoré rozpúšťajú iné oxidy, tvoria trosku. Matný materiál obsahuje 15 - 55% Cu; 15 až 50% Fe; 20 až 30% S. Troska pozostáva hlavne z Si02, FeO, CaO, AI203.
Matný a troska sa uvoľňujú, keď sa hromadia špeciálnymi otvormi.
Matná konverzia
Matná látka sa premieňa v taviacich zariadeniach medi (obrázok 44) ich prefúknutím vzduchom, aby sa oxidovala sírovité železo, prenieslo železo do trosky a izolovalo sa blistrovú meď.
Konvertory majú dĺžku 6 - 10 ma vonkajší priemer 3 - 4 m. Roztavená rohož sa naleje, taviace produkty sa vypustia a plyny sa odvádzajú cez hrdlo umiestnené v strede skrinky konvertora. Na prefúknutie rohože je stlačený vzduch privádzaný cez prívodné rúrky umiestnené pozdĺž generatrix konvertora. V jednej z koncových stien konvertora je umiestnený otvor, ktorým sa vykonáva pneumatické zaťaženie tavidla, ktoré je potrebné na odstránenie železa do trosky.
Preplachovací proces sa uskutočňuje v dvoch periódach. V prvom období sa rohož naleje do konvertora a dodáva sa kremenný tok. V tomto období sa vyskytujú oxidačné reakcie sulfidov.
Výsledný oxid železa interaguje s kremičitým tavivom a je odstránený do trosky.
Keď sa troska akumuluje, je čiastočne vysušená a do konvertora sa naleje nová časť pôvodného matného materiálu, pričom sa v konvertore udržuje určitá úroveň matného podkladu. V druhej perióde oxid medi interaguje so sulfidom medi za vzniku kovovej medi
Výsledkom čistenia je teda blistrová meď obsahujúca 98,4 až 99,4% Cu. Výsledná blistrová meď sa naleje do plochých foriem na stroji na liatie pásky.
Technológia výroby horčíka
Hlavný spôsob výroby horčíka je elektrolytický. Elektrolytická výroba horčíka z vodných roztokov je nemožná, pretože elektrochemický potenciál horčíka je oveľa negatívnejší ako potenciál pre vypúšťanie iónov vodíka na katóde. Preto sa elektrolýza horčíka uskutočňuje z jeho roztavených solí.
Hlavnou zložkou elektrolytu je chlorid horečnatý, chlorid horečnatý a do neho sa zavádzajú NaCl, CaCl2, KCl a malé množstvá NaF a CaF2, aby sa znížila teplota topenia elektrolytu a zvýšila sa jeho elektrická vodivosť.
Hlavnými surovinami na výrobu horčíka sú karnallit (MgCl2 KCl6H2O), magnezit (MgCO3), dolomit (CaCO3 MgCO3), bischofit (MgCl2 6H2O). Najväčšie množstvo horčíka sa získava z karnallitu.
Hlavné fázy výroby horčíka:
1. karnallit;
2. obohatenie karnallitu;
3. Dehydratácia karnallitu;
4. elektrolytická výroba horčíka;
5. rafinácia horčíka;
6. Horčík.
Obohatenie karnallitu je prvou fázou jeho spracovania. Podstatou procesu obohatenia je separácia KCl a nerozpustných nečistôt prevedením MgCl2 a KCl do vodného roztoku. Keď sa výsledný roztok ochladí vo vákuových kryštalizátoroch, vyzrážajú sa kryštály umelého karnallitu MgCl2 KCl6H2O, ktoré sa oddelia filtráciou.
Karnallit je dehydratovaný v dvoch stupňoch. Prvý stupeň sa uskutočňuje v rúrkových peciach alebo peciach s fluidným lôžkom pri 550 až 600 ° C. Pri pôsobení tepla zahriatych plynov sa karnallit dehydratuje a po tomto spracovaní obsahuje 3 až 4% vlhkosti.
Druhý stupeň dehydratácie sa uskutočňuje buď roztavením karnallitu získaného po prvom stupni v elektrických peciach, po ktorom nasleduje sedimentácia oxidu horečnatého, alebo chloráciou karnallitu v roztavenom stave.
Elektrolytická výroba horčíka. Na tento účel sa používa elektrolyzér, ktorý je vnútorne potiahnutý šamotovými tehlami. Anódy sú grafitové platne a katódy sú oceľové platne umiestnené na oboch stranách anódy.
Pri elektrolytickom rozklade chloridu horečnatého prechádza elektrolytom prúd 2,7 až 2,8 V.
V dôsledku elektrolytického rozkladu chloridu horečnatého vznikajú ióny chlóru, ktoré sa pohybujú k anóde a po vybití vytvárajú z elektrolytu bubliny chlóru. Ióny horčíka sa pohybujú na katódu a po vybití sa uvoľňujú na povrch a vytvárajú kvapky tekutého horčíka. Horčík má nižšiu hustotu ako elektrolyt, takže sa vznáša na svoj povrch v katódovom priestore, odkiaľ sa periodicky odstraňuje pomocou vákuového vedra.
Počas elektrolýzy sa v dôsledku spotreby MgCl2 zvyšuje koncentrácia iných chloridov v elektrolyte. Preto sa periodicky časť spotrebovaného elektrolytu odstraňuje z kúpeľa a namiesto toho sa nalieva tavenina MgCl2 alebo karnallit. V dôsledku čiastočného rozkladu nečistôt sa na dne kúpeľa vytvára kal, ktorý sa z kúpeľa pravidelne odstraňuje.
Rafinácia horčíka. V elektrolytických kúpeľoch sa získa surový horčík, ktorý obsahuje 5% nečistôt: kovové nečistoty (Fe, Na, K, Al, Ca) a nekovové nečistoty (MgCl2, KCl, NaCl, CaCl2, MgO). Horčík sa rafinuje (rafinuje) pretavením tavidlami.


