21.07.2019
Interakcia zásad s kyselinami. Hydroxid sodný
sodík Výraz "zásaditý" sa týka alkalických kovov a je distribuovaný v hlavnej podskupine prvej skupiny PSE. DI Mendelejev. Na vonkajšej energetickej úrovni svojho atómu v pomerne veľkej vzdialenosti od jadra je jeden elektrón, ktorý atómy alkalické kovy rozdávajú pomerne ľahko a menia sa na jednotlivo nabité katióny; To vysvetľuje veľmi vysokú chemickú aktivitu alkalických kovov.
Bežným spôsobom výroby alkalických kovov je elektrolýza ich roztavených solí (zvyčajne chloridov).
Sodík ako alkalický kov sa vyznačuje nízkou tvrdosťou, nízkou hustotou a nízkou teplotou topenia.
Sodík, ktorý interaguje s kyslíkom, tvorí hlavne peroxid sodný
2 Na + 02 Na2O2
Redukcia peroxidov a superperoxidov nadbytkom alkalického kovu môže produkovať oxid:
Na2O2 + 2Na2NaO
Oxidy sodíka interagujú s vodou za vzniku hydroxidu: Na2O + H2O → 2 NaOH.
Peroxidy sú úplne hydrolyzované vodou za vzniku zásady: Na2O2 + 2 HOH → 2 NaOH + H2O2
Ako všetky alkalické kovy je sodík silným redukčným činidlom a energicky interaguje s mnohými nekovmi (s výnimkou dusíka, jódu, uhlíka a vzácnych plynov):
Reaguje veľmi slabo s dusíkom v žeravom výboji a vytvára veľmi nestabilnú látku - nitrid sodný
Interaguje so zriedenými kyselinami ako normálny kov:
Pri koncentrovaných oxidačných kyselinách sa uvoľňujú redukčné produkty:
Hydroxid sodný NaOH (žieravina) je silná chemická báza. V priemysle sa hydroxid sodný získava chemickými a elektrochemickými metódami.
Metódy chemickej výroby:
Vápno, ktoré spočíva v interakcii roztoku sódy s vápenným mliekom pri teplote asi 80 ° C. Tento proces sa nazýva kaustifikácia; Prechádza reakciou:
Na2C03 + Ca (OH) 2 → 2NaOH + CaC03
Feritická, ktorá obsahuje dve fázy:
Na2C03 + Fe203 → 2NaFeО2 + CO2
2NaFeО 2 + xH2 О \u003d 2NaOH + Fe203 * xH2 О
Elektrochemicky sa hydroxid sodný získava elektrolýzou roztokov halitu (minerál pozostávajúci hlavne z chloridu sodného NaCl) so súčasnou výrobou vodíka a chlóru. Tento proces môže predstavovať celkový vzorec:
2NaCl + 2H20 ± 2- → H2 + Cl2 + 2NaOH
Hydroxid sodný reaguje:
1) neutralizácia:
NaOH + HCI → NaCl + H20
2) výmena so soľami v roztoku:
2NaOH + CuS04 → Cu (OH) 2 ↓ + Na2S04
3) reaguje s nekovmi
3S + 6NaOH → 2Na2S + Na2S03 + 3H20
4) reaguje s kovmi
2Al + 2NaOH + 6H20 → 3H2 + 2Na
Hydroxid sodný sa široko používa v rôznych priemyselných odvetviach, napríklad pri varení buničiny, na zmydelnenie tukov pri výrobe mydla; ako katalyzátor chemických reakcií pri výrobe motorovej nafty atď.
Uhličitan sodnývyrába sa buď vo forme Na2C03 (sódový popol), alebo vo forme kryštalického hydrátu Na2C03 * 10H20 (kryštalická sóda) alebo vo forme hydrogenuhličitanu sodného (pitná sóda).
Soda sa najčastejšie vyrába metódou chloridu amónneho na základe reakcie:
NaCl + NH4HCO3, NaHC03 + NH4CI
Veľa priemyselných odvetví konzumuje uhličitany sodné: chemické látky, mydlo, buničinu a papier, textil, potraviny atď
Fyzikálne vlastnosti
Hydroxid sodný
Termodynamika riešení
Δ H 0 rozpustenie pre nekonečne zriedený vodný roztok -44,45 kJ / mol.
Monohydrát (kosoštvorcový syngónium) kryštalizuje z vodných roztokov pri 12,3 - 61,8 ° C, teplota topenia 65,1 ° C; hustota 1,829 g / cm3; ΔH 0 arr −734,96 kJ / mol), v rozmedzí od -28 do -24 ° С - heptahydrát, od -24 do -17,7 ° С - pentahydrátu, od -17,7 do -5,4 ° С - tetrahydrátu ( a-modifikácia), od -5,4 do 12,3 ° C. Rozpustnosť v metanole je 23,6 g / l (t \u003d 28 ° C), v etanole 14,7 g / l (t \u003d 28 ° C). NaOH · 3,5H20 (teplota topenia 15,5 ° C);
Chemické vlastnosti
(všeobecne je možné takúto reakciu predstavovať jednoduchou iónovou rovnicou, reakcia prebieha s uvoľňovaním tepla (exotermická reakcia): OH - + H30 + → 2H20.)
- s amfotérnymi oxidmi, ktoré majú tak zásadité, ako aj kyslé vlastnosti a sú schopné reagovať s alkáliami, ako pri pevných zliatinách:
ZnO + 2NaOH → Na2Zn2 + H20
takže pri riešení:
ZnO + 2NaOH (roztok) + H20 → Na2 (roztok)+ H2
(Výsledný anión sa nazýva ión tetrahydroxozinátu a soľ, ktorá sa dá z roztoku izolovať, sa nazýva tetrahydroxozincate sodný. Hydroxid sodný vstupuje do podobných reakcií s inými amfotérnymi oxidmi.)
- s oxidmi kyselín - s tvorbou solí; táto vlastnosť sa používa na čistenie priemyselných emisií z kyslých plynov (napríklad: CO 2, S02 a H2S):
2Na + + 2OH - + Cu2 + + S04-\u003e Cu (OH) 2 ↓ + Na2S04
Hydroxid sodný sa používa na zrážanie hydroxidov kovov. Napríklad sa hydroxid hlinitý vo forme gélu vyrába pôsobením hydroxidu sodného na síran hlinitý vo vodnom roztoku. Používa sa najmä na čistenie vody z jemných suspenzií.
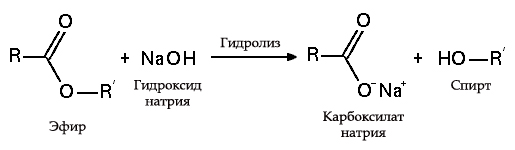
Hydrolýza esterov
- s tukmi (zmydelnenie), je takáto reakcia nevratná, pretože výsledná kyselina s alkalickými formami tvorí mydlo a glycerín. Glycerín sa následne extrahuje z mydlových vankúšov vákuovým odparením a ďalším destilačným prečistením získaných produktov. Tento spôsob získavania mydla je známy na Blízkom východe od 7. storočia:
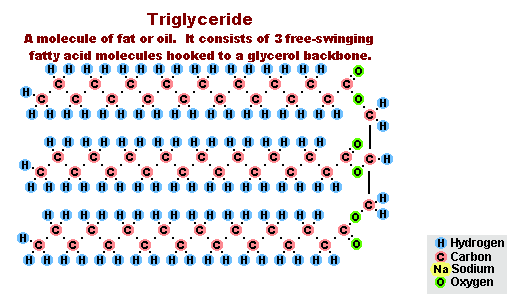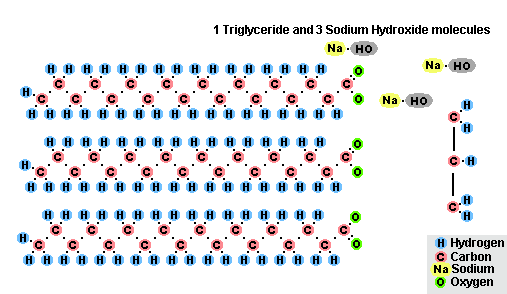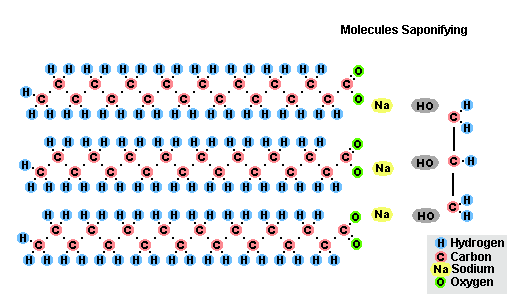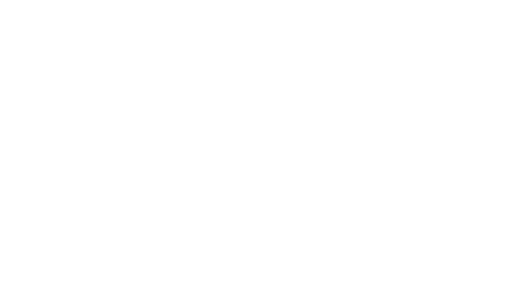
Proces saponifikácie tukov
V dôsledku interakcie tukov s hydroxidom sodným sa získajú tuhé mydlá (používajú sa na výrobu tyčiniek mydla) a s hydroxidom draselným sú to buď pevné alebo tekuté mydlá, v závislosti od zloženia tuku.
HO-CH2-CH2OH + 2NaOH → NaO-CH2-CH2-ONa + 2H20
2NaCl + 2H20 \u003d H2 + Cl2 + 2NaOH,V súčasnosti sa žieravé zásady a chlór vyrábajú tromi elektrochemickými metódami. Dvaja z nich sú elektrolýza pevným azbestom alebo polymérna katóda (membránová a membránová výroba), tretia je elektrolýza kvapalnou katódou (metóda výroby ortuti). Z elektrochemických spôsobov výroby je najjednoduchším a najpohodlnejším spôsobom elektrolýza s ortuťovou katódou, ale táto metóda spôsobuje značné poškodenie životného prostredia v dôsledku vyparovania a vytekania kovovej ortuti. Metóda membránovej výroby je najúčinnejšia, energeticky najnáročnejšia a najšetrnejšia k životnému prostrediu, ale tiež najviac náladová, vyžaduje najmä suroviny s vyššou čistotou.
Žieravá zásada získaná elektrolýzou s kvapalnou ortuťovou katódou je omnoho čistejšia ako zásada získaná metódou bránice. Pre niektoré odvetvia je to dôležité. Pri výrobe umelých vlákien sa teda môže použiť iba lúh získaný elektrolýzou s kvapalnou ortuťovou katódou. Vo svetovej praxi sa používajú všetky tri spôsoby výroby chlóru a lúhovín, s jasným trendom zvyšovania podielu membránovej elektrolýzy. V Rusku sa približne 35% celkového vyrobeného lúhu vyrába elektrolýzou s ortuťovou katódou a 65% elektrolýzou s pevnou katódou (membránové a membránové metódy).
Účinnosť výrobného procesu sa počíta nielen z výťažku hydroxidu sodného, \u200b\u200bale aj z výťažku chlóru a vodíka získaného elektrolýzou, pomer chlóru a hydroxidu sodného na výstupe je 100/110, reakcia prebieha v nasledujúcich pomeroch:
1,8 NaCl +0,5 H20 + 2,8 MJ \u003d 1,00 Cl2 + 1,10 NaOH + 0,03 H2,Hlavné ukazovatele rôznych výrobných metód sú uvedené v tabuľke:
| Indikátor pre 1 tonu NaOH | Metóda ortuti | Metóda F-stop | Membránová metóda |
|---|---|---|---|
| Výťažok chlóru% | 97 | 96 | 98,5 |
| Elektrina (kWh) | 3 150 | 3 260 | 2 520 |
| Koncentrácia NaOH | 50 | 12 | 35 |
| Čistota chlóru | 99,2 | 98 | 99,3 |
| Čistota vodíka | 99,9 | 99,9 | 99,9 |
| Hmotnostný zlomok O 2 v chlóru,% | 0,1 | 1-2 | 0,3 |
| Hmotnostný podiel Cl - v NaOH,% | 0,003 | 1-1,2 | 0,005 |
Schéma procesu na pevnej katóde
Metóda F-stop - Dutina elektrolyzéra s pevnou katódou je rozdelená poréznym septom - membránou - na katódový a anódový priestor, kde sú príslušne umiestnené katóda a anóda elektrolyzéra. Preto sa taký elektrolyzér často nazýva bránica a výrobný postup sa nazýva elektrolýza bránice. Prúd nasýteného anolytu nepretržite vstupuje do anódového priestoru membránového elektrolyzéra. V dôsledku elektrochemického procesu sa chlór uvoľňuje na anóde v dôsledku rozkladu halitu a vodík na katóde v dôsledku rozkladu vody. Chlór a vodík sa z bunky odstraňujú samostatne bez miešania:
2Cl - -2 e \u003d Cl20, H20 - 2 e - 1/2 02 \u003d H2.
V tomto prípade je katódová zóna obohatená hydroxidom sodným. Roztok z katódovej zóny, nazývaný elektrolytická zásada, obsahujúci nerozložený anolyt a hydroxid sodný, sa z elektrolyzéra nepretržite odstraňuje. V ďalšom stupni sa elektrolytická zásada odparí a obsah NaOH v nej sa upraví na 42 až 50% v súlade s normou. Halit a síran sodný sa vyzrážajú so zvyšujúcou sa koncentráciou hydroxidu sodného. Roztok lúhovej alkálie sa dekantuje z zrazeniny a prevedie sa ako hotový produkt do skladu alebo do odparovacieho stupňa, čím sa získa pevný produkt, po ktorom nasleduje tavenie, šupina alebo granulácia. Kryštalický halit (reverzná soľ) sa vracia do elektrolýzy a pripraví sa z neho takzvaná reverzná soľanka. Sulfát sa z neho extrahuje, aby sa zabránilo akumulácii síranu v roztokoch pred prípravou reverznej soľanky. Strata anolytu sa kompenzuje pridaním čerstvej soľanky, ktorá sa získa podzemným vylúhovaním soľných vrstiev alebo rozpustením pevného halitu. Čerstvá soľanka pred zmiešaním s reverznou soľankou sa očistí od mechanických suspenzií a významnej časti iónov vápnika a horčíka. Výsledný chlór sa oddelí od vodnej pary, stlačí a privádza buď na výrobu produktov obsahujúcich chlór, alebo na skvapalnenie.
Membránová metóda - podobné membráne, ale anódový a katódový priestor je oddelený katexovou membránou. Membránová elektrolýza poskytuje najčistejšiu žieravinu.
Technologická schéma elektrolýza.Hlavným technologickým stupňom je elektrolýza, hlavným prístrojom je elektrolytický kúpeľ, ktorý pozostáva z elektrolyzéra, rozkladača a ortuťovej pumpy, vzájomne prepojených komunikáciami. V elektrolytickom kúpeli ortuť cirkuluje pôsobením ortuťovej pumpy a prechádza elektrolyzérom a rozkladačom. Katóda elektrolyzéra je prúd ortuti. Anódy - grafit alebo málo opotrebované. Spolu s ortuťou elektrolyzérom nepretržite prúdi anolytový prúd - roztok halitu. V dôsledku elektrochemického rozkladu halitu sa na anóde tvoria ióny iónov a uvoľňuje sa chlór:
2C1-2 e \u003d Cl20,
ktorý sa vypúšťa z elektrolyzéra a na ortuťovej katóde sa vytvára slabý roztok sodíka v ortuti, takzvaný amalgám:
Na + + e \u003d Na 0 nNa + + nHg - \u003d Na + HgAmalgám nepretržite prúdi z bunky do rozkladača. Do rozkladača sa tiež nepretržite dodáva voda zbavená nečistôt. V ňom je amalgám sodný v dôsledku spontánneho elektrochemického procesu takmer úplne rozložený vodou s tvorbou ortuti, roztoku lúhu a vodíka:
Na + Hg + H20 \u003d NaOH + 1 / 2H2 + HgLúhový roztok získaný týmto spôsobom, ktorý je komerčným výrobkom, neobsahuje halitové nečistoty škodlivé pri výrobe viskózy. Ortuť je takmer úplne zbavená amalgámu sodného a vracia sa do bunky. Na úpravu sa vypúšťa vodík. Anolyt vychádzajúci z elektrolyzéra je nasýtený čerstvým halogenitom, z neho sú odstránené nečistoty, vyplavené z anód a štruktúrnych materiálov a vrátené do elektrolýzy. Pred saturáciou sa v nej rozpustený chlór extrahuje z anolytu v dvoj alebo trojkrokovom procese.
Laboratórne metódy získavania
V laboratóriu sa hydroxid sodný získava chemickými metódami, ktoré sú historickejšie ako praktické.
Vápniková metóda Získanie hydroxidu sodného je interakcia roztoku sódy s vápenným mliekom pri teplote asi 80 ° C. Tento proces sa nazýva kaustifikácia; Je opísaná reakciou:
Na2C03 + Ca (OH) 2 \u003d 2NaOH + CaC03V dôsledku reakcie sa vytvorí roztok hydroxidu sodného a zrazenina uhličitanu vápenatého. Uhličitan vápenatý sa oddelí od roztoku, ktorý sa odparí, čím sa získa roztavený produkt obsahujúci asi 92% NaOH. Roztavený NaOH sa naleje do železných bubnov, kde stuhne.
Feritická metóda opísaná dvoma reakciami:
Na2C03 + Fe203 \u003d Na20 ° Fe203 + C02 (1) Na 2 0 Fe 2 0 3 -f H2O \u003d 2 NaOH + Fe203 (2)(1) - proces spekania uhličitanu sodného s oxidom železa pri teplote 1100 - 1200 ° C V tomto prípade sa tvorí špecitan sodný a uvoľňuje sa oxid uhličitý. Ďalej sa koláč spracuje (vylúhuje) vodou podľa reakcie (2); získa sa roztok hydroxidu sodného a zrazenina Fe203, ktorý sa po separácii z roztoku vráti do procesu. Roztok obsahuje asi 400 g / l NaOH. Odparením sa získa produkt obsahujúci asi 92% NaOH.
Chemické spôsoby výroby hydroxidu sodného majú značné nedostatky: spotrebúva sa veľké množstvo paliva, vyrobený hydroxid sodný je kontaminovaný nečistotami a údržba prístroja je náročná. V súčasnosti sú tieto metódy takmer úplne nahradené elektrochemickým spôsobom výroby.
Trh s hydroxidom sodným
Svetová výroba hydroxidu sodného, \u200b\u200b2005| výrobca | Objem výroby, milión ton | Podiel na svetovej produkcii |
|---|---|---|
| DOW | 6.363 | 11.1 |
| Spoločnosť náhodnej chemikálie | 2.552 | 4.4 |
| Formosa plasty | 2.016 | 3.5 |
| PPG | 1.684 | 2.9 |
| Bayer | 1.507 | 2.6 |
| Akzo nobel | 1.157 | 2.0 |
| Tosoh | 1.110 | 1.9 |
| Arkema | 1.049 | 1.8 |
| Olin | 0.970 | 1.7 |
| Rusko | 1.290 | 2.24 |
| Čína | 9.138 | 15.88 |
| ostatné | 27.559 | 47,87 |
| celkom: | 57,541 | 100 |
TP - pevná ortuť (šupinatá);
TD - pevná membrána (tavená);
PP - ortuťový roztok;
PX - chemický roztok;
RD - roztok bránice.
| Názov ukazovateľa | TR OKP 21 3211 0400 | TD OKP 21 3212 0200 | RR OKP 21 3211 0100 | PX 1 OKP 21 3221 0530 | OKP 21 3221 0540 PX 2 | RD Špičková kvalita OKP 21 3212 0320 | RD Prvá trieda OKP 21 3212 0330 |
|---|---|---|---|---|---|---|---|
| vzhľad | Šupinatá biela hmota. Mierne sfarbenie povolené | Kondenzovaná hmota je biela. Mierne sfarbenie povolené | Bezfarebná číra tekutina | Bezfarebná alebo sfarbená tekutina. Kryštalizovaná zrazenina je povolená | Bezfarebná alebo sfarbená tekutina. Kryštalizovaná zrazenina je povolená | Bezfarebná alebo sfarbená tekutina. Kryštalizovaná zrazenina je povolená | |
| Hmotnostný podiel hydroxidu sodného,%, nie menej | 98,5 | 94,0 | 42,0 | 45,5 | 43,0 | 46,0 | 44,0 |
| Názov podniku | 2005 tis. Ton | 2006 tis. Ton | podiel v roku 2005% | podiel v roku 2006% |
|---|---|---|---|---|
| OJSC Caustic Sterlitamak | 239 | 249 | 20 | 20 |
| OJSC "Caustic", Volgograd | 210 | 216 | 18 | 18 |
| Sayanskkhimplast OJSC | 129 | 111 | 11 | 9 |
| LLC Usoliekhimprom | 84 | 99 | 7 | 8 |
| Sibur-Neftekhim OJSC | 87 | 92 | 7 | 8 |
| OJSC "Khimprom", Cheboksary | 82 | 92 | 7 | 8 |
| VOAO Khimprom, Volgograd | 87 | 90 | 7 | 7 |
| CJSC Ilimkhimprom | 70 | 84 | 6 | 7 |
| KCHKhK OJSC | 81 | 79 | 7 | 6 |
| NAC „NITROGEN“ | 73 | 61 | 6 | 5 |
| Khimprom OJSC, Kemerovo | 42 | 44 | 4 | 4 |
| celkom: | 1184 | 1217 | 100 | 100 |
| Názov podniku | 2005 ton | 2006 ton | podiel v roku 2005% | podiel v roku 2006% |
|---|---|---|---|---|
| OJSC "Caustic", Volgograd | 67504 | 63510 | 62 | 60 |
| OJSC Caustic Sterlitamak | 34105 | 34761 | 31 | 33 |
| Sibur-Neftekhim OJSC | 1279 | 833 | 1 | 1 |
| VOAO Khimprom, Volgograd | 5768 | 7115 | 5 | 7 |
| celkom: | 108565 | 106219 | 100 | 100 |
prihláška
biodiesel

Treska Lutefisková na oslave dňa ústavy Nórska

Nemecká bageta
Lúh sodný Používa sa v rôznych priemyselných odvetviach a pre domáce potreby:
- Žieravé sa používa v celulózový a papierenský priemysel na delignifikáciu (Kraftovu reakciu) celulózy pri výrobe papiera, lepenky, umelých vlákien, drevovláknitých dosiek.,
- Na zmydelnenie tukov pomocou výroba mydla, šampónov a iných detergentov, V staroveku sa do vody pridával popol počas umývania a domácnosti si zjavne všimli, že ak popol obsahuje tuk, ktorý sa dostal do krbu počas varenia, riad sa dobre umýva. Profesia výrobcu mydla (saponarius) sa prvýkrát spomína okolo roku 385 po Kr. e. Theodore Priscianus. Arabi vyrábajú mydlo z olejov a sódy už od 7. storočia, dnes sa mydlá vyrábajú rovnakým spôsobom ako pred 10 storočiami.
- chemický priemysel - neutralizovať kyseliny a oxidy kyselín, ako reagencie alebo vinylové alebo pogumované obleky.
MAC hydroxidu sodného vo vzduchu 0,5 mg / m3.
literatúra
- Všeobecná chemická technológia. Ed. I.P. Mukhlenova. Učebnica pre chemické a technologické špeciality vysokých škôl. - M.: Vyššia škola.
- Základy všeobecnej chémie, zväzok 3, B. V. Nekrasov. - M .: Chemistry, 1970.
- Všeobecná chemická technológia. Furmer I.E., Zaitsev V.N. - M .: Higher School, 1978.
- Vyhláška Ministerstva zdravotníctva Ruskej federácie z 28. marca 2003 N 126 „Po schválení zoznamu škodlivých výrobných faktorov, pod vplyvom ktorých sa na preventívne účely odporúča použitie mlieka alebo iných ekvivalentných potravín“.
- Vyhláška vedúceho štátneho zdravotníckeho lekára Ruskej federácie zo 4. apríla 2003 N 32 „O zavedení sanitárnych predpisov pre organizáciu nákladnej železničnej dopravy. SP 2.5.1250-03 ".
- Federálny zákon z 21. júla 1997 N 116-ФЗ „O priemyselnej bezpečnosti nebezpečných výrobných zariadení“ (v znení zmien a doplnení z 18. decembra 2006).
- Vyhláška Ministerstva prírodných zdrojov Ruskej federácie z 2. decembra 2002 N 786 „O schválení federálneho klasifikačného katalógu odpadov“ (v znení zmien a doplnení 30. júla 2003).
- Vyhláška Štátneho výboru práce ZSSR z 10.25.1974 N 298 / P-22 „Po schválení zoznamu priemyselných odvetví, obchodov, povolaní a pozícií so škodlivými pracovnými podmienkami, v ktorých práca oprávňuje na dodatočnú dovolenku a skrátenú pracovnú dobu“ (zmenená a doplnená 29. mája 1991) ).
- Vyhláška Ministerstva práce Ruska z 22. júla 1999 N 26 „O schválení štandardných priemyselných noriem pre bezplatné vydávanie špeciálneho oblečenia, špeciálnej obuvi a iných osobných ochranných prostriedkov pre pracovníkov v chemickom priemysle“.
- Vyhláška vedúceho štátneho zdravotníckeho lekára Ruskej federácie z 05.30.2003 N 116 o stanovení GN 2.1.6.1339-03 „Odhadované úrovne bezpečného vystavenia znečisťujúcich látok (SEC) znečisťujúcim látkam v atmosférickom vzduchu v obývaných oblastiach“ (zmenené a doplnené 3. novembra 2005). Ilustrovaný encyklopedický slovník
HYDROXID SODNÝ - (lúh sodný, lúh sodný, lúh) NaOH bezfarebná tuhá kryštalická látka, hustota 2130 kg m. t \u003d 320 ° C; keď sa rozpustí vo vode, uvoľní sa veľké množstvo tepla; deštruktívny účinok na pokožku, vreckovku, papier, nebezpečný ... ... Veľká polytechnická encyklopédia
- (lúh sodný, lúh sodný), NaOH, silná zásada (zásada). Bezfarebné kryštály (technická nepriehľadná biela hmota produktu). Hygroskopický, rozpustný vo vode, uvoľňujúci veľké množstvo tepla. Príjem elektrolýzou roztoku ... Encyklopedický slovník
hydroxid sodný - natrio hidroksidas statusas T sritis chemija formulaė NaOH atitikmenys: angl. hydroxid sodný; hydroxid sodný rus. žieraviny; hydroxid sodný; hydroxid sodný; hydroxid sodný ryšiai: sinonimas - natrio šarmas sinonimas - kaustinė soda ... Chemijos terminų aiškinamasis žodynas
- (lúh sodný, lúh sodný), NaOH, silná zásada (zásada). Bestsv. kryštály (technická nepriehľadná hmota produktu). Hygroskopický, rozpustný vo vode, uvoľňujúci veľké množstvo tepla. Elektrolýza roztoku chloridu sodného ... Prírodná história. Encyklopedický slovník
- (lúh sodný) NaOH, bezfarebný. kryštály; do 299 ° C je kosoštvorec stabilný. modifikácia (a \u003d 0,33994 nm, c \u003d 1,1377 nm), vyššia ako 299 oK monoklinická; Polymorfný prechod DH0 5,85 kJ / mol; t. pl. 323 ° C, t. 1403 ° C; tesný. 2,02 g / cm3; ... Chemická encyklopédia
Lúh sodný, lúh, bezfarebný kryštalický NaOH. hmotnosť, pevne. 2130 kg / m3, tPl 320 ° C, rozpustnosť vo vode 52,2% (pri 20 ° C). Silná základňa, poškodzujúca živočíšne tkanivo; je obzvlášť nebezpečné dostať N. kvapky do očí. ... ... Veľký encyklopedický polytechnický slovník
Silná zásada, bežne používaná ako čistiaci prostriedok. Ak sa hydroxid sodný dostane na povrch pokožky, spôsobuje vážne chemické popálenie; v takom prípade okamžite postihnuté miesto umyte veľkým množstvom kože ... ... Lekárske termíny
HYDROXID SODNÝ, BEZPEČNÁ SODA - (lúh sodný) silná zásada, ktorá sa bežne používa ako čistiaci prostriedok. Ak sa hydroxid sodný dostane na povrch pokožky, spôsobuje vážne chemické popálenie; v takom prípade okamžite postihnuté miesto pokožky umyte ... ... Vysvetľujúci slovník medicíny
Hydroxid sodný aj iné zásady, názov „žieravá zásada“ je spôsobený schopnosťou korodovať pokožku, papier, sklo a spôsobiť vážne popáleniny. Do 17. storočia bola zásada alkálie (fr. alkálie) sa tiež nazývali uhličitany sodné a draselné. Vo francúzštine vedec A. L. Duhamel du Monceau najskôr rozlišoval medzi týmito látkami: hydroxid sodný sa stal známym ako lúh sodný, uhličitan sodný ako popol sodný (z rastliny Salsola Soda, z ktorej sa ťažil) a uhličitan draselný ako potaš. V súčasnosti sa sóda nazýva sodná soľ kyseliny uhličitej. V angličtine a francúzštine slovo sodík znamená sodík, draslík - draslík.
Fyzikálne vlastnosti
Hydroxid sodný
Termodynamika riešení
Δ H 0 rozpustenie pre nekonečne zriedený vodný roztok -44,45 kJ / mol.
Monohydrát (kosoštvorcový syngónium) kryštalizuje z vodných roztokov pri 12,3 - 61,8 ° C, teplota topenia 65,1 ° C; hustota 1,829 g / cm3; ΔH 0 arr −734,96 kJ / mol), v rozmedzí od -28 do -24 ° С - heptahydrát, od -24 do -17,7 ° С - pentahydrátu, od -17,7 do -5,4 ° С - tetrahydrátu ( a-modifikácia), od -5,4 do 12,3 ° C. Rozpustnosť v metanole je 23,6 g / l (t \u003d 28 ° C), v etanole 14,7 g / l (t \u003d 28 ° C). NaOH · 3,5H20 (teplota topenia 15,5 ° C);
Chemické vlastnosti
(všeobecne je možné takúto reakciu predstavovať jednoduchou iónovou rovnicou, reakcia prebieha s uvoľňovaním tepla (exotermická reakcia): OH - + H30 + → 2H20.)
- s amfotérnymi oxidmi, ktoré majú tak zásadité, ako aj kyslé vlastnosti a sú schopné reagovať s alkáliami, ako pri pevných zliatinách:
ZnO + 2NaOH → Na2Zn2 + H20
takže pri riešení:
ZnO + 2NaOH (roztok) + H20 → Na2 (roztok)+ H2
(Výsledný anión sa nazýva ión tetrahydroxozinátu a soľ, ktorá sa dá z roztoku izolovať, sa nazýva tetrahydroxozincate sodný. Hydroxid sodný vstupuje do podobných reakcií s inými amfotérnymi oxidmi.)
- s oxidmi kyselín - s tvorbou solí; táto vlastnosť sa používa na čistenie priemyselných emisií z kyslých plynov (napríklad: CO 2, S02 a H2S):
2Na + + 2OH - + Cu2 + + S04-\u003e Cu (OH) 2 ↓ + Na2S04
Hydroxid sodný sa používa na zrážanie hydroxidov kovov. Napríklad sa hydroxid hlinitý vo forme gélu vyrába pôsobením hydroxidu sodného na síran hlinitý vo vodnom roztoku. Používa sa najmä na čistenie vody z jemných suspenzií.

Hydrolýza esterov
- s tukmi (zmydelnenie), je takáto reakcia nevratná, pretože výsledná kyselina s alkalickými formami tvorí mydlo a glycerín. Glycerín sa následne extrahuje z mydlových vankúšov vákuovým odparením a ďalším destilačným prečistením získaných produktov. Tento spôsob získavania mydla je známy na Blízkom východe od 7. storočia:

Proces saponifikácie tukov
V dôsledku interakcie tukov s hydroxidom sodným sa získajú tuhé mydlá (používajú sa na výrobu tyčiniek mydla) a s hydroxidom draselným sú to buď pevné alebo tekuté mydlá, v závislosti od zloženia tuku.
HO-CH2-CH2OH + 2NaOH → NaO-CH2-CH2-ONa + 2H20
2NaCl + 2H20 \u003d H2 + Cl2 + 2NaOH,V súčasnosti sa žieravé zásady a chlór vyrábajú tromi elektrochemickými metódami. Dvaja z nich sú elektrolýza pevným azbestom alebo polymérna katóda (membránová a membránová výroba), tretia je elektrolýza kvapalnou katódou (metóda výroby ortuti). Z elektrochemických spôsobov výroby je najjednoduchším a najpohodlnejším spôsobom elektrolýza s ortuťovou katódou, ale táto metóda spôsobuje značné poškodenie životného prostredia v dôsledku vyparovania a vytekania kovovej ortuti. Metóda membránovej výroby je najúčinnejšia, energeticky najnáročnejšia a najšetrnejšia k životnému prostrediu, ale tiež najviac náladová, vyžaduje najmä suroviny s vyššou čistotou.
Žieravá zásada získaná elektrolýzou s kvapalnou ortuťovou katódou je omnoho čistejšia ako zásada získaná metódou bránice. Pre niektoré odvetvia je to dôležité. Pri výrobe umelých vlákien sa teda môže použiť iba lúh získaný elektrolýzou s kvapalnou ortuťovou katódou. Vo svetovej praxi sa používajú všetky tri spôsoby výroby chlóru a lúhovín, s jasným trendom zvyšovania podielu membránovej elektrolýzy. V Rusku sa približne 35% celkového vyrobeného lúhu vyrába elektrolýzou s ortuťovou katódou a 65% elektrolýzou s pevnou katódou (membránové a membránové metódy).
Účinnosť výrobného procesu sa počíta nielen z výťažku hydroxidu sodného, \u200b\u200bale aj z výťažku chlóru a vodíka získaného elektrolýzou, pomer chlóru a hydroxidu sodného na výstupe je 100/110, reakcia prebieha v nasledujúcich pomeroch:
1,8 NaCl +0,5 H20 + 2,8 MJ \u003d 1,00 Cl2 + 1,10 NaOH + 0,03 H2,Hlavné ukazovatele rôznych výrobných metód sú uvedené v tabuľke:
| Indikátor pre 1 tonu NaOH | Metóda ortuti | Metóda F-stop | Membránová metóda |
|---|---|---|---|
| Výťažok chlóru% | 97 | 96 | 98,5 |
| Elektrina (kWh) | 3 150 | 3 260 | 2 520 |
| Koncentrácia NaOH | 50 | 12 | 35 |
| Čistota chlóru | 99,2 | 98 | 99,3 |
| Čistota vodíka | 99,9 | 99,9 | 99,9 |
| Hmotnostný zlomok O 2 v chlóru,% | 0,1 | 1-2 | 0,3 |
| Hmotnostný podiel Cl - v NaOH,% | 0,003 | 1-1,2 | 0,005 |
Schéma procesu na pevnej katóde
Metóda F-stop - Dutina elektrolyzéra s pevnou katódou je rozdelená poréznym septom - membránou - na katódový a anódový priestor, kde sú príslušne umiestnené katóda a anóda elektrolyzéra. Preto sa taký elektrolyzér často nazýva bránica a výrobný postup sa nazýva elektrolýza bránice. Prúd nasýteného anolytu nepretržite vstupuje do anódového priestoru membránového elektrolyzéra. V dôsledku elektrochemického procesu sa chlór uvoľňuje na anóde v dôsledku rozkladu halitu a vodík na katóde v dôsledku rozkladu vody. Chlór a vodík sa z bunky odstraňujú samostatne bez miešania:
2Cl - -2 e \u003d Cl20, H20 - 2 e - 1/2 02 \u003d H2.
V tomto prípade je katódová zóna obohatená hydroxidom sodným. Roztok z katódovej zóny, nazývaný elektrolytická zásada, obsahujúci nerozložený anolyt a hydroxid sodný, sa z elektrolyzéra nepretržite odstraňuje. V ďalšom stupni sa elektrolytická zásada odparí a obsah NaOH v nej sa upraví na 42 až 50% v súlade s normou. Halit a síran sodný sa vyzrážajú so zvyšujúcou sa koncentráciou hydroxidu sodného. Roztok lúhovej alkálie sa dekantuje z zrazeniny a prevedie sa ako hotový produkt do skladu alebo do odparovacieho stupňa, čím sa získa pevný produkt, po ktorom nasleduje tavenie, šupina alebo granulácia. Kryštalický halit (reverzná soľ) sa vracia do elektrolýzy a pripraví sa z neho takzvaná reverzná soľanka. Sulfát sa z neho extrahuje, aby sa zabránilo akumulácii síranu v roztokoch pred prípravou reverznej soľanky. Strata anolytu sa kompenzuje pridaním čerstvej soľanky, ktorá sa získa podzemným vylúhovaním soľných vrstiev alebo rozpustením pevného halitu. Čerstvá soľanka pred zmiešaním s reverznou soľankou sa očistí od mechanických suspenzií a významnej časti iónov vápnika a horčíka. Výsledný chlór sa oddelí od vodnej pary, stlačí a privádza buď na výrobu produktov obsahujúcich chlór, alebo na skvapalnenie.
Membránová metóda - podobné membráne, ale anódový a katódový priestor je oddelený katexovou membránou. Membránová elektrolýza poskytuje najčistejšiu žieravinu.
Technologická schéma elektrolýza.Hlavným technologickým stupňom je elektrolýza, hlavným prístrojom je elektrolytický kúpeľ, ktorý pozostáva z elektrolyzéra, rozkladača a ortuťovej pumpy, vzájomne prepojených komunikáciami. V elektrolytickom kúpeli ortuť cirkuluje pôsobením ortuťovej pumpy a prechádza elektrolyzérom a rozkladačom. Katóda elektrolyzéra je prúd ortuti. Anódy - grafit alebo málo opotrebované. Spolu s ortuťou elektrolyzérom nepretržite prúdi anolytový prúd - roztok halitu. V dôsledku elektrochemického rozkladu halitu sa na anóde tvoria ióny iónov a uvoľňuje sa chlór:
2C1-2 e \u003d Cl20,
ktorý sa vypúšťa z elektrolyzéra a na ortuťovej katóde sa vytvára slabý roztok sodíka v ortuti, takzvaný amalgám:
Na + + e \u003d Na 0 nNa + + nHg - \u003d Na + HgAmalgám nepretržite prúdi z bunky do rozkladača. Do rozkladača sa tiež nepretržite dodáva voda zbavená nečistôt. V ňom je amalgám sodný v dôsledku spontánneho elektrochemického procesu takmer úplne rozložený vodou s tvorbou ortuti, roztoku lúhu a vodíka:
Na + Hg + H20 \u003d NaOH + 1 / 2H2 + HgLúhový roztok získaný týmto spôsobom, ktorý je komerčným výrobkom, neobsahuje halitové nečistoty škodlivé pri výrobe viskózy. Ortuť je takmer úplne zbavená amalgámu sodného a vracia sa do bunky. Na úpravu sa vypúšťa vodík. Anolyt vychádzajúci z elektrolyzéra je nasýtený čerstvým halogenitom, z neho sú odstránené nečistoty, vyplavené z anód a štruktúrnych materiálov a vrátené do elektrolýzy. Pred saturáciou sa v nej rozpustený chlór extrahuje z anolytu v dvoj alebo trojkrokovom procese.
Laboratórne metódy získavania
V laboratóriu sa hydroxid sodný získava chemickými metódami, ktoré sú historickejšie ako praktické.
Vápniková metóda Získanie hydroxidu sodného je interakcia roztoku sódy s vápenným mliekom pri teplote asi 80 ° C. Tento proces sa nazýva kaustifikácia; Je opísaná reakciou:
Na2C03 + Ca (OH) 2 \u003d 2NaOH + CaC03V dôsledku reakcie sa vytvorí roztok hydroxidu sodného a zrazenina uhličitanu vápenatého. Uhličitan vápenatý sa oddelí od roztoku, ktorý sa odparí, čím sa získa roztavený produkt obsahujúci asi 92% NaOH. Roztavený NaOH sa naleje do železných bubnov, kde stuhne.
Feritická metóda opísaná dvoma reakciami:
Na2C03 + Fe203 \u003d Na20 ° Fe203 + C02 (1) Na 2 0 Fe 2 0 3 -f H2O \u003d 2 NaOH + Fe203 (2)(1) - proces spekania uhličitanu sodného s oxidom železa pri teplote 1100 - 1200 ° C V tomto prípade sa tvorí špecitan sodný a uvoľňuje sa oxid uhličitý. Ďalej sa koláč spracuje (vylúhuje) vodou podľa reakcie (2); získa sa roztok hydroxidu sodného a zrazenina Fe203, ktorý sa po separácii z roztoku vráti do procesu. Roztok obsahuje asi 400 g / l NaOH. Odparením sa získa produkt obsahujúci asi 92% NaOH.
Chemické spôsoby výroby hydroxidu sodného majú značné nedostatky: spotrebúva sa veľké množstvo paliva, vyrobený hydroxid sodný je kontaminovaný nečistotami a údržba prístroja je náročná. V súčasnosti sú tieto metódy takmer úplne nahradené elektrochemickým spôsobom výroby.
Trh s hydroxidom sodným
Svetová výroba hydroxidu sodného, \u200b\u200b2005| výrobca | Objem výroby, milión ton | Podiel na svetovej produkcii |
|---|---|---|
| DOW | 6.363 | 11.1 |
| Spoločnosť náhodnej chemikálie | 2.552 | 4.4 |
| Formosa plasty | 2.016 | 3.5 |
| PPG | 1.684 | 2.9 |
| Bayer | 1.507 | 2.6 |
| Akzo nobel | 1.157 | 2.0 |
| Tosoh | 1.110 | 1.9 |
| Arkema | 1.049 | 1.8 |
| Olin | 0.970 | 1.7 |
| Rusko | 1.290 | 2.24 |
| Čína | 9.138 | 15.88 |
| ostatné | 27.559 | 47,87 |
| celkom: | 57,541 | 100 |
TP - pevná ortuť (šupinatá);
TD - pevná membrána (tavená);
PP - ortuťový roztok;
PX - chemický roztok;
RD - roztok bránice.
| Názov ukazovateľa | TR OKP 21 3211 0400 | TD OKP 21 3212 0200 | RR OKP 21 3211 0100 | PX 1 OKP 21 3221 0530 | OKP 21 3221 0540 PX 2 | RD Špičková kvalita OKP 21 3212 0320 | RD Prvá trieda OKP 21 3212 0330 |
|---|---|---|---|---|---|---|---|
| vzhľad | Šupinatá biela hmota. Mierne sfarbenie povolené | Kondenzovaná hmota je biela. Mierne sfarbenie povolené | Bezfarebná číra tekutina | Bezfarebná alebo sfarbená tekutina. Kryštalizovaná zrazenina je povolená | Bezfarebná alebo sfarbená tekutina. Kryštalizovaná zrazenina je povolená | Bezfarebná alebo sfarbená tekutina. Kryštalizovaná zrazenina je povolená | |
| Hmotnostný podiel hydroxidu sodného,%, nie menej | 98,5 | 94,0 | 42,0 | 45,5 | 43,0 | 46,0 | 44,0 |
| Názov podniku | 2005 tis. Ton | 2006 tis. Ton | podiel v roku 2005% | podiel v roku 2006% |
|---|---|---|---|---|
| OJSC Caustic Sterlitamak | 239 | 249 | 20 | 20 |
| OJSC "Caustic", Volgograd | 210 | 216 | 18 | 18 |
| Sayanskkhimplast OJSC | 129 | 111 | 11 | 9 |
| LLC Usoliekhimprom | 84 | 99 | 7 | 8 |
| Sibur-Neftekhim OJSC | 87 | 92 | 7 | 8 |
| OJSC "Khimprom", Cheboksary | 82 | 92 | 7 | 8 |
| VOAO Khimprom, Volgograd | 87 | 90 | 7 | 7 |
| CJSC Ilimkhimprom | 70 | 84 | 6 | 7 |
| KCHKhK OJSC | 81 | 79 | 7 | 6 |
| NAC „NITROGEN“ | 73 | 61 | 6 | 5 |
| Khimprom OJSC, Kemerovo | 42 | 44 | 4 | 4 |
| celkom: | 1184 | 1217 | 100 | 100 |
| Názov podniku | 2005 ton | 2006 ton | podiel v roku 2005% | podiel v roku 2006% |
|---|---|---|---|---|
| OJSC "Caustic", Volgograd | 67504 | 63510 | 62 | 60 |
| OJSC Caustic Sterlitamak | 34105 | 34761 | 31 | 33 |
| Sibur-Neftekhim OJSC | 1279 | 833 | 1 | 1 |
| VOAO Khimprom, Volgograd | 5768 | 7115 | 5 | 7 |
| celkom: | 108565 | 106219 | 100 | 100 |
prihláška
biodiesel

Treska Lutefisková na oslave dňa ústavy Nórska


