27.07.2019
1 alkalické kovy. Vieš ako
Výpis chemickej hodiny z 9. ročníka na túto tému:
"Zlúčeniny alkalických kovov a ich použitie."
ciele: Zovšeobecniť a systematizovať vedomosti o alkalických kovoch a ich zlúčeninách; zoznámiť sa s používaním týchto zlúčenín v každodennom živote a produkcii, ich významom v živote organizmov
Ciele lekcie:
1. Zabezpečiť počas hodiny asimiláciu chemických vlastností zlúčenín alkalických kovov, ich použitie v každodennom živote a výrobe a ich význam v živote organizmov.
Naďalej rozvíjať zručnosti v oblasti všeobecného vzdelávania a chemických činidiel.
2. Tvorba základných filozofických predstáv o príčinných súvislostiach medzi javmi, štruktúra atómu alkalického kovu - vlastnosti jednoduchej látky - vlastnosti zlúčenín alkalických kovov a ich aplikácia na základe vlastností.
3. Rozvíjať schopnosť porovnávať, sumarizovať študované fakty, logicky vyjadrovať svoje myšlienky pri odpovedaní. Rozvíjať kognitívny záujem školákov pomocou údajov o aplikácii javov študovaných v živote.
Typ lekcie: kombinované - štúdium nových materiálov využívajúcich IKT.
zariadenie: učebnica, krieda, tabuľa, počítač, projektor médií, plátno, prezentácia témy hodiny, vývojové diagramy lekcií pre študentov, chemikálie (roztoky: hydroxid sodný, kyselina chlorovodíková, síran meďnatý, hydroxid zinočnatý, fenolftaleín) a laboratórne sklo (stojan na skúmavky).
POSTUP
ja .Organizačný okamih.
II , Učíme sa nový materiál.
1. Overenie predtým študovaného materiálu na tému „Alkalické kovy“.
Hádajte hádanky:
1. Zvyčajne sa skladujú v petroleji a tečie po vode,
V prírode, pamätajte teraz,
Zadarmo nie je nikde prítomný
Je možné ho otvoriť v soliach
Plamene od neho zožltnú
A môžete získať od soli
Ako to Davy pochopil.
O čom hovoríme? (Na)
2. Dôrazne sa vytlačí
Z vlhkosti - čistý vodík,
Nahrádza to
A pevne pletie kyslík.
Tento prvok v rastlinách je skrytý
Podľa fialovej farby
Môže byť otvorená v soliach.
O čom hovoríme? (K).
1. Aké kovy sme sa stretli v poslednej lekcii?
2. Prečo sa tomu hovorí?
3. Aký je spoločný znak v štruktúre atómov všetkých alkalických kovov?
Súvisiaci test: Alkalické kovy.
1. Nevzťahuje sa na alkalické kovy: a) rubidium; c) draslík; b) cézium; d) meď.
2. Elektronický vzorec 2) 8) 8) 1 zodpovedá prvku: a) lítium; c) draslík; b) sodík;
3. Atómový polomer prvkov skupiny I hlavnej podskupiny so zvyšujúcim sa jadrovým nábojom:
a) pravidelne sa mení; c) sa nemení; b) zvýšenia;
4. Alkalické kovy sú veľmi silné:
a) oxidačné vlastnosti; c) redukčné vlastnosti; b) amfotérne vlastnosti;
5. Fyzikálne vlastnosti alkalických kovov sa neuplatňujú:
a) strieborno-biela; b) mäkké a ľahké; d) žiaruvzdorné.
6. Pri interakcii prvkov skupiny I hlavnej podskupiny s vodou sa vytvára toto:
a) kyselina; b) sa uvoľňuje zásada a vodík; d) soľ.
7. Sodík a draslík sa skladujú v petroleji, pretože:
a) majú štipľavý zápach; b) ľahko oxidujú na vzduchu;
Sebakontrola: žiadne chyby - „5“, 1,2 chyby - „4“, 3 chyby - „3“, viac - „2“
Odpovede: 1 - 2 - v 3 - 4 - v 5 - 6 - 6 7 - b.
Sebakontrola: žiadne chyby - „5“, 1,2 chyby - „4“, 3,4 chyby - „3“, viac - „2“
2. Aktualizácia vedomostí.
Je možné v prírode stretnúť alkalické kovy vo voľnej forme? Prečo?
Predpokladajme, že vo forme ktorých zlúčenín sa dajú nájsť v prírode?
Alkalické kovy sa v prírode vyskytujú iba vo forme zlúčenín.
Na a K sa prirodzene vyskytujú vo forme chloridov, síranov, kremičitanov atď.
Li, Rb, Cs sú súčasťou rôznych minerálov.
Fr sa nachádza v rádioaktívnych rudách Ac a U.
Na stole: predmety obsahujúce zlúčeniny alkalických kovov (sóda, soľ, batérie do prstov, mydlo) a kladú otázku.
Pozrite sa na tieto objekty. Čo ich podľa vás spája?
1 Čo je genetická súvislosť?
2. Vytvorte genetickú sériu sodíka.
Na → Na20 → 2NaOH → Na2C03
3. Ktoré triedy zlúčenín tvoria alkalické kovy? Zvážte ich vlastnosti.
V priebehu vysvetlenia materiálu a prezerania snímok si študenti vedú poznámky podľa plánu, odhaľujú vlastnosti a aplikácie.
Oxidy alkalických kovov
tvrdý, biely, ľahko rozpustný.
b) chemické vlastnosti; Študenti napíšu do notebooku: oxidy alkalických kovov sú typické základné oxidy. Rovnako ako všetky zásadité oxidy, oxidy alkalických kovov reagujú s vodou, s oxidmi kyselín, s kyselinami.
Chlapci na tabuli a v notebooku napíšu rovnice chemických reakcií pomocou príkladu oxidu sodného:
Na20 + H20 → 2NaOH;
Na20 + C02 → Na2C03;
Na20 + H2CO3 → Na2C03 + H20
Hydroxidy alkalických kovov
.
a) fyzikálne vlastnosti; Študenti zapíšu do vlastností notebooku: tvrdá, biela, dobre rozpustná, tepelne stabilná, skorodovaná látka a papier.
b) chemické vlastnosti
Školenie o bezpečnosti pri laboratórnych prácach.
Chemické vlastnosti hydroxidu sodného.
Účel: Experimentálne preukázať chemické vlastnosti alkalických kovov pomocou príkladu hydroxidu sodného.
Návod na použitie
Do čistej skúmavky nalejte hydroxid sodný, pridajte niekoľko kvapiek fenolftaleínu. Čo pozorujete?
Do rovnakej skúmavky sa pridá roztok kyseliny chlorovodíkovej. Čo pozorujete? Napíšte reakčnú rovnicu.
NaOH + HCl → NaCl + H 2 O Chlapci na tabuli a v notebooku si zapíšu rovnice chemickej reakcie v iónovej forme.
Nalejte hydroxid sodný do čistej skúmavky a pridajte roztok síranu meďnatého. Čo pozorujete? Napíšte reakčnú rovnicu.
2NaOH + CuSO4 → Na2S04 + Cu (OH) 2 Chlapci na tabuli a v notebooku zapisujú chemické reakčné rovnice v iónovej forme.
Urobte záver o chemických vlastnostiach hydroxidov alkalických kovov.
Hydroxidy alkalických kovov reagujú s kyselinami, soľami - aplikácia - sklíčko č. 5.
Hydroxid sodný - NaOH - hydroxid sodný, hydroxid sodný, hydroxid sodný.
Hydroxid draselný - KOH - hydroxid draselný.
NaOH a KOH - žieravé zásady, korózne textílie a papier. Záznam študentov:Použitie: na umelý hodváb v výroba mydla a SMS, kozmetiky, liekov atď.
Alkalické soli
.
Fyzikálne vlastnosti, Študenti zapisujú vlastnosti do poznámkového bloku tuhé kryštalické látky, takmer všetky rozpustné vo vode.
Samostatná práca s učebnicovým textom.
Použitie: vyplnenie tabuľky zo snímky č. 5. Práca na učebnici s. 56 - 57
Soľná receptúra
meno
prihláška
NaHC03
K2C03
NaCl
Na2S04 - 10 H20
Na2C03 \u003d 10 H20
Dôležitosť života organizmov - podložné sklíčko č. 6.
Posolstvo študenta na tému: „Hodnota zlúčenín alkalických kovov v živote organizmov.“
Ióny sodíka a draslíka hrajú veľkú biologickú úlohu: Na + je hlavný extracelulárny ión nachádzajúci sa v krvi a lymfy a K + je hlavný intracelulárny ión. „Pracujte“ spolu. Pomer koncentrácie týchto iónov reguluje krvný tlak v živom organizme a zaisťuje pohyb soľných roztokov z koreňov do listov rastlín. Draselné ióny - podporujú činnosť srdcového svalu, pomáhajú s reumatizmom, zlepšujú funkciu čriev. Zlúčeniny draslíka - eliminujú opuchy.
V. upevňovacie
VI. Zhrnutie lekcie. Triedenie.
Súhrn lekcie:
Aké fyzikálne a chemické vlastnosti sú charakteristické pre oxidy, hydroxidy alkalických kovov?
Kde sa používajú hydroxidy a soli alkalických kovov?
Dodatočný materiál. To je zaujímavé.
Úloha: Prečo sa v starom Grécku odporúčalo vojakom, aby pred dlhými výletmi v horúcom počasí zjedli kúsok chleba, osolili a zapili vodou?
Elektrolytické ióny sa ľahko hydratujú, takže chlorid sodný zachytáva vodu v tele.
Účel: Prečo Eskimos jesť veľmi málo soli?
Podľa jednej z vedeckých teórií sú všetky zvieratá, ktoré žijú na Zemi, vrátane ľudí, potomkami organizmov, ktoré sa objavili a žili v mori. Telesná tekutina týchto tvorov bola zložená z morskej vody. Po presťahovaní na pevninu zachránili morskú vodu ako tekutinu svojho tela. Príroda však nedokáže poskytnúť živým organizmom dostatočné množstvo soli v prirodzenej forme. Keďže sa soľ rozpúšťa vo vode, značná časť sa z pôdy vymýva dažďovou vodou do riek, morí a oceánov. Výsledkom je, že rastliny rastúce na zemi neobsahujú dostatok soli. Preto zvieratá, ktoré sa živia rastlinami, potrebujú soľ. Každý deň telo stráca určité množstvo tekutín obsahujúcich soľ a rastlinné potraviny ho za to nevymieňajú. Zvieratá, ktoré sa živia inými zvieratami, nepotrebujú ďalšiu soľ. Dostávajú potrebnú soľ z organizmov svojich obetí. Eskimáci jedia hlavne mäso, takže ich potreba soli je veľmi malá.
Úloha: Prečo v Anglicku došlo v posledných desaťročiach k poklesu úmrtnosti na cerebrovaskulárne choroby?
Je to kvôli zvýšenej spotrebe čerstvého ovocia a zeleniny. Čerstvá zelenina a ovocie majú vždy veľa draslíka a trochu sodíka. Sodík zadržiava v tele vodu, zvyšuje krvný tlak a naopak draslík pomáha znižovať. Preto sa zvýšenie spotreby zeleniny, ovocia, najmä jabĺk, môže považovať za zásadné opatrenie na prevenciu cerebrovaskulárnych chorôb.
KDE V ĽUDSKÝCH LÁSKOCH NA SALT .
Soľ sa používa na konzervovanie potravín pred kazom a hnilobou. Na šetrenie jedla (keď neexistovali chladničky a mrazničky) sa použila soľ. Po vyskúšaní zeleniny zo slaného nálevu začali ľudia soliť, kvasiť a piť čerstvú zeleninu. Človek je tak zvyknutý soliť všetko, čo je dokonca pripravený zmieriť s niektorými chorobami, len aby neprešiel na diétu bez solí. Postupne sa vyvinul zvyk na solenie všetkého jedla bez toho, aby sa to vôbec vyskúšalo.
ČASTI SALTU - LITTLE POTASSIUM, LITTLE POTASSIUM - Veľa chorôb
Otázka soli je otázkou rovnováhy draslík-sodík. V tele je to mimoriadne dôležité. Draslík a sodík sa neustále dohadujú o svojej prítomnosti v bunkách. Chlorid sodný neobsahuje draslík, je to úplne sodík. Naše telo nevyhnutne potrebuje draslík, ktorý by mal byť 4-krát vyšší ako sodík. Telo zhromažďuje draslík všade, ale nadmerné používanie stolovej soli ruší všetky jeho snahy. Preto pri nadmernom príjme soli dochádza k nedostatku draslíka, čo v priebehu času vedie k mnohým ochoreniam: fyzická a duševná únava, slabý spánok, kŕče, bolesť kĺbov.
Nadbytok sodíka (soli) preťažuje srdce. Chcete zistiť, či jete veľa soli? Choďte do zrkadla: biely kruh okolo dúhovky naznačuje nadmerný príjem soli.
Hydroxid draselný
Lúh draselný sa používa na výrobu hnojív, syntetického kaučuku, elektrolytov pre batérie, činidlá a používa sa vo farmaceutickom priemysle a ďalších odvetviach hospodárstva.
Lúh draselný sa prepravuje po železnici, cestnou dopravou v súlade s pravidlami pre prepravu tovaru platnými pre tento druh prepravy.
Lúh draselný sa uchováva v tesne uzavretej nádobe, napr „šíri sa“ vo vzduchu a absorbuje z neho vlhkosť.
Jeho tradičný názov „lúh draselný“ odráža žieravé účinky tejto látky na živé tkanivo. Ak sa hydroxid draselný dostane na pokožku, sú možné chemické popáleniny.
Jemné mydlá sa získavajú zmydelnením olejov a tukov hydroxidom draselným. Všetky tieto mydlá majú jemnú krémovú konzistenciu.
Lúh sodný.
Najbežnejšia zásada. Ročne sa na svete vyprodukuje a spotrebuje viac ako 57 miliónov ton žieravín.
Kaustická sóda sa používa v mnohých priemyselných odvetviach a na použitie v domácnosti:
V celulózovom a papierenskom priemysle pri výrobe papiera, kartónu, umelých vlákien, drevovláknitých dosiek.
Na zmydelnenie tukov pri výrobe mydla, šampónov a iných detergentov.
V chemickom priemysle - neutralizovať kyseliny a oxidy kyselín, ako činidlo alebo katalyzátor pri chemických reakciách atď.
Lúh sodný (Hydroxid sodný) je žieravá a leptavá látka. Vzťahuje sa na látky druhej triedy nebezpečnosti. Preto pri práci s ním musíte byť opatrní.
Pri kontakte s pokožkou, sliznicami a očami sa tvoria vážne chemické popáleniny. Ak sa slizničné povrchy dostanú do styku s leptavými zásadami, je potrebné postihnuté miesto umyť prúdom vody a ak príde do styku so slabým roztokom kyseliny octovej.
Na lítiu - ku hviezdam
Výrobcovia mobilných telefónov, vreckových prístrojov a prenosných počítačov tento kov skutočne potrebujú. Jadrová energia spotrebúva veľké množstvo lítia (Li), podľa výpočtov teoretikov je to práve tento alkalický kov, ktorý môže poskytnúť kľúč k termonukleárnej energii. Ako silná psychotropná látka sa Li používa vo vojenskej a aplikovanej psychiatrii (a povaha vplyvu Li na psychiku človeka nie je úplne objasnená). Deuterid lítny sa používa vo vodíkovej bombe ako pracovná látka a ako regulátor výbušnej energie.
Tento kov je potrebný aj na prieskum vesmíru.
Workflow pre študentov na lekciu
Téma: Zlúčeniny alkalických kovov.
test
Hydridy. Najstabilnejší hydrid lítny, ktorý sa ľahko získa prechodom vodíka cez zahrievané lítium. LiH je biely kryštalický prášok s teplotou topenia 680 ° C. Pri vysokých teplotách je LiH mimoriadne reaktívny. Prudko sa rozloží vodou:
LiH + H20 \u003d LiOH + H2
Oxidy. Najstabilnejší je Li20. Oxidy lítia a sodíka sú biele, ostatné žlté. Intenzita farieb sa navyše zvyšuje so zvyšujúcim sa sériovým číslom prvku.
Peroxidy. Získavajú sa spaľovaním kovov v nadbytku kyslíka. Peroxidy alkalických kovov sa od roku 2006 môžu považovať za deriváty peroxidu vodíka interagujú s kyselinami a vodou za vzniku peroxidu vodíka:
M202 + H2S04 \u003d M2SO4 + H202
M202 + 2H20 \u003d 2MOH + H202
Najdôležitejší je peroxid sodný, ktorý sa používa na výrobu kyslíka v uzavretých priestoroch (napríklad v ponorke):
2Na202 + 2CO2 \u003d 2Na2C03 + 2O2
Hydroxidy. Táto technika sa nazýva leptavá zásada (NaOH - lúh sodný, KOH - lúh draselný). Sú to bezfarebné, taviteľné látky. V roztavenom stave interagujú so sklom, porcelánom, platinou. Tavenie alkálií sa preto uskutočňuje v strieborných alebo železných téglikoch, s ktorými neinteragujú. Hydroxidy sú ľahko rozpustné vo vode s vysokou tvorbou tepla.
Hydroxidy sa pripravujú nasledujúcimi spôsobmi:
a) Vzájomné pôsobenie kovov alebo oxidov s vodou:
Li20 + H20 \u003d 2 LiOH
Táto reakcia sa používa iba na výrobu veľmi čistých hydroxidov.
b) Kaustifikačná reakcia je najstaršou známou metódou na výrobu hydroxidu sodného. Táto metóda spočíva v úprave roztoku sódy hydroxidom vápenatým (hasené vápno) za varu. Výsledný nerozpustný uhličitan vápenatý sa odfiltruje alebo sa z neho odstráni číra kvapalina:
Na2C03 + Ca (OH) 2 \u003d 2NaOH + CaC03
Výsledný roztok hydroxidu sodného sa skoncentroval odparením vo vákuu. Tuhý hydroxid sodný sa topil pri 500 ° C, aby sa úplne odstránila voda a získal sa NaOH obsahujúci 3-4% Na2C03. Takto získaný NaOH sa nazýva „lúh sodný“.
c) Elektrolýza chloridov alkalických kovov vo vodnom roztoku je moderný priemyselný spôsob výroby NaOH a KOH súčasne s chlórom. Keď sa roztok NaCl podrobí elektrolýze inertnými elektródami (platina, grafit), na anóde sa uvoľní chlór a na katóde sa vodík. Ióny Na + a OH - sa akumulujú v katódovom priestore, ktoré tvoria NaOH.
d) Fúzia uhličitanov alkalických kovov s oxidmi a následné spracovanie zliatiny vodnou parou:
Fe203 + Na2C03 \u003d 2NaFe02 + CO2
2NaFe02 + H20 \u003d 2NaOH + Fe203
Zásady sú najdôležitejšou surovinou v chemickom priemysle pre farbivá, poháre, mydlá, papier, umelé vlákna a lieky.
Soľ. NaCl a KCl sa vyskytujú vo veľkých množstvách v prírode. NaCl (stolová soľ) sa nachádza v morskej vode (v priemere 2,7%) a vo forme kamennej soli v ložiskách s kapacitou až niekoľko kilometrov. Čistý NaCl a KCl sa získavajú z prírodných chloridov rekryštalizáciou. Soli lítia sa získavajú z prírodného uhličitanu lítneho. Získanie solí rubídia a cézia je spojené s ťažkosťami, pretože ich rozpustnosť je veľmi blízka rozpustnosti draselných solí. Zvyčajne sa materské lúhy, ktoré zostanú po karnallite, rekryštalizujú a z nich sa izoluje kamenec rubidium a cézium, ktoré sa čistia rekryštalizáciou. Oddelenie rubídia od cézia sa uskutočňuje pomocou rôznych rozpustností ich uhličitanov v alkohole.
Z dusičnanov majú praktický význam NaNO 3 a KNO 3. Technické názvy sú dusičnan sodný a dusičnan draselný. Obe soli sa používajú ako minerálne hnojivá. KNO 3 sa tiež používa na výrobu čierneho prášku (NaNO 3 sa nepoužíva kvôli jeho hygroskopicite).
Kyselina uhličitá H2CO3 poskytuje dva rady uhličitanov alkalických kovov, kyslé (MHCO 3) a médium (M 2 CO 3) Kyslé uhličitany (hydrogenuhličitany, hydrogenuhličitany) sú známe pre všetky alkalické kovy okrem lítia. S výnimkou uhličitanu lítneho sú všetky neutrálne uhličitany vo vode vysoko rozpustné. Na 2 CO 3 - sóda, ktorá sa niekedy vyskytuje v prírode vo vodách niektorých jazier a v minerálnych prameňoch. Uvoľnite sodík amoniakom: roztok chloridu sodného je nasýtený amoniakom a oxidom uhličitým. V tomto prípade sa zráža NaHC03, pretože sóda je horšie rozpustná ako NH 4CI:
NaCl + H20 + C02 + NH3 \u003d NaHC03 + NH4CI
2NaHCO3 → Na2C03 + C02 + H20
K 2 CO 3 - potaš, hygroskopický biely prášok, vysoko rozpustný vo vode. Prijať hydroxidom draselným karbonizáciou:
2KOH + C02 \u003d K2C03 + H20
Potaš sa používa v priemysle mydla a skla, na farbenie a bielenie vlny, na výrobu kyanidu draselného, \u200b\u200bv organickej syntéze.
Kyselina sírová poskytuje dva rady síranov alkalických kovov - kyslý a stredný.
Na2S04 sa získava ako vedľajší produkt pri výrobe kyseliny chlorovodíkovej z chloridu sodného a kyseliny sírovej. Z vodných roztokov kryštalizuje síran sodný ako Na2S04. 10H20, v odbore sa tento kryštalický hydrát nazýva Glauberova soľ. Používa sa na farbenie bavlnených tkanín, v medicíne.
· · ·§ 96. Zásada
Skupina alkalických kovov zahŕňa nasledujúcu sériu kovov; Li, Na, K, Rb, Cs, Fr. Sú v hlavnej podskupine I skupiny periodického systému.
Všetky tieto sú podobné tým, že majú na vonkajšej elektrónovej vrstve jeden elektrón (tabuľka 18) /.
Alkalické sú s-prvky. Elektrón vonkajšej elektrónovej vrstvy atómu alkalického kovu je v porovnaní s inými prvkami rovnakej periódy najvzdialenejší od jadra, t. J. Polomer atómu alkalického kovu je najväčší v porovnaní s polomermi atómov iných prvkov rovnakej periódy. V spojení
|
Základný poplatok |
Počet elektrónov na energetických úrovniach |
Polomer atómov |
|||||||
týmto sa valenčný elektrón vonkajšej vrstvy atómov alkalických kovov ľahko rozpadne a zmení ich na pozitívne jednotlivo nabité ióny. Je to spôsobené skutočnosťou, že zlúčeniny alkalických kovov s inými prvkami sú skonštruované podľa typu iónovej väzby.
Pri redoxných reakciách sa správajú ako silné redukčné činidlá a táto schopnosť sa zvyšuje z kovu na kov so zvyšujúcim sa nábojom atómového jadra.
§ 97. Sodík
Elektronická konfigurácia atómu sodíka 1 2 2 2 2 2 6 6 3 1 1. Štruktúra vonkajšej vrstvy:
Sodík sa v prírode vyskytuje iba vo forme solí. Najbežnejšou sodnou soľou je chlorid sodný NaCl, ako aj minerálny sylvinit KCl · NaCl a niektoré sulfátové soli, napríklad Glauberova soľ Na2S04 · 10H2O, ktorá sa nachádza vo veľkých množstvách v Kasa-Bogaz-Gol Kaspického mora.
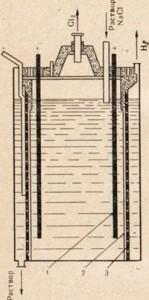
Kovový sodík sa získava z chloridu sodného elektrolýzou taveniny tejto soli. Zariadenie na elektrolýzu je znázornené na obr. 76. Elektródy sa spustia do roztavenej soli. Anódové a katódové priestory sú oddelené membránou, ktorá izoluje vzniknutý sodík tak, že nedochádza k spätnej reakcii. Pozitívny sodíkový ión prijíma elektrón z katódy a mení sa na neutrálny atóm sodíka. Neutrálne atómy sodíka sa zhromažďujú na katóde vo forme roztaveného kovu. Proces prebiehajúci na katóde môže byť znázornený nasledujúcou schémou:
Na + + Na 0.
Pretože k prijímaniu elektrónov dochádza na katóde a akékoľvek prijímanie elektrónov atómom alebo iónom je redukcia, ióny sodíka na katóde sú znížené. Na anóde chlórové ióny darujú elektróny, t.j. proces oxidácie a uvoľňovania voľných
plynný chlór, ktorý môže predstavovať nasledujúca schéma:
Cl - - e - → Cl 0
Výsledný kovový sodík má strieborno-bielu farbu a dá sa ľahko rezať nožom. Plátok sodíka, ak sa skúma bezprostredne po reze, má lesklý kovový lesk, ale vďaka extrémne rýchlej oxidácii kovu sa rýchlo stmieva.
![]()
Obr. 76. Schéma inštalácie pre elektrolýzu roztaveného chloridu sodného.
1 - kruhová katóda; 2 - zvonček na odstránenie plynného chlóru z anódového priestoru
Ak sa sodík oxiduje v malom množstve kyslíka pri teplote asi 180 °, získa sa oxid sodný:
4Na + O2 \u003d 2Na20.
Pri horení kyslíkom sa získa peroxid sodný:
2Na + 02 \u003d Na2O2.
V tomto prípade sodík horí oslnivým žltým plameňom.
Kvôli ľahkej a rýchlej oxidácii sodíka sa skladuje pod vrstvou petroleja alebo parafínu a je to výhodné, pretože určité množstvo vzduchu sa v petroleji rozpúšťa a oxidácia sodíka sa stále vyskytuje, aj keď pomaly.
Sodík môže poskytnúť zlúčeninu s vodíkom - NaH hydridom, v ktorom vykazuje oxidačný stav 1. Toto je soľná zlúčenina, ktorá sa líši od prchavých hydridov prvkov hlavných podskupín skupín IV-VII v povahe chemickej väzby a stupni oxidácie.
Kovový sodík môže reagovať nielen s kyslíkom a vodíkom, ale aj s mnohými jednoduchými a zložitými látkami. Napríklad pri mletí v malte so sírou sodík s ňou prudko reaguje a vytvára:
2Na + S \u003d Na2S
Reakcia je sprevádzaná ohniskami, takže malta by sa mala držať ďalej od očí a okolo ruky si omotať uterák. Na reakciu by sa mali odobrať malé kúsky sodíka.
Sodík prudko horí v chlóri za tvorby chloridu sodného, \u200b\u200bčo je obzvlášť dobré pozorovať v skúmavke s obsahom chlóru a vápnika, v ktorej prúd chlóru prechádza cez roztavený a veľmi horúci sodík:
2Na + Cl2 \u003d 2NaCl
Sodík reaguje nielen s jednoduchými, ale aj s komplexnými látkami, napríklad s vodou, ktorá sa z neho vytesňuje, pretože je to veľmi aktívny kov, v sérii záťaží je to veľa vľavo od vodíka a ľahko ho vytesňuje z vody:
2Na + 2H20 \u003d 2NaOH + H2
Horiace alkalické kovy sa nesmú hasiť vodou. Najlepšie je naplniť ho práškom zo sódy. V prítomnosti sodíka sa bezfarebný plameň plynového horáka zmení na žltý.
Kovový sodík sa môže použiť ako katalyzátor v organickej syntéze, napríklad pri výrobe syntetického kaučuku z butadiénu. Slúži ako východiskový materiál na prípravu ďalších zlúčenín sodíka, napríklad peroxidu sodného.
■ 27. Dokážte pomocou rovníc reakcií uvedených v texte reakcií obsahujúcich kovový sodík, ktorý sa správa ako redukčné činidlo.
28. Prečo nie je možné sodík skladovať na vzduchu?
29. Študent namočil kúsok sodíka do roztoku síranu meďnatého v nádeji, že vytlačí kov zo soli. Namiesto červeného kovu sa objavila želatínovo modrá zrazenina. Opíšte vzniknuté reakcie a napíšte ich rovnice do molekulárnych a iónových foriem. Ako by sa mali zmeniť reakčné podmienky tak, aby reakcia viedla k požadovanému výsledku? Napíšte rovnice v molekulárnych, plných a skrátených iónových formách.
30. 2,3 g kovového sodíka sa umiestnilo do nádoby so 45 ml vody. Aký lúh sodný sa tvoril na konci reakcie.
31. Aké látky sa môžu použiť na hasenie horiaceho sodíka? Dajte odôvodnenú odpoveď.
§ 98. Kyslíkové zlúčeniny sodíka. Lúh sodný
Kyslíkové zlúčeniny sodíka, ako už bolo uvedené, sú oxid sodný Na2O a peroxid sodný Na2O2.
Oxid sodný Na2O nie je nijak zvlášť významný. Prudko reaguje s vodou a vytvára lúh sodný.
Na2O + H20 \u003d 2NaOH
Peroxid sodný Na202 je žltkastý prášok. Môže sa považovať za druh peroxidu vodíka, pretože jeho štruktúra je rovnaká ako štruktúra H2O2. Rovnako ako peroxid sodný je silné oxidačné činidlo. Pôsobením vody tvorí alkáliu a:
Na2O2 + H20 \u003d H202 + 2NaOH
tvorené pôsobením zriedených kyselín na peroxid sodný:
Na2O2 + H2S04 \u003d H2O2 + Na2S04
Všetky vyššie uvedené vlastnosti peroxidu sodného umožňujú jeho použitie na bielenie všetkých možných materiálov.
Obr. 77. Schéma inštalácie na elektrolýzu roztoku chloridu sodného.
1 - anóda; 2 - membrána oddeľujúca anódový a katódový priestor; 3 katóda
Veľmi dôležitou zlúčeninou sodíka je hydroxid sodný alebo hydroxid sodný, hydroxid sodný. Nazýva sa tiež žieravá sóda alebo jednoducho žieravá.
Na získanie lúhovej sódy sa používa chlorid sodný - najlacnejšia prírodná zlúčenina sodíka, ktorá sa elektrolyzuje, ale v tomto prípade sa nepoužíva tavenina, ale používa sa soľný roztok (Obr. 77). Popis elektrolýzy roztoku chloridu sodného je uvedený v § 33. Na obr. 77 ukazuje, že anódový a katódový priestor sú oddelené membránou. Toto sa uskutočnilo, aby sa zabránilo vzájomnej interakcii vytvorených produktov, napríklad Сl2 + 2NaOH \u003d NaClO + NaCl + Н2O.
Lúh sodný - tuhá kryštalická látka bielej farby, dokonale rozpustná vo vode. Keď sa hydroxid sodný rozpustí vo vode, uvoľní sa veľké množstvo tepla a roztok je veľmi horúci. Lúh sodný sa musí skladovať v dobre utesnených nádobách, aby sa zabránilo prenikaniu vodnej pary, pod vplyvom ktorej môže byť veľmi vlhký, ako aj kysličníku uhličitému, pri ktorého pôsobení sa lúh sodný môže postupne premieňať na uhličitan sodný:
2NaOH + CO2 \u003d Na2C03 + H20.
Kaustická sóda je typická zásada, takže opatrenia pri práci s ňou sú rovnaké ako pri práci s akýmikoľvek inými zásadami.
Lúh sodný sa používa v mnohých priemyselných odvetviach, napríklad na rafináciu ropných produktov, výrobu mydla z tukov, v papierenskom priemysle, na výrobu umelých vlákien a farbív, na výrobu liekov atď. (Obr. 78).
Do notebooku napíšte oblasti aplikácie hydroxidu sodného.
Z sodných solí je potrebné uviesť predovšetkým chlorid sodný NaCl, ktorý slúži ako hlavná surovina pre hydroxid sodný a kovový sodík (ďalšie podrobnosti o tejto soli nájdete na strane 164), nátrium sodný, uhličitan sodný (pozri na strane 278), Na2SO4 (pozri stranu) 224), NaNO3 (pozri str. 250), atď.
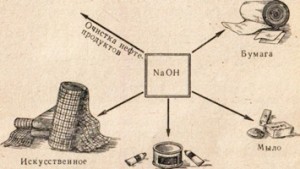
Obr. 78. Použitie hydroxidu sodného
■ 32. Opíšte spôsob výroby hydroxidu sodného elektrolýzou chloridu sodného.
33. Lúh sodný sa môže získať pôsobením na uhličitan sodný haseným vápnom. Vytvorte molekulárnu a iónovú formu rovnice pre túto reakciu a tiež vypočítajte, koľko sódy potrebujúcej 95% uhličitanu je potrebné na získanie 40 kg hydroxidu sodného.
34. Prečo nie sú zátky pri skladovaní roztoku hydroxidu sodného vo fľašiach so zátkami „zaseknuté“ a nedajú sa odstrániť? Ak sa fľaša na určitý čas drží hore nohami vo vode, korok sa môže voľne odstrániť. Vysvetlite, vzhľadom na reakčné rovnice, aké procesy prebiehajú v tomto prípade.
35. Napíšte rovnice reakcií v molekulárnych a iónových formách, ktoré charakterizujú vlastnosti hydroxidu sodného ako typickej zásady.
36. Aké bezpečnostné opatrenia by sa mali dodržiavať pri práci s hydroxidom sodným? Aké opatrenia prvej pomoci by sa mali poskytnúť pri popáleninách s lúhom sodným?
§ 99. Draslík
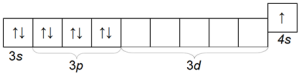
Draslík K je tiež pomerne bežným alkalickým kovom, ktorý sa líši od sodíka svojím atómovým polomerom (štvrtá perióda), a preto má väčšiu chemickú aktivitu ako sodík. Elektronická konfigurácia atómu draslíka je 1 s 2 2 2 2 2 6 6 3 2 2 3 6 6 4 1.
Štruktúra vonkajšej elektronickej vrstvy
Draslík je mäkký kov, ktorý je dobre rezaný nožom. Aby sa zabránilo oxidácii, je podobne ako sodík skladovaný pod vrstvou petroleja.
Draslík reaguje ešte prudšie s vodou ako sodík, s tvorbou alkálií as uvoľňovaním vodíka, ktorý zapaľuje:
2K + 2H20 \u003d 2KOH + H2.
Pri spaľovaní kyslíka (na spaľovanie sa odporúča brať ešte menšie kúsky kovu ako pri spaľovaní sodíka), napríklad sodíka, pri horení veľmi prudko pri tvorbe peroxidu draselného.
Je potrebné poznamenať, že draslík je v obehu oveľa nebezpečnejší ako sodík. K silnému výbuchu môže dôjsť aj pri rezaní draslíka, preto s ním musíte zaobchádzať ešte opatrnejšie.
Hydroxid draselný alebo hydroxid draselný KOH je biela kryštalická látka. Kaustický draslík je v každom prípade podobný hydroxidu sodného. Oni sú široko používané v priemysle mydla, ale jeho výroba je o niečo drahšia, takže nenájde takú aplikáciu ako NaOH.
Zvlášť treba uviesť draselné soli, pretože niektoré z nich sa široko používajú ako hnojivá. Sú to chlorid draselný KCI, dusičnan draselný KNO3, ktorý je tiež dusíkatým hnojivom.
■ 37. Ako môžeme vysvetliť skutočnosť, že hydroxid sodný je chemicky aktívnejší ako hydroxid sodný?
38. Časť draslíka sa do formy spustila vodou. Po skončení reakcie sa do nej vložilo malé množstvo zinku vo forme bielej želatínovej zrazeniny. Zrazenina zmizla a pri testovaní roztoku s fenolftaleínom zafarbilo farbu karmínovej farby. Aké chemické procesy tu nastali?
Ktoré sú v riešení? Dajte odôvodnenú odpoveď.
39. Prečo je draslík, rovnako ako všetky alkalické kovy, členom skupiny s-prvkov?
Alkalické kovy ľahko reagujú s nekovmi:
2K + I 2 \u003d 2 KI
2Na + H2 \u003d 2NaH
6Li + N2 \u003d 2Li3N (reakcia je už pri izbovej teplote)
2Na + S \u003d Na2S
2Na + 2C \u003d Na2C2
Pri reakciách s kyslíkom vykazuje každý alkalický kov svoju individualitu: pri horení na vzduchu tvorí lítium oxid, peroxid sodný, peroxid draselný.
4Li + 02 \u003d 2Li20
2Na + 02 \u003d Na202
K + 02 \u003d K02
Získanie oxidu sodného:
10Na + 2NaNO3 \u003d 6Na20 + N2
2Na + Na202 \u003d 2Na20
2Na + 2NaON \u003d 2Na20 + H2
Interakcia s vodou vedie k tvorbe zásady a vodíka.
2Na + 2H20 \u003d 2NaOH + H2
Reakcia s kyselinami:
2Na + 2HCl \u003d 2NaCl + H2
8Na + 5H2S04 (konc.) \u003d 4Na2SO4 + H2S + 4H20
2Li + 3H2S04 (koncentrovaný) \u003d 2LiHS04 + S02 + 2H20
8Na + 10HN03 \u003d 8NaN03 + NH4N03 + 3H20
Pri interakcii s amoniakom sa tvoria amidy a vodík:
2Li + 2NH3 \u003d 2LiNH2 + H2
Interakcia s organickými zlúčeninami:
H \u003d C \u003d C \u003d H + 2Na → Na \u003d C \u003d C \u003d Na + H2
2CH3CI + 2Na → C2H6 + 2NaCl
2C6H5OH + 2Na → 2C6H5 ONa + H2
2CH3OH + 2Na → 2CH3 ONa + H2
2CH3 COOH + 2Na → 2CH3 COOONa + H2
Kvalitatívnou reakciou na alkalické kovy je zafarbenie plameňa ich katiónmi. Li + iónové farby karmínovo červený plameň, Na + iónová žltá, K + fialová
Zlúčeniny alkalických kovov
Oxidy.
Oxidy alkalických kovov sú typické bázické oxidy. Reagujte s kyselinami a amfotérnymi oxidmi, kyselinami, vodou.
3Na20 + P205 \u003d 2Na3P04
Na20 + AI203 \u003d 2NaA102
Na20 + 2HCI \u003d 2NaCl + H20
Na20 + 2H + \u003d 2Na + + H20
Na20 + H20 \u003d 2NaOH
peroxidy.
2Na202 + CO2 \u003d 2Na2C03 + 02
Na2O2 + CO \u003d Na2C03
Na2O2 + S02 \u003d Na2S04
2Na20 + 02 \u003d 2Na202
Na20 + NO + N02 \u003d 2NaN02
2Na202 \u003d 2Na20 + 02
Na202 + 2H20 (studená) \u003d 2NaOH + H202
2Na202 + 2H20 (horizontálne) \u003d 4NaOH + 02
Na202 + 2HCl \u003d 2NaCl + H202
2Na202 + 2H2SO4 (dekomp. Horizontálny) \u003d 2Na2SO4 + 2H20 + 02
2Na202 + S \u003d Na2S04 + Na20
5Na202 + 8H2SO4 + 2KMn04 \u003d 5O2 + 2MnSO4 + 8H20 + 5Na2SO4 + K2S04
Na2O2 + 2H2SO4 + 2NaI \u003d I2 + 2Na2SO4 + 2H20
Na2O2 + 2H2SO4 + 2 FeS04 \u003d Fe2 (S04) 3 + Na2S04 + 2H20
3Na202 + 2Na3 \u003d 2Na2Cr04 + 8NaOH + 2H20
Zásada (zásada).
2NaOH (nadbytok) + CO2 \u003d Na2C03 + H20
NaOH + C02 (nadbytok) \u003d NaHC03
S02 + 2NaOH (nadbytok) \u003d Na2S03 + H20
Si02 + 2NaOH Na2S03 + H20
2NaOH + AI203 2NaA102 + H20
2NaOH + AI203 + 3H20 \u003d 2Na
NaOH + Al (OH) 3 \u003d Na
2NaOH + 2Al + 6H20 \u003d 2Na + 3H2
2KOH + 2NO2 + 02 \u003d 2KNO3 + H20
KOH + KHCO3 \u003d K2C03 + H20
2NaOH + Si + H20 \u003d Na2Si03 + H2
3KOH + P4 + 3H20 \u003d 3KH2P02 + PH3
2KOH (studený) + Cl2 \u003d KC10 + KC1 + H20
6KOH (horúci) + 3CI2 \u003d KC133 + 5KCl + 3H20
6NaOH + 3S \u003d 2Na2S + Na2S03 + 3H20
2NaNO3 2NaNO2 + 02
NaHC03 + HN03 \u003d NaN03 + C02 + H20
NaI → Na + + I -
na katóde: 2Н 2 О + 2e → H2 + 2OH - 1
na anóde: 2I - - 2e → I 2 1
2H20 + 2I - ![]() H2 + 2OH - + I2
H2 + 2OH - + I2
2H20 + 2NaI ![]() H2 + 2NaOH + I2
H2 + 2NaOH + I2
2NaCl ![]() 2Na + Cl2
2Na + Cl2
na katóde na anóde
2Na2HP04NaP207 + H20
KN03 + 4Mg + 6H20 \u003d NH3 + 4 mg (OH) 2 + KOH
4KClO3 KCl + 3KClO4
2KClO3 ![]() 2KCl + 3O 2
2KCl + 3O 2
KC133 + 6HC1 \u003d KC1 + 3CI2 + 3H20
Na2S03 + S \u003d Na2S203
Na2S203 + H2S04 \u003d Na2S04 + S ↓ + S02 + H20
2NaI + Br2 \u003d 2NaBr + I2
2NaBr + Cl2 \u003d 2NaCl + Br2
I Skupina.
1. Elektrické povrchové výboje prešli cez povrch roztoku hydroxidu sodného naliateho do banky a vzduch v banke bol sfarbený do hnedého stavu, ktorý po chvíli zmizol. Výsledný roztok sa opatrne odparil a zistilo sa, že tuhý zvyšok je zmes dvoch solí. Pri zahrievaní tejto zmesi sa uvoľní plyn a zostane jediná látka. Napíšte rovnice opísaných reakcií.
2. Látka uvoľnená na katóde počas elektrolýzy taveniny chloridu sodného sa spálila v kyslíku. Výsledný produkt sa umiestnil do plynomeru naplneného oxidom uhličitým. Výsledná látka sa pridala do roztoku chloridu amónneho a roztok sa zahrieval. Napíšte rovnice opísaných reakcií.
3) Kyselina dusičná sa neutralizovala jedlou sódou, neutrálny roztok sa opatrne odparil a zvyšok sa kalcinoval. Výsledná látka sa vniesla do roztoku manganistanu draselného okysleného kyselinou sírovou a roztok sa zmenil na sfarbený. Reakčný produkt obsahujúci dusík sa umiestnil do roztoku hydroxidu sodného, \u200b\u200bpridal sa zinkový prach a uvoľnil sa plyn so štipľavým zápachom. Napíšte rovnice opísaných reakcií.
4) Látka získaná na anóde počas elektrolýzy roztoku jodidu sodného s inertnými elektródami sa zaviedla do reakcie s draslíkom. Reakčný produkt bol zahrievaný koncentrovanou kyselinou sírovou a vyvíjaný plyn bol vedený cez horúci roztok chromanu draselného. Napíšte rovnice opísaných reakcií
5) Látka získaná na katóde počas elektrolýzy taveniny chloridu sodného sa spálila v kyslíku. Získaný produkt sa následne spracuje s oxidom siričitým a roztokom hydroxidu bárnatého. Napíšte rovnice opísaných reakcií
6) Biely fosfor sa rozpúšťa v roztoku hydroxidu draselného s vývojom plynu s cesnakovým zápachom, ktorý sa spontánne vznieti vo vzduchu. Pevný produkt spaľovacej reakcie reagoval s hydroxidom sodným v takom pomere, aby výsledná biela látka obsahovala jeden atóm vodíka; keď sa kalcinuje, vytvára sa pyrofosforečnan sodný. Napíšte rovnice opísaných reakcií
7) Neznámy kov horel v kyslíku. Reakčný produkt, ktorý reaguje s oxidom uhličitým, tvorí dve látky: pevnú látku, ktorá reaguje s roztokom kyseliny chlorovodíkovej s uvoľňovaním oxidu uhličitého, a plynnú jednoduchú látku, ktorá podporuje spaľovanie. Napíšte rovnice opísaných reakcií.
8) Hnedý plyn prešiel nadbytkom roztoku hydroxidu draselného v prítomnosti veľkého prebytku vzduchu. Do výsledného roztoku sa pridali hobliny horčíka a zahrievali sa a kyselina dusičná sa neutralizovala uvoľňovaným plynom. Výsledný roztok sa opatrne odparil a tuhý reakčný produkt sa kalcinoval. Napíšte rovnice opísaných reakcií.
9) Počas tepelného rozkladu soli A v prítomnosti oxidu manganičitého sa vytvára binárna soľ B a plyn podporujúci horenie a sú súčasťou vzduchu; keď sa táto soľ zahrieva bez katalyzátora, vytvorí sa soľ B a kyslá soľ s vyšším obsahom kyslíka. Počas interakcie soli A s kyselinou chlorovodíkovou sa uvoľní žltozelený plyn (jednoduchá látka) a vytvorí sa soľ B. Soľ B zmení plameň na fialovú, keď interaguje s roztokom dusičnanu strieborného, \u200b\u200bčím sa vytvorí biela zrazenina. Napíšte rovnice opísaných reakcií.
10) K zahriatej koncentrovanej kyseline sírovej sa pridali hobliny medi a vyvíjaný plyn sa nechal prejsť roztokom hydroxidu sodného (nadbytok). Reakčný produkt bol izolovaný, rozpustený vo vode a zahrievaný sírou, ktorá sa rozpustila v dôsledku reakcie. K výslednému roztoku sa pridá zriedená kyselina sírová. Napíšte rovnice opísaných reakcií.
11) Soľ bola spracovaná koncentrovanou kyselinou sírovou. Výsledná soľ sa nechá reagovať s hydroxidom sodným. Výsledný produkt bol kalcinovaný nadbytkom uhlia. Plyn uvoľnený v tomto prípade reagoval v prítomnosti chlórového katalyzátora. Napíšte rovnice opísaných reakcií.
12) Sodík reagoval s vodíkom. Reakčný produkt sa rozpustil vo vode, vytvoril sa plyn, ktorý reagoval s chlórom, a výsledný roztok reagoval s chlórom, keď sa zahrieval, čím sa vytvorila zmes dvoch solí. Napíšte rovnice opísaných reakcií.
13) Sodík bol spálený v nadbytku kyslíka, výsledná kryštalická látka bola umiestnená do sklenenej skúmavky a cez ňu prešiel oxid uhličitý. Plyn vychádzajúci z trubice sa zhromaždil a spálil fosfor vo svojej atmosfére. Výsledný materiál sa neutralizoval nadbytkom roztoku hydroxidu sodného. Napíšte rovnice opísaných reakcií.
14) Roztok kyseliny chlorovodíkovej sa pridal k roztoku získanému interakciou peroxidu sodného s vodou, keď sa zahrieval až do ukončenia reakcie. Roztok vytvorenej soli sa elektrolyzoval inertnými elektródami. Plyn generovaný elektrolýzou na anóde prešiel suspenziou hydroxidu vápenatého. Napíšte rovnice opísaných reakcií.
15) Sírny plyn prešiel cez roztok hydroxidu sodného za vzniku strednej soli. K výslednému roztoku sa pridal vodný roztok manganistanu draselného. Výsledná zrazenina sa oddelila a pôsobila na ňu s kyselinou chlorovodíkovou. Uvoľnený plyn prešiel studeným roztokom hydroxidu draselného. Napíšte rovnice opísaných reakcií.
16) Zmes oxidu kremičitého (IV) a kovu horčíka bola kalcinovaná. Na výslednú jednoduchú látku sa pôsobilo koncentrovaným roztokom hydroxidu sodného. Uvoľnený plyn prešiel cez zahriaty sodík. Výsledná látka bola umiestnená do vody. Napíšte rovnice opísaných reakcií.
17) Produkt interakcie lítia s dusíkom sa spracuje vodou. Výsledný plyn prešiel roztokom kyseliny sírovej až do ukončenia chemických reakcií. Výsledný roztok sa zmieša s roztokom chloridu bárnatého. Roztok bol prefiltrovaný a filtrát bol zmiešaný s roztokom dusičnanu sodného a zahrievaný. Napíšte rovnice opísaných reakcií.
18) Sodík sa zahrieval v atmosfére vodíka. Keď sa k získanej látke pridala voda, pozoroval sa vývoj plynu a tvorba číreho roztoku. Týmto roztokom prešiel hnedý plyn, ktorý sa získal ako výsledok interakcie medi s koncentrovaným roztokom kyseliny dusičnej. Napíšte rovnice opísaných reakcií.
19) Hydrogenuhličitan sodný bol kalcinovaný. Výsledná soľ sa rozpustila vo vode a zmiešala sa s roztokom hliníka, čím sa vytvorila zrazenina a uvoľnil sa bezfarebný plyn. Zrazenina sa nechá reagovať s nadbytkom roztoku kyseliny dusičnej a plyn sa nechá prejsť roztokom kremičitanu draselného. Napíšte rovnice opísaných reakcií.
20) Sodík bol fúzovaný so sírou. Výsledná zlúčenina sa spracovala s kyselinou chlorovodíkovou a vyvíjaný plyn úplne reagoval s oxidom siričitým. Na výsledný materiál sa pôsobilo koncentrovanou kyselinou dusičnou. Napíšte rovnice opísaných reakcií.
21) Sodík spaľoval prebytočný kyslík. Výsledná látka bola ošetrená vodou. Výsledná zmes sa varila a potom sa do horúceho roztoku pridal chlór. Napíšte rovnice opísaných reakcií.
22) Draslík sa zahrieval v atmosfére dusíka. Výsledná látka sa zmieša s nadbytkom kyseliny chlorovodíkovej, potom sa k výslednej zmesi solí pridá suspenzia hydroxidu vápenatého a zmes sa zahrieva. Výsledný plyn prešiel radiačným oxidom medi II. Napíšte rovnice popísaných reakcií.
23) Draslík sa spálil v atmosfére chlóru a výsledná soľ sa spracovala s nadbytkom vodného roztoku dusičnanu strieborného. Vytvorená zrazenina sa odfiltruje, filtrát sa odparí a zmes sa opatrne zahrieva. Výsledná soľ sa nechá reagovať s vodným roztokom brómu. Napíšte rovnice opísaných reakcií.
24) Lítium reagovalo s vodíkom. Reakčný produkt sa rozpustil vo vode, vytvoril sa plyn, ktorý reagoval s brómom, a výsledný roztok reagoval s chlórom, keď sa zahrieval, čím sa vytvorila zmes dvoch solí. Napíšte rovnice opísaných reakcií.
25) Vo vzduchu horel sodík. Výsledná tuhá látka absorbuje oxid uhličitý pri uvoľňovaní kyslíka a soli. Táto soľ bola rozpustená v kyseline chlorovodíkovej a k výslednému roztoku bol pridaný roztok dusičnanu strieborného. Vypadla biela zrazenina. Napíšte rovnice opísaných reakcií.
26) Kyslík bol vystavený elektrickému výboju v ozonizátore. Výsledný plyn prešiel cez vodný roztok jodidu draselného, \u200b\u200bzatiaľ čo nový plyn bol uvoľňovaný bez farby a zápachu, ktorý podporuje spaľovanie a dýchanie. Sodík sa spálil v atmosfére posledného plynu a tuhá látka získaná s týmto reagovala s oxidom uhličitým. Napíšte rovnice opísaných reakcií.
I Skupina.
1. N2 + 02 ![]() 2NO
2NO
2NO + 02 \u003d 2NO2
2NO2 + 2NaOH \u003d NaNO3 + NaNO2 + H20
2NaNO3 2NaNO2 + 02
2. 2NaCl ![]() 2Na + Cl2
2Na + Cl2
na katóde na anóde
2Na + 02 \u003d Na202
2Na202 + 2CO2 \u003d 2Na2C03 + 02
Na2C03 + 2NH4C1 \u003d 2NaCl + C02 + 2NH3 + H20
3. NaHC03 + HN03 \u003d NaN03 + C02 + H20
2NaNO3 2NaNO2 + 02
5NaNO2 + 2KMnO4 + 3H2S04 \u003d 5NaNO3 + 2MnSO4 + K2SO4 + 3H20
NaN03 + 4Zn + 7NaOH + 6H20 \u003d 4Na2 + NH3
4,2H20 + 2Na ![]() H2 + 2NaOH + I2
H2 + 2NaOH + I2
2K + I 2 \u003d 2 KI
8KI + 5H2S04 (konc.) \u003d 4K2SO4 + H2S + 4I2 + 4H20
3H2S + 2K2Cr04 + 2H20 \u003d 2Cr (OH) 3 ↓ + 3S ↓ + 4KOH
5. 2NaCl ![]() 2Na + Cl2
2Na + Cl2
na katóde na anóde
2Na + 02 \u003d Na202
Na2O2 + S02 \u003d Na2S04
Na2S04 + Ba (OH) 2 \u003d BaS04 + 2NaOH
6. P4 + 3KOH + 3H20 \u003d 3KH2P02 + PH3
2PH3 + 4O2 \u003d P205 + 3H20
P205 + 4NaOH \u003d 2Na2HP04 + H20


