14.08.2019
Care sunt proprietățile comune ale metalelor cu elemente chimice. Metalele ca elemente chimice
Încă din copilărie întâlnim fraza că un astfel de obiect este confecționat din metal. Ce este metalul?
Metalele sunt un anumit grup de elemente chimice (precum și aliajele lor) care au proprietăți comune întregului grup, precum rezistența crescută, conductibilitatea termică și electrică bună, ductilitate, ductilitate, luciu metalic.
Aproape 80% din toate elementele chimice cunoscute aparțin metalelor (96 din 118).
Proprietățile fizice ale metalelor
Toate metalele, cu excepția mercurului, sunt în mod normal solide. În ceea ce privește duritatea, cel mai moale metal este cesiul (0,2 puncte pe o scară de 10 puncte Mohs). Cel mai greu este wolframul. Duritatea sa este de 6 puncte. Duritatea fierului este de 4 puncte.
Temperaturile de topire (tranziția la starea lichidă) a metalelor variază: de la - 39º pentru mercur până la 3 410º pentru tungsten. Toate metalele alcaline au puncte mici de topire, iar staniu și plumb sunt cele obișnuite. Pot fi topite chiar acasă pe un arzător de gaz. Majoritatea metalelor sunt topite în cuptoare speciale cu temperaturi ridicate.
Datorită prezenței electronilor mobili liberi în grilele de cristal ale metalelor, toate conduc electricitatea și căldura foarte bine. Cei mai buni conductori de electricitate din metale sunt argintul, cuprul și aluminiul. Nu este întâmplător că din ultimele două metale se realizează cablarea electrică.
Cu o conductibilitate termică excelentă a metalelor, întâlnim adesea în viața de zi cu zi. Pentru a fierbe apa, o turnăm într-o tigaie metalică și o punem pe aragaz. Teng încălzește metalul, iar metalul transferă aproape toată energia termică în apă.
Proprietățile chimice ale metalelor
În timpul reacțiilor chimice, toate metalele își donează cu ușurință electronii și acționează ca agenți reducători.
Aproape toate metalele sunt oxidate de oxigen. Metalele alcaline (litiu, calciu) reacționează cu oxigenul în condiții normale. Oxidarea altor metale prin oxigen necesită o temperatură ridicată. De exemplu, dacă încălziți un fir de cupru peste un foc, cuprul va interacționa cu oxigenul din aer și va deveni acoperit cu o peliculă neagră (oxid de cupru):
- 2Cu + O 2 → 2CuO
Aurul și platina nu reacționează cu oxigenul.
Dintre alți agenți de oxidare, clorul și sulful reacționează cu metalele. Dacă amestecați filamente de fier și pulbere de sulf și încălziți amestecul, atunci înaintea ochilor noștri obținem sulfură de fier:
- Fe + S → FeS
Activitatea de reducere a diferitelor metale este diferită. În activitatea lor, metalele sunt distribuite după cum urmează:
- Li - K - Ba - Sr - Ca - Na - Mg - Al - Mn - Zn - Cr - Fe - Ca - Co - Ni - Sn - Pb - (H2) - Cu - Hg - Ag - Pt - Au.
Cu cât este mai stânga metalul în acest rând, cu atât este mai activ. Elementul anterior poate deplasa metalul spre dreapta. De exemplu, dacă o bucată de fier este plasată într-o eprubetă cu o soluție de sulfat de cupru, atunci va fi acoperită cu o acoperire maro (o peliculă de cupru):
- Fe + CuSO4 → FeSO4 + Cu
Metalele din stânga hidrogenului (H2) îl pot deplasa din acid clorhidric. Dacă o bucată de zinc este coborâtă în acid clorhidric, hidrogenul va începe să fie eliberat:
- HCl + Zn → ZnCl2 + H2
Metalele alcaline reacționează ușor cu apa. Dacă o bucată de sodiu este plasată într-un recipient cu apă, atunci hidrogenul va fi eliberat activ și alcalinul va forma:
- 2Na + 2H2O → 2NaOH + H2
Aplicație metalică
Datorită proprietăților sale benefice, metalele au intrat ferm în viața umană. Un bărbat folosește puterea metalelor, făcându-le carcasele clădirilor (de la pavilioane mici până la zgârie-nori uriași), caroserii auto (mașini, vagoane, nave, mașini-unelte), precum și piese de lucru ale diverselor unelte.
definiție
Fiind în natură
Proprietățile metalului
Proprietăți caracteristice de metale
Proprietăți fizice de metale
Proprietățile chimice ale metalelor
Structura microscopică
Metale alcaline
Caracteristicile generale ale metalelor alcaline
Proprietățile chimice ale metalelor alcaline
Producția de metale alcaline
hidroxizi
carbonați
rubidiu
Metale alcaline pământești
calciu
stronțiu
Metale de tranziție
Caracteristici generale ale elementelor de tranziție
Aplicație metalică
Materiale de construcție
Materiale electrice
Materiale de scule
Povestea
extractiv metalurgie
Metalul este (numele provine de la lat. metallum - mine) - un grup de elemente cu proprietăți metalice caracteristice, cum ar fi conductivitatea termică și electrică ridicată, un coeficient de temperatură pozitiv de rezistență, o ductilitate ridicată, etc. Aproximativ 70% din toate elementele chimice aparțin metalelor.
Metalul este











![]()





















![]()


![]()





Fiind în natură
Majoritatea metalelor sunt prezente în natură sub formă de minereuri și compuși. Ele formează oxizi, sulfuri, carbonați și alți compuși chimici. Pentru a obține metale pure și aplicarea lor ulterioară, este necesar să le izolați de minereuri și să efectuați curățarea. Dacă este necesar, se efectuează alierea și alte prelucrări ale metalelor Știința studiază acest lucru. metalurgie. Metalurgia distinge minereurile feroase (pe baza de glandă) și culoare (neincluse) fier, în total aproximativ 70 de articole). și platina se aplică și metalelor prețioase. În plus, în cantități mici, ele sunt prezente în apa de mare, plante, organisme vii (jucând un rol important).
Se știe că corpul uman este compus din 3% din metale. Cel mai mult în celulele noastre sunt calciu și sodiu, concentrate în sistemele limfatice. Magneziul se acumulează în mușchi și sistemul nervos, cupru - în ficat, - în sânge.
Proprietățile metalului
Metalul este
Proprietățile caracteristice ale metalelor
Lustru metalic (cu excepția iodului și carbonului sub formă de grafit. În ciuda strălucirii sale metalice, iodul cristalin și grafitul sunt nemetale.)
Conductivitate electrică bună (cu excepția carbonului.)
Posibilitate de prelucrare ușoară.
Densitate mare (de obicei, metalele sunt mai grele decât nemetalele.)
Punct de topire ridicat (excepții: mercur, galiu și metale alcaline.)
Conductivitate termică ridicată
În reacții, acestea sunt întotdeauna agenți reducători.
Proprietățile fizice ale metalelor
Toate metalele (cu excepția mercurului și, condițional) în condiții solide sunt într-o stare solidă, dar au duritate diferită. Deci, metalele alcaline sunt tăiate cu ușurință cu un cuțit de bucătărie, iar metalele precum vanadiul, tungstenul și cromul zgârie ușor cel mai tare și sticla. Mai jos este duritatea unor metale pe scara Mohs.
Punctele de topire variază între -39 ° C (mercur) și 3410 ° C (wolfram). Punctul de topire al majorității metalelor (cu excepția alcaliilor) este mare, dar unele metale „normale”, de exemplu staniu și plumbpoate fi topit pe o sobă electrică sau electrică convențională.
În funcție de densitate, metalele sunt împărțite în lumină (densitate 0,53 h 5 g / cm_) și grele (5 h 22,5 g / cm_). Cel mai ușor metal este litiu (densitate 0,53 g / cm_). În prezent este imposibil să denumim cel mai greu metal, deoarece densitățile osmiei și iridiului - cele două cele mai grele metale - sunt aproape egale (aproximativ 22,6 g / cm2 - exact de două ori mai mari decât densitatea plumb), și este extrem de dificil să se calculeze densitatea lor exactă: pentru aceasta trebuie să curățați complet metalele, deoarece orice impuritate le reduce densitatea.
Majoritatea metalelor sunt din plastic, adică sârma metalică poate fi îndoită și nu se va rupe. Acest lucru se datorează deplasării straturilor de atomi de metal fără a rupe legătura dintre ei. Cele mai plastice sunt aur, argint și cupru. din aur este posibil să se realizeze o folie cu o grosime de 0,003 mm, care este folosită pentru articole de comerț cu aur. Cu toate acestea, nu toate metalele sunt ductile. Sârmă de la zinc sau staniu crizele când sunt îndoite; după deformare, manganul și bismutul nu se îndoaie aproape niciodată, ci se rup imediat. Plasticitatea depinde și de puritatea metalului; Astfel, cromul foarte pur este foarte plastic, dar, contaminat chiar și cu impurități minore, devine fragil și mai greu.
Toate metalele conduc electricitatea bine; acest lucru se datorează prezenței în rețelele de cristal ale electronilor mobili care se deplasează sub influența unui câmp electric. argintcupru și aluminiu au cea mai mare conductivitate electrică; din acest motiv, ultimele două metale sunt cel mai adesea folosite ca material pentru fire. Sodiul are, de asemenea, o conductibilitate electrică foarte ridicată; în echipamentele experimentale se cunosc încercări de utilizare a conductoarelor de sodiu sub formă de tuburi din oțel inoxidabil cu pereți subțiri umplute cu sodiu. Datorită gravității specifice scăzute de sodiu, cu o rezistență egală, „firele” de sodiu sunt mult mai ușoare decât cuprul și chiar ceva mai ușoare decât aluminiul.
Conductivitatea termică ridicată a metalelor depinde și de mobilitatea electronilor liberi. Prin urmare, o serie de conductivități termice este similară cu o serie de conductivități electrice, iar cel mai bun conductor de căldură, precum electricitatea, este. Sodiul găsește, de asemenea, utilizarea ca un bun conductor de căldură; este cunoscută pe scară largă, de exemplu, utilizarea de sodiu în supapele motoarelor auto pentru a îmbunătăți răcirea acestora.
Suprafața netedă a metalelor reflectă multă lumină - acest fenomen se numește strălucire metalică. Cu toate acestea, într-o stare pulbere, majoritatea metalelor își pierd strălucirea; aluminiu iar magneziul își păstrează strălucirea în pulbere. Cele mai multe reflectă lumina, argintul și - oglinzile sunt fabricate din aceste metale. Rodiul este uneori folosit și pentru fabricarea oglinzilor, în ciuda prețului său excepțional de mare: datorită durității și rezistenței chimice mult mai mari decât argintul sau chiar paladiul, stratul de rodiu poate fi mult mai subțire decât argintul.
Culoarea majorității metalelor este aproximativ aceeași - gri deschis cu o nuanță albăstruie. , cupru și, respectiv, cesiu, galben, roșu și galben deschis.
Proprietățile chimice ale metalelor
Metalul este
Majoritatea metalelor au o cantitate mică de electroni pe stratul extern de electroni (1-3), astfel încât acționează ca agenți reducători în majoritatea reacțiilor (adică „dau înapoi” electronii lor)
1. Reacții cu substanțe simple
Toate metalele reacționează cu oxigenul, cu excepția aurului, a platinei. Reacția cu argintul are loc la temperaturi ridicate, dar oxidul de argint (II) practic nu se formează, deoarece este instabil termic. În funcție de metal, producția poate fi oxizi, peroxizi, peroxizi:
4Li + O2 \u003d 2Li2Oxid de litiu
2Na + O2 \u003d peroxid de sodiu Na2O2
K + O2 \u003d superoxid de potasiu KO2
Pentru a obține oxid din peroxid, peroxidul este redus cu un metal:
Na2O2 + 2Na \u003d 2Na2O
Cu metale cu activitate medie și joasă, reacția are loc atunci când este încălzită:
3Fe + 2O2 \u003d Fe3O4
Doar cele mai active metale reacționează cu azot, numai litiu interacționează la temperatura camerei, formând nitruri:
6Li + N2 \u003d 2Li3N
Când este încălzit:
3Ca + N2 \u003d Ca3N2
Toate metalele reacționează cu sulful, cu excepția aurului și a platină:
Fierul interacționează cu gri atunci când este încălzit, formând sulfură:
Doar cele mai active metale reacționează cu hidrogenul, adică metale din grupele IA și IIA, cu excepția Be. Reacțiile se efectuează prin încălzire și se formează hidruri. În reacții, metalul acționează ca un agent reducător, starea de oxidare a hidrogenului este −1:
Doar cele mai active metale reacționează cu carbonul. În acest caz, se formează acetilenide sau metanide. Acetilenidele, când reacționează cu apa, dau acetilenă, metanide - metan.
2Na + 2C \u003d Na2C2
Na2C2 + 2H2O \u003d 2NaOH + C2H2
Dopajul reprezintă introducerea de elemente suplimentare în topitură care modifică proprietățile mecanice, fizice și chimice ale materialului de bază.
Structura microscopică
Proprietățile caracteristice ale metalelor pot fi înțelese pe baza structurii lor interne. Toți aceștia au o conexiune slabă de electroni ai nivelului de energie extern (cu alte cuvinte, electroni de valență) cu nucleul. Datorită acestui fapt, diferența de potențial creată în conductor conduce la o mișcare de electroni ca o avalanșă (numiți electroni de conducere) în rețeaua de cristal. Colectarea unor astfel de electroni este adesea numită gaz de electroni. Pe lângă electroni, fononii (vibrațiile din zăbrele) contribuie la conductivitatea termică. Plasticitatea se datorează micii bariere energetice la mișcarea luxațiilor și la deplasarea planurilor cristalografice. Duritatea poate fi explicată printr-un număr mare de defecte structurale (atomi interstițiali etc.).
Datorită recuperării ușoare a electronilor, este posibilă oxidarea metalelor, ceea ce poate duce la coroziunea și degradarea suplimentară a proprietăților. Capacitatea de oxidare poate fi recunoscută prin seria standard de activitate a metalelor. Acest fapt confirmă necesitatea utilizării metalelor în combinație cu alte elemente (aliajul, cel mai important dintre acestea fiind oțel), alierea lor și aplicarea diverselor acoperiri.
Pentru o descriere mai corectă a proprietăților electronice ale metalelor, este necesară utilizarea mecanicii cuantice. În toate solidele cu o simetrie suficientă, nivelurile de energie ale electronilor indivizilor individuali se suprapun și formează benzi permise, iar banda formată de electroni de valență se numește banda de valență. Legătura slabă a electronilor de valență în metale duce la faptul că banda de valență din metale este foarte largă, iar toți electronii de valență nu sunt suficienți pentru a o umple complet.
Caracteristica principală a unei astfel de zone parțial umplute este că, chiar și cu o tensiune minimă aplicată, restructurarea electronilor de valență începe în eșantion, adică un curent electric curge.
Aceeași mobilitate ridicată a electronilor duce la o conductibilitate termică ridicată, precum și la capacitatea de a reflecta radiațiile electromagnetice (ceea ce conferă metalelor un luciu caracteristic).
Metale alcaline
Metalul este
Metale alcaline - elemente ale subgrupului principal din grupa I a sistemului periodic al elementelor chimice ale DI Dmitry Ivanovich Mendeleev: litiu Li, sodiu Na, potasiu K, rubidiu Rb, cesiu Cs și Franța Fr. Aceste metale sunt numite alcaline, deoarece majoritatea compușilor lor sunt solubile în apă. În limba slavă, „leach” înseamnă „dizolva”, iar acest lucru a determinat numele acestui grup de metale. Când metalele alcaline se dizolvă în apă, se formează hidroxizi solubili, numiți alcali.
Caracteristicile generale ale metalelor alcaline
În Sistemul Periodic, acestea urmează imediat gazele inerte, de aceea, o caracteristică a structurii atomilor de metale alcaline este aceea că conțin un electron la un nou nivel de energie: configurația lor electronică este ns1. Este evident că electronii de valență ai metalelor alcaline pot fi îndepărtați cu ușurință, deoarece este benefic energetic pentru un atom să doneze un electron și să dobândească o configurație de gaz inert. Prin urmare, toate metalele alcaline sunt caracterizate prin reducerea proprietăților. Acest lucru este confirmat de valorile scăzute ale potențialelor lor de ionizare (potențialul de ionizare al atomului de cesiu este unul dintre cele mai mici) și electronegativitatea (EO).
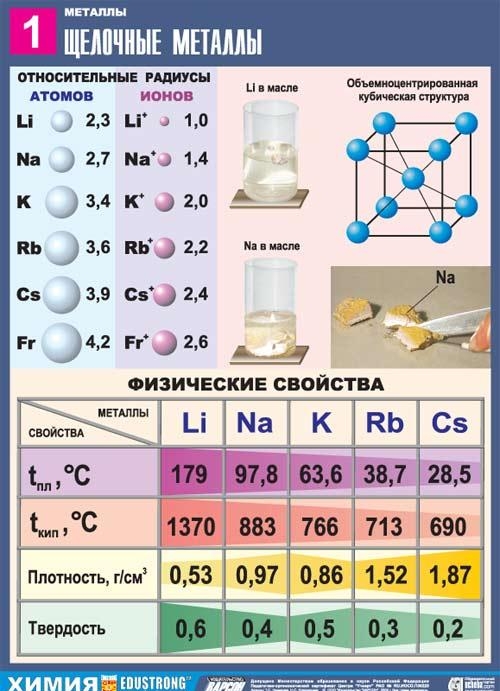
Toate metalele acestui subgrup au o culoare alb-argintiu (cu excepția cesiumului galben-argintiu), sunt foarte moi, pot fi tăiate cu un bisturiu. Litiu, sodiu și potasiu sunt mai ușoare decât apa și plutesc pe suprafața sa, reacționând cu acesta.
Metalele alcaline se găsesc în natură sub formă de compuși care conțin cationi încărcați singuri. Multe minerale conțin metale ale subgrupului principal din grupa I. De exemplu, ortoclasa, sau feldspatul, este format din aluminusilicat de potasiu K2, similar mineralcare conține sodiu - albit - are compoziția Na2. Apa de mare conține clorură de sodiu NaCl, iar solul conține săruri de potasiu - KCl de silvină, NaCl de silvinită. KCl, KCl carnalit. MgCI2. 6H2O, polialgalit K2SO4. MgSO4. CaSO4. 2H2O.
Proprietățile chimice ale metalelor alcaline
Metalul este
Datorită activității chimice ridicate a metalelor alcaline cu privire la apă, oxigen, azot, acestea sunt depozitate sub un strat de kerosen. Pentru a realiza reacția cu un metal alcalin, o bucată de dimensiunea dorită este tăiată cu grijă cu un bisturiu sub strat petrol lampant, într-o atmosferă cu argon, suprafața metalică este curățată complet de produsele interacțiunii sale cu aerul și abia apoi proba este plasată în vasul de reacție.
1. Interacțiunea cu apa. O proprietate importantă a metalelor alcaline este activitatea ridicată a acestora în ceea ce privește apa. Litiu reacționează cel mai calm (fără explozie) cu apă.
Într-o reacție similară, sodiu arde cu o flacără galbenă și are loc o explozie mică. Potasiul este și mai activ: în acest caz, explozia este mult mai puternică, iar flacăra este de culoare violet.
2. Interacțiunea cu oxigenul. Produsele de ardere ale metalelor alcaline în aer au o compoziție diferită în funcție de activitatea metalului.
Doar litiu arde în aer cu formarea oxidului stoechiometric.
În timpul arderii de sodiu, peroxidul de Na2O2 este format în principal cu un amestec mic de peroxid de NaO2.
Produsele de ardere de potasiu, rubidiu și cesiu conțin în principal superoxid.
Pentru a obține oxizi de sodiu și potasiu, amestecurile de hidroxid, peroxid sau superoxid sunt încălzite cu exces de metal în absența oxigenului.
Următoarea regularitate este tipică pentru compușii de oxigen ai metalelor alcaline: pe măsură ce raza cationului metalelor alcaline crește, stabilitatea compușilor de oxigen care conțin ion peroxid O22 și ion superperoxid O2 - crește.
Pentru metalele alcaline grele, este caracteristică formarea de ozonide destul de stabile din compoziția EO3. Toți compușii de oxigen au o culoare diferită, a cărei intensitate se adâncește într-o serie de la Li la Cs.
Oxizii metalici alcalini posedă toate proprietățile inerente oxizilor de bază: reacționează cu apa, oxizii de acizi și acizii.
Peroxizii și superoxizii prezintă proprietățile agenților oxidanti puternici.
Peroxizii și superoxizii interacționează intens cu apa, formând hidroxizi.
3. Interacțiunea cu alte substanțe. Metalele alcaline reacționează cu multe non-metale. Când sunt încălziți, se combină cu hidrogenul pentru a forma hidruri, cu halogeni, gri, azot, fosfor, carbon și siliciu pentru a forma, respectiv, haluri, sulfuri, nitride, fosfide, carburi și silicide.
Când sunt încălzite, metalele alcaline sunt capabile să reacționeze cu alte metale, formând compuși intermetalici. Metalele alcaline cu acizii reacționează activ (cu o explozie).
Metalele alcaline sunt dizolvate în amoniac lichid și derivații săi - amine și amide.
Când este dizolvat în amoniac lichid, un metal alcalin pierde un electron, care este solvat de molecule de amoniac și dă soluției o culoare albastră. Amidele rezultate sunt ușor descompuse de apă cu formarea de alcalini și amoniac.
Metalele alcaline interacționează cu substanțele organice cu alcooli (cu formarea alcoolaților) și acizii carboxilici (cu formarea sărurilor).
4. Determinarea calitativă a metalelor alcaline. Deoarece potențialele de ionizare ale metalelor alcaline sunt mici, când metalul sau compușii săi sunt încălziți într-o flacără, atomul ionizează, colorând flacăra într-o anumită culoare.
Producția de metale alcaline
1. Pentru producerea de metale alcaline, în principal electroliza topiturilor halogenurilor lor, cel mai adesea clorurile formând naturale minerale:
catod: Li + + e → Li
anod: 2Cl- - 2e → Cl2
2. Uneori, pentru a obține metale alcaline, se efectuează electroliza topiturilor lor de hidroxid:
catod: Na + + e → Na
anod: 4OH- - 4e → 2H2O + O2
Deoarece metalele alcaline din seria electrochimică a tensiunilor sunt la stânga hidrogenului, prepararea lor electrolitică din soluții de sare este imposibilă; în acest caz, se formează alcaline și hidrogen corespunzătoare.
hidroxizi
Pentru a obține hidroxizi de metale alcaline, se utilizează în principal metode electrolitice. Cea mai mare scară este producerea de hidroxid de sodiu prin electroliza unei soluții apoase concentrate de clorură de sodiu.
În primul rând, alcalina a fost obținută printr-o reacție de schimb.
Alcaliul obținut în acest mod a fost puternic contaminat cu sodă Na2CO3.
Hidroxizii de metale alcaline sunt substanțe igroscopice albe, a căror soluții apoase sunt baze puternice. Ei participă la toate reacțiile caracteristice bazelor - reacționează cu acizi, oxizi acide și amfoterice, hidroxizi amfoterici.
Când sunt încălzite, hidroxizii de metale alcaline sunt sublimate fără descompunere, cu excepția hidroxidului de litiu, care, la fel ca hidroxizii metalici ai subgrupului principal din grupa II, se descompun într-un oxid și apă la calcinare.
Hidroxidul de sodiu este utilizat pentru a face săpunuri, detergenți sintetici, fibre artificiale, compuși organici, cum ar fi fenolul.
carbonați
Un produs important din metale alcaline este soda Na2CO3. Cea mai mare parte a sifonului din întreaga lume este produsă după metoda Solve, propusă încă de la începutul secolului XX. Esența metodei este următoarea: o soluție apoasă de NaCl, la care se adaugă amoniac, este saturată cu dioxid de carbon la o temperatură de 26 - 30 ° C. În acest caz, se formează bicarbonat de sodiu puțin solubil, numit sodă de copt.
Se adaugă amoniac pentru a neutraliza mediul acid care apare la trecerea dioxidului de carbon în soluție și pentru a produce ionul bicarbonat de HCO3, care este necesar pentru a precipita bicarbonatul de sodiu. După separarea sifonului potabil, soluția care conține clorură de amoniu este încălzită cu var și se eliberează amoniac, care este returnat în zona de reacție.
Astfel, în metoda amoniacului de a produce sodă, singura deșeuri este clorura de calciu care rămâne în soluție și are o utilizare limitată.
Calcinarea, sau spălarea, sodă Na2CO3 și dioxid de carbon, utilizate în procesul de producere a bicarbonatului de sodiu, se obțin prin calcinarea bicarbonatului de sodiu.
Principalul cumpărător de sodă este sticla.
Spre deosebire de sare acidă ușor solubilă de NaHCO3, carbonatul de hidrogen de potasiu KHCO3 este foarte solubil în apă, prin urmare, carbonatul de potasiu, sau potasa, K2CO3 este produs prin acțiunea dioxidului de carbon asupra unei soluții de hidroxid de potasiu.
Potasa este folosită la fabricarea sticlei și a săpunului lichid.
Litiu este singurul metal alcalin pentru care nu a fost obținut hidrocarbonat. Motivul acestui fenomen este raza foarte mică a ionului de litiu, care nu îi permite să dețină un ion destul de mare HCO3-.
litiu
Metalul este
Litiu - element al subgrupului principal al primului grup, a doua perioadă a sistemului periodic al elementelor chimice D. I. Mendeleev Dmitri Ivanovici, cu număr atomic 3. Este desemnat de simbolul Li (lat. litiu). Substanța simplă litiu (număr CAS: 7439-93-2) este un metal alcalin moale de culoare alb-argintiu.
Litiu a fost descoperit în 1817 de chimistul și mineralogul suedez A. Arfvedson, mai întâi în petalita minerală (Li, Na), apoi în spodumenul LiAl și în lepidolitul KLi1.5Al1.5 (F, OH) 2. Humphrey Davy a primit pentru prima dată metal litiu în 1825.
Litiu și-a primit numele datorită faptului că a fost găsit în „pietre” (greacă. Σος - piatră). Denumită inițial „lition”, numele modern a fost propus de Berzelius.
Litiu este un metal alb-argintiu, moale și ductil, mai greu decât sodiul, dar mai moale decât plumbul. Poate fi prelucrat prin presare și rulare.
La temperatura camerei, metalul litiu are o rețea cubică centrată pe corp (numărul de coordonare 8), care, atunci când a lucrat la rece, se transformă într-o zăbrelă cubică aproape închisă, unde fiecare atom având coordonarea cuboctedrică dublă este înconjurat de alți 12. Sub 78 K, o formă cristalină stabilă este o structură hexagonală închisă în care fiecare atom de litiu are 12 vecini cei mai apropiați situați la vârfurile cuboctaedrului.
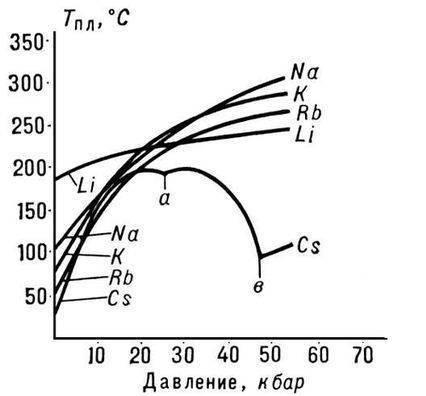
Dintre toate metalele alcaline, litiu este caracterizat prin cele mai mari puncte de topire și fierbere (180,54 și, respectiv, 1340 ° C), are cea mai mică densitate la temperatura camerei dintre toate metalele (0,533 g / cm2, aproape jumătate din densitatea apei).
Dimensiunea mică a atomului de litiu duce la apariția proprietăților speciale ale metalului. De exemplu, se amestecă cu sodiu doar la temperaturi sub 380 ° C și nu se amestecă cu potasiu topit, rubidiu și cesiu, în timp ce alte perechi de metale alcaline se amestecă între ele în orice proporție.
Metal alcalin, instabil în aer. Litiu este cel mai puțin activ metal alcalin, practic nu reacționează cu aerul uscat (și chiar cu oxigenul uscat) la temperatura camerei.
În aerul umed, acesta se oxidează încet, transformându-se în azotură de Li3N, hidroxid de LiOH și carbonat de Li2CO3. Când este încălzit în oxigen, acesta arde, transformându-se în oxid de Li2O. Există o caracteristică interesantă că, în intervalul de temperatură de la 100 ° C la 300 ° C, litiu este acoperit cu o peliculă densă de oxid și nu se oxidează în viitor.
În 1818, chimistul german Leopold Gmelin a stabilit că litiul și sărurile sale colorează flacăra roșie carmină, care este un semn calitativ pentru determinarea litiului. Temperatura de aprindere este de aproximativ 300 ° C. Produsele de ardere irită membrana mucoasă a nazofaringelui.
Liniștit, fără explozie și foc, reacționează cu apa, formând LiOH și H2. De asemenea, reacționează cu alcoolul etilic, formând un alcoolat, cu amoniac și cu halogeni (cu iod - numai atunci când este încălzit).
Litiu este păstrat în eter de petrol, parafină, benzină și / sau ulei mineral în cutii de staniu închise ermetic. Metalul cu litiu provoacă arsuri pe piele, mucoase și ochi.
În metalele feroase și neferoase, litiu este utilizat pentru a deoxida și a crește ductilitatea și rezistența aliajelor. Litiu este uneori utilizat pentru recuperarea metalelor rare prin metode metalotermie.
Carbonatul de litiu este cea mai importantă substanță auxiliară (adăugată la electrolit) în topirea aluminiului, iar consumul său crește în fiecare an proporțional cu volumul producției globale de aluminiu (consum de carbonat de litiu 2,5-3,5 kg pe tonă de aluminiu turnat).
Aliajele de litiu cu argint și aur, precum și cuprum, sunt niște lipitori foarte eficienți. Aliajele de litiu cu magneziu, scandiu, cuprum, cadmiu și aluminiu sunt noi materiale promițătoare în aviație și astronautică. Pe baza de aluminat și silicat de litiu, s-au creat ceramice care s-au întărit la temperatura camerei și au fost utilizate în echipamente militare, metalurgie și, în viitor, în energie termonucleară. Sticla are la bază litiu-aluminiu-silicat armat cu fibre de carbură de siliciu. Litiu întărește foarte eficient aliajele de plumb și le conferă ductilitate și rezistență la coroziune.
Sărurile de litiu au un efect psihotrop și sunt utilizate în medicină pentru prevenirea și tratarea mai multor boli mintale. Cel mai frecvent în această capacitate este carbonatul de litiu. utilizat în psihiatrie pentru stabilizarea stării de spirit a persoanelor care suferă de tulburare bipolară și modificări frecvente ale dispoziției. Este eficient în prevenirea maniei pentru depresie și reduce sinuciderea.Medicii au observat în mod repetat că anumiți compuși de litiu (în doze adecvate, desigur) au un efect pozitiv asupra pacienților care suferă de depresie maniacală. Acest efect este explicat în două moduri. Pe de o parte, s-a constatat că litiu este capabil să regleze activitatea anumitor enzime implicate în transferul ionilor de sodiu și potasiu din fluidul extracelular în celulele creierului. Pe de altă parte, s-a observat că ionii de litiu afectează în mod direct echilibrul ionic al celulei. Și starea pacientului depinde în mare măsură de echilibrul de sodiu și potasiu: un exces de sodiu în celule este caracteristic pacienților cu depresie, lipsa acestuia este pentru suferința de manie. Alinând echilibrul de potasiu de sodiu, sărurile de litiu au un efect pozitiv asupra celor și altora.
sodiu
Metalul este
Sodiu - element al subgrupului principal al primului grup, al treilea perioadă sistem periodic de elemente chimice D. I. Dmitri Ivanovici Mendeleev, cu număr atomic 11. Este desemnat prin simbolul Na (lat. Natrium). Substanța simplă este sodiul (numărul CAS: 7440-23-5) - un metal alcalin moale de culoare alb-argintiu.
În apă, sodiul se comportă la fel ca litiu: reacția continuă cu evoluția rapidă a hidrogenului și în soluție se formează hidroxid de sodiu.
Sodiu (sau mai bine zis, compușii săi) a fost folosit încă din cele mai vechi timpuri. De exemplu, soda (natron), care se găsește în mod natural în apele lacurilor de sodă din Egipt. Egiptenii antici foloseau sodă naturală pentru îmbălsămare, albire pânză, gătit mâncare, confecționarea vopselelor și glazurilor. Pliniu cel Bătrân scrie că în soda Deltei Nilului (exista o proporție suficientă de impurități în ea) era izolată de apa râului. A ieșit la vânzare sub formă de piese mari, din cauza unei amestecuri de cărbune vopsit în gri sau chiar negru.
Sodiu a fost obținut pentru prima dată de chimistul englez Humphrey Davy în 1807 prin electroliza NaOH solid.
Denumirea "sodiu" (natrium) provine de la arabul natron (în greacă - nitron) și inițial se referă la sodă naturală. Elementul însuși a fost numit anterior sodiu (lat. Sodiu).

Sodiul este un metal alb-argintiu, în straturi subțiri cu o nuanță violetă, este din plastic, chiar moale (ușor tăiat cu un cuțit), o felie proaspătă de sclipici de sodiu. Conductivitatea electrică și conductivitatea termică a sodiului sunt destul de mari, densitatea este de 0,96842 g / cm2 (la 19,7 ° C), punctul de topire este de 97,86 ° C, iar punctul de fierbere este de 883,15 ° C.
Metalul alcalin în aer este oxidat cu ușurință. Pentru a proteja împotriva oxigenului, sodiul metalic este păstrat sub un strat petrol lampant. Sodiu este mai puțin activ decât litiu, prin urmare, reacționează cu azot doar atunci când este încălzit:
Cu un exces mare de oxigen, se formează peroxid de sodiu
2Na + O2 \u003d Na2O2
Sodium metal este utilizat pe scară largă în chimia pregătitoare și industrie ca agent de reducere puternic, inclusiv în metalurgie. Sodiu este utilizat în producția de baterii cu sulf de sodiu cu un consum mare de energie. De asemenea, este utilizat în robinetele de evacuare a camionului ca radiator. Ocazional, sodiul metalic este folosit ca material pentru firele electrice destinate curenților foarte mari.
Într-un aliaj cu potasiu, precum și cu rubidiu și cesiu, este utilizat ca mediu de transfer de căldură extrem de eficient. În special, un aliaj cu o compoziție de sodiu 12%, potasiu 47%, cesiu 41% are un punct de topire scăzut de -78 ° C și a fost propus ca fluid de lucru pentru motoarele cu rachete ionice și un agent de răcire pentru centralele nucleare.
Sodiu este de asemenea utilizat în lămpile cu descărcare de înaltă și joasă presiune (NLVD și NLND). Lămpile NLVD de tip DNaT (Arc Sodium Tubular) sunt foarte utilizate pe scară largă în iluminatul stradal. Ele dau o lumină galbenă strălucitoare. Durata de viață a lămpilor DNaT este de 12-24 mii de ore. Prin urmare, lămpile de descărcare de tip DNaT sunt indispensabile pentru iluminatul urban, arhitectural și industrial. Există, de asemenea, lămpi DNaS, DNaMT (Arc Sodium Matte), DNaZ (Arc Sodium Mirror) și DNaTBR (Arc Sodium Tubular Without Mercury).
Sodium metal este utilizat în analiza calitativă a materiei organice. Aliajul de sodiu și substanța de testat sunt neutralizate cu etanol, se adaugă mai multe mililitri de apă distilată și se împarte în 3 părți, J. Lassenya (1843), care urmărește determinarea azotului, a sulfului și a halogenilor ( test Beilstein)
Clorura de sodiu (sare de masă) este cel mai vechi agent de aromatizare și conservare utilizat.
Azida de sodiu (Na3N) este utilizată ca agent de nitrurare în metalurgie și în producția de azidă de plumb.
Cianura de sodiu (NaCN) este utilizată în metoda hidrometalurgică de scurgere a aurului din roci, precum și în oțel nitrocarburând și în electroplacare (argintare, aurire).
Cloratul de sodiu (NaClO3) este utilizat pentru a distruge vegetația nedorită pe căile ferate.
potasiu
Kaliy - un element al subgrupului principal al primului grup, al patrulea perioadă sistem periodic de elemente chimice D. I. Mendeleev Dmitry Ivanovich, cu număr atomic 19. Este desemnat de simbolul K (lat. Kalium). Substanța simplă este potasiul (număr CAS: 7440-09-7) - un metal alcalin moale de culoare alb-argintiu.
În natură, potasiul se găsește doar în compuși cu alte elemente, de exemplu, în apa de mare, precum și în multe minerale. Se oxidează foarte repede în aer și reacționează foarte ușor chimic, în special cu apa, formând un alcalin. În multe privințe, proprietățile chimice ale potasiului sunt foarte apropiate de sodiu, dar din punct de vedere al funcției biologice și al utilizării acestora de către celulele organismelor vii, ele sunt încă diferite.
Potasiul (mai precis, compușii săi) a fost folosit încă din cele mai vechi timpuri. Deci, producția de potasă (care era folosită ca detergent) a existat deja în secolul al XI-lea. Cenușa formată în timpul arderii paiului sau a lemnului a fost tratată cu apă, iar soluția rezultată (lichior) a fost evaporată după filtrare. Reziduul uscat, pe lângă carbonatul de potasiu, conținea sulfat de potasiu K2SO4, sodă și clorură de potasiu KCl.
În 1807, un chimist englez, Davy, a izolat potasiul prin electroliza potasiului caustic solid (KOH) și l-a numit „potasiu” (potasiu latin; acest nume este încă utilizat în engleză, franceză, spaniolă, portugheză și poloneză). În 1809, L.V. Gilbert a propus denumirea de "potasiu" (lat. Kalium, din araba al-kali - potasiu). Acest nume a intrat în limba germană, iar de acolo în majoritatea limbilor din Europa de Nord și de Est (inclusiv rusă) și „câștigat” atunci când aleg un simbol pentru acest element - K.
Potasiul este o substanță argintie cu un luciu caracteristic pe o suprafață proaspăt formată. Foarte ușor și fuzibil. Se dizolvă relativ bine în mercur, formând amalgame. Fiind introdus în flacăra unui arzător, potasiul (precum și compușii săi) colorează flacăra într-o culoare roz-violet caracteristică.
Potasiul, ca și alte metale alcaline, prezintă proprietăți metalice tipice și este foarte activ din punct de vedere chimic, emană cu ușurință electroni.
Este un agent de reducere puternic. Se combină atât de activ cu oxigenul încât nu formează oxid, ci superoxid de potasiu KO2 (sau K2O4). Când este încălzit într-o atmosferă cu hidrogen, se formează hidrură de potasiu KH. Acesta interacționează bine cu toate nemetalele, formând halogenuri, sulfuri, nitride, fosfide etc., precum și cu substanțe complexe precum apa (reacția are loc cu o explozie), diferiți oxizi și săruri. În acest caz, reduc alte metale în stare liberă.
Potasiul este depozitat sub un strat de kerosen.
Un lichid la temperatura camerei de potasiu și sodiu este utilizat ca lichid de răcire în sistemele închise, de exemplu, în centralele atomice cu neutroni rapide. În plus, aliajele sale lichide cu rubidiu și cesiu sunt utilizate pe scară largă. Compoziția aliajului de sodiu este 12%, potasiu 47%, cesiu 41% are un punct de topire scăzut -78 ° C.
Compușii de potasiu sunt cei mai importanți nutrienți și de aceea sunt folosiți ca îngrășăminte.
Sărurile de potasiu sunt utilizate pe scară largă în electroplare, deoarece, în ciuda costului relativ ridicat, sunt adesea mai solubile decât sărurile de sodiu corespunzătoare și, prin urmare, asigură funcționarea intensivă a electroliților la densități mari de curent.
Potasiul este un nutrient esențial, mai ales în lumea plantelor. Cu o lipsă de potasiu în sol, plantele se dezvoltă foarte slab și scad, astfel că aproximativ 90% din sărurile de potasiu extrase sunt utilizate ca îngrășăminte.
Potasiul, împreună cu azotul și fosforul, sunt printre elementele principale ale nutriției plantelor. Funcția potasiului în plante, precum și alte elemente necesare pentru acestea, sunt strict specifice. La plante, potasiul este sub formă ionică. Potasiul se găsește în principal în citoplasmă și vacuole ale celulelor. Aproximativ 80% din potasiu se află în seva celulelor.
Funcțiile potasiului sunt foarte diverse. S-a constatat că stimulează cursul normal al fotosintezei, îmbunătățește fluxul de carbohidrați de la lamele frunzelor către alte organe, precum și sinteza zaharurilor.
Potasiul îmbunătățește acumularea de monosacharide în culturile de fructe și legume, crește conținutul de zahăr în culturile de rădăcini, amidonul în cartofi, îngroașă pereții celulari de paie din culturile de cereale și crește rezistența pâinii la adăpost și îmbunătățește calitatea fibrelor din in și cânepă.
Contribuind la acumularea de carbohidrați în celulele plantelor, potasiul mărește presiunea osmotică a sucului de celule și crește astfel rezistența la frig și rezistența la îngheț a plantelor.
Potasiul este absorbit de plante sub formă de cationi și, evident, rămâne în această formă în celule, activând cele mai importante biochimice procesele în celulele plantelor, potasiul își mărește rezistența la diferite boli, atât în \u200b\u200bperioada de creștere, cât și în perioada de după recoltare, îmbunătățește semnificativ calitatea păstrării fructelor și legumelor.
Deficiența de potasiu provoacă multe tulburări metabolice la plante, activitatea unui număr de enzime este slăbită, metabolismul de carbohidrați și proteine \u200b\u200bsunt perturbate și cheltuieli carbohidrați pentru respirație. Drept urmare, productivitatea plantelor scade, calitatea produselor scade.



rubidiu
Rubidiul este un element al subgrupului principal al primului grup, a cincea perioadă a sistemului periodic al elementelor chimice ale DI Dmitry Ivanovich Mendeleev, cu numărul atomic 37. Este desemnat de simbolul Rb (lat. Rubidium). Substanța simplă este rubidiul (număr CAS: 7440-17-7) - un metal alcalin moale de culoare alb-argintiu.
În 1861, oamenii de știință germani Robert Wilhelm Bunsen și Gustav Robert Kirchhoff, studiind aluminosilicații naturali folosind analiza spectrală, au descoperit un element nou în ele, numit ulterior rubidiu prin culoarea celor mai puternice linii ale spectrului.
Rubidiul formează cristale moi de culoare alb argintiu, care au o strălucire metalică pe o tăietură proaspătă. Duritate Brinell 0,2 Mn / mІ (0,02 kgf / mm2). Sticla de cristal Rubidium este centrată în volum cubic, а \u003d 5,71 Е (la temperatura camerei). Raza atomică este 2,48 E, raza ionului este Rb + 1,49 E. Densitatea este de 1,525 g / cm2 (0 ° C), mp 38,9 ° C, mp 703 ° C. Căldura specifică este de 335,2 j / (kg · K), coeficientul termic de expansiune liniară este de 9,0 · 10-5 deg-1 (0-38 ° С), modulul elastic este de 2,4 GN / m² (240 kgf / mm²), rezistivitate electrică specifică volumului 11,29 · 10-6 ohm · cm (20 ° C); rubidiul este paramagnetic.
Metal alcalin, extrem de instabil în aer (reacționează cu aerul în prezența urmelor de apă cu aprinderea). Formează toate tipurile de săruri - mai ales solubile (clorații și percloratele sunt ușor solubile). Hidroxidul de rubidiu este o substanță foarte agresivă pentru sticlă și alte materiale structurale și pentru containere, iar topita distruge majoritatea metalelor (chiar și platina).
Utilizarea rubidiului este diversă și, în ciuda faptului că într-o serie de domenii de aplicare ale acesteia este inferioară cesiumului în cele mai importante caracteristici fizice, cu toate acestea, acest metal alcalin rar joacă un rol important în tehnologiile moderne. Următoarele aplicații ale rubidiului pot fi notate: cataliză, electronică industrie, optică specială, atomică, medicină.
Rubidiul este utilizat nu numai în forma sa pură, ci și sub forma unui număr de aliaje și compuși chimici. Este important de menționat că rubidiul are o bază de materii prime foarte bună și favorabilă, însă situația cu disponibilitatea resurselor este mult mai favorabilă decât în \u200b\u200bcazul cesiului și rubidiul poate juca un rol și mai important, de exemplu, în cataliză (unde s-a dovedit cu succes).
Izotopul rubidium-86 este utilizat pe scară largă în inspecția cu raze gamma, echipamente de măsurare, precum și în sterilizarea unui număr de medicamente și produse alimentare importante. Rubidiumul și aliajele sale cu cesiu sunt un mediu de răcire și de lucru foarte promițător pentru unitățile de turbină cu temperatură ridicată (în acest sens, rubidiul și cesiul au devenit importante în ultimii ani, iar costul extrem de ridicat al metalelor este retrogradat în raport cu posibilitățile de a crește brusc eficiența unităților de turbină, ceea ce înseamnă și mai jos cheltuieli combustibil și poluarea mediului). Cele mai utilizate sisteme pe bază de rubidiu ca purtători de căldură sunt aliajele ternare: sodiu-potasiu-rubidiu și sodiu-rubidiu-cesiu.
În cataliză, rubidiul este utilizat atât în \u200b\u200bsinteza organică cât și în cea organică. Activitatea catalitică a rubidiului este utilizată în principal pentru rafinarea unui număr de produse importante. Acetatul de rubidiu, de exemplu, este utilizat pentru a sintetiza metanolul și o serie de alcooli mai mari din gazele de apă, care la rândul său este extrem de important în legătură cu gazificarea subterană a cărbunelui și cu producerea de combustibil lichid artificial pentru mașini și combustibil cu jet. O serie de aliaje de rubidiu cu telur au o sensibilitate mai mare în regiunea ultravioletă a spectrului decât compușii de cesiu și, în această privință, este capabil în acest caz să concureze cu cesiu-133 ca material pentru fotoconvertoare. Ca parte a compozițiilor speciale de lubrifiere (aliaje), rubidiul este utilizat ca un lubrifiant extrem de eficient în vid (tehnologie rachetă și spațiu).
Hidroxidul de rubidiu este utilizat pentru prepararea electrolitului pentru ChIT la temperatură scăzută, precum și ca aditiv la o soluție de hidroxid de potasiu pentru a îmbunătăți performanțele sale la temperaturi scăzute și a crește conductivitatea electrolitului. În celulele cu combustibil cu hidrură, se folosește rubidiul metalic.
Clorura de rubidiu dintr-un aliaj cu clorură de cuprum este utilizată pentru măsurarea temperaturilor ridicate (până la 400 ° C).
Plasmul Rubidium este utilizat pentru a excita radiațiile laser.
Clorura de rubidiu este folosită ca electrolit în celulele combustibile, același lucru se poate spune și pentru hidroxidul de rubidiu, care este foarte eficient ca un electrolit în celulele de combustibil, folosind oxidarea directă a cărbunelui.
cesiu
Cesiul este un element al subgrupului principal al primului grup, a șasea perioadă a sistemului periodic al elementelor chimice ale DI Mendeleev Dmitry Ivanovich, cu numărul atomic 55. Este desemnat de simbolul Cs (lat. Cesium). Substanța simplă este cesiu (număr CAS: 7440-46-2) - un metal alcalin moale de culoare galben-argintiu. Cesium și-a primit numele pentru prezența a două linii albastre strălucitoare în spectrul emisiilor (din lat. Caesius - albastru deschis).
Cesium a fost descoperit în 1860 de oamenii de știință germani R. V. Bunsen și G. R. Kirchhoff în apele izvorului mineral Dürhheim din Republica Germania prin spectroscopie optică, devenind astfel primul element descoperit prin analiza spectrală. În forma sa pură, cesiul a fost izolat pentru prima dată în 1882 de chimistul suedez K. Setterberg în timpul electrolizei unei topituri dintr-un amestec de cianură de cesiu (CsCN) și bariu.
Principalele minerale de cesiu sunt polucitul și avogadritul foarte rar (K, Cs). În plus, sub formă de impurități, cesiul este inclus într-o serie de aluminosilicați: lepidolit, phlogopite, biotit, amazonit, petalit, beril, cinabdită, leucită, carnalită. Ca materii prime industriale se utilizează polucitul și lepidolitul.
În producția industrială de cesiu sub formă de compuși, este extras din poluitul mineral. Aceasta se realizează prin deschiderea clorurii sau sulfatului. Prima implică tratarea mineralului de pornire cu acid clorhidric încălzit, adăugarea de clorură de antimoniu SbCl3 pentru a precipita compusul Cs3 și spălarea cu apă caldă sau soluție de amoniac pentru a forma clorură de cesiu CsCl. În al doilea caz, este tratat cu acid sulfuric încălzit pentru a forma CsAl (SO4) 2 · 12H2O alumiu de cesiu.
În Federația Rusă, după prăbușirea URSS, nu a fost realizată producția industrială de jumătate de lucit, deși au fost descoperite rezerve de minerale colosale în tundra Voronoi de lângă Murmansk în vremea sovietică. Până când industria rusă a reușit să se pună pe picioare, s-a dovedit că licența canadiană a dobândit o licență pentru dezvoltarea acestui domeniu. În prezent, prelucrarea și extragerea sărurilor de cesiu din polucită se efectuează la Novosibirsk la Uzina de metale rare ZAO.
Există mai multe metode de laborator pentru producerea de cesiu. Se poate obține:
încălzirea la vid a unui amestec de crom sau dicromat de cesiu cu zirconiu;
descompunerea azidei de cesiu în vid;
încălzirea unui amestec de clorură de cesiu și calciu special preparat.
Toate metodele consumă timp. Al doilea vă permite să obțineți metal de înaltă puritate, dar este exploziv și necesită implementare timp de câteva zile.
Cesium a găsit aplicație abia la începutul secolului XX, când mineralele sale au fost descoperite și tehnologia de producere a acesteia în formă pură a fost dezvoltată. În prezent, cesiul și compușii săi sunt folosiți în electronice, radio, electro, raze X, industria chimică, optică, medicină, energie nucleară. Se folosește cel mai stabil stabil cesiu-133 natural și, într-o măsură limitată, izotopul său radioactiv cesiu-137, extras din suma fragmentelor de fisiune de uraniu, plutoniu, toriu în reactoarele centralelor nucleare.
Metale alcaline pământești
Metalele alcaline de pământ sunt elemente chimice: calciu Ca, stronțiu Sr, bariu Ba, radiu Ra (uneori beriliu Be și magneziu Mg sunt, de asemenea, greșit denumite metale alcaline de pământ). Acestea sunt numite astfel, deoarece oxizii lor - „pământuri” (în terminologia alchimistilor) - transmit o reacție alcalină în apă. Sărurile metalelor alcaline de pământ, cu excepția radiumului, sunt distribuite pe larg în natură sub formă de minerale.
calciu
Calciul este un element al subgrupului principal al celui de-al doilea grup, a patra perioadă a sistemului periodic al elementelor chimice ale DI Dmitry Ivanovich Mendeleev, cu număr atomic 20. Este desemnat de simbolul Ca (lat. Calciu). Substanța simplă de calciu (număr CAS: 7440-70-2) este un metal alcalin moale, activ chimic, de culoare alb-argintiu.
Metalul de calciu există în două modificări alotrope. Până la 443 ° C, α-Ca este stabilă cu o rețea cubică centrată pe față (parametrul a \u003d 0,55 nm), β-Ca este stabilă cu o rețea cubică centrată pe corp, de tip α-Fe (parametrul a \u003d 0,448 nm). Entalpia standard ΔH0 a tranziției α → β este 0,93 kJ / mol.
Calciul este un metal alcalin de pământ tipic. Reactivitatea calciului este ridicată, dar mai mică decât toate celelalte metale alcaline. Acesta interacționează cu ușurință cu oxigenul, dioxidul de carbon și umiditatea aerului, motiv pentru care suprafața metalului de calciu este de obicei cenușie, de aceea calciul este de obicei depozitat într-un laborator, ca și alte metale alcaline, într-un borcan bine închis sub un strat de kerosen sau parafină lichidă.
Printre potențialele standard, calciul este situat la stânga hidrogenului. Potențialul standard al electrodului unei perechi de Ca2 + / Ca0 este 2,84 V, astfel încât calciul reacționează activ cu apa, dar fără aprindere:
Ca + 2H2O \u003d Ca (OH) 2 + H2 + Q.
Cu non-metale active (oxigen, clor, brom), calciul reacționează în condiții normale:
2Ca + O2 \u003d 2CaO, Ca + Br2 \u003d CaBr2.
Când este încălzit în aer sau în oxigen, calciul se aprinde. Cu non-metale mai puțin active (hidrogen, bor, carbon, siliciu, azot, fosfor și altele), calciul interacționează atunci când este încălzit, de exemplu:
Ca + H2 \u003d CaH2, Ca + 6B \u003d CaB6,
3Ca + N2 \u003d Ca3N2, Ca + 2C \u003d CaC2,
3Ca + 2P \u003d Ca3P2 (fosfură de calciu); fosfurile de calciu ale compozițiilor CaP și CaP5 sunt de asemenea cunoscute;
2Ca + Si \u003d Ca2Si (silicida de calciu); silicizii de calciu din compozițiile CaSi, Ca3Si4 și CaSi2 sunt de asemenea cunoscuți.
Cursul reacțiilor de mai sus este de obicei însoțit de eliberarea unei cantități mari de căldură (adică aceste reacții sunt exoterme). În toți compușii cu nemetale, starea de oxidare a calciului este +2. Majoritatea compușilor de calciu cu non-metale sunt ușor descompuse de apă, de exemplu:
CaH2 + 2H2O \u003d Ca (OH) 2 + 2H2,
Ca3N2 + 3H2O \u003d 3Ca (OH) 2 + 2NH3.
Ionul Ca2 + este incolor. Când sărurile de calciu solubile sunt introduse în flacără, flacăra devine roșie cărămidă.
Sărurile de calciu cum ar fi clorura de CaCl2, bromura de CaBr2, iodura de CaI2 și nitratul de Ca (NO3) 2 sunt ușor solubile în apă. Fluorura de CaF2 insolubilă în apă, carbonatul de CaCO3, sulfatul de CaSO4, ortofosfatul Ca3 (PO4) 2, oxalatul de CaC2O4 și alții.
Important este faptul că, spre deosebire de carbonatul de calciu CaCO3, carbonatul acid de calciu (bicarbonat) Ca (HCO3) 2 este solubil în apă. În natură, acest lucru duce la următoarele procese. Când ploaia rece sau apa de râu, saturată cu dioxid de carbon, pătrunde în subteran și intră în calcare, se observă dizolvarea lor:
CaCO3 + CO2 + H2O \u003d Ca (HCO3) 2.
În aceleași locuri în care apa saturată cu bicarbonat de calciu iese la suprafața pământului și este încălzită de soare, are loc reacția inversă:
Ca (HCO3) 2 \u003d CaCO3 + CO2 + H2O.
Deci în natură are loc un transfer de mase mari de substanțe. Drept urmare, în subteran se pot forma goluri uriașe, iar frumoase „icicle” de piatră - stalactite și stalagmite - se formează în peșteri.
Prezența bicarbonatului de calciu dizolvat în apă determină în mare măsură duritatea temporară a apei. Se numește temporar, deoarece atunci când apa este fiartă, hidrocarbonatul se descompune și CaCO3 precipită. Acest fenomen, de exemplu, duce la formarea scării în ceainic în timp.
stronțiu
Strontium - element al subgrupului principal al celui de-al doilea grup, a cincea perioadă a sistemului periodic al elementelor chimice D. I. Mendeleev Dmitry Ivanovich, cu număr atomic 38. Este desemnat de simbolul Sr (lat. Strontium). Substanța simplă a strontiului (număr CAS: 7440-24-6) este un metal alcalin moale, maleabil și ductil, de culoare alb-argintiu. Are activitate chimică ridicată, reacționează rapid cu umiditatea și oxigenul din aer, devenind acoperit cu o peliculă de oxid galben.
Un element nou a fost găsit în strontianita minerală, găsită în 1764 într-o mină de plumb din apropierea satului scoțian Stronshian, care ulterior a dat numele noului element. Prezența de oxid de metal nou în acest mineral a fost stabilită aproape 30 de ani mai târziu de William Kruykshenk și Ader Crawford. Alocat în formă pură de Sir Humphrey Davy în 1808.
Strontium - un metal moale, alb-argintiu, are ductilitate și ductilitate, este ușor tăiat cu un cuțit.
Polimorf - trei dintre modificările sale sunt cunoscute. Până la 215 ° C, o modificare centrată pe față (α-Sr) este stabilă, între 215 și 605 ° C - hexagonal (β-Sr), peste 605 ° C - o modificare centrată în volum cub (γ-Sr).
Punct de topire - 768 ° C, Punct de fierbere - 1390 ° C.
Strontiul prezintă întotdeauna o valență +2 în compușii săi. Prin proprietățile sale, strontiul este aproape de calciu și bariu, ocupând o poziție intermediară între ele.
În seria electrochimică de eforturi, strontiul este printre cele mai active metale (potențialul său normal de electrod este de -2,89 V. Reacționează energetic cu apa pentru a forma hidroxid:
Sr + 2H2O \u003d Sr (OH) 2 + H2
Acesta interacționează cu acizii, deplasează metalele grele din sărurile lor. Cu acizii concentrați (H2SO4, HNO3) reacționează slab.
Stronțiul metalic se oxidează rapid în aer, formând o peliculă gălbui în care, pe lângă oxidul SrO, peroxidul SrO2 și nitrura Sr3N2 sunt întotdeauna prezente. Când este încălzit în aer, se aprinde; stronțiu pudră în aer este predispus la autoaprindere.
Reacționează viguros cu nemetalele - sulf, fosfor, halogeni. Acesta interacționează cu hidrogenul (peste 200 ° C), azotul (peste 400 ° C). Practic nu reacționează cu alcaline.
La temperaturi ridicate, reacționează cu CO2 pentru a forma carbură:
5Sr + 2CO2 \u003d SrC2 + 4SrO
Săruri ușor solubile de stronțiu cu anioni Cl-, I-, NO3-. Sărurile cu anioni F-, SO42-, CO32-, PO43- sunt ușor solubile.
Strontiumul este utilizat pentru alierea cuprumului și a unor aliaje ale acestuia, pentru introducerea în aliaje de plumb a bateriei, pentru desulfurarea fontelor, cuprumului și oţeluri.
bariu
Bariul este un element al subgrupului principal al celui de-al doilea grup, a șasea perioadă a sistemului periodic al elementelor chimice ale DI Dmitry Ivanovici Mendeleev, cu numărul atomic 56. Este desemnat de simbolul Ba (lat. Barium). Substanța simplă este bariul (număr CAS: 7440-39-3) - un metal alcalin moale, maleabil, de culoare alb-argintiu. Are o activitate chimică ridicată.
Barium a fost descoperit ca oxid de BaO în 1774 de Karl Scheele. În 1808, chimistul englez Humphrey Davy a obținut prin electroliza hidroxidului de bariu umed cu un catod de mercur amalgam bariu; După evaporarea mercurului, el a izolat bariul metalic la încălzire.
Bariul este un metal maleabil alb-argintiu. Când o lovitură ascuțită se rupe. Există două modificări alotrope ale bariului: până la 375 ° C, α-Ba este stabilă cu o grilă centrată pe corp (parametrul a \u003d 0,501 nm), iar β-Ba este mai stabilă.
Duritate la o scară mineralogică de 1,25; pe scara 2 a Mohs.
Bariul metalic este depozitat în kerosen sau sub un strat de parafină.
Bariul este un metal alcalin de pământ. Este oxidat intens în aer, formând oxid de bariu BaO și azot de bariu Ba3N2 și se aprinde cu o încălzire ușoară. Reacționează viguros cu apa pentru a forma hidroxidul de bariu Ba (OH) 2:
Ba + 2H2O \u003d Ba (OH) 2 + H2
Interactioneaza activ cu acizii diluati. Multe săruri de bariu sunt insolubile sau ușor solubile în apă: sulfat de bariu BaSO4, sulfat de bariu BaSO3, carbonat de bariu BaCO3, fosfat de bariu Ba3 (PO4) 2. Sulfura de bariu BaS, spre deosebire de sulfura de calciu CaS, este foarte solubilă în apă.
Reacționează ușor cu halogenii pentru a forma halogenuri.
Când este încălzit cu hidrogen, formează hidrura de bariu BaH2, care la rândul său cu hidrura de litiu LiH dă complexul Li.
Reacționează atunci când este încălzit cu amoniac:
6Ba + 2NH3 \u003d 3BaH2 + Ba3N2
Nitrura de bariu Ba3N2, atunci când este încălzită, interacționează cu CO, formând cianură:
Ba3N2 + 2CO \u003d Ba (CN) 2 + 2BaO
Cu amoniacul lichid, oferă o soluție albastru închis din care poate fi izolat amoniacul, care are un strălucire auriu și se descompune ușor odată cu îndepărtarea NH3. În prezența unui catalizator de platină, amoniacul se descompune formând amidă de bariu:
Ba (NH2) 2 + 4NH3 + H2
Carburul de bariu BaC2 poate fi obținut prin încălzirea într-un cuptor cu cărbune BaO.
Formează fosfor Ba3P2 cu fosfor.
Bariul reduce oxizii, halogenele și sulfurile multor metale la metalul corespunzător.
Metalul de bariu, adesea în aliaj cu aluminiu, este utilizat ca gât (getter) în dispozitivele electronice cu vid ridicat și este adăugat, de asemenea, împreună cu zirconiu, la lichidele de răcire a metalelor lichide (sodiu, potasiu, rubidiu, litiu, aliaje de cesiu) pentru a reduce agresivitatea la conducte și în metalurgie.
Metale de tranziție
Metalele de tranziție (elemente de tranziție) sunt elemente ale subgrupurilor laterale ale Tabelului periodic al elementelor chimice ale lui D. I. Mendeleev Dmitry Ivanovich, în atomii cărora apar electroni pe orbitalele d și f. În termeni generali, structura electronică a elementelor de tranziție poate fi reprezentată după cum urmează:. Orbitalele ns conțin unul sau doi electroni; electronii de valență rămași sunt localizați pe orbitali. Deoarece numărul de electroni de valență este vizibil mai mic decât numărul de orbitali, substanțele simple formate din elemente de tranziție sunt metale.
Caracteristici generale ale elementelor de tranziție
Toate elementele de tranziție au următoarele proprietăți comune:
Valori mici ale electronegativității.
Stări de oxidare variabile. Pentru aproape toate elementele d, în atomii cărora există 2 electroni de valență pe subnivelul ns extern, starea de oxidare +2 este cunoscută.
Pornind de la elementele d ale grupului III din Tabelul periodic al elementelor chimice din D. I. Dmitri Ivanovici Mendeleev, elementele din starea de oxidare inferioară formează compuși care prezintă proprietăți de bază, în cel mai înalt - acid, în intermediar - amfoteric
fier
Fierul este un element al unui subgrup grup lateral din grupa a opta a celei de-a patra perioade a sistemului periodic al elementelor chimice ale DI Mendeleev Dmitry Ivanovici, număr atomic 26. Este desemnat prin simbolul Fe (lat. Ferrum). Unul dintre cele mai comune metale din scoarța terestră (locul doi după aluminiu).
Fierul cu substanță simplă (numărul CAS: 7439-89-6) este un metal maleabil alb-argintiu cu o reactivitate chimică ridicată: fierul se corodează rapid la temperaturi ridicate sau cu umiditate ridicată în aer. În oxigen pur, fierul arde și într-o stare fină dispersată se aprinde spontan în aer.
De fapt, fierul se numește de obicei aliajele sale cu un conținut scăzut de impurități (până la 0,8%), care păstrează moliciunea și ductilitatea metalului pur. Dar, în practică, se folosesc mai des aliajele de fier cu carbon: (până la 2% carbon) și (mai mult de 2% carbon), precum și oțel inoxidabil (aliat) cu aditivi de aliere din metal (crom, mangan, Ni, etc.). Combinația de proprietăți specifice ale fierului și aliajele sale face ca „metalul nr. 1” să aibă importanță pentru oameni.
În natură, fierul se găsește rar în forma sa pură, cel mai adesea se găsește în meteoritele de fier-nichel. Prevalența fierului în scoarța terestră este de 4,65% (locul 4 după O, Si, Al). De asemenea, se crede că fierul constituie o mare parte din miezul pământului.




Fierul este un metal tipic, în stare liberă este alb-argintiu cu o nuanță cenușie. Metalul pur este plastic, diferite impurități (în special carbon) își măresc duritatea și fragilitatea. Are proprietăți magnetice pronunțate. Emite adesea așa-numita „triadă a fierului” - un grup de trei metale (fier Fe, cobalt Co, Ni Ni), care au proprietăți fizice similare, razele atomice și valori ale electronegativității.
Fierul este caracterizat prin polimorfism, are patru modificări cristaline:
până la 769 ° C, α-Fe (ferită) există cu o rețea cubică centrată pe corp și proprietățile unui feromagnet (769 ° C ≈ 1043 K - Punctul Curie pentru fier)
În intervalul de temperatură 769-917 ° C, β-Fe există, care diferă de α-Fe doar în parametrii rețelei cubice centrate pe corp și proprietățile magnetice ale paramagnetului
în intervalul de temperatură 917–1394 ° C, există γ-Fe (austenită) cu o rețea cubică centrată pe față
peste 1394 ° C, δ-Fe este stabilă cu o rețea cubică centrată pe volum
Metalurgia nu izolează β-Fe ca o fază separată și o consideră un tip de α-Fe. Când fierul sau oțelul este încălzit deasupra punctului Curie (769 ° C ≈ 1043 K), mișcarea termică a ionilor perturba orientarea momentelor magnetice de rotire a electronilor, feromagnetul devine paramagnet - are loc o tranziție de fază de ordinul doi, dar o tranziție de fază de prim ordin nu se produce cu o modificare a parametrilor fizici de bază ai cristalelor.
Pentru fier pur la presiune normală, din punct de vedere al metalurgiei, există următoarele modificări stabile:
De la zero absolut la 910 ° C, modificarea α cu o rețea de cristal cubică (bcc) centrată pe corp este stabilă. O soluție solidă de carbon în α-fier se numește ferită.
De la 910 până la 1400 ° C, modificarea y cu o rețea de cristal cubică (fcc) centrată pe față este stabilă. O soluție solidă de carbon în γ-fier se numește austenită.
De la 910 la 1539 єC, modificarea with cu o rețea de cristal cubică (bcc) centrată pe corp este stabilă. O soluție solidă de carbon în δ-fier (precum și în α-fier) \u200b\u200bse numește ferită. Uneori, δ-ferrita și α-ferrita de temperatură ridicată (sau doar ferrita) sunt uneori distinse, deși structurile lor atomice sunt aceleași.
Prezența carbonului și a elementelor de aliere în oțel modifică semnificativ temperatura tranzițiilor de fază.
În regiunea presiunilor ridicate (peste 104 MPa, 100 mii atmosfere), apare o modificare a fierului cu o rețea hexagonală închisă (HCP).
Fenomenul polimorfismului este extrem de important pentru metalurgia oțelului. Oțelul este tratat termic datorită tranzițiilor α-γ ale rețelei de cristal. Fără acest fenomen, fierul, ca bază a oțelului, nu ar fi primit o utilizare atât de răspândită.
Fierul este refractar, se referă la metale cu activitate medie. Punctul de topire a fierului este de 1539 ° C, punctul de fierbere este de aproximativ 3200 ° C.
Fierul este unul dintre cele mai utilizate metale, reprezentând până la 95% din producția metalurgică mondială.
Fierul este componenta principală a oțelurilor și a fierului de călcat - cele mai importante materiale structurale.
Fierul poate face parte din aliaje pe bază de alte metale - de exemplu, nichel.
Oxidul magnetic de fier (magnetita) este un material important în producerea dispozitivelor de memorie pe computer pe termen lung: hard disk-uri, dischete etc.
Pulberea de magnetită ultrafină este folosită ca toner în imprimantele laser alb-negru.
Proprietățile feromagnetice unice ale mai multor aliaje pe bază de fier contribuie la utilizarea pe scară largă a acestora în inginerie electrică pentru nucleele magnetice ale transformatoarelor și motoarelor electrice.
Clorura de fier (III) (clorură ferică) este folosită în practica radioamatorilor amatori pentru decaparea plăcilor de circuite imprimate.
Sulfatul feros (sulfat de fier) \u200b\u200bamestecat cu sulfat de cupru este utilizat pentru a controla ciupercile dăunătoare în grădinărit și construcție.
Fierul este folosit ca un anod în bateriile de fier-nichel, baterii de fier-aer.
cupru
Cuprul este un element al subgrupului lateral al primului grup, a patra perioadă a sistemului periodic al elementelor chimice ale DI Dmitry Ivanovich Mendeleev, cu număr atomic 29. Este desemnat de simbolul Cu (lat. Cuprum). Substanța simplă cupru (numărul CAS: 7440-50-8) este un metal de tranziție din plastic cu o culoare roz aurie (culoare roz în absența unei pelicule de oxid). C a fost mult timp utilizat pe scară largă de om.



Cuprul este un metal ductil roz-auriu, acoperit rapid cu o peliculă de oxid în aer, ceea ce îi conferă o nuanță intensă-galben-roșie intensă. Cuprul are o conductivitate termică și electrică ridicată (ocupă locul doi în conductivitatea electrică după argint). Are doi izotopi stabili - 63Cu și 65Cu și mai mulți izotopi radioactivi. Cel mai longeviv dintre ei, 64Cu, are un timp de înjumătățire de 12,7 ore și două opțiuni de descompunere cu diverse produse.
Densitate - 8,94 * 10і kg / ml
Căldură specifică la 20 ° C - 390 J / kg * K
Rezistivitatea electrică la 20-100 ° С - 1,78 · 10–8 Ohm · m
Punctul de topire - 1083 ° C
Punctul de fierbere - 2600 ° C
Există o serie de aliaje de cuprum: alama - un aliaj de cuprum cu zinc, - un aliaj de cuprum cu staniu, cupronickel - un aliaj de cuprum și nichel și altele.
zinc
Zincul este un element al subgrupului lateral al celui de-al doilea grup, a patra perioadă a sistemului periodic al elementelor chimice ale lui DI Mendeleev Dmitry Ivanovici, cu număr atomic 30. Este desemnat de simbolul Zn (lat. Zinkum). O substanță simplă (număr CAS: 7440-66-6) în condiții normale este un metal de tranziție fragilă de culoare albă-albăstrui (se estompează în aer, fiind acoperit cu un strat subțire de oxid de zinc).
În forma sa pură, un metal alb argintiu destul de ductil. Are o grilă hexagonală cu parametrii a \u003d 0,26649 nm, c \u003d 0,49468 nm. Este fragilă la temperatura camerei, atunci când placa este îndoită, se frânează din fricțiunea cristalitelor (de obicei mai puternică decât „strigătul de staniu”). La 100-150 ° C, zincul este plastic. Impuritățile, chiar și cele minore, cresc brusc fragilitatea zincului.
Metal tipic amfoteric. Potențialul standard al electrodului este de -0,76 V, situat într-o serie de potențiale standard până la fier.
În aer, zincul este acoperit cu o peliculă subțire de oxid de ZnO. Cu încălzire puternică, arde cu formarea de oxid de ZnO alb amfoteric:
2Zn + O2 \u003d 2ZnO.
Oxidul de zinc reacționează cu ambele soluții acide:
ZnO + 2HNO3 \u003d Zn (NO3) 2 + H2O
și alcaline:
ZnO + 2NaOH \u003d Na2ZnO2 + H2O,
Zincul cu puritate normală reacționează activ cu soluții acide:
Zn + 2HCl \u003d ZnCl2 + H2,
Zn + H2SO4 (decomp.) \u003d ZnSO4 + H2
și soluții alcaline:
Zn + 2NaOH + 2H2O \u003d Na2 + H2,
formând hidroxizincati. Zincul foarte pur nu reacționează cu soluțiile de acizi și alcaline. Interacțiunea începe cu adăugarea a câteva picături de soluție de sulfat de cupru CuSO4.
Când este încălzit, zincul reacționează cu halogenii pentru a forma halogenuri de ZnHal2. Cu fosforul, zincul formează fosfurile Zn3P2 și ZnP2. Cu sulf și analogii săi - seleniu și telur - diverse calcogenide, ZnS, ZnSe, ZnSe2 și ZnTe.
Zincul nu reacționează direct cu hidrogenul, azotul, carbonul, siliconul și borul. Nitrura de Zn3N2 este obținută prin reacția de zinc cu amoniac la 550-600 ° C.
În soluții apoase, ionii de zinc Zn2 + formează acvomplexe 2+ și 2+.
Zincul metalic pur este folosit pentru restaurarea metalelor nobile minate prin scurgerile subterane (aur, argint). În plus, zincul este folosit pentru a extrage argintul, aurul (și alte metale) din plumb brut sub formă de compuși intermetalici de zinc cu argint și aur (așa-numita „spumă de argint”), care sunt apoi prelucrate prin metode de rafinare convenționale.
Este utilizat pentru a proteja oțelul împotriva coroziunii (galvanizarea suprafețelor care nu sunt supuse la solicitare mecanică sau metalizare - pentru poduri, rezervoare, structuri metalice). De asemenea, este utilizat ca material pentru electrodul negativ în surse de curent chimic, adică în baterii și acumulatori, de exemplu: element mangan-zinc, baterie argint-zinc (EMF 1,85 V, 150 W · h / kg, 650 W · h / dmі, curenți mici de rezistență și de descărcare colosală, element de mercur-zinc (EMF 1,35 V, 135 W · h / kg, 550-650 W · h / dmі), element dioxid sulfat-mercur, element iod-zinc, oxid de cupru celulă galvanică (0,7-1,6 EMF, 84-127 W · h / kg, 410-570 W · h / dm_), element crom-zinc, element zinc-argint-argint nt, baterie nichel-zinc (EMF 1,82 Volt, 95-118 W · h / kg, 230-295 W · h / dmi), element plumb-zinc, baterie zinc-clor, baterie zinc-brom etc.). Rolul zincului în bateriile zinc-aer este foarte important.În ultimii ani, zincul-aer - bateriile pentru calculatoare (laptopuri) au fost dezvoltate intens pe baza sistemului zinc-aer, iar în acest domeniu s-a obținut un succes semnificativ (mai mare decât bateriile cu litiu, capacitatea și resursa sunt mai mici de 3 de asemenea, acest sistem este foarte promițător pentru pornirea motoarelor (baterie de plumb - 55 W · h / kg, zinc-aer - 220-300 W · h / kg) și pentru vehicule electrice (kilometraj de până la 900 km). Incluse în mai multe lipitori pentru a reduce punctul de topire. Zincul este o componentă importantă a aramei. Oxidul de zinc este utilizat pe scară largă în medicină ca agent antiseptic și antiinflamator. Oxidul de zinc este de asemenea utilizat pentru a produce vopsea - oxid de zinc.
Clorura de zinc este un flux important pentru lipirea metalelor și o componentă în fabricarea fibrelor.
Telluridă, selenidă, fosforă, sulfură de zinc sunt semiconductoare utilizate pe scară largă.
Selenura de zinc este utilizată pentru a realiza ochelari optici cu un coeficient de absorbție foarte scăzut în intervalul infraroșu mediu, de exemplu în laserele cu dioxid de carbon.
mercur
Mercurul este un element al unui subgrup grup lateral al celui de-al doilea grup, a șasea perioadă a sistemului periodic al elementelor chimice ale DI Dmitry Ivanovici Mendeleev, cu număr atomic 80. Este desemnat de simbolul Hg (lat. Hydrargyrum). Mercurul cu substanță simplă (numărul CAS: 7439-97-6) este un metal de tranziție, la temperatura camerei este un lichid alb-argintiu, vizibil volatil, ale cărui vapori sunt extrem de toxici. Mercurul este unul dintre cele două elemente chimice (și singurul metal), substanțele simple ale căror în condiții normale se află într-o stare lichidă de agregare (al doilea element este bromul). Se găsește în natură atât sub formă nativă, cât și formează o serie de minerale. Cel mai adesea, mercurul se obține prin reducerea mineralului său cel mai comun - cinabru. Este utilizat pentru fabricarea de instrumente de măsurare, pompe de vid, surse de lumină și în alte domenii ale științei și tehnologiei.
Mercurul este singurul lichid metalic la temperatura camerei. Are proprietățile unui diamagnet. Formează aliaje lichide cu multe metale - amalgame. Doar fier, mangan și Ni.
Mercurul este un metal cu activitate scăzută.
Când este încălzit la 300 ° C, mercurul reacționează cu oxigenul: 2Hg + O2 → 2HgO Se formează oxid roșu de mercur (II). Această reacție este reversibilă: atunci când este încălzită peste 340 ° C, oxidul se descompune în substanțe simple. Reacția de descompunere a oxidului de mercur a fost istoric una dintre primele metode de producere a oxigenului.
Când mercurul este încălzit cu sulf, se formează sulfură de mercur (II).
Mercurul nu se dizolvă în soluții de acizi care nu au proprietăți oxidante, dar se dizolvă în acvatică și acid azotic, formând săruri de mercur divalent. Când excesul de mercur este dizolvat în acid azotic la rece, se formează nitrat de Hg2 (NO3) 2.
Dintre elementele din grupa IIB a grupului de mercur, este posibil să se distrugă o coajă de electroni 6d10 foarte stabilă, ceea ce duce la posibilitatea compușilor de mercur (+4). Așadar, pe lângă Hg2F2 ușor solubil și HgF2 care se descompun în apă, există și HgF4 obținut prin interacțiunea atomilor de mercur și a unui amestec de neon și fluor la o temperatură de 4 K.
Mercurul este utilizat la fabricarea termometrelor, lămpile cu mercur și cuarț și fluorescente sunt umplute cu vapori de mercur. Contactele cu mercur servesc ca senzori de poziție. În plus, mercurul metalic este utilizat pentru a produce o serie de aliaje critice.
Anterior, diverse amalgame de metale, în special amalgame de aur și argint, au fost utilizate pe scară largă în bijuterii, la fabricarea oglinzilor și a umpluturilor dentare. În tehnologie, mercurul a fost utilizat pe scară largă pentru barometre și manometre. Compușii cu mercur au fost folosiți ca antiseptic (clorură de mercur), laxativ (calomel), în producția de pălării etc., dar datorită toxicității ridicate, până la sfârșitul secolului XX au fost exprimate practic din aceste zone (înlocuirea amalgamării prin pulverizare și electrodepunerea metalelor, polimer umpluturi în stomatologie).
Aliajul de mercur de taliu se folosește pentru termometre cu temperatură joasă.
Mercurul metalic servește ca un catod pentru producerea electrolitică a mai multor metale active, clor și alcaline, în unele surse de curent chimic (de exemplu, mercur-zinc - tip RC), în surse de tensiune de referință (celula Weston). Elementul mercur-zinc (emf 1,35 Volți) are o energie foarte mare în volum și greutate (130 W / h / kg, 550 W / h / dm).
Mercurul este utilizat pentru reciclarea aluminiului secundar și a mineritului de aur (a se vedea amalgamul).
Uneori, mercurul este folosit ca fluid de lucru în lagărele hidrodinamice puternic încărcate.
Mercurul este parte a unor vopsele biocide pentru a preveni murdărirea cojilor navelor în apa de mare.
Mercur-203 (T1 / 2 \u003d 53 sec) este utilizat în radiofarmacologie.
Sărurile de mercur sunt de asemenea utilizate:
Iodura de mercur este utilizată ca un detector de radiații semiconductor.
Fulminatul de mercur („mercur exploziv”) a fost folosit de mult timp ca exploziv inițiator (detonatoare).
Bromura de mercur este folosită în descompunerea termochimică a apei în hidrogen și oxigen (energie atomică a hidrogenului).
Unii compuși de mercur sunt folosiți ca medicamente (de exemplu, mertiolat pentru conservarea vaccinurilor), dar în principal din cauza toxicității, mercurul a fost înlocuit din medicament (clorură de mercur, oxiananură de mercur - antiseptice, calomel - laxativ, etc.) la mijlocul secolului XX.

aluminiu
Aluminiul este un element al subgrupului principal al grupării a treia din a treia perioadă a sistemului periodic al elementelor chimice ale lui DI Mendeleev Dmitry Ivanovici, număr atomic 13. Este desemnat de simbolul Al (lat. Aluminiu). Aparține grupului de metale ușoare. Cel mai obișnuit metal și cel de-al treilea element mai chimic (după oxigen și siliciu) din scoarța terestră.
Substanță simplă Aluminium (număr CAS: 7429-90-5) - metal ușor, nemagnetic argintiu-alb care poate fi ușor modelat, turnat, prelucrat. Aluminiul are o conductivitate termică și electrică ridicată, rezistența la coroziune datorită formării rapide a filmelor puternice cu oxid care protejează suprafața de interacțiuni ulterioare.
Conform unor studii biologice, aportul de aluminiu în corpul uman a fost considerat un factor în dezvoltarea bolii Alzheimer, dar aceste studii au fost ulterior criticate și concluzia despre relația unuia cu celălalt a fost respinsă.
Metal alb-argintiu, ușor, densitate 2,7 g / cm2, punct de topire pentru 658 ° C tehnic, aluminiu de înaltă puritate 660 ° C, punct de fierbere 2500 ° C, rezistență temporară la turnare 10-12 kg / mm2, deformabil 18 -25 kg / mm2, aliaje 38-42 kg / mm2.
Duritatea Brinell este de 24-32 kgf / mm2, ductilitate ridicată: tehnic 35%, pur 50%, laminat într-o foaie subțire și chiar folie.
Aluminiul are o conductivitate electrică ridicată și conductivitate termică, 65% din conductivitatea electrică a Cuprum, are o reflectivitate ridicată.
Aluminiul formează aliaje cu aproape toate metalele.
În condiții normale, aluminiu este acoperit cu o peliculă de oxid subțire și puternică și, prin urmare, nu reacționează cu agenți de oxidare clasici: cu H2O (t °); O2, HNO3 (fără încălzire). Datorită acestui fapt, aluminiul nu este practic sensibil la coroziune și, prin urmare, este foarte solicitat de industria modernă. Cu toate acestea, în timpul distrugerii peliculei de oxid (de exemplu, la contactul cu soluții de săruri de amoniu NH4 +, alcaline fierbinți sau ca urmare a amalgamării), aluminiu acționează ca un agent activ de reducere a metalelor.
Reacționează ușor cu substanțe simple:
cu oxigen:
4Al + 3O2 \u003d 2Al2O3
cu halogeni:
2Al + 3Br2 \u003d 2AlBr3
reacționează cu alte nemetale atunci când este încălzit:
cu sulf, formând sulfură de aluminiu:
2Al + 3S \u003d Al2S3
cu azot pentru a forma nitrură de aluminiu:
cu carbon, formând carbură de aluminiu:
4Al + 3C \u003d Al4C3
Sulfura de aluminiu și carbură sunt complet hidrolizate:
Al2S3 + 6H2O \u003d 2Al (OH) 3 + 3H2S
Al4C3 + 12H2O \u003d 4Al (OH) 3+ 3CH4
Cu substanțe complexe:
cu apă (după îndepărtarea peliculei de oxid de protecție, de exemplu, amalgamare sau soluții de alcalini fierbinți):
2Al + 6H2O \u003d 2Al (OH) 3 + 3H2
cu alcaline (cu formarea de tetrahidroxoaluminați și alte aluminate):
2Al + 2NaOH + 6H2O \u003d 2Na + 3H2
2 (NaOH.H2O) + 2Al \u003d 2NaAlO2 + 3H2
Ușor solubil în acizi sulfurici clorhidrici și diluati
2Al + 6HCl \u003d 2AlCl3 + 3H2
2Al + 3H2SO4 (dec) \u003d Al2 (SO4) 3 + 3H2
Când este încălzit, se dizolvă în acizi - agenți de oxidare care formează săruri solubile de aluminiu:
2Al + 6H2SO4 (conc) \u003d Al2 (SO4) 3 + 3SO2 + 6H2O
Al + 6HNO3 (conc) \u003d Al (NO3) 3 + 3NO2 + 3H2O
restabilește metalele din oxizii lor (aluminotermie):
8Al + 3Fe3O4 \u003d 4Al2O3 + 9Fe
2Al + Cr2O3 \u003d Al2O3 + 2Cr
Folosit pe scară largă ca material structural. Avantajele principale ale aluminiului în această calitate sunt ușurința, flexibilitatea de ștanțare, rezistența la coroziune (în aer, aluminiu este acoperit instantaneu cu o peliculă durabilă Al2O3, care împiedică oxidarea ulterioară a acesteia), conductivitatea termică ridicată, non-toxicitatea compușilor săi. În special, aceste proprietăți au făcut ca aluminiul să fie extrem de popular în fabricarea de vase, folie de aluminiu în industria alimentară și pentru ambalare.
Dezavantajul principal al aluminiului ca material structural este rezistența sa redusă, de aceea este de obicei topit cu o cantitate mică de Cuprum și magneziu (aliajul se numește duralumin).
Conductivitatea electrică a aluminiului este de doar 1,7 ori mai mică decât cea a Cuprum, în timp ce aluminiul este de aproximativ 2 ori mai ieftin. Prin urmare, este utilizat pe scară largă în inginerie electrică pentru fabricarea firelor, ecranarea lor și chiar în microelectronică la fabricarea conductoarelor în jetoane. Conductivitatea electrică mai mică a aluminiului (37 1 / ohm) în comparație cu Cuprum (63 1 / ohm) este compensată printr-o creștere a secțiunii transversale a conductoarelor de aluminiu. Un dezavantaj al aluminiului ca material electrotehnic este o peliculă puternică cu oxid care îngreunează lipirea.
Datorită complexului său de proprietăți, este distribuit pe scară largă în echipamente termice.
Aluminiul și aliajele sale își păstrează rezistența la temperaturi extrem de scăzute. Datorită acestui fapt, este utilizat pe scară largă în tehnologia criogenică.
Reflectivitate ridicată, combinată cu costuri reduse și ușurință de pulverizare, face din aluminiu un material ideal pentru fabricarea oglinzilor.
În producția de materiale de construcție ca agent generator de gaz.
Coroziunea și scalarea sunt utilizate pentru a modifica oțelul și alte aliaje, de exemplu, supape pentru motoare cu combustie internă cu piston, palete de turbină, turnuri de recuperare a uleiului, echipamente de schimb de căldură și, de asemenea, înlocuirea galvanizării.
Sulfura de aluminiu este utilizată pentru producerea sulfurii de hidrogen.
Cercetările sunt în curs de dezvoltare pentru a dezvolta aluminiu spumos ca un material deosebit de puternic și ușor.
Când aluminiu era foarte scump, din el se făceau o varietate de bijuterii. Moda pentru ei a trecut imediat când au apărut Noile tehnologii (evoluții) ale producției sale, care s-au redus de multe ori. În zilele noastre, aluminiu este uneori folosit la fabricarea de bijuterii.


Alte metale
plumb
Plumbul este un element al subgrupului principal al grupării a patra, a șasea Perioadă a sistemului periodic al elementelor chimice ale DI Dmitry Ivanovici Mendeleev, cu număr atomic 82. Este indicat prin simbolul Pb (lat. Plumbum). Substanță simplă Plumb (număr CAS: 7439-92-1) este un metal gri maleabil, cu o topire relativ scăzută.
Plumbul are o conductivitate termică destul de scăzută, este de 35,1 W / (m · K), la o temperatură de 0 ° C. Metalul este moale, ușor de tăiat cu un cuțit. La suprafață, este de obicei acoperit cu o peliculă de oxizi mai mult sau mai puțin groasă, atunci când este tăiată, se deschide o suprafață strălucitoare, care se estompează în aer în timp.
Punctul de topire: 327.4 ° C
Punctul de fierbere: 1740 ° C
Nitratul de plumb este utilizat pentru producerea de explozibili mixți puternici. Azidul de plumb este utilizat ca cel mai utilizat detonator (inițiator exploziv). Percloratul de plumb este utilizat pentru prepararea lichidelor grele (densitate 2,6 g / cm2) utilizate la prelucrarea flotației minereurilor; uneori este utilizat în explozive amestecate puternice ca agent oxidant. Fluorura de plumb singură, precum și fluorura de bismut, Kuprum, Silver, este folosită ca material catod în surse de curent chimic. Bismutatul de plumb, PbS sulfura de plumb, iodura de plumb sunt utilizate ca material catod în bateriile cu litiu. Plumb Clorură PbCl2 ca material catodic în surse de curent de așteptare. Telluride de plumb PbTe este utilizat pe scară largă ca material termoelectric (putere termoelectrică cu 350 μV / K), cel mai utilizat material în producția de generatoare termoelectrice și frigidere termoelectrice. Dioxidul de plumb PbO2 este utilizat pe scară largă nu numai într-o baterie cu plumb, dar, de asemenea, multe surse de curent chimic de rezervă sunt produse pe baza sa, de exemplu, un element plumb-clor, un element plumb-fluor etc.
Albul de plumb, principalul carbonat Pb (OH) 2.PbCO3, o pulbere albă densă, este obținut din plumb în aer sub influența dioxidului de carbon și a acidului acetic. Utilizarea albului de plumb ca pigment colorant nu este acum la fel de frecventă ca înainte, datorită descompunerii lor sub acțiunea de hidrogen sulfurat H2S. Spălarea albă de plumb este utilizată, de asemenea, pentru producerea chitului, în tehnologia cimentului și a hârtiei carbonatate cu plumb.
Arsenatul de plumb și arsenitul sunt utilizate în tehnologia insecticidelor pentru a ucide insectele - dăunători agricoli (viermele de mătase nepereche și bumbacul). Plumb Borate Pb (BO2) 2 · H2O, o pulbere albă insolubilă, este utilizat pentru uscarea picturilor și lacurilor, și împreună cu alte metale - ca acoperiri de sticlă și porțelan. Clorura de plumb PbCl2, o pulbere albă cristalină, este solubilă în apă fierbinte, soluții ale altor cloruri și în special clorură de amoniu NH4Cl. Este utilizat pentru prepararea unguentelor în tratamentul tumorilor.
Lead Chromate PbCrO4 este cunoscut sub numele de colorant galben crom, este un pigment important pentru prepararea vopselelor, pentru colorarea porțelanului și a țesăturilor. În industrie, cromatul este utilizat mai ales în producția de pigmenți galbeni. Nitratul de plumb Pb (NO3) 2 este o substanță cristalină albă, ușor solubilă în apă. Este un astringent de utilizare limitată. În industrie, este utilizat în producția de chibrituri, vopsire și imprimare textilă, coarne de vopsire și gravură. Sulfatul de plumb Pb (SO4) 2, o pulbere albă insolubilă în apă, este utilizat ca un pigment în baterii, litografie și în tehnologia de țesături imprimate.
Sulfura de plumb PbS, o pulbere neagră insolubilă în apă, este utilizată pentru arderea olăritului și pentru detectarea ionilor de plumb.
Deoarece Plumb absoarbe bine radiația γ, este utilizat pentru protecția împotriva radiațiilor în instalațiile cu raze X și în reactoarele nucleare. În plus, Lead este considerat ca un lichid de răcire în proiectele reactoarelor promitente de neutroni rapide.
Aplicarea semnificativă a aliajelor de plumb. Puterul (aliaj de plumb), care conține 85-90% metal de staniu și 15-10% Pb, este modelat, ieftin și utilizat la fabricarea ustensilelor de uz casnic. Soldul care conține 67% Pb și 33% Tin metal este utilizat în inginerie electrică. Aliajele de plumb și antimoniu sunt utilizate la fabricarea gloanțelor și tipografiei, iar aliajele de plumb, antimoniu și staniu sunt utilizate pentru turnarea figurilor și rulmenții. Aliajele de plumb antimoniu sunt utilizate în mod obișnuit pentru teci de cablu și plăci de baterii electrice. Compușii de plumb sunt folosiți la fabricarea de coloranți, vopsele, insecticide, sticlă Comert cu articole și ca aditivi la benzină sub formă de plumb tetraetil (C2H5) 4Pb (un lichid moderat volatil, o pereche de tăieturi în concentrații mici au un miros dulce de fructe, în cele mari există un miros neplăcut; Mp \u003d 130 ° C, mp \u003d 80 ° C / 13 mm RT densitate 1.650 g / cm; nD2v \u003d 1.5198; insolubil în apă, amestecat cu solvenți organici; foarte toxic, pătrunde ușor în piele; MPC \u003d 0,005 mg / m; LD50 \u003d 12,7 mg / kg (șobolan, oral)) pentru a crește gradul de octan.

staniu
Tinul este un element al subgrupului principal al grupării a patra, a cincea Perioada a sistemului periodic al elementelor chimice DI Mendeleev Dmitry Ivanovich, cu numărul atomic 50. Este desemnat prin simbolul Tin metal (lat. Stannum). În condiții normale, o substanță simplă este un metal lucios ductil, maleabil și fuzibil de culoare alb-argintiu. Tinul formează mai multe modificări alotrope: sub 13,2 ° C α-staniu stabil (staniu gri) cu o rețea cubică de tip diamant, peste 13,2 ° C β-staniu (staniu alb) cu o rețea de cristal tetragonală.
Stanul este utilizat în principal ca acoperire sigură, netoxică, rezistentă la coroziune în forma sa pură sau în aliaje cu alte metale. Principalele aplicații industriale ale stanului sunt în plăcuța de tiniche (fier conserve) pentru fabricarea containerelor cu produse alimentare, în lipitoare pentru electronice, în conducte de casă, în aliaje de rulment și în acoperiri de staniu și aliajele sale. Cel mai important aliaj de staniu este bronz (cu Cuprum). Un alt aliaj cunoscut - un computer - este folosit pentru confecționarea vaselor. Recent, interesul pentru utilizarea metalului a fost reînviat, deoarece este cel mai „ecologic” dintre metalele grele neferoase. Folosit pentru a crea fire superconductoare bazate pe compusul intermetalic Nb3Sn.
prețurile pe metal Tin in 2006 s-a ridicat la o medie de 12-18 $ / kg, dioxid de staniu de puritate ridicata aproximativ 25 $ / kg, staniu unic cristal cu puritate ridicata aproximativ 210 $ / kg.
Compușii intermetalici de staniu și zirconiu au puncte de topire ridicate (până la 2000 ° C) și rezistență la oxidare atunci când sunt încălzite în aer și au o serie de aplicații.
Tinul este cea mai importantă componentă de aliere în producția de aliaje de titan structurale.
Dioxidul de staniu este un material abraziv foarte eficient utilizat pentru „finisarea” suprafeței sticlei optice.
Un amestec de săruri de staniu - „compoziția galbenă” - a fost folosit anterior ca colorant pentru lână.
Stanul este de asemenea utilizat în surse de curent chimic ca material anodic, de exemplu: element mangan-staniu, element oxid-mercur-staniu. Promițătoare este folosirea stanului într-o baterie cu plumb; Deci, de exemplu, la o tensiune egală cu o baterie de plumb, o baterie de plumb are o capacitate de 2,5 ori mai mare și o densitate de energie de 5 ori mai mare pe unitatea de volum, rezistența sa internă este mult mai mică.
Tin Tinul metalic este non-toxic, ceea ce permite utilizarea sa în industria alimentară. Impuritățile dăunătoare conținute de staniu în condiții normale de depozitare și utilizare, inclusiv în topitură la temperaturi de până la 600 ° C, nu sunt eliberate în aerul zonei de lucru în volume care depășesc concentrația maximă admisă în conformitate cu GOST. Expunerea pe termen lung (15-20 de ani) la praful de staniu are un efect fibrogen asupra plămânilor și poate provoca boala celor care lucrează cu pneumoconioză.
Aplicație metalică
Materiale de construcție
Metalele și aliajele lor sunt unul dintre materialele structurale principale ale civilizației moderne. Acest lucru este determinat în principal de rezistența mare, uniformitatea și impermeabilitatea lor la lichide și gaze. În plus, schimbând compoziția aliajelor, este posibil să își schimbe proprietățile pe o gamă foarte largă.
Materiale electrice
Metalele sunt utilizate ca buni conductori Energie electrică (Cupru, aluminiu) și ca materiale cu rezistență ridicată la rezistențe și elemente de încălzire electrice (nichrom etc.).
Materiale de scule
Metalele și aliajele lor sunt utilizate pe scară largă pentru fabricarea uneltelor (piesele lor de lucru). Acestea sunt în principal oțeluri și carburi pentru scule. Diamant, nitru de bor și ceramică sunt, de asemenea, utilizate ca materiale pentru scule.
metalurgie
Metalurgia sau metalurgia este un domeniu al științei materialelor care studiază comportamentul fizic și chimic al metalelor, compușilor intermetalici și aliajelor. Metalurgia include și aplicarea practică a cunoștințelor existente despre metale - de la extragerea materiilor prime la emisia monetară a produselor finite.
Studiul structurii și proprietăților fizico-chimice ale topiturilor de metal și oxid și soluții solide, dezvoltarea teoriei stării condensate a materiei;
Studiul termodinamicii, cineticii și mecanismului reacțiilor metalurgice;
Dezvoltarea bazelor științifice și tehnice și economice pentru utilizarea integrată a materiilor prime minerale polimetalice și a deșeurilor industriale cu soluția problemelor de mediu;
Dezvoltarea teoriei fundamentelor fundamentale ale fazei pirometalurgice, electrotermice, hidrometalurgice și gazoase procese producerea de metale, aliaje, pulberi metalice și materiale compozite și acoperiri.
Metalele feroase includ fierul, manganul, cromul, vanadiul. Toate celelalte sunt colorate. În funcție de proprietățile și scopul lor fizic, metalele neferoase sunt împărțite în mod convențional în grele (cupru, plumb, zinc, staniu, Ni) și ușoare (aluminiu, magneziu).
Conform principalului proces tehnologic, acesta este împărțit în pirometalurgie (topire) și hidrometalurgie (extragerea metalelor în soluții chimice). O varietate de pirometalurgie este metalurgia cu plasmă.
Metalurgie cu plasmă - extracția din minereuri, topirea și prelucrarea metalelor și aliajelor sub influența plasmei.
Prelucrarea minereurilor (oxizi etc.) se realizează prin descompunerea lor termică în plasmă. Pentru a preveni reacțiile invers, se folosește un agent de reducere (carbon, hidrogen, metan etc.) sau o răcire accentuată a fluxului de plasmă, care încalcă echilibrul termodinamic.
Plasma Metalurgie permite reducerea directă a metalului din minereu, accelerează semnificativ procesele metalurgice, obține materiale curate, reduce consumul de combustibil (agent de reducere). Dezavantajul metalurgiei plasmatice este consumul ridicat de energie electrică folosită pentru a genera plasma.

Povestea
Primele dovezi că o persoană a fost angajată în metalurgie datează din 5-6 milenii î.Hr. e. și au fost găsite în Majdanpek, Pločnik și în alte locuri din Serbia (inclusiv toporul de cupru 5500 î.Hr., legat de cultura Vinca), Bulgaria (5000 î.Hr.), Palmele (), Spania, Stonehenge (). Totuși, așa cum se întâmplă adesea cu astfel de fenomene de lungă durată, vârsta nu poate fi întotdeauna determinată cu exactitate.
În cultura timpurilor timpurii, există argint, cupru, staniu și fier de meteorit, ceea ce a permis prelucrarea metalelor limitate. Astfel, „Heavenly Daggers” erau foarte apreciate - armele egiptene create din fierul de meteorit 3000 de ani î.Hr. e. Dar, după ce am învățat să-mi mina Cuprul și stanul stâncă și primesc un aliaj numit bronz, oamenii din 3500 î.Hr. e. a intrat în epoca bronzului.
Obținerea fierului din minereu și topirea metalului a fost mult mai dificilă. Se crede că tehnologia a fost inventată de hitiți în jurul anului 1200 î.Hr. de exemplu, acesta a fost începutul epocii fierului. Secretul mineritului și al fabricării fierului a devenit un factor cheie în stăpânirea filistenilor.
Urmele dezvoltării metalurgiei feroase pot fi urmărite în multe culturi și civilizații trecute. Aceasta include regatele și imperiile antice și medievale din Orientul Mijlociu și Orientul Mijlociu, Egiptul antic și Anatolia (), Cartagine, Greci și Romani din vechime și medieval A Europei, China, etc. Trebuie menționat că multe metode, dispozitive și tehnologii ale metalurgiei au fost inițial inventate în China antică, iar europenii au stăpânit acest meșteșug (inventând furnale, Fonta, Oțel, ciocane hidraulice etc.). Cu toate acestea, cercetările recente sugerează că tehnologia romană era mult mai avansată decât se credea anterior, în special în domeniile mineritului și forjării.
Metalurgie extractivă
Metalurgia minieră constă în extragerea metalelor valoroase din minereu și topirea materiilor prime extrase în metal pur. Pentru a converti un oxid de metal sau sulfură în Metal pur, minereul trebuie separat prin metode fizice, chimice sau electrolitice.
Metalurgiștii lucrează cu trei componente principale: materii prime, concentrat (oxid de valoare sau sulfură a metalului) și deșeuri. După exploatare, bucăți mari de minereu sunt zdrobite până la punctul în care fiecare particulă este fie un concentrat valoros, fie deșeuri.
munte muncă opțional dacă minereul și mediul permit scurgerea. În acest fel, se poate dizolva și obține o soluție îmbogățită cu Mineral.
Minereul conține adesea mai multe metale valoroase. În acest caz, deșeurile dintr-un proces pot fi utilizate ca materie primă pentru un alt proces.
aliaj
Aliajul este un amestec omogen macroscopic format din două sau mai multe elemente chimice cu predominanță a componentelor metalice. Faza principală sau unică a aliajului, de regulă, este o soluție solidă de elemente de aliere din metal, care este baza aliajului.
Aliajele au proprietăți metalice, de exemplu: luciu metalic, conductivitate electrică ridicată și conductivitate termică. Uneori, componentele din aliaj pot fi nu numai elemente chimice, ci și compuși chimici cu proprietăți metalice. De exemplu, principalele componente ale carburilor sunt carburile de wolfram sau titan. Proprietățile macroscopice ale aliajelor diferă întotdeauna de proprietățile componentelor lor, iar omogenitatea macroscopică a aliajelor multifazice (eterogene) se realizează datorită distribuției uniforme a fazelor de impuritate în matricea metalică.
Aliajele se obțin de obicei prin amestecarea componentelor într-o stare topită, urmată de răcire. La temperaturi ridicate de topire a componentelor, aliajele sunt produse prin amestecarea pulberilor de metale cu sinterizarea ulterioară (astfel se obțin, de exemplu, multe aliaje de tungsten).
Aliajele sunt unul dintre materialele structurale principale. Printre acestea, cele mai importante sunt aliajele pe bază de fier și aluminiu. În compoziția mai multor aliaje pot fi introduse nemetale precum carbon, siliciu, bor, etc. În tehnică sunt utilizate peste 5 mii de aliaje.
surse
http://ru.wikipedia.org/
Enciclopedia investitorului. 2013 .
Sinonime:- - METAL, soț metal., Lat. krushets; și într-o formă mică, în topire: korolek. În viața de zi cu zi, metale valoroase, scumpe: aur, platină, argint; simplu: fier, cupru, zinc, staniu, plumb; chimia a descoperit astfel de principii de aproape toate mineralele constând din ... ... Dicționarul explicativ al lui Dahl
Marea majoritate (93 din 117) dintre elementele chimice cunoscute în prezent sunt metale.
Atomii din diferite metale au o structură comună, iar substanțele simple și complexe formate de acestea au proprietăți similare (fizice și chimice).
Poziția în sistemul periodic și structura atomilor de metal.
În sistemul periodic, metalele sunt amplasate la stânga și sub linia de rupere condiționată care trece de la bor la astatină (vezi tabelul de mai jos). Aproape toate elementele s (cu excepția lui H, He) aparțin metalelor, aproximativ jumătate r-elemente, toate d- și f-elemente ( lantanidelor și actinide).
Majoritatea atomilor de metal de la nivelul energiei externe conțin un număr mic (până la 3) electroni, doar unii atomi cu element p (Sn, Pb, Bi, Po) au mai mulți (patru până la șase). Electronii de valență ai atomilor de metal sunt legați slab (în comparație cu atomii nemetalici) legați de nucleu. Prin urmare, atomii metalici dau relativ ușor acești electroni altor atomi, acționând în reacții chimice doar ca agenți reducători și transformându-se în cationi încărcați pozitiv:
Me - ne - \u003d Me n +.
Spre deosebire de nemetalele, atomii metalici sunt caracterizați doar de stări de oxidare pozitive de la +1 la +8.
Ușurătatea cu care atomii de metal își donează electronii de valență altor atomi caracterizează activitatea de reducere a acestui metal. Cu cât atomul de metal își dă mai ușor electronii, cu atât este mai puternic agentul de reducere. Dacă metalele sunt aranjate pe rând în ordinea reducerii capacității lor de reducere în soluții apoase, obținem seria de deplasare a metalelor, care se mai numește seria electrochimică de tensiuni (sau aproape de activitate) metale (vezi tabelul de mai jos).
Prevalență mmetale în natură.
Primele trei metale cele mai frecvente în scoarța terestră (acesta este stratul de suprafață al planetei noastre cu o grosime de aproximativ 16 km) include aluminiu, fier și calciu. Mai puțin frecvente sunt sodiul, potasiul și magneziul. Tabelul de mai jos prezintă fracțiile de masă ale unor metale din scoarța terestră.
fier și calciu. Mai puțin frecvente sunt sodiul, potasiul și magneziul. Tabelul de mai jos prezintă fracțiile de masă ale unor metale din scoarța terestră.
Prevalența metalelor în scoarța terestră
| metal | metal | Fracția de masă în scoarța terestră,% | |
|---|---|---|---|
| Al | 8,8 | Cr | 8,3 ∙ 10 -3 |
| Fe | 4,65 | Zn | 8,3 ∙ 10 -3 |
| Ca | 3,38 | Ni | 8 ∙ 10 -3 |
| na | 2,65 | cu | 4,7 ∙ 10 -3 |
| K | 2,41 | Pb | 1,6 ∙ 10 -3 |
| mg | 2,35 | Ag | 7 ∙ 10 -6 |
| Ti | 0,57 | Hg | 1,35 ∙ 10 -6 |
| Mn | 0,10 | Au | 5 ∙ 10 -8 |
Elementele a căror fracție de masă în scoarța terestră este mai mică de 0,01% sunt numite rar. Metalele rare includ, de exemplu, toate lantanidele. Dacă un element nu este capabil să se concentreze în scoarța terestră, adică nu-și formează propriile minereuri, ci apare ca o impuritate cu alte elemente, atunci se face referire la distrată elemente. Următoarele metale sunt împrăștiate, de exemplu: Sc, Ga, In, Tl, Hf.
În anii 40 ai secolului XX. Cercetătorii germani Walter și Ida Nolla au sugerat acest lucru. că în fiecare pietruire de pe pavaj există toate elementele chimice ale sistemului periodic. La început, aceste cuvinte au fost întâmpinate de colegii lor, cu departe de aprobarea unanimă. Cu toate acestea, pe măsură ce apar metode de analiză din ce în ce mai precise, oamenii de știință sunt din ce în ce mai convinși de validitatea acestor cuvinte.
Deoarece toate organismele vii sunt în contact strâns cu mediul, fiecare dintre ele ar trebui să conțină, dacă nu toate, atunci majoritatea elementelor chimice ale sistemului periodic. De exemplu, în corpul unui adult, fracția în masă a substanțelor anorganice este de 6%. Dintre metalele din acești compuși, sunt prezenți Mg, Ca, Na, K. Multe dintre enzime și alți compuși organici activi biologic din corpul nostru conțin V, Mn, Fe, Cu, Zn, Co, Ni, Mo, Cr și alte metale.
Corpul unui adult conține în medie aproximativ 140 g de ioni de potasiu și aproximativ 100 g de ioni de sodiu. Cu mâncare, consumăm zilnic de la 1,5 g la 7 g de ioni de potasiu și de la 2 g la 15 g de ioni de sodiu. Nevoia de ioni de sodiu este atât de mare încât trebuie adăugați în mod special la mâncare. O pierdere semnificativă de ioni de sodiu (sub formă de NaCl cu urină și transpirație) afectează negativ sănătatea umană. De aceea, pe vreme caldă, medicii recomandă consumul de apă minerală. Cu toate acestea, conținutul excesiv de sare din alimente afectează în mod negativ activitatea organelor noastre interne (în primul rând inima și rinichii).
Aveți nevoie de JavaScript activat pentru a vota.Și alți compuși chimici. Pentru a obține metale pure și aplicarea lor ulterioară, este necesar să le izolați de minereuri și să efectuați curățarea. Dacă este necesar alierea și alte prelucrări de metale. Știința studiază acest lucru. metalurgie . Metalurgia distinge minereurile feroase (pe baza de glandă) și neferoase (nu includ fier, doar aproximativ 70 de elemente). Aur, argint și platină se aplică și pentru metale prețioase (nobile) . În plus, în cantități mici, ele sunt prezente în apa de mare, plante, organisme vii (jucând un rol important).
Se știe că corpul uman este format din 3% de metale . Cel mai mult în noi celulele calciu și sodiu concentrat în sisteme limfatice. magneziu se acumulează în mușchii și sistemul nervos , cupru - în ficat , fier - în sânge.
extracție
Metalele sunt deseori extrase de pe pământ prin exploatare, rezultatele - minereuri minate - servesc ca o sursă relativ bogată de elemente necesare. Pentru a afla locația minereurilor, se utilizează metode speciale de căutare, inclusiv explorarea minereurilor și explorarea depozitelor. Depozitele sunt, în general, împărțite în carieră (minereuri de suprafață), în care mineritul se realizează prin extragerea solului folosind echipamente grele, precum și subterane a mea.
Metalele sunt extrase din minereul extras, de obicei prin reducere chimică sau electrolitică. pyro temperaturile ridicate sunt utilizate pentru a transforma minereul în materii prime metalice, în hidrometalurgia aplicați în același scop chimia apei. Metodele utilizate depind de tipul de metal și de tipul de contaminare.
Când minereul metalic este un compus ionic din metal și non-metal, acesta este de obicei topit - încălzit cu un agent de reducere - pentru a recupera metalul pur. Multe metale comune, cum ar fi fier topit folosind ca agent reducător carbon (obținut din arderea cărbunelui). Unele metale, cum ar fi aluminiu și sodiu nu au reductant viabil din punct de vedere economic și sunt recuperați folosind electroliză.
Duritatea Mohs a unor metale:
| duritate | metal |
|---|---|
| 0.2 | cesiu |
| 0.3 | rubidiu |
| 0.4 | potasiu |
| 0.5 | sodiu |
| 0.6 | litiu |
| 1.2 | indiu |
| 1.2 | taliu |
| 1.25 | bariu |
| 1.5 | stronțiu |
| 1.5 | galiu |
| 1.5 | staniu |
| 1.5 | plumb |
| 1.5 | |
| 1.75 | calciu |
| 2.0 | cadmiu |
| 2.25 | bismut |
| 2.5 | magneziu |
| 2.5 | zinc |
| 2.5 | lantan |
| 2.5 | argint |
| 2.5 | aur |
| 2.59 | ytriu |
| 2.75 | aluminiu |
| 3.0 | cupru |
| 3.0 | antimoniu |
| 3.0 | toriu |
| 3.17 | scandiu |
| 3.5 | platină |
| 3.75 | cobalt |
| 3.75 | paladiu |
| 3.75 | zirconiu |
| 4.0 | fier |
| 4.0 | nichel |
| 4.0 | hafniu |
| 4.0 | mangan |
| 4.5 | vanadiu |
| 4.5 | molibden |
| 4.5 | rodiu |
| 4.5 | Titan |
| 4.75 | niobiu |
| 5.0 | iridiu |
| 5.0 | ruteniu |
| 5.0 | tantal |
| 5.0 | technețiu |
| 5.0 | crom |
| 5.5 | beriliu |
| 5.5 | osmiu |
| 5.5 | reniu |
| 6.0 | tungsten |
| 6.0 | β-Uranus |
Datorită recuperării ușoare a electronilor, este posibilă oxidarea metalelor, ceea ce poate duce la coroziune și degradarea suplimentară a proprietăților. Capacitatea de oxidare poate fi recunoscută prin seria standard de activitate a metalelor. Acest fapt confirmă necesitatea utilizării metalelor în combinație cu alte elemente ( aliaj dintre care cel mai important este oțel), alierea lor și aplicarea diverselor acoperiri.
Pentru o descriere mai corectă a proprietăților electronice ale metalelor, este necesară utilizarea mecanica cuantică . În toate solidele cu suficient simetrie nivelurile de energie ale electronilor atomilor individuali se suprapun și formează zone permise, iar zona formată de electroni de valență se numește bandă de valență . Legătura slabă a electronilor de valență în metale duce la faptul că banda de valență din metale este foarte largă, iar toți electronii de valență nu sunt suficienți pentru a o umple complet.
Caracteristica principală a unei astfel de zone parțial umplute este că, chiar și cu o tensiune minimă aplicată, restructurarea electronilor de valență începe în eșantion, adică curge curent electric.
Aceeași mobilitate ridicată a electronilor duce la o conductibilitate termică ridicată, precum și la capacitatea de a reflecta radiațiile electromagnetice (ceea ce conferă metalelor un luciu caracteristic).
Unele metale
- lumină:
- altele:
Aplicație metalică
Materiale de construcție
Materiale de scule
Istoria dezvoltării ideilor despre metale
A început cunoașterea omului cu metale aur , argint și cupru , adică din metale găsite în stare liberă pe suprafața pământului; ulterior li s-au unit metale care sunt semnificativ frecvente în natură și se disting ușor de compușii lor: staniu , plumb , fier și. Aceste șapte metale erau cunoscute omenirii în timpuri străvechi. Printre artefactele egiptene antice se găsesc produse din aur și cupru, care, conform unor surse, datează din epoca îndepărtată de 3000-4000 de ani î.Hr. e.
La șapte metale celebre, doar în vârste medii S-au adăugat zinc , bismut , antimoniu iar la începutul secolului XVIII arsenic . De la mijlocul secolului al XVIII-lea, numărul metalelor descoperite a crescut rapid și ajunge la 65 până la începutul secolului XX și 96 până la începutul secolului XXI.
Niciuna dintre industriile chimice nu a contribuit atât la dezvoltarea cunoștințelor chimice, cât la procesele asociate cu producția și prelucrarea metalelor; istoria lor este legată de cele mai importante momente din istoria chimiei. Proprietățile metalelor sunt atât de caracteristice, încât deja în cea mai timpurie epocă, aurul, argintul, cuprul, plumbul, stanul, fierul și mercurul au constituit un grup natural de substanțe omogene, iar conceptul de „metal” se referă la cele mai vechi concepte chimice. Cu toate acestea, opiniile asupra naturii lor într-o formă mai mult sau mai puțin specifică apar doar în Evul Mediu alchimistii . Idei adevărate Aristotel despre natură: formarea a tot ceea ce există din patru elemente (foc, pământ, apă și aer) a indicat deja complexitatea metalelor; dar aceste idei erau prea vagi și abstracte. Alchimiștii au conceptul complexității metalelor și, ca urmare a acestui fapt, credința în capacitatea de a transforma unele metale în altele, de a le crea artificial, este conceptul de bază al viziunii lor asupra lumii. Acest concept este o concluzie firească din masa faptelor referitoare la transformările chimice ale metalelor acumulate până la acel moment. De fapt, transformarea unui metal într-un oxid complet diferit de aceștia prin simpla calcinare în aer și prepararea inversă a unui metal dintr-un oxid, precipitarea unor metale de la altele, formarea aliajelor având alte proprietăți decât metalele prelevate inițial și așa mai departe - toate acestea păreau a fi indică complexitatea naturii lor.
În ceea ce privește conversia reală a metalelor în aur, credința în posibilitatea de a se baza pe multe fapte vizibile. La început, formarea aliajelor într-o culoare asemănătoare cu aurul, de exemplu din cupru și zinc, în ochii alchimiștilor le transforma deja în aur. Li s-a părut că este necesar să schimbați doar culoarea, iar proprietățile metalului vor deveni, de asemenea, diferite. În special, experimentele slab stabilite au contribuit la această credință, când substanțele care conțin o amestecare a acestui aur au fost luate pentru a transforma un metal de bază în aur. De exemplu, deja la sfârșitul secolului al XVIII-lea, un farmacist din Copenhaga a afirmat că argintul pur chimic este parțial transformat în aur atunci când este topit cu arsenic. Acest fapt a fost confirmat de un celebru chimist. Guiton de Morvo și a făcut mult zgomot. Curând după aceea, s-a arătat că arsenul folosit pentru experiment conținea urme de argint și aur.
Întrucât dintre cele șapte metale cunoscute atunci, unele au fost mai ușor de suferit transformări chimice, altele mai dificile, alchimistii le-au împărțit în nobile - perfecte și ignobile - imperfecte. Primul a aparținut aurului și argintului, al doilea la cupru, staniu, plumb, fier și mercur. Acestea din urmă, care posedă proprietățile metalelor nobile, dar în același timp se deosebesc puternic de toate metalele în starea lichidă și volatilitatea sa, oamenii de știință extrem de ocupați din acea vreme, iar unii îl distingeau într-un grup special; atenția atrasă de ea a fost atât de mare încât au început să ia în considerare mercurul printre elementele din care s-au format metalele în sine și tocmai în ea au văzut un purtător de proprietăți metalice. Acceptând existența în natură a tranziției unor metale la altele, imperfecte spre perfecte, alchimistii au presupus că în condiții obișnuite această transformare este extrem de lentă, timp de secole, și poate nu fără participarea misterioasă a corpurilor cerești, care la acea vreme erau credite cu un rol atât de mare iar în soarta omului. Întâmplător, erau șapte metale cunoscute, precum și planete cunoscute atunci, iar acest lucru a indicat în continuare o legătură misterioasă între ele. Pentru alchimiști, metalele sunt adesea numite planete; se numește aur Soarele argint - Luna cupru - Venus , staniu - Jupiter plumb - Saturn fier - Marte și mercur - mercur . Când au fost descoperite zinc, bismut, antimoniu și arsen, corpuri care sunt în toate privințele similare cu metalele, dar care au una dintre cele mai caracteristice proprietăți ale metalului, maleabilitatea, sunt slab dezvoltate, au fost selectate într-un grup special - semimetale. Împărțirea metalelor în metale și semimetale corespunzătoare a existat încă de la mijlocul secolului al XVIII-lea.
Determinarea compoziției metalului a fost inițial pur speculativă. La început, alchimiștii au acceptat că sunt formate din două elemente - și sulf . Originea acestei viziuni nu este cunoscută, ea există deja în secolul VIII. pe Geberit dovada prezenței mercurului în metale este că le dizolvă, iar în aceste soluții individualitatea lor dispare, este absorbită de mercur, ceea ce nu s-ar fi întâmplat dacă nu ar avea un lucru în comun cu mercurul. În plus, mercurul cu plumb a dat ceva similar cu staniu. În ceea ce privește sulful, poate că a fost luat pentru că se știau compuși cu sulf, care au aspect similar cu metalele. În viitor, aceste idei simple, datorate probabil încercărilor nereușite de obținere a metalelor în mod artificial, devin extrem de complicate și confuze. În concepțiile alchimiștilor, de exemplu din secolele X-XIII, mercurul și sulful din care se formează metalele nu erau mercurul și sulful pe care alchimiștii le aveau în mâini. Era doar ceva asemănător cu ei, posedând proprietăți speciale; ceva care a existat cu adevărat în sulf și mercur obișnuit a fost exprimat în ele într-o măsură mai mare decât în \u200b\u200balte corpuri. Sub mercur, care face parte din metale, ele reprezentau ceva care le prevedea imuabilitatea, strălucirea metalică, ductilitatea, într-un cuvânt, a unui suport de tip metalic; prin sulf s-a înțeles purtătorul schimbării, degradabilității și combustibilității metalelor. Aceste două elemente erau în metale în proporții diferite și, așa cum se spunea atunci, fixate în diferite moduri; în plus, acestea pot fi de diferite grade de puritate. Potrivit lui Geber, de exemplu, aurul constă dintr-o cantitate mare de mercur și o cantitate mică de sulf în cel mai înalt grad de puritate și cel mai fixat; în staniu, dimpotrivă, și-au asumat mult sulf și puțin mercur, care nu erau curate, slab fixate și așa mai departe. Toate acestea, desigur, doreau să exprime o atitudine diferită a metalelor față de singurul agent chimic puternic din acea vreme - focul. Odată cu dezvoltarea ulterioară a acestor puncte de vedere, două elemente - mercur și sulf - păreau a fi insuficiente pentru alchimiști pentru a explica compoziția metalelor; li s-a adăugat sare și ceva arsenic. Au vrut să indice prin aceasta că, cu toate transformările metalelor, ceva rămâne nevolatil, constant. Dacă în natură „transformarea metalelor de bază în metale nobile durează secole”, alchimiștii au căutat să creeze condiții în care acest proces de perfecțiune, maturizarea să fie rapid și ușor. Datorită legăturii strânse a chimiei cu medicina de atunci și cu biologia, ideea transformării metalelor a fost identificată în mod natural cu ideea creșterii și dezvoltării corpurilor organizate: tranziția, de exemplu, a plumbului în aur, formarea unei plante din cereale aruncate în pământ și, așa cum s-a spus, descompunerea, fermentarea, vindecarea unui organ bolnav la o persoană - toate acestea erau fenomene particulare ale unui proces de viață comun misterios, îmbunătățire și erau cauzate doar de stimulente. De aici se înțelege că principiul misterios, care face posibilă obținerea aurului, a fost vindecarea bolilor, transformarea vechiului corp uman într-unul tânăr și așa mai departe. Deci a existat un concept al unei pietre minunate a filozofului.
În ceea ce privește rolul piatra filosofului în conversia metalelor de bază în nobile, există mai multe indicii cu privire la convertirea lor în aur, nu se spune prea multe despre obținerea de argint. După unii autori, aceeași piatră a filozofului transformă metalele în argint și aur; conform altora, există două tipuri de substanță: una perfectă, cealaltă mai puțin perfectă, iar aceasta din urmă servește la producerea de argint. În ceea ce privește cantitatea de piatră a filozofului necesară transformării, direcțiile sunt de asemenea diferite. Într-una, 1 parte din ea este capabilă să transforme 10.000.000 de părți de metal în aur, în altele - 100 de părți și chiar doar 2 părți. Pentru a obține aur, s-a topit o parte din metal de bază sau s-a luat mercur și s-a aruncat acolo o piatră de filosof; unii au dat asigurări că transformarea are loc instantaneu, în timp ce alții - puțin câte puțin. Aceste păreri asupra naturii metalelor și asupra capacității lor de a transforma stăpânirea în general timp de mai multe secole până în secolul al XVII-lea, când încep să nege brusc toate acestea, cu atât mai mult cu cât aceste puncte de vedere au provocat apariția multor șarlatani care au exploatat speranța căreia să obțină aur. În special, el s-a luptat cu ideile alchimiștilor Boyle „Aș dori să știu”, spune el la un loc, „cum poate fi descompus aurul în mercur, sulf și sare; Sunt dispus să plătesc costurile acestei experiențe; pentru mine, nu aș putea realiza asta niciodată. ”
După secole de încercări lipsite de fructe de a produce în mod artificial metale și cu numărul de fapte acumulate până în secolul al XVII-lea, de exemplu, despre rolul aerului în combustie, creșterea greutății metalului în oxidare, care, întâmplător, era încă cunoscută Geber în secolul al VIII-lea, problema compoziției elementare a metalului părea să fie foarte aproape de final; dar un nou curent a apărut în chimie, rezultatul căruia a fost o teorie a phlogistonului, iar soluția acestei întrebări a fost încă întârziată mult timp.
Oamenii de știință din acea vreme erau foarte interesați de fenomenele de ardere. Plecând de la ideea de bază a filozofiei de atunci, că similitudinea proprietăților corpurilor ar trebui să provină din aceleași principii, din elementele care le compun, s-a presupus că corpurile combustibile cuprind un element comun. Actul de ardere a fost considerat un act de descompunere, de descompunere în elemente; în timp ce elementul de combustibilitate a ieșit în evidență sub formă de flacără, în timp ce altele au rămas. Recunoscând părerea alchimiștilor asupra formării metalelor din cele trei elemente, mercur, sulf și sare și acceptând existența lor reală în metal, sulful a trebuit să fie recunoscut drept principiul combustibilului. Atunci, cealaltă componentă a metalului, evident, a trebuit să recunoască restul de calcinare a metalului - „pământ”, așa cum au spus atunci; prin urmare, nu există nicio legătură cu mercurul. Sulful, pe de altă parte, se ard acid sulfuric , care mulți, în virtutea celor spuse, au fost considerați un corp mai simplu decât sulful și au fost incluși în numărul de corpuri elementare. Erau confuzie și contradicție. Becher Pentru a împăca conceptele vechi cu cele noi, el a acceptat existența a trei grade în metalul pământului: de fapt „pământ”, „pământ combustibil” și „pământ cu mercur”. În aceste condiții Stahl a propus teoria lui. În opinia sa, începutul inflamabilității nu este sulful sau orice altă substanță cunoscută, ci ceva necunoscut, numit de el phlogiston . Metalele sunt formate din phogogiston și pământ; calcinarea metalului în aer este însoțită de eliberarea de phogogiston; primirea inversă a metalelor din țara sa folosind cărbune - o substanță bogată în flogiston - este actul de a combina phlogistonul cu pământul. Deși au existat mai multe metale și fiecare dintre ele, când a fost calcinat, și-a dat propriul teren, acesta din urmă, ca element, a fost unul, așa că această componentă a metalului a fost de aceeași natură ipotetică ca și phlogistonul; cu toate acestea, adepții lui Stahl au luat uneori tot atâtea „terenuri elementare” cât erau metale. când Cavendish la dizolvarea metalelor în acizii primiți hidrogen și a studiat proprietățile sale (incapacitatea de a menține combustia, explozivitatea sa într-un amestec cu aer etc.), a recunoscut fiogogelul Stahl din el; metalele, conform conceptelor sale, constau din hidrogen și „pământ”. Această părere a fost acceptată de mulți adepți ai teoriei phlogiston.
În ciuda armoniei aparente a teoriei phlogistonului, au existat fapte majore care nu au putut fi conectate cu aceasta. De asemenea, Heber știa că metalele atunci când sunt arse cresc în greutate; între timp, potrivit Stahl, ei trebuie să piardă phlogiston: atunci când phlogistonul este reconectat la „pământ”, greutatea metalului obținut este mai mică decât greutatea „pământului”. Astfel, s-a dovedit că phlogiston trebuie să aibă o proprietate specială - gravitația negativă. În ciuda tuturor ipotezelor ingenioase exprimate pentru a explica acest fenomen, acesta a fost de neînțeles și nedumerit.
când Lavoisier a aflat rolul aerului în combustie și a arătat că profitul în greutatea metalelor în timpul arderii provine de la adăugarea de oxigen din aer la metale și, astfel, a stabilit că actul de ardere a metalelor nu este descompunerea în elemente, ci, dimpotrivă, actul de unire, problema complexității metalelor a fost rezolvat negativ. Metalele au fost atribuite unor elemente chimice simple, în virtutea ideii principale a lui Lavoisier, că corpurile simple sunt cele din care nu a fost posibil să se izoleze alte corpuri. Odată cu creația sistem periodic de elemente chimice Mendeleev elementele metalice și-au luat locul potrivit în ea.
Vezi și
notițe
referințe
- S.P. Vukolov: // Dicționar enciclopedic Brockhaus și Efron : În 86 de volume (82 de volume și 4 suplimentare). - SPb. , 1890-1907. (partea istorică)
| Tabelul periodic | |
|---|---|
| Dmitri Ivanovici Mendeleev · Legea periodică · Grupuri de articole | |
| formate | scurt · Pe blocuri · extins · Extins · Configurații electronice · electronegativitate · alternativă · Izotopii elementelor |
| Liste de articole pe | nume ·
etimologie (în onoarea locurilor, în onoarea descoperitorilor) · Ora de deschidere Stare de oxidare · prevalența (în om) · Stabilitatea izotopilor · |


