21.07.2019
Interacțiunea alcalinilor cu acizii. Hidroxid de sodiu
sodiu se referă la metale alcaline și este distribuit în subgrupul principal al primului grup de PSE-uri. DI Mendeleev. La nivelul energiei externe a atomului său, la o distanță relativ mare de nucleu, se află un electron, care atomi metale alcaline ele cedează destul de ușor, transformându-se în cationi singuri încărcați; acest lucru explică activitatea chimică foarte ridicată a metalelor alcaline.
O metodă obișnuită pentru producerea alcalinei este electroliza sărurilor topite ale acestora (de obicei cloruri).
Sodiul, ca metal alcalin, se caracterizează prin duritate redusă, densitate mică și puncte de topire reduse.
Sodiul, care interacționează cu oxigenul, formează în principal peroxid de sodiu
2 Na + O2 Na2O2
Reducerea peroxizilor și superperoxizilor cu un exces de metal alcalin poate produce oxid:
Na2O2 + 2 Na 2 Na2O
Oxizii de sodiu interacționează cu apa pentru a forma hidroxid: Na2O + H2O → 2 NaOH.
Peroxizii sunt complet hidrolizați de apă cu formarea alcalinilor: Na2O2 + 2 HOH → 2 NaOH + H2O2
Ca toate metalele alcaline, sodiul este un agent de reducere puternic și interacționează energetic cu multe non-metale (cu excepția azotului, iodului, carbonului și gazelor nobile):
Reacționează extrem de slab cu azotul într-o descărcare de strălucire, formând o substanță foarte instabilă - nitrura de sodiu
Interacționează cu acizii diluați ca un metal normal:
Cu acizi oxidanți concentrați, produsele de reducere sunt eliberate:
Hidroxid de sodiu NaOH (alcalin caustic) este o bază chimică puternică. În industrie, hidroxidul de sodiu este obținut prin metode chimice și electrochimice.
Metode de producție chimică:
Var, care constă în interacțiunea unei soluții de sodă cu lapte de var la o temperatură de aproximativ 80 ° C. Acest proces se numește caustificare; Trece prin reacție:
Na2C03 + Ca (OH) 2 → 2NaOH + CaCO3
Ferritic, care include două etape:
Na2C03 + Fe2O3 → 2NaFeО2 + CO2
2NaFeО 2 + xH 2 О \u003d 2NaOH + Fe 2 O 3 * xH 2 О
Electrochimic, hidroxidul de sodiu este obținut prin electroliza soluțiilor de halit (un mineral format în principal din clorură de sodiu NaCl) cu producerea simultană de hidrogen și clor. Acest proces poate fi reprezentat de formula totală:
2NaCl + 2H2O ± 2- → H2 + Cl2 + 2NaOH
Hidroxidul de sodiu reacționează:
1) neutralizare:
NaOH + HCl → NaCl + H20
2) schimb cu săruri în soluție:
2NaOH + CuSO4 → Cu (OH) 2 ↓ + Na2S04
3) reacționează cu nemetalele
3S + 6NaOH → 2Na 2 S + Na2S03 + 3H2O
4) reacționează cu metalele
2Al + 2NaOH + 6H2 O → 3H 2 + 2Na
Hidroxidul de sodiu este utilizat pe scară largă în diverse industrii, de exemplu, la gătitul celulelor, pentru saponificarea grăsimilor la fabricarea săpunului; ca catalizator pentru reacțiile chimice în producția de motorină etc.
Carbonat de sodiuse produce fie sub formă de Na 2 CO 3 (cenușă de sodă), fie sub formă de hidrat cristalin Na2 CO 3 * 10H 2 O (sodă cristalină), fie sub formă de bicarbonat de NaHCO 3 (sodă potabilă).
Soda este produsă cel mai adesea prin metoda clorurii de amoniac, pe baza reacției:
NaCl + NH4 HCO3 ↔ NaHCO 3 + NH4Cl
Multe industrii consumă carbonate de sodiu: produse chimice, săpun, pulpă și hârtie, materiale textile, alimente etc.
Proprietăți fizice
Hidroxid de sodiu
Termodinamica soluțiilor
Δ H 0 dizolvare pentru o soluție apoasă diluată infinit de -44,45 kJ / mol.
Monohidratul (sângoniu rombic) cristalizează din soluții apoase la 12,3 - 61,8 ° C, punctul de topire 65,1 ° C; densitate 1.829 g / cm³; ΔH 0 arr −734,96 kJ / mol), în intervalul de la -28 la -24 ° С - heptahidrat, de la -24 la -17,7 ° С - pentahidrat, de la -17,7 până la -5,4 ° С - tetrahidrat ( α-modificare), de la -5,4 până la 12,3 ° C. Solubilitatea în metanol este de 23,6 g / l (t \u003d 28 ° C), în etanol 14,7 g / l (t \u003d 28 ° C). NaOH · 3,5H 2 O (punctul de topire 15,5 ° C);
Proprietăți chimice
(în general, o astfel de reacție poate fi reprezentată printr-o ecuație ionică simplă, reacția continuă cu eliberarea de căldură (reacție exotermă): OH - + H3O + → 2H2 O.)
- cu oxizi amfoterici care au atât proprietăți de bază cât și acide și capacitatea de a reacționa cu alcaline, ca și în cazul aliajelor solide:
ZnO + 2NaOH → Na2 ZnO2 + H2O
deci cu soluții:
ZnO + 2NaOH (soluție) + H2 O → Na2 (soluție)+ H2
(Anionul rezultat se numește ionul tetrahidroxozincat, iar sarea care poate fi izolată din soluție se numește tetrahidroxozincat de sodiu. Hidroxidul de sodiu intră în reacții similare cu alți oxizi amfoterici.)
- cu oxizi de acid - cu formarea sărurilor; această proprietate este folosită pentru curățarea emisiilor industriale de gazele acide (de exemplu: CO 2, SO2 și H 2 S):
2Na + + 2OH - + Cu 2+ + SO 4 2- → Cu (OH) 2 ↓ + Na 2 SO 4
Hidroxidul de sodiu este utilizat pentru a precipita hidroxizii metalici. De exemplu, un hidroxid de aluminiu asemănător unui gel este produs prin acționarea cu hidroxid de sodiu asupra sulfatului de aluminiu într-o soluție apoasă. Se folosește, în special, pentru purificarea apei din suspensii fine.
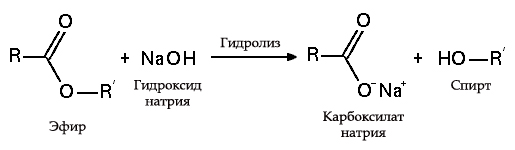
Hidroliza esterilor
- cu grăsimi (saponificare), o astfel de reacție este ireversibilă, deoarece acidul rezultat cu alcali formează săpun și glicerină. Glicerina este extrasă ulterior din plăcuțele de săpun prin evaporarea în vid și purificarea suplimentară a distilării produselor obținute. Această metodă de obținere a săpunului este cunoscută în Orientul Mijlociu încă din secolul al VII-lea:
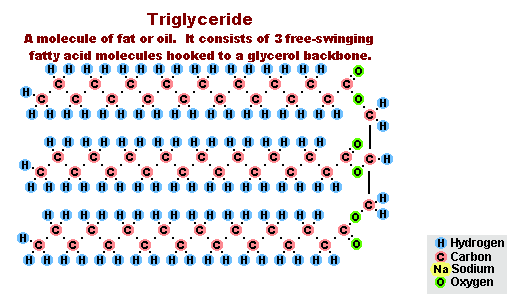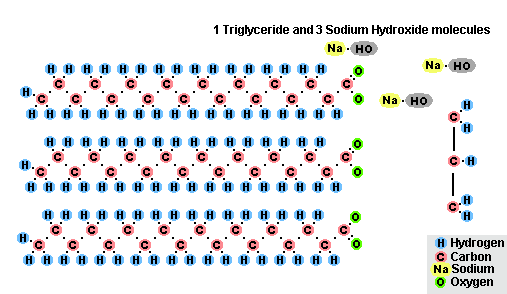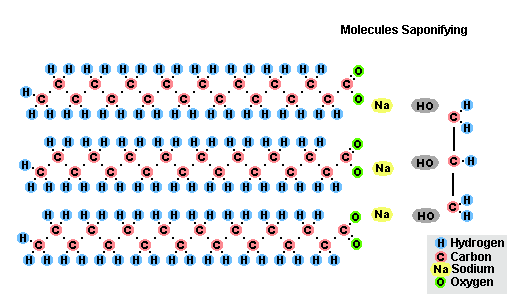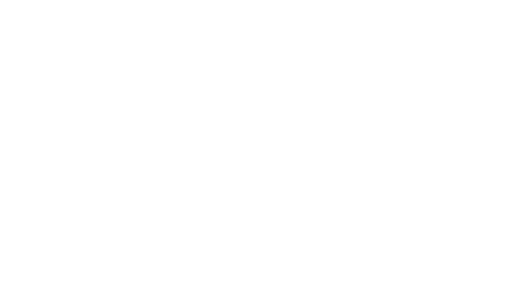
Procesul de saponificare a grăsimilor
Ca urmare a interacțiunii grăsimilor cu hidroxidul de sodiu, se obțin săpunuri solide (sunt utilizate pentru a produce săpunuri cu bare), iar cu hidroxid de potasiu, sunt fie săpunuri solide, fie lichide, în funcție de compoziția grăsimii.
HO-CH2-CH2 OH + 2NaOH → NaO-CH2 -CH2 -ONa + 2H 2 O
2NaCl + 2H 2 O \u003d H2 + Cl2 + 2NaOH,În prezent, alcalii caustici și clorul sunt produși prin trei metode electrochimice. Două dintre ele sunt electroliza cu un catod solid de azbest sau polimer (metode de producție cu membrană și membrană), a treia este electroliza cu un catod lichid (metoda de producție a mercurului). Printre metodele de producție electrochimice, cea mai ușoară și mai convenabilă cale este electroliza cu un catod cu mercur, însă această metodă provoacă daune semnificative mediului ca urmare a evaporării și scurgerii de mercur metalic. Metoda de producere a membranelor este cea mai eficientă, cea mai puțin eficientă din punct de vedere energetic și cea mai ecologică, dar și cea mai capricioasă, în special, necesită materii prime de puritate mai mare.
Alcaliul caustic obținut prin electroliză cu un catod cu mercur lichid este mult mai curat decât cel obținut prin metoda diafragmei. Pentru unele industrii acest lucru este important. Deci, la producerea de fibre artificiale, se poate utiliza numai caustic obținut prin electroliză cu un catod cu mercur lichid. În practica mondială, se folosesc toate cele trei metode de producere a clorului și causticului, cu o tendință clară spre creșterea proporției de electroliză a membranei. În Rusia, aproximativ 35% din totalul caustic produs este produs prin electroliză cu un catod cu mercur și 65% prin electroliză cu un catod solid (metode cu membrană și membrană).
Eficiența procesului de producție se calculează nu numai prin randamentul de hidroxid de sodiu, ci și prin randamentul de clor și hidrogen obținut prin electroliză, raportul dintre clor și hidroxid de sodiu la ieșire este 100/110, reacția se desfășoară în următoarele raporturi:
1,8 NaCl +0,5 H 2 O + 2,8 MJ \u003d 1,00 Cl2 + 1,10 NaOH + 0,03 H 2,Principalii indicatori ai diferitelor metode de producție sunt prezentați în tabel:
| Indicatorul pentru 1 tonă de NaOH | Metoda Mercur | Metoda F-stop | Metoda membranei |
|---|---|---|---|
| Randament clor% | 97 | 96 | 98,5 |
| Electricitate (kWh) | 3 150 | 3 260 | 2 520 |
| Concentrație de NaOH | 50 | 12 | 35 |
| Puritatea clorului | 99,2 | 98 | 99,3 |
| Puritatea hidrogenului | 99,9 | 99,9 | 99,9 |
| Fracția în masă de O2 în clor,% | 0,1 | 1-2 | 0,3 |
| Fracția de masă a cl - în NaOH,% | 0,003 | 1-1,2 | 0,005 |
Diagrama de flux a procesului de catod solid
Metoda F-stop - Cavitatea electrolizantului catodului solid este împărțită de un sept poros - diafragma - în spațiul catodului și anodului, unde sunt localizate respectiv catodul și anodul electrolizantului. Prin urmare, un astfel de electrolizor este adesea numit diafragmă, iar metoda de producție se numește electroliză cu diafragmă. Un flux de anoliti saturat intră continuu în spațiul anodic al electrolizatorului cu diafragmă. Ca urmare a procesului electrochimic, clorul este eliberat la anod datorită descompunerii halitului, iar hidrogenul la catod datorită descompunerii apei. Clorul și hidrogenul sunt eliminate din celulă separat, fără a se amesteca:
2Cl - - 2 e \u003d CI2, H2O - 2 e - 1/2 O2 \u003d H2.
În acest caz, zona catodului este îmbogățită cu hidroxid de sodiu. Soluția din zona catodului, numită alcalin electrolitic, care conține anolit nedecompus și hidroxid de sodiu, este îndepărtată continuu din electrolizor. În următoarea etapă, alcalinul electrolitic este evaporat și conținutul de NaOH din acesta este ajustat la 42-50% în conformitate cu standardul. Halita și sulfatul de sodiu se precipită cu concentrația crescândă de hidroxid de sodiu. O soluție de alcalin caustic este decantată din precipitat și transferată ca produs finit în depozit sau în stadiul de evaporare pentru a obține un produs solid, urmată de topire, scalare sau granulare. Halita cristalină (sare inversă) este revenită în electroliză, pregătind așa-numita saramură inversă din ea. Sulfatul este extras din acesta pentru a evita acumularea de sulfat în soluții înainte de a pregăti saramura inversă. Pierderea anolitului este compensată prin adăugarea de saramură proaspătă, obținută prin scurgerea subterană a straturilor de sare sau prin dizolvarea halitului solid. Saramură proaspătă înainte de a o amesteca cu saramură inversă, se curăță de suspensii mecanice și o parte semnificativă de ioni de calciu și magneziu. Clorul rezultat este separat de vaporii de apă, comprimat și alimentat fie pentru producerea de produse care conțin clor, fie pentru lichefiere.
Metoda membranei - asemănător diafragmei, dar spațiile anodice și catodice sunt separate de o membrană schimbătoare de cationi. Electroliza cu membrană oferă cea mai curată caustică.
Schema tehnologică electroliza.Etapa tehnologică principală este electroliza, aparatul principal este o baie electrolitică, care constă dintr-un electrolizator, un decompozitor și o pompă de mercur, interconectate prin comunicații. Într-o baie electrolitică, mercurul circulă sub acțiunea unei pompe de mercur, trecând printr-un electrolizor și un decompozitor. Catodul electrolizantului este un flux de mercur. Anodi - grafit sau uzură scăzută. Împreună cu mercurul, un flux de anoliti - o soluție de halit - curge continuu prin electrolizor. Ca urmare a descompunerii electrochimice a halitului, pe anod se formează ioni Cl și se eliberează clor:
2 Cl - - 2 e \u003d Cl2 0,
care este evacuat din electrolizor, iar la catodul de mercur se formează o soluție slabă de sodiu în mercur, așa-numitul amalgam:
Na + + e \u003d Na 0 nNa + + nHg - \u003d Na + HgAmalgamul curge continuu de la celulă la descompunător. Bine curățată de impurități, apa este, de asemenea, furnizată în mod continuu decompozitorului. În ea, amalgamul de sodiu, ca urmare a unui proces electrochimic spontan, este descompus aproape complet de apă cu formarea de mercur, o soluție de caustic și hidrogen:
Na + Hg + H2 0 \u003d NaOH + 1 / 2H 2 + HgSoluția caustică obținută în acest mod, care este un produs comercial, nu conține impurități halite dăunătoare în producerea viscozei. Mercurul este eliberat aproape complet de amalgamul de sodiu și returnat în celulă. Hidrogenul este evacuat pentru tratament. Anolitul care iese din electrolizor este saturat cu halit proaspăt, impuritățile introduse cu acesta sunt îndepărtate din acesta, precum și spălate din anoduri și materiale structurale și revenite la electroliză. Înainte de saturație, clorul dizolvat în el este extras din anolit într-un proces în două sau trei etape.
Metode de obținere a laboratorului
În laborator, hidroxidul de sodiu este obținut prin metode chimice mai istorice decât practice.
Metoda calcaroasă Obținerea hidroxidului de sodiu este interacțiunea unei soluții de sodă cu lapte de var la o temperatură de aproximativ 80 ° C. Acest proces se numește caustificare; Este descris prin reacție:
Na2C03 + Ca (OH) 2 \u003d 2NaOH + CaC03Ca urmare a reacției, se formează o soluție de hidroxid de sodiu și un precipitat de carbonat de calciu. Carbonatul de calciu este separat de soluție, care este evaporat pentru a obține un produs topit conținând aproximativ 92% NaOH. NaOH topit este turnat în butoaie de fier, unde se solidifică.
Metoda feritică descris de două reacții:
Na2C0 3 + Fe 2 0 3 \u003d Na 2 0 Fe 2 0 3 + C0 2 (1) Na2 0 Fe 2 0 3 -f H2 0 \u003d 2 NaOH + Fe 2 O 3 (2)(1) - procesul de sinterizare a cenușei de sodiu cu oxid de fier la o temperatură de 1100-1200 ° C. În acest caz, se formează specii de ferită de sodiu și se eliberează dioxid de carbon. În continuare, tortul este tratat (lexiat) cu apă conform reacției (2); se obține o soluție de hidroxid de sodiu și un precipitat de Fe2O3, care, după separarea lui de soluție, revine la proces. Soluția conține NaOH aproximativ 400 g / l. Se evaporă pentru a obține un produs care conține aproximativ 92% NaOH.
Metodele chimice de producere a hidroxidului de sodiu au dezavantaje semnificative: o cantitate mare de combustibil este consumată, soda caustică produsă este contaminată cu impurități, iar întreținerea aparatului este laborioasă. În prezent, aceste metode sunt înlocuite aproape complet de metoda de producere electrochimică.
Piața de sodă caustică
Producția mondială de sodă caustică, 2005| producător | Volumul producției, milioane de tone | Ponderea în producția mondială |
|---|---|---|
| DOW | 6.363 | 11.1 |
| Compania Chimică Occidentală | 2.552 | 4.4 |
| Materiale plastice Formosa | 2.016 | 3.5 |
| PPG | 1.684 | 2.9 |
| Bayer | 1.507 | 2.6 |
| Akzo nobel | 1.157 | 2.0 |
| Tosoh | 1.110 | 1.9 |
| Arkema | 1.049 | 1.8 |
| Olin | 0.970 | 1.7 |
| Rusia | 1.290 | 2.24 |
| China | 9.138 | 15.88 |
| alte | 27.559 | 47,87 |
| total: | 57,541 | 100 |
TP - mercur solid (flăcător);
TD - diafragmă solidă (topită);
PP - soluție de mercur;
PX - soluție chimică;
RD - soluție de diafragmă.
| Numele indicatorului | TR OKP 21 3211 0400 | TD OKP 21 3212 0200 | RR OKP 21 3211 0100 | PX 1 grad OKP 21 3221 0530 | PX 2 grad OKP 21 3221 0540 | RD Gradul superior OKP 21 3212 0320 | RD clasa I OKP 21 3212 0330 |
|---|---|---|---|---|---|---|---|
| apariție | Masă albă scalpată. Se admite o colorare ușoară | Masa topită este albă. Se admite o colorare ușoară | Lichid transparent incolor | Lichid incolor sau colorat. Precipitatul cristalizat este permis | Lichid incolor sau colorat. Precipitatul cristalizat este permis | Lichid incolor sau colorat. Precipitatul cristalizat este permis | |
| Fracția în masă a hidroxidului de sodiu,%, nu mai puțin | 98,5 | 94,0 | 42,0 | 45,5 | 43,0 | 46,0 | 44,0 |
| Denumirea întreprinderii | 2005 mii tone | 2006 mii tone | cota in 2005% | cota in 2006% |
|---|---|---|---|---|
| OJSC Caustic Sterlitamak | 239 | 249 | 20 | 20 |
| OJSC „Caustic”, Volgograd | 210 | 216 | 18 | 18 |
| Sayanskkhimplast OJSC | 129 | 111 | 11 | 9 |
| SRL Usoliekhimprom | 84 | 99 | 7 | 8 |
| Sibur-Neftekhim OJSC | 87 | 92 | 7 | 8 |
| OJSC "Khimprom", Cheboksary | 82 | 92 | 7 | 8 |
| VOAO Khimprom, Volgograd | 87 | 90 | 7 | 7 |
| CJSC Ilimkhimprom | 70 | 84 | 6 | 7 |
| KCHKhK OJSC | 81 | 79 | 7 | 6 |
| NAC "NITROGEN" | 73 | 61 | 6 | 5 |
| Khimprom OJSC, Kemerovo | 42 | 44 | 4 | 4 |
| total: | 1184 | 1217 | 100 | 100 |
| Denumirea întreprinderii | 2005 tone | 2006 tone | cota in 2005% | cota in 2006% |
|---|---|---|---|---|
| OJSC „Caustic”, Volgograd | 67504 | 63510 | 62 | 60 |
| OJSC Caustic Sterlitamak | 34105 | 34761 | 31 | 33 |
| Sibur-Neftekhim OJSC | 1279 | 833 | 1 | 1 |
| VOAO Khimprom, Volgograd | 5768 | 7115 | 5 | 7 |
| total: | 108565 | 106219 | 100 | 100 |
cerere
biodiesel

Lutefisk de cod la sărbătoarea Zilei Constituției Norvegiei

Bagel german
Soda caustica Este utilizat într-o mare varietate de industrii și pentru nevoile interne:
- Caustic este utilizat în industria de celuloză și hârtie pentru delimitarea (reacției Kraft) a celulozei, la producerea de hârtie, carton, fibre artificiale, plăci de fibre.,
- Pentru saponificarea grăsimilor cu producerea de săpun, șampon și alți detergenți. În antichitate, s-a adăugat cenușă în apă în timpul spălării și, se pare, gospodinele au observat că, dacă cenușa conține grăsime care a intrat în vatră în timpul gătitului, vasele sunt spălate bine. Profesia de producător de săpun (saponarius) a fost menționată pentru prima dată în jurul anului 385 d.Hr. e. Theodore Priscianus. Arabii produc săpun din uleiuri și sifon încă din secolul al VII-lea; astăzi, săpunurile sunt produse în același mod ca acum 10 secole.
- industrii chimice - pentru a neutraliza acizii și oxizii de acid, ca reactiv sau costume de vinil sau cauciucate.
MAC de hidroxid de sodiu în aer 0,5 mg / m³.
literatură
- Tehnologie chimică generală. Ed. I. P. Mukhlenova. Manual pentru specialități chimice și tehnologice ale universităților. - M .: Școala superioară.
- Fundamentele chimiei generale, vol. 3, B. V. Nekrasov. - M.: Chimie, 1970.
- Tehnologie chimică generală. Furmer I.E., Zaitsev V.N. - M.: Școala Superioară, 1978.
- Ordinul Ministerului Sănătății din Federația Rusă din 28 martie 2003 N 126 „La aprobarea Listei factorilor nocivi de producție sub influența cărora se recomandă utilizarea laptelui sau a altor produse alimentare echivalente în scop preventiv”.
- Decretul medicului șef sanitar de stat al Federației Ruse din 4 aprilie 2003 N 32 „Cu privire la aplicarea normelor sanitare pentru organizarea transportului feroviar de mărfuri. SP 2.5.1250-03 ".
- Legea federală din 21 iulie 1997 N 116-ФЗ „privind siguranța industrială a instalațiilor de producție periculoase” (modificată la 18 decembrie 2006).
- Ordinul Ministerului Resurselor Naturale al Federației Ruse din 2 decembrie 2002 N 786 „Cu privire la aprobarea catalogului federal de clasificare a deșeurilor” (modificat și completat la 30 iulie 2003).
- Decretul Comitetului de Stat al Muncii din URSS din 10.25.1974 N 298 / P-22 „La aprobarea listei de industrii, magazine, profesii și funcții cu condiții de muncă dăunătoare, muncă care oferă dreptul la concediu suplimentar și la o durată de muncă scurtată” (modificată la 29 mai 1991 ).
- Decretul Ministerului Muncii din Rusia din 22 iulie 1999 N 26 „Cu privire la aprobarea standardelor standard ale industriei pentru eliberarea gratuită a îmbrăcămintei speciale, a încălțămintei speciale și a altor echipamente de protecție personală pentru lucrătorii din industria chimică”
- Rezoluția medicului șef sanitar de stat din Federația Rusă din 30.05.2003 N 116 privind legiferarea GN 2.1.6.1339-03 „Niveluri indicative de expunere sigură (SEC) a poluanților în aerul atmosferic al zonelor populate.” (Modificat la 3 noiembrie 2005). Dicționar ilustrat enciclopedic
HIDROXID DE SODIU - (sodă caustică, sodă caustică, caustică) Substanță cristalină solidă incoloră NaOH, densitate 2130 kg m. t \u003d 320 ° C; atunci când este dizolvată în apă, se eliberează o cantitate mare de căldură; efect distructiv asupra pielii, țesuturilor, hârtiei, periculoase ... ... Enciclopedie politehnică mare
- (sodă caustică, sodă caustică), NaOH, bază puternică (alcalin). Cristale incolore (masă opacă albă a produsului tehnic). Igroscopic, solubil în apă, eliberând o cantitate mare de căldură. Primiți prin electroliză o soluție ... Dicționar enciclopedic
hidroxid de sodiu - natrio hidroksidas statusas T sritis chemija formulė NaOH atitikmenys: angl. soda caustica; hidroxid de sodiu rus. caustice; soda caustica; hidroxid de sodiu; hidroxid de sodiu ryšiai: sinonime - natrio šarmas sinonimas - sodiu kaustinė ... Chemijos terminų aiškinamasis žodynas
- (sodă caustică, sodă caustică), NaOH, bază puternică (alcalin). Bestsv. cristale (tehnologie. masă opacă albă a produsului). Igroscopic, solubil în apă, eliberând o cantitate mare de căldură. Primiți prin electroliză o soluție de clorură de sodiu ... Istoria naturală. Dicționar enciclopedic
- (sodă caustică) NaOH, incolor. cristale; până la 299 ° C rombic este stabil. modificare (a \u003d 0,33994 nm, c \u003d 1,1377 nm), mai mare decât 299 o С monoclinic; DH0 tranziție polimorfă 5,85 kJ / mol; t. pl. 323 ° C, t. 1403 ° C; strâns. 2,02 g / cm3; ... Enciclopedia chimică
Soda caustica, caustica, cristalina incolora NaOH. masa, strâns. 2130 kg / m3, t Pl 320 ° С, solubilitate în apă 52,2% (la 20 ° С). Baza puternică, dăunătoare țesutului animal; este deosebit de periculos să obțineți picături de N. în ochi ... ... Mare dicționar politehnic enciclopedic
Alcal puternic, utilizat pe scară largă ca agent de curățare. Când hidroxidul de sodiu intră pe suprafața pielii, provoacă o arsură chimică severă; în acest caz, spălați imediat zona afectată cu o cantitate mare de piele ... ... Termeni medicali
HIDROXID DE SODIU, SODA CAUSTICĂ - (sodă caustică) alcalin puternic, utilizat pe scară largă ca agent de curățare. Când hidroxidul de sodiu intră pe suprafața pielii, provoacă o arsură chimică severă; în acest caz, spălați imediat zona afectată a pielii ... ... Dicționar explicativ de medicină
Atât hidroxidul de sodiu, cât și alți alcali, denumirea de „alcali caustici” se datorează capacității de a coroda pielea, hârtia, sticla și de a provoca arsuri severe. Până în secolul al XVII-lea, alcalin (Fr. alcaliu) au fost, de asemenea, numite carbonați de sodiu și potasiu. În limba franceză, omul de știință A. L. Duhamel du Monceau distinge pentru prima dată între aceste substanțe: hidroxidul de sodiu a devenit cunoscut sub formă de sodă caustică, carbonat de sodiu sub formă de cenușă de sodă (din planta Salsola Soda, din care a fost extrasă cenușă) și carbonat de potasiu sub formă de potasă. În prezent, soda este numită săruri de sodiu ale acidului carbonic. În engleză și franceză, cuvântul sodiu înseamnă sodiu, potasiu - potasiu.
Proprietăți fizice
Hidroxid de sodiu
Termodinamica soluțiilor
Δ H 0 dizolvare pentru o soluție apoasă diluată infinit de -44,45 kJ / mol.
Monohidratul (sângoniu rombic) cristalizează din soluții apoase la 12,3 - 61,8 ° C, punctul de topire 65,1 ° C; densitate 1.829 g / cm³; ΔH 0 arr −734,96 kJ / mol), în intervalul de la -28 la -24 ° С - heptahidrat, de la -24 la -17,7 ° С - pentahidrat, de la -17,7 până la -5,4 ° С - tetrahidrat ( α-modificare), de la -5,4 până la 12,3 ° C. Solubilitatea în metanol este de 23,6 g / l (t \u003d 28 ° C), în etanol 14,7 g / l (t \u003d 28 ° C). NaOH · 3,5H 2 O (punctul de topire 15,5 ° C);
Proprietăți chimice
(în general, o astfel de reacție poate fi reprezentată printr-o ecuație ionică simplă, reacția continuă cu eliberarea de căldură (reacție exotermă): OH - + H3O + → 2H2 O.)
- cu oxizi amfoterici care au atât proprietăți de bază cât și acide și capacitatea de a reacționa cu alcaline, ca și în cazul aliajelor solide:
ZnO + 2NaOH → Na2 ZnO2 + H2O
deci cu soluții:
ZnO + 2NaOH (soluție) + H2 O → Na2 (soluție)+ H2
(Anionul rezultat se numește ionul tetrahidroxozincat, iar sarea care poate fi izolată din soluție se numește tetrahidroxozincat de sodiu. Hidroxidul de sodiu intră în reacții similare cu alți oxizi amfoterici.)
- cu oxizi de acid - cu formarea sărurilor; această proprietate este folosită pentru curățarea emisiilor industriale de gazele acide (de exemplu: CO 2, SO2 și H 2 S):
2Na + + 2OH - + Cu 2+ + SO 4 2- → Cu (OH) 2 ↓ + Na 2 SO 4
Hidroxidul de sodiu este utilizat pentru a precipita hidroxizii metalici. De exemplu, un hidroxid de aluminiu asemănător unui gel este produs prin acționarea cu hidroxid de sodiu asupra sulfatului de aluminiu într-o soluție apoasă. Se folosește, în special, pentru purificarea apei din suspensii fine.

Hidroliza esterilor
- cu grăsimi (saponificare), o astfel de reacție este ireversibilă, deoarece acidul rezultat cu alcali formează săpun și glicerină. Glicerina este extrasă ulterior din plăcuțele de săpun prin evaporarea în vid și purificarea suplimentară a distilării produselor obținute. Această metodă de obținere a săpunului este cunoscută în Orientul Mijlociu încă din secolul al VII-lea:

Procesul de saponificare a grăsimilor
Ca urmare a interacțiunii grăsimilor cu hidroxidul de sodiu, se obțin săpunuri solide (sunt utilizate pentru a produce săpunuri cu bare), iar cu hidroxid de potasiu, sunt fie săpunuri solide, fie lichide, în funcție de compoziția grăsimii.
HO-CH2-CH2 OH + 2NaOH → NaO-CH2 -CH2 -ONa + 2H 2 O
2NaCl + 2H 2 O \u003d H2 + Cl2 + 2NaOH,În prezent, alcalii caustici și clorul sunt produși prin trei metode electrochimice. Două dintre ele sunt electroliza cu un catod solid de azbest sau polimer (metode de producție cu membrană și membrană), a treia este electroliza cu un catod lichid (metoda de producție a mercurului). Printre metodele de producție electrochimice, cea mai ușoară și mai convenabilă cale este electroliza cu un catod cu mercur, însă această metodă provoacă daune semnificative mediului ca urmare a evaporării și scurgerii de mercur metalic. Metoda de producere a membranelor este cea mai eficientă, cea mai puțin eficientă din punct de vedere energetic și cea mai ecologică, dar și cea mai capricioasă, în special, necesită materii prime de puritate mai mare.
Alcaliul caustic obținut prin electroliză cu un catod cu mercur lichid este mult mai curat decât cel obținut prin metoda diafragmei. Pentru unele industrii acest lucru este important. Deci, la producerea de fibre artificiale, se poate utiliza numai caustic obținut prin electroliză cu un catod cu mercur lichid. În practica mondială, se folosesc toate cele trei metode de producere a clorului și causticului, cu o tendință clară spre creșterea proporției de electroliză a membranei. În Rusia, aproximativ 35% din totalul caustic produs este produs prin electroliză cu un catod cu mercur și 65% prin electroliză cu un catod solid (metode cu membrană și membrană).
Eficiența procesului de producție se calculează nu numai prin randamentul de hidroxid de sodiu, ci și prin randamentul de clor și hidrogen obținut prin electroliză, raportul dintre clor și hidroxid de sodiu la ieșire este 100/110, reacția se desfășoară în următoarele raporturi:
1,8 NaCl +0,5 H 2 O + 2,8 MJ \u003d 1,00 Cl2 + 1,10 NaOH + 0,03 H 2,Principalii indicatori ai diferitelor metode de producție sunt prezentați în tabel:
| Indicatorul pentru 1 tonă de NaOH | Metoda Mercur | Metoda F-stop | Metoda membranei |
|---|---|---|---|
| Randament clor% | 97 | 96 | 98,5 |
| Electricitate (kWh) | 3 150 | 3 260 | 2 520 |
| Concentrație de NaOH | 50 | 12 | 35 |
| Puritatea clorului | 99,2 | 98 | 99,3 |
| Puritatea hidrogenului | 99,9 | 99,9 | 99,9 |
| Fracția în masă de O2 în clor,% | 0,1 | 1-2 | 0,3 |
| Fracția de masă a cl - în NaOH,% | 0,003 | 1-1,2 | 0,005 |
Diagrama de flux a procesului de catod solid
Metoda F-stop - Cavitatea electrolizantului catodului solid este împărțită de un sept poros - diafragma - în spațiul catodului și anodului, unde sunt localizate respectiv catodul și anodul electrolizantului. Prin urmare, un astfel de electrolizor este adesea numit diafragmă, iar metoda de producție se numește electroliză cu diafragmă. Un flux de anoliti saturat intră continuu în spațiul anodic al electrolizatorului cu diafragmă. Ca urmare a procesului electrochimic, clorul este eliberat la anod datorită descompunerii halitului, iar hidrogenul la catod datorită descompunerii apei. Clorul și hidrogenul sunt eliminate din celulă separat, fără a se amesteca:
2Cl - - 2 e \u003d CI2, H2O - 2 e - 1/2 O2 \u003d H2.
În acest caz, zona catodului este îmbogățită cu hidroxid de sodiu. Soluția din zona catodului, numită alcalin electrolitic, care conține anolit nedecompus și hidroxid de sodiu, este îndepărtată continuu din electrolizor. În următoarea etapă, alcalinul electrolitic este evaporat și conținutul de NaOH din acesta este ajustat la 42-50% în conformitate cu standardul. Halita și sulfatul de sodiu se precipită cu concentrația crescândă de hidroxid de sodiu. O soluție de alcalin caustic este decantată din precipitat și transferată ca produs finit în depozit sau în stadiul de evaporare pentru a obține un produs solid, urmată de topire, scalare sau granulare. Halita cristalină (sare inversă) este revenită în electroliză, pregătind așa-numita saramură inversă din ea. Sulfatul este extras din acesta pentru a evita acumularea de sulfat în soluții înainte de a pregăti saramura inversă. Pierderea anolitului este compensată prin adăugarea de saramură proaspătă, obținută prin scurgerea subterană a straturilor de sare sau prin dizolvarea halitului solid. Saramură proaspătă înainte de a o amesteca cu saramură inversă, se curăță de suspensii mecanice și o parte semnificativă de ioni de calciu și magneziu. Clorul rezultat este separat de vaporii de apă, comprimat și alimentat fie pentru producerea de produse care conțin clor, fie pentru lichefiere.
Metoda membranei - asemănător diafragmei, dar spațiile anodice și catodice sunt separate de o membrană schimbătoare de cationi. Electroliza cu membrană oferă cea mai curată caustică.
Schema tehnologică electroliza.Etapa tehnologică principală este electroliza, aparatul principal este o baie electrolitică, care constă dintr-un electrolizator, un decompozitor și o pompă de mercur, interconectate prin comunicații. Într-o baie electrolitică, mercurul circulă sub acțiunea unei pompe de mercur, trecând printr-un electrolizor și un decompozitor. Catodul electrolizantului este un flux de mercur. Anodi - grafit sau uzură scăzută. Împreună cu mercurul, un flux de anoliti - o soluție de halit - curge continuu prin electrolizor. Ca urmare a descompunerii electrochimice a halitului, pe anod se formează ioni Cl și se eliberează clor:
2 Cl - - 2 e \u003d Cl2 0,
care este evacuat din electrolizor, iar la catodul de mercur se formează o soluție slabă de sodiu în mercur, așa-numitul amalgam:
Na + + e \u003d Na 0 nNa + + nHg - \u003d Na + HgAmalgamul curge continuu de la celulă la descompunător. Bine curățată de impurități, apa este, de asemenea, furnizată în mod continuu decompozitorului. În ea, amalgamul de sodiu, ca urmare a unui proces electrochimic spontan, este descompus aproape complet de apă cu formarea de mercur, o soluție de caustic și hidrogen:
Na + Hg + H2 0 \u003d NaOH + 1 / 2H 2 + HgSoluția caustică obținută în acest mod, care este un produs comercial, nu conține impurități halite dăunătoare în producerea viscozei. Mercurul este eliberat aproape complet de amalgamul de sodiu și returnat în celulă. Hidrogenul este evacuat pentru tratament. Anolitul care iese din electrolizor este saturat cu halit proaspăt, impuritățile introduse cu acesta sunt îndepărtate din acesta, precum și spălate din anoduri și materiale structurale și revenite la electroliză. Înainte de saturație, clorul dizolvat în el este extras din anolit într-un proces în două sau trei etape.
Metode de obținere a laboratorului
În laborator, hidroxidul de sodiu este obținut prin metode chimice mai istorice decât practice.
Metoda calcaroasă Obținerea hidroxidului de sodiu este interacțiunea unei soluții de sodă cu lapte de var la o temperatură de aproximativ 80 ° C. Acest proces se numește caustificare; Este descris prin reacție:
Na2C03 + Ca (OH) 2 \u003d 2NaOH + CaC03Ca urmare a reacției, se formează o soluție de hidroxid de sodiu și un precipitat de carbonat de calciu. Carbonatul de calciu este separat de soluție, care este evaporat pentru a obține un produs topit conținând aproximativ 92% NaOH. NaOH topit este turnat în butoaie de fier, unde se solidifică.
Metoda feritică descris de două reacții:
Na2C0 3 + Fe 2 0 3 \u003d Na 2 0 Fe 2 0 3 + C0 2 (1) Na2 0 Fe 2 0 3 -f H2 0 \u003d 2 NaOH + Fe 2 O 3 (2)(1) - procesul de sinterizare a cenușei de sodiu cu oxid de fier la o temperatură de 1100-1200 ° C. În acest caz, se formează specii de ferită de sodiu și se eliberează dioxid de carbon. În continuare, tortul este tratat (lexiat) cu apă conform reacției (2); se obține o soluție de hidroxid de sodiu și un precipitat de Fe2O3, care, după separarea lui de soluție, revine la proces. Soluția conține NaOH aproximativ 400 g / l. Se evaporă pentru a obține un produs care conține aproximativ 92% NaOH.
Metodele chimice de producere a hidroxidului de sodiu au dezavantaje semnificative: o cantitate mare de combustibil este consumată, soda caustică produsă este contaminată cu impurități, iar întreținerea aparatului este laborioasă. În prezent, aceste metode sunt înlocuite aproape complet de metoda de producere electrochimică.
Piața de sodă caustică
Producția mondială de sodă caustică, 2005| producător | Volumul producției, milioane de tone | Ponderea în producția mondială |
|---|---|---|
| DOW | 6.363 | 11.1 |
| Compania Chimică Occidentală | 2.552 | 4.4 |
| Materiale plastice Formosa | 2.016 | 3.5 |
| PPG | 1.684 | 2.9 |
| Bayer | 1.507 | 2.6 |
| Akzo nobel | 1.157 | 2.0 |
| Tosoh | 1.110 | 1.9 |
| Arkema | 1.049 | 1.8 |
| Olin | 0.970 | 1.7 |
| Rusia | 1.290 | 2.24 |
| China | 9.138 | 15.88 |
| alte | 27.559 | 47,87 |
| total: | 57,541 | 100 |
TP - mercur solid (flăcător);
TD - diafragmă solidă (topită);
PP - soluție de mercur;
PX - soluție chimică;
RD - soluție de diafragmă.
| Numele indicatorului | TR OKP 21 3211 0400 | TD OKP 21 3212 0200 | RR OKP 21 3211 0100 | PX 1 grad OKP 21 3221 0530 | PX 2 grad OKP 21 3221 0540 | RD Gradul superior OKP 21 3212 0320 | RD clasa I OKP 21 3212 0330 |
|---|---|---|---|---|---|---|---|
| apariție | Masă albă scalpată. Se admite o colorare ușoară | Masa topită este albă. Se admite o colorare ușoară | Lichid transparent incolor | Lichid incolor sau colorat. Precipitatul cristalizat este permis | Lichid incolor sau colorat. Precipitatul cristalizat este permis | Lichid incolor sau colorat. Precipitatul cristalizat este permis | |
| Fracția în masă a hidroxidului de sodiu,%, nu mai puțin | 98,5 | 94,0 | 42,0 | 45,5 | 43,0 | 46,0 | 44,0 |
| Denumirea întreprinderii | 2005 mii tone | 2006 mii tone | cota in 2005% | cota in 2006% |
|---|---|---|---|---|
| OJSC Caustic Sterlitamak | 239 | 249 | 20 | 20 |
| OJSC „Caustic”, Volgograd | 210 | 216 | 18 | 18 |
| Sayanskkhimplast OJSC | 129 | 111 | 11 | 9 |
| SRL Usoliekhimprom | 84 | 99 | 7 | 8 |
| Sibur-Neftekhim OJSC | 87 | 92 | 7 | 8 |
| OJSC "Khimprom", Cheboksary | 82 | 92 | 7 | 8 |
| VOAO Khimprom, Volgograd | 87 | 90 | 7 | 7 |
| CJSC Ilimkhimprom | 70 | 84 | 6 | 7 |
| KCHKhK OJSC | 81 | 79 | 7 | 6 |
| NAC "NITROGEN" | 73 | 61 | 6 | 5 |
| Khimprom OJSC, Kemerovo | 42 | 44 | 4 | 4 |
| total: | 1184 | 1217 | 100 | 100 |
| Denumirea întreprinderii | 2005 tone | 2006 tone | cota in 2005% | cota in 2006% |
|---|---|---|---|---|
| OJSC „Caustic”, Volgograd | 67504 | 63510 | 62 | 60 |
| OJSC Caustic Sterlitamak | 34105 | 34761 | 31 | 33 |
| Sibur-Neftekhim OJSC | 1279 | 833 | 1 | 1 |
| VOAO Khimprom, Volgograd | 5768 | 7115 | 5 | 7 |
| total: | 108565 | 106219 | 100 | 100 |
cerere
biodiesel

Lutefisk de cod la sărbătoarea Zilei Constituției Norvegiei


