27.07.2019
1 metale alcaline Știi cum
Rezumat al unei lecții de chimie în clasa a 9-a pe această temă:
"Compuși ai metalelor alcaline și utilizarea lor."
goluri: Generalizarea și sistematizarea cunoștințelor despre metalele alcaline și compușii acestora; familiarizați-vă cu utilizarea acestor compuși în viața de zi cu zi și importanța lor în viața organismelor
Obiectivele lecției:
1. Pentru a asigura, în timpul lecției, asimilarea proprietăților chimice ale compușilor metalelor alcaline, utilizarea lor în viața și producția de zi cu zi, precum și importanța lor în viața organismelor.
Continuă să dezvolți abilități generale de reactiv educațional și chimic.
2. Formarea ideilor filozofice de bază ale relațiilor cauză-efect între fenomene, structura unui atom de metal alcalin - proprietățile unei substanțe simple - proprietățile compușilor metalelor alcaline și aplicarea lor bazată pe proprietăți.
3. Dezvoltați capacitatea de a compara, de a rezuma faptele studiate, de a vă exprima în mod logic gândurile când răspundeți. Dezvoltarea interesului cognitiv al copiilor școlari, folosind date despre aplicarea fenomenelor studiate în viață.
Tip de lecție: combinat - studiul materialelor noi folosind TIC.
echipament: manual, cretă, tablă, computer, proiector media, ecran, prezentare subiect de lecție, organigramele lecțiilor pentru studenți, substanțe chimice (soluții: hidroxid de sodiu, acid clorhidric, sulfat de cupru, hidroxid de zinc, fenolftaleină) și articole de sticlă de laborator (suport pentru epruvetă).
PROCEDURĂ
eu . Moment organizațional.
II . Învățarea de materiale noi.
1. Verificarea materialului studiat anterior pe tema „Metale alcaline”.
Ghici ghicitori:
1. De obicei se depozitează în kerosen, iar el fuge pe apă,
În natură, amintiți-vă acum,
Gratuit nu este prezent nicăieri
Este posibil să-l deschideți în săruri
Flăcările se îngălbenesc de la el
Și puteți obține din sare
Cum l-a obținut Davy.
Despre ce element vorbim? (Na)
2. Forțează puternic
Din umiditate - hidrogen pur,
O înlocuiește
Și tricotează ferm oxigenul.
Acest element din plante este ascuns
Prin culoare violet
Poate fi deschis în săruri.
Despre ce element vorbim? (K).
1. Ce metale am întâlnit în ultima lecție?
2. De ce se numesc asta?
3. Care este caracteristica comună în structura atomilor tuturor metalelor alcaline?
Încercare conexă: metale alcaline.
1. Nu se aplică metalelor alcaline: a) rubidiu; c) potasiu; b) cesiu; d) cupru.
2. Formula electronică) 2) 8) 8) 1 corespunde elementului: a) litiu; c) potasiu; b) sodiu;
3. Raza atomică a elementelor din grupa I a subgrupului principal, cu încărcare nucleară în creștere:
a) se modifică periodic; c) nu se schimbă; b) crește;
4. Metalele alcaline sunt foarte puternice:
a) proprietăți oxidante; c) reducerea proprietăților; b) proprietăți amfoterice;
5 .. Proprietățile fizice ale metalelor alcaline nu se aplică:
a) alb-argintiu; b) moale și ușor; d) refractar.
6. În interacțiunea elementelor din grupa I a subgrupului principal cu apa, se formează următoarele:
a) acid; b) alcalin și hidrogen este eliberat; d) sare.
7. Sodiul și potasiul sunt depozitate în kerosen deoarece:
a) au un miros înțepător; b) sunt oxidate cu ușurință în aer;
Autocontrol: fără erori - „5”, 1.2 erori - „4”, 3 erori - „3”, mai multe - „2”
Răspunsuri: 1 - 2 - în 3 - 4 - în 5 - 6 - 6 7 - b.
Autocontrol: fără erori - "5", 1.2 erori - "4", 3,4 erori - "3", mai multe - "2"
2. Actualizarea cunoștințelor.
Este posibil să întâlniți metale alcaline în formă liberă în natură? De ce?
Să presupunem, sub formă de compuși care pot fi găsiți în natură?
În natură, metalele alcaline se găsesc doar sub formă de compuși.
Na și K apar în mod natural sub formă de cloruri, sulfați, silicați etc.
Li, Rb, Cs fac parte din diferite minerale.
Fr se găsește în minereurile radioactive Ac și U.
Pe masă: obiecte care conțin compuși de metale alcaline (sodă, sare, baterii de degete, săpun) și pune o întrebare.
Privește aceste obiecte. Ce crezi că îi unește?
1 Ce este o legătură genetică?
2. Faceți o serie genetică de sodiu.
Na → Na2O → 2NaOH → Na2C03
3. Ce clase de compuși formează metale alcaline? Luați în considerare proprietățile lor.
În cursul explicării materialului și vizualizării diapozitivelor, elevii păstrează note conform planului, dezvăluind proprietățile și aplicațiile.
Oxizi de metale alcaline
tare, alb, ușor solubil.
b) proprietăți chimice; Elevii scriu într-un caiet: oxizii de metale alcaline sunt oxizi de bază tipici. Ca toate oxizii de bază, oxizii de metale alcaline reacționează cu apa, cu oxizii de acid, cu acizii.
Tipii de pe tablă și din caiet notează ecuațiile reacțiilor chimice folosind oxid de sodiu ca exemplu:
Na2O + H2O → 2NaOH;
Na2O + CO2 → Na2C03;
Na2O + H2 CO3 → Na2C03 + H2O
Hidroxizi de metale alcaline
.
a) proprietăți fizice; Studenții scriu în caiet proprietățile: țesături și hârtie dure, albe, bine solubile, stabile termic, corodează.
b) proprietățile chimice
Instruire de siguranță la efectuarea lucrărilor de laborator.
Proprietățile chimice ale hidroxidului de sodiu.
Scop: a demonstra experimental proprietățile chimice ale metalelor alcaline folosind hidroxid ca exemplu sodiu.
Manual de instrucțiuni
Turnați hidroxid de sodiu într-un tub curat, adăugați câteva picături de fenolftaleină. Ce observi?
Se adaugă soluție de acid clorhidric în același tub. Ce observi? Scrieți ecuația de reacție.
NaOH + HCl → NaCl + H 2 O Tipurile de pe tablă și din caiet notează ecuațiile de reacție chimică sub formă ionică.
Turnați hidroxid de sodiu într-un tub curat și adăugați soluție de sulfat de cupru. Ce observi? Scrieți ecuația de reacție.
2NaOH + CuSO 4 → Na 2 SO 4 + Cu (OH) 2 Băieții de pe tablă și din caiet notează ecuațiile de reacție chimică în formă ionică.
Faceți o concluzie despre proprietățile chimice ale hidroxizilor de metale alcaline.
Hidroxizii de metale alcaline reacționează cu acizii, sărurile) - diapozitivul nr. 5.
Hidroxid de sodiu - NaOH - sodă caustică, sodă caustică, caustică.
Hidroxid de potasiu - KOH - hidroxid de potasiu.
NaOH și KOH - alcaline caustice, țesături corodate și hârtie. Studenții înregistrează:Aplicație: pentru raion artificial în producerea de săpun și SMS, produse cosmetice, medicamente etc.
Săruri alcaline
.
Proprietăți fizice. Elevii scriu proprietăți într-un caiet substanțe solide cristaline, aproape toate solubile în apă.
Lucrare independentă cu text de manual.
Aplicație: completarea tabelului din diapozitivul nr. 5. Lucrați la manualul p. 56 - 57
Formula de sare
numele
cerere
NaHCO 3
K2C03
NaCl
Na2S04 ∙ 10 H 2 O
Na2C03∙10H20
Semnificația în viața organismelor - numărul 6.
Mesajul studentului pe această temă: „Valoarea compușilor metalelor alcaline în viața organismelor.”
Ionii de sodiu și potasiu joacă un rol biologic important: Na + este principalul ion extracelular găsit în sânge și limfă, iar K + este principalul ion intracelular. „Lucrează” împreună. Raportul dintre concentrația acestor ioni reglează tensiunea arterială într-un organism viu și asigură mișcarea soluțiilor de sare de la rădăcini la frunzele plantelor. Ionii de potasiu - susțin activitatea mușchiului cardiac, ajută la reumatism, îmbunătățesc funcția intestinului. Compuși de potasiu - elimină umflarea.
V. fixare
VI. Rezumatul lecției. Notarea.
Rezumatul lecției:
Ce proprietăți fizice și chimice sunt caracteristice pentru oxizi, hidroxizi ai metalelor alcaline?
Unde se folosesc hidroxizii și sărurile metalelor alcaline?
Material suplimentar. Acest lucru este interesant.
Sarcină: De ce în Grecia antică, înainte de călătorii lungi pe vreme caldă, soldaților li se recomanda să mănânce o felie de pâine, sărată și spălată cu apă?
Ionii de electroliți se hidratează ușor, astfel încât clorura de sodiu captează apa în organism.
Obiectiv: De ce mâncă eskimoșii foarte puțină sare?
Conform uneia dintre teoriile științifice, toate animalele care trăiesc pe pământ, inclusiv oamenii, sunt descendenți ai organismelor care au apărut și au trăit în mare. Fluidul corporal al acestor creaturi era apa de mare în compoziție. După ce s-au mutat pe uscat, ei au economisit apa de mare ca fluidul corpului lor. Dar natura nu este în măsură să ofere organismelor vii o cantitate suficientă de sare în forma sa naturală. Deoarece sarea se dizolvă în apă, o parte semnificativă din ea este spălată din sol de apa de ploaie în râuri, mări și oceane. Drept urmare, plantele care cresc pe sol nu conțin suficientă sare. De aceea, animalele care se hrănesc cu plante au nevoie de sare. În fiecare zi, organismul pierde o anumită cantitate de lichid care conține sare, iar alimentele vegetale nu compensează. Animalele care se hrănesc cu alte animale nu au nevoie de sare suplimentară. Obțin sarea de care au nevoie de la organismele victimelor lor. Eschimosii mănâncă în principal carne, deci nevoia lor de sare este foarte mică.
Sarcină: De ce în Anglia din ultimele decenii a existat o scădere a mortalității din cauza bolilor cerebrovasculare?
Acest lucru se datorează consumului crescut de fructe și legume proaspete. Legumele și fructele proaspete au întotdeauna mult potasiu și puțin sodiu. Sodiul retine apa in organism, crescand tensiunea arteriala, iar potasiul, dimpotriva, ajuta la reducerea acesteia. De aceea, o creștere a consumului de legume, fructe, în special mere, poate fi considerată o măsură esențială pentru prevenirea bolilor cerebrovasculare.
UNDE ÎN OAMENI IUBESC PENTRU VÂNZARE .
Sarea este folosită pentru a păstra alimentele de la stricare și de la descompunere. Pentru a economisi mâncarea (când nu existau frigidere și congelatoare), s-a folosit sare. După ce au încercat legume din saramură, oamenii au început să sarate, să fermenteze și să apeze legumele proaspete. O persoană este atât de obișnuită să sărure tot ceea ce este chiar gata să facă față cu unele boli, doar pentru a nu trece la o dietă fără sare. Treptat, s-a dezvoltat un obicei de a sări toate produsele alimentare fără să le încercați măcar.
MULTE DE SĂRĂTURĂ - POTATIU PICT, POTATIU PICT - MULTE BOLI
Problema sării este o problemă de echilibru potasiu-sodiu. Este extrem de important în organism. Potasiul și sodiul se ceartă în mod constant asupra prezenței lor în celule. Nu există potasiu în clorura de sodiu, este complet sodic. Corpul nostru are mare nevoie de potasiu, care ar trebui să fie de 4 ori mai mult decât sodiu. Organismul colectează potasiu peste tot, dar utilizarea excesivă de sare de masă își anulează toate eforturile. Prin urmare, cu un exces de aport de sare, apare o lipsă de potasiu, care în timp duce la o serie de afecțiuni: oboseală fizică și psihică, somn slab, crampe, dureri articulare.
Excesul de sodiu (sare) supraîncărcare inima. Vrei să afli dacă mănânci multă sare? Mergeți în oglindă: un cerc alb în jurul irisului indică un aport excesiv de sare.
Hidroxid de potasiu
Potasiu caustic este utilizat pentru producerea de îngrășăminte, cauciuc sintetic, electroliți pentru baterii, reactivi și este utilizat în industria farmaceutică și în alte sectoare ale economiei.
Potasiul caustic este transportat pe calea ferată, pe cale rutieră, în conformitate cu regulile privind transportul mărfurilor în vigoare pe acest tip de transport.
Potasiu caustic este păstrat într-un recipient bine închis, ca se „răspândește” în aer, absorbând umezeala din el.
Denumirea sa tradițională „potasiu caustic” reflectă efectul coroziv al acestei substanțe asupra țesutului viu. Dacă potasiul caustic ajunge pe piele, sunt posibile arsuri chimice.
Săpunurile ușoare sunt obținute prin saponificarea uleiurilor și grăsimilor cu potasiu caustic. Toate aceste săpunuri au o consistență moale cremoasă.
Soda caustica.
Cel mai frecvent alcalin. Peste 57 de milioane de tone de alcalini caustici sunt produse și consumate în lume pe an.
Soda caustică este utilizată într-o mare varietate de industrii și pentru uz intern:
În industria de celuloză și hârtie în producția de hârtie, carton, fibre artificiale, plăci din fibre de lemn.
Pentru saponificarea grăsimilor la fabricarea săpunului, șamponului și a altor detergenți.
În industriile chimice - pentru a neutraliza acizii și oxizii de acid, ca reactiv sau catalizator în reacțiile chimice etc.
Sodul caustic (hidroxid de sodiu) este o substanță caustică și corozivă. Se referă la substanțe din clasa a II-a de pericol. Prin urmare, atunci când lucrați cu acesta, trebuie să aveți grijă.
În caz de contact cu pielea, mucoasele și ochii, se formează arsuri chimice grave. Dacă suprafețele mucoase vin în contact cu alcalii caustici, este necesară spălarea zonei afectate cu un flux de apă și dacă intră în contact cu o soluție slabă de acid acetic.
Pe litiu - spre stele
Producătorii de telefoane mobile, gadgeturi de buzunar și laptopuri au mare nevoie de acest metal. Energia nucleară consumă cantități mari de litiu (Li), conform calculelor teoreticienilor, este acest metal alcalin care poate oferi cheia energiei termonucleare. Fiind o substanță psihotropă puternică, Li este utilizat în psihiatria militară și aplicată (iar natura efectului Li asupra psihicului uman nu este pe deplin înțeleasă). Deuteridul de litiu este utilizat într-o bombă cu hidrogen ca substanță de lucru și ca regulator al puterii explozive.
Acest metal este de asemenea necesar pentru explorarea spațiului profund.
Flux de lucru pentru studenți la lecție
Subiect: Compuși ai metalelor alcaline.
test
Hidruri. Cea mai stabilă hidrură de litiu, care se obține cu ușurință trecând hidrogenul peste litiu încălzit. LiH este o pulbere albă cristalină cu un punct de topire de 680 ° C. La temperaturi ridicate, LiH este extrem de reactiv. Descompus în mod viguros de apă:
LiH + H2O \u003d LiOH + H2
Oxizii. Cel mai stabil este Li 2 O. Oxizii de litiu și sodiu sunt albi, restul sunt galbeni. Mai mult, intensitatea culorii crește odată cu creșterea numărului de serie al elementului.
Peroxizi. Se obțin prin arderea metalelor în exces de oxigen. Peroxizii de metale alcaline pot fi considerați derivați ai peroxidului de hidrogen interacționează cu acizii și apa pentru a forma peroxid de hidrogen:
M 2 O 2 + H 2 SO 4 \u003d M 2 SO 4 + H 2 O 2
M2O2 + 2H2O \u003d 2MOH + H2O2
Cea mai mare importanță este peroxidul de sodiu, care este utilizat pentru a produce oxigen în spații închise (de exemplu, un submarin):
2Na2O2 + 2CO2 \u003d 2Na2 CO3 + 2O2
Hidroxizii. Tehnica se numește alcalină caustică, (NaOH - sodă caustică, KOH - potasiu caustic). Acestea sunt substanțe incolore, fuzibile. În stare topită interacționează cu sticla, porțelanul, platina. Prin urmare, topirea alcalinilor se realizează în creuzete de argint sau fier, cu care acestea nu interacționează. Hidroxizii sunt ușor solubili în apă cu generare de căldură ridicată.
Hidroxizii sunt preparați în următoarele moduri:
a) Interacțiunea metalelor sau oxizilor cu apa:
Li2O + H2O \u003d 2LiOH
Această reacție este utilizată doar pentru a produce hidroxizi foarte pure.
b) Reacția de caustificare este cea mai veche metodă cunoscută pentru producerea de sodă caustică. Această metodă constă în tratarea unei soluții de sodă cu hidroxid de calciu (var tăiat) în timp ce fierbe. Carbonatul de calciu insolubil rezultat este filtrat sau un lichid limpede este decantat din acesta:
Na2C03 + Ca (OH) 2 \u003d 2NaOH + CaCO3
Soluția de hidroxid de sodiu rezultată a fost concentrată prin evaporare în vid. Hidroxidul de sodiu solid s-a topit la 500 ° C pentru a îndepărta complet apa și a fost obținut NaOH conținând 3-4% Na2C03. Obținut în acest fel NaOH se numește "sodă caustică".
c) Electroliza clorurilor de metale alcaline în soluție apoasă este o metodă industrială modernă pentru producerea de NaOH și KOH simultan cu clorul. Când o soluție de NaCl este supusă electrolizei cu electrozi inerți (platină, grafit), clorul este eliberat la anod și hidrogen la catod. Ionii Na + și ionii OH se acumulează în spațiul catodului, care formează NaOH.
d) Fuziunea carbonatelor de metale alcaline cu oxizi și tratarea ulterioară a aliajului cu vapori de apă:
Fe2O3 + Na2C03 \u003d 2NaFeO2 + CO2
2NaFeO 2 + H 2 O \u003d 2NaOH + Fe 2 O 3
Alkalis este cea mai importantă materie primă din industria chimică pentru coloranți, pahare, săpunuri, hârtie, fibre artificiale și medicamente.
Sare. NaCl și KCl se găsesc în cantități mari în natură. NaCl (sare de masă) se găsește în apa mării (în medie 2,7%) și sub formă de sare de rocă în depozite cu o capacitate de până la câțiva kilometri. NaCl pur și KCl sunt obținute din cloruri naturale prin recristalizare. Sărurile de litiu sunt obținute din carbonatul de litiu natural. Obținerea sărurilor de rubidiu și cesiu este asociată cu dificultăți, deoarece solubilitatea lor este foarte aproape de solubilitatea sărurilor de potasiu. De obicei, lichidele mamă rămase după carnalit sunt recristalizate, iar alumidiul rubidiu și cesiu sunt izolate de ele, care sunt purificate prin recristalizare. Separarea rubidiului de cesiu se realizează utilizând diferite solubilități ale carbonatelor lor în alcool.
Dintre nitrați, NaNO3 și KNO 3 au o importanță practică. Denumirile tehnice sunt nitratul de sodiu și nitratul de potasiu. Ambele săruri sunt utilizate ca îngrășăminte minerale. KNO 3 este de asemenea utilizat pentru producerea de pulbere neagră (NaNO 3 nu este utilizat datorită igroscopicității sale).
Acidul carbonic H 2 CO 3 oferă două rânduri de carbonate de metale alcaline, acid (MHCO 3) și mediu (M 2 CO 3) .Carbonatele acide (bicarbonati, bicarbonati) sunt cunoscute pentru toate metalele alcaline, cu excepția litiului. Cu excepția carbonatului de litiu, toți carbonații neutri sunt foarte solubili în apă. Na 2 CO 3 - sodă, uneori întâlnită în natură în apele unor lacuri și în izvoare minerale. Obțineți amoniac sodic: o soluție de clorură de sodiu este saturată cu amoniac și dioxid de carbon. În acest caz, NaHCO 3 precipită, deoarece soda este mai slab solubilă decât NH 4 Cl:
NaCl + H2O + CO2 + NH3 \u003d NaHCO3 + + NH4CI
2NaHCO3 → Na2C03 + CO2 + H20
K 2 CO 3 - potasiu, pulbere albă higroscopică, foarte solubil în apă. Primiți prin carbonizarea hidroxidului de potasiu:
2KOH + CO2 \u003d K2C03 + H20
Potasa este folosită în industria săpunului și a sticlei, pentru vopsirea și albirea lânii, în producerea cianurii de potasiu, în sinteza organică.
Acidul sulfuric dă două rânduri de sulfați de metale alcaline - acid și mediu.
Na2S04 este obținut ca produs secundar în producerea acidului clorhidric din clorură de sodiu și acid sulfuric. Din soluții apoase, sulfatul de sodiu cristalizează sub formă de Na2S04. 10H 2 O, în domeniu, acest hidrat cristalin se numește sare Glauber. Folosit pentru vopsirea țesăturilor de bumbac, în medicină.
· · ·§ 96. alcalin
Grupul de metale alcaline include următoarea serie de metale; Li, Na, K, Rb, Cs, Fr. Se află în subgrupa I principală a grupului sistemului periodic.
Toate acestea sunt similare prin faptul că au un electron pe stratul extern de electroni (tabelul 18) /.
Alcalinele sunt elemente s. Electronul stratului de electroni exterior al unui atom de metal alcalin, în comparație cu alte elemente din aceeași perioadă, este cel mai îndepărtat de nucleu, adică raza atomului de metal alcalin este cea mai mare în comparație cu razele de atomi ale altor elemente din aceeași perioadă. În legătură
|
Încărcarea de bază |
Numărul de electroni la niveluri de energie |
Raza de atom |
|||||||
prin aceasta, electronul de valență al stratului exterior al atomilor de metal alcalin se desparte cu ușurință, transformându-i în ioni pozitivi încărcați singuri. Acest lucru se datorează faptului că compușii metalelor alcaline cu alte elemente sunt construite în funcție de tipul de legătură ionică.
În reacțiile redox, ele se comportă ca agenți reducători puternici, iar această capacitate crește de la metal la metal, odată cu creșterea încărcăturii nucleului atomic.
§ 97. Sodiu
Configurația electronică a atomului de sodiu ls 2 2s 2 2p 6 3s 1. Structura stratului său exterior:
Sodiul se găsește în natură numai sub formă de săruri. Cea mai obișnuită sare de sodiu este clorura de sodiu NaCl, precum și mineralul silvinitic KCl · NaCl și unele săruri sulfatate, de exemplu, sarea Glauber Na2SO4 · 10H2O, care se găsește în cantități mari în Marea Caspică Kara-Bogaz-Gol.
Metalul de sodiu este obținut din clorura de sodiu prin electroliza topiturii acestei sări. Instalarea pentru electroliză este prezentată în Fig. 76. Electrozii sunt coborâți în sarea topită. Spațiile anodice și catodice sunt separate printr-o diafragmă, care izolează sodiul format astfel încât reacția inversă să nu se producă. Un ion de sodiu pozitiv primește un electron de la catod și se transformă într-un atom de sodiu neutru. Atomii neutri de sodiu sunt colectați la catod sub formă de metal topit. Procesul care are loc la catod poate fi reprezentat de următoarea schemă:
Na + + Na 0.
Deoarece adoptarea electronilor are loc la catod și orice acceptare a electronilor de către un atom sau ion este o reducere, ionii de sodiu la catod sunt reduse. La anod, ionii de clor donează electroni, adică procesul de oxidare și eliberarea liberului
gazul clor, care poate fi reprezentat prin următoarea schemă:
Cl - - e - → Cl 0
Sodul metalic rezultat are o culoare alb-argintiu și este ușor tăiat cu un cuțit. O felie de sodiu, dacă este examinată imediat după tăiere, are o strălucire metalică strălucitoare, dar se estompează rapid datorită oxidării extrem de rapide a metalului.
![]()
Fig. 76. Schema de instalare pentru electroliza clorurii de sodiu topite.
1 - catod inelar; 2 - clopot pentru îndepărtarea clorului gazos din spațiul anodului
Dacă sodiu este oxidat într-o cantitate mică de oxigen la o temperatură de aproximativ 180 °, se obține oxid de sodiu:
4Na + O2 \u003d 2Na2O.
La arderea în oxigen, se obține peroxid de sodiu:
2Na + O2 \u003d Na2O2.
În acest caz, sodiul arde cu o flacără galbenă orbitoare.
Datorită oxidării ușoare și rapide a sodiului, acesta este păstrat sub un strat de kerosen sau parafină și este de preferat, deoarece o anumită cantitate de aer se dizolvă în kerosen și oxidarea de sodiu, deși încet, încă.
Sodiul poate da un compus cu hidrogen - hidrura de NaH, în care prezintă o stare de oxidare de 1. Acesta este un compus asemănător sării care diferă de hidrurile volatile ale elementelor principalelor subgrupuri ale grupurilor IV-VII în natura legăturii chimice și a gradului de oxidare.
Sodium metal poate reacționa nu numai cu oxigenul și hidrogenul, ci și cu multe substanțe simple și complexe. De exemplu, când măcinăm într-un mortar cu sulf, sodiul reacționează violent cu acesta, formând:
2Na + S \u003d Na2S
Reacția este însoțită de focare, astfel încât mortarul trebuie să fie ferit de ochi și să înfășurați un prosop în jurul mâinii. Pentru reacție trebuie luate bucăți mici de sodiu.
Sodul arde puternic în clor cu formarea de clorură de sodiu, care este deosebit de bine de observat într-un tub de clor-calciu, în care un flux de clor este trecut prin sodiu topit și foarte fierbinte:
2Na + Cl2 \u003d 2NaCl
Sodul reacționează nu numai cu substanțe simple, ci și cu substanțe complexe, de exemplu cu apa, deplasându-se de la ea, deoarece este un metal foarte activ, într-o serie de eforturi se află mult la stânga hidrogenului și îl deplasează cu ușurință pe acesta din urmă:
2Na + 2H2O \u003d 2NaOH + H2
Arderea metalelor alcaline nu trebuie stinsă cu apă. Cel mai bine este să-l umpleți cu pudră de cenușă de sodă. În prezența sodiului, flacăra incoloră a unui arzător de gaz devine galbenă.
Metalul de sodiu poate fi utilizat ca catalizator în sinteza organică, de exemplu, în producerea cauciucului sintetic din butadienă. Servește ca materie primă pentru prepararea altor compuși de sodiu, de exemplu peroxid de sodiu.
■ 27. Demonstrați folosind ecuațiile reacțiilor date în textul reacțiilor care implică sodiu metalic că se comportă ca un agent reducător.
28. De ce nu poate fi depozitat sodiul în aer?
29. Studentul a scufundat o bucată de sodiu într-o soluție de sulfat de cupru, sperând să îndepărteze metalul din sare. În locul metalului roșu, a apărut un precipitat albastru gelatinos. Descrieți reacțiile care au avut loc și scrieți ecuațiile lor în forme moleculare și ionice. Cum trebuie schimbate condițiile de reacție astfel încât reacția să conducă la rezultatul dorit? Scrieți ecuațiile în forme ionice moleculare, complete și prescurtate.
30. 2,3 g de sodiu metal au fost introduse într-un vas cu 45 ml de apă. Ce sifon caustic s-a format la sfârșitul reacției.
31. Ce agenți pot fi folosiți pentru stingerea unui sodiu arzător? Dați un răspuns motivat.
§ 98. Compuși cu oxigen de sodiu. Soda caustica
Compușii cu oxigen de sodiu, așa cum am menționat deja, sunt oxidul de sodiu Na2O și peroxidul de sodiu Na2O2.
Oxidul de sodiu Na2O nu este deosebit de semnificativ. Reacționează puternic cu apa, formând sodă caustică:
Na2O + H2O \u003d 2NaOH
Peroxidul de sodiu Na202 este o pulbere gălbui. Poate fi considerată ca un fel de sare de peroxid de hidrogen, deoarece structura sa este aceeași cu cea a H2O2. Ca și peroxidul de sodiu este un agent oxidant puternic. Sub acțiunea apei, formează un alcalin și:
Na2O2 + H2O \u003d H2O2 + 2NaOH
format prin acțiunea acizilor diluați asupra peroxidului de sodiu:
Na2O2 + H2SO4 \u003d H2O2 + Na2SO4
Toate proprietățile de mai sus ale peroxidului de sodiu permit utilizarea acestuia pentru albirea tuturor materialelor posibile.
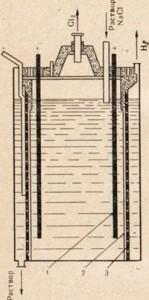
Fig. 77. Schema de instalare pentru electroliza soluției de clorură de sodiu.
1 - anod; 2 - o diafragmă care separă spațiul anodului și catodului; 3 catod
Un compus de sodiu foarte important este hidroxidul de sodiu sau sodă caustică, NaOH. Se mai numește și sodă caustică sau pur și simplu caustic.
Pentru a obține sodă caustică, se folosește clorură de sodiu - cel mai ieftin compus natural de sodiu, care îl electrolizează, dar, în acest caz, nu este o topire, ci se folosește o soluție de sare (Fig. 77). Pentru o descriere a electrolizei soluției de clorură de sodiu, vezi § 33. În Fig. 77 arată că anodul și spațiul catodului sunt separați printr-o diafragmă. Acest lucru se face pentru a preveni interacționarea produselor formate între ele, de exemplu Сl2 + 2NaOH \u003d NaClO + NaCl + Н2O.
Soda caustică - o substanță solidă cristalină de culoare albă, perfect solubilă în apă. Când hidroxidul de sodiu este dizolvat în apă, o cantitate mare de căldură este eliberată și soluția este foarte fierbinte. Soda caustică trebuie păstrată în vase bine sigilate pentru a preveni pătrunderea vaporilor de apă, sub influența cărora poate fi foarte umedă, precum și dioxid de carbon, sub influența căreia soda caustică se poate transforma treptat în carbonat de sodiu:
2NaOH + CO2 \u003d Na2CO3 + H2O.
Soda caustică este un alcalin tipic, astfel încât precauțiile pentru a lucra cu acesta sunt aceleași ca atunci când lucrați cu orice alți alcali.
Soda caustică este folosită în multe industrii, de exemplu, pentru rafinarea produselor petroliere, producerea de săpun din grăsimi, în industria hârtiei, în producerea de fibre și coloranți artificiali, în producerea de medicamente etc. (Fig. 78).
Scrieți în caiet zonele de aplicare a sifonului caustic.
Dintre sărurile de sodiu, în primul rând, clorura de sodiu, NaCl, care servește ca materie primă principală pentru hidroxid de sodiu și sodiu metalic (pentru detalii despre această sare, vezi pagina 164), sodă Na2CO3 (vezi pagina 278), Na2SO4 (vezi pagina 224), NaNO3 (vezi p. 250) etc.
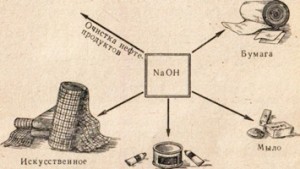
Fig. 78. Utilizarea sifonului caustic
■ 32. Descrieți metoda de producere a sodului caustic prin electroliza clorurii de sodiu.
33. Soda caustică poate fi obținută prin acționarea asupra carbonatului de sodiu cu var tăiat. Realizați o formă moleculară și ionică a ecuației pentru această reacție și, de asemenea, calculați cât de mult sodă conținând 95% carbonat este necesară pentru a obține 40 kg de sodă caustică.
34. De ce, atunci când depozitați o soluție de sodă caustică în sticle cu dopuri de pământ, dopurile sunt „blocate” și nu pot fi îndepărtate? Dacă, pentru o anumită perioadă de timp, sticla este ținută cu susul în jos în apă, atunci pluta poate fi îndepărtată liber. Explicați, având în vedere ecuațiile de reacție, ce fel de procese au loc în acest caz.
35. Scrieți ecuațiile reacțiilor în forme moleculare și ionice care caracterizează proprietățile sifonului caustic ca un alcalin tipic.
36. Ce precauții trebuie respectate atunci când lucrați cu sodă caustică? Ce măsuri de prim ajutor ar trebui să fie prevăzute pentru arsuri cu sodă caustică?
§ 99. Potasiu
Potasiul K este, de asemenea, un metal alcalin destul de comun, care diferă de sodiu prin raza sa atomică (a patra perioadă) și, prin urmare, are o activitate chimică mai mare decât sodiul. Configurația electronică a atomului de potasiu este 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1.
Structura stratului său electronic exterior
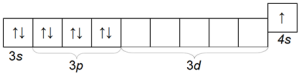
Potasiul este un metal moale care este bine tăiat cu un cuțit. Pentru a evita oxidarea, la fel ca sodiul, este depozitat sub un strat de kerosen.
Potasiul reacționează și mai violent cu apa decât sodiul, cu formarea de alcali și cu eliberarea de hidrogen, care se aprinde:
2K + 2H2O \u003d 2KOH + H2.
Atunci când arzi în oxigen (se recomandă să iei bucăți de metal chiar mai mici pentru ardere decât pentru a arde sodiu), cum ar fi sodiul, arde foarte puternic odată cu formarea peroxidului de potasiu.
Trebuie menționat că potasiul este mult mai periculos în circulație decât sodiul. O explozie puternică poate apărea chiar și atunci când tăiați potasiu, așa că trebuie să vă descurcați cu mai multă atenție.
Hidroxidul de potasiu sau hidroxidul de potasiu KOH este o substanță cristalină albă. Potasiul caustic este în orice mod asemănător cu sodă caustică. Sunt utilizate pe scară largă în industria săpunului, dar producția sa este ceva mai scumpă, deci nu găsește o astfel de aplicație ca NaOH.
Sărurile de potasiu trebuie notate mai ales, deoarece unele dintre ele sunt utilizate pe scară largă ca îngrășăminte. Acestea sunt clorura de potasiu KCl, azotatul de potasiu KNO3, care este de asemenea un îngrășământ cu azot.
■ 37. Cum putem explica faptul că potasa caustică este mai activă din punct de vedere chimic decât soda caustică?
38. O bucată de potasiu a fost coborâtă în matriță cu apă. După ce s-a încheiat reacția, s-a pus puțin zinc acolo ca precipitat alb gelatinos. Precipitatul a dispărut, iar la testarea soluției cu fenolftaleină, aceasta din urmă a devenit o culoare roșie. Ce procese chimice s-au produs aici?
Care sunt în soluție? Dați un răspuns motivat.
39. De ce potasiul, ca toate metalele alcaline, este un membru al familiei elementelor s?
Metalele alcaline reacționează ușor cu nemetalele:
2K + I 2 \u003d 2KI
2Na + H2 \u003d 2NaH
6Li + N 2 \u003d 2Li 3 N (reacția este deja la temperatura camerei)
2Na + S \u003d Na2S
2Na + 2C \u003d Na2C2
În reacțiile cu oxigenul, fiecare metal alcalin își arată individualitatea: atunci când arde în aer, litiu formează oxid, peroxid de sodiu, peroxid de potasiu.
4Li + O2 \u003d 2Li2O
2Na + O2 \u003d Na2O2
K + O2 \u003d KO2
Obținerea oxidului de sodiu:
10Na + 2NaNO 3 \u003d 6Na2O + N2
2Na + Na2O2 \u003d 2Na2O
2Na + 2NaON \u003d 2Na2O + H2
Interacțiunea cu apa duce la formarea alcalinilor și a hidrogenului.
2Na + 2H2O \u003d 2NaOH + H2
Reacția cu acizii:
2Na + 2HCl \u003d 2NaCl + H2
8Na + 5H 2 SO 4 (conc.) \u003d 4Na 2 SO 4 + H 2 S + 4H 2 O
2Li + 3H 2 SO 4 (conc.) \u003d 2LiHSO 4 + SO 2 + 2H 2 O
8Na + 10HNO 3 \u003d 8NaNO 3 + NH4N03 + 3H2O
Când interacționează cu amoniacul, se formează amide și hidrogen:
2Li + 2NH 3 \u003d 2LiNH 2 + H2
Interacțiunea cu compușii organici:
H ─ C ≡ C ─ H + 2Na → Na ─ C≡C ─ Na + H2
2CH3Cl + 2Na → C2H6 + 2NaCl
2C 6 H 5 OH + 2Na → 2C 6 H 5 ONa + H2
2CH3 OH + 2Na → 2 CH3 ONa + H2
2CH 3 COOH + 2Na → 2CH 3 COOONa + H2
O reacție calitativă la metalele alcaline este colorarea flăcării cu cationii lor. Li + ion coloreaza flacara rosu carmin, galben Na + ion, K + violet
Compuși ai metalelor alcaline
Oxizii.
Oxizii metalici alcalini sunt oxizi de bază tipici. Reacționează cu oxizi de acid și amfoteric, acizi, apă.
3Na 2 O + P 2 O 5 \u003d 2Na 3 PO 4
Na2O + Al2O3 \u003d 2NaAlO2
Na2O + 2HCl \u003d 2NaCl + H20
Na2O + 2H + \u003d 2Na + + H20
Na2O + H2O \u003d 2NaOH
peroxizi.
2Na2O2 + CO2 \u003d 2Na 2 CO3 + O2
Na2O2 + CO \u003d Na2C03
Na2O2 + SO2 \u003d Na2S04
2Na2O + O2 \u003d 2Na2O2
Na2O + NO + NO 2 \u003d 2NaNO2
2Na2O2 \u003d 2Na2O + O2
Na2O2 + 2H2O (rece) \u003d 2NaOH + H2O2
2Na 2 O 2 + 2H 2 O (orizontală) \u003d 4NaOH + O2
Na2O2 + 2HCl \u003d 2NaCl + H2O2
2Na 2 O 2 + 2H 2 SO 4 (descompunere orizontală) \u003d 2Na 2 SO 4 + 2H 2 O + O 2
2Na2O2 + S \u003d Na2S03 + Na2O
5Na 2 O 2 + 8H 2 SO 4 + 2KMnO 4 \u003d 5O 2 + 2MnSO 4 + 8H 2 O + 5Na 2 SO 4 + K 2 SO 4
Na2O 2 + 2H 2 SO 4 + 2NaI \u003d I 2 + 2Na 2 SO 4 + 2H 2 O
Na2O 2 + 2H 2 SO 4 + 2 FeSO 4 \u003d Fe 2 (SO 4) 3 + Na2 SO 4 + 2H 2 O
3Na 2O 2 + 2Na 3 \u003d 2Na 2 CrO 4 + 8NaOH + 2H 2 O
Baza (alcalin).
2NaOH (exces) + CO2 \u003d Na2C03 + H20
NaOH + CO 2 (exces) \u003d NaHCO 3
SO2 + 2NaOH (exces) \u003d Na2S03 + H2O
Si02 + 2NaOH Na2 Si03 + H20
2NaOH + Al2O3 2NaAlO2 + H2O
2NaOH + Al2O3 + 3H2O \u003d 2Na
NaOH + Al (OH) 3 \u003d Na
2NaOH + 2Al + 6H 2 O \u003d 2Na + 3H 2
2KOH + 2NO2 + O2 \u003d 2KNO 3 + H20
KOH + KHCO3 \u003d K2C03 + H20
2NaOH + Si + H 2 O \u003d Na2 SiO 3 + H2
3KOH + P 4 + 3H 2 O \u003d 3KH2 PO 2 + PH 3
2KOH (la rece) + Cl2 \u003d KClO + KCl + H20
6KOH (fierbinte) + 3Cl2 \u003d KClO 3 + 5KCl + 3H2O
6NaOH + 3S \u003d 2Na 2 S + Na2S03 + 3H2O
2NaNO 3 2NaNO 2 + O2
NaHCO3 + HNO3 \u003d NaNO3 + CO2 + H20
NaI → Na + + I -
la catod: 2Н 2 О + 2e → H 2 + 2OH - 1
pe anod: 2I - - 2e → I 2 1
2H 2 O + 2I - ![]() H2 + 2OH - + I2
H2 + 2OH - + I2
2H2O + 2NaI ![]() H2 + 2NaOH + I2
H2 + 2NaOH + I2
2NaCI ![]() 2Na + Cl2
2Na + Cl2
la catod la anod
2Na 2 HPO 4 Na 4 P 2 O 7 + H 2 O
KNO3 + 4Mg + 6H2O \u003d NH3 + 4Mg (OH) 2 + KOH
4KClO 3 KCl + 3KClO 4
2KClO 3 ![]() 2KCl + 3O2
2KCl + 3O2
KClO 3 + 6HCl \u003d KCl + 3Cl 2 + 3H2O
Na2S03 + S \u003d Na2S2O3
Na 2 S 2 O 3 + H 2 SO 4 \u003d Na 2 SO 4 + S ↓ + SO 2 + H 2 O
2NaI + Br 2 \u003d 2NaBr + I 2
2NaBr + Cl2 \u003d 2NaCl + Br2
I Un grup.
1. Descărcările electrice au fost trecute pe suprafața soluției de sodă caustică turnată în balon, iar aerul din balon a fost colorat maro, care dispare după un timp. Soluția rezultată a fost evaporată cu atenție și s-a constatat că reziduul solid este un amestec de două săruri. Când acest amestec este încălzit, gazul este eliberat și singura substanță rămâne. Scrieți ecuațiile reacțiilor descrise.
2. Substanța eliberată la catod în timpul electrolizei topiturii de clorură de sodiu a fost arsă în oxigen. Produsul rezultat a fost plasat într-un contor de gaz umplut cu dioxid de carbon. Substanța rezultată a fost adăugată la o soluție de clorură de amoniu și soluția a fost încălzită. Scrieți ecuațiile reacțiilor descrise.
3) Acidul azotic a fost neutralizat cu bicarbonat de sodiu, soluția neutră a fost evaporată cu atenție și reziduul a fost calcinat. Substanța rezultată a fost introdusă într-o soluție de permanganat de potasiu acidulată cu acid sulfuric și soluția a fost decolorată. Produsul de reacție care conține azot a fost plasat într-o soluție de hidroxid de sodiu și s-a adăugat praf de zinc și a fost eliberat un gaz cu un miros înțepător. Scrieți ecuațiile reacțiilor descrise.
4) Substanța obținută la anod în timpul electrolizei unei soluții de iodură de sodiu cu electrozi inerți a fost introdusă în reacție cu potasiu. Produsul de reacție a fost încălzit cu acid sulfuric concentrat și gazul evoluat a fost trecut printr-o soluție fierbinte de cromat de potasiu. Scrieți ecuațiile reacțiilor descrise
5) Substanța obținută la catod în timpul electrolizei unei topituri de clorură de sodiu a fost arsă în oxigen. Produsul obținut a fost ulterior tratat cu dioxid de sulf și o soluție de hidroxid de bariu. Scrieți ecuațiile reacțiilor descrise
6) Fosforul alb se dizolvă într-o soluție de potasiu caustic cu evoluția unui gaz cu un miros de usturoi care se aprinde spontan în aer. Produsul solid al reacției de ardere a reacționat cu hidroxid de sodiu într-un asemenea raport încât substanța albă rezultată conține un atom de hidrogen; când acesta din urmă este calcinat, se formează pirofosfat de sodiu. Scrieți ecuațiile reacțiilor descrise
7) Metal necunoscut ars în oxigen. Produsul de reacție, interacționează cu dioxidul de carbon, formează două substanțe: un solid, care interacționează cu o soluție de acid clorhidric cu eliberarea de dioxid de carbon și o substanță simplă gazoasă care susține arderea. Scrieți ecuațiile reacțiilor descrise.
8) Gazul brun a fost trecut printr-un exces de soluție de hidroxid de potasiu în prezența unui exces mare de aer. În soluția rezultată s-au adăugat bărbierituri de magneziu și încălzit, iar acidul azotic a fost neutralizat cu gazul eliberat. Soluția rezultată a fost evaporată cu atenție și produsul de reacție solid a fost calcinat. Scrieți ecuațiile reacțiilor descrise.
9) În timpul descompunerii termice a sării A în prezența dioxidului de mangan, se formează sare binară B și un gaz care susține arderea și fac parte din aer; când această sare este încălzită fără un catalizator, se formează sare B și o sare acidă mai mare care conține oxigen. În timpul interacțiunii sării A cu acidul clorhidric, se eliberează un gaz galben-verde (o substanță simplă) și se formează sare B. Sarea B transformă flacăra purpurie, când interacționează cu o soluție de azotat de argint, se formează un precipitat alb. Scrieți ecuațiile reacțiilor descrise.
10) S-au adăugat bărbierituri de cupru în acidul sulfuric concentrat încălzit, iar gazul evoluat a fost trecut printr-o soluție de sodă caustică (în exces). Produsul de reacție a fost izolat, dizolvat în apă și încălzit cu sulf, care s-a dizolvat ca urmare a reacției. La soluția rezultată s-a adăugat acid sulfuric diluat. Scrieți ecuațiile reacțiilor descrise.
11) Sarea a fost tratată cu acid sulfuric concentrat. Sarea rezultată a fost tratată cu hidroxid de sodiu. Produsul rezultat a fost calcinat cu cărbune în exces. Gazul degajat în acest caz a reacționat în prezența unui catalizator de clor. Scrieți ecuațiile reacțiilor descrise.
12) Sodiu a reacționat cu hidrogenul. Produsul de reacție s-a dizolvat în apă, s-a format un gaz care a reacționat cu clorul, iar soluția rezultată a reacționat cu clorul când s-a încălzit pentru a forma un amestec de două săruri. Scrieți ecuațiile reacțiilor descrise.
13) Sodiu a fost ars în exces de oxigen, substanța cristalină rezultată a fost plasată într-un tub de sticlă și a fost trecută dioxidul de carbon. Gazul care iese din tub a fost colectat și ars fosfor în atmosfera sa. Materialul rezultat a fost neutralizat cu un exces de soluție de hidroxid de sodiu. Scrieți ecuațiile reacțiilor descrise.
14) Soluția de acid clorhidric a fost adăugată la soluția obținută prin interacțiunea peroxidului de sodiu cu apa atunci când a fost încălzită până la finalizarea reacției. O soluție de sare formată a fost electrolizată cu electrozi inerți. Gazul generat prin electroliză la anod a fost trecut printr-o suspensie de hidroxid de calciu. Scrieți ecuațiile reacțiilor descrise.
15) Gazul de sulf a fost trecut printr-o soluție de hidroxid de sodiu pentru a forma o sare de mijloc. La soluția rezultată s-a adăugat o soluție apoasă de permanganat de potasiu. Precipitatul rezultat a fost separat și a acționat asupra acestuia cu acid clorhidric. Gazul degajat a fost trecut printr-o soluție rece de hidroxid de potasiu. Scrieți ecuațiile reacțiilor descrise.
16) Un amestec de silice (IV) și metal de magneziu a fost calcinat. Substanța simplă rezultată a fost tratată cu o soluție concentrată de hidroxid de sodiu. Gazul eliberat a fost transmis peste sodiu încălzit. Substanța rezultată a fost plasată în apă. Scrieți ecuațiile reacțiilor descrise.
17) Produsul interacțiunii litiu cu azot a fost tratat cu apă. Gazul rezultat a fost trecut printr-o soluție de acid sulfuric până la încetarea reacțiilor chimice. Soluția rezultată a fost tratată cu o soluție de clorură de bariu. Soluția a fost filtrată și filtratul a fost amestecat cu o soluție de azotat de sodiu și încălzit. Scrieți ecuațiile reacțiilor descrise.
18) Sodiu a fost încălzit într-o atmosferă de hidrogen. Când s-a adăugat apă la substanța obținută, s-a observat evoluția gazelor și formarea unei soluții clare. Prin această soluție a fost trecut gaz gazon, care a fost obținut ca urmare a interacțiunii cuprului cu o soluție concentrată de acid azotic. Scrieți ecuațiile reacțiilor descrise.
19) Bicarbonatul de sodiu a fost calcinat. Sarea rezultată a fost dizolvată în apă și amestecată cu o soluție de aluminiu, ca urmare, s-a format un precipitat și s-a eliberat un gaz incolor. Precipitatul a fost tratat cu un exces de soluție de acid azotic și gazul a fost trecut printr-o soluție de silicat de potasiu. Scrieți ecuațiile reacțiilor descrise.
20) Sodiu s-a topit cu sulf. Compusul rezultat a fost tratat cu acid clorhidric, gazul evoluat a reacționat complet cu dioxid de sulf. Materialul rezultat a fost tratat cu acid azotic concentrat. Scrieți ecuațiile reacțiilor descrise.
21) Sodiu ars în exces de oxigen. Substanța rezultată a fost tratată cu apă. Amestecul rezultat a fost fiert, după care s-a adăugat clor la soluția fierbinte. Scrieți ecuațiile reacțiilor descrise.
22) Potasiul a fost încălzit într-o atmosferă de azot. Substanța rezultată a fost tratată cu un exces de acid clorhidric, după care a fost adăugată o suspensie de hidroxid de calciu la amestecul de săruri rezultat și încălzită. Gazul rezultat a fost trecut fericit de oxid de cupru radiant (II) Scrieți ecuațiile reacțiilor descrise.
23) Potasiul a fost ars într-o atmosferă de clor, sarea rezultată a fost tratată cu un exces de soluție apoasă de azotat de argint. Precipitatul format a fost filtrat, filtratul a fost evaporat și amestecul a fost încălzit cu atenție. Sarea rezultată a fost tratată cu o soluție apoasă de brom. Scrieți ecuațiile reacțiilor descrise.
24) Litiu a reacționat cu hidrogenul. Produsul de reacție s-a dizolvat în apă, s-a format un gaz care a reacționat cu brom, iar soluția rezultată a reacționat cu clor când s-a încălzit pentru a forma un amestec de două săruri. Scrieți ecuațiile reacțiilor descrise.
25) Sodiu ars în aer. Solidul rezultat absoarbe dioxidul de carbon cu eliberarea de oxigen și sare. Sarea din urmă a fost dizolvată în acid clorhidric și s-a adăugat o soluție de azotat de argint la soluția rezultată. Un precipitat alb a căzut. Scrieți ecuațiile reacțiilor descrise.
26) Oxigenul a fost supus descărcării electrice într-un ozonizant. Gazul rezultat a fost trecut printr-o soluție apoasă de iodură de potasiu, în timp ce un nou gaz a fost eliberat fără culoare și miros, care susține combustia și respirația. Sodiu a fost ars în atmosfera ultimului gaz, iar solidul obținut cu acesta a reacționat cu dioxid de carbon. Scrieți ecuațiile reacțiilor descrise.
I Un grup.
1. N2 + O2 ![]() 2NO
2NO
2NO + O2 \u003d 2NO2
2NO2 + 2NaOH \u003d NaNO3 + NaNO2 + H20
2NaNO 3 2NaNO 2 + O2
2. 2NaCI ![]() 2Na + Cl2
2Na + Cl2
la catod la anod
2Na + O2 \u003d Na2O2
2Na2O2 + 2CO2 \u003d 2Na2 CO3 + O2
Na2C03 + 2NH4CI \u003d 2NaCl + CO2 + 2NH 3 + H20
3. NaHCO3 + HNO3 \u003d NaNO3 + CO2 + H20
2NaNO 3 2NaNO 2 + O2
5NaNO 2 + 2KMnO 4 + 3H 2 SO 4 \u003d 5NaNO 3 + 2MnSO 4 + K 2 SO 4 + 3H 2 O
NaNO3 + 4Zn + 7NaOH + 6H2O \u003d 4Na2 + NH3
4,2 H 2 O + 2 NaI ![]() H2 + 2NaOH + I2
H2 + 2NaOH + I2
2K + I 2 \u003d 2KI
8KI + 5H 2 SO 4 (conc.) \u003d 4K 2 SO 4 + H 2 S + 4I 2 + 4H 2 O
3H 2 S + 2K2 CrO 4 + 2H 2 O \u003d 2Cr (OH) 3 ↓ + 3S ↓ + 4KOH
5. 2NaCI ![]() 2Na + Cl2
2Na + Cl2
la catod la anod
2Na + O2 \u003d Na2O2
Na2O2 + SO2 \u003d Na2S04
Na2S04 + Ba (OH) 2 \u003d BaS04 + 2NaOH
6. P 4 + 3KOH + 3H 2 O \u003d 3KH2 PO 2 + PH 3
2PH 3 + 4O 2 \u003d P2O 5 + 3H2O
P2O 5 + 4NaOH \u003d 2Na 2 HPO 4 + H2O


