30.08.2019
Технология на производство на алуминий. Технологичният процес на производство на алуминий
1.1 Получаване на алуминиев оксид от руди
Алуминиевият оксид се произвежда по три начина: алкален, кисел и електролитен. Алкалният метод е най-разпространен (методът на К. I. Байер, разработен в Русия в края на века преди миналия и използван за обработка на висококачествен боксит с малко количество (до 5-6%) силициев диоксид). Оттогава техническото му изпълнение е значително подобрено. Схемата за производство на алуминиев оксид съгласно метода на Bayer е показана на фиг. 1.
Същността на метода е, че алуминиевите разтвори бързо се разлагат при въвеждането на алуминиев хидроксид в тях и разтворът, останал след разлагането след изпаряване при интензивно разбъркване при 169-170 ° С, може да разтвори разтворителя, съдържащ се в боксит. Този метод се състои от следните основни операции:
Приготвяне на боксит, състоящ се в неговото раздробяване и смилане в мелници; бокситите, каустичните основи и малко количество вар се подават към мелниците, което подобрява отделянето на Al 2 O 3; получената каша се подава до излугване;
Излугване на боксит (наскоро използваните кръгли автоклавни блокове са частично заменени с тръбни автоклави, при които излугването става при температури 230-250 ° С (500-520 К)), което се състои в химичното му разлагане от взаимодействие с воден алкален разтвор; хидрати на алуминиев оксид в контакт с основи преминават в разтвора под формата на натриев алуминат:
AlOOH + NaOH → NaAlO 2 + H 2 O
Al (OH) 3 + NaOH → NaAlO 2 + 2H20;
SiO 2 + 2NaOH → Na 2 SiO 3 + H 2 O;
в разтвор натриевият алуминат и натриевият силикат образуват неразтворим натриев алумосиликат; оксидите от титан и желязо преминават в неразтворимия остатък, което прави остатъка червен; този остатък се нарича червена кал. След завършване на разтварянето, полученият натриев алуминат се разрежда с воден алкален разтвор, докато се понижава температурата до 100 ° С;
Отделянето на алуминатен разтвор от червена кал обикновено се извършва чрез промиване в специални сгъстители; в резултат на това червената кал се утаява, а алуминатният разтвор се изцежда и след това се филтрира (избистря). В ограничени количества, утайката се използва например като добавка към цимента. В зависимост от степента на боксит, 1–1 тона получен алуминиев оксид представляват 0,6–1,0 тона червена кал (твърди частици);
Разлагане на алуминатен разтвор. Филтрира се и се изпомпва в големи контейнери със смесители (разградители). След охлаждане при 60 ° С (330 К) и непрекъснато разбъркване, алуминиев хидроксид Al (OH) 3 се екстрахира от свръхнаситения разтвор. Тъй като този процес протича бавно и неравномерно и образуването и растежът на кристали от алуминиев хидроксид са от голямо значение при по-нататъшната му обработка, към разлагащите се добавя голямо количество твърд хидроксид:
Na 2 O ּ Al 2 O 3 + 4H 2 O → Al (OH) 3 + 2NaOH;
Разпределение на алуминиев хидроксид и неговата класификация; това се случва в хидроциклони и вакуумни филтри, където утайка, съдържаща 50-60% частици Al (OH), е изолирана от алуминатен разтвор. Значителна част от хидроксида се връща в процеса на разлагане като семенен материал, който остава в циркулация в постоянни количества. Остатъкът след измиване с вода преминава към калциниране; филтратът също се връща в циркулация (след концентриране в изпарители, за извличане на нов боксит);
Дехидратация на алуминиев хидроксид (калциниране); това е последната операция за производство на алуминиев оксид; провежда се в тръбни въртящи се пещи, а напоследък и в пещи с турбулентно движение на материала при температура 1150-1300 ° С; суровият алуминиев хидроксид, преминаващ през въртяща се пещ, се суши и дехидратира; при нагряване последователно се появяват следните структурни трансформации:
| Al (OH) 3 → AlOOH → γ-Al 2 O 3 → α-Al 2 O 3 |
В най-накрая калцинирания алуминий съдържа 30-50% α-Al 2O 3 (корунд), останалата част γ-Al 2 O 3.
Този метод извлича 85-87% от общия брой на алуминиевия оксид. Полученият алуминиев оксид е силно химично съединение с температура на топене 2050 ° С.
1.2 Получаване на алуминий от неговия оксид
Електролитичното редуциране на алуминиев триоксид, разтворен в стопилка на база криолит, се провежда при 950-970 ° С в електролизатор. Клетката се състои от баня, облицована с въглеродни блокове, към дъното на която се подава електрически ток. Течният алуминий, отделен на дъното, служещ като катод, е по-тежък от стопилката на електролитната сол, поради което той се събира на въглищна основа, откъдето периодично се изпомпва (фиг. 2). Отгоре въглеродните аноди се потапят в електролита, който изгаря в атмосферата кислород, освободен от алуминиев оксид, отделяйки въглероден окис (СО) или въглероден диоксид (CO 2). На практика се използват два вида аноди:
а) аноди на Зедерберг за самостоятелно изпичане, състоящи се от брикети, така наречените "хлябове" от маса на Зедерберг (ниско пепелни въглища с 25-35% катран на каменни катран), натъпкани в алуминиева обвивка; под въздействието на висока температура анодната маса се изгаря (синтерова);
б) отпалени или "непрекъснати" аноди от големи въглищни блокове (например 1900 × 600 × 500 мм с тегло около 1,1 тона).
Силата на тока върху електролизаторите е 150 000 А. Те са свързани към мрежата последователно, тоест се получава система (серия) - дълга серия от електролизатори.
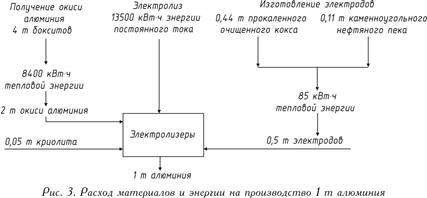
Работното напрежение на банята, което е 4-5 V, е значително по-високо от напрежението, при което става разлагането на алуминиев оксид, тъй като загубите на напрежение в различни части на системата са неизбежни по време на работа. Балансът на суровините и енергията при производството на 1 тон алуминий е представен на фиг. 3.
Електролиза на алуминиев хлорид (метод на Alcoa)
В реакционния съд алуминиевият оксид първо се превръща в алуминиев хлорид. След това в плътно изолирана баня се извършва електролиза на AlCl3, разтворен в разтопената сол на KCl, NaCl. Хлорът, отделен по време на този процес, се изсмуква и доставя за вторична употреба; алуминият се отлага при катода.
Предимствата на този метод пред съществуващата електролиза на течен криолит-алуминиев разтвор (Al 2 O 3, разтворен в криолит Na 3 AlF 6) са: спестяване на до 30% енергия; възможността за използване на алуминиев оксид, който не е подходящ за традиционна електролиза (например, Al 2 O 3 с високо съдържание на силиций); замяна на скъп криолит с по-евтини соли; изчезването на опасността от отделяне на флуор.
Редукция на алуминиев хлорид с манган (метод Тот)
Когато манганът се редуцира от алуминиевия хлорид, алуминият се освобождава. Чрез контролирана кондензация замърсителите, свързани с хлора, се отделят от потока на манган хлорид. Когато се отделя хлор, мангановият хлорид се окислява до манганов оксид, който след това се редуцира до рециклиран манган. Информацията в съществуващите публикации е много неточна, така че в този случай трябва да се откажете от оценката на метода.
Една много съмнителна легенда гласи, че веднъж човек с метална, нечуплива купа дошъл при римския император Тиберий (42 г. пр. Н. Е. - 37 г. сл. Хр.). Предполага се, че материалът за купата е получен от алуминиев двуокис (Al 2 O 3) и следователно е трябвало да е алуминий. Страхувайки се, че такъв глинен метал може да обезцени злато и сребро, Тиберий заповяда, за всеки случай, да отсече главата на човек. Разбира се, в тази история е трудно да се повярва: родният алуминий не се среща в природата и по времето на Римската империя не би могло да има технически средства, които биха позволили алуминият да бъде извлечен от неговите съединения.
По разпространение в природата алуминият заема първо място сред металите; съдържанието му в земната кора е 7,45%. Въпреки широкото си разпространение в природата, алуминият е един от редките метали до края на 19 век. В чистата си форма алуминият не се получава поради високата си химическа активност. Той се намира главно под формата на съединения с кислород и силиций - алумосиликати.
Като алуминиеви руди могат да служат само руди, богати на алуминиев двуокис (Al 2 O 3) и срещащи се в големи маси по повърхността на земята. Такива скали включват боксит, нефелин - (Na, K) 2 O ּ Al 2 O 3 ּ 2 SiO 2, алунити - (Na, K) 2 SO 4 ּ Al 2 (SO 4) 3 ּ 4 Al (OH) 3 и каолини (глина), поле спар (ортоклаза) - K 2 O ּ Al 2 O 3 ּ 6 SiO 2.
Основната руда за производство на алуминий е боксит. Алуминият в тях се съдържа под формата на хидроксиди Al (OH), AlOOH, корунд Al 2 O 3 и каолинит Al 2 O 3 ּ 2 SiO 2 ּ 2 H 2 O. Химичен състав бокситен комплекс: 28-70% алуминиев оксид; 0,5-20% силициев диоксид; 2-50% железен оксид; 0,1-10% титанов оксид. Напоследък като руда се използват нефелин и алунит.
Големи находища на боксити са разположени на Урал, в района Тихвин в района на Ленинград, в териториите на Алтай и Красноярск.
Нефелин (K ּ Na 2 O ּ Al 2 O 3 ּ 2 SiO 2) е част от скалите на апатитонефелин (на полуостров Кола).
За първи път в свободна форма алуминият е изолиран през 1825 г. от датския физик Ерстед от действието на калиевия амалгам върху алуминиевия хлорид. През 1827г Германският химик Уелър подобри метода на Ерстед, като замести калиевата амалгама с метален калий:
AlCl 3 + 3K → 3KCl + Al (Реакцията протича с отделяне на топлина).
През 1854 г. Сейнт Клер Девил във Франция за първи път прилага метода на Велер за промишленото производство на алуминий, използвайки по-евтин натрий вместо калий, а вместо хигроскопичен алуминиев хлорид, по-стабилен двоен алуминиев хлорид и натрий. През 1865 г. руският физик-химик Н. Н. Бекетов показва възможността за изместване на алуминия с магнезий от разтопен криолит. Тази реакция е използвана през 1888 г. за производството на алуминий в първия немски завод в Гмелинген. Производството на алуминий по тези така наречени "химически" методи се извършва от 1854 до 1890 г. За 35 години, използвайки тези методи, са получени общо около 20 тона алуминий.
В края на 80-те години на миналия век химическите методи заменят електролитичния метод, което позволява драстично да намали цената на алуминия и създаде предпоставките за бързото развитие на алуминиевата индустрия. Основателите на съвременния електролитен метод за производство на алуминий Eru във Франция и Хол в САЩ независимо подадоха през 1886 г. почти същите заявления за патентоване на метод за производство на алуминий чрез електролиза на алуминиев разтвор, разтворен в разтопен криолит. След появата на патентите на Eru и Hall започва модерната алуминиева промишленост, която за повече от 115 години от съществуването си се превърна в една от най-големите индустрии в металургията.
Процесът за производство на алуминий се състои от три основни етапа:
1). Получаване на алуминиев оксид (Al 2 O 3) от алуминиеви руди;
2). Получаване на алуминий от алуминиев оксид;
3). Рафиниране на алуминий.
Получаване на алуминиев оксид от руди.
Алуминиевият оксид се произвежда по три начина: алкален, кисел и електролитен. Алкалният метод е най-разпространен (методът на К. I. Байер, разработен в Русия в края на века преди миналия и използван за обработка на висококачествен боксит с малко количество (до 5-6%) силициев диоксид). Оттогава техническото му изпълнение е значително подобрено. Схемата за производство на алуминиев оксид съгласно метода на Bayer е показана на фиг. 1.
Същността на метода е, че алуминиевите разтвори бързо се разлагат при въвеждането на алуминиев хидроксид в тях и разтворът, останал след разлагането след изпаряване при интензивно разбъркване при 169-170 ° С, може да разтвори разтворителя, съдържащ се в боксит. Този метод се състои от следните основни операции:
1). Приготвяне на боксит, състоящ се в неговото раздробяване и смилане в мелници; бокситите, каустичните основи и малко количество вар се подават към мелниците, което подобрява отделянето на Al 2 O 3; получената каша се подава до излугване;
2). Излугване на боксит (наскоро използваните кръгли автоклавни блокове са частично заменени с тръбни автоклави, при които излугването става при температури 230-250 ° С (500-520 К)), което се състои в химичното му разлагане от взаимодействие с воден алкален разтвор; хидрати на алуминиев оксид в контакт с основи преминават в разтвора под формата на натриев алуминат:
AlOOH + NaOH → NaAlO 2 + H 2 O
Al (OH) 3 + NaOH → NaAlO 2 + 2H20;
SiO 2 + 2NaOH → Na 2 SiO 3 + H 2 O;
в разтвор натриевият алуминат и натриевият силикат образуват неразтворим натриев алумосиликат; оксидите от титан и желязо преминават в неразтворимия остатък, което прави остатъка червен; този остатък се нарича червена кал. След завършване на разтварянето, полученият натриев алуминат се разрежда с воден алкален разтвор, докато се понижава температурата до 100 ° С;
3). Отделянето на алуминатен разтвор от червена кал обикновено се извършва чрез промиване в специални сгъстители; в резултат на това червената кал се утаява, а алуминатният разтвор се изцежда и след това се филтрира (избистря). В ограничени количества, утайката се използва например като добавка към цимента. В зависимост от степента на боксит, 1–1 тона получен алуминиев оксид представляват 0,6–1,0 тона червена кал (твърди частици);
4). Разлагане на алуминатен разтвор. Филтрира се и се изпомпва в големи контейнери със смесители (разградители). След охлаждане при 60 ° С (330 К) и непрекъснато разбъркване, алуминиев хидроксид Al (OH) 3 се екстрахира от свръхнаситения разтвор. Тъй като този процес протича бавно и неравномерно и образуването и растежът на кристали от алуминиев хидроксид са от голямо значение при по-нататъшната му обработка, към разлагащите се добавя голямо количество твърд хидроксид:
Na 2 O ּ Al 2 O 3 + 4H 2 O → Al (OH) 3 + 2NaOH;
5). Разпределение на алуминиев хидроксид и неговата класификация; това се случва в хидроциклони и вакуумни филтри, където утайка, съдържаща 50-60% частици Al (OH), е изолирана от алуминатен разтвор. Значителна част от хидроксида се връща в процеса на разлагане като семенен материал, който остава в циркулация в постоянни количества. Остатъкът след измиване с вода преминава към калциниране; филтратът също се връща в циркулация (след концентриране в изпарители, за извличане на нов боксит);
6). Дехидратация на алуминиев хидроксид (калциниране); това е последната операция за производство на алуминиев оксид; провежда се в тръбни въртящи се пещи, а напоследък и в пещи с турбулентно движение на материала при температура 1150-1300 ° С; суровият алуминиев хидроксид, преминаващ през въртяща се пещ, се суши и дехидратира; при нагряване последователно се появяват следните структурни трансформации:
| Al (OH) 3 → AlOOH → γ-Al 2 O 3 → α-Al 2 O 3 | |||
| 200 за C– | 950 о С– | 1200 за S. | |
В най-накрая калцинирания алуминий съдържа 30-50% α-Al 2O 3 (корунд), останалата част γ-Al 2 O 3.
Този метод извлича 85-87% от общия брой на алуминиевия оксид. Полученият алуминиев оксид е силно химично съединение с температура на топене 2050 ° С.
Получаване на алуминий от неговия оксид
Електролиза на алуминиев оксид
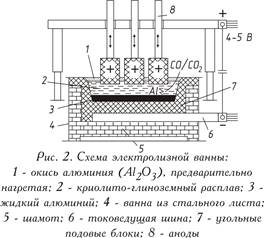 Електролитичното редуциране на алуминиев триоксид, разтворен в стопилка на база криолит, се провежда при 950-970 ° С в електролизатор. Клетката се състои от баня, облицована с въглеродни блокове, към дъното на която се подава електрически ток. Течният алуминий, утаяван на дъното, служещ като катод, е по-тежък от разтопената сол на електролита, поради което се събира върху въглищна основа, откъдето периодично се изпомпва (фиг. 2). Отгоре въглеродните аноди се потапят в електролита, който изгаря в атмосферата кислород, освободен от алуминиев оксид, отделяйки въглероден окис (СО) или въглероден диоксид (CO 2). На практика се използват два вида аноди:
Електролитичното редуциране на алуминиев триоксид, разтворен в стопилка на база криолит, се провежда при 950-970 ° С в електролизатор. Клетката се състои от баня, облицована с въглеродни блокове, към дъното на която се подава електрически ток. Течният алуминий, утаяван на дъното, служещ като катод, е по-тежък от разтопената сол на електролита, поради което се събира върху въглищна основа, откъдето периодично се изпомпва (фиг. 2). Отгоре въглеродните аноди се потапят в електролита, който изгаря в атмосферата кислород, освободен от алуминиев оксид, отделяйки въглероден окис (СО) или въглероден диоксид (CO 2). На практика се използват два вида аноди:
а) аноди на Зедерберг за самостоятелно изпичане, състоящи се от брикети, така наречените "хлябове" от маса на Зедерберг (ниско пепелни въглища с 25-35% катран на каменни катран), натъпкани в алуминиева обвивка; под въздействието на висока температура анодната маса се изгаря (синтерова);
б) отпалени или "непрекъснати" аноди от големи въглищни блокове (например 1900 × 600 × 500 мм с тегло около 1,1 тона).
Силата на тока върху електролизаторите е 150 000 А. Те са свързани към мрежата последователно, тоест се получава система (серия) - дълга серия от електролизатори.
Работното напрежение на банята, което е 4-5 V, е значително по-високо от напрежението, при което става разлагането на алуминиев оксид, тъй като загубите на напрежение в различни части на системата са неизбежни по време на работа. Балансът на суровините и енергията при производството на 1 тон алуминий е представен на фиг. 3.
Електролиза на алуминиев хлорид (метод на Alcoa)
 В реакционния съд алуминиевият оксид първо се превръща в алуминиев хлорид. След това в плътно изолирана баня се извършва електролиза на AlCl3, разтворен в разтопената сол на KCl, NaCl. Хлорът, отделен по време на този процес, се изсмуква и доставя за вторична употреба; алуминият се отлага при катода.
В реакционния съд алуминиевият оксид първо се превръща в алуминиев хлорид. След това в плътно изолирана баня се извършва електролиза на AlCl3, разтворен в разтопената сол на KCl, NaCl. Хлорът, отделен по време на този процес, се изсмуква и доставя за вторична употреба; алуминият се отлага при катода.
Предимствата на този метод пред съществуващата електролиза на течен криолит-алуминиев разтвор (Al 2 O 3, разтворен в криолит Na 3 AlF 6) са: спестяване на до 30% енергия; възможността за използване на алуминиев оксид, който не е подходящ за традиционна електролиза (например, Al 2 O 3 с високо съдържание на силиций); замяна на скъп криолит с по-евтини соли; изчезването на опасността от отделяне на флуор.
Редукция на алуминиев хлорид с манган (метод Тот)
 Когато манганът се редуцира от алуминиевия хлорид, алуминият се освобождава. Чрез контролирана кондензация замърсителите, свързани с хлора, се отделят от потока на манган хлорид. Когато се отделя хлор, мангановият хлорид се окислява до манганов оксид, който след това се редуцира до рециклиран манган. Информацията в съществуващите публикации е много неточна, така че в този случай трябва да се откажете от оценката на метода.
Когато манганът се редуцира от алуминиевия хлорид, алуминият се освобождава. Чрез контролирана кондензация замърсителите, свързани с хлора, се отделят от потока на манган хлорид. Когато се отделя хлор, мангановият хлорид се окислява до манганов оксид, който след това се редуцира до рециклиран манган. Информацията в съществуващите публикации е много неточна, така че в този случай трябва да се откажете от оценката на метода.
Получаване на рафиниран алуминий
За алуминий рафинирането на електролиза с разлагане на водни солни разтвори не е възможно. Тъй като за някои цели степента на пречистване на индустриалния алуминий (Al 99.5 - Al 99.8), получена чрез електролиза на криолит-алуминиев разтвор, е недостатъчна, още повече чист алуминий (Al 99, 99 R) се получава от промишлени алуминий или метални отпадъци чрез рафиниране. Най-известният метод на рафиниране е трислойната електролиза.
Трислойно рафиниране на електролиза
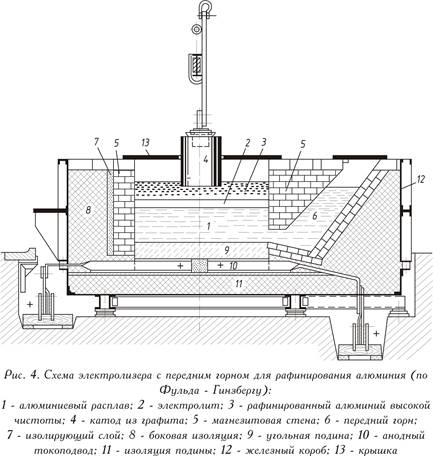
Облечен със стоманен лист, работещ при постоянен ток (показан на фиг. 4 - виж по-горе), рафиниращата вана се състои от въглищно огнище с токови отводи и топлоизолационна магнезитна облицовка. За разлика от електролизата на стопилка на криолит-алуминий, стопеният рафиниран метал (долен аноден слой) обикновено е анодът тук. Електролитът е съставен от чисти флуориди или смес от бариев хлорид и алуминиеви и натриеви флуориди (среден слой). Алуминият, който се разтваря от анодния слой в електролита, се отделя над електролита (горен катоден слой). Чистият метал служи като катод. Токът се подава към катодния слой от графитен електрод.
Ваната работи при 750-800 ° C, консумацията на енергия е 20 kW ּ h за 1 kg чист алуминий, т.е. малко по-висока, отколкото при конвенционалната алуминиева електролиза.
Металът на анода съдържа 25-35% Cu; 7-12% Zn; 6-9% Si; до 5% Fe и малко количество манган, никел, олово и калай, останалото (40-55%) е алуминий. Всички тежки метали и силиций по време на рафинирането остават в анодния слой. Наличието на магнезий в електролита води до нежелани промени в състава на електролита или до неговото силно шлакиране. За да се отстрани магнезият, шлаката, съдържаща магнезий, се обработва с флюси или газообразен хлор.
В резултат на рафинирането се получават чист алуминий (99,99%) и продукти за сегрегация (загер продукт), които съдържат тежки метали и силиций и се отделят под формата на алкален разтвор и кристален остатък. Алкалният разтвор е отпадък, а твърдият остатък се използва за разкисляване.
Рафинираният алуминий обикновено има следния състав,%: Fe 0,0005-0,002; Si 0,002-0,005; Cu 0,0005-0,002; Zn 0,0005-0,002; Mg следи; Останалите.
Рафинираният алуминий се преработва в полуфабрикат в указания състав или се легира с магнезий (виж таблица 1.2.).
ТАБЛИЦА 1.2. Химическият състав на алуминий с висока чистота и първичен алуминий съгласно DIN 1712 , лист 1.
| марка | номер | Допустими примеси *,% | |||||||
| обща сума | включително | ||||||||
| си | Fe | Ti | Cu | Zn | друг | ||||
| A199,99R | 3.0400 | 0,01 | 0,006 | 0,005 | 0,002 | 0,003 | 0,005 | 0,001 | |
| A199.9H | 3.0300 | 0,1 | 0,050 | 0,035 | 0,006 | 0,005 | 0,04 | 0,003 | |
| A199.8H | 3.0280 | 0,2 | 0,15 | 0,15 | 0,03 | 0,01 | 0,06 | 0,01 | |
| A199.7H | 3.0270 | 0,3 | 0,20 | 0,25 | 0,03 | 0,01 | 0,06 | 0,01 | |
| A199.5H ** | 3.0250 | 0,5 | 0,30 | 0,40 | 0,03 | 0,02 | 0,07 | 0,03 | |
| A199H | 3.0200 | 1,0 | 0,5 | 0,6 | 0,03 | 0,02 | 0,08 | 0,03 | |
* Доколкото е възможно да се определи чрез конвенционални методи за изследване. ** Чистият алуминий за електротехника (алуминиеви проводници) се доставя под формата на първичен алуминий 99,5, съдържащ не повече от 0,03% (Ti + Cr + V + Mn); обозначен в случая с Е-А1, номер на материала 3.0256. В противен случай той отговаря на VDE-0202. |
|||||||||
Рафиниране чрез органоалуминиеви сложни съединения и зонално топене
Алуминий с чистота по-висока от клас А1 99,99 R може да се получи чрез рафиниране на електролиза на чист или технически чист алуминий, като се използват сложни алуминиеви органоалуминиеви съединения като електролит. Електролизата се извършва при температура около 1000 ° С между твърдите алуминиеви електроди и по принцип е подобна на електролизата на рафиниране на мед. Характерът на електролита диктува необходимостта да се работи без въздух и при ниска плътност на тока.
Този тип рафинираща електролиза, първоначално използвана само в лабораторен мащаб, вече се извършва в малък производствен мащаб - няколко тона метал се произвеждат годишно. Номиналната степен на пречистване на получения метал е 99,999-99,9999%. Потенциалните приложения за метал от тази чистота са криогенно електротехника и електроника.
Възможно е да се използва обмисленият метод на рафиниране при галванопластика.
Дори по-висока чистота - номинално до A1 99.99999 - може да бъде получена чрез последващо зонално топене на метал. Когато обработвате алуминий с висока чистота в полуфабрикат, лист или тел, трябва да се вземат специални предпазни мерки, като се вземе предвид ниската температура на прекристализация на метала. Забележително свойство на рафинирания метал е неговата висока електрическа проводимост в областта на криогенните температури.
Получаване на вторичен алуминий
Преработката на вторични суровини и производствени отпадъци е икономически изгодна. Получените вторични сплави задоволяват около 25% от общото търсене на алуминий.
 Най-важната област на приложение на вторичните сплави е производството на отливки с алуминиева форма. В DIN 1725, лист 2, заедно със стандартните степени на сплав, са дадени многобройни степени на сплав, произведени от леярни. Списъкът на сплавите, произведени от тези растения, съдържа освен стандартни, и някои нестандартни сплави.
Най-важната област на приложение на вторичните сплави е производството на отливки с алуминиева форма. В DIN 1725, лист 2, заедно със стандартните степени на сплав, са дадени многобройни степени на сплав, произведени от леярни. Списъкът на сплавите, произведени от тези растения, съдържа освен стандартни, и някои нестандартни сплави.
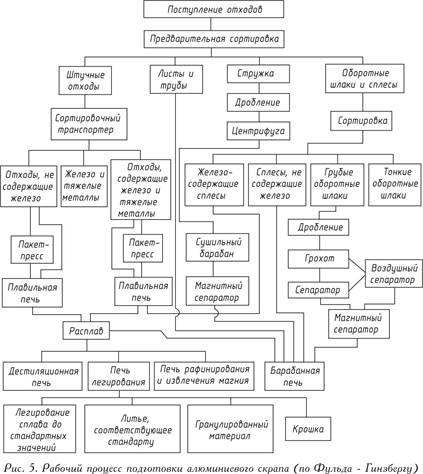
Безупречна подготовка на алуминиев скрап в най-различни пропорции може да се извърши само в специално оборудвани плавилни предприятия. Идеята за сложен работен процес в такъв завод е дадена на фиг. 5.
Отпадъците се разтварят след грубо предварително сортиране. Желязото, никелът или медта, съдържащи се в тези отпадъци, чиято точка на топене е по-висока от точката на топене на алуминия, остава в него по време на топене в пещ за прах на топене, а алуминият се топи. За да се отстранят неметалните включвания от отпадъци като оксиди, нитриди, карбиди или газове, разтопеният метал се обработва със соли или (което е по-рационално) газът се издухва с хлор или азот.
Известни са различни методи за отстраняване на метални примеси от стопилката, например добавяне на магнезий и евакуация - методът на Бекше; цинкови или живачни добавки, последвани от евакуация - субхалогенен метод. Премахването на магнезия се ограничава до въвеждането на хлор в разтопения метал. Чрез въвеждане на добавки, точно определени от състава на стопилката, се получава предварително определена лята сплав.
Производство на алуминий от индустриален клас
Електролитичният метод е единственият използван в световен мащаб за производство на метален алуминий с техническа чистота. Всички други методи (цинково-термични, карбидотермални, субхлоридни, нитридни и др.), С които алуминият може да бъде извлечен от алуминиеви руди, са разработени в лабораторен и пилотен мащаб, но все още не са намерили практическо приложение.
За получаване на алуминиево-силициеви сплави успешно се използва електротермичният метод, първият разработен и внедрен в индустриален мащаб в СССР. Състои се от два етапа: на първия етап се получава първична алуминиево-силициева сплав със съдържание на 60-63% Al чрез директно редуциране на алуминиево-силициеви руди в рудо-термични електрически пещи; на втория етап първичната сплав се разрежда с технически алуминий, като се получават силимин и други отливки и ковани алуминиево-силиконови сплави. В момента се правят проучвания за извличане на алуминий от технически клас от първичната сплав.
По принцип производството на алуминий по електролитичен метод включва производството на алуминий (алуминиев оксид) от алуминиеви руди, производство на флуоридни соли (криолит, алуминиев флуорид и натриев флуорид), производство на въглеродна анодна маса, калциниран въглероден анод и катодни блокове и други облицовъчни материали, както и реалното електролитично производство на алуминий, което е последният етап на съвременната алуминиева металургия.
Характерно за производството на алуминиев оксид, флуоридни соли и въглеродни продукти е изискването за максимална степен на чистота на тези материали, тъй като криолит-алуминиевият разтвор, подложен на електролиза, не трябва да съдържа примеси от елементи, по-електропозитивни от алуминия, които биха се замърсили предимно при катода. метал.
В клас алуминиев оксид G-00, G-0 и G-1, които се използват главно при електролиза, съдържанието на Si02 е 0,02-0,05%, aFe 2O 3 - 0,03-0,05%. Средно криолитът съдържа 0,36-0,38% Si02 и 0,05-0,06% Fe 2O 3, а алуминиевият флуорид 0,30-0,35% (SiO 2 + Fe 2O 3). Анодната маса съдържа не повече от 0,25% Si02 и 0,20% Fe 2O 3.
Най-важната алуминиева руда, от която се добива алуминиев оксид, боксит. В боксита алуминият присъства под формата на алуминиев хидроксид. В Съветския съюз, освен боксит, за производството на алуминий се използва нефелинова скала - натриев и калиев алумосиликат, както и алунитовата скала, в която алуминият е под формата на негов сулфат. Суровините за производството на анодна маса и калцинирани анодни блокове са чисти въглеродни материали - петролен или коксов катъл и катран на въглищния катран като свързващо вещество и калциев флуорид (флуорспар) за производството на криолит и други флуоридни соли.
По време на електролитичното производство на алуминий, алуминиев двуокис Al 2 O 3, разтворен в разтопен криолит Na 3 AlF 6, се разлага електрохимично с изхвърлянето на алуминиеви катиони на катода (течен алуминий) и кислородсъдържащите йони (кислородни йони) на въглеродния анод.
Според съвременните представи, криолитът в разтопено състояние се разделя на йони и: алуминий на сложни йони и: ![]() които са в равновесие с прости йони:
които са в равновесие с прости йони: ![]() ,
, ![]() .
.
Основният процес, който протича при катода, е редукцията на тривалентни алуминиеви йони: Al 3+ + 3 д → Ал (I).
Наред с основния процес е възможно непълно изхвърляне на тривалентни алуминиеви йони с образуването на едновалентни йони: Al 3+ + 2 д → Al + (II) и накрая изхвърлянето на едновалентни йони с освобождаването на метал: Al + + д → Ал (III).
При определени условия (сравнително висока концентрация на Na + йони, висока температура и др.) Може да възникне изхвърляне на натриеви йони с освобождаването на метал: Na + + д → Na (IV). Реакциите (II) и (IV) водят до намаляване на текущия изход на алуминий.
Кислородните йони се изхвърлят на въглеродния анод: 2O 2–4 д → O 2. Обаче кислородът не се освобождава в свободната си форма, тъй като окислява въглерода на анода до образуването на смес от CO 2 и CO.
Общата реакция, протичаща в електролизатора, може да бъде представена чрез уравнението Al 2 O 3 + х C ↔ 2Al + (2 х –3) CO + (3– х) CO 2.
Съставът на електролита на индустриални алуминиеви електролитични клетки, в допълнение към основните компоненти - криолит, алуминиев флуорид и алуминиев оксид, включва малки количества (до 8-9% общо) на някои други соли - CaF 2, MgF 2, NaCl и LiF (добавки), които подобряват някои физикохимични свойства на електролита и по този начин повишават ефективността на електролитните клетки. Максималното съдържание на алуминиев оксид в електролита обикновено е 6-8%, като намалява по време на електролиза. Тъй като електролитът се изчерпва от алуминий, в него се вкарва друга порция алуминий. За нормална работа на алуминиевите електролизатори съотношението NaF: AlF3 в електролита се поддържа в границите 2,7-2,8, като се добавят порции криолит и алуминиев флуорид.
При производството на алуминий се използват електролизатори със самозапиляващи се въглеродни аноди и захранване със страничен или горен ток, както и електролизатори с предварително изгорени въглеродни аноди. Най-обещаващият дизайн на електролизатори с изпечени аноди, който позволява да се увеличи единичната мощност на агрегата, да се намали специфичната консумация на електроенергия с постоянен ток за електролиза, да се получи по-чист метал, да се подобрят санитарните и хигиенните условия на работа и да се намалят емисиите на вредни вещества в атмосферата.
Основните технически параметри и показатели за ефективност на алуминиевите електролизатори от различни видове са дадени в табл. 1.3.
ТАБЛИЦА 1.3
ОСНОВНИ ТЕХНИЧЕСКИ ПАРАМЕТРИ И ИНДИКАТОРИ НА РАБОТА НА АЛУМИНИЕВИ ЕЛЕКТРОЛИЗАТОРИ
| Параметри и индикатори | Със аноди за самостоятелно печене | С изгорели аноди | |
страничен захранване с ток |
горен токов проводник | ||
| Сила на тока, kA | 60-120 | 60-155 | 160-255 |
| Дневна производителност на електролизатора, t | 0,42-0,85 | 0,40-1,10 | 1,10-1,74 |
| Плътност на тока на анода, A / cm 2 | 0,80-0,90 | 0,65-0,70 | 0,70-0,89 |
| Средното напрежение на клетката, V | 4,45-4,65 | 4,50-4,70 | 4,30-4,50 |
| Текуща продукция,% | 85-88 | 84-86 | 85-89 |
| Коефициенти на разход на 1 тон алуминий: | |||
| dC електричество, kW ּ h | 15100-16200 | 15500-17300 | 14500-15500 |
| алуминиев оксид, кг | 1920-1940 | 1920-1940 | 1920-1940 |
| анодна маса, kg | 520-560 | 560-620 | - |
| изгорени аноди, кг | - | - | 540-600 |
| Флуоридни соли по отношение на флуор, kg | 20-30 | 25-35 | 15-25 |
Първичният алуминий, извлечен от електролитичните клетки (суров алуминий), съдържа редица примеси, които могат да бъдат разделени на три групи: неметални (флуорни соли, α- и γ-алуминий, алуминиев карбид и нитрид, въглищни частици, механично завлечени по време на изливането на метал от електролизатора); метал (желязо, силиций), преминаващ от суровини, въглищни материали и структурни елементи на електролизатора; газообразен - главно водород, който се образува в метала в резултат на електролитично разлагане на вода, която влиза в електролита със суровини.
От металните примеси, освен желязо и силиций, се съдържа най-голямото количество галий, цинк, титан, манган, натрий, ванадий, хром и мед. Съдържанието на тези и някои други метални микроелементи в електролитен алуминий дадено по-долу,%:
Основният източник на метални примеси в алуминия е алуминий, който в зависимост от вида на суровината може да съдържа галий, цинк, калий, фосфор, сяра, ванадий, титан и хром. Въглеродните материали (анодна маса, калцинирани аноди, катодни продукти) служат като източник на такива микро-примеси като например ванадий, титан, манган, цинк.
Чрез електролиза на криолит-алуминиеви стопилки, при условие че се използват чисти суровини (предимно алуминиеви и въглеродни материали), е възможно да се получи суров алуминий от степени A85 и A8 (99,85 и 99,80%). Най-големият дял метал от тези степени (60-70% от общата продукция) се получава на електролизатори с изпечени аноди, както и на електролизатори със захранване със страничен ток (до 70% от общото производство). При електролизатори със самостоятелно изпичащи аноди и горно токово олово производството на алуминий от суров клас А8 е ниско (1-3%), а металът от клас A85 не може да бъде получен поради значителни примеси на желязо, влизащо в алуминия от необработени източници (анодни щифтове, чугунени секции на газови колектори , технологичен инструмент, монтаж на катод).
Разтопеният първичен алуминий, извлечен от електролизаторите с помощта на вакуумен черпак, влиза в отделението за леене за пречистване от неметални и газови примеси и по-нататъшна преработка в търговски продукти (блокове, цилиндрични и плоски блокове, телени пръчки и др.). Преди леене суровият алуминий се поддържа в разтопено състояние в електрически съпротивителни пещи (миксери) или в газоотражателни пещи. В тези пещи се извършва не само рационално партидиране на партиди течен алуминий с различни състави, но и частично почистени от неметални включвания, оксидни филми и натрий.
Алуминият се излива от смесителя в блокове с помощта на машини за леене на конвейер; цилиндрични и плоски слитъци се правят по метода на полу-непрекъснато леене, а за получаване на телени пръти се използват специални комбинирани леярски и валцови единици.
В домашните алуминиеви топи при изливане на блокове алуминият, постъпващ от смесителя във формата на леярската машина, се подлага на най-простата форма на рафиниране - филтриране на стопилката през фибростъкло с размери на окото от 0,6 × 0,6 до 1,7 × 1,7 мм. Този метод ви позволява да почиствате алуминия само от много груби оксидни включвания; по-съвършен метод за филтриране на стопилката през фибростъклото във горната част на течението. При този метод на филтриране частици от оксидни включвания, които се сблъскват с решетката, не се улавят от потока на стопилката, а се отлагат в дъното на леене.
За едновременно пречистване на алуминия, както от неметални примеси, така и от водород, успешно се използва методът на филтриране през флюсов филтър в комбинация с азотно продухване. Като флюс можете да използвате киселия електролит на алуминиевите клетки за електролиза. В резултат на такова почистване съдържанието на водород в алуминия се намалява от 0,22 на 0,16 cm 3 на 100 g метал.
В основния алуминий, използван за производството на Al-Mg сплави, съдържанието на натрий не трябва да надвишава 0,001%. Това се дължи на факта, че присъствието на натрий в тези сплави нарушава механичните и други експлоатационни свойства на продуктите, използвани в редица сектори на националната икономика.
Най-много ефективен метод Едновременното рафиниране на алуминий от натриеви, водородни и неметални примеси е продухването на разтопения метал с газова смес от азот с 2-10% хлор, вкаран в стопилката под формата на малки мехурчета с помощта на специални устройства. Този метод на рафиниране позволява да се намали съдържанието на натрий в алуминия до 0,0003-0,001% с поток на газова смес от 0,8 до 1,5 м 3 / т метал.
Консумацията на електроенергия за производството на 1 тон алуминий, който може да се продава от суров метал, е 150-200 кВтч; невъзстановими загуби на метал в леярна са равни на 1,5-5% в зависимост от вида на продаваемите продукти.
Получаване на алуминий с висока чистота
За получаване на алуминий с висока чистота (клас A995-A95) първичният алуминий с техническа чистота се рафинира електролитно. Това позволява да се намали съдържанието на метални и газообразни примеси в алуминия и по този начин значително да се увеличи неговата електропроводимост, пластичност, отразяваща способност и устойчивост на корозия.
Електролитичното рафиниране на алуминия се извършва чрез електролиза на разтопени соли по трислоен метод. Същността на метода е следната. В рафиниращата клетка има три разтопени слоя. Най-долната, най-тежка, лежи на проводимото огнище и служи като анод; Нарича се анодна сплав и представлява сплав от рафиниран алуминий с мед, която се въвежда, за да направи слоя по-тежък. Средният слой е разтопен електролит; плътността му е по-малка от плътността на анодната сплав и по-висока от плътността на чистия рафиниран (катоден) алуминий, разположен над електролита (горен, трети течен слой).
По време на анодното разтваряне всички примеси са по-електропозитивни от алуминия (Fe, Si, Ti, Cu и др.) И остават в анодната сплав, без да преминават в електролита. Само алуминият ще се разтвори анодно, което под формата на йони Al 3+ преминава в електролита: Al– 3 д → Al 3+.
По време на електролиза алуминиевите йони се прехвърлят в катода, върху който се изхвърлят: Al 3+ + 3 д → Ал. В резултат на това катодът се натрупва слой от разтопен рафиниран алуминий.
Ако в анодната сплав присъстват примеси, които са по-електроотрицателни от алуминия (например Ba, Na, Mg, Ca), те могат да се разтварят електрохимично заедно с алуминий върху анода и да преминат в електролита под формата на йони. Тъй като съдържанието на електроотрицателни примеси в суровия алуминий е малко, те не се натрупват в забележимо количество в електролита. Изхвърлянето на тези йони на катода практически не се случва, тъй като техният електроден потенциал е електроотрицателен от алуминия.
Като електролит при електролитичното рафиниране на алуминия в Съветския съюз и в повечето страни се използва флуоридно-хлориден електролит, чийто състав е 55-60% BaCl 2, 35-40% AlF 4 + NaF и 0-4% NaCl. Моларното съотношение на NaF: AlF3 поддържа 1.5-2.0; температура на топене на електролит 720-730 ° C; температурата на процеса на електролиза е около 800 ° C; плътността на електролита е 2,7 g / cm3.
Анодната сплав се приготвя от първичен алуминий и чиста мед (99,90-99,95% Cu), които се въвеждат в метала в количество 30-40%. Плътността на течната анодна сплав от този състав е 3-3,5 g / cm3; плътността на чиста разтопен катоден алуминий е 2,3 g / cm3. С това съотношение на плътностите се създават условията, необходими за добро разделяне на трите разтопени слоя.
В кватернерната система Al-Cu-Fe-Si, към която принадлежи анодната сплав, се образува евтектика с точка на топене 520 ° C. Охлаждайки анодната сплав, съдържаща примеси от желязо и силиций в количества, по-високи от евтектичните концентрации, е възможно отделянето на желязо и силиций в твърдата фаза под формата на интерметални съединения FeSiAl 5 и Cu 2 FeAl 7. Тъй като температурата на анодната сплав в джобовете на електролизатора е с 30–40 ° C по-ниска от температурата на анодната сплав в работното пространство на банята, в тях ще се отделят твърди интерметални утайки (тъй като желязото и силицият се натрупват в анодната сплав). Периодично премахвайки тези отлагания, те почистват анодната сплав (без да я актуализират) от примеси от желязо и силиций. Тъй като галият е концентриран в анодната сплав, утайките, извлечени от електролизатора (30-40 кг на 1 тон алуминий), могат да послужат като източник на този метал.
За електролитично рафиниране се използват електролизатори, които по дизайн приличат на електролизатори с изпечени аноди за електролитно производство на първичен алуминий, но имат различна полюсна връзка: огнището служи като анод, а горният ред електроди като катод. Съвременните електролизатори за електролитно рафиниране на алуминий са проектирани за токове до 75 kA.
По-долу са дадени основните технически и икономически показатели на електролизаторите за 1979 г., постигнати от домашните (1, 2, 3) предприятия.
Ефективността на електрохимичния ток, изчислена от метала, излят от електролизатора, е 97-98%. Действителната ефективност на тока, изчислена от количеството на продаваемия метал, е 92-96%.
| Сила на тока, kA | 23,5 | 62,9 | 69,8* |
| Средно напрежение, V | 5,43 | 5,68 | 5,69 |
| Текуща продукция,% | 95,7 | 93,0 | 92,7 |
| DC консумация на мощност, kW ּ ч / т | 17 370 | 18 700 | 19 830 |
| Общо променлив ток, kW ּ ч / т | 18 670 | 19 590 | 20 780 |
| Нива, cm | |||
| катоден алуминий | 16,6 | 12,9 | 14,6 |
| електролит | 13,3 | 11,6 | 14,2 |
| анодна сплав | 40,1 | 29,5 | 30,0 |
| Коефициенти на потребление, kg / t: | |||
| бариев хлорид | 40,5 | 41,5 | 27,0 |
| криолит | 27,7 | 21,0 | 16,5 |
| алуминиев флуорид | 6,7 | 13,1 | 3,8 |
| натриев хлорид | 1,0 | 4,8 | - |
| суров алуминий | 1020 | 1028 | 1032 |
| графит | 11,9 | 11,5 | 16,6 |
| мед | 9,8 | 15,5 | 16,4 |
| Производство на алуминий с висока чистота,% степени: | |||
| A995 | 47,8** | 3,5 | 2,1 |
| A99 | 30,4 | 67,1 | 54,2 |
| A97 | 8,3 | 21,5 | 43,7 |
| A95 | 10,4 | 7,9 | - |
| под A95 | 3,1 | - | - |
* Високи степени на производство на алуминий ** Степен на електролизатори без разширение. |
|||
Основният фактор, който намалява ефективността на тока, в допълнение към директните загуби на ток при изхвърлянето на повече електроотрицателни йони, загубите на метал поради неговото окисляване и механични загуби на алуминий, е работата на електролизатори с отделяне на несортиран метал, който отново се връща в анодната сплав за последващо рафиниране. Тези периоди на работа на клетките се извършват по време на пускане на клетки и нарушения на технологичния режим.
Електролитичното рафиниране на алуминий е много енергоемко производство. Консумацията на електроенергия в променлив ток, включително енергията, изразходвана за подготовката на електролита и анодната сплав, работата на вентилационни устройства и превозни средства, както и загубата на преобразуване на променлив ток в постоянен ток е 18,5-21,0 хиляди кВтч на 1 тон алуминий. Енергийната ефективност на рафинирането на електролитичните клетки не надвишава 5-7%, т.е. 93-95% от енергията се изразходва под формата на топлинни загуби, генерирани главно в електролитния слой (приблизително 80-85% от общия топлоприем). Следователно, основните начини за по-нататъшно намаляване на специфичната консумация на енергия за електролитично рафиниране на алуминий са подобряване на топлоизолацията на електролизера (особено горната част на конструкцията) и намаляване на електролитния слой (намаляване на междуелектродното разстояние).
Чистотата на алуминия, рафинирана съгласно трислойния метод, 99,995%; тя се определя от разликата с пет основни примеси - желязо, силиций, мед, цинк и титан. Количеството произведен метал от тази марка може да бъде 45-48% от общата продукция (без нейното разширяване с по-ниски степени).
Трябва обаче да се отбележи, че в електролитно рафинирания алуминий примесите от други метали се съдържат в по-малки количества, което намалява абсолютната чистота на такъв алуминий. Радиоактивен анализ позволява да се открият до 30 примеси в електролитно рафинирания алуминий, чието общо съдържание е приблизително 60 ּ 10 -4%. Следователно, чистотата на рафинирания алуминий в разлика с тези примеси е 99,994%.
В допълнение към примесите, осигурени от GOST (виж таблица 1.1), най-разпространеният клас (A99) съдържа електролитно рафиниран алуминий,%: Cr 0,00016; V 0,0001; Ga 0,0006; Pb 0,002; Sn 0,00005; Ca 0,002-0,003; Na 0,001-0,008; Mn 0,001-0,007; Mg 0,001-0,007; като<0,0001; Sb<0,00002; Bi<0,00001; Cd<0,000001; S 0,0007.
Един от източниците на замърсяване с атомен алуминий са проводници с графит, съдържащи желязо и силициев оксид и постоянно в контакт с рафиниран алуминий. Ако токът се подава директно към катодния алуминий с алуминиеви пръти и се използва много чист графитен инструмент, е възможно да се получи метал с чистота 99,999% по разлика с определените примеси (Fe, Si, Cu, Zn и Ti). Такъв метал съдържа средно,%: Si 0,0002; Fe 0,00032; Cu 0,0002; Zn 0,0002 и Ti 0,00005. Поради технически затруднения този метод за подаване на ток все още не е намерил широко индустриално приложение.
Производство на алуминий с висока чистота
Алуминият с висока чистота (клас A999) може да се получи по три начина: зонално топене, дестилация чрез субхалиди и електролиза на алуминиево-органични съединения. От горните методи за производство на алуминий с висока чистота, в СССР е получен практичен метод за топене на зони.
Принципът на топене на зоната е многократното преминаване на разтопената зона по алуминиев слитък. По стойността на коефициентите на разпределение К \u003d С телевизия / S w (къде C tv е концентрацията на примеси в твърдо вещество и C g - в течна фаза), които до голяма степен определят ефективността на пречистването от примеси, тези примеси могат да бъдат разделени на три групи. Първата група включва примеси, които понижават точката на топене на алуминия; K<1 , по време на топенето на зоната те се концентрират в разтопената зона и се пренасят от нея в крайната част на слитъка. Тези примеси включват Ga, Sn, Be, Sb, Ca, Th, Fe, Co, Ni, Ce, Te, Ba, Pt, Au, Bi, Pb, Cd, In, Na, Mg, Cu, Si, Ge , Zn. Втората група включва примеси, които увеличават точката на топене на алуминия; те се характеризират K\u003e 1 и по време на зоновото топене те се концентрират в твърдата (първоначалната) част на слитъка. Тези примеси включват Nb, Ta, Cr, Ti, Mo, V. Третата група включва примеси с коефициент на разпределение, много близък до единство (Mn, Sc). Тези примеси практически не се отстраняват по време на зонално топене на алуминий.
Алуминият, предназначен за зонално топене, се подлага на известна подготовка, която се състои в филтриране, дегазиране и офорт. Филтрацията е необходима, за да се отстрани от алуминия огнеупорен и силен оксиден филм, диспергиран в метала. Алуминиевият оксид, присъстващ в разтопен алуминий, може да образува центрове на кристализация, когато се втвърди, което води до образуването на поликристален слитък и нарушаване на преразпределението на примесите между твърдия метал и стопената зона. Алуминият се филтрира във вакуум (остатъчно налягане 0,1-0,4 Па) през отвор в дъното на графитен тигел с диаметър 1,5-2 мм. Предварителното дегазиране на алуминия преди топене в зоната (също нагряване във вакуум) се извършва, за да се предотврати пръскане на метал по време на топене в зоната в случай на процес във висок вакуум. Последният етап от приготвянето на алуминий за зонално топене е офорт на повърхността му със смес от концентрирана солна и азотна киселина.
Тъй като алуминият има значителна химическа активност и особено чист графит се използва като основен материал за контейнери (лодки), зоновото топене на алуминий се извършва във вакуум или в атмосфера на инертен газ (аргон, хелий).
Топенето на зоната във вакуум осигурява висока чистота на алуминия поради изпаряването на някои примеси по време на вакуум (магнезий, цинк, кадмий, алкалоземни и алкалоземни метали), а също така се елиминира замърсяването на пречистения метал с примеси в резултат на използването на защитни инертни газове. Зоновото топене на алуминий във вакуум може да се извърши по време на непрекъснато изпомпване на кварцова тръба, където се поставя графитна лодка с алуминиев слитък, както и в запечатани кварцови ампули, от които въздухът предварително се изпомпва до остатъчно налягане от около 1 ּ 10-3 Па.
За да се създаде разтопена зона на алуминиев слитък по време на топенето на нейната зона, отоплението може да се приложи с помощта на пещи с малък съпротивление или високочестотни токове. За захранване на електрически съпротивителни пещи не се изисква сложно оборудване; пещите са лесни за работа. Единственият недостатък на този метод на нагряване е малкият напречен разрез на слитъка от пречистен алуминий.
Индукционното отопление с високочестотни токове е идеален начин за създаване на разтопена зона на блокове по време на топене на зоната. Методът на високочестотно нагряване (в допълнение към позволяването на зонално топене на блокове с големи напречни сечения) позволява важното предимство разтопеният метал да се смесва непрекъснато в зоната; това улеснява дифузията на примесните атоми от фронта на кристализацията дълбоко в стопилката.
За първи път промишленото производство на алуминий с висока чистота чрез зонално топене е овладяно в Алуминиевия завод „Волхов“ през 1965 г. с помощта на инсталацията UZPI-3, разработена от ВАС. Тази настройка беше оборудвана с четири кварцови ретора с индукционно загряване, докато индукторите бяха подвижни, а контейнерите с метал - неподвижни. Производителността му беше 20 кг метал на цикъл на почистване. Впоследствие през 1972 г. в Алуминиевия завод „Волхов“ е създадена и пусната в търговска експлоатация по-високоефективна изцяло метална инсталация UZPI-4.
Ефективността на пречистването на алуминий по време на топене в зоната може да се характеризира със следните данни. Ако общото съдържание на примеси в електролитно рафинирания алуминий е (30–60) ּ 10–4%, то след зоновото топене намалява до (2.8–3.2) ּ 10–4%, т.е. 15–20 пъти. Това съответства на остатъчното електрическо съпротивление на алуминий ρ ○ (при температура на течен хелий 4,2 K), съответно (20–40) - 10–10 и (1,8–2,1) ּ 10–10, или чистота 99,997–99,994 и 99,9997%. В таблицата. 1.4 (виж по-долу) са показани данните от радиоактивен анализ на съдържанието на някои примеси в пречистен в зоната алуминий и електролитно рафиниран. Тези данни показват силно намаляване на съдържанието на повечето примеси, въпреки че примеси като манган и скандий практически не се отстраняват по време на топенето на зоните.
През последните години VAMI разработи и изпробва в индустриални условия технология за производство на алуминий с чистота 99,9999% чрез каскадно топене. Същността на метода на каскадно топене на зоната е, че пречистването на изходния алуминий с чистота A999 се осъществява чрез последователно повтаряне на цикли (каскади) на зоналната лента. В този случай изходният материал на всяка следваща каскада е средната, най-чистата част на слитъка, получена в резултат на предишния цикъл на почистване.
ТАБЛИЦА 1.4
| примес | Източник алуминий (електролитно рафиниран 99,993-99,994%) | Алуминий за топене на зони | |
| графит, вакуум | alund air | ||
| мед | 1,9 | 0,02 | 0,08 |
| арсен | 0,15 | 0,0015 | 0,001 |
| антимон | 1,2 | 0,03 | 0,02 |
| Уран | 0,002 | - | - |
| желязо | 3 | ≤0,2 | ≤0,3 |
| галий | 0,3 | 0,02 | 0,05 |
| манган | 0,2-0,3 | 0,1-0,2 | 0,15 |
| скандий | 0,4-0,5 | 0,4-0,5 | 0,4-0,5 |
| итрий | 0,02-0,04 | <<0,001 | <<0,001 |
| лутетий | 0,002-0,004 | <<0,0001 | <<0,0001 |
| холмий | 0,005-0,01 | <<0,0001 | <<0,0001 |
| гадолиний | 0,02-0,04 | <<0,01 | <<0,01 |
| тербий | 0,003-0,006 | <<0,001 | <<0,001 |
| самарий | 0,05-0,01 | <<0,0001 | <<0,0001 |
| неодим | 0,1-0,2 | <<0,01 | <<0,01 |
| празедиум | 0,05-0,1 | <<0,001 | <<0,001 |
| серий | 0,3-0,6 | <<0,01 | <<0,01 |
| лантан | 0,01 | <<0,001 | <<0,001 |
| никел | 2,3 | - | <1 |
| кадмий | 3,5 | <<0,01 | 0,02-0,07 |
| цинк | 20 | <<0,05 | 1 |
| кобалт | 0,01 | <<0,01 | <<0,01 |
| натрий | 1-2 | <0,2 | <0,2 |
| калий | 0,05 | 0,01 | 0,01 |
| барий | 6 | - | - |
| хлор | 0,01 | <0,01 | <0,01 |
| фосфор | 3 | 0,04 | - |
| сяра | 15 | 0,5-1,5 | - |
| въглероден | 1-2 | - | 1-2 |
| Забележка. Количествата телур, бисмут, сребро, молибден, хром, цирконий, калций, стронций, рубидий, церий, индий, селен и живак в алуминия след зонално топене са по-ниски от чувствителността на радиоактивния анализ. | |||
В таблицата. 1.5 (виж по-долу) показва резултатите от мас-спектралния анализ и измерване R 293 К / R 4.2 K алуминий, получен чрез каскадно топене. От горните данни може да се заключи, че чистотата на такъв алуминий, определена от разликата с десет основни примеси (Si, Fe, Mg, Mn, Ti, Cu, Cr, Zn, Na и V), е\u003e 99,9999%. Този извод се потвърждава косвено от стойността R 293 К / R 4.2 K, което във всички проби е\u003e 30 ּ 10 3.
За да се получи метал с чистота 99,9999%, е достатъчно да се извършат две каскади за зонално топене (виж таблица 1.5). По-нататъшното увеличаване на броя на каскадите не увеличава чистотата на алуминия, въпреки че увеличава общия добив на метал с чистота 99,9999%.
Друг възможен процес за получаване на алуминий с висока чистота е неговата дестилация през субхалиди, по-специално чрез алуминиев субфлуорид.
Налягането на наситените пари на алуминиевия метал не е достатъчно високо, за да го дестилира директно с практически приемливи скорости. Въпреки това, когато се нагрява във вакуум (при 1000-1050 ° С) с AlF 3, алуминият образува летлив AlF субфлуорид, който се дестилира в студена зона (800 ° С), където отново се разлага (непропорционално) с отделянето на чист алуминий:
Възможността за дълбоко пречистване на алуминия от примеси се дължи главно на факта, че вероятността от образуване на алуминиеви суб-съединения е много по-висока от вероятността за образуване на суб-съединения на примеса.
ТАБЛИЦА 1.5
РЕЗУЛТАТИ ОТ МАСА СПЕКТРАЛЕН АНАЛИЗ И ИЗМЕРВАНИЯ R 293 К / R 4.2 K АЛУМИНИЙ КАСКАДЕН ЗОНА МЕЛТ.
| Броят на каскадите | Съдържанието на примеси, × 10 -4% | ||||||
| си | Fe | Mg | Mn | Ti | сумата | ||
| родител | 18,3 | 0,210 | <0,103 | 0,89 | <0,061 | 0,069 | 1,544 |
| A999 | |||||||
| 2 | 36,5 | <0,062 | <0,103 | 0,006 | <0,061 | 0,017 | 0,460 |
| 2 | 38,0 | <0,062 | <0,103 | 0,006 | <0,061 | 0,017 | 0,460 |
| 2 | 39,5 | 0,073 | <0,103 | 0,045 | <0,061 | 0,07 | 0,563 |
| 3 | 32,0 | 0,204 | <0,103 | 0,006 | <0,061 | 0,017 | 0,502 |
| 3 | 30,0 | 0,073 | 0,100 | 0,006 | 0,020 | 0,07 | 0,480 |
| 3 | 32,0 | 0,052 | 0,100 | 0,006 | 0,061 | 0,07 | 0,500 |
| 4 | 40,0 | <0,021 | <0,103 | 0,006 | 0,061 | 0,07 | 0,472 |
| 4 | 30,5 | 0,031 | 0,100 | 0,006 | 0,061 | 0,07 | 0,479 |
| 5 | 34,0 | 0,104 | <0,060 | 0,006 | 0,061 | 0,017 | 0,459 |
| Бележки: 1. Количеството примеси се дава, като се вземат предвид други примеси, чието съдържание във всички проби е × 10 -4%:<0,071 Cu; <0,038 Cr; 0,048 Zn; 0,017 Na; 0,037 V. 2. При подсчете суммы примесей принимали их максимальное значение, равное пределу чувствительности анализа, например <0,061 считали как 0,061. | |||||||
Съдържанието на примеси в алуминий, дестилиран чрез субфлуорид, е обратно свързано с масата на получените блокове. В блокове с тегло 1,5-1,7 kg, общото съдържание на примеси (Si, Fe, Cu, Mg) е 11 is 10–4%, а съдържанието на газ е 0,007 cm 3/100 g. Специфична остатъчна устойчивост (ρ ○) при температура на течния хелий за такъв метал е (1,7 ÷ 2,0) ּ 10–10 Ohm ּ cm. Дестилацията на алуминий чрез субфлуорид има няколко недостатъка (сравнително малка производителност, недостатъчно дълбоко пречистване от магнезий и др.), Следователно методът не е получил индустриално развитие.
Разработени са и методи за получаване на алуминий с висока чистота чрез електролиза на сложни органоалуминиеви съединения, които се различават по състав на електролити. Например в Германия се използва метод за електролиза на 50% разтвор на NaF2 Al (C2H5) 3 в толуен. Рафинирането се извършва при 100 ° С, напрежението върху клетката 1,0-1,5 V и плътността на тока 0,3-0,5 A / DM 2 с помощта на алуминиеви електроди. Катоден токов изход 99%. Електрохимичното рафиниране в електроалуминиевите електролити значително намалява съдържанието на манган и скандий, които на практика не се отстраняват по време на почистване на зоната. Недостатъците на този метод са ниската му производителност и високата опасност от пожар.
За по-дълбоко пречистване на алуминий и получаване на метал с чистота 99,99999% или повече може да се използва комбинация от горните методи: електролиза на органоалуминиеви съединения или сублимация чрез субфлуорид, последвано от зонално топене на получения алуминий. Например чрез многозонно пречистване на алуминий, получен чрез електролиза на органоалуминиеви съединения, е възможно да се получи метал с висока чистота със съдържание на примеси 10–9%: Fe 50; си<500; Cu 10; Mg 30; Mn5; Ti <500; Cr 20; Zn <50; Co <1; Ag <5; Sb <1 и Se 3.
приложение
Комбинацията от физични, механични и химични свойства на алуминия определя широкото му използване в почти всички области на технологията, особено под формата на сплавите му с други метали. В електротехниката алуминият успешно замества медта, особено при производството на твърди проводници, например в въздушни линии, кабели с високо напрежение, шини за разпределителни уреди, трансформатори (електропроводимостта на алуминия достига 65,5% от електропроводимостта на медта и е повече от три пъти по-лека от медта; със сечение, което осигурява същата проводимост, масата на алуминиевите проводници е половината от тази на медта). Ултрачистият алуминий се използва при производството на електрически кондензатори и токоизправители, чийто ефект се основава на способността на алуминиев оксиден филм да предава електрически ток само в една посока. Свръхчистият алуминий, пречистен чрез зонално топене, се използва за синтеза на полупроводникови съединения от тип A III B V, използвани при производството на полупроводникови устройства. Чистият алуминий се използва при производството на различни видове отражателни огледала. Алуминият с висока чистота се използва за защита на металните повърхности от атмосферна корозия (облицовка, алуминиева боя). Със сравнително ниско сечение на абсорбция на неутрон, алуминият се използва като структурен материал в ядрените реактори.
В алуминиеви резервоари с голям капацитет се съхраняват и транспортират течни газове (метан, кислород, водород и др.), Азотна и оцетна киселини, чиста вода, водороден прекис и хранителни масла. Алуминият е широко използван в оборудването и апаратите на хранително-вкусовата промишленост, за опаковане на хранителни продукти (под формата на фолио), за производство на различни видове домакински продукти. Потреблението на алуминий рязко се увеличи за декорацията на сгради, архитектурни, транспортни и спортни съоръжения.
В металургията алуминият (в допълнение към сплавите, базирани на него) е една от най-разпространените легиращи добавки в сплави на основата на Cu, Mg, Ti, Ni, Zn и Fe. Алуминият се използва и за разкисляване на стоманата преди изливането й във формата, както и в процесите на производство на определени метали по метода на алуминотермията. На основата на алуминия, SAP (агломерен алуминиев прах) е създаден от прахова металургия, която има висока топлинна устойчивост при температури над 300 ° C.
Алуминият се използва при производството на експлозиви (амонал, алуминотол). Различни алуминиеви съединения са широко използвани.
Производството и потреблението на алуминий непрекъснато нараства, като значително превъзхожда производството на стомана, мед, олово, цинк.
DIN (DeutschIndustrienorm) - индустриалният стандарт на Германия.
Технологичният процес на производство на алуминий включва три основни етапа:
1. Създаване на алуминий от алуминиеви руди;
2. Създаване на алуминий от алуминиев оксид;
3. Процесът на рафиниране на алуминий.
И в същото време използването на такова оборудване е необходимо:
оборудване за централна система за разпределение на алуминиев оксид;
електролизер;
катодна шина;
пречиствателни станции за сух газ;
монтажни, технологични и леярни кранове;
смукателни единици;
леярно оборудване;
оборудване на магазина за анодно сглобяване;
метални конструкции на производствени сгради.
Създаването на алуминиев оксид от руди - етап на производство на алуминий
Алуминиевият оксид може да бъде получен чрез три метода: киселинен, алкален и електролитичен. Най-популярен е алкалният метод. Същността на метода е, че алуминиевите разтвори започват да се разлагат много бързо с въвеждането на алуминиев хидроксид и разтворът, който остава след разпадане след изпаряване при интензивно разбъркване при температура 170 ° С, може отново да разтвори алуминия, съдържащ се в боксит. Този метод има следните основни етапи:
1. Приготвяне на боксит, който включва раздробяване и смилане в специални мелници. Каустична алкал, боксит и малко вар се изпращат до мелниците. Кашата, която се оказа, се изпраща за излугване.
2. Излугването на боксит предполага химичното му разлагане от съединение с воден разтвор на алкал. В този случай хидратите на алуминиев оксид, когато се комбинират с алкални, преминават в разтвора под формата на натриев алуминат, а силициевият диоксид, съдържащ се в боксит, комбиниран с алкал, преминава в разтвора под формата на натриев силикат. В разтвор тези съединения: натриев алуминат и натриев силикат образуват неразтворим натриев алумосиликат. Окисите на желязото и титана преминават в този остатък, което придава на остатъка червен оттенък. Такъв остатък е червената кал. Когато разтварянето на получения натриев алуминат завърши, той се разрежда с воден разтвор на алкал, докато понижава температурата до 100 ° С.
3. Отделянето на червената кал и алуминатния разтвор един от друг се дължи на измиване в сгъстители. След това червената кал се утаява, а останалият алуминатен разтвор се филтрира.
4. Разлагане на алуминатен разтвор. Филтрира се и се изпраща в големи контейнери с миксери. От този разтвор при охлаждане до 60 ° С и разбъркване постоянно се отделя алуминиев хидроксид. Поради факта, че процесът е неравномерен и много бавен и растежът на кристали от алуминиев хидроксид е много важен при по-нататъшната обработка, разлагащите все още добавят много твърд хидроксид към тези контейнери с миксери.
5. Производството на алуминиев хидроксид се извършва във вакуумни филтри и хидроциклони. Повечето хидроксид като семенен материал се връща към процедурата на разлагане. След промиване с вода, остатъкът се изпраща за калциниране; и филтратът също се връща към процеса.
6. Дехидратация на алуминиев хидроксид - последният етап на производството на алуминиев оксид. Провежда се в тръбни, постоянно въртящи се пещи. Суровият алуминиев хидроксид при преминаване през фурната е напълно изсушен и дехидратиран.
Създаването на алуминий от алуминиев оксид в производството също протича на няколко етапа.
1. Електролизата на алуминиевия оксид протича при температура в клетката - 970 ° C. Клетката има баня, облицована с въглеродни блокове, към която е свързан електрически ток. Освободеният течен алуминий се събира на въглищна основа и от там редовно се изпомпва. Въглеродните аноди се потапят в електролита отгоре, изгаряйки в атмосфера на кислород, който се отделя от алуминиев оксид и се отделя въглероден окис или диоксид.
2. Електролизата на алуминиев хлорид се извършва чрез превръщане на алуминиев оксид в реакционния съд в алуминиев хлорид. Тогава в изолирана баня се извършва електролизата на алуминиев хлорид. Хлорът, който се отделя в този случай, се изсмуква и изпраща за рециклиране. И алуминий се утаява в катода.
3. Намаляване на манганов алуминиев хлорид при освобождаване на алуминий. Поради контролираната кондензация замърсители, свързани с хлор, се отделят от потока на манганов хлорид. Когато се отделя хлор, мангановият хлорид се превръща в манганов оксид, който след това се редуцира до състояние на манган, който може да се рециклира.
Процес на рафиниране на алуминий в производството на алуминий
Рафинирането на електролиза с разлагане на водни солни разтвори за алуминий не е възможно. Тъй като степента на пречистване на индустриалния алуминий, която се получава чрез електролиза на криолит-алуминиев разтвор, ще бъде недостатъчна за някои цели, алуминият е още по-чист от метални и промишлени алуминиеви отпадъци поради рафиниране. Най-разпространеният метод на рафиниране е трислойна електролиза.
Алуминият се използва при производството на експлозиви (алумотол, амонал). Използват се голямо разнообразие от алуминиеви съединения. Производството и потреблението на алуминий непрекъснато нараства, много по-бързо от производството на мед, стомана, цинк и олово.
За получаване на мед се използват медни руди, както и медни отпадъци и техните сплави. Рудите съдържат 1 - 6% мед. Рудата, съдържаща по-малко от 0,5% мед, не се обработва, тъй като при сегашното технологично ниво извличането на мед от нея е нерентабилно.
В рудите медта е под формата на серни съединения (CuFeS 2 - халкопирит, Cu 2 S - халкозин, CuS - covelin), оксиди (CuO, CuO) и бикарбонати
Рудовата руда се състои от пирит (FeS 2), кварц (SiO2), различни съединения, съдържащи Al 2 O3, MgO, CaO и железни оксиди.
Рудите понякога съдържат значителни количества други метали (цинк, злато, сребро и други).
Има два метода за производство на мед от руди:
- хидро;
- пирометалургични.
Хидрометалургичната не намери своето широко приложение поради невъзможността да извлича благородни метали заедно с мед.
Пирометалургичният метод е подходящ за преработка на всички руди и включва следните операции:
- подготовка на руди за топене;
- матово топене;
- матова конверсия;
- рафиниране на мед.
Приготвяне на руди за топене
Приготвянето на руди се състои в обогатяване и изпичане. Обогатяването на медни руди се осъществява чрез флотация. Резултатът е меден концентрат, съдържащ до 35% мед и до 50% сяра. Обикновено концентратите се изгарят в пещи с кипящ слой, за да се намали съдържанието на сяра до оптимални стойности. По време на изпичането сярата се окислява при температура 750 - 800 ° С, част от сярата се отстранява с газове. Резултатът е продукт, наречен шлака.
Претопяване на матова
Матовото се топи в светлоотразителни или електрически пещи при температура 1250 - 1300 ° С. Топените концентрати на медни руди влизат в процеса на топене, по време на нагряването на който протичат реакции на редукция на меден оксид и по-високи железни оксиди
6CuO + FeS \u003d 3Cu 2O + FeO + SO2
FeS + 3Fe 3 O 4 + 5SiO 2 \u003d 5 (2FeO · SiO 2) + SO 2
В резултат на взаимодействието на Cu 2O с FeS, Cu 2 S се образува чрез реакцията:
Cu 2 O + FeS \u003d Cu 2 S + FeO
Сулфидите на мед и желязо, слети заедно, образуват матови и разтопени силикати на желязо, разтваряйки други оксиди, образуват шлака. Матовият съдържа 15 - 55% Cu; 15 до 50% Fe; 20-30% S. Шлаката се състои главно от SiO 2, FeO, CaO, Al 2 O 3.
Матата и шлаката се отделят, докато се натрупват през специални отвори.
Матово преобразуване
Матовата се преобразува в мелница (Фигура 44) чрез издухването й с въздух за окисляване на сярно желязо, прехвърляне на желязо в шлака и изолиране на блистерна мед.
Преобразувателите са с дължина 6 - 10 м и външен диаметър 3 - 4 м. Разтопеният мат се излива, стопяващите се продукти се оттичат и газовете се отстраняват през шийка, разположена в средата на корпуса на конвертора. За пречистване на матовия сгъстен въздух се подава през тръби, разположени по протежение на генератора на конвертора. В една от крайните стени на конвертора е разположен отвор, през който се извършва пневматично зареждане на кварцов поток, което е необходимо за отстраняване на желязо в шлаката.
Процесът на прочистване се извършва в два периода. През първия период матът се излива в конвертора и се подава кварцов поток. В този период настъпват реакции на окисление на сулфид.
Полученият железен оксид взаимодейства с кварцовия поток и се отстранява до шлака.
Тъй като шлаката се натрупва, тя частично се източва и нова част от първоначалния матиран се излива в конвертора, поддържайки определено ниво на матовост в конвертора. Във втория период медният оксид взаимодейства с меден сулфид, за да образува метална мед
По този начин в резултат на пречистването се получава мехур с мед, съдържащ 98.4 - 99.4% Cu. Получената блистерна мед се излива в плоски форми на машина за леене на лента.
Технология за производство на магнезий
Основният метод за получаване на магнезий е електролитичен. Електролитичното производство на магнезий от водни разтвори е невъзможно, тъй като електрохимичният потенциал на магнезия е много по-отрицателен от потенциала за отделяне на водородни йони на катода. Следователно, електролизата на магнезий се извършва от неговите разтопени соли.
Основният компонент на електролита е магнезиев хлорид MgCl2, а в него се въвеждат NaCl, CaCl2, KCl и малки количества NaF и CaF2 за понижаване на температурата на топене на електролита и повишаване на неговата електропроводимост.
Основните суровини за производството на магнезий са карналит (MgCl2 KCl 6H2O), магнезит (MgCO3), доломит (CaCO3 MgCO3), бишофит (MgCl2 6H2O). Най-голямо количество магнезий се получава от карналит.
Основните етапи на производството на магнезий:
1. Карналит;
2. Обогатяване на карналит;
3. Дехидратация на карналит;
4. Електролитично производство на магнезий;
5. Рафиниране на магнезий;
6. Магнезий.
Обогатяването на карналит е първият етап от неговата обработка. Същността на процеса на обогатяване е да се отделят KCl и неразтворимите примеси чрез прехвърляне на MgCl2 и KCl във воден разтвор. Когато полученият разтвор се охлади във вакуумни кристализатори, кристали от утайка от изкуствен карналит MgCl2 KCl 6H2O, които се разделят чрез филтриране.
Карналит се дехидратира на два етапа. Първият етап се провежда в тръбни пещи или пещи с кипящ слой при 550-600 ° С. Под въздействието на топлината на нагрятите газове карналитът се дехидратира и след тази обработка съдържа 3-4% влага.
Вторият етап на дехидратация се извършва или чрез стопяване на получения след първия етап карналит в електрически пещи, последвано от утаяване на магнезиев оксид, или хлориране на карналит в разтопено състояние.
Електролитично производство на магнезий. За тази цел се използва електролизатор, който е вътрешно облицован с тухли с тухли. Анодите са графитни плочи, а катодите са стоманени плочи, разположени от двете страни на анода.
За електролитичното разлагане на магнезиевия хлорид през електролита се пропуска ток от 2,7-2,8 V.
В резултат на електролитичното разлагане на магнезиевия хлорид се образуват хлорни йони, които се придвижват към анода и след изхвърлянето създават хлорни мехурчета, излизащи от електролита. Магнезиевите йони се придвижват към катода и след изпускане се отделят на повърхността, образувайки капчици течен магнезий. Магнезият има по-ниска плътност от електролита, така че той плава на повърхността му в катодното пространство, откъдето периодично се отстранява с помощта на вакуумна кофа.
По време на електролиза концентрацията на други хлориди в електролита се увеличава поради консумацията на MgCl2. Поради това периодично част от отработения електролит се отстранява от банята и вместо нея се излива MgCl2 или карналитна стопилка. В резултат на частичното разлагане на примесите, на дъното на банята се образува утайка, която редовно се отстранява от банята.
Рафиниране на магнезий. В баните за електролиза се получава груб магнезий, който съдържа 5% примеси: метални примеси (Fe, Na, K, Al, Ca) и неметални примеси (MgCl2, KCl, NaCl, CaCl2, MgO). Магнезият се рафинира (рафинира) чрез разтопяване с флюси.


