21.07.2019
Взаимодействието на алкали с киселини. Натриев хидроксид
натрий се отнася до алкални метали и се разпространява в основната подгрупа на първата група PSE тях. DI Менделеев. На външно енергийно ниво на своя атом на сравнително голямо разстояние от ядрото е един електрон, който атоми алкални метали те се раздават доста лесно, превръщайки се в еднократно заредени катиони; това обяснява много високата химична активност на алкалните метали.
Често срещан метод за получаване на алкален е електролизата на техните разтопени соли (обикновено хлориди).
Натрият като алкален метал се характеризира с ниска твърдост, ниска плътност и ниска точка на топене.
Натрият, взаимодействащ с кислорода, образува главно натриев пероксид
2 Na + O2 Na2O2
Намаляването на пероксидите и суперпероксидите с излишък на алкален метал може да произведе оксид:
Na2O2 + 2 Na 2 Na2O
Натриевите оксиди взаимодействат с водата и образуват хидроксид: Na2O + H2O → 2 NaOH.
Пероксидите са напълно хидролизирани от водата с образуването на алкали: Na2O2 + 2 HOH → 2 NaOH + H2O2
Както всички алкални метали, натрият е силен редуциращ агент и взаимодейства енергично с много неметали (с изключение на азот, йод, въглерод и благородни газове):
Той реагира изключително слабо с азота при светлинен разряд, образувайки много нестабилно вещество - натриев нитрид
Той взаимодейства с разредени киселини като нормален метал:
При концентрирани окислителни киселини се отделят продукти за редукция:
Натриев хидроксид NaOH (каустична алкал) е силна химическа основа. В промишлеността натриевият хидроксид се получава по химически и електрохимични методи.
Методи за химическо производство:
Вар, който се състои във взаимодействието на разтвор на сода с варово мляко при температура около 80 ° С. Този процес се нарича каустификация; Преминава през реакцията:
Na2CO3 + Ca (OH) 2 → 2NaOH + CaCO3
Ферит, който включва два етапа:
Na 2 CO 3 + Fe 2 O 3 → 2NaFeO 2 + CO 2
2NaFeO 2 + xH 2 О \u003d 2NaOH + Fe 2 O 3 * xH 2 О
Електрохимично, натриевият хидроксид се получава чрез електролиза на разтвори на халит (минерал, състоящ се главно от натриев хлорид NaCl) с едновременно производство на водород и хлор. Този процес може да бъде представен чрез общата формула:
2NaCl + 2H2O ± 2- → H 2 + Cl2 + 2NaOH
Натриевият хидроксид реагира:
1) неутрализация:
NaOH + HCl → NaCl + H20
2) обмен със соли в разтвор:
2NaOH + CuSO 4 → Cu (OH) 2 ↓ + Na2S04
3) реагира с неметали
3S + 6NaOH → 2Na 2S + Na2SO3 + 3H20
4) реагира с метали
2Al + 2NaOH + 6H20 → 3H2 + 2Na
Натриевият хидроксид се използва широко в различни индустрии, например при готвене на целулоза, за осапуняване на мазнини при производството на сапун; като катализатор за химични реакции при производството на дизелово гориво и др.
Натриев карбонаттой се произвежда или под формата на Na 2 CO 3 (сода пепел), или под формата на кристален хидрат Na 2 CO 3 * 10H 2 O (кристална сода), или под формата на NaHCO 3 бикарбонат (сода за пиене).
Най-често содата се произвежда по амонячно-хлоридния метод, въз основа на реакцията:
NaCl + NH4 HCO 3 ↔ NaHCO 3 + NH4Cl
Много индустрии консумират натриеви карбонати: химически, сапун, целулозно-хартиени, текстилни, хранителни и др.
Физични свойства
Натриев хидроксид
Термодинамика на разтворите
Δ H 0 разтваряне за безкрайно разреден воден разтвор от -44,45 kJ / mol.
Монохидрат (ромбичен сингоний) кристализира от водни разтвори при 12.3 - 61.8 ° С, точка на топене 65.1 ° С; плътност 1,829 g / cm³; ΔH 0 прис −734.96 kJ / mol), в диапазона от -28 до -24 ° С - хептахидрат, от -24 до -17.7 ° С - пентахидрат, от -17.7 до -5.4 ° С - тетрахидрат ( α-модификация), от -5.4 до 12.3 ° C. Разтворимостта в метанол е 23.6 g / l (t \u003d 28 ° C), в етанол 14.7 g / l (t \u003d 28 ° C). NaOH · 3.5H20 (точка на топене 15.5 ° C);
Химични свойства
(като цяло такава реакция може да бъде представена с просто йонно уравнение, реакцията протича с отделяне на топлина (екзотермична реакция): OH - + H30 + → 2H20.)
- с амфотерни оксиди, които имат както основни, така и киселинни свойства и способността да реагират с основи, както с твърди сплави:
ZnO + 2NaOH → Na 2 ZnO 2 + H 2 O
така че с решения:
ZnO + 2NaOH (разтвор) + H 2 O → Na 2 (разтвор)+ Н2
(Полученият анион се нарича тетрахидроксоцинкатен йон, а солта, която може да бъде изолирана от разтвора, се нарича натриев тетрахидроксоцинкат. Натриевият хидроксид влиза в подобни реакции с други амфотерни оксиди.)
- с кисели оксиди - с образуването на соли; това свойство се използва за почистване на промишлени емисии от киселинни газове (например: CO 2, SO 2 и H 2 S):
2Na + + 2OH - + Cu 2+ + SO 4 2- → Cu (OH) 2 ↓ + Na 2 SO 4
Натриевият хидроксид се използва за утаяване на метални хидроксиди. Например, гелообразен алуминиев хидроксид се получава, като действа с натриев хидроксид върху алуминиев сулфат във воден разтвор. Използва се, по-специално, за пречистване на водата от фините суспензии.
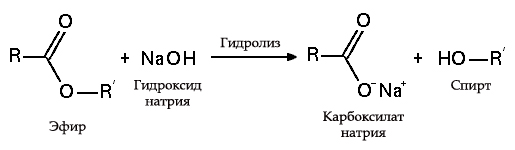
Хидролиза на естери
- с мазнини (осапуняване) такава реакция е необратима, тъй като получената киселина с алкални образува сапун и глицерин. Впоследствие глицеринът се екстрахира от подложките за сапун чрез вакуумно изпаряване и допълнително пречистване на дестилацията на получените продукти. Този метод за получаване на сапун е известен в Близкия изток от VII век:
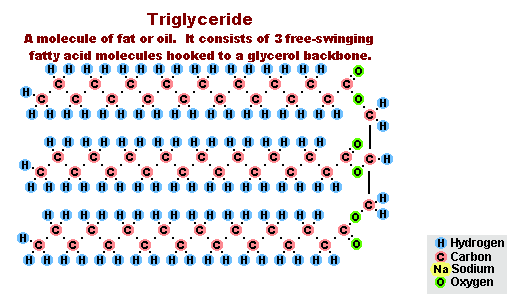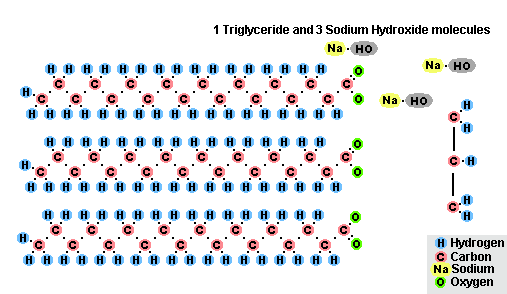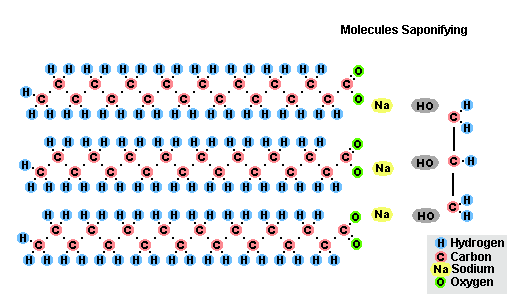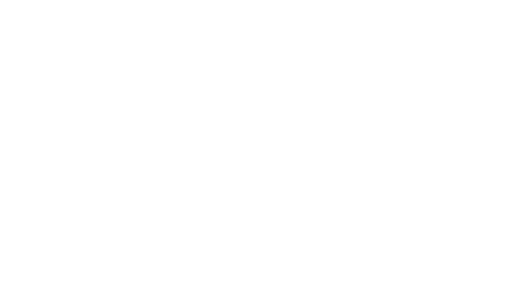
Процес на осапуняване на мазнини
В резултат на взаимодействието на мазнини с натриев хидроксид се получават твърди сапуни (те се използват за производство на сапуни), а с калиев хидроксид те са твърди или течни сапуни, в зависимост от състава на мазнините.
HO-CH2 -CH2OH + 2NaOH → NaO-CH2 -CH2 -ONa + 2H20
2NaCl + 2H20 \u003d H2 + Cl2 + 2NaOH,В момента каустичните алкали и хлорът се получават по три електрохимични метода. Две от тях са електролиза с твърд азбест или полимерен катод (методи за производство на диафрагма и мембрана), третата е електролиза с течен катод (метод за получаване на живак). Сред електрохимичните методи на производство най-лесният и удобен начин е електролизата с живачен катод, но този метод причинява значителна вреда на околната среда в резултат на изпаряване и изтичане на метален живак. Методът за производство на мембрана е най-ефективният, най-малко енергоемкият и най-екологичният, но също така и най-капризният, в частност изисква суровини с по-висока чистота.
Каустичната алкал, получена чрез електролиза с течен живачен катод, е много по-чиста от получената по метода на диафрагмата. За някои отрасли това е важно. Така че при производството на изкуствени влакна може да се използва само каустик, получен чрез електролиза с течен живачен катод. В световната практика се използват и трите метода за производство на хлор и каустик, с ясна тенденция към увеличаване на дела на мембранната електролиза. В Русия приблизително 35% от общия произведен каустик се произвежда чрез електролиза с живачен катод и 65% от електролиза с твърд катод (диафрагмен и мембранен метод).
Ефективността на производствения процес се изчислява не само от добива на сода каустик, но и от добива на хлор и водород, получени чрез електролиза, съотношението хлор и натриев хидроксид на изхода е 100/110, реакцията протича в следните съотношения:
1,8 NaCl +0,5 H20 + 2,8 MJ \u003d 1,00 Cl 2 + 1,10 NaOH + 0,03 H2,Основните показатели за различните методи на производство са дадени в таблицата:
| Индикаторът за 1 тон NaOH | Метод на живак | F-stop метод | Мембранен метод |
|---|---|---|---|
| Добив на хлор,% | 97 | 96 | 98,5 |
| Електричество (кВтч) | 3 150 | 3 260 | 2 520 |
| Концентрация на NaOH | 50 | 12 | 35 |
| Чистота на хлора | 99,2 | 98 | 99,3 |
| Чистота на водорода | 99,9 | 99,9 | 99,9 |
| Масова част на O 2 в хлор,% | 0,1 | 1-2 | 0,3 |
| Масова част на Cl - в NaOH,% | 0,003 | 1-1,2 | 0,005 |
Диаграма на процеса на твърд катод
F-stop метод - Кухината на електролизатора с твърд катод е разделена с пореста септума - диафрагмата - в пространство на катода и анода, където съответно са разположени катода и анода на електролизатора. Следователно, такъв електролизатор често се нарича диафрагма, а методът на производство се нарича диафрагмена електролиза. Наситеният анолитен поток непрекъснато навлиза в анодното пространство на диафрагмения електролизатор. В резултат на електрохимичния процес хлорът се отделя на анода поради разлагането на халит, а водорода на катода поради разлагането на водата. Хлорът и водородът се отделят от клетката отделно, без да се смесват:
2Cl - - 2 д \u003d Cl20, H20 - 2 д - 1/2 O 2 \u003d H2.
В този случай катодната зона се обогатява с натриев хидроксид. Разтворът от катодната зона, наречен електролитичен алкал, съдържащ неразложен анолит и натриев хидроксид, се отстранява непрекъснато от електролизатора. На следващия етап електролитичната основа се изпарява и съдържанието на NaOH в нея се настройва на 42-50% в съответствие със стандарта. Утайка от халит и натриев сулфат с увеличаване на концентрацията на натриев хидроксид. Разтвор на каустична алкал се декантира от утайката и се прехвърля като завършен продукт в склада или на етапа на изпаряване, за да се получи твърд продукт, последвано от топене, мащабиране или гранулиране. Кристалният халит (обратна сол) се връща на електролиза, приготвяйки от него така наречената обратна солна луга. Сулфатът се извлича от него, за да се избегне натрупването на сулфат в разтвори, преди да се приготви обратната солна луга. Загубата на анолити се компенсира чрез добавяне на прясна саламура, получена чрез подземно излугване на слоеве сол или чрез разтваряне на твърд халит. Пресният саламура преди смесването му с обратната солна луга се почиства от механични суспензии и значителна част от калциеви и магнезиеви йони. Полученият хлор се отделя от водна пара, пресова се и се подава или за получаване на продукти, съдържащи хлор, или за втечняване.
Мембранен метод - подобно на диафрагмата, но анодното и катодното пространство са разделени от катионообменна мембрана. Мембранната електролиза осигурява най-чистият каустик.
Технологична схема електролиза.Основният технологичен етап е електролиза, основният апарат е електролитична баня, която се състои от електролизатор, декомпозитор и живачна помпа, свързани помежду си чрез комуникации. В електролитична баня живакът циркулира под действието на живачна помпа, преминавайки през електролизатор и декомпозитор. Катодът на електролизатора е поток от живак. Аноди - графит или слабо износване. Заедно с живак, през електролизатора непрекъснато тече анолитен поток - разтвор на халит. В резултат на електрохимичното разлагане на халит се образуват Cl - йони на анода и се отделя хлор:
2 Cl - - 2 д \u003d Cl 2 0,
който се отделя от електролизатора и при живачния катод се образува слаб разтвор на натрий в живак, така наречената амалгама:
Na + + e \u003d Na 0 nNa + + nHg - \u003d Na + HgАмалгамата непрекъснато тече от клетката към декомпозитора. Добре почистената от примеси вода също непрекъснато се подава в декомпозитора. В него натриевата амалгама в резултат на спонтанен електрохимичен процес е почти напълно разградена от водата с образуването на живак, разтвор на каустик и водород:
Na + Hg + H2 0 \u003d NaOH + 1 / 2H 2 + HgПолученият по този начин разяждащ разтвор, който е търговски продукт, не съдържа халитови примеси, вредни при производството на вискоза. Меркурий почти напълно се освобождава от натриевата амалгама и се връща в клетката. Водородът се отделя за лечение. Анолитът, който излиза от електролизатора, се насища с пресен халит, примесите, въведени с него, се отстраняват от него, както и се измиват от анодите и структурните материали и се връщат към електролизата. Преди насищане разтвореният в него хлор се екстрахира от анолита при дву- или триетапен процес.
Лабораторни методи за получаване
В лабораторията натриевият хидроксид се получава по химически методи, които са повече исторически, отколкото практически.
Варовит метод Получаването на натриев хидроксид е взаимодействието на соден разтвор с варово мляко при температура около 80 ° С. Този процес се нарича каустификация; Описва се чрез реакцията:
Na2C0 3 + Ca (OH) 2 \u003d 2NaOH + CaC03В резултат на реакцията се образува разтвор на натриев хидроксид и утайка от калциев карбонат. Калциевият карбонат се отделя от разтвора, който се изпарява до получаване на разтопен продукт, съдържащ около 92% NaOH. Разтопеният NaOH се излива в железни барабани, където се втвърдява.
Феритен метод описани от две реакции:
Na 2 C0 3 + Fe 2 0 3 \u003d Na 2 0 Fe 2 0 3 + C0 2 (1) Na 2 0 Fe 2 0 3 -f H 2 0 \u003d 2 NaOH + Fe 2 O 3 (2)(1) - процесът на синтероване на калцинирана сода с железен оксид при температура 1100-1200 ° C. В този случай се образува натриев сперит ферит и се отделя въглероден диоксид. След това тортата се обработва (излужва) с вода съгласно реакция (2); се получава разтвор на натриев хидроксид и утайка от Fe203, която след отделянето му от разтвора се връща към процеса. Разтворът съдържа около 400 g / l NaOH. Изпарява се до получаване на продукт, съдържащ около 92% NaOH.
Химическите методи за производство на натриев хидроксид имат значителни недостатъци: изразходва се голямо количество гориво, произвежданата каустична сода е замърсена с примеси, а поддръжката на апарата отнема много време. В момента тези методи са почти напълно заменени от електрохимичния метод на производство.
Пазар на сода каустик
Световно производство на сода каустик, 2005 г.| производител | Обем на производството, милиони тона | Дял в световното производство |
|---|---|---|
| DOW | 6.363 | 11.1 |
| Случайна химическа компания | 2.552 | 4.4 |
| Формоза пластмаса | 2.016 | 3.5 |
| PPG | 1.684 | 2.9 |
| Bayer | 1.507 | 2.6 |
| Akzo nobel | 1.157 | 2.0 |
| Tosoh | 1.110 | 1.9 |
| Arkema | 1.049 | 1.8 |
| Олин | 0.970 | 1.7 |
| Русия | 1.290 | 2.24 |
| Китай | 9.138 | 15.88 |
| друг | 27.559 | 47,87 |
| Общо: | 57,541 | 100 |
TP - твърд живак (люспест);
TD - твърда диафрагма (слята);
PP - живачен разтвор;
PX - химичен разтвор;
RD - диафрагмен разтвор.
| Име на индикатора | TR OKP 21 3211 0400 | TD OKP 21 3212 0200 | RR OKP 21 3211 0100 | PX 1 клас OKP 21 3221 0530 | PX 2 клас OKP 21 3221 0540 | RD Най-висок клас OKP 21 3212 0320 | RD първи клас OKP 21 3212 0330 |
|---|---|---|---|---|---|---|---|
| вид | Лющеща се бяла маса. Допуска се леко оцветяване | Разтопената маса е бяла. Допуска се леко оцветяване | Безцветна бистра течност | Безцветна или оцветена течност. Допуска се кристализация на утайка | Безцветна или оцветена течност. Допуска се кристализация на утайка | Безцветна или оцветена течност. Допуска се кристализация на утайка | |
| Масова част на натриев хидроксид,%, не по-малко | 98,5 | 94,0 | 42,0 | 45,5 | 43,0 | 46,0 | 44,0 |
| Име на предприятието | 2005 хиляди тона | 2006 хиляди тона | дял през 2005 г.% | дял през 2006 г.% |
|---|---|---|---|---|
| OJSC Caustic Sterlitamak | 239 | 249 | 20 | 20 |
| OJSC "Caustic", Волгоград | 210 | 216 | 18 | 18 |
| Sayanskkhimplast OJSC | 129 | 111 | 11 | 9 |
| LLC Usoliekhimprom | 84 | 99 | 7 | 8 |
| "Сибур-Нефтехим" АД | 87 | 92 | 7 | 8 |
| OJSC "Химпром", Чебоксари | 82 | 92 | 7 | 8 |
| VOAO Химпром, Волгоград | 87 | 90 | 7 | 7 |
| ЗАТ Илимхимпром | 70 | 84 | 6 | 7 |
| KCHKhK OJSC | 81 | 79 | 7 | 6 |
| NAC "Азот" | 73 | 61 | 6 | 5 |
| "Химпром" АД, Кемерово | 42 | 44 | 4 | 4 |
| Общо: | 1184 | 1217 | 100 | 100 |
| Име на предприятието | 2005 тона | 2006 тона | дял през 2005 г.% | дял през 2006 г.% |
|---|---|---|---|---|
| OJSC "Caustic", Волгоград | 67504 | 63510 | 62 | 60 |
| OJSC Caustic Sterlitamak | 34105 | 34761 | 31 | 33 |
| "Сибур-Нефтехим" АД | 1279 | 833 | 1 | 1 |
| VOAO Химпром, Волгоград | 5768 | 7115 | 5 | 7 |
| Общо: | 108565 | 106219 | 100 | 100 |
приложение
биодизел

Лютефиск на треската по случай празника на Конституцията на Норвегия

Немски геврек
Сода каустик Използва се в най-различни индустрии и за битови нужди:
- Каустикът се използва при целулозно-хартиена промишленост за делигнификация (Kraft Reaction) на целулоза, при производството на хартия, картон, изкуствени влакна, фибропласт.,
- За осапуняване на мазнини с производството на сапун, шампоан и други перилни препарати, В древността пепелта се добавяла към водата по време на измиване и, както изглежда, домакините забелязали, че ако пепелта съдържа мазнини, попадащи в огнището по време на готвене, съдовете се мият добре. Професията на производителя на сапун (saponarius) за първи път се споменава около 385 г. сл. Хр. д. Теодор Прискиан. Арабите произвеждат сапун от масла и сода от VII век; днес сапуните се произвеждат по същия начин, както преди 10 века.
- Най- химическа промишленост - за неутрализиране на киселини и киселинни оксиди като реагент или винилови или гумирани костюми.
MAC натриев хидроксид във въздух 0,5 mg / m³.
литература
- Обща химическа технология. Ед. И. П. Мухленова. Учебник за химични и технологични специалности на университетите. - М .: Висше училище.
- Основи на общата химия, том 3, Б. В. Некрасов. - М.: Химия, 1970.
- Обща химическа технология. Фурмер И.Е., Зайцев В. Н. - М .: Висше училище, 1978г.
- Заповед на Министерството на здравеопазването на Руската федерация от 28 март 2003 г. N 126 „За одобряване на Списъка на вредните производствени фактори, под влияние на които се препоръчва употребата на мляко или други еквивалентни хранителни продукти за превантивни цели“.
- Указ на главния държавен санитарен лекар на Руската федерация от 4 април 2003 г. N 32 „За въвеждане на санитарните правила за организация на железопътния превоз на товари. SP 2.5.1250-03 ".
- Федерален закон от 21 юли 1997 г. N 116-ФЗ „Промишлена безопасност на опасни производствени съоръжения“ (изменен на 18 декември 2006 г.).
- Заповед на Министерството на природните ресурси на Руската федерация от 2 декември 2002 г. N 786 „За одобряването на федералния каталог на класификацията на отпадъците“ (изменена и допълнена на 30 юли 2003 г.).
- Указ на Държавния комитет по труда на СССР от 25.10.1974 г. N 298 / P-22 „За одобряване на списъка на промишлеността, магазините, професиите и длъжностите с вредни условия на труд, работа в която дава право на допълнителен отпуск и съкратено работно време“ (изменена на 29 май 1991 г. ).
- Постановление на Министерството на труда на Русия от 22 юли 1999 г. N 26 „За одобряването на стандартни индустриални стандарти за безплатно издаване на специално облекло, специални обувки и други лични предпазни средства за работници в химическата промишленост“.
- Указ на главния държавен санитарен лекар на Руската федерация от 05.30.2003 г. N 116 за въвеждане в сила на БН 2.1.6.1339-03 „Прогнозни нива на безопасна експозиция (SEC) на замърсители в атмосферния въздух на населените места.“ (Изменена на 3 ноември 2005 г.). Илюстриран енциклопедичен речник
НАРОДЕН ХИДРОКСИД - (каустична сода, сода каустик, каустик) Безцветно твърдо кристално вещество NaOH, плътност 2130 kg m. t \u003d 320 ° C; когато се разтвори във вода, се отделя голямо количество топлина; разрушителен ефект върху кожата, тъканите, хартията, опасен ... ... Голяма политехническа енциклопедия
- (сода каустик, сода каустик), NaOH, здрава основа (алкална). Безцветни кристали (бяла непрозрачна маса на технически продукт). Хигроскопичен, разтворим във вода, отделяйки голямо количество топлина. Получаване чрез електролиза на разтвор ... Енциклопедичен речник
натриев хидроксид - natrio hidroksidas statusas T sritis chemija formulė NaOH atitikmenys: angl. сода каустик; натриев хидроксид рус. натриевата основа; сода каустик; натриев хидроксид; натриев хидроксид ryšiai: sinonimas - natrio šarmas sinonimas - kaustinė soda ... Chemijos terminų aiškinamasis žodynas
- (сода каустик, сода каустик), NaOH, здрава основа (алкална). Bestsv. кристали (технологичен продукт бяла непрозрачна маса). Хигроскопичен, разтворим във вода, отделяйки голямо количество топлина. Получават се чрез електролиза на разтвор на натриев хлорид ... Естествена история. Енциклопедичен речник
- (сода каустик) NaOH, безцветен. кристали; до 299 ° C ромбичната е стабилна. модификация (a \u003d 0,33994 nm, c \u003d 1,1377 nm), по-висока от 299 o С моноклин; DH0 полиморфен преход 5,85 kJ / mol; т. пл. 323 ° C, t. 1403 ° С; здраво. 2,02 g / cm3; ... Химична енциклопедия
Сода каустик, каустик, безцветен кристален NaOH. маса, плътно. 2130 kg / m3, t Pl 320 ° С, разтворимост във вода 52,2% (при 20 ° С). Силна основа, увреждаща животинската тъкан; особено опасно е да получите капки на Н. в очите. ... ... Голям енциклопедичен политехнически речник
Силна алкал, широко използвана като почистващо средство. Когато натриевият хидроксид навлезе в повърхността на кожата, причинява силно химическо изгаряне; в този случай незабавно измийте засегнатата област с голямо количество кожа ... ... Медицински термини
НАРОДЕН ХИДРОКСИД, КАВСТИЧНА СОДА - (сода каустик) силна основа, широко използвана като почистващо средство. Когато натриевият хидроксид навлезе в повърхността на кожата, причинява силно химическо изгаряне; в този случай незабавно измийте засегнатата зона на кожата ... ... Обяснителен медицински речник
Както натриевият хидроксид, така и други алкали, името „каустична алкал“ се дължи на способността да корозира кожата, хартията и стъклото и да причини силни изгаряния. До 17-ти век, алкални (Fr. основа) бяха наричани още натриеви и калиеви карбонати. На френски език ученият А. Л. Дюхамел дю Монсо за първи път разграничи тези вещества: натриевият хидроксид стана известен като сода каустик, натриевият карбонат като сода пепел (от растението Salsola Soda, от която се добива) и калиев карбонат като поташ. В момента содата се нарича натриеви соли на въглеродна киселина. На английски и френски думата натрий означава натрий, калий - калий.
Физични свойства
Натриев хидроксид
Термодинамика на разтворите
Δ H 0 разтваряне за безкрайно разреден воден разтвор от -44,45 kJ / mol.
Монохидрат (ромбичен сингоний) кристализира от водни разтвори при 12.3 - 61.8 ° С, точка на топене 65.1 ° С; плътност 1,829 g / cm³; ΔH 0 прис −734.96 kJ / mol), в диапазона от -28 до -24 ° С - хептахидрат, от -24 до -17.7 ° С - пентахидрат, от -17.7 до -5.4 ° С - тетрахидрат ( α-модификация), от -5.4 до 12.3 ° C. Разтворимостта в метанол е 23.6 g / l (t \u003d 28 ° C), в етанол 14.7 g / l (t \u003d 28 ° C). NaOH · 3.5H20 (точка на топене 15.5 ° C);
Химични свойства
(като цяло такава реакция може да бъде представена с просто йонно уравнение, реакцията протича с отделяне на топлина (екзотермична реакция): OH - + H30 + → 2H20.)
- с амфотерни оксиди, които имат както основни, така и киселинни свойства и способността да реагират с основи, както с твърди сплави:
ZnO + 2NaOH → Na 2 ZnO 2 + H 2 O
така че с решения:
ZnO + 2NaOH (разтвор) + H 2 O → Na 2 (разтвор)+ Н2
(Полученият анион се нарича тетрахидроксоцинкатен йон, а солта, която може да бъде изолирана от разтвора, се нарича натриев тетрахидроксоцинкат. Натриевият хидроксид влиза в подобни реакции с други амфотерни оксиди.)
- с кисели оксиди - с образуването на соли; това свойство се използва за почистване на промишлени емисии от киселинни газове (например: CO 2, SO 2 и H 2 S):
2Na + + 2OH - + Cu 2+ + SO 4 2- → Cu (OH) 2 ↓ + Na 2 SO 4
Натриевият хидроксид се използва за утаяване на метални хидроксиди. Например, гелообразен алуминиев хидроксид се получава, като действа с натриев хидроксид върху алуминиев сулфат във воден разтвор. Използва се, по-специално, за пречистване на водата от фините суспензии.

Хидролиза на естери
- с мазнини (осапуняване) такава реакция е необратима, тъй като получената киселина с алкални образува сапун и глицерин. Впоследствие глицеринът се екстрахира от подложките за сапун чрез вакуумно изпаряване и допълнително пречистване на дестилацията на получените продукти. Този метод за получаване на сапун е известен в Близкия изток от VII век:

Процес на осапуняване на мазнини
В резултат на взаимодействието на мазнини с натриев хидроксид се получават твърди сапуни (те се използват за производство на сапуни), а с калиев хидроксид те са твърди или течни сапуни, в зависимост от състава на мазнините.
HO-CH2 -CH2OH + 2NaOH → NaO-CH2 -CH2 -ONa + 2H20
2NaCl + 2H20 \u003d H2 + Cl2 + 2NaOH,В момента каустичните алкали и хлорът се получават по три електрохимични метода. Две от тях са електролиза с твърд азбест или полимерен катод (методи за производство на диафрагма и мембрана), третата е електролиза с течен катод (метод за получаване на живак). Сред електрохимичните методи на производство най-лесният и удобен начин е електролизата с живачен катод, но този метод причинява значителна вреда на околната среда в резултат на изпаряване и изтичане на метален живак. Методът за производство на мембрана е най-ефективният, най-малко енергоемкият и най-екологичният, но също така и най-капризният, в частност изисква суровини с по-висока чистота.
Каустичната алкал, получена чрез електролиза с течен живачен катод, е много по-чиста от получената по метода на диафрагмата. За някои отрасли това е важно. Така че при производството на изкуствени влакна може да се използва само каустик, получен чрез електролиза с течен живачен катод. В световната практика се използват и трите метода за производство на хлор и каустик, с ясна тенденция към увеличаване на дела на мембранната електролиза. В Русия приблизително 35% от общия произведен каустик се произвежда чрез електролиза с живачен катод и 65% от електролиза с твърд катод (диафрагмен и мембранен метод).
Ефективността на производствения процес се изчислява не само от добива на сода каустик, но и от добива на хлор и водород, получени чрез електролиза, съотношението хлор и натриев хидроксид на изхода е 100/110, реакцията протича в следните съотношения:
1,8 NaCl +0,5 H20 + 2,8 MJ \u003d 1,00 Cl 2 + 1,10 NaOH + 0,03 H2,Основните показатели за различните методи на производство са дадени в таблицата:
| Индикаторът за 1 тон NaOH | Метод на живак | F-stop метод | Мембранен метод |
|---|---|---|---|
| Добив на хлор,% | 97 | 96 | 98,5 |
| Електричество (кВтч) | 3 150 | 3 260 | 2 520 |
| Концентрация на NaOH | 50 | 12 | 35 |
| Чистота на хлора | 99,2 | 98 | 99,3 |
| Чистота на водорода | 99,9 | 99,9 | 99,9 |
| Масова част на O 2 в хлор,% | 0,1 | 1-2 | 0,3 |
| Масова част на Cl - в NaOH,% | 0,003 | 1-1,2 | 0,005 |
Диаграма на процеса на твърд катод
F-stop метод - Кухината на електролизатора с твърд катод е разделена с пореста септума - диафрагмата - в пространство на катода и анода, където съответно са разположени катода и анода на електролизатора. Следователно, такъв електролизатор често се нарича диафрагма, а методът на производство се нарича диафрагмена електролиза. Наситеният анолитен поток непрекъснато навлиза в анодното пространство на диафрагмения електролизатор. В резултат на електрохимичния процес хлорът се отделя на анода поради разлагането на халит, а водорода на катода поради разлагането на водата. Хлорът и водородът се отделят от клетката отделно, без да се смесват:
2Cl - - 2 д \u003d Cl20, H20 - 2 д - 1/2 O 2 \u003d H2.
В този случай катодната зона се обогатява с натриев хидроксид. Разтворът от катодната зона, наречен електролитичен алкал, съдържащ неразложен анолит и натриев хидроксид, се отстранява непрекъснато от електролизатора. На следващия етап електролитичната основа се изпарява и съдържанието на NaOH в нея се настройва на 42-50% в съответствие със стандарта. Утайка от халит и натриев сулфат с увеличаване на концентрацията на натриев хидроксид. Разтвор на каустична алкал се декантира от утайката и се прехвърля като завършен продукт в склада или на етапа на изпаряване, за да се получи твърд продукт, последвано от топене, мащабиране или гранулиране. Кристалният халит (обратна сол) се връща на електролиза, приготвяйки от него така наречената обратна солна луга. Сулфатът се извлича от него, за да се избегне натрупването на сулфат в разтвори, преди да се приготви обратната солна луга. Загубата на анолити се компенсира чрез добавяне на прясна саламура, получена чрез подземно излугване на слоеве сол или чрез разтваряне на твърд халит. Пресният саламура преди смесването му с обратната солна луга се почиства от механични суспензии и значителна част от калциеви и магнезиеви йони. Полученият хлор се отделя от водна пара, пресова се и се подава или за получаване на продукти, съдържащи хлор, или за втечняване.
Мембранен метод - подобно на диафрагмата, но анодното и катодното пространство са разделени от катионообменна мембрана. Мембранната електролиза осигурява най-чистият каустик.
Технологична схема електролиза.Основният технологичен етап е електролиза, основният апарат е електролитична баня, която се състои от електролизатор, декомпозитор и живачна помпа, свързани помежду си чрез комуникации. В електролитична баня живакът циркулира под действието на живачна помпа, преминавайки през електролизатор и декомпозитор. Катодът на електролизатора е поток от живак. Аноди - графит или слабо износване. Заедно с живак, през електролизатора непрекъснато тече анолитен поток - разтвор на халит. В резултат на електрохимичното разлагане на халит се образуват Cl - йони на анода и се отделя хлор:
2 Cl - - 2 д \u003d Cl 2 0,
който се отделя от електролизатора и при живачния катод се образува слаб разтвор на натрий в живак, така наречената амалгама:
Na + + e \u003d Na 0 nNa + + nHg - \u003d Na + HgАмалгамата непрекъснато тече от клетката към декомпозитора. Добре почистената от примеси вода също непрекъснато се подава в декомпозитора. В него натриевата амалгама в резултат на спонтанен електрохимичен процес е почти напълно разградена от водата с образуването на живак, разтвор на каустик и водород:
Na + Hg + H2 0 \u003d NaOH + 1 / 2H 2 + HgПолученият по този начин разяждащ разтвор, който е търговски продукт, не съдържа халитови примеси, вредни при производството на вискоза. Меркурий почти напълно се освобождава от натриевата амалгама и се връща в клетката. Водородът се отделя за лечение. Анолитът, който излиза от електролизатора, се насища с пресен халит, примесите, въведени с него, се отстраняват от него, както и се измиват от анодите и структурните материали и се връщат към електролизата. Преди насищане разтвореният в него хлор се екстрахира от анолита при дву- или триетапен процес.
Лабораторни методи за получаване
В лабораторията натриевият хидроксид се получава по химически методи, които са повече исторически, отколкото практически.
Варовит метод Получаването на натриев хидроксид е взаимодействието на соден разтвор с варово мляко при температура около 80 ° С. Този процес се нарича каустификация; Описва се чрез реакцията:
Na2C0 3 + Ca (OH) 2 \u003d 2NaOH + CaC03В резултат на реакцията се образува разтвор на натриев хидроксид и утайка от калциев карбонат. Калциевият карбонат се отделя от разтвора, който се изпарява до получаване на разтопен продукт, съдържащ около 92% NaOH. Разтопеният NaOH се излива в железни барабани, където се втвърдява.
Феритен метод описани от две реакции:
Na 2 C0 3 + Fe 2 0 3 \u003d Na 2 0 Fe 2 0 3 + C0 2 (1) Na 2 0 Fe 2 0 3 -f H 2 0 \u003d 2 NaOH + Fe 2 O 3 (2)(1) - процесът на синтероване на калцинирана сода с железен оксид при температура 1100-1200 ° C. В този случай се образува натриев сперит ферит и се отделя въглероден диоксид. След това тортата се обработва (излужва) с вода съгласно реакция (2); се получава разтвор на натриев хидроксид и утайка от Fe203, която след отделянето му от разтвора се връща към процеса. Разтворът съдържа около 400 g / l NaOH. Изпарява се до получаване на продукт, съдържащ около 92% NaOH.
Химическите методи за производство на натриев хидроксид имат значителни недостатъци: изразходва се голямо количество гориво, произвежданата каустична сода е замърсена с примеси, а поддръжката на апарата отнема много време. В момента тези методи са почти напълно заменени от електрохимичния метод на производство.
Пазар на сода каустик
Световно производство на сода каустик, 2005 г.| производител | Обем на производството, милиони тона | Дял в световното производство |
|---|---|---|
| DOW | 6.363 | 11.1 |
| Случайна химическа компания | 2.552 | 4.4 |
| Формоза пластмаса | 2.016 | 3.5 |
| PPG | 1.684 | 2.9 |
| Bayer | 1.507 | 2.6 |
| Akzo nobel | 1.157 | 2.0 |
| Tosoh | 1.110 | 1.9 |
| Arkema | 1.049 | 1.8 |
| Олин | 0.970 | 1.7 |
| Русия | 1.290 | 2.24 |
| Китай | 9.138 | 15.88 |
| друг | 27.559 | 47,87 |
| Общо: | 57,541 | 100 |
TP - твърд живак (люспест);
TD - твърда диафрагма (слята);
PP - живачен разтвор;
PX - химичен разтвор;
RD - диафрагмен разтвор.
| Име на индикатора | TR OKP 21 3211 0400 | TD OKP 21 3212 0200 | RR OKP 21 3211 0100 | PX 1 клас OKP 21 3221 0530 | PX 2 клас OKP 21 3221 0540 | RD Най-висок клас OKP 21 3212 0320 | RD първи клас OKP 21 3212 0330 |
|---|---|---|---|---|---|---|---|
| вид | Лющеща се бяла маса. Допуска се леко оцветяване | Разтопената маса е бяла. Допуска се леко оцветяване | Безцветна бистра течност | Безцветна или оцветена течност. Допуска се кристализация на утайка | Безцветна или оцветена течност. Допуска се кристализация на утайка | Безцветна или оцветена течност. Допуска се кристализация на утайка | |
| Масова част на натриев хидроксид,%, не по-малко | 98,5 | 94,0 | 42,0 | 45,5 | 43,0 | 46,0 | 44,0 |
| Име на предприятието | 2005 хиляди тона | 2006 хиляди тона | дял през 2005 г.% | дял през 2006 г.% |
|---|---|---|---|---|
| OJSC Caustic Sterlitamak | 239 | 249 | 20 | 20 |
| OJSC "Caustic", Волгоград | 210 | 216 | 18 | 18 |
| Sayanskkhimplast OJSC | 129 | 111 | 11 | 9 |
| LLC Usoliekhimprom | 84 | 99 | 7 | 8 |
| "Сибур-Нефтехим" АД | 87 | 92 | 7 | 8 |
| OJSC "Химпром", Чебоксари | 82 | 92 | 7 | 8 |
| VOAO Химпром, Волгоград | 87 | 90 | 7 | 7 |
| ЗАТ Илимхимпром | 70 | 84 | 6 | 7 |
| KCHKhK OJSC | 81 | 79 | 7 | 6 |
| NAC "Азот" | 73 | 61 | 6 | 5 |
| "Химпром" АД, Кемерово | 42 | 44 | 4 | 4 |
| Общо: | 1184 | 1217 | 100 | 100 |
| Име на предприятието | 2005 тона | 2006 тона | дял през 2005 г.% | дял през 2006 г.% |
|---|---|---|---|---|
| OJSC "Caustic", Волгоград | 67504 | 63510 | 62 | 60 |
| OJSC Caustic Sterlitamak | 34105 | 34761 | 31 | 33 |
| "Сибур-Нефтехим" АД | 1279 | 833 | 1 | 1 |
| VOAO Химпром, Волгоград | 5768 | 7115 | 5 | 7 |
| Общо: | 108565 | 106219 | 100 | 100 |
приложение
биодизел

Лютефиск на треската по случай празника на Конституцията на Норвегия


