27.07.2019
1 алкални метали. Знаеш как
Резюме на урок по химия в 9 клас по темата:
"Съединения на алкални метали и тяхното използване."
цели: Да се \u200b\u200bобобщят и систематизират знанията за алкалните метали и техните съединения; запознайте се с употребата на тези съединения в ежедневието и производството, тяхното значение за живота на организмите
Цели на урока:
1. За да се гарантира по време на урока усвояването на химичните свойства на съединенията на алкалните метали, тяхното използване в ежедневието и производството и тяхното значение в живота на организмите.
Продължавайте да развивате общообразователни и химически умения за реагенти.
2. Формирането на основните философски идеи за причинно-следствените връзки между явленията, структурата на атома на алкален метал - свойствата на просто вещество - свойствата на съединенията на алкалните метали и тяхното приложение въз основа на свойствата.
3. Развийте способността да сравнявате, обобщавате изследваните факти, логично да изразявате мислите си, когато отговаряте. Да развие познавателния интерес на учениците, използвайки данни за приложението на изучаваните явления в живота.
Тип на урока: комбинирано - изучаване на нов материал с използване на ИКТ.
оборудване: учебник, тебешир, дъска, компютър, медиен проектор, екран, представяне на тема на урока, диаграми на урок за ученици, химикали (разтвори: натриев хидроксид, солна киселина, меден сулфат, цинков хидроксид, фенолфталеин) и лабораторни съдове за стъкло (багажник за епруветка).
ПРОЦЕДУРА
аз .Организационен момент.
II , Учене на нов материал.
1. Проверка на предварително проучен материал по темата "Алкални метали".
Отгадайте гатанките:
1. Обикновено се съхраняват в керосин, а той тича по вода,
В природата помнете сега,
Безплатно няма никъде
Възможно е да се отвори в солите
Пламъците пожълтяват от него
И можете да получите от солта
Как Дейви го получи.
За кой елемент говорим? (Na)
2. Той енергично изтласква
От влага - чист водород,
Той го замества
И здраво плете кислород.
Този елемент в растенията е скрит
По виолетов цвят
Може да е отворен в солите.
За кой елемент говорим? (К).
1. С какви метали се срещнахме в последния урок?
2. Защо се наричат \u200b\u200bтака?
3. Какво е общото в структурата на атомите на всички алкални метали?
Свързан тест: Алкални метали.
1. Не се прилага за алкални метали: а) рубидий; в) калий; б) цезий; г) мед.
2. Електронната формула) 2) 8) 8) 1 съответства на елемента: а) литий; в) калий; б) натрий;
3. Атомният радиус на елементите от група I на основната подгрупа с нарастващ ядрен заряд:
а) се променя периодично; в) не се променя; б) увеличава;
4. Алкалните метали са много силни:
а) окислителни свойства; в) редуциращи свойства; б) амфотерни свойства;
5. Физичните свойства на алкалните метали не се прилагат:
а) сребристобял; б) мека и лека; г) огнеупорни.
6. При взаимодействието на елементи от I група на основната подгрупа с вода,
а) киселина; б) се отделя алкал и водород; г) сол.
7. Натрий и калий се съхраняват в керосин, защото:
а) имат остра миризма; б) лесно се окисляват във въздуха;
Самоконтрол: няма грешки - "5", 1.2 грешки - "4", 3 грешки - "3", още - "2"
Отговори: 1 - 2 - в 3 - 4 - в 5 - 6 - 6 7 - б.
Самоконтрол: няма грешки - "5", 1.2 грешки - "4", 3.4 грешки - "3", още - "2"
2. Актуализиране на знанията.
Възможно ли е да срещнете алкални метали в свободна форма в природата? Защо?
Да предположим, под формата на кои съединения те могат да бъдат намерени в природата?
В природата алкалните метали се намират само под формата на съединения.
Na и K естествено се срещат под формата на хлориди, сулфати, силикати и др.
Li, Rb, Cs са част от различни минерали.
Fr се намира в радиоактивните руди Ac и U.
На масата: предмети, съдържащи съединения на алкални метали (сода, сол, батерии за пръсти, сапун) и задава въпрос.
Погледнете тези обекти. Какво мислите, че ги обединява?
1 Какво е генетична връзка?
2. Направете генетична серия от натрий.
Na → Na 2 O → 2NaOH → Na 2 CO 3
3. Какви класове съединения образуват алкални метали? Помислете за техните свойства.
В процеса на обяснение на материала и разглеждане на слайдовете учениците водят бележки по план, разкривайки свойства и приложения.
Оксиди на алкални метали
твърд, бял, лесно разтворим.
б) химични свойства; Учениците записват в тетрадка: оксидите на алкалните метали са типични основни оксиди. Подобно на всички основни оксиди, оксидите на алкалните метали реагират с вода, с киселинни окиси, с киселини.
Момчетата на дъската и в тефтера записват уравненията на химичните реакции, използвайки натриев оксид като пример:
Na2O + H20 \u003d 2NaOH;
Na 2 O + CO 2 → Na 2 CO 3;
Na 2 O + H 2 CO 3 → Na 2 CO 3 + H 2 O
Хидроксиди на алкални метали
.
а) физически свойства; Учениците записват в свойството на бележника: твърди, бели, добре разтворими, термично стабилни, корозиращи материи и хартия.
б) химични свойства
Обучение по безопасност когато извършвате лабораторни работи.
Химични свойства на натриев хидроксид.
Предназначение: експериментално да се докажат химичните свойства на алкалните метали като се използва хидроксид като пример натрий.
Инструкция за употреба
Изсипете натриев хидроксид в чиста епруветка, добавете няколко капки фенолфталеин. Какво наблюдавате?
Добавете разтвор на солна киселина в същата епруветка. Какво наблюдавате? Напишете уравнението на реакцията.
NaOH + HCl → NaCl + H 2 O Момчетата на дъската и в тефтера записват уравненията на химическата реакция в йонна форма.
Изсипете натриев хидроксид в чиста епруветка и добавете разтвор на меден сулфат. Какво наблюдавате? Напишете уравнението на реакцията.
2NaOH + CuSO 4 → Na 2 SO 4 + Cu (OH) 2 Момчетата на дъската и в тефтера записват уравненията на химическата реакция в йонна форма.
Направете заключение за химичните свойства на хидроксидите на алкални метали.
Хидроксиди на алкални метали реагират с приложение на киселини, соли) - слайд №5.
Натриев хидроксид - NaOH - сода каустик, сода каустик, каустик.
Калиев хидроксид - KOH - калиев хидроксид.
NaOH и KOH - каустични основи, корозивни тъкани и хартия. Студентите записват:Приложение: за изкуствен район в производството на сапун и SMS, козметика, лекарства и др.
Алкални соли
.
Физични свойства, Учениците записват свойства в тетрадка твърди кристални вещества, почти всички разтворими във вода.
Самостоятелна работа с текст на учебника.
Приложение: попълване на таблицата от слайд № 5. Работа по учебника стр. 56 - 57
Солева формула
името
приложение
NaHCO 3
K 2 CO 3
NaCl
Na 2 SO 4 ∙ 10 H 2 O
Na 2 CO 3 ∙ 10 H 2 O
Значение в живота на организмите - слайд номер 6.
Съобщението на ученика по темата: „Стойността на съединенията на алкални метали в живота на организмите.“
Натриевите и калиеви йони играят голяма биологична роля: Na + е основният извънклетъчен йон, който се намира в кръвта и лимфата, а К + е основният вътреклетъчен йон. „Работете” заедно. Съотношението на концентрацията на тези йони регулира кръвното налягане в жив организъм и осигурява движението на солеви разтвори от корените към листата на растението. Калиеви йони - подпомагат работата на сърдечния мускул, помагат при ревматизъм, подобряват работата на червата. Калиевите съединения - премахват отока.
V. фиксиране
VI. Обобщение на урока Степенуването.
Обобщение на урока:
Какви физични и химични свойства са характерни за оксидите, хидроксидите на алкалните метали?
Къде се използват хидроксиди и соли на алкални метали?
Допълнителен материал. Това е интересно.
Задача: Защо в Древна Гърция, преди дълги пътувания в горещо време, на войниците се препоръчваше да ядат резен хляб, осолен и измит с вода?
Електролитните йони се хидратират лесно, така че натриевият хлорид улавя водата в тялото.
Цел: Защо ескимосите ядат много малко сол?
Според една от научните теории всички животни, които живеят на земята, включително хората, са потомци на организми, които са се появили и са живели в морето. Телесната течност на тези същества беше морска вода по състав. Като се преместили на сушата, те спасили морската вода като течност на тялото си. Но природата не е в състояние да осигури на живите организми достатъчно количество сол в естествения си вид. Тъй като солта се разтваря във вода, значителна част от нея се измива от почвата чрез дъждовна вода в реки, морета и океани. В резултат растенията, които растат на земята, не съдържат достатъчно сол. Ето защо животните, които се хранят с растения, се нуждаят от сол. Всеки ден тялото губи определено количество течност, съдържаща сол, а растителните храни не го компенсират. Животните, които се хранят с други животни, не се нуждаят от допълнителна сол. Те получават необходимата сол от организмите на жертвите си. Ескимосите се хранят основно с месо, така че нуждата им от сол е много малка.
Задача: Защо в Англия през последните десетилетия се наблюдава намаляване на смъртността от мозъчно-съдови заболявания?
Това се дължи на увеличената консумация на пресни плодове и зеленчуци. В пресни зеленчуци и плодове винаги има много калий и малко натрий. Натрият задържа водата в тялото, повишава кръвното налягане, а калият, напротив, спомага за намаляването му. Ето защо увеличаването на консумацията на зеленчуци, плодове, по-специално ябълки, може да се счита за съществена мярка за предотвратяване на мозъчно-съдови заболявания.
КЪДЕ В ХОРА ЛЮБОВ ЗА СОЛ .
Солта се използва за консервиране на храната от разваляне и гниене. За да се спести храна (когато нямаше хладилници и фризери), се използваше сол. Опитали зеленчуци от саламура, хората започнали да солят, ферментират и поливат пресни зеленчуци. Човек е толкова свикнал да осолява всичко, че дори е готов да се примири с някои болести, само и само да не премине към диета без сол. Постепенно се разви навик да осолявате цялата храна, без дори да я опитвате.
МНОГО СОЛ - МАЛКО ПОТАСИЙ, МАЛКО ПОТАСИЙ - МНОГО ЗАБОЛЯВАНИЯ
Въпросът за солта е въпрос на калиево-натриево равновесие. Той е изключително важен за организма. Калият и натрият постоянно спорят за присъствието си в клетките. В натриевия хлорид няма калий, той е напълно натриев. Нашето тяло се нуждае от остра нужда от калий, който трябва да бъде 4 пъти повече от натрия. Тялото събира калий навсякъде, но прекомерната употреба на трапезна сол анулира всичките му усилия. Затова при излишък от прием на сол се появява липса на калий, което с течение на времето води до редица неразположения: физическа и психическа умора, лош сън, спазми, болки в ставите.
Излишъкът от натрий (сол) претоварва сърцето. Искате ли да разберете дали ядете много сол? Отидете до огледалото: бял кръг около ириса показва прекомерен прием на сол.
Калиев хидроксид
Каустичният калий се използва за производство на торове, синтетичен каучук, електролити за батерии, реагенти и се използва във фармацевтичната индустрия и други сектори на икономиката.
Каустичният калий се транспортира с железопътен, автомобилен транспорт в съответствие с правилата за превоз на стоки, които са в сила за този вид транспорт.
Каустичният калий се съхранява в плътно затворен съд, като тя се "разпространява" във въздуха, абсорбирайки влагата от него.
Традиционното му наименование "каустичен калий" отразява корозивния ефект на това вещество върху живата тъкан. Ако каустичният калий попадне върху кожата, са възможни химически изгаряния.
Леките сапуни се получават чрез осапуняване на масла и мазнини с каустичен калий. Всички тези сапуни имат мека кремообразна консистенция.
Сода каустик.
Най-често срещаните алкали. В света годишно се произвеждат и консумират над 57 милиона тона каустична основа.
Сода каустик се използва в най-различни индустрии и за битова употреба:
В целулозно-хартиената промишленост в производството на хартия, картон, изкуствени влакна, дъски от дървесни влакна.
За осапуняване на мазнини при производството на сапун, шампоан и други перилни препарати.
В химическата промишленост - за неутрализиране на киселини и кисели оксиди, като реагент или катализатор при химически реакции и др.
Натриев каустик (натриев хидроксид) е разяждащо и разяждащо вещество. Отнася се за вещества от 2-ри клас на опасност. Затова при работа с него трябва да се внимава.
При контакт с кожата, лигавиците и очите се образуват сериозни химически изгаряния. Ако лигавичните повърхности влязат в контакт с едър алкал, е необходимо засегнатата област да се измие със струя вода и ако тя влезе в контакт със слаб разтвор на оцетна киселина.
На литий - до звездите
Производителите на мобилни телефони, джобни джаджи и лаптопи имат остра нужда от този метал. Ядрената енергия консумира големи количества литий (Li); според изчисленията на теоретиците именно този алкален метал може да даде ключа към термоядрената енергия. Като мощно психотропно вещество, Ли се използва във военната и приложна психиатрия (а естеството на ефекта на Ли върху човешката психика не е напълно изяснено). Литиевият деутерид се използва във водородна бомба като работно вещество и като регулатор на експлозивната мощност.
Този метал е необходим и за дълбоко изследване на космоса.
Работен поток за учениците до урока
Тема: Съединения на алкални метали.
тест
Хидриди. Най-стабилният литиев хидрид, който лесно се получава чрез преминаване на водород над нагрятия литий. LiH е бял кристален прах с температура на топене 680 ° С. При високи температури LiH е изключително реактивен. Енергично се разлага от вода:
LiH + H20 \u003d LiOH + H2
Оксиди. Най-стабилният е Li 2 O. Литиевият и натриевият оксиди са бели, останалите са жълти. Освен това интензитетът на цвета се увеличава с увеличаване на серийния номер на елемента.
Пероксиди. Те се получават чрез изгаряне на метали в излишък от кислород. Пероксидите на алкални метали могат да се считат за производни на водородния пероксид оттогава те взаимодействат с киселини и вода, за да образуват водороден пероксид:
M 2 O 2 + H 2 SO 4 \u003d M 2 SO 4 + H 2 O 2
М202 + 2Н20 \u003d 2МОН + Н2О2
Най-голямо значение има натриевият пероксид, който се използва за производство на кислород в затворени помещения (например подводница):
2Na 2O 2 + 2CO 2 \u003d 2Na 2 CO 3 + 2O 2
Хидроксиди. Техниката се нарича каустична алкал, (NaOH - сода каустик, KOH - каустичен калий). Това са безцветни, стопяеми вещества. В разтопено състояние те взаимодействат със стъкло, порцелан, платина. Следователно, топенето на алкали се извършва в сребърни или железни тигели, с които те не взаимодействат. Хидроксидите са лесно разтворими във вода с висока топлинна енергия.
Хидроксидите се получават по следните начини:
а) Взаимодействието на метали или оксиди с вода:
Li2O + H20 \u003d 2LiOH
Тази реакция се използва само за получаване на много чисти хидроксиди.
б) Реакцията на каустификация е най-старият известен метод за получаване на каустична сода. Този метод се състои в третиране на разтвор на сода с калциев хидроксид (гасена вар) по време на кипене. Полученият неразтворим калциев карбонат се филтрира или от него се декантира бистра течност:
Na2CO3 + Ca (OH) 2 \u003d 2NaOH + CaCO3
Полученият разтвор на натриев хидроксид се концентрира чрез изпаряване под вакуум. Твърдият натриев хидроксид се стопява при 500 ° С, за да се отстрани напълно водата и се получава NaOH, съдържащ 3-4% Na2C03. Получаван по този начин NaOH се нарича "сода каустик."
в) Електролизата на хлориди на алкални метали във воден разтвор е съвременен промишлен метод за получаване на NaOH и KOH едновременно с хлор. Когато разтворът на NaCl е подложен на електролиза с инертни електроди (платина, графит), хлор се отделя на анода, а водородът на катода. Na + йони и OH - йони се натрупват в катодното пространство, които образуват NaOH.
г) Сплавване на карбонати на алкални метали с оксиди и последваща обработка на сплавта с водна пара:
Fe 2O 3 + Na2C03 \u003d 2NaFeO 2 + CO 2
2NaFeO 2 + H20 \u003d 2NaOH + Fe 2 O 3
Алкалите са най-важната суровина в химическата промишленост за багрила, чаши, сапуни, хартия, изкуствени влакна и лекарства.
Сол. NaCl и KCl се срещат в големи количества в природата. NaCl (трапезна сол) се намира в морска вода (средно 2,7%) и под формата на каменна сол в находища с капацитет до няколко километра. Чисти NaCl и KCl се получават от естествени хлориди чрез прекристализация. Литиевите соли се получават от естествен литиев карбонат. Получаването на соли на рубидий и цезий е свързано с трудности, защото тяхната разтворимост е много близка до разтворимостта на калиевите соли. Обикновено майчините течности, останали след карналит, се прекристализират и от тях се изолират алуминиевият рубидий и цезий, които се пречистват чрез прекристализация. Отделянето на рубидий от цезий се извършва, като се използват различни разтворимости на техните карбонати в алкохол.
От нитратите, NaNO 3 и KNO 3 имат практическо значение. Техническите наименования са натриев нитрат и калиев нитрат. И двете соли се използват като минерални торове. KNO 3 се използва и за производството на черен прах (NaNO 3 не се използва поради неговата хигроскопичност).
Въглеродна киселина H 2 CO 3 дава два реда карбонати на алкални метали, кисели (MHCO 3) и средни (M 2 CO 3). Киселинните карбонати (въглеводороди, бикарбонати) са известни за всички алкални метали, с изключение на лития. С изключение на литиевия карбонат, всички неутрални карбонати са силно разтворими във вода. Na 2 CO 3 - сода, понякога се среща в природата във водите на някои езера и в минерални извори. Вземете сода амоняк начин: разтвор на натриев хлорид е наситен с амоняк и въглероден диоксид. В този случай NaHCO 3 се утаява, защото содата е по-лошо разтворима от NH 4 Cl:
NaCl + H2O + CO 2 + NH3 \u003d NaHCO 3 ¯ + NH4C1
2NaHCO 3 → Na 2 CO 3 + CO 2 + H 2 O
K 2 CO 3 - поташ, хигроскопичен бял прах, силно разтворим във вода. Получавайте чрез карбонизация на калиев хидроксид:
2KOH + CO 2 \u003d K 2 CO 3 + H20
Картофът се използва в производството на сапун и стъкло, за боядисване и избелване на вълна, при производството на калиев цианид, в органичен синтез.
Сярна киселина дава два реда сулфати на алкални метали - кисели и средни.
Na2S04 се получава като страничен продукт при производството на солна киселина от натриев хлорид и сярна киселина. От водни разтвори натриевият сулфат кристализира като Na2S04. 10Н20, в областта този кристален хидрат се нарича Глауберова сол. Използва се за боядисване на памучни тъкани, в медицината.
· · ·§ 96. Алкални
Групата на алкални метали включва следните серии метали; Li, Na, K, Rb, Cs, Fr. Те са в основната подгрупа I на групата на периодичната система.
Всички те са сходни по това, че имат един електрон на външния слой на електрон (Таблица 18) /.
Алкалните са s-елементи. Електронът на външния електронен слой на атом на алкален метал, в сравнение с други елементи от същия период, е най-отдалечен от ядрото, т.е. радиусът на атома на алкалния метал е най-голям в сравнение с радиусите на атомите на други елементи от същия период. Във връзка
|
Основно зареждане |
Броят на електроните на енергийни нива |
Радиус на атома |
|||||||
с това валентният електрон на външния слой от атоми на алкални метали лесно се разрушава, превръщайки ги в положителни еднозарядни йони. Това се дължи на факта, че съединенията на алкални метали с други елементи са изградени от типа йонна връзка.
При редокс реакции те се държат като силни редуциращи агенти и тази способност се увеличава от метал на метал с увеличаване на заряда на атомното ядро.
§ 97. Натрий
Електронна конфигурация на натриевия атом ls 2 2s 2 2p 6 3s 1. Структурата на външния му слой:
Натрият се намира в природата само под формата на соли. Най-често срещаната натриева сол е натриевият хлорид NaCl, както и минералният силвинит KCl · NaCl и някои сулфатни соли, например глауберовата сол Na2SO4 · 10H2O, която се намира в големи количества в Каспийско море Кара-Богаз-Гол.
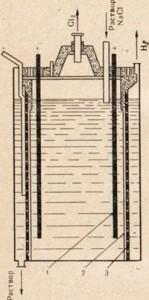
Натриевият метал се получава от натриев хлорид чрез електролиза на стопилката на тази сол. Инсталацията за електролиза е показана на фиг. 76. Електродите се спускат в разтопената сол. Пространствата на анода и катода са разделени с диафрагма, която изолира образувания натрий, така че да не се получи обратната реакция. Положителен натриев йон получава електрон от катода и се превръща в неутрален натриев атом. Неутралните натриеви атоми се събират при катода под формата на разтопен метал. Процесът, протичащ при катода, може да бъде представен по следната схема:
Na + + Na 0.
Тъй като приемането на електрони става на катода и всяко приемане на електрони от атом или йон е редукция, натриевите йони в катода се намаляват. На анода хлорните йони даряват електрони, т.е. процесът на окисляване и освобождаване на свободни
хлорен газ, който може да бъде представен по следната схема:
Cl - - д - → Cl 0
Полученият метален натрий има сребристо-бял цвят и лесно се нарязва с нож. Филийка с натрий, ако се изследва веднага след разрязването, има ярък метален блясък, но бързо затъмнява поради изключително бързото окисляване на метала.
![]()
Фиг. 76. Инсталационна схема за електролиза на разтопен натриев хлорид.
1 - пръстен катод; 2 - звънец за отстраняване на газообразен хлор от анодното пространство
Ако натрият се окисли в малко количество кислород при температура около 180 °, се получава натриев оксид:
4Na + O2 \u003d 2Na2O.
При изгаряне в кислород се получава натриев пероксид:
2Na + O2 \u003d Na2O2.
В този случай натрият гори с ослепително жълт пламък.
Поради лесното и бързо окисляване на натрия, той се съхранява под слой керосин или парафин и е за предпочитане, тъй като определено количество въздух се разтваря в керосин и натриево окисление, макар и бавно, все пак се случва.
Натрият може да даде съединение с водород - NaH хидрид, в което той показва състояние на окисляване 1. Това е солоподобно съединение, което се различава от летливите хидриди на елементите от основните подгрупи от групи IV-VII по естеството на химическата връзка и степента на окисление.
Натриевият метал може да реагира не само с кислород и водород, но и с много прости и сложни вещества. Например, когато се смила в разтвор със сяра, натрият реагира бурно с него, образувайки:
2Na + S \u003d Na2S
Реакцията е придружена от огнища, така че хоросанът трябва да се държи далеч от очите и да увиете кърпа около ръката си. За реакцията трябва да се вземат малки парчета натрий.
Натрият гори силно в хлор с образуването на натриев хлорид, което е особено добре да се наблюдава в хлоро-калциева тръба, в която поток от хлор преминава през разтопен и много горещ натрий:
2Na + Cl2 \u003d 2NaCl
Натрият реагира не само с прости, но и със сложни вещества, например с вода, измествайки се от него, тъй като е много активен метал, в серия от напрежения е много вляво от водорода и лесно измества последния от водата:
2Na + 2H2O \u003d 2NaOH + H2
Изгарянето на алкален метал не трябва да се гаси с вода. Най-добре е да го напълните с прах от сода. В присъствието на натрий безцветният пламък на газова горелка става жълт.
Натриевият метал може да се използва като катализатор в органичния синтез, например при производството на синтетичен каучук от бутадиен. Той служи като изходен материал за получаване на други натриеви съединения, например натриев пероксид.
■ 27. Докажете, използвайки уравненията на реакциите, дадени в текста на реакциите, включващи метален натрий, че той се държи като редуциращ агент.
28. Защо натрият не може да се съхранява на въздух?
29. Ученикът потопи парче натрий в разтвор на меден сулфат, надявайки се да измести метала от солта. Вместо червен метал се появи желатинова синя утайка. Опишете възникналите реакции и напишете уравненията си в молекулярни и йонни форми. Как трябва да се променят условията на реакцията, така че реакцията да доведе до желания резултат? Напишете уравненията в молекулярни, пълни и съкратени йонни форми.
30. 2.3 g натриев метал се поставят в съд с 45 ml вода. Каква каустична сода се е образувала в края на реакцията.
31. Какви агенти могат да се използват за гасене на горящ натрий? Дайте мотивиран отговор.
§ 98. Кислородни съединения на натрий. Сода каустик
Кислородните съединения на натрия, както вече беше споменато, са натриев оксид Na2O и натриев пероксид Na2O2.
Натриевият оксид Na2O не е особено важен. Реагира енергично с вода, образувайки сода каустик:
Na2O + H2O \u003d 2NaOH
Натриевият пероксид Na202 е жълтеникав прах. Може да се разглежда като вид водородна прекисна сол, тъй като нейната структура е същата като тази на H2O2. Подобно на натриев пероксид е мощен окислител. Под действието на водата образува алкал и:
Na2O2 + H2O \u003d H2O2 + 2NaOH
образувани от действието на разредени киселини върху натриев пероксид:
Na2O2 + H2SO4 \u003d H2O2 + Na2SO4
Всички по-горе свойства на натриев пероксид позволяват използването му за избелване на всички възможни материали.
Фиг. 77. Инсталационна схема за електролиза на разтвор на натриев хлорид.
1 - анод; 2 - диафрагма, разделяща пространството на анода и катода; 3 катода
Много важно натриево съединение е натриевият хидроксид или сода каустик, NaOH. Нарича се още сода каустик, или просто каустик.
За получаване на сода каустик се използва натриев хлорид - най-евтиното естествено натриево съединение, което го електролизира, но в този случай се използва не стопилка, а солен разтвор (фиг. 77). За описание на електролизата на разтвор на натриев хлорид вижте § 33. На фиг. 77 показва, че анодното и катодното пространство са разделени с диафрагма. Това се прави с цел да се предотврати взаимодействието на образуваните продукти помежду си, например Сl2 + 2NaOH \u003d NaClO + NaCl + Н2O.
Каустична сода - твърдо кристално вещество с бял цвят, отлично разтворимо във вода. Когато натриевият хидроксид се разтвори във вода, се отделя голямо количество топлина и разтворът е много горещ. Каустичната сода трябва да се съхранява в добре запечатани съдове, за да се предотврати проникването й във водни пари, под въздействието на които тя може да бъде много мокра, както и въглероден диоксид, под въздействието на който каустичната сода може постепенно да се превърне в натриев карбонат:
2NaOH + CO2 \u003d Na2CO3 + H2O.
Каустичната сода е типична алкална основа, така че предпазните мерки за работа с нея са същите като при работа с всякакви други основи.
Сода каустик се използва в много отрасли, например за рафиниране на петролни продукти, производство на сапун от мазнини, в хартиената промишленост, в производството на изкуствени влакна и багрила, в производството на лекарства и др. (Фиг. 78).
Напишете в бележника областите на приложение на сода каустик.
От натриевите соли трябва да се отбележи преди всичко натриев хлорид NaCl, който служи като основна суровина за натриев хидроксид и метален натрий (за повече подробности относно тази сол, виж страница 164), сода Na2CO3 (виж страница 278), Na2SO4 (виж страница 224), NaNO3 (виж стр. 250) и т.н.
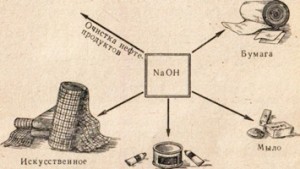
Фиг. 78. Използването на сода каустик
■ 32. Опишете метода за получаване на сода каустик чрез електролиза на натриев хлорид.
33. Сода каустик може да се получи, като действа на натриев карбонат с гасена вар. Направете молекулна и йонна форма на уравнението за тази реакция и също така изчислете колко сода, съдържаща 95% карбонат, е необходима, за да получите 40 кг каустична сода.
34. Защо, когато съхранявате разтвор на сода каустик в бутилки със смлени запушалки, запушалките са „залепени“ и не могат да бъдат отстранени? Ако за определен период бутилката се държи с главата надолу във вода, тогава тапата може да бъде свободно отстранена. Обяснете, като имаме предвид уравненията на реакцията, какви процеси протичат в този случай.
35. Напишете уравненията на реакциите в молекулярни и йонни форми, характеризиращи свойствата на каустичната сода като типична алкала.
36. Какви предпазни мерки трябва да се спазват при работа с сода каустик? Какви мерки за първа помощ трябва да се осигурят при изгаряния с каустична сода?
§ 99. Калий
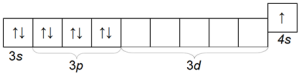
Калият К също е доста често срещан алкален метал, който се различава от натрия по атомния си радиус (четвърти период) и следователно има по-голяма химична активност от натрия. Електронната конфигурация на калиевия атом е 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1.
Структурата на външния му електронен слой
Калият е мек метал, който е добре нарязан с нож. За да се избегне окисляването, той, подобно на натрия, се съхранява под слой керосин.
Калият реагира дори по-силно с водата от натрия, с образуването на алкали и с отделянето на водород, който се запалва:
2K + 2H2O \u003d 2KOH + H2.
При изгаряне с кислород (препоръчва се да се вземат дори по-малки парчета метал за изгаряне, отколкото за изгаряне на натрий), като натрий, той гори много енергично с образуването на калиев пероксид.
Трябва да се отбележи, че калият е много по-опасен в циркулацията от натрия. Силна експлозия може да възникне дори при рязане на калий, така че трябва да се справите с него още по-внимателно.
Калиев хидроксид или калиев хидроксид KOH е бяло кристално вещество. Каустичният калий по всякакъв начин е подобен на сода каустик. Те се използват широко в производството на сапуни, но производството му е малко по-скъпо, така че не намира такова приложение като NaOH.
Калиевите соли трябва да се отбележат особено, тъй като някои от тях се използват широко като торове. Това са калиев хлорид KCl, калиев нитрат KNO3, който също е азотен тор.
■ 37. Как можем да обясним факта, че каустичният поташ е химически по-активен от каустичната сода?
38. Парче калий се спуска във формата с вода. След приключване на реакцията, малко цинк се поставя там като бяла желатинова утайка. Утайката изчезна и при тестване на разтвора с фенолфталеин, последният придобие пурпурен цвят. Какви химични процеси са се случили тук?
Кои са в решение? Дайте мотивиран отговор.
39. Защо калият, като всички алкални метали, е член на семейството на s-елементите?
Алкалните метали лесно реагират с неметалите:
2K + I 2 \u003d 2KI
2Na + H2 \u003d 2NaH
6Li + N2 \u003d 2Li 3 N (реакцията вече е при стайна температура)
2Na + S \u003d Na 2 S
2Na + 2C \u003d Na2C2
При реакции с кислород всеки алкален метал показва своята индивидуалност: при изгаряне във въздух литият образува оксид, натрий - пероксид, калий - пероксид.
4Li + O 2 \u003d 2Li 2 O
2Na + O2 \u003d Na2O2
K + O 2 \u003d KO 2
Получаване на натриев оксид:
10Na + 2NaNO 3 \u003d 6Na2O + N2
2Na + Na2O 2 \u003d 2Na 2O
2Na + 2NaON \u003d 2Na 2O + H2
Взаимодействието с водата води до образуването на алкал и водород.
2Na + 2H20 \u003d 2NaOH + H2
Реакция с киселини:
2Na + 2HCl \u003d 2NaCl + H2
8Na + 5H 2 SO 4 (съгл.) \u003d 4Na 2 SO 4 + H 2 S + 4H 2 O
2Li + 3H2S04 (съгл.) \u003d 2LiHSO 4 + SO2 + 2H20
8Na + 10HNO 3 \u003d 8NaNO 3 + NH 4 NO 3 + 3H20
При взаимодействие с амоняк се образуват амиди и водород:
2Li + 2NH3 \u003d 2LiNH 2 + H2
Взаимодействие с органични съединения:
H ─ C ≡ C ─ H + 2Na → Na ─ C≡C ─ Na + H 2
2CH3Cl2Na → C2H6 + 2NaCl
2C 6 H 5 OH + 2Na → 2C 6 H 5 ONa + H2
2CH 3 OH + 2Na → 2 CH3 ONa + H2
2CH 3 COOH + 2Na → 2CH 3 COOONa + H2
Качествена реакция на алкални метали е оцветяването на пламъка с техните катиони. Li + йон оцветява кармино червения пламък, Na + йонно жълто, K + виолетово
Съединения на алкални метали
Оксиди.
Оксидите на алкалните метали са типични основни оксиди. Реагира с киселинни и амфотерни оксиди, киселини, вода.
3Na 2 O + P 2 O 5 \u003d 2Na 3 PO 4
Na2O + Al2O3 \u003d 2NaAlO2
Na2O + 2HCl \u003d 2NaCl + H20
Na2O + 2H + \u003d 2Na + + H20
Na2O + H20 \u003d 2NaOH
пероксиди.
2Na 2 O 2 + CO 2 \u003d 2Na 2 CO 3 + 0
Na2O2 + CO \u003d Na2C03
Na2O2 + SO2 \u003d Na2S04
2Na 2 O + O 2 \u003d 2Na 2 O 2
Na2O + NO + NO2 \u003d 2NaNO2
2Na 2 O 2 \u003d 2Na 2 O + O 2
Na2O2 + 2H2O (студено) \u003d 2NaOH + H2O2
2Na 2 O 2 + 2H 2 O (хоризонтален) \u003d 4NaOH + O 2
Na2O2 + 2HCl \u003d 2NaCl + H2O2
2Na 2 O 2 + 2H 2 SO 4 (разлагане хоризонтален) \u003d 2Na 2 SO 4 + 2H 2 O + O 2
2Na 2 O 2 + S \u003d Na 2 SO 3 + Na 2 O
5Na 2 O 2 + 8H 2 SO 4 + 2KMnO 4 \u003d 5O 2 + 2MnSO 4 + 8H 2 O + 5Na 2 SO 4 + K 2 SO 4
Na 2 O 2 + 2H 2 SO 4 + 2NaI \u003d I 2 + 2Na 2 SO 4 + 2H 2 O
Na 2 O 2 + 2H 2 SO 4 + 2 FeSO 4 \u003d Fe 2 (SO 4) 3 + Na 2 SO 4 + 2H 2 O
3Na 2 O 2 + 2Na 3 \u003d 2Na 2 CrO 4 + 8NaOH + 2H 2 O
Основа (алкална).
2NaOH (излишък) + CO 2 \u003d Na2C03 + H20
NaOH + CO 2 (излишък) \u003d NaHCO 3
SO 2 + 2NaOH (излишък) \u003d Na 2 SO 3 + H 2 O
SiO2 + 2NaOH Na2 SiO3 + H20
2NaOH + Al 2O 3 2NaAlO 2 + H2O
2NaOH + Al 2O 3 + 3H20 \u003d 2Na
NaOH + Al (OH) 3 \u003d Na
2NaOH + 2Al + 6H20 \u003d 2Na + 3H2
2KOH + 2NO 2 + 0 2 \u003d 2KNO 3 + H 2 O
KOH + KHCO 3 \u003d K 2 CO 3 + H 2 O
2NaOH + Si + H20 \u003d Na2 SiO 3 + H2
3KOH + P 4 + 3H20 \u003d 3KH 2 PO2 + PH3
2KOH (студено) + Cl2 \u003d KClO + KCl + H20
6KOH (горещо) + 3Cl2 \u003d KClO 3 + 5KCl + 3H20
6NaOH + 3S \u003d 2Na 2S + Na2SO3 + 3H20
2NaNO 3 2NaNO 2 + 0
NaHCO 3 + HNO 3 \u003d NaNO 3 + CO 2 + H20
NaI → Na + + I -
при катода: 2Н 2 О + 2е → Н 2 + 2ОН - 1
на анода: 2I - - 2e → I 2 1
2H 2 O + 2I - ![]() H2 + 2OH - + I2
H2 + 2OH - + I2
2H20 + 2NaI ![]() H2 + 2NaOH + I2
H2 + 2NaOH + I2
2NaCl ![]() 2Na + Cl2
2Na + Cl2
при катода на анода
2Na 2 HPO 4 Na 4 P 2 O 7 + H 2 O
KNO3 + 4Mg + 6H20 \u003d NH3 + 4Mg (OH) 2 + KOH
4KClO 3 KCl + 3KClO 4
2KClO 3 ![]() 2KCl + 302
2KCl + 302
KClO 3 + 6HCl \u003d KCl + 3Cl2 + 3H20
Na2SO3 + S \u003d Na2S2O3
Na 2 S 2 O 3 + H 2 SO 4 \u003d Na 2 SO 4 + S ↓ + SO 2 + H 2 O
2NaI + Br 2 \u003d 2NaBr + I2
2NaBr + Cl2 \u003d 2NaCl + Br2
I група.
1. Електрически зауствания се пропускат по повърхността на разтвора от сода каустик, излята в колбата, и въздухът в колбата е оцветен в кафяво, което изчезва след време. Полученият разтвор се изпарява внимателно и се установява, че твърдият остатък е смес от две соли. Когато тази смес се нагрява, се отделя газ и остава единственото вещество. Напишете уравненията на описаните реакции.
2. Веществото, което се отделя на катода по време на електролиза на стопилката на натриев хлорид, се изгаря в кислород. Полученият продукт се поставя в газомер, напълнен с въглероден диоксид. Полученото вещество се добавя към разтвор на амониев хлорид и разтворът се нагрява. Напишете уравненията на описаните реакции.
3) Азотната киселина се неутрализира със сода за хляб, неутралният разтвор се изпарява внимателно и остатъкът се калцинира. Полученото вещество се въвежда в разтвор на калиев перманганат, подкислен със сярна киселина и разтворът се обезцветява. Азотсъдържащият реакционен продукт се поставя в разтвор на натриев хидроксид и се добавя цинков прах и се отделя газ с остра миризма. Напишете уравненията на описаните реакции.
4) Веществото, получено на анода по време на електролизата на разтвор на натриев йодид с инертни електроди, се въвежда в реакцията с калий. Реакционният продукт се нагрява с концентрирана сярна киселина и отделеният газ се пропуска през горещ разтвор на калиев хромат. Напишете уравненията на описаните реакции
5) Веществото, получено в катода по време на електролиза на стопилка натриев хлорид, се изгаря в кислород. Впоследствие полученият продукт се обработва със серен диоксид и разтвор на бариев хидроксид. Напишете уравненията на описаните реакции
6) Белият фосфор се разтваря в разтвор на каустичен калий с отделяне на газ с мирис на чесън, който спонтанно се запалва във въздуха. Твърдият продукт от реакцията на горене реагира с натриев хидроксид в такова съотношение, че полученото бяло вещество съдържа един водороден атом; когато последният се калцинира, се образува натриев пирофосфат. Напишете уравненията на описаните реакции
7) Неизвестен метал изгаря в кислород. Продуктът на реакцията, взаимодействащ с въглеродния диоксид, образува две вещества: твърдо вещество, което взаимодейства с разтвор на солна киселина с отделянето на въглероден диоксид и просто газообразно вещество, което поддържа горенето. Напишете уравненията на описаните реакции.
8) Кафявият газ се пропуска през излишък от разтвор на калиев хидроксид в присъствието на голям излишък на въздух. Към получения разтвор се прибавят магнезиеви стърготини и се нагрява и азотната киселина се неутрализира с освободения газ. Полученият разтвор се изпарява внимателно и твърдият реакционен продукт се калцинира. Напишете уравненията на описаните реакции.
9) По време на термичното разлагане на сол А в присъствието на манганов диоксид се образуват бинарна сол В и газ, които поддържат горенето и са част от въздуха; когато тази сол се нагрява без катализатор, се образува сол В и по-високо съдържание на кислород съдържаща киселина. По време на взаимодействието на сол А със солна киселина се отделя жълто-зелен газ (просто вещество) и се образува сол Б. Солта В превръща пламъка в лилав цвят, когато взаимодейства с разтвор на сребърен нитрат, се образува бяла утайка. Напишете уравненията на описаните реакции.
10) Медните стърготини се добавят към нагрятата концентрирана сярна киселина и отделеният газ се пропуска през разтвор на сода каустик (излишък). Продуктът на реакцията се изолира, разтваря се във вода и се нагрява със сяра, която се разтваря в резултат на реакцията. Към получения разтвор се добавя разредена сярна киселина. Напишете уравненията на описаните реакции.
11) Солта се обработва с концентрирана сярна киселина. Получената сол се обработва с натриев хидроксид. Полученият продукт се калцинира с излишък на въглища. Газът, отделен в този случай, реагира в присъствието на хлорен катализатор. Напишете уравненията на описаните реакции.
12) Натрият реагира с водород. Продуктът на реакцията се разтваря във вода, образува се газ, който реагира с хлор, и полученият разтвор реагира с хлор при нагряване до получаване на смес от две соли. Напишете уравненията на описаните реакции.
13) Натрият се изгаря в излишък от кислород, полученото кристално вещество се поставя в стъклена епруветка и през него се пропуска въглероден диоксид. Газът, излизащ от тръбата, се събира и изгаря фосфор в атмосферата му. Полученият материал се неутрализира с излишък от разтвор на натриев хидроксид. Напишете уравненията на описаните реакции.
14) Към разтвора, получен при взаимодействието на натриев пероксид с вода, се нагрява разтвор на солна киселина, докато реакцията приключи. Разтвор на образуваната сол се електролизира с инертни електроди. Газът, генериран чрез електролиза на анода, се пропуска през суспензия на калциев хидроксид. Напишете уравненията на описаните реакции.
15) Серен газ се пропуска през разтвор на натриев хидроксид, за да се образува средна сол. Към получения разтвор се прибавя воден разтвор на калиев перманганат. Получената утайка се отделя и действа върху нея със солна киселина. Освободеният газ се пропуска през студен разтвор на калиев хидроксид. Напишете уравненията на описаните реакции.
16) Смес от силициев диоксид (IV) и магнезиев метал се калцинира. Полученото просто вещество се третира с концентриран разтвор на натриев хидроксид. Освободеният газ се пропуска над нагрятия натрий. Полученото вещество се поставя във вода. Напишете уравненията на описаните реакции.
17) Продуктът от взаимодействието на литий с азот се обработва с вода. Полученият газ се пропуска през разтвор на сярна киселина до прекратяване на химичните реакции. Полученият разтвор се обработва с разтвор на бариев хлорид. Разтворът се филтрува и филтратът се смесва с разтвор на натриев нитрат и се нагрява. Напишете уравненията на описаните реакции.
18) Натрият се нагрява в атмосфера на водород. Когато към полученото вещество се добави вода, се наблюдава отделяне на газ и образуване на бистър разтвор. През този разтвор се пропуска кафяв газ, който се получава в резултат на взаимодействието на медта с концентриран разтвор на азотна киселина. Напишете уравненията на описаните реакции.
19) Натриевият бикарбонат се калцинира. Получената сол се разтваря във вода и се смесва с алуминиев разтвор, в резултат на което се образува утайка и се отделя безцветен газ. Утайката се обработва с излишък от разтвор на азотна киселина и газът се пропуска през разтвор на калиев силикат. Напишете уравненията на описаните реакции.
20) Натрият се слепва със сяра. Полученото съединение се обработва със солна киселина, отделеният газ напълно реагира със серен диоксид. Полученият материал се обработва с концентрирана азотна киселина. Напишете уравненията на описаните реакции.
21) Натрият изгаря в излишък от кислород. Полученото вещество се обработва с вода. Получената смес се вари, след което хлорът се добавя към горещия разтвор. Напишете уравненията на описаните реакции.
22) Калият се нагрява в атмосфера на азот. Полученото вещество се третира с излишък от солна киселина, след което към получената смес от соли се прибавя суспензия на калциев хидроксид и се нагрява. Полученият газ се предава с лъчезарен меден оксид (II). Напишете уравненията на описаните реакции.
23) Калият се изгаря в атмосфера на хлор, получената сол се третира с излишък от воден разтвор на сребърен нитрат. Образуваната утайка се филтрира, филтратът се изпарява и сместа се нагрява внимателно. Получената сол се обработва с воден разтвор на бром. Напишете уравненията на описаните реакции.
24) Литий реагира с водород. Продуктът на реакцията се разтваря във вода, образува се газ, който взаимодейства с бром, и полученият разтвор взаимодейства с хлор при нагряване до получаване на смес от две соли. Напишете уравненията на описаните реакции.
25) Натрий изгаря във въздуха. Полученото твърдо вещество абсорбира въглеродния диоксид с отделянето на кислород и сол. Последната сол се разтваря в солна киселина и към получения разтвор се прибавя разтвор на сребърен нитрат. Изпадна бяла утайка. Напишете уравненията на описаните реакции.
26) Кислородът се подлага на електрически разряд в озонизатор. Полученият газ се пропуска през воден разтвор на калиев йодид, докато се отделя нов газ без цвят и миризма, който поддържа горенето и дишането. Натрият се изгаря в атмосферата на последния газ и полученото с него твърдо вещество взаимодейства с въглероден диоксид. Напишете уравненията на описаните реакции.
I група.
1. N2 + 0 ![]() 2NO
2NO
2NO + 0 \u003d 2NO2
2NO 2 + 2NaOH \u003d NaNO 3 + NaNO 2 + H20
2NaNO 3 2NaNO 2 + 0
2. 2NaCl ![]() 2Na + Cl2
2Na + Cl2
при катода на анода
2Na + O2 \u003d Na2O2
2Na 2 O 2 + 2CO 2 \u003d 2Na 2 CO 3 + 0
Na2C03 + 2NH4Cl \u003d 2NaCl + CO 2 + 2NH3 + H20
3. NaHCO 3 + HNO 3 \u003d NaNO 3 + CO 2 + H20
2NaNO 3 2NaNO 2 + 0
5NaNO 2 + 2KMnO 4 + 3H 2 SO 4 \u003d 5NaNO 3 + 2MnSO 4 + K 2 SO 4 + 3H 2 O
NaNO3 + 4Zn + 7NaOH + 6H20 \u003d 4Na2 + NH3
4.2H20 + 2 NaI ![]() H2 + 2NaOH + I2
H2 + 2NaOH + I2
2K + I 2 \u003d 2KI
8KI + 5H 2 SO 4 (съгл.) \u003d 4K 2 SO 4 + H 2 S + 4I 2 + 4H 2 O
3H 2S + 2K 2 CrO 4 + 2H 2 O \u003d 2Cr (OH) 3 ↓ + 3S ↓ + 4KOH
5. 2NaCl ![]() 2Na + Cl2
2Na + Cl2
при катода на анода
2Na + O2 \u003d Na2O2
Na2O2 + SO2 \u003d Na2S04
Na2S04 + Ba (OH) 2 \u003d BaSO 4 ↓ + 2NaOH
6. P 4 + 3KOH + 3H20 \u003d 3KH 2 PO2 + PH3
2PH3 + 4O2 \u003d P2O5 + 3H20
P 2 O 5 + 4NaOH \u003d 2Na 2 HPO 4 + H 2 O


