14.08.2019
रासायनिक तत्वों धातुओं के सामान्य गुण क्या हैं। धातु रासायनिक तत्वों के रूप में
बचपन से ही हम इस वाक्यांश में आते हैं कि ऐसी वस्तु धातु से बनी होती है। धातु क्या है?
धातु रासायनिक तत्वों (साथ ही उनकी मिश्र धातुओं) का एक निश्चित समूह है जो पूरे समूह के लिए सामान्य गुण हैं, जैसे कि ताकत, अच्छी तापीय और विद्युत चालकता, नमनीयता, लचीलापन और धातु की चमक।
सभी ज्ञात रासायनिक तत्वों का लगभग 80% धातु (118 में से 96) धातुओं से संबंधित है।
धातुओं के भौतिक गुण
पारा के अपवाद के साथ सभी धातु, आमतौर पर ठोस होते हैं। कठोरता के संदर्भ में, सबसे नरम धातु सीज़ियम है (10-बिंदु मोह पैमाने पर 0.2 अंक)। सबसे कठिन टंगस्टन है। इसकी कठोरता 6 अंक है। लोहे की कठोरता 4 अंक है।
धातुओं के पिघलने का तापमान (तरल अवस्था में संक्रमण) भिन्न होता है: - 39 merc से पारा के लिए 3 410 to से टंगस्टन के लिए। सभी क्षार धातुओं में कम गलनांक होता है, और टिन और सीसा सामान्य होते हैं। उन्हें गैस बर्नर पर घर पर भी पिघलाया जा सकता है। अधिकांश धातुओं को उच्च तापमान के साथ विशेष भट्टियों में पिघलाया जाता है।
धातुओं के क्रिस्टल लैटिस में मुफ्त मोबाइल इलेक्ट्रॉनों की उपस्थिति के कारण, सभी बिजली और गर्मी का संचालन करते हैं। धातुओं से बिजली के सबसे अच्छे संवाहक चांदी, तांबा और एल्यूमीनियम हैं। यह कोई दुर्घटना नहीं है कि यह अंतिम दो धातुओं से है जो वे विद्युत तारों को बनाते हैं।
धातुओं की उत्कृष्ट तापीय चालकता के साथ, हम अक्सर रोजमर्रा की जिंदगी में भी मुठभेड़ करते हैं। पानी को उबालने के लिए, हम इसे धातु के पैन में डालते हैं और इसे स्टोव पर रख देते हैं। टेंग धातु को गर्म करता है, और धातु लगभग सभी थर्मल ऊर्जा को पानी में स्थानांतरित करता है।
धातुओं के रासायनिक गुण
रासायनिक प्रतिक्रियाओं के दौरान, सभी धातु आसानी से अपने इलेक्ट्रॉनों को दान करते हैं और एजेंटों को कम करने के रूप में कार्य करते हैं।
लगभग सभी धातुएं ऑक्सीजन द्वारा ऑक्सीकृत होती हैं। क्षार धातु (लिथियम, कैल्शियम) सामान्य परिस्थितियों में ऑक्सीजन के साथ प्रतिक्रिया करते हैं। ऑक्सीजन द्वारा अन्य धातुओं के ऑक्सीकरण के लिए एक ऊंचा तापमान की आवश्यकता होती है। उदाहरण के लिए, यदि आप आग पर एक तांबे के तार को गर्म करते हैं, तो तांबे हवा से ऑक्सीजन के साथ बातचीत करेगा और एक काली फिल्म (तांबा ऑक्सीकरण) के साथ कवर हो जाएगा:
- 2Cu + O 2 → 2CuO
सोना और प्लेटिनम ऑक्सीजन के साथ प्रतिक्रिया नहीं करते हैं।
अन्य ऑक्सीकरण एजेंटों में से, क्लोरीन और सल्फर धातुओं के साथ प्रतिक्रिया करते हैं। यदि आप लोहे के बुरादे और सल्फर पाउडर को मिलाते हैं और मिश्रण को गर्म करते हैं, तो हमारी आँखों के सामने हमें लौह सल्फाइड मिलता है:
- Fe + S → FeS
विभिन्न धातुओं की कम करने की गतिविधि अलग होती है। उनकी गतिविधि में, धातुओं को निम्नानुसार वितरित किया जाता है:
- ली - के - बा - सीनियर - सीए - ना - एमजी - अल - एनएन - सीआर - फ़े - सीए - सह - नी - एसएन - पीबी - (एच २) - सीयू - एचजी - एजी - पीटी - औ।
इस पंक्ति में बाईं ओर जितना अधिक धातु है, उतना ही सक्रिय है। पिछला तत्व धातु को दाईं ओर विस्थापित कर सकता है। उदाहरण के लिए, यदि लोहे के टुकड़े को टेस्ट ट्यूब में कॉपर सल्फेट के घोल के साथ रखा जाता है, तो उसे भूरे रंग की कोटिंग (तांबे की फिल्म) के साथ कवर किया जाएगा:
- Fe + CuSO4 → FeSO4 + Cu
हाइड्रोजन (H2) के बाईं ओर धातुएं इसे हाइड्रोक्लोरिक एसिड से विस्थापित कर सकती हैं। यदि जस्ता के टुकड़े को हाइड्रोक्लोरिक एसिड में उतारा जाता है, तो हाइड्रोजन निकलना शुरू हो जाएगा:
- HCl + Zn → ZnCl2 + H2
क्षार धातुएं पानी के साथ आसानी से प्रतिक्रिया करती हैं। यदि सोडियम का एक टुकड़ा पानी के एक कंटेनर में रखा जाता है, तो हाइड्रोजन सक्रिय रूप से छोड़ा जाएगा और क्षार बनेगा:
- 2Na + 2H2O → 2NaOH + H2
धातु आवेदन
इसके लाभकारी गुणों के कारण, धातुओं ने मानव जीवन में दृढ़ता से प्रवेश किया है। एक आदमी धातुओं की ताकत का उपयोग करता है, जिससे उन्हें इमारतों (छोटे मंडपों से लेकर विशाल गगनचुंबी इमारतों तक), कार निकायों (कारों, वैगनों, जहाजों, मशीन टूल्स) के साथ-साथ विभिन्न उपकरणों के काम करने वाले हिस्सों को बनाने में मदद मिलती है।
परिभाषा
प्रकृति में होना
धातु के गुण
विशेषता गुण धातुओं की
भौतिक गुण धातुओं की
धातुओं के रासायनिक गुण
सूक्ष्म संरचना
क्षार धातु
क्षार धातुओं की सामान्य विशेषताएँ
क्षार धातुओं के रासायनिक गुण
क्षार धातुओं का उत्पादन
हाइड्रॉक्साइड
कार्बोनेट
रूबिडीयाम
क्षारीय पृथ्वी धातु
कैल्शियम
स्ट्रोंटियम
संक्रमण धातु
संक्रमण तत्वों की सामान्य विशेषताएं
धातु आवेदन
निर्माण सामग्री
विद्युत सामग्री
उपकरण सामग्री
कहानी
निष्कर्षण धातुकर्म
धातु है (नाम लाट से आता है। मेटालम - मेरा) - विशिष्ट धात्विक गुणों वाले तत्वों का एक समूह, जैसे कि उच्च तापीय और विद्युत चालकता, प्रतिरोध का एक सकारात्मक तापमान गुणांक, उच्च लचीलापन, आदि सभी रासायनिक तत्वों का लगभग 70% धातुओं से संबंधित है।
धातु है











![]()





















![]()


![]()





प्रकृति में होना
अधिकांश धातुएं अयस्कों और यौगिकों के रूप में प्रकृति में मौजूद हैं। वे ऑक्साइड, सल्फाइड, कार्बोनेट और अन्य रासायनिक यौगिक बनाते हैं। शुद्ध धातुओं और उनके आगे के आवेदन को प्राप्त करने के लिए, उन्हें अयस्कों से अलग करना और सफाई करना आवश्यक है। यदि आवश्यक हो, तो मिश्र धातु और अन्य धातु प्रसंस्करण किया जाता है। विज्ञान इसका अध्ययन कर रहा है। धातुकर्म। धातुकर्म फेरस अयस्कों (पर आधारित) को अलग करता है ग्रंथि) और रंग (शामिल नहीं है लोहाकुल मिलाकर लगभग 70 आइटम)। , और प्लैटिनम भी कीमती धातुओं पर लागू होते हैं। इसके अलावा, छोटी मात्रा में वे समुद्र के पानी, पौधों, जीवित जीवों (एक महत्वपूर्ण भूमिका निभाते हुए) में मौजूद हैं।
यह ज्ञात है कि मानव शरीर 3% धातुओं से बना है। हमारी कोशिकाओं में अधिकांश कैल्शियम और सोडियम हैं, लसीका प्रणालियों में केंद्रित हैं। मैग्नीशियम मांसपेशियों और तंत्रिका तंत्र में बनाता है, तांबा - जिगर में, - रक्त में।
धातु के गुण
धातु है
धातुओं के चारित्रिक गुण
धातु की चमक (ग्रेफाइट के रूप में आयोडीन और कार्बन को छोड़कर। इसके धातु चमक के बावजूद, क्रिस्टलीय आयोडीन और ग्रेफाइट गैर-धातु हैं।)
अच्छा विद्युत चालकता (कार्बन को छोड़कर)
आसान मशीनिंग की संभावना।
उच्च घनत्व (आमतौर पर धातुएं गैर-धातुओं की तुलना में भारी होती हैं।)
उच्च गलनांक (अपवाद: पारा, गैलियम और क्षार धातु।)
उच्च तापीय चालकता
प्रतिक्रियाओं में, वे हमेशा एजेंटों को कम कर रहे हैं।
धातुओं के भौतिक गुण
ठोस परिस्थितियों में सभी धातु (पारा और सशर्त को छोड़कर) ठोस अवस्था में होते हैं, लेकिन उनमें अलग-अलग कठोरता होती है। तो, क्षार धातुओं को आसानी से रसोई के चाकू से काट दिया जाता है, और वेनेडियम, टंगस्टन और क्रोमियम जैसे धातु आसानी से सबसे कठिन और कांच को खरोंचते हैं। नीचे मोहस पैमाने पर कुछ धातुओं की कठोरता है।
गलनांक ting39 ° C (पारा) से 3410 ° C (टंगस्टन) तक होता है। अधिकांश धातुओं का पिघलने बिंदु (क्षार के अपवाद के साथ) उच्च है, लेकिन कुछ "सामान्य" धातुएं, उदाहरण के लिए टिन और नेतृत्वएक पारंपरिक बिजली या गैस स्टोव पर पिघलाया जा सकता है।
घनत्व के आधार पर, धातुओं को प्रकाश में विभाजित किया जाता है (घनत्व 0.53 h 5 g / cm_) और भारी (5 h 22.5 g / cm_)। सबसे हल्की धातु लिथियम (घनत्व 0.53 ग्राम / सेमी_) है। सबसे भारी धातु को नाम देना वर्तमान में असंभव है, चूंकि ओस्मियम और इरिडियम की घनत्व - दो सबसे भारी धातुएं - लगभग बराबर हैं (लगभग 22.6 ग्राम / सेमी 2 - घनत्व से लगभग दो गुना अधिक नेतृत्व), और उनके सटीक घनत्व की गणना करना बेहद मुश्किल है: इसके लिए आपको धातुओं को पूरी तरह से साफ करने की आवश्यकता है, क्योंकि कोई भी अशुद्धियां उनके घनत्व को कम करती हैं।
अधिकांश धातुएं प्लास्टिक हैं, अर्थात, धातु के तार को झुकाया जा सकता है, और यह टूटेगा नहीं। यह उनके बीच के बंधन को तोड़ने के बिना धातु परमाणुओं की परतों के विस्थापन के कारण है। सबसे अधिक प्लास्टिक हैं सोना, चांदी और तांबा। से सोना 0.003 मिमी की मोटाई के साथ पन्नी बनाना संभव है, जिसका उपयोग व्यापार वस्तुओं को बनाने के लिए किया जाता है। हालांकि, सभी धातुएं नमनीय नहीं हैं। से तार जस्ता या टिन जब मुड़ा हुआ crunches; विरूपण पर, मैंगनीज और बिस्मथ लगभग कभी नहीं झुकते हैं, लेकिन तुरंत टूट जाते हैं। प्लास्टिसिटी धातु की शुद्धता पर भी निर्भर करता है; इस प्रकार, बहुत शुद्ध क्रोमियम बहुत प्लास्टिक है, लेकिन, मामूली अशुद्धियों के साथ दूषित भी भंगुर और कठिन हो जाता है।
सभी धातुएं अच्छी तरह से बिजली का संचालन करती हैं; यह एक विद्युत क्षेत्र के प्रभाव में चल रहे मोबाइल इलेक्ट्रॉनों के क्रिस्टल क्रिस्टल में मौजूदगी के कारण है। चांदीतांबा और अल्युमीनियम सबसे बड़ी विद्युत चालकता है; इस कारण से, अंतिम दो धातुओं को अक्सर तारों के लिए सामग्री के रूप में उपयोग किया जाता है। सोडियम में बहुत अधिक विद्युत चालकता होती है, सोडियम से भरे पतली दीवारों वाले स्टेनलेस स्टील ट्यूब के रूप में सोडियम कंडक्टरों का उपयोग करने का प्रयास प्रायोगिक उपकरणों में जाना जाता है। सोडियम के कम विशिष्ट गुरुत्वाकर्षण के कारण, समान प्रतिरोध के साथ, सोडियम "तार" तांबे की तुलना में बहुत हल्का होता है और यहां तक \u200b\u200bकि एल्यूमीनियम की तुलना में कुछ हद तक हल्का होता है।
धातुओं की उच्च तापीय चालकता भी मुक्त इलेक्ट्रॉनों की गतिशीलता पर निर्भर करती है। इसलिए, कई तापीय चालकता विद्युत चालकता की एक श्रृंखला के समान है, और बिजली की तरह गर्मी का सबसे अच्छा कंडक्टर है। सोडियम गर्मी के एक अच्छे संवाहक के रूप में भी उपयोग करता है; यह व्यापक रूप से जाना जाता है, उदाहरण के लिए, ऑटोमोबाइल इंजन के वाल्वों में सोडियम का उपयोग उनके शीतलन में सुधार करने के लिए।
धातुओं की चिकनी सतह बहुत प्रकाश को दर्शाती है - इस घटना को धातु की चमक कहा जाता है। हालांकि, एक पाउडर अवस्था में, अधिकांश धातु अपनी चमक खो देते हैं; अल्युमीनियम और मैग्नीशियम, हालांकि, पाउडर में अपनी चमक बनाए रखते हैं। सबसे अधिक प्रतिबिंबित प्रकाश, चांदी और - दर्पण इन धातुओं से बने होते हैं। रोडियाम का उपयोग कभी-कभी दर्पण के निर्माण के लिए किया जाता है, इसके असाधारण उच्च मूल्य के बावजूद: चांदी या यहां तक \u200b\u200bकि पैलेडियम की तुलना में बहुत अधिक कठोरता और रासायनिक प्रतिरोध के कारण, रोडियम की परत चांदी की तुलना में बहुत पतली हो सकती है।
अधिकांश धातुओं का रंग लगभग एक ही है - एक धूसर रंग के साथ हल्के भूरे रंग का। , तांबा और सीज़ियम, क्रमशः, पीला, लाल और हल्का पीला।
धातुओं के रासायनिक गुण
धातु है
अधिकांश धातुओं में बाहरी इलेक्ट्रॉन परत (1-3) पर इलेक्ट्रॉनों की एक छोटी मात्रा होती है, इसलिए वे अधिकांश प्रतिक्रियाओं में एजेंटों को कम करने के रूप में कार्य करते हैं (अर्थात, वे अपने इलेक्ट्रॉनों को "वापस देते हैं")
1. सरल पदार्थों के साथ प्रतिक्रियाएं
सोना, प्लैटिनम को छोड़कर सभी धातुएं ऑक्सीजन के साथ प्रतिक्रिया करती हैं। चांदी के साथ प्रतिक्रिया उच्च तापमान पर होती है, लेकिन चांदी (II) ऑक्साइड व्यावहारिक रूप से नहीं बनती है, क्योंकि यह थर्मल रूप से अस्थिर है। धातु के आधार पर, उत्पादन ऑक्साइड, पेरोक्साइड, पेरोक्साइड हो सकता है:
4Li + O2 \u003d 2Li2O लिथियम ऑक्साइड
2Na + O2 \u003d Na2O2 सोडियम पेरोक्साइड
K + O2 \u003d KO2 पोटेशियम सुपरऑक्साइड
पेरोक्साइड से ऑक्साइड प्राप्त करने के लिए, पेरोक्साइड को एक धातु के साथ कम किया जाता है:
Na2O2 + 2Na \u003d 2Na2O
मध्यम और निम्न गतिविधि धातुओं के साथ, प्रतिक्रिया तब होती है जब गर्म होता है:
3F + 2O2 \u003d Fe3O4
नाइट्रोजन के साथ केवल सबसे सक्रिय धातुएं ही प्रतिक्रिया करती हैं, केवल लिथियम ही कमरे के तापमान पर बातचीत करती है, जिससे नाइट्राइड बनता है:
6 एलआई + एन 2 \u003d 2 एल 3 एन
गर्म होने पर:
3C + N2 \u003d Ca3N2
सभी धातुएं सोने के अलावा सल्फर के साथ प्रतिक्रिया करती हैं प्लैटिनम:
आयरन के साथ बातचीत करता है धूसर जब गर्म किया जाता है, तो सल्फाइड बनता है:
केवल सक्रिय धातुएं हाइड्रोजन के साथ प्रतिक्रिया करती हैं, अर्थात्, बी को छोड़कर समूहों IA और IIA की धातुएं। प्रतिक्रियाओं को गर्म करके किया जाता है, और हाइड्राइड का गठन किया जाता है। प्रतिक्रियाओं में, धातु एक कम करने वाले एजेंट के रूप में कार्य करता है; हाइड्रोजन का ऑक्सीकरण राज्य acts1 है:
केवल सबसे सक्रिय धातुएं कार्बन के साथ प्रतिक्रिया करती हैं। इस मामले में, एसिटिलीनाइड्स या मेथेनाइड्स बनते हैं। एसिटाइलीनाइड्स, जब पानी के साथ प्रतिक्रिया की जाती है, तो एसिटिलीन, मेथेनाइड्स - मीथेन देते हैं।
2Na + 2C \u003d Na2C2
Na2C2 + 2H2O \u003d 2NaOH + C2H2
डोपिंग अतिरिक्त तत्वों का पिघल में परिचय है जो आधार सामग्री के यांत्रिक, भौतिक और रासायनिक गुणों को संशोधित करता है।
सूक्ष्म संरचना
धातुओं की विशेषता गुणों को उनकी आंतरिक संरचना के आधार पर समझा जा सकता है। इन सभी का नाभिक के साथ बाहरी ऊर्जा स्तर (दूसरे शब्दों में, वैलेंस इलेक्ट्रॉनों) के इलेक्ट्रॉनों का कमजोर संबंध है। इसके कारण, कंडक्टर में निर्मित संभावित अंतर क्रिस्टल जाली में इलेक्ट्रॉनों (जिसे चालन इलेक्ट्रॉनों कहा जाता है) के हिमस्खलन जैसी गति की ओर जाता है। ऐसे इलेक्ट्रॉनों के संग्रह को अक्सर इलेक्ट्रॉन गैस कहा जाता है। इलेक्ट्रॉनों के अलावा, फोनोन (जाली कंपन) तापीय चालकता में योगदान करते हैं। प्लास्टिसिटी अव्यवस्थाओं के आंदोलन के लिए छोटे ऊर्जा अवरोध और क्रिस्टलोग्राफिक विमानों की शिफ्ट के कारण है। कठोरता को बड़ी संख्या में संरचनात्मक दोष (अंतरालीय परमाणु, आदि) द्वारा समझाया जा सकता है।
इलेक्ट्रॉनों के आसान पुनरावृत्ति के कारण, धातुओं का ऑक्सीकरण संभव है, जिससे जंग हो सकता है और गुणों का और क्षरण हो सकता है। ऑक्सीकरण क्षमता को धातु गतिविधि की मानक श्रृंखला द्वारा पहचाना जा सकता है। यह तथ्य अन्य तत्वों (मिश्र धातु के साथ संयोजन में धातुओं का उपयोग करने की आवश्यकता की पुष्टि करता है, जिनमें से सबसे महत्वपूर्ण है इस्पात), उनके मिश्र धातु और विभिन्न कोटिंग्स के आवेदन।
धातुओं के इलेक्ट्रॉनिक गुणों के अधिक सही विवरण के लिए, क्वांटम यांत्रिकी का उपयोग करना आवश्यक है। पर्याप्त समरूपता वाले सभी ठोस पदार्थों में, अलग-अलग परमाणुओं के इलेक्ट्रॉन ऊर्जा का स्तर ओवरलैप और फॉर्म की अनुमति देता है, और वैलेंस इलेक्ट्रॉनों द्वारा गठित बैंड को वैलेंस बैंड कहा जाता है। धातुओं में वैलेंस इलेक्ट्रॉनों का कमजोर बंधन इस तथ्य की ओर जाता है कि धातुओं में वैलेंस बैंड बहुत व्यापक है, और सभी वैलेंस इलेक्ट्रॉन इसे पूरी तरह से भरने के लिए पर्याप्त नहीं हैं।
इस तरह के आंशिक रूप से भरे क्षेत्र की प्रमुख विशेषता यह है कि एक न्यूनतम लागू वोल्टेज के साथ भी, नमूने में वैलेंस इलेक्ट्रॉनों का पुनर्गठन शुरू होता है, अर्थात, एक विद्युत प्रवाह।
वही उच्च इलेक्ट्रॉन गतिशीलता उच्च तापीय चालकता की ओर जाता है, साथ ही विद्युत चुम्बकीय विकिरण को दर्पण करने की क्षमता (जो धातुओं को एक विशिष्ट चमक देता है)।
क्षार धातु
धातु है
क्षारीय धातुएं - डी आई दिमित्री इवानोविच मेंडेलीव के रासायनिक तत्वों की आवधिक प्रणाली के समूह I के मुख्य उपसमूह के तत्व: लिथियम ली, सोडियम ना, पोटेशियम के, रुबिडियम आरबी, सीज़ियम सीएस और फ्रांस फ्र। इन धातुओं को क्षारीय कहा जाता है क्योंकि उनके अधिकांश यौगिक पानी में घुलनशील होते हैं। स्लाव में, "लीच" का अर्थ है "भंग", और इसने धातुओं के इस समूह का नाम निर्धारित किया। जब क्षार धातुएं पानी में घुल जाती हैं, तो घुलनशील हाइड्रॉक्साइड बनते हैं, जिन्हें क्षार कहा जाता है।
क्षार धातुओं की सामान्य विशेषताएँ
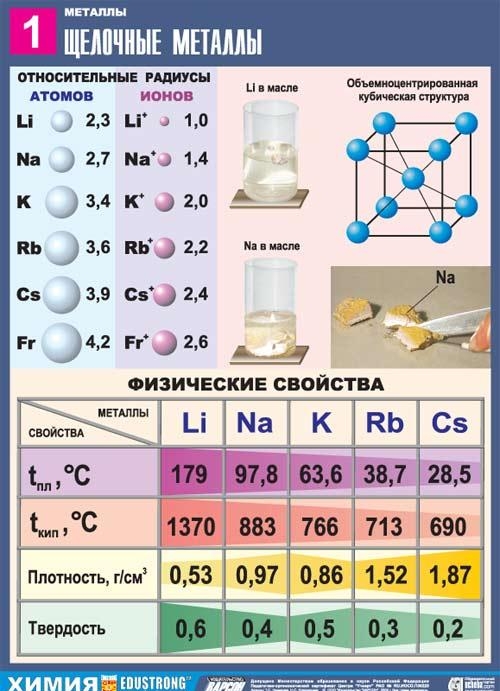
आवधिक प्रणाली में, वे तुरंत अक्रिय गैसों का पालन करते हैं; इसलिए, क्षार धातु परमाणुओं की संरचना की एक विशेषता यह है कि वे एक नए ऊर्जा स्तर पर एक इलेक्ट्रॉन होते हैं: उनका इलेक्ट्रॉनिक विन्यास ns1 है। यह स्पष्ट है कि क्षार धातुओं के वैलेंस इलेक्ट्रॉनों को आसानी से हटाया जा सकता है, क्योंकि यह परमाणु के लिए एक इलेक्ट्रॉन दान करने और एक अक्रिय गैस कॉन्फ़िगरेशन प्राप्त करने के लिए ऊर्जावान रूप से फायदेमंद है। इसलिए, सभी क्षार धातुओं को गुणों को कम करने की विशेषता है। यह उनके आयनीकरण की क्षमता के कम मूल्यों (सीज़ियम परमाणु की आयनीकरण क्षमता सबसे कम है) और इलेक्ट्रोनगेटिविटी (ईओ) द्वारा पुष्टि की जाती है।
इस उपसमूह की सभी धातुओं में एक चांदी-सफेद रंग है (चांदी-पीले सीज़ियम को छोड़कर), वे बहुत नरम हैं, उन्हें एक स्केलपेल के साथ काटा जा सकता है। लिथियम, सोडियम और पोटेशियम पानी से हल्के होते हैं और इसकी सतह पर तैरते हैं, इसके साथ प्रतिक्रिया करते हैं।
अल्कली धातु प्रकृति में यौगिकों के रूप में पाई जाती है, जिसमें एकल रूप से आवेशित धनावेश होते हैं। कई खनिजों में समूह I के मुख्य उपसमूह की धातुएँ होती हैं। उदाहरण के लिए, ऑर्थोक्लेज़, या फेल्डस्पार, पोटेशियम एलुमिनाइलेट K2 के समान होते हैं खनिजसोडियम युक्त - एलाबाइट - की संरचना Na2 है। समुद्री जल में सोडियम क्लोराइड NaCl होता है, और मिट्टी में पोटेशियम लवण होते हैं - सिल्विन KCl, सिल्विनाइट NaCl। KCl, कार्नेलाइट KCl। MgCl2। 6H2O, पोलीगलाइट K2SO4। MgSO4। CaSO4। 2H2O।
क्षार धातुओं के रासायनिक गुण
धातु है
पानी, ऑक्सीजन, नाइट्रोजन के संबंध में क्षार धातुओं की उच्च रासायनिक गतिविधि के कारण, उन्हें मिट्टी के तेल की एक परत के तहत संग्रहीत किया जाता है। क्षार धातु के साथ प्रतिक्रिया करने के लिए, वांछित आकार का एक टुकड़ा सावधानीपूर्वक परत के नीचे एक स्केलपेल के साथ काटा जाता है मिट्टी का तेलएक आर्गन वातावरण में, धातु की सतह को हवा के साथ अपनी बातचीत के उत्पादों से अच्छी तरह से साफ किया जाता है और उसके बाद ही नमूना को प्रतिक्रिया पोत में रखा जाता है।
1. पानी के साथ सहभागिता। पानी के संबंध में क्षार धातुओं की एक महत्वपूर्ण संपत्ति उनकी उच्च गतिविधि है। लिथियम पानी के साथ सबसे अधिक शांति से (विस्फोट के बिना) प्रतिक्रिया करता है।
एक समान प्रतिक्रिया में, सोडियम एक पीले रंग की लौ के साथ जलता है और एक छोटा विस्फोट होता है। पोटेशियम और भी अधिक सक्रिय है: इस मामले में, विस्फोट बहुत मजबूत है, और लौ बैंगनी रंग की है।
2. ऑक्सीजन के साथ सहभागिता। हवा में क्षार धातुओं के दहन उत्पादों में धातु की गतिविधि के आधार पर एक अलग संरचना होती है।
Stoichiometric ऑक्साइड के गठन के साथ केवल लिथियम हवा में जलता है।
सोडियम के जलने के दौरान, Na2O2 पेरोक्साइड मुख्य रूप से NaO2 पेरोक्साइड की एक छोटी सी मिश्रण के साथ बनता है।
पोटेशियम, रुबिडियम और सीज़ियम के दहन उत्पादों में मुख्य रूप से सुपरऑक्साइड होता है।
सोडियम और पोटेशियम ऑक्साइड प्राप्त करने के लिए, ऑक्सीजन की अनुपस्थिति में हाइड्रोक्साइड, पेरोक्साइड या सुपरऑक्साइड के मिश्रण को अतिरिक्त धातु से गर्म किया जाता है।
निम्न नियमितता क्षार धातुओं के ऑक्सीजन यौगिकों की विशेषता है: जैसे-जैसे क्षार धातु के धनायन की त्रिज्या बढ़ती जाती है, वैसे-वैसे ऑक्सीजन यौगिकों की स्थिरता पेरोक्साइड आयन O22 और सुपरपरोक्साइड आयन O2- बढ़ती जाती है।
भारी क्षारीय धातुओं के लिए, रचना EO3 की काफी स्थिर ऑजोनाइड्स की विशेषता है। सभी ऑक्सीजन यौगिकों का एक अलग रंग होता है, जिसकी तीव्रता ली से लेकर सीएस तक की श्रृंखला में गहरी होती है।
क्षार धातु ऑक्साइड में मूल ऑक्साइड में निहित सभी गुण होते हैं: वे पानी, एसिड ऑक्साइड और एसिड के साथ प्रतिक्रिया करते हैं।
पेरोक्साइड और सुपरऑक्साइड, मजबूत ऑक्सीकरण एजेंटों के गुणों का प्रदर्शन करते हैं।
पेरोक्साइड और सुपरऑक्साइड, जल के साथ तीव्रता से बातचीत करते हैं, जिससे हाइड्रॉक्साइड्स बनते हैं।
3. अन्य पदार्थों के साथ सहभागिता। क्षार धातु कई गैर-धातुओं के साथ प्रतिक्रिया करते हैं। गर्म होने पर, वे हाइड्रोजन के साथ मिलकर हाइड्राइड्स बनाते हैं, हैलोजन के साथ, धूसर, नाइट्रोजन, फास्फोरस, कार्बन और सिलिकॉन बनाने के लिए, क्रमशः, halides, sulfides, नाइट्राइड, फॉस्फाइड, कार्बाइड और सिलिकाइड।
गर्म होने पर, क्षार धातु अन्य धातुओं के साथ प्रतिक्रिया करने में सक्षम होते हैं, जिससे इंटरमेटेलिक यौगिक बनते हैं। एसिड के साथ क्षार धातु सक्रिय रूप से (एक विस्फोट के साथ) प्रतिक्रिया करता है।
क्षार धातुओं को तरल अमोनिया और इसके डेरिवेटिव - अमीन और एमाइड में भंग कर दिया जाता है।
जब तरल अमोनिया में भंग हो जाता है, तो एक क्षार धातु एक इलेक्ट्रॉन खो देता है, जो अमोनिया के अणुओं द्वारा हल किया जाता है और समाधान को एक नीला रंग देता है। परिणामी एमाइड आसानी से क्षार और अमोनिया के गठन के साथ पानी से विघटित हो जाते हैं।
अल्कली धातु कार्बनिक पदार्थों के साथ अल्कोहल (अल्कोहल के निर्माण के साथ) और कार्बोक्जिलिक एसिड (लवण के निर्माण के साथ) के साथ बातचीत करती है।
4. क्षार धातुओं का गुणात्मक निर्धारण। चूँकि क्षार धातुओं की आयनीकरण क्षमताएँ छोटी होती हैं, जब धातु या इसके यौगिकों को एक लौ में गर्म किया जाता है, परमाणु आयनों को एक निश्चित रंग में रंग देता है।
क्षार धातुओं का उत्पादन
1. क्षार धातुओं के उत्पादन के लिए, मुख्य रूप से उनके हलवों के पिघलने के इलेक्ट्रोलिसिस, सबसे अधिक बार प्राकृतिक रूप से बनाने वाले क्लोराइड खनिज पदार्थ:
कैथोड: Li + + e → Li
एनोड: 2Cl- - 2e → Cl2
2. कभी-कभी क्षार धातुओं को प्राप्त करने के लिए, उनके हाइड्रॉक्साइड पिघल के इलेक्ट्रोलिसिस किया जाता है:
कैथोड: ना + + ई → ना
एनोड: 4OH- - 4e → 2H2O + O2
चूंकि वोल्टेज की विद्युत श्रृंखला में क्षार धातुएं हाइड्रोजन के बाईं ओर होती हैं, इसलिए नमक के घोल से उनकी इलेक्ट्रोलाइटिक तैयारी असंभव है; इस मामले में, इसी क्षार और हाइड्रोजन बनते हैं।
हाइड्रॉक्साइड
क्षार धातु हाइड्रॉक्साइड प्राप्त करने के लिए, इलेक्ट्रोलाइटिक तरीकों का मुख्य रूप से उपयोग किया जाता है। सोडियम क्लोराइड के केंद्रित जलीय घोल के इलेक्ट्रोलिसिस द्वारा सबसे बड़े पैमाने पर सोडियम हाइड्रॉक्साइड का उत्पादन होता है।
सबसे पहले, क्षार विनिमय प्रतिक्रिया द्वारा प्राप्त किया गया था।
इस तरह से प्राप्त क्षार Na2CO3 सोडा के साथ भारी दूषित था।
क्षार धातु हाइड्रॉक्साइड सफेद हीड्रोस्कोपिक पदार्थ हैं, जलीय घोल जिनमें मजबूत आधार होते हैं। वे आधारों की सभी प्रतिक्रियाओं की विशेषता में भाग लेते हैं - वे एसिड, अम्लीय और एम्फ़ोटेरिक ऑक्साइड, एम्फ़ोटेरिक हाइड्रॉक्साइड के साथ प्रतिक्रिया करते हैं।
जब गर्म किया जाता है, तो क्षार धातु हाइड्रॉक्साइड को अपघटन के बिना उच्चीकृत किया जाता है, लिथियम हाइड्रॉक्साइड के अपवाद के साथ, जो कि समूह II के मुख्य उपसमूह के धातु हाइड्रॉक्साइड की तरह, एक ऑक्साइड में और विघटन पर पानी में विघटित हो जाता है।
सोडियम हाइड्रोक्साइड का उपयोग साबुन, सिंथेटिक डिटर्जेंट, कृत्रिम फाइबर, कार्बनिक यौगिक, जैसे कि फिनोल बनाने के लिए किया जाता है।
कार्बोनेट
एक महत्वपूर्ण क्षारीय धातु उत्पाद Na2CO3 सोडा है। पूरी दुनिया में सोडा का थोक हल विधि के अनुसार उत्पादित किया जाता है, जिसे 20 वीं शताब्दी की शुरुआत में प्रस्तावित किया गया था। विधि का सार इस प्रकार है: NaCl का एक जलीय घोल, जिसमें अमोनिया मिलाया जाता है, को 26 - 30 ° C के तापमान पर कार्बन डाइऑक्साइड से संतृप्त किया जाता है। इस मामले में, विरल रूप से घुलनशील सोडियम बाइकार्बोनेट, जिसे बेकिंग सोडा कहा जाता है, का गठन किया जाता है।
अमोनिया को अम्लीय वातावरण को बेअसर करने के लिए जोड़ा जाता है जो तब होता है जब कार्बन डाइऑक्साइड समाधान में पारित हो जाता है और एचसीओ 3-बाइकार्बोनेट आयन का उत्पादन करने के लिए होता है, जो सोडियम बाइकार्बोनेट को उपजी करने के लिए आवश्यक है। पीने के सोडा को अलग करने के बाद, अमोनियम क्लोराइड युक्त घोल को चूने के साथ गर्म किया जाता है और अमोनिया छोड़ा जाता है, जो प्रतिक्रिया क्षेत्र में वापस आ जाता है।
इस प्रकार, सोडा के उत्पादन की अमोनिया विधि में, एकमात्र अपशिष्ट कैल्शियम क्लोराइड है जो समाधान में शेष है और इसका सीमित उपयोग है।
सोडियम बाइकार्बोनेट के निर्माण की प्रक्रिया में उपयोग किए जाने वाले कैल्सीनिंग या धुलाई, Na2CO3 सोडा और कार्बन डाइऑक्साइड, सोडियम बाइकार्बोनेट को शांत करके प्राप्त किए जाते हैं।
सोडा का मुख्य खरीदार कांच है।
NaHCO3 के थोड़ा घुलनशील एसिड नमक के विपरीत, पोटेशियम हाइड्रोजन कार्बोनेट केएचसीओ 3 पानी में अत्यधिक घुलनशील है, इसलिए पोटेशियम हाइड्रॉक्साइड के एक समाधान पर कार्बन डाइऑक्साइड की कार्रवाई से पोटेशियम कार्बोनेट, या पोटाश, K2CO3 का उत्पादन किया जाता है।
पोटाश का उपयोग कांच और तरल साबुन के निर्माण में किया जाता है।
लिथियम एकमात्र क्षार धातु है जिसके लिए हाइड्रोकार्बन प्राप्त नहीं हुआ है। इस घटना का कारण लिथियम आयन की बहुत छोटी त्रिज्या है, जो इसे एक बड़े आयन एचसीओ 3 को धारण करने की अनुमति नहीं देता है।
लिथियम
धातु है
लिथियम - पहले समूह के मुख्य उपसमूह का एक तत्व, रासायनिक तत्वों की आवधिक प्रणाली की दूसरी अवधि डी। आई। मेंडेलीव दिमित्री इवानोविच, परमाणु संख्या के साथ 3. यह प्रतीक Li (lat। Lithium) द्वारा निर्दिष्ट किया गया है। सरल पदार्थ लिथियम (CAS संख्या: 7439-93-2) चांदी-सफेद रंग की एक नरम क्षारीय धातु है।
लिथियम की खोज 1817 में स्वीडिश केमिस्ट और मिनरलोगिस्ट ए। आरफवेडसन द्वारा की गई थी, पहले खनिज पेटलाइट (ली, ना) में, और फिर स्पोड्यूमिन लीएएल में और लेपिडोलाइट KLi.5.5Al1.5 (F, OH) 2 में। हम्फ्री डेवी ने पहली बार 1825 में लिथियम धातु प्राप्त की।
लिथियम को इसका नाम इस तथ्य के कारण मिला कि यह "पत्थरों" (ग्रीक। itsος - पत्थर) में पाया गया था। मूल रूप से "लिथियन" कहा जाता है, आधुनिक नाम बर्ज़ेलियस द्वारा प्रस्तावित किया गया था।
लिथियम एक चांदी-सफेद धातु है, नरम और नमनीय, सोडियम की तुलना में कठोर, लेकिन सीसे की तुलना में नरम। इसे दबाकर और रोल करके प्रोसेस किया जा सकता है।
कमरे के तापमान पर, लिथियम धातु में एक क्यूबिक बॉडी-केंद्रित जाली (समन्वय संख्या 8) होती है, जो ठंडा होने पर काम करती है, एक क्यूबिक क्लोज-पैक जाली में बदल जाती है, जहां डबल क्यूबक्टाहेड्रल समन्वय वाले प्रत्येक परमाणु 12 अन्य से घिरा होता है। 78 K के नीचे, एक स्थिर क्रिस्टलीय रूप एक हेक्सागोनल क्लोज-पैक संरचना है जिसमें प्रत्येक लिथियम परमाणु के पास 12 निकटतम पड़ोसी हैं जो क्यूबक्टाहेड्रोन के कोने पर स्थित है।
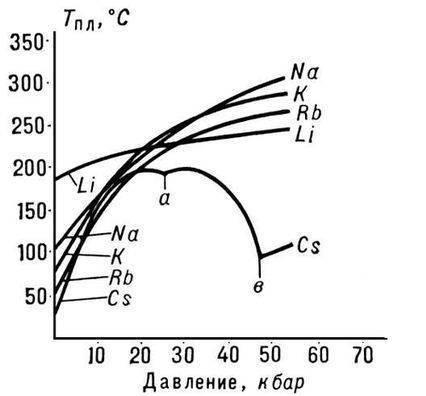
सभी क्षार धातुओं में से, लिथियम को सबसे अधिक पिघलने और क्वथनांक (क्रमशः 180.54 और 1340 डिग्री सेल्सियस) की विशेषता है, इसमें सभी धातुओं (0.533 ग्राम / सेमी 2, पानी का लगभग आधा घनत्व) के बीच कमरे के तापमान पर सबसे कम घनत्व है।
लिथियम परमाणु का छोटा आकार धातु के विशेष गुणों की उपस्थिति की ओर जाता है। उदाहरण के लिए, यह केवल 380 डिग्री सेल्सियस से नीचे के तापमान पर सोडियम के साथ मिश्रण करता है और पिघले हुए पोटेशियम, रुबिडियम और सीज़ियम के साथ नहीं मिलाता है, जबकि क्षार धातुओं के अन्य जोड़े किसी भी अनुपात में एक दूसरे के साथ मिश्रण करते हैं।
क्षारीय धातु, हवा में अस्थिर। लिथियम कम से कम सक्रिय क्षार धातु है, व्यावहारिक रूप से कमरे के तापमान पर शुष्क हवा (और सूखी ऑक्सीजन के साथ) के साथ प्रतिक्रिया नहीं करता है।
नम हवा में, यह धीरे-धीरे ऑक्सीकरण करता है, Li3N नाइट्राइड, LiOH हाइड्रॉक्साइड और Li2CO3 कार्बोनेट में बदल जाता है। जब ऑक्सीजन में गरम किया जाता है, तो यह जलता है, Li2O ऑक्साइड में बदल जाता है। एक दिलचस्प विशेषता यह है कि तापमान में 100 डिग्री सेल्सियस से 300 डिग्री सेल्सियस तक की लिथियम एक घने ऑक्साइड फिल्म के साथ लेपित होती है, और भविष्य में ऑक्सीकरण नहीं होती है।
1818 में, जर्मन रसायनज्ञ लियोपोल्ड गमेलिन ने उस लिथियम की स्थापना की और उसके लवण कार्माइन-लाल लौ को रंगते हैं, जो लिथियम के निर्धारण के लिए एक गुणात्मक संकेत है। इग्निशन तापमान लगभग 300 ° C है। दहन उत्पाद नासॉफिरैन्क्स के श्लेष्म झिल्ली को परेशान करते हैं।
चुपचाप, बिना विस्फोट और आग के, पानी के साथ प्रतिक्रिया करता है, जिससे LiOH और H2 बनता है। यह एथिल अल्कोहल के साथ भी प्रतिक्रिया करता है, एक अल्कोहल बनाता है, अमोनिया के साथ और हलोजन के साथ (आयोडीन के साथ - केवल गर्म)।
लिथियम को पेट्रोलियम ईथर, पैराफिन, गैसोलीन और / या खनिज तेल में भली भांति बंद करके सील किए गए टिन के बक्से में संग्रहित किया जाता है। लिथियम धातु का कारण त्वचा, श्लेष्म झिल्ली और आंखों में जलन होती है।
लौह और अलौह धातु विज्ञान में, लिथियम का उपयोग मिश्र धातुओं की नमनीयता और शक्ति बढ़ाने के लिए किया जाता है। लिथियम का उपयोग कभी-कभी मेटालोथर्मी विधियों द्वारा दुर्लभ धातुओं को पुनर्प्राप्त करने के लिए किया जाता है।
एल्यूमीनियम के गलाने में लिथियम कार्बोनेट सबसे महत्वपूर्ण सहायक पदार्थ (इलेक्ट्रोलाइट में जोड़ा गया) है और वैश्विक एल्यूमीनियम उत्पादन की मात्रा (लिथियम कार्बोनेट 2.5-3.5 किलोग्राम प्रति टन गलाने वाली एल्यूमीनियम की खपत) के अनुपात में हर साल इसकी खपत बढ़ जाती है।
चांदी और सोने के साथ-साथ कप्रम के साथ लिथियम की मिश्र धातु, बहुत प्रभावी सैनिक हैं। मैग्नीशियम, स्कैंडियम, cuprum, कैडमियम और एल्यूमीनियम के साथ लिथियम के मिश्र धातु विमानन और अंतरिक्ष यात्री में नई आशाजनक सामग्री हैं। एल्यूमिनेट और लिथियम सिलिकेट के आधार पर, सिरेमिक तैयार किए गए थे जो कमरे के तापमान पर कठोर हो गए थे और भविष्य में थर्मोन्यूक्लियर ऊर्जा में सैन्य उपकरण, धातु विज्ञान और, में उपयोग किए गए थे। ग्लास सिलिकॉन कार्बाइड फाइबर के साथ प्रबलित लिथियम-एल्यूमीनियम-सिलिकेट पर आधारित है। लिथियम बहुत प्रभावी ढंग से मिश्र धातुओं का नेतृत्व करता है और उन्हें लचीलापन और संक्षारण प्रतिरोध देता है।
लिथियम लवणों का एक मनोवैज्ञानिक प्रभाव होता है और कई मानसिक बीमारियों की रोकथाम और उपचार में दवा में उपयोग किया जाता है। इस क्षमता में सबसे आम है लिथियम कार्बोनेट। मनोरोग में जिसका उपयोग द्विध्रुवी विकार से पीड़ित लोगों के मूड को स्थिर करने के लिए किया जाता है और लगातार मिजाज होता है। यह अवसाद के लिए उन्माद को रोकने और आत्महत्या को कम करने में प्रभावी है। मेडिक्स ने बार-बार देखा है कि कुछ लिथियम यौगिक (उचित मात्रा में, निश्चित रूप से) उन्मत्त अवसाद से पीड़ित रोगियों पर सकारात्मक प्रभाव डालते हैं। इस प्रभाव को दो तरीकों से समझाया गया है। एक ओर, यह पाया गया कि लिथियम मस्तिष्क कोशिकाओं में बाह्य तरल पदार्थ से सोडियम और पोटेशियम आयनों के हस्तांतरण में शामिल कुछ एंजाइमों की गतिविधि को विनियमित करने में सक्षम है। दूसरी ओर, यह देखा गया है कि लिथियम आयन कोशिका के आयनिक संतुलन को सीधे प्रभावित करते हैं। और रोगी की स्थिति सोडियम और पोटेशियम के संतुलन पर काफी हद तक निर्भर करती है: कोशिकाओं में सोडियम की अधिकता अवसादग्रस्त रोगियों की विशेषता है, इसकी कमी उन्माद से पीड़ित लोगों के लिए है। सोडियम पोटेशियम संतुलन को संरेखित करते हुए, लिथियम लवण उन और अन्य पर सकारात्मक प्रभाव डालते हैं।
सोडियम
धातु है
सोडियम - पहले समूह के मुख्य उपसमूह का एक तत्व, तीसरा अवधि रासायनिक तत्वों की आवधिक प्रणाली I। दिमित्री इवानोविच मेंडेलीव, परमाणु संख्या के साथ 11. यह प्रतीक Na (lat। Natrium) द्वारा निर्दिष्ट है। सरल पदार्थ सोडियम (CAS संख्या: 7440-23-5) है - चांदी-सफेद रंग का एक नरम क्षारीय धातु।
पानी में, सोडियम लिथियम के समान व्यवहार करता है: हाइड्रोजन के तेजी से विकास के साथ प्रतिक्रिया होती है, और समाधान में सोडियम हाइड्रॉक्साइड बनता है।
सोडियम (या बल्कि, इसके यौगिकों) का उपयोग प्राचीन काल से किया जाता रहा है। उदाहरण के लिए, सोडा (नैट्रॉन), मिस्र में सोडा झीलों के पानी में स्वाभाविक रूप से पाया जाता है। प्राचीन मिस्र के लोग प्राकृतिक सोडा का इस्तेमाल करते थे, जो कि कैनवस, ब्लीचिंग कैनिंग, खाना पकाने, पेंट बनाने और ग्लेज़ बनाने के लिए किया जाता था। प्लिनी द एल्डर लिखता है कि नील डेल्टा सोडा में (इसमें अशुद्धियों का पर्याप्त अनुपात था) नदी के पानी से अलग किया गया था। यह ग्रे या काले रंग में चित्रित कोयले के मिश्रण के कारण बड़े टुकड़ों के रूप में बिक्री पर चला गया।
सोडियम को सबसे पहले 1807 में अंग्रेजी रसायनज्ञ हम्फ्री डेवी ने ठोस NaOH के इलेक्ट्रोलिसिस द्वारा प्राप्त किया था।
"सोडियम" (नैट्रियम) नाम अरबी नैट्रॉन (ग्रीक में - नाइट्रॉन) से आता है और मूल रूप से यह प्राकृतिक सोडा को संदर्भित करता है। तत्व को पहले सोडियम (लैट सोडियम) कहा जाता था।

सोडियम एक चांदी-सफेद धातु है, एक बैंगनी रंग के साथ पतली परतों में, प्लास्टिक है, यहां तक \u200b\u200bकि नरम (आसानी से चाकू से काट दिया जाता है), सोडियम ग्लिसेंस का एक ताजा टुकड़ा। सोडियम की विद्युत चालकता और तापीय चालकता काफी अधिक है, घनत्व 0.96842 g / cm2 (19.7 ° C पर) है, पिघलने बिंदु 97.86 ° C है, और क्वथनांक 883.15 ° C है।
हवा में क्षारीय धातु आसानी से ऑक्सीकृत हो जाती है। ऑक्सीजन से बचाने के लिए, धातु सोडियम एक परत के नीचे जमा होता है मिट्टी का तेल। सोडियम, लिथियम की तुलना में कम सक्रिय है, इसलिए गर्म होने पर ही नाइट्रोजन के साथ प्रतिक्रिया करता है:
ऑक्सीजन की एक बड़ी अतिरिक्त के साथ, सोडियम पेरोक्साइड का गठन होता है
2Na + O2 \u003d Na2O2
सोडियम धातु का व्यापक रूप से प्रारंभिक रसायन विज्ञान में उपयोग किया जाता है और उद्योग एक मजबूत कम करने वाले एजेंट के रूप में, धातु विज्ञान में भी शामिल है। सोडियम का उपयोग अत्यधिक ऊर्जा-गहन सोडियम-सल्फर बैटरी के उत्पादन में किया जाता है। इसका उपयोग ट्रक निकास वाल्व में हीट सिंक के रूप में भी किया जाता है। कभी-कभी, धातु सोडियम का उपयोग बिजली के तारों के लिए एक सामग्री के रूप में किया जाता है जो बहुत उच्च धाराओं के लिए होता है।
पोटेशियम के साथ एक मिश्र धातु में, साथ ही रूबिडियम और सीज़ियम के साथ, यह अत्यधिक कुशल गर्मी हस्तांतरण माध्यम के रूप में उपयोग किया जाता है। विशेष रूप से, सोडियम 12%, पोटेशियम 47%, सीज़ियम 41% की संरचना के साथ एक मिश्र धातु में point78 डिग्री सेल्सियस का रिकॉर्ड कम पिघलने बिंदु है और इसे आयन रॉकेट इंजनों के लिए काम करने वाले तरल पदार्थ और परमाणु ऊर्जा संयंत्रों के लिए शीतलक के रूप में प्रस्तावित किया गया था।
सोडियम का उपयोग उच्च और निम्न दबाव निर्वहन लैंप (एनएलवीडी और एनएलएनडी) में भी किया जाता है। DNVT (आर्क सोडियम ट्यूबलर) प्रकार के एनएलवीडी लैंप सड़क प्रकाश व्यवस्था में बहुत व्यापक रूप से उपयोग किए जाते हैं। वे एक चमकदार पीली रोशनी देते हैं। DNaT लैंप की सेवा जीवन 12-24 हजार घंटे है। इसलिए, DNaT प्रकार के डिस्चार्ज लैंप शहरी, वास्तुकला और औद्योगिक प्रकाश व्यवस्था के लिए अपरिहार्य हैं। इसमें डीएनएएस, डीएनएएमटी (आर्क सोडियम मैट), डीएनएज (आर्क सोडियम मिरर) और डीएनएटीबीआर (आर्क सोडियम ट्यूब विद मर्करी) लैंप भी हैं।
सोडियम धातु का उपयोग कार्बनिक पदार्थों के गुणात्मक विश्लेषण में किया जाता है। सोडियम और परीक्षण पदार्थ के मिश्र धातु को इथेनॉल के साथ बेअसर किया जाता है, आसुत जल के कई मिलीलीटर जोड़े और 3 भागों में विभाजित होते हैं, जे। लसेन्या (1843), जिसका उद्देश्य नाइट्रोजन, सल्फर और हैलोजेन का निर्धारण करना है ( कसौटी Beilstein)
सोडियम क्लोराइड (टेबल सॉल्ट) सबसे पुराना इस्तेमाल होने वाला फ्लेवरिंग और संरक्षण एजेंट है।
सोडियम एज़ाइड (Na3N) का उपयोग धातु विज्ञान में नाइट्राइडिंग एजेंट के रूप में और लेड एज़ाइड के उत्पादन में किया जाता है।
सोडियम साइनाइड (NaCN) का उपयोग चट्टानों से सोने के हाइड्रोमेटेलर्जिकल तरीके के साथ-साथ नाइट्रोकार्ब्राइजिंग स्टील और इलेक्ट्रोप्लेटिंग (सिल्वरिंग, गिल्डिंग) में किया जाता है।
सोडियम क्लोरेट (NaClO3) का उपयोग रेल की पटरियों पर अवांछित वनस्पति को नष्ट करने के लिए किया जाता है।
पोटैशियम
कालिया - पहले समूह के मुख्य उपसमूह का एक तत्व, चौथा अवधि रासायनिक तत्वों की आवधिक प्रणाली डी। आई। मेंडेलीव दिमित्री इवानोविच, परमाणु संख्या 19 के साथ। यह प्रतीक K (lat। Kalium) द्वारा निर्दिष्ट है। सरल पदार्थ पोटेशियम (सीएएस संख्या: 7440-09-7) है - चांदी-सफेद रंग का एक नरम क्षारीय धातु।
प्रकृति में, पोटेशियम केवल अन्य तत्वों के साथ यौगिकों में पाया जाता है, उदाहरण के लिए, समुद्र के पानी में, साथ ही साथ कई खनिजों में। यह हवा में बहुत जल्दी ऑक्सीकरण करता है और बहुत आसानी से रासायनिक रूप से प्रतिक्रिया करता है, खासकर पानी के साथ, एक क्षार बनाता है। कई मामलों में, पोटेशियम के रासायनिक गुण सोडियम के बहुत करीब हैं, लेकिन जैविक क्रियाओं और जीवित जीवों की कोशिकाओं द्वारा उनके उपयोग के दृष्टिकोण से, वे अभी भी अलग हैं।
पोटेशियम (अधिक सटीक रूप से, इसके यौगिकों) का उपयोग प्राचीन काल से किया जाता रहा है। तो, पोटाश का उत्पादन (जो एक डिटर्जेंट के रूप में इस्तेमाल किया गया था) पहले से ही 11 वीं शताब्दी में मौजूद था। पुआल या लकड़ी जलाने के दौरान बनाई गई राख को पानी के साथ इलाज किया गया था, और परिणामस्वरूप समाधान (शराब) को छानने के बाद वाष्पित किया गया था। शुष्क अवशेष, पोटेशियम कार्बोनेट के अलावा, पोटेशियम सल्फेट K2SO4, सोडा और पोटेशियम क्लोराइड KCl शामिल थे।
1807 में, एक अंग्रेजी रसायनज्ञ, डेवी, ठोस कास्टिक पोटेशियम (KOH) के इलेक्ट्रोलिसिस द्वारा पृथक पोटेशियम और इसे "पोटेशियम" (लैटिन पोटेशियम) कहा जाता है, यह नाम अभी भी अंग्रेजी, फ्रेंच, स्पेनिश, पुर्तगाली और पोलिश में उपयोग किया जाता है। 1809 में, एल.वी. गिल्बर्ट ने "पोटेशियम" (अव्य। कलियम, अरबी अल-काली - पोटेशियम से) नाम प्रस्तावित किया। इस नाम ने जर्मन भाषा में प्रवेश किया, और वहां से उत्तरी और पूर्वी यूरोप की अधिकांश भाषाओं में (रूसी सहित) और "जीता" इस तत्व के लिए एक प्रतीक चुनते समय - के।
पोटेशियम एक सिल्हूट पदार्थ है, जिसकी ताज़ी बनी सतह पर एक विशिष्ट चमक होती है। बहुत हल्का और फुस्स। यह पारा में अपेक्षाकृत अच्छी तरह से घुल जाता है, जिससे अमलगम बनता है। एक बर्नर की लौ में पेश किया जा रहा है, पोटेशियम (साथ ही इसके यौगिकों) एक विशिष्ट गुलाबी-बैंगनी रंग में लौ को रंग देता है।
अन्य क्षार धातुओं की तरह पोटेशियम, विशिष्ट धात्विक गुणों को प्रदर्शित करता है और रासायनिक रूप से सक्रिय है, आसानी से इलेक्ट्रॉनों को छोड़ देता है।
यह एक मजबूत कम करने वाला एजेंट है। यह ऑक्सीजन के साथ इतनी सक्रिय रूप से जोड़ती है कि यह ऑक्साइड नहीं बनाता है, लेकिन पोटेशियम सुपरऑक्साइड ऑक्साइड KO2 (या K2O4)। हाइड्रोजन वायुमंडल में गर्म होने पर पोटैशियम हाइड्राइड केएच बनता है। यह सभी गैर-धातुओं के साथ अच्छी तरह से संपर्क करता है, जिसमें हैलिड्स, सल्फ़ाइड, नाइट्राइड्स, फ़ॉस्फ़ाइड्स आदि, साथ ही साथ जटिल पदार्थ जैसे पानी (एक विस्फोट के साथ प्रतिक्रिया होती है), विभिन्न ऑक्साइड और लवण के साथ होता है। इस मामले में, वे अन्य धातुओं को एक स्वतंत्र अवस्था में कम कर देते हैं।
पोटैशियम केरोसीन की एक परत के नीचे जमा होता है।
पोटेशियम और सोडियम के कमरे के तापमान मिश्र धातु पर एक तरल का उपयोग बंद प्रणालियों में शीतलक के रूप में किया जाता है, उदाहरण के लिए, फास्ट-न्यूट्रॉन परमाणु संयंत्रों में। इसके अलावा, रुबिडियम और सीज़ियम के साथ इसके तरल मिश्र धातुओं का व्यापक रूप से उपयोग किया जाता है। सोडियम की मिश्र धातु संरचना 12%, पोटेशियम 47%, सीज़ियम 41% में रिकॉर्ड कम गलनांक −78 ° C है।
पोटेशियम यौगिक सबसे महत्वपूर्ण पोषक तत्व हैं और इसलिए उर्वरकों के रूप में उपयोग किया जाता है।
पोटेशियम लवण का व्यापक रूप से इलेक्ट्रोप्लेटिंग में उपयोग किया जाता है, चूंकि अपेक्षाकृत उच्च लागत के बावजूद, वे अक्सर इसी सोडियम लवण की तुलना में अधिक घुलनशील होते हैं, और इसलिए उच्च वर्तमान घनत्वों पर इलेक्ट्रोलाइट्स का गहन संचालन प्रदान करते हैं।
पोटेशियम एक आवश्यक पोषक तत्व है, खासकर पौधे की दुनिया में। मिट्टी में पोटेशियम की कमी के साथ, पौधे बहुत खराब रूप से विकसित होते हैं और कम हो जाते हैं, इसलिए निकाले गए पोटेशियम लवण का लगभग 90% उर्वरकों के रूप में उपयोग किया जाता है।
पोटेशियम, नाइट्रोजन और फास्फोरस के साथ, पौधों के पोषण के मुख्य तत्वों में से हैं। पौधों में पोटेशियम का कार्य, साथ ही साथ उनके लिए आवश्यक अन्य तत्व, कड़ाई से विशिष्ट हैं। पौधों में, पोटेशियम आयनिक रूप में होता है। पोटेशियम मुख्य रूप से कोशिकाओं के कोशिका द्रव्य और रिक्तिका में पाया जाता है। लगभग 80% पोटेशियम सेल सैप में होता है।
पोटेशियम के कार्य बहुत विविध हैं। यह पाया गया कि यह प्रकाश संश्लेषण के सामान्य पाठ्यक्रम को उत्तेजित करता है, पत्ती ब्लेड से अन्य अंगों में कार्बोहाइड्रेट के बहिर्वाह को बढ़ाता है, साथ ही साथ शर्करा का संश्लेषण भी करता है।
पोटेशियम फल और सब्जी फसलों में मोनोसेकेराइड के संचय को बढ़ाता है, रूट फसलों में चीनी सामग्री को बढ़ाता है, आलू में स्टार्च, अनाज की फसलों के तने की सेल की दीवारों को मोटा करता है और रोटी के प्रतिरोध को बढ़ाता है, और सन और सन में फाइबर की गुणवत्ता में सुधार करता है।
पादप कोशिकाओं में कार्बोहाइड्रेट के संचय में योगदान करते हुए, पोटेशियम सेल रस के आसमाटिक दबाव को बढ़ाता है और जिससे पौधों की ठंड प्रतिरोध और ठंढ प्रतिरोध बढ़ जाता है।
पोटेशियम को पौधों द्वारा पिंजरों के रूप में अवशोषित किया जाता है और, जाहिर है, कोशिकाओं में इस रूप में रहता है, सबसे महत्वपूर्ण जैव रासायनिक को सक्रिय करता है प्रक्रियाओं पौधों की कोशिकाओं में, पोटेशियम बढ़ते मौसम के दौरान और बाद की फसल में, विभिन्न रोगों के लिए उनके प्रतिरोध को बढ़ाता है, फल और सब्जियों की गुणवत्ता को बनाए रखने में काफी सुधार करता है।
पोटेशियम की कमी से पौधों में कई चयापचय संबंधी विकार हो जाते हैं, कई एंजाइमों की गतिविधि कमजोर हो जाती है, कार्बोहाइड्रेट और प्रोटीन चयापचय परेशान होते हैं, और लागत सांस लेने के लिए कार्बोहाइड्रेट। नतीजतन, पौधे की उत्पादकता घट जाती है, उत्पाद की गुणवत्ता कम हो जाती है।



रूबिडीयाम
रुबिडियम पहले समूह के मुख्य उपसमूह का एक तत्व है, डी। दिमित्री इवानोविच मेंडेलीव के रासायनिक तत्वों की आवधिक प्रणाली की पांचवीं अवधि, परमाणु संख्या 37 के साथ। यह प्रतीक आरबी (लाट। रुबिडियम) द्वारा नामित है। सरल पदार्थ रूबिडियम (सीएएस संख्या: 7440-17-7) है - चांदी-सफेद रंग का एक नरम क्षारीय धातु।
1861 में, जर्मन वैज्ञानिकों रॉबर्ट विल्हेम बन्सेन और गुस्ताव रॉबर्ट किर्चॉफ ने वर्णक्रमीय विश्लेषण का उपयोग करते हुए प्राकृतिक एलुमिनोसिलाइकेट्स का अध्ययन किया, उनमें एक नए तत्व की खोज की, जिसे बाद में स्पेक्ट्रम की सबसे मजबूत लाइनों के रंग से रूबिडियम कहा जाता है।
रूबिडियम में सिल्वर-सफ़ेद नरम क्रिस्टल होते हैं जो एक ताजा कट पर एक धातु की चमक रखते हैं। बैंगन कठोरता 0.2 Mn / mІ (0.02 kgf / mm2)। रुबिडियम क्रिस्टल जाली घन-केंद्रित है, और \u003d 5.71 lat (कमरे के तापमान पर)। परमाणु त्रिज्या 2.48 E है, आयन का त्रिज्या Rb + 1.49 E. है। घनत्व 1.525 g / cm2 (0 ° C), MP 38.9 ° C, MP 703 ° C है। विशिष्ट गर्मी 335.2 j / (kg · K) है, रैखिक विस्तार का थर्मल गुणांक 9.0 · 10-5 डिग्री -1 (0-38 ° С) है, लोचदार मापांक 2.4 GN / m² (240 kgf / mm²) है, विशिष्ट मात्रा विद्युत प्रतिरोधकता 11.29 · 10-6 ओम · सेमी (20 डिग्री सेल्सियस); रुबिडियम पैरामैग्नेटिक है।
क्षारीय धातु, हवा में बेहद अस्थिर (इग्निशन के साथ पानी के निशान की उपस्थिति में हवा के साथ प्रतिक्रिया करता है)। यह सभी प्रकार के लवण बनाता है - ज्यादातर घुलनशील (क्लोरेट्स और पर्क्लोरेट्स थोड़ा घुलनशील)। रुबिडियम हाइड्रॉक्साइड ग्लास और अन्य संरचनात्मक और कंटेनर सामग्री के लिए एक बहुत ही आक्रामक पदार्थ है, और पिघला हुआ अधिकांश धातुओं (यहां तक \u200b\u200bकि प्लैटिनम) को नष्ट कर देता है।
रुबिडियम का उपयोग विविधतापूर्ण है और, इस तथ्य के बावजूद कि आवेदन के कई क्षेत्रों में यह अपनी सबसे महत्वपूर्ण शारीरिक विशेषताओं में सीज़ियम से नीच है, फिर भी, यह दुर्लभ क्षार धातु आधुनिक प्रौद्योगिकियों में एक महत्वपूर्ण भूमिका निभाता है। रुबिडियम के निम्नलिखित अनुप्रयोगों पर ध्यान दिया जा सकता है: कटैलिसीस, इलेक्ट्रॉनिक उद्योग, विशेष प्रकाशिकी, परमाणु, चिकित्सा।
रुबिडियम का उपयोग न केवल अपने शुद्ध रूप में किया जाता है, बल्कि कई मिश्र धातुओं और रासायनिक यौगिकों के रूप में भी किया जाता है। यह ध्यान रखना महत्वपूर्ण है कि रुबिडियम का एक बहुत अच्छा और अनुकूल कच्चा माल आधार है, लेकिन संसाधनों की उपलब्धता के साथ स्थिति सीज़ियम के मामले में की तुलना में बहुत अधिक अनुकूल है और रूबिडियम एक और भी महत्वपूर्ण भूमिका ले सकता है, उदाहरण के लिए, कटैलिसीस में (जहां यह खुद को सफलतापूर्वक साबित कर चुका है)।
रुबिडियम -86 आइसोटोप का व्यापक रूप से गामा-किरण निरीक्षण, मापने के उपकरण और साथ ही कई महत्वपूर्ण दवाओं और खाद्य उत्पादों के नसबंदी में उपयोग किया जाता है। सीज़ियम के साथ रुबिडियम और इसके मिश्र उच्च तापमान वाले टरबाइन इकाइयों के लिए एक बहुत ही आशाजनक शीतलक और काम करने का माध्यम हैं (इस संबंध में, हाल के वर्षों में रुबिडियम और सीज़ियम महत्वपूर्ण हो गए हैं, और टरबाइन इकाइयों की दक्षता में वृद्धि करने की संभावनाओं के संबंध में पृष्ठभूमि के लिए धातुओं की अत्यधिक उच्च लागत को वापस ले लिया गया है, जिसका अर्थ है) और कम है खर्चों ईंधन और पर्यावरण प्रदूषण)। गर्मी वाहक के रूप में सबसे व्यापक रूप से इस्तेमाल किया जाने वाला रुबिडियम-आधारित सिस्टम टेरानरी मिश्र हैं: सोडियम-पोटेशियम-रूबिडियम और सोडियम-रूबिडियम-सीज़ियम।
कटैलिसीस में, रूबिडियम का उपयोग कार्बनिक और अकार्बनिक संश्लेषण दोनों में किया जाता है। रुबिडियम की उत्प्रेरक गतिविधि का उपयोग मुख्य रूप से कई महत्वपूर्ण उत्पादों के शोधन के लिए किया जाता है। उदाहरण के लिए, रुबिडियम एसीटेट का उपयोग मेथनॉल और पानी गैस से उच्चतर अल्कोहल को संश्लेषित करने के लिए किया जाता है, जो बदले में कोयले के भूमिगत गैसीकरण और कारों और जेट जैल के लिए कृत्रिम तरल ईंधन के उत्पादन के संबंध में अत्यंत महत्वपूर्ण है। टेल्यूरियम के साथ रुबिडियम के कई मिश्र धातुओं में स्पेक्ट्रम की पराबैंगनी क्षेत्र में उच्च संवेदनशीलता होती है, और इस संबंध में, यह इस मामले में फोटोकॉपी करने वालों के लिए एक सामग्री के रूप में सीज़ियम -133 के साथ प्रतिस्पर्धा करने में सक्षम है। विशेष स्नेहन रचनाओं (मिश्र) के हिस्से के रूप में, रूबिडियम का उपयोग वैक्यूम (रॉकेट और अंतरिक्ष प्रौद्योगिकी) में एक अत्यधिक प्रभावी स्नेहक के रूप में किया जाता है।
रुबिडियम हाइड्रॉक्साइड का उपयोग निम्न-तापमान ChIT के लिए इलेक्ट्रोलाइट की तैयारी के लिए किया जाता है, साथ ही साथ पोटेशियम हाइड्रॉक्साइड के घोल में एक एडिटिव को कम तापमान पर इसके प्रदर्शन को बेहतर बनाने और इलेक्ट्रोलाइट चालकता को बढ़ाने के लिए उपयोग किया जाता है। हाइड्राइड ईंधन कोशिकाओं में, धातु रूबिडियम का उपयोग किया जाता है।
कप्रम क्लोराइड के साथ एक मिश्र धातु में रुबिडियम क्लोराइड का उपयोग उच्च तापमान (400 डिग्री सेल्सियस तक) को मापने के लिए किया जाता है।
रुबिडियम प्लाज्मा का उपयोग लेजर विकिरण को उत्तेजित करने के लिए किया जाता है।
रुबिडियम क्लोराइड का उपयोग ईंधन कोशिकाओं में इलेक्ट्रोलाइट के रूप में किया जाता है, रूबिडियम हाइड्रोक्साइड के लिए भी यही कहा जा सकता है, जो प्रत्यक्ष कोयला ऑक्सीकरण का उपयोग करके ईंधन कोशिकाओं में इलेक्ट्रोलाइट के रूप में बहुत प्रभावी है।
सीज़ियम
सीज़ियम पहले समूह के मुख्य उपसमूह का एक तत्व है, डी। मेंडेलीव दिमित्री इवानोविच के रासायनिक तत्वों की आवधिक प्रणाली की छठी अवधि, परमाणु संख्या 55 के साथ। यह प्रतीक Cs (lat। सीज़ियम) द्वारा नामित है। सरल पदार्थ सीज़ियम है (CAS संख्या: 7440-46-2) - चांदी-पीले रंग का एक नरम क्षारीय धातु। सीज़ियम को उत्सर्जन स्पेक्ट्रम में दो उज्ज्वल नीली रेखाओं की उपस्थिति के लिए इसका नाम मिला (लेट। कैसियस - आकाश नीला)।
1860 में जर्मनी के वैज्ञानिकों आर.वी. बनसेन और जी.आर. किर्चॉफ द्वारा ऑप्टिकल स्पेक्ट्रोस्कोपी द्वारा Dürhheim खनिज वसंत के पानी में सीज़ियम की खोज की गई थी, जिससे वर्णक्रमीय विश्लेषण द्वारा खोजा गया पहला तत्व बन गया। अपने शुद्ध रूप में, सीज़ियम साइनाइड (CsCN) और बेरियम के मिश्रण के पिघल के इलेक्ट्रोलिसिस के दौरान स्वीडिश रसायनज्ञ के। सेटरबर्ग द्वारा 1882 में सीज़ियम को पहली बार अलग किया गया था।
मुख्य सीज़ियम खनिज प्रदूषित और बहुत ही दुर्लभ एवोगैड्राइट (K, Cs) हैं। इसके अलावा, अशुद्धियों के रूप में, सीमियम को एलुमिनोसिलिकेट्स की एक संख्या में शामिल किया जाता है: लेपिडोलाइट, फ़्लोगोपाइट, बायोटाइट, अमेज़ॅनाइट, पेटलाइट, बेरिल, सिनवेल्डाइट, ल्यूसाइट, कार्नलाइट। पॉल्यूसाइट और लेपिडोलाइट का उपयोग औद्योगिक कच्चे माल के रूप में किया जाता है।
यौगिकों के रूप में सीज़ियम के औद्योगिक उत्पादन में खनिज प्रदूषक से निकाला जाता है। यह क्लोराइड या सल्फेट खोलने के द्वारा किया जाता है। पहले में गर्म हाइड्रोक्लोरिक एसिड के साथ शुरुआती खनिज का इलाज करना शामिल है, जिसमें SbCl3 एंटीमनी क्लोराइड जोड़कर Cs3 यौगिक को उपजी किया जाता है, और CsCl सीज़ियम क्लोराइड बनाने के लिए गर्म पानी या अमोनिया घोल से धोया जाता है। दूसरे मामले में, इसे गर्म सल्फ्यूरिक एसिड के साथ CsAl (SO4) 2 · 12H2O फिटकिरी सीज़ियम फिटकरी के साथ किया जाता है।
रूसी संघ में, यूएसएसआर के पतन के बाद, अर्ध-ल्यूसाइट का औद्योगिक उत्पादन नहीं किया गया था, हालांकि सोवियत काल में मुरामनस्क के पास वोरोनोई टुंड्रा में भारी खनिज भंडार की खोज की गई थी। जब तक रूसी उद्योग अपने पैरों पर चलने में सक्षम था, तब तक यह पता चला कि कनाडाई लाइसेंस ने इस क्षेत्र को विकसित करने के लिए लाइसेंस प्राप्त कर लिया था। वर्तमान में, ज़ूओ दुर्लभ धातु संयंत्र में नोवोसिबिर्स्क में प्रदूषित से सीज़ियम लवण का प्रसंस्करण और निष्कर्षण किया जाता है।
सीज़ियम के उत्पादन के लिए कई प्रयोगशाला विधियाँ हैं। इसे प्राप्त किया जा सकता है:
वैक्यूम में हीटिंग जिरकोनियम के साथ क्रोमियम या सीज़ियम डाइक्रोमेट का मिश्रण;
वैक्यूम में सीज़ियम एजाइड का अपघटन;
सीज़ियम क्लोराइड और विशेष रूप से तैयार कैल्शियम का मिश्रण गर्म करना।
सभी तरीके समय लेने वाले हैं। दूसरा आपको उच्च शुद्धता वाली धातु प्राप्त करने की अनुमति देता है, लेकिन यह विस्फोटक है और कई दिनों तक कार्यान्वयन की आवश्यकता होती है।
सीज़ियम को केवल 20 वीं शताब्दी की शुरुआत में आवेदन मिला, जब इसके खनिजों की खोज की गई और इसे शुद्ध रूप में उत्पादन करने की तकनीक विकसित की गई। वर्तमान में, सीज़ियम और इसके यौगिकों का उपयोग इलेक्ट्रॉनिक्स, रेडियो, इलेक्ट्रो, एक्स-रे, रासायनिक उद्योग, प्रकाशिकी, चिकित्सा, परमाणु ऊर्जा में किया जाता है। परमाणु ऊर्जा संयंत्रों के रिएक्टरों में यूरेनियम, प्लूटोनियम, थोरियम के विखंडन के योग से निकाले जाने वाले ज्यादातर स्थिर प्राकृतिक सीज़ियम -133 का उपयोग किया जाता है, और एक सीमित सीमा तक, इसका रेडियोधर्मी आइसोटोप सीज़ियम -137।
क्षारीय पृथ्वी धातु
क्षारीय पृथ्वी धातुएं रासायनिक तत्व हैं: कैल्शियम सीए, स्ट्रोंटियम सीन, बेरियम बा, रेडियम रा (कभी-कभी बेरिलियम बी और मैग्नीशियम एमजी को भी गलती से क्षारीय पृथ्वी धातुओं के रूप में संदर्भित किया जाता है)। उनका नाम इसलिए रखा गया है क्योंकि उनके ऑक्साइड - "पृथ्वी" (रसायनविदों की शब्दावली में) - पानी के लिए एक क्षारीय प्रतिक्रिया प्रदान करते हैं। रेडियम को छोड़कर क्षारीय पृथ्वी धातुओं के लवण, खनिज के रूप में व्यापक रूप से प्रकृति में वितरित किए जाते हैं।
कैल्शियम
कैल्शियम दूसरे समूह के मुख्य उपसमूह का एक तत्व है, डीआई दिमित्री इवानोविच मेंडेलीव के रासायनिक तत्वों की आवधिक प्रणाली की चौथी अवधि, परमाणु संख्या 20 के साथ। यह प्रतीक सीए (लाट। कैल्शियम) द्वारा निर्दिष्ट है। सरल कैल्शियम पदार्थ (CAS संख्या: 7440-70-2) चांदी-सफेद रंग की एक नरम, रासायनिक रूप से सक्रिय क्षारीय पृथ्वी धातु है।
कैल्शियम धातु दो एलोट्रोपिक संशोधनों में मौजूद है। 443 ° C तक, α-Ca घन-चेहरा-केंद्रित जाली (पैरामीटर a \u003d 0.558 एनएम) के साथ स्थिर है, β-Ca α-Fe प्रकार के घन-शरीर-केंद्रित जाली (पैरामीटर a \u003d 0.448 एनएम) के साथ स्थिर है। Α → is संक्रमण का मानक थैलेपी ΔH0 0.93 kJ / मोल है।
कैल्शियम एक विशिष्ट क्षारीय पृथ्वी धातु है। कैल्शियम की प्रतिक्रियाशीलता उच्च है, लेकिन अन्य सभी क्षारीय पृथ्वी धातुओं की तुलना में कम है। यह आसानी से ऑक्सीजन, कार्बन डाइऑक्साइड और हवा की नमी के साथ बातचीत करता है, यही कारण है कि कैल्शियम धातु की सतह आमतौर पर सुस्त ग्रे होती है, इसलिए कैल्शियम आमतौर पर अन्य क्षारीय पृथ्वी धातुओं की तरह एक प्रयोगशाला में संग्रहीत किया जाता है, कसोसीन या तरल पैराफिन की एक परत के नीचे कसकर बंद जार में।
मानक क्षमता के बीच, कैल्शियम हाइड्रोजन के बाईं ओर स्थित है। Ca2 + / Ca0 की एक जोड़ी की मानक इलेक्ट्रोड क्षमता 2.84 V है, जिससे कैल्शियम सक्रिय रूप से पानी के साथ प्रतिक्रिया करता है, लेकिन बिना प्रज्वलन के:
सीए + 2 एच 2 ओ \u003d सीए (ओएच) 2 + एच 2+ क्यू।
सक्रिय गैर-धातुओं (ऑक्सीजन, क्लोरीन, ब्रोमिन) के साथ, कैल्शियम सामान्य परिस्थितियों में प्रतिक्रिया करता है:
2Ca + O2 \u003d 2CaO, Ca + Br2 \u003d CaBr2।
जब हवा में या ऑक्सीजन में गरम किया जाता है, तो कैल्शियम प्रज्वलित होता है। कम सक्रिय गैर-धातुओं (हाइड्रोजन, बोरान, कार्बन, सिलिकॉन, नाइट्रोजन, फास्फोरस और अन्य) के साथ, कैल्शियम गर्म होने पर बातचीत करता है, उदाहरण के लिए:
सीए + एच २ \u003d सीएएच २, सीए + ६ बी \u003d सीएबी ६,
3C + N2 \u003d Ca3N2, Ca + 2C \u003d CaC2,
3Ca + 2P \u003d Ca3P2 (कैल्शियम फॉस्फाइड); कैल्शियम की फॉस्फाइड रचना CaP और CaP5 भी ज्ञात हैं;
2Ca + Si \u003d Ca2Si (कैल्शियम साइलिसिस), कैल्शियम की रचनाओं CaSi, Ca3Si4 और CaS2 2 को भी जाना जाता है।
उपरोक्त प्रतिक्रियाओं का कोर्स आमतौर पर बड़ी मात्रा में गर्मी की रिहाई के साथ होता है (यानी, ये प्रतिक्रियाएं एक्ज़ोथिर्मिक हैं)। गैर-धातुओं के साथ सभी यौगिकों में, कैल्शियम का ऑक्सीकरण राज्य +2 है। गैर-धातुओं के साथ कैल्शियम यौगिकों के अधिकांश आसानी से पानी से विघटित होते हैं, उदाहरण के लिए:
सीएएच 2 + 2 एच 2 ओ \u003d सीए (ओएच) 2 + 2 एच 2,
Ca3N2 + 3H2O \u003d 3Ca (OH) 2 + 2NH3।
सीए 2 + आयन रंगहीन है। जब घुलनशील कैल्शियम लवण को लौ में पेश किया जाता है, तो लौ ईंट की लाल हो जाती है।
कैल्शियम लवण जैसे कि सीएएल 2 क्लोराइड, सीएबीआर 2 ब्रोमाइड, सीएआई 2 आयोडाइड और सीए (एनओ 3) 2 नाइट्रेट पानी में आसानी से घुलनशील होते हैं। पानी में अघुलनशील CaF2 फ्लोराइड, CaCO3 कार्बोनेट, CaSO4 सल्फेट, Ca3 (PO4) 2 ऑर्थोफोस्फेट, CaC2O4 ऑक्सालेट और कुछ अन्य हैं।
महत्वपूर्ण तथ्य यह है कि, कैल्शियम कार्बोनेट CaCO3 के विपरीत, अम्लीय कैल्शियम कार्बोनेट (बाइकार्बोनेट) Ca (HCO3) 2 पानी में घुलनशील है। प्रकृति में, यह निम्नलिखित प्रक्रियाओं की ओर जाता है। जब ठंडी बारिश या नदी का पानी, कार्बन डाइऑक्साइड से संतृप्त होता है, भूमिगत में प्रवेश करता है और अंगों में प्रवेश करता है, तो उनका विघटन देखा जाता है:
CaCO3 + CO2 + H2O \u003d Ca (HCO3) 2।
उन्हीं स्थानों पर जहाँ पानी में कैल्शियम बाइकार्बोनेट से संतृप्त पानी पृथ्वी की सतह पर आता है और सूर्य द्वारा गर्म किया जाता है, उल्टे प्रवाह की जगह देता है:
Ca (HCO3) 2 \u003d CaCO3 + CO2 + H2O।
इसलिए प्रकृति में पदार्थों के बड़े द्रव्यमान का स्थानांतरण होता है। नतीजतन, विशाल अंतराल भूमिगत, और सुंदर पत्थर "आइकल्स" बना सकते हैं - स्टैलेक्टाइट्स और स्टैलेग्माइट्स - गुफाओं में रूप।
पानी में भंग कैल्शियम बाइकार्बोनेट की उपस्थिति काफी हद तक पानी की अस्थायी कठोरता को निर्धारित करती है। इसे अस्थायी कहा जाता है क्योंकि जब पानी को उबाला जाता है, तो हाइड्रोकार्बोनेट विघटित हो जाता है और CaCO3 अवक्षेपित हो जाता है। यह घटना, उदाहरण के लिए, समय के साथ केतली में पैमाने के गठन की ओर ले जाती है।
स्ट्रोंटियम
स्ट्रोंटियम - दूसरे समूह के मुख्य उपसमूह का एक तत्व, रासायनिक तत्वों की आवधिक प्रणाली की पांचवीं अवधि डी। मेंडेलीव दिमित्री इवानोविच, परमाणु संख्या 38 के साथ। यह प्रतीक Sr (lat। स्ट्रोंटियम) द्वारा नामित है। स्ट्रोंटियम का सरल पदार्थ (CAS संख्या: 7440-24-6) चांदी-सफेद रंग की एक नरम, निंदनीय और नमनीय क्षारीय पृथ्वी धातु है। यह उच्च रासायनिक गतिविधि है, जल्दी से हवा में नमी और ऑक्सीजन के साथ प्रतिक्रिया करता है, एक पीले ऑक्साइड फिल्म के साथ कवर किया जाता है।
खनिज स्ट्रोंटियनाइट में एक नया तत्व पाया गया था, 1764 में एक प्रमुख खदान में स्ट्रॉन्शियन के स्कॉटिश गांव के पास पाया गया, जिसने बाद में नए तत्व को नाम दिया। इस खनिज में नए धातु ऑक्साइड की उपस्थिति लगभग 30 साल बाद विलियम क्रुकशेंक और एडर क्रॉफोर्ड द्वारा स्थापित की गई थी। 1808 में सर हम्फ्री डेवी द्वारा शुद्ध रूप में आवंटित।
स्ट्रोंटियम - एक नरम चांदी-सफेद धातु, जिसमें लचीलापन और नमनीयता होती है, आसानी से चाकू से काटा जाता है।
बहुरूपी - इसके तीन संशोधन ज्ञात हैं। 215 ° C तक, घन चेहरा केंद्रित संशोधन (α-Sr) स्थिर होता है, जो 215 और 605 ° C - हेक्सागोनल (β-Sr) के बीच होता है, 605 ° C से ऊपर - घन मात्रा-केंद्रित संशोधन (γ-Sr)।
गलनांक - 768 ° C, क्वथनांक - 1390 ° C
स्ट्रोंटियम हमेशा अपने यौगिकों में एक +2 वैधता प्रदर्शित करता है। इसके गुणों से, स्ट्रोंटियम कैल्शियम और बेरियम के करीब है, उनके बीच एक मध्यवर्ती स्थिति पर कब्जा कर रहा है।
तनावों की विद्युत श्रृंखला में, स्ट्रोंटियम सबसे सक्रिय धातुओं में से एक है (इसकी सामान्य इलेक्ट्रोड क्षमता −2.89 वी है। हाइड्रॉक्साइड बनाने के लिए पानी के साथ ऊर्जावान रूप से प्रतिक्रिया करता है:
सीन + 2 एच 2 ओ \u003d सीनियर (ओएच) 2 + एच 2
यह एसिड के साथ बातचीत करता है, अपने लवण से भारी धातुओं को विस्थापित करता है। केंद्रित एसिड (H2SO4, HNO3) के साथ यह कमजोर रूप से प्रतिक्रिया करता है।
धातु स्ट्रोंटियम जल्दी से हवा में ऑक्सीकरण करता है, जिसमें एक पीले रंग की फिल्म बनती है, जिसमें SrO ऑक्साइड के अलावा, SrO2 पेरोक्साइड और Sr3N2 नाइट्राइड हमेशा मौजूद होते हैं। जब हवा में गरम किया जाता है, तो यह प्रज्वलित होता है, हवा में पाउडर स्ट्रोंटियम आत्म-प्रज्वलन के लिए प्रवण होता है।
गैर-धातुओं के साथ सख्ती से प्रतिक्रिया करता है - सल्फर, फास्फोरस, हैलोजेन। यह हाइड्रोजन (200 डिग्री सेल्सियस से ऊपर), नाइट्रोजन (400 डिग्री सेल्सियस से ऊपर) के साथ इंटरैक्ट करता है। व्यावहारिक रूप से क्षार के साथ प्रतिक्रिया नहीं करता है।
उच्च तापमान पर, कार्बाइड बनाने के लिए CO2 के साथ प्रतिक्रिया करता है:
5Sr + 2CO2 \u003d SrC2 + 4SrO
आयनों के साथ थोड़ा घुलनशील स्ट्रॉन्शियम लवण Cl-, I-, NO3-। आयनों एफ-, SO42-, CO32-, PO43- के साथ लवण थोड़ा घुलनशील हैं।
स्ट्रॉन्शियम का उपयोग एल्युमिनियम कपग्राम और उसके कुछ मिश्र धातुओं के लिए किया जाता है, जो बैटरी की लीड मिश्र धातुओं में डालने के लिए, कच्चा लोहा, कप्रम और के डिसल्फराइजेशन के लिए किया जाता है। स्टील्स.
बेरियम
बेरियम दूसरे समूह के मुख्य उपसमूह का एक तत्व है, डीआई दिमित्री इवानोविच मेंडेलीव के रासायनिक तत्वों की आवधिक प्रणाली की छठी अवधि, परमाणु संख्या 56 के साथ। यह प्रतीक बा (लाट बेरियम) द्वारा नामित है। सरल पदार्थ बेरियम (CAS संख्या: 7440-39-3) है - चांदी-सफेद रंग की एक नरम, निंदनीय क्षारीय पृथ्वी धातु। इसकी एक उच्च रासायनिक गतिविधि है।
बेरियम को 1774 में कार्ल स्कील द्वारा बाओ ऑक्साइड के रूप में खोजा गया था। 1808 में, अंग्रेजी रसायनज्ञ हम्फ्री डेवी को पारा क्रोड के साथ गीला बेरियम हाइड्रॉक्साइड के इलेक्ट्रोलिसिस द्वारा प्राप्त किया गया था मिश्रण बेरियम; पारा के वाष्पीकरण के बाद, उन्होंने गर्म होने पर धातु बेरियम को अलग कर दिया।
बेरियम एक चांदी-सफेद निंदनीय धातु है। जब तेज झटका लगता है। बेरियम के दो एलोट्रोपिक संशोधन हैं: 375 ° C तक, α-Ba एक घन-शरीर-केंद्रित जाली (पैरामीटर a \u003d 0.501 एनएम) के साथ स्थिर है; उच्च, β-Ba स्थिर है।
1.25 के एक खनिज पैमाने पर कठोरता; मोह पैमाने 2 पर।
धातु बेरियम को मिट्टी के तेल में या पैराफिन की एक परत के नीचे संग्रहित किया जाता है।
बेरियम एक क्षारीय पृथ्वी धातु है। यह बेरियम ऑक्साइड BaO और बेरियम नाइट्राइड Ba3N2 के गठन के साथ हवा में गहन ऑक्सीकरण होता है, और मामूली हीटिंग के साथ प्रज्वलित होता है। बेरियम हाइड्रॉक्साइड बा (OH) 2 बनाने के लिए पानी के साथ सख्ती से प्रतिक्रिया करता है:
बा + २ एच २ ओ \u003d बा (ओएच) २ + एच २
सक्रिय रूप से तनु अम्लों के साथ संपर्क करता है। कई बेरियम लवण पानी में अघुलनशील या थोड़ा घुलनशील हैं: बेरियम सल्फेट BaSO4, बेरियम सल्फाइट BaSO3, बेरियम कार्बोनेट BaCO3, बेरियम फॉस्फेट Ba3 (PO4) 2। कैल्शियम सल्फाइड CaS के विपरीत बेरियम सल्फाइड BaS, पानी में अत्यधिक घुलनशील है।
यह हलोजन बनाने के लिए हैलोजेन के साथ आसानी से प्रतिक्रिया करता है।
हाइड्रोजन के साथ गर्म होने पर, यह बेरियम हाइड्राइड BaH2 बनाता है, जो लिथियम हाइड्राइड LiH के साथ मिलकर Li को जटिल बनाता है।
अमोनिया के साथ गर्म होने पर प्रतिक्रियाएं:
6Ba + 2NH3 \u003d 3BH2 + Ba3N2
बेरियम नाइट्राइड Ba3N2, जब गर्म होता है, सीओ के साथ बातचीत करता है, सायनाइड बनाता है:
Ba3N2 + 2CO \u003d Ba (CN) 2 + 2BOO
तरल अमोनिया के साथ, यह एक गहरा नीला घोल देता है जिससे अमोनिया को अलग किया जा सकता है, जिसमें एक सुनहरी शीन है और एनएच 3 को हटाने के साथ आसानी से विघटित हो जाती है। एक प्लैटिनम उत्प्रेरक की उपस्थिति में, अमोनिया का बेरियम एमाइड बनने के लिए विघटित होता है:
बा (NH2) 2 + 4NH3 + H2
बेरियम कार्बाइड BaC2 को बाओ कोयला भट्टी में गर्म करके प्राप्त किया जा सकता है।
यह फास्फोरस के साथ फास्फोरस Ba3P2 बनाता है।
बेरियम कई धातुओं के ऑक्साइड, हलाइड और सल्फाइड को घटाकर संबंधित धातु को बनाता है।
बेरियम धातु, अक्सर एल्यूमीनियम के साथ मिश्र धातु में, उच्च-वैक्यूम इलेक्ट्रॉनिक उपकरणों में एक गेटर (गटर) के रूप में उपयोग किया जाता है, और पाइपलाइनों के लिए आक्रामकता को कम करने के लिए तरल धातु शीतलक (सोडियम, पोटेशियम, रूबिडियम, लिथियम, सीज़ियम मिश्र धातुओं) के साथ ज़िरकोनियम के साथ भी जोड़ा जाता है। धातु विज्ञान।
संक्रमण धातु
संक्रमण धातुएं (संक्रमण तत्व) डी। आई। मेंडेलीव दिमित्री इवानोविच के रासायनिक तत्वों की आवर्त सारणी के साइड उपसमूहों के तत्व हैं, जिनके परमाणुओं में डी और एफ-ऑर्बिटल्स पर इलेक्ट्रॉन दिखाई देते हैं। सामान्य शब्दों में, संक्रमण तत्वों की इलेक्ट्रॉनिक संरचना को निम्नानुसार दर्शाया जा सकता है:। Ns ऑर्बिटल्स में एक या दो इलेक्ट्रॉन होते हैं, शेष वैलेंस इलेक्ट्रॉन ऑर्बिटल्स पर स्थित होते हैं। चूंकि वैलेंस इलेक्ट्रॉनों की संख्या कक्षाओं की संख्या से काफी कम है, इसलिए संक्रमण तत्वों द्वारा गठित सरल पदार्थ धातु हैं।
संक्रमण तत्वों की सामान्य विशेषताएं
सभी संक्रमण तत्वों में निम्नलिखित सामान्य गुण हैं:
इलेक्ट्रोनगेटिविटी के छोटे मूल्य।
चर ऑक्सीकरण राज्यों। लगभग सभी डी-तत्वों के लिए, जिन परमाणुओं में बाहरी ns-sublevel पर 2 वैलेंस इलेक्ट्रॉन हैं, ऑक्सीकरण स्थिति +2 ज्ञात है।
डी। आई। दिमित्री इवानोविच मेंडेलीव के रासायनिक तत्वों की आवर्त सारणी के समूह III के डी-तत्वों से शुरू होकर, निम्न ऑक्सीकरण राज्य रूपों में तत्व जो मूल गुणों को प्रदर्शित करते हैं, मध्यवर्ती - एम्फ़ोटेरिक में उच्चतम अम्लीय।
लोहा
आयरन, डी। मेंडेलीव दिमित्री इवानोविच के रासायनिक तत्वों की आवधिक प्रणाली के चौथे काल के आठवें समूह के एक साइड सबग्रुप का एक तत्व है, परमाणु संख्या 26। यह प्रतीक Fe (lat। Ferrum) द्वारा नामित है। पृथ्वी की पपड़ी में सबसे आम धातुओं में से एक (एल्यूमीनियम के बाद दूसरा स्थान)।
सरल पदार्थ लोहा (CAS संख्या: 7439-89-6) एक चांदी-सफेद निंदनीय धातु है जिसमें एक उच्च रासायनिक प्रतिक्रिया होती है: लोहे का तापमान तेजी से उच्च तापमान पर या हवा में उच्च आर्द्रता पर होता है। शुद्ध ऑक्सीजन में, लोहा जलता है, और एक सूक्ष्म रूप से बिखरे हुए राज्य में यह अनायास हवा में प्रज्वलित होता है।
वास्तव में, लोहे को आमतौर पर अशुद्धियों की एक कम सामग्री (0.8% तक) के साथ अपने मिश्र धातु कहा जाता है, जो शुद्ध धातु की कोमलता और लचीलापन बनाए रखता है। लेकिन व्यवहार में, कार्बन के साथ लोहे के मिश्र धातुओं का उपयोग अधिक बार किया जाता है: (2% कार्बन तक) और (2% से अधिक कार्बन), साथ ही साथ धातु मिश्र धातु (क्रोमियम, मैंगनीज, नी, आदि) के साथ स्टेनलेस (मिश्र धातु) स्टील। लोहे और इसके मिश्र धातुओं के विशिष्ट गुणों का संयोजन इसे मनुष्यों के लिए "धातु नंबर 1" बनाता है।
प्रकृति में, लोहे शायद ही कभी अपने शुद्ध रूप में पाया जाता है, ज्यादातर यह लोहे-निकल उल्कापिंडों में पाया जाता है। पृथ्वी की पपड़ी में लोहे की व्यापकता 4.65% (O, Si, Al के बाद 4 वाँ स्थान) है। यह भी माना जाता है कि लोहा पृथ्वी के कोर का एक बड़ा हिस्सा बनाता है।




लोहा एक विशिष्ट धातु है, इसकी मुक्त अवस्था में यह एक ग्रे रंग के साथ चांदी-सफेद है। शुद्ध धातु प्लास्टिक है, विभिन्न अशुद्धियाँ (विशेष रूप से कार्बन में) इसकी कठोरता और भंगुरता को बढ़ाती हैं। इसने चुंबकीय गुणों का उच्चारण किया है। अक्सर तथाकथित "लोहे का त्रय" उत्सर्जित करते हैं - तीन धातुओं का एक समूह (लौह Fe, कोबाल्ट सह) नी नी), जिसमें समान भौतिक गुण, परमाणु रेडियो, और वैद्युतीयऋणात्मकता के मूल्य हैं।
लोहे को बहुरूपता की विशेषता है, इसमें चार क्रिस्टलीय संशोधन हैं:
769 ° C तक, α-Fe (फेराइट) एक शरीर-केंद्रित घन जाली और एक फेरोमैग्नेट के गुणों के साथ मौजूद है (769 ° C 43 1043 K - लोहे के लिए क्यूरी बिंदु)
तापमान रेंज में 769–917 ° C, Fe-Fe मौजूद है, जो α-Fe से केवल शरीर-केंद्रित घन जाली के मापदंडों और पैरामैगनेट के चुंबकीय गुणों में भिन्न होता है
तापमान रेंज 917–1394 ° C में, चेहरा-केंद्रित घन जाली के साथ Fe-Fe (austenite) मौजूद है।
1394 डिग्री सेल्सियस से ऊपर, δ-Fe एक वॉल्यूम-केंद्रित क्यूबिक जाली के साथ स्थिर है
धातुकर्म β-Fe को एक अलग चरण के रूप में अलग नहीं करता है, और इसे एक प्रकार α-Fe के रूप में मानता है। जब लोहे या स्टील को क्यूरी पॉइंट (769 ° C K 1043 K) से ऊपर गर्म किया जाता है, तो आयनों की तापीय गति इलेक्ट्रॉन स्पिन चुंबकीय क्षणों के उन्मुखीकरण को परेशान करती है, फेरोमैग्नेट पैरामैनेट हो जाता है - एक दूसरे क्रम का चरण संक्रमण होता है, लेकिन क्रिस्टल के मूल भौतिक मापदंडों में बदलाव के साथ एक प्रथम-क्रम चरण संक्रमण नहीं होता है।
सामान्य दबाव में शुद्ध लोहे के लिए, धातु विज्ञान के दृष्टिकोण से, निम्नलिखित स्थिर संशोधन मौजूद हैं:
पूर्ण शून्य से 910 ,C तक, शरीर-केंद्रित घन (bcc) क्रिस्टल जाली के साथ α-संशोधन स्थिर है। Α- लोहे में कार्बन का एक ठोस विलयन फेराइट कहलाता है।
910 से 1400 ,C तक, फेस-केंद्रित क्यूबिक (एफसीसी) क्रिस्टल जाली के साथ 00 संशोधन स्थिर है। Γ-लोहे में कार्बन के एक ठोस विलयन को ऑस्टेनाइट कहते हैं।
910 से 1539 डिग्री सेल्सियस तक, शरीर-केंद्रित घन (बीसीसी) क्रिस्टल जाली के साथ 10-संशोधन स्थिर है। Δ- लोहा (साथ ही α- लोहे में) कार्बन का एक ठोस विलयन फेराइट कहलाता है। उच्च-तापमान--फेराइट और निम्न-तापमान α-ferrite (या सिर्फ फेराइट) कभी-कभी प्रतिष्ठित होते हैं, हालांकि उनकी परमाणु संरचनाएं समान होती हैं।
स्टील में कार्बन और मिश्र धातु तत्वों की उपस्थिति चरण परिवर्तन के तापमान को महत्वपूर्ण रूप से बदल देती है।
उच्च दबाव (104 एमपीए, 100 हजार वायुमंडल से ऊपर) के क्षेत्र में, हेक्सागोनल क्लोज-पैक (एचसीपी) जाली के साथ ε-लोहे का एक संशोधन उत्पन्न होता है।
स्टील धातु विज्ञान के लिए बहुरूपता की घटना अत्यंत महत्वपूर्ण है। यह क्रिस्टल जाली के α-γ संक्रमण के लिए धन्यवाद है कि स्टील का इलाज गर्मी है। इस घटना के बिना, लोहे, स्टील के आधार के रूप में, इस तरह के व्यापक उपयोग को प्राप्त नहीं होता।
लोहा दुर्दम्य है, मध्यम गतिविधि की धातुओं को संदर्भित करता है। लोहे का गलनांक 1539 ° C है, क्वथनांक लगभग 3200 ° C है।
लोहा सबसे अधिक उपयोग की जाने वाली धातुओं में से एक है, यह विश्व धातुकर्म उत्पादन का 95% तक खाता है।
लोहा स्टील्स और कच्चा लोहा का मुख्य घटक है - सबसे महत्वपूर्ण संरचनात्मक सामग्री।
लोहा अन्य धातुओं के आधार पर मिश्र धातुओं का हिस्सा हो सकता है - उदाहरण के लिए, निकल।
चुंबकीय लौह ऑक्साइड (मैग्नेटाइट) दीर्घकालिक कंप्यूटर मेमोरी उपकरणों के उत्पादन में एक महत्वपूर्ण सामग्री है: हार्ड ड्राइव, फ्लॉपी डिस्क, आदि।
अल्ट्राफाइन मैग्नेटाइट पाउडर का उपयोग काले और सफेद लेजर प्रिंटर में टोनर के रूप में किया जाता है।
ट्रांसफार्मर और विद्युत मोटरों के चुंबकीय कोर के लिए इलेक्ट्रिकल इंजीनियरिंग में लौह-आधारित मिश्र धातुओं के अद्वितीय फेरोमैग्नेटिक गुण उनके व्यापक उपयोग में योगदान करते हैं।
आयरन (III) क्लोराइड (फेरिक क्लोराइड) का इस्तेमाल शौकिया रेडियो प्रैक्टिस में प्रिंटेड सर्किट बोर्ड को अचार बनाने में किया जाता है।
कॉपर सल्फेट के साथ मिश्रित फेरस सल्फेट (लौह सल्फेट) का उपयोग बागवानी और निर्माण में हानिकारक कवक को नियंत्रित करने के लिए किया जाता है।
आयरन का उपयोग आयरन-निकल बैटरी, आयरन-एयर बैटरी में एनोड के रूप में किया जाता है।
तांबा
कॉपर पहले समूह के एक साइड सबग्रुप का एक तत्व है, डीआई दिमित्री इवानोविच मेंडेलीव के रासायनिक तत्वों की आवधिक प्रणाली की चौथी अवधि, परमाणु संख्या 29 के साथ। यह प्रतीक Cu (lat। Cuprum) द्वारा नामित किया गया है। सरल पदार्थ तांबा (CAS संख्या: 7440-50-8) एक सुनहरे गुलाबी रंग (ऑक्साइड फिल्म की अनुपस्थिति में गुलाबी रंग) का एक प्लास्टिक संक्रमण धातु है। सी लंबे समय से आदमी द्वारा व्यापक रूप से इस्तेमाल किया गया है।



कॉपर एक सुनहरा-गुलाबी नमनीय धातु है, जो हवा में ऑक्साइड फिल्म के साथ जल्दी से लेपित होता है, जो इसे एक विशिष्ट तीव्र पीला-लाल रंग देता है। कॉपर में एक उच्च तापीय और विद्युत चालकता होती है (चांदी के बाद विद्युत चालकता में दूसरा स्थान)। इसके दो स्थिर समस्थानिक हैं - 63Cu और 65Cu, और कई रेडियोधर्मी समस्थानिक। उनमें से सबसे लंबे समय तक जीवित, 64Cu, 12.7 घंटे का आधा जीवन और विभिन्न उत्पादों के साथ दो अपघटन विकल्प हैं।
घनत्व - 8.94 * 10і किग्रा / मी
20 डिग्री सेल्सियस पर विशिष्ट गर्मी - 390 जे / किग्रा * के
20-100 ° С पर विद्युत प्रतिरोधकता - 1.78 · 10 Oh8 ओम · मी
गलनांक - 1083 ° C
उबलते बिंदु - 2600 डिग्री सेल्सियस
कई प्रकार के कपल मिश्र होते हैं: पीतल - जस्ता के साथ कप्रम का एक मिश्र धातु, - टिन के साथ कप्रम का मिश्रधातु, कप्रोनिक्ल - कपराम और निकल का मिश्रधातु, और कुछ अन्य।
जस्ता
जिंक, दूसरे समूह के एक साइड सबग्रुप का एक तत्व है, डी। मेंडेलीव दिमित्री इवानोविच के रासायनिक तत्वों की आवधिक प्रणाली की चौथी अवधि, परमाणु संख्या 30 के साथ। यह प्रतीक Zn (lat। Zumum) द्वारा निर्दिष्ट है। एक साधारण पदार्थ (CAS संख्या: 7440-66-6) सामान्य परिस्थितियों में एक नीले-सफेद रंग का एक भंगुर संक्रमण धातु है (यह हवा में फीका होता है, जिंक ऑक्साइड की एक पतली परत के साथ कवर किया जाता है)।
अपने शुद्ध रूप में, बल्कि नमनीय चांदी-सफेद धातु। इसमें हेक्सागोनल जाली है जिसका पैरामीटर a \u003d 0.26649 एनएम, c \u003d 0.49468 एनएम है। यह कमरे के तापमान पर नाजुक होता है, जब प्लेट मुड़ी हुई होती है, तो क्रिस्टलीय के घर्षण से दरार सुनाई देती है (आमतौर पर "टिन रो" से अधिक मजबूत)। 100-150 डिग्री सेल्सियस पर, जस्ता प्लास्टिक है। अशुद्धताएं, यहां तक \u200b\u200bकि मामूली भी, तेजी से जस्ता की भंगुरता को बढ़ाती हैं।
विशिष्ट उभयचर धातु। मानक इलेक्ट्रोड क्षमता -0.76 V है, जो लोहे तक की मानक क्षमता की एक श्रृंखला में स्थित है।
हवा में, जस्ता ZnO ऑक्साइड की एक पतली फिल्म के साथ लेपित है। मजबूत हीटिंग के साथ, यह एम्फ़ोटेरिक सफ़ेद ZnO ऑक्साइड के निर्माण से जलता है:
2Zn + O2 \u003d 2ZnO।
जिंक ऑक्साइड दोनों एसिड समाधानों के साथ प्रतिक्रिया करता है:
ZnO + 2HNO3 \u003d Zn (NO3) 2 + H2O
और क्षार:
ZnO + 2NaOH \u003d Na2ZnO2 + H2O,
सामान्य शुद्धता का जस्ता एसिड समाधानों के साथ सक्रिय रूप से प्रतिक्रिया करता है:
Zn + 2HCl \u003d ZnCl2 + H2,
Zn + H2SO4 (decomp।) \u003d ZnSO4 + H2
और क्षार समाधान:
Zn + 2NaOH + 2H2O \u003d Na2 + H2,
हाइड्रॉक्सीजिनेट्स का निर्माण। बहुत शुद्ध जस्ता एसिड और क्षार के समाधान के साथ प्रतिक्रिया नहीं करता है। कपराम सल्फेट समाधान CuSO4 की कुछ बूंदों को मिलाकर बातचीत शुरू होती है।
जब गरम किया जाता है, जस्ता ZnHal2 halides बनाने के लिए हलोजन के साथ प्रतिक्रिया करता है। फॉस्फोरस के साथ, जिंक फॉस्फाइड Zn3P2 और ZnP2 बनाता है। सल्फर और इसके एनालॉग्स के साथ - सेलेनियम और टेल्यूरियम - विभिन्न चेल्कोजेनाइड्स, ZnS, ZnSe, ZnSe2 और ZnTe।
हाइड्रोजन, नाइट्रोजन, कार्बन, सिलिकॉन और बोरान के साथ जस्ता सीधे प्रतिक्रिया नहीं करता है। Zn3N2 नाइट्राइड 550-600 डिग्री सेल्सियस पर अमोनिया के साथ जस्ता की प्रतिक्रिया द्वारा प्राप्त किया जाता है।
जलीय समाधानों में, जिंक आयन Zn2 + फॉर्म एक्वाकॉमप्लेक्स 2+ और 2+ बनाते हैं।
शुद्ध धातु जस्ता का उपयोग भूमिगत लीचिंग (सोना, चांदी) द्वारा खनन किए गए महान धातुओं को बहाल करने के लिए किया जाता है। इसके अलावा, जस्ता का उपयोग चांदी और सोने (तथाकथित "सिल्वर फोम") के साथ जस्ता इंटरमेटेलिक यौगिकों के रूप में कच्चे सीसे से चांदी, सोना (और अन्य धातु) निकालने के लिए किया जाता है, जो तब पारंपरिक शोधन विधियों द्वारा संसाधित होते हैं।
इसका उपयोग स्टील को जंग से बचाने के लिए किया जाता है (सतहों का गैल्वनाइजेशन यांत्रिक तनाव या धातुकरण के अधीन नहीं है - पुलों, टैंकों, धातु संरचनाओं के लिए)। इसका उपयोग रासायनिक वर्तमान स्रोतों में नकारात्मक इलेक्ट्रोड के लिए एक सामग्री के रूप में भी किया जाता है, अर्थात्, बैटरी और संचायक में, उदाहरण के लिए: मैंगनीज-जस्ता तत्व, चांदी-जस्ता बैटरी (EMF 1.85 V, 150 W · h / kg, 650 W / h) डीएमईए, कम प्रतिरोध और कोलोसल डिस्चार्ज करंट, मरकरी-जिंक तत्व (EMF 1.35 V, 135 W · h / kg, 550-650 W · h / dmі), डाइअॉॉक्सिसेलेट-पारा तत्व, आयोडीन-जिंक तत्व, कॉपर ऑक्साइड गैल्वेनिक सेल (EMF 0.7-1.6 वोल्ट, 84-127 W · h / kg, 410-570 W · h / dm_), क्रोमियम-जस्ता तत्व, जस्ता-चांदी-चांदी तत्व एनटी, निकल-जस्ता बैटरी (ईएमएफ 1.82 वोल्ट, 95-118 डब्ल्यू · एच / किग्रा, 230-295 डब्ल्यू · एच / डीएमआई), सीसा-जस्ता तत्व, जस्ता-क्लोरीन बैटरी, जस्ता-ब्रोमिन बैटरी, आदि)। जस्ता-वायु बैटरी में जस्ता की भूमिका बहुत महत्वपूर्ण है। हाल के वर्षों में, जस्ता-वायु प्रणाली के आधार पर कंप्यूटर (लैपटॉप) के लिए जस्ता-वायु - बैटरी को गहन रूप से विकसित किया गया है, और इस क्षेत्र में महत्वपूर्ण सफलता हासिल की गई है (लिथियम बैटरी से बड़ी है, क्षमता और संसाधन 3 से कम है। लागत का समय), इंजन शुरू करने के लिए भी यह प्रणाली बहुत ही आशाजनक है (लीड बैटरी - 55 डब्ल्यू · एच / किग्रा, जस्ता-वायु - 220-300 डब्ल्यू · एच / किग्रा) और इलेक्ट्रिक वाहनों के लिए (900 किमी तक का माइलेज)। कई विक्रेताओं में उनके गलनांक को कम करने के लिए शामिल किया गया। जस्ता पीतल का एक महत्वपूर्ण घटक है। जिंक ऑक्साइड व्यापक रूप से एक एंटीसेप्टिक और विरोधी भड़काऊ एजेंट के रूप में दवा में उपयोग किया जाता है। जस्ता ऑक्साइड का उपयोग पेंट - जस्ता ऑक्साइड के उत्पादन के लिए भी किया जाता है।
जस्ता क्लोराइड सोल्डरिंग धातुओं और फाइबर के निर्माण में एक घटक के लिए एक महत्वपूर्ण प्रवाह है।
टेल्यूराइड, सेलेनाइड, फॉस्फाइड, जिंक सल्फाइड व्यापक रूप से अर्धचालक होते हैं।
जस्ता सेलेनाइड का उपयोग मध्य-अवरक्त रेंज में बहुत कम अवशोषण गुणांक के साथ ऑप्टिकल ग्लास बनाने के लिए किया जाता है, उदाहरण के लिए, कार्बन डाइऑक्साइड लेज़रों में।
पारा
पारा दूसरे समूह के एक साइड सबग्रुप का एक तत्व है, डी। दिमित्री इवानोविच मेंडेलीव के रासायनिक तत्वों की आवधिक प्रणाली की छठी अवधि, परमाणु संख्या 80 के साथ। यह प्रतीक Hg (lat। Hydrargyrum) द्वारा निर्दिष्ट है। सरल पदार्थ पारा (सीएएस संख्या: 7439-97-6) एक संक्रमण धातु है, कमरे के तापमान पर यह एक भारी चांदी-सफेद, विशेष रूप से वाष्पशील तरल है, जिनमें से वाष्प बेहद विषाक्त हैं। पारा दो रासायनिक तत्वों (और एकमात्र धातु) में से एक है, जिनमें से सामान्य पदार्थ सामान्य परिस्थितियों में एकत्रीकरण की तरल अवस्था में हैं (दूसरा तत्व ब्रोमीन है)। यह प्रकृति में देशी रूप में पाया जाता है और कई खनिजों का निर्माण करता है। सबसे अधिक बार, पारा अपने सबसे सामान्य खनिज - सिनेबार से घटाकर प्राप्त किया जाता है। इसका उपयोग मापने के उपकरण, वैक्यूम पंप, प्रकाश स्रोतों और विज्ञान और प्रौद्योगिकी के अन्य क्षेत्रों में निर्माण के लिए किया जाता है।
कमरे के तापमान पर पारा एकमात्र धातु तरल है। इसमें डायमेंग्नेट के गुण होते हैं। कई धातुओं के साथ तरल मिश्र धातु amalgams। केवल लोहा, मैंगनीज और नी.
बुध एक निम्न-गतिविधि धातु है।
300 ° C तक गर्म होने पर पारा ऑक्सीजन के साथ प्रतिक्रिया करता है: 2Hg + O2 → 2HgO पारा का ऑक्साइड (II) बनता है। यह प्रतिक्रिया प्रतिवर्ती है: जब 340 डिग्री सेल्सियस से ऊपर गरम किया जाता है, तो ऑक्साइड सरल पदार्थों को विघटित करता है। पारा ऑक्साइड की अपघटन प्रतिक्रिया ऐतिहासिक रूप से ऑक्सीजन के उत्पादन के लिए पहले तरीकों में से एक रही है।
जब पारा सल्फर के साथ गर्म होता है, तो पारा (II) सल्फाइड बनता है।
पारा अम्लों के विलयनों में नहीं घुलता है, जिसमें ऑक्सीकरण गुण नहीं होते हैं, लेकिन यह एक्वा रेजिया और नाइट्रिक एसिड में घुल जाता है, जिससे घने पारे के लवण बनते हैं। जब ठंड में नाइट्रिक एसिड में अतिरिक्त पारा घुल जाता है, तो Hg2 (NO3) 2 नाइट्रेट बनता है।
पारा समूह के समूह IIB के तत्वों में से, एक बहुत ही स्थिर 6d10 - इलेक्ट्रॉन शेल को नष्ट करना संभव है, जिससे पारा यौगिकों (+4) की संभावना होती है। तो, विरल रूप से घुलनशील Hg2F2 और जल-विघटित HgF2 के अलावा, HgF4 भी पारा परमाणुओं और 4 K. के तापमान पर नियॉन और फ्लोरीन के मिश्रण से प्राप्त होता है।
पारा थर्मामीटर के निर्माण में उपयोग किया जाता है, पारा-क्वार्ट्ज और फ्लोरोसेंट लैंप पारा वाष्प से भरे होते हैं। पारा संपर्क स्थिति सेंसर के रूप में कार्य करता है। इसके अलावा, धातु पारा का उपयोग महत्वपूर्ण मिश्र धातुओं की एक श्रृंखला का उत्पादन करने के लिए किया जाता है।
पहले, दर्पण और दंत भराव के निर्माण में धातुओं के विभिन्न अमलगम, विशेष रूप से सोने और चांदी के अमलगमों का व्यापक रूप से उपयोग किया जाता था। प्रौद्योगिकी में, पारा का उपयोग बैरोमीटर और मैनोमीटर के लिए व्यापक रूप से किया गया है। पारा यौगिकों का उपयोग एंटीसेप्टिक (मर्क्यूरिक क्लोराइड), रेचक (कैलोमेल) के रूप में, टोपी उत्पादन में, आदि के रूप में किया जाता था, लेकिन इसकी उच्च विषाक्तता के कारण, 20 वीं शताब्दी के अंत तक इन्हें इन क्षेत्रों से बाहर निचोड़ लिया गया (धातुओं के छिड़काव और इलेक्ट्रोडिशन द्वारा बहुलक का प्रतिस्थापन)। दंत चिकित्सा में भरने)।
थैलियम पारा मिश्र धातु का उपयोग कम तापमान थर्मामीटर के लिए किया जाता है।
मेटालिक पारा कुछ सक्रिय वर्तमान स्रोतों (उदाहरण के लिए, पारा-जस्ता - प्रकार आरसी), संदर्भ वोल्टेज स्रोतों (वेस्टन सेल) में कई सक्रिय धातुओं, क्लोरीन और क्षार के इलेक्ट्रोलाइटिक उत्पादन के लिए कैथोड के रूप में कार्य करता है। पारा-जस्ता तत्व (ईएमएफ 1.35 वोल्ट) की मात्रा और वजन (130 डब्ल्यू / एच / किग्रा, 550 डब्ल्यू / एच / डीएम) में बहुत अधिक ऊर्जा है।
मरकरी का इस्तेमाल सेकेंडरी एल्युमीनियम और गोल्ड माइनिंग (अमलगम देखने के लिए) के रिसाइकल के लिए किया जाता है।
पारा का उपयोग कभी-कभी अत्यधिक भरी हुई हाइड्रोडायनामिक बियरिंग में काम करने वाले तरल पदार्थ के रूप में भी किया जाता है।
समुद्री जल में जहाज के पतवारों को रोकने के लिए पारा कुछ जैव-रासायनिक पेंट का हिस्सा है।
पारा -203 (टी 1/2 \u003d 53 सेकंड) का उपयोग रेडियोफार्माकोलॉजी में किया जाता है।
पारा लवण भी उपयोग किया जाता है:
पारा आयोडाइड का उपयोग सेमीकंडक्टर रेडिएशन डिटेक्टर के रूप में किया जाता है।
मर्करी फुलमैनेट ("विस्फोटक पारा") का उपयोग लंबे समय से एक विस्फोटक (डेटोनेटर) के रूप में किया जाता है।
पारा ब्रोमाइड का उपयोग हाइड्रोजन और ऑक्सीजन (परमाणु हाइड्रोजन ऊर्जा) में पानी के थर्मोकैमिकल अपघटन में किया जाता है।
कुछ पारा यौगिकों का उपयोग दवाओं के रूप में किया जाता है (उदाहरण के लिए, टीकों को संरक्षित करने के लिए मेरिऑल्यूट), लेकिन मुख्य रूप से विषाक्तता के कारण, पारा दवा (मर्क्यूरिक क्लोराइड, पारा ऑक्सीसाइनाइड - एंटीसेप्टिक्स, कैलोमेल - रेचक, आदि) से 20 वीं सदी के मध्य में मिला था।

अल्युमीनियम
एल्युमिनियम, डी। मेंडेलीव दिमित्री इवानोविच के रासायनिक तत्वों की आवधिक प्रणाली के तीसरे काल के तीसरे समूह के मुख्य उपसमूह का एक तत्व है, परमाणु संख्या 13. यह प्रतीक अल (लाट। एल्यूमीनियम) द्वारा नामित है। यह प्रकाश धातुओं के समूह से संबंधित है। पृथ्वी की पपड़ी में सबसे आम धातु और तीसरा सबसे आम (ऑक्सीजन और सिलिकॉन के बाद) रासायनिक तत्व है।
सरल पदार्थ एल्यूमीनियम (CAS-संख्या: 7429-90-5) - हल्के, गैर-चुंबकीय चांदी-सफेद धातु जिसे आसानी से ढाला जा सकता है, डाली जा सकती है। एल्यूमीनियम में उच्च तापीय और विद्युतीय चालकता है, मजबूत ऑक्साइड फिल्मों के तेजी से गठन के कारण संक्षारण प्रतिरोध है जो सतह को आगे की बातचीत से बचाता है।
कुछ जैविक अध्ययनों के अनुसार, मानव शरीर में एल्यूमीनियम का सेवन अल्जाइमर रोग के विकास का एक कारक माना जाता था, लेकिन बाद में इन अध्ययनों की आलोचना की गई और दूसरे के साथ एक के संबंध के बारे में निष्कर्ष को खारिज कर दिया गया।
धातु चांदी-सफेद, हल्के, घनत्व 2.7 ग्राम / सेमी 2, पिघलने बिंदु के लिए तकनीकी 658 डिग्री सेल्सियस, उच्च शुद्धता एल्यूमीनियम 660 डिग्री सेल्सियस, क्वथनांक 2500 डिग्री सेल्सियस, कास्ट प्रतिरोध 10-12 किग्रा / मिमी 2, विकृत 18 -25 किलोग्राम / मिमी 2, मिश्र धातु 38-42 किलोग्राम / मिमी 2।
Brinell कठोरता 24-32 kgf / mm2, उच्च लचीलापन है: तकनीकी 35%, शुद्ध 50%, एक पतली शीट और यहां तक \u200b\u200bकि पन्नी में लुढ़का।
एल्युमिनियम में एक उच्च विद्युत चालकता और तापीय चालकता होती है, जो कि क्यूप्रम की विद्युत चालकता का 65%, एक उच्च परावर्तन है।
एल्युमिनियम लगभग सभी धातुओं के साथ मिश्र धातु बनाता है।
सामान्य परिस्थितियों में, एल्यूमीनियम एक पतली और मजबूत ऑक्साइड फिल्म के साथ लेपित है और इसलिए शास्त्रीय ऑक्सीकरण एजेंटों के साथ प्रतिक्रिया नहीं करता है: एच 2 ओ (टी °); ओ 2, एचएनओ 3 (हीटिंग के बिना) के साथ। इसके कारण, एल्यूमीनियम व्यावहारिक रूप से जंग के लिए अतिसंवेदनशील नहीं है और इसलिए आधुनिक उद्योग द्वारा व्यापक रूप से मांग में है। हालांकि, ऑक्साइड फिल्म के विनाश के दौरान (उदाहरण के लिए, अमोनियम लवण एनएच 4 +, गर्म क्षार के समाधान के साथ संपर्क में या समामेलन के परिणामस्वरूप), एल्यूमीनियम एक सक्रिय धातु को कम करने वाले एजेंट के रूप में कार्य करता है।
सरल पदार्थों के साथ आसानी से प्रतिक्रिया करता है:
ऑक्सीजन के साथ:
4Al + 3O2 \u003d 2Al2O3
हलोजन के साथ:
2Al + 3Br2 \u003d 2AlBr3
गर्म होने पर अन्य गैर-धातुओं के साथ प्रतिक्रिया करता है:
सल्फर के साथ, एल्यूमीनियम सल्फाइड बनाने:
2Al + 3S \u003d Al2S3
एल्यूमीनियम नाइट्राइड बनाने के लिए नाइट्रोजन के साथ:
कार्बन के साथ, एल्यूमीनियम कार्बाइड बनाने:
4Al + 3C \u003d Al4C3
एल्यूमीनियम सल्फाइड और कार्बाइड पूरी तरह से हाइड्रोलाइज्ड हैं:
Al2S3 + 6H2O \u003d 2Al (OH) 3 + 3H2S
Al4C3 + 12H2O \u003d 4Al (OH) 3+ 3CH4
जटिल पदार्थों के साथ:
पानी के साथ (सुरक्षात्मक ऑक्साइड फिल्म को हटाने के बाद, उदाहरण के लिए, समामेलन या गर्म क्षार के समाधान)
2Al + 6H2O \u003d 2Al (OH) 3 + 3H2
क्षार के साथ (tetrahydroxoaluminates और अन्य aluminates के गठन के साथ):
2Al + 2NaOH + 6H2O \u003d 2Na + 3H2
2 (NaOH.H2O) + 2Al \u003d 2NaAlO2 + 3H2
हाइड्रोक्लोरिक में आसानी से घुलनशील और सल्फ्यूरिक एसिड को पतला करते हैं:
2Al + 6HCl \u003d 2AlCl3 + 3H2
2Al + 3H2SO4 (dec) \u003d Al2 (SO4) 3 + 3H2
गर्म होने पर, यह एसिड में घुल जाता है - ऑक्सीकरण एजेंट जो एल्यूमीनियम के घुलनशील लवण बनाते हैं:
2Al + 6H2SO4 (संक्षिप्त) \u003d Al2 (SO4) 3 + 3SO2 + 6H2O
Al + 6HNO3 (कांसेप्ट) \u003d Al (NO3) 3 + 3NO2 + 3H2O
धातुओं को उनके आक्साइड (एल्यूमियोथेमी) से पुनर्स्थापित करता है:
8Al + 3Fe3O4 \u003d 4Al2O3 + 9Fe
2Al + Cr2O3 \u003d Al2O3 + 2Cr
व्यापक रूप से एक संरचनात्मक सामग्री के रूप में उपयोग किया जाता है। इस गुण में एल्युमिनियम के मुख्य लाभ हल्केपन, स्टैम्पिंग के लचीलेपन, संक्षारण प्रतिरोध (हवा में, एल्युमिनियम को तुरंत टिकाऊ Al2O3 फिल्म के साथ लेपित किया जाता है, जो इसके आगे के ऑक्सीकरण को रोकता है), उच्च तापीय चालकता, इसके यौगिकों की गैर-विषाक्तता। विशेष रूप से, इन गुणों ने कुकवेयर के निर्माण, खाद्य उद्योग में एल्यूमीनियम पन्नी और पैकेजिंग के लिए एल्यूमीनियम को बहुत लोकप्रिय बना दिया है।
एक संरचनात्मक सामग्री के रूप में एल्यूमीनियम का मुख्य नुकसान इसकी कम ताकत है, इसलिए इसे आमतौर पर कम मात्रा में क्यूप्रम और मैग्नीशियम (मिश्र धातु को ड्यूरिलमिन कहा जाता है) के साथ जोड़ा जाता है।
एल्युमिनियम की विद्युत चालकता क्यूप्रम की तुलना में केवल 1.7 गुना कम है, जबकि एल्यूमीनियम लगभग 2 गुना सस्ता है। इसलिए, यह तारों के निर्माण के लिए इलेक्ट्रिकल इंजीनियरिंग में व्यापक रूप से उपयोग किया जाता है, उनके परिरक्षण, और यहां तक \u200b\u200bकि चिप्स में कंडक्टरों के निर्माण में माइक्रोइलेक्ट्रॉनिक में भी। क्यूप्रम (63 1 / ओम) की तुलना में एल्यूमीनियम की निचली विद्युत चालकता (37 1 / ओम) को एल्यूमीनियम कंडक्टर के क्रॉस सेक्शन में वृद्धि से मुआवजा दिया जाता है। एक इलेक्ट्रोटेक्निकल सामग्री के रूप में एल्यूमीनियम का नुकसान एक मजबूत ऑक्साइड फिल्म है जो सोल्डरिंग को मुश्किल बनाता है।
गुणों के अपने परिसर के कारण इसे व्यापक रूप से थर्मल उपकरण में वितरित किया जाता है।
एल्यूमीनियम और इसके मिश्र धातु बहुत कम तापमान पर अपनी ताकत बनाए रखते हैं। इसके कारण, इसका व्यापक रूप से क्रायोजेनिक तकनीक में उपयोग किया जाता है।
उच्च परावर्तन, कम लागत और छिड़काव में आसानी के साथ संयुक्त अल्युमीनियम दर्पणों के निर्माण के लिए एक आदर्श सामग्री बनाता है।
गैस बनाने वाले एजेंट के रूप में निर्माण सामग्री के उत्पादन में।
जंग और स्केलिंग का उपयोग स्टील और अन्य मिश्र धातुओं को बदलने के लिए किया जाता है, उदाहरण के लिए, पिस्टन आंतरिक दहन इंजन वाल्व, टरबाइन ब्लेड, तेल वसूली टॉवर, गर्मी विनिमय उपकरण, और गैल्वनाइजिंग को भी प्रतिस्थापित करते हैं।
एल्यूमीनियम सल्फाइड हाइड्रोजन सल्फाइड के उत्पादन के लिए उपयोग किया जाता है।
विशेष रूप से मजबूत और हल्के सामग्री के रूप में झागदार एल्यूमीनियम विकसित करने के लिए अनुसंधान चल रहा है।
जब एल्युमीनियम बहुत महंगा था, तो उससे कई तरह के गहने बनाए जाते थे। उनके लिए फैशन तुरंत पारित हो गया जब इसके उत्पादन की नई प्रौद्योगिकियां (विकास) दिखाई दीं, जो कई बार कम हुईं। आजकल, गहने के निर्माण में कभी-कभी एल्यूमीनियम का उपयोग किया जाता है।


अन्य धातु
नेतृत्व
लेड चौथे समूह के मुख्य उपसमूह का एक तत्व है, डीआई दिमित्री इवानोविच मेंडेलीव के रासायनिक तत्वों की आवधिक प्रणाली की छठी अवधि, परमाणु संख्या 82 के साथ। यह प्रतीक Pb (lat। प्लम) द्वारा दर्शाया गया है। सरल पदार्थ लीड (CAS-संख्या: 7439-92-1) एक निंदनीय, अपेक्षाकृत कम पिघलने वाली ग्रे धातु है।
लीड में काफी कम तापीय चालकता है, यह 0 ° C के तापमान पर 35.1 W / (m · K) है। धातु नरम है, चाकू से काटना आसान है। सतह पर, यह आमतौर पर ऑक्साइड की अधिक या कम मोटी फिल्म के साथ कवर किया जाता है; जब कट जाता है, तो एक चमकदार सतह खुलती है, जो समय के साथ हवा में लुप्त होती है।
गलनांक: 327.4 ° C
क्वथनांक: 1740 ° C
लीड नाइट्रेट का उपयोग शक्तिशाली मिश्रित विस्फोटकों के उत्पादन के लिए किया जाता है। लीड एज़ाइड का उपयोग सबसे व्यापक रूप से उपयोग किए जाने वाले डेटोनेटर (विस्फोटक की शुरुआत) के रूप में किया जाता है। लीड परक्लोरेट का उपयोग अयस्कों के प्लवनशीलता प्रसंस्करण में उपयोग होने वाले भारी तरल (घनत्व 2.6 ग्राम / सेमी 2) को तैयार करने के लिए किया जाता है, यह कभी-कभी शक्तिशाली मिश्रित विस्फोटकों में ऑक्सीकरण एजेंट के रूप में उपयोग किया जाता है। अकेले लेड फ्लोराइड, साथ ही बिस्मथ फ्लोराइड, कुप्रम, सिल्वर के साथ रासायनिक वर्तमान स्रोतों में कैथोड सामग्री के रूप में उपयोग किया जाता है। लीड बिस्मुटेट, PbS लीड सल्फाइड, लीड आयोडाइड का उपयोग लिथियम बैटरी में कैथोड सामग्री के रूप में किया जाता है। स्टैंडबाय वर्तमान स्रोतों में एक कैथोड सामग्री के रूप में लीड क्लोराइड PbCl2। लीड टेलुराइड PbTe को व्यापक रूप से थर्मोइलेक्ट्रिक जनरेटर और थर्मोइलेक्ट्रिक रेफ्रिजरेटर के उत्पादन में सबसे व्यापक रूप से इस्तेमाल की जाने वाली सामग्री (थर्मोइलेक्ट्रिक पावर 350 μV / K) के रूप में उपयोग किया जाता है। लीड डाइऑक्साइड PbO2 व्यापक रूप से न केवल एक लीड-एसिड बैटरी में उपयोग किया जाता है, बल्कि इसके आधार पर कई आरक्षित रासायनिक वर्तमान स्रोतों का उत्पादन किया जाता है, उदाहरण के लिए, एक लीड-क्लोरीन तत्व, एक लीड-फ्लोरीन तत्व, आदि।
लीड सफेद, मुख्य कार्बोनेट Pb (OH) 2.PbCO3, एक घने सफेद पाउडर, कार्बन डाइऑक्साइड और एसिटिक एसिड के प्रभाव में हवा में लीड से प्राप्त किया जाता है। H2S हाइड्रोजन सल्फाइड की कार्रवाई के तहत अपघटन के कारण रंग वर्णक के रूप में सीसा सफेद का उपयोग अब पहले की तरह सामान्य नहीं है। सीमेंट और सीसा-कार्बोनेट पेपर की तकनीक में पोटीन के उत्पादन के लिए लेड वाइटवॉश का भी उपयोग किया जाता है।
कीटों को मारने के लिए कीटनाशक तकनीक में लेड आर्सेनेट और आर्सेनाइट का उपयोग किया जाता है - कृषि कीट (बिना रेशम के कीड़ों और कपास की फसल)। लीड बोरेट पीबी (बीओ 2) 2 · एच 2 ओ, एक अघुलनशील सफेद पाउडर है, जिसका उपयोग पेंट और वार्निश को सुखाने के लिए किया जाता है, और साथ में अन्य धातुओं के साथ - कांच और चीनी मिट्टी के बरतन के रूप में। लीड क्लोराइड PbCl2, एक सफेद क्रिस्टलीय पाउडर, गर्म पानी में घुलनशील, अन्य क्लोराइड के समाधान और विशेष रूप से अमोनियम क्लोराइड NH4Cl। इसका उपयोग ट्यूमर के उपचार में मलहम की तैयारी के लिए किया जाता है।
लीड क्रोमेट PbCrO4 क्रोम पीले डाई के रूप में जाना जाता है, यह पेंट की तैयारी के लिए चीनी मिट्टी के बरतन और कपड़े रंगने के लिए एक महत्वपूर्ण रंगद्रव्य है। उद्योग में, क्रोमेट का उपयोग मुख्य रूप से पीले रंजक के उत्पादन में किया जाता है। लेड नाइट्रेट Pb (NO3) 2 एक सफेद क्रिस्टलीय पदार्थ है जो पानी में आसानी से घुलनशील होता है। यह सीमित उपयोग का एक कसैला है। उद्योग में, इसका उपयोग मैच उत्पादन, रंगाई और कपड़ा छपाई, रंगाई सींग और उत्कीर्णन में किया जाता है। लीड सल्फेट पीबी (एसओ 4) 2, एक पानी-अघुलनशील सफेद पाउडर, का उपयोग बैटरी, लिथोग्राफी, और मुद्रित कपड़े तकनीक में वर्णक के रूप में किया जाता है।
लीड सल्फाइड PbS, एक काला पानी-अघुलनशील पाउडर, मिट्टी के बर्तनों को आग लगाने और लीड आयन का पता लगाने के लिए उपयोग किया जाता है।
चूंकि लीड well विकिरण को अच्छी तरह से अवशोषित करता है, इसका उपयोग एक्स-रे प्रतिष्ठानों और परमाणु रिएक्टरों में विकिरण सुरक्षा के लिए किया जाता है। इसके अलावा, लीड को तेजी से न्यूट्रॉन रिएक्टरों को बढ़ावा देने की परियोजनाओं में एक शीतलक माना जाता है।
लीड मिश्र महत्वपूर्ण अनुप्रयोग पाते हैं। 85-90% टिन धातु और 15-10% पीबी युक्त प्यूटर (टिन-लीड मिश्र धातु), ढाला, सस्ती, और घरेलू बर्तनों के निर्माण में उपयोग किया जाता है। इलेक्ट्रिकल इंजीनियरिंग में 67% Pb और 33% टिन धातु वाले सोल्डर का उपयोग किया जाता है। लीड और एंटीमनी मिश्र धातुओं का उपयोग गोलियों और टाइपोग्राफी के निर्माण में किया जाता है, और लीड, सुरमा और टिन मिश्र धातुओं का उपयोग आकृति की ढलाई और बीयरिंग के लिए किया जाता है। एंटीमनी लीड मिश्र आमतौर पर केबल म्यान और इलेक्ट्रिक बैटरी प्लेटों के लिए उपयोग किया जाता है। लीड यौगिकों का उपयोग रंजक, पेंट, कीटनाशक, कांच के निर्माण में किया जाता है व्यापार आइटम और टेट्राएथिल लेड (C2H5) 4Pb (मध्यम रूप से वाष्पशील तरल, कम सांद्रता में कटौती की एक जोड़ी के रूप में गैसोलीन के लिए योजक के रूप में एक मीठा गंध गंध है, बड़े लोगों में एक अप्रिय गंध है; एमपीपी \u003d 130 डिग्री सेल्सियस, एमपी \u003d 80 डिग्री सेल्सियस / 13 मिमी आरटी) .st। dens; 1,650 g / cm; nD2v \u003d 1,5198; पानी में अघुलनशील, कार्बनिक सॉल्वैंट्स के साथ मिश्रित; अत्यधिक विषाक्त, आसानी से त्वचा में प्रवेश करती है; MPC \u003d 0.005 mg / m; LDH \u003d 12.7 mg / ओक्टेन रेटिंग बढ़ाने के लिए किलो (चूहा, मौखिक))।

टिन
टिन चौथे समूह के मुख्य उपसमूह का एक तत्व है, रासायनिक तत्वों की आवधिक प्रणाली की पांचवीं अवधि डीआई मेंडेलीव दिमित्री इवानोविच, परमाणु संख्या 50 के साथ। यह टिन धातु (लाट। स्टैनम) के प्रतीक द्वारा निर्दिष्ट है। सामान्य परिस्थितियों में, एक साधारण पदार्थ चांदी-सफेद रंग का एक नमनीय, निंदनीय और सुपाच्य चमकदार धातु है। टिन कई ऐलोट्रोपिक संशोधनों का निर्माण करता है: 13.2 ° C स्थिर α- टिन (ग्रे टिन) नीचे हीरे के प्रकार के क्यूबिक जाली के साथ, 13.2 डिग्री सेल्सियस स्थिर tin-टिन (सफेद टिन) से ऊपर एक टेट्रोगोन क्रिस्टल जाली के साथ।
टिन मुख्य रूप से अपने शुद्ध रूप में या अन्य धातुओं के साथ मिश्र धातुओं में एक सुरक्षित, गैर विषैले, संक्षारण प्रतिरोधी कोटिंग के रूप में उपयोग किया जाता है। टिन के मुख्य औद्योगिक अनुप्रयोग टिनप्लेट (टिनर्ड आयरन) में खाद्य उत्पादों के कंटेनरों के निर्माण के लिए, इलेक्ट्रॉनिक्स में विक्रेताओं के लिए, घरेलू पाइपलाइनों में, असर वाली मिश्र धातुओं में और टिन और इसके मिश्र धातुओं के कोटिंग्स में हैं। सबसे महत्वपूर्ण टिन मिश्र धातु है पीतल (कामरेड के साथ)। एक अन्य प्रसिद्ध मिश्र धातु - एक कंप्यूटर - का उपयोग व्यंजन बनाने के लिए किया जाता है। हाल ही में, धातु के उपयोग में रुचि को पुनर्जीवित किया गया है, क्योंकि यह भारी गैर-लौह धातुओं में सबसे "पर्यावरण के अनुकूल" है। Nb3Sn इंटरमेटॉलिक कंपाउंड के आधार पर सुपरकंडक्टिंग तारों को बनाने के लिए उपयोग किया जाता है।
कीमतों 2006 में धातु टिन पर औसतन 12-18 $ / किग्रा, उच्च शुद्धता का टिन डाइऑक्साइड लगभग 25 $ / किग्रा, एकल क्रिस्टल टिन उच्च शुद्धता का लगभग 210 $ / किग्रा था।
टिन और जिरकोनियम इंटरमेटैलिक यौगिकों में उच्च पिघलने के बिंदु (2000 डिग्री सेल्सियस तक) और ऑक्सीकरण प्रतिरोध होते हैं जब हवा में गर्म होते हैं और कई अनुप्रयोग होते हैं।
टिन संरचनात्मक टाइटेनियम मिश्र धातुओं के उत्पादन में सबसे महत्वपूर्ण मिश्र धातु घटक है।
टिन डाइऑक्साइड एक बहुत प्रभावी अपघर्षक सामग्री है जिसका उपयोग ऑप्टिकल ग्लास की सतह को "परिष्करण" करने के लिए किया जाता है।
टिन लवण का मिश्रण - "पीली रचना" - पहले ऊन के लिए डाई के रूप में उपयोग किया जाता था।
टिन का उपयोग रासायनिक वर्तमान स्रोतों में एनोड सामग्री के रूप में भी किया जाता है, उदाहरण के लिए: मैंगनीज-टिन तत्व, ऑक्साइड-पारा-टिन तत्व। प्रोमिसिंग टिन का उपयोग सीसा-टिन बैटरी में होता है; इसलिए, उदाहरण के लिए, एक लीड बैटरी के साथ बराबर वोल्टेज पर, एक लीड-टिन बैटरी में 2.5 गुना अधिक क्षमता और प्रति यूनिट वॉल्यूम में 5 गुना अधिक ऊर्जा घनत्व होता है, इसका आंतरिक प्रतिरोध बहुत कम होता है।
धातु टिन गैर विषैले है, जो खाद्य उद्योग में इसके उपयोग की अनुमति देता है। 600 डिग्री सेल्सियस तक के तापमान पर पिघल सहित भंडारण और उपयोग की सामान्य परिस्थितियों में टिन में निहित हानिकारक अशुद्धियां, GOST के अनुसार अधिकतम अनुमत एकाग्रता से अधिक मात्रा में कार्य क्षेत्र की हवा में जारी नहीं की जाती हैं। टिन की धूल से लंबे समय तक (15-20 वर्ष) रहने से फेफड़ों पर फाइब्रोजेनिक प्रभाव पड़ता है और यह न्यूमोकोनिओसिस के साथ काम करने वालों की बीमारी का कारण बन सकता है।
धातु आवेदन
निर्माण सामग्री
धातु और उनके मिश्र आधुनिक सभ्यता के मुख्य संरचनात्मक पदार्थों में से एक हैं। यह मुख्य रूप से तरल पदार्थ और गैसों के लिए उनकी उच्च शक्ति, एकरूपता और अभेद्यता से निर्धारित होता है। इसके अलावा, मिश्र धातुओं की संरचना को बदलते हुए, उनके गुणों को बहुत विस्तृत श्रृंखला में बदलना संभव है।
विद्युत सामग्री
धातुओं का उपयोग अच्छे कंडक्टर के रूप में किया जाता है विद्युत शक्ति (कॉपर, एल्यूमीनियम), और प्रतिरोधों और इलेक्ट्रिक हीटिंग तत्वों (निक्रोम, आदि) के लिए उच्च प्रतिरोध वाली सामग्री के रूप में।
उपकरण सामग्री
धातु और उनके मिश्र धातुओं का व्यापक रूप से उपकरणों के निर्माण (उनके काम करने वाले भागों) के लिए उपयोग किया जाता है। ये मुख्य रूप से टूल स्टील्स और कार्बाइड हैं। हीरा, बोरान नाइट्राइड और चीनी मिट्टी की चीज़ें भी उपकरण सामग्री के रूप में उपयोग की जाती हैं।
धातुकर्म
धातु विज्ञान या धातु विज्ञान सामग्री विज्ञान का एक क्षेत्र है जो धातुओं, इंटरमेटेलिक यौगिकों और मिश्र धातुओं के भौतिक और रासायनिक व्यवहार का अध्ययन करता है। धातु विज्ञान में धातुओं के बारे में मौजूदा ज्ञान का व्यावहारिक अनुप्रयोग भी शामिल है - कच्चे माल की निकासी से लेकर तैयार उत्पादों के मौद्रिक उत्सर्जन तक।
धातु और ऑक्साइड के पिघलने और ठोस समाधान की संरचना और भौतिक रासायनिक गुणों का अध्ययन, पदार्थ के संघनित अवस्था के सिद्धांत का विकास;
ऊष्मप्रवैगिकी, कैनेटीक्स और धातुकर्म प्रतिक्रियाओं के तंत्र का अध्ययन;
पर्यावरणीय समस्याओं के समाधान के साथ पॉलीमेलेटिक खनिज कच्चे माल और औद्योगिक कचरे के एकीकृत उपयोग के लिए वैज्ञानिक और तकनीकी और आर्थिक नींव का विकास;
पाइरोमेटेलर्जिकल, इलेक्ट्रोथर्मल, हाइड्रोमेटालार्जिकल और गैस-चरण के मूल सिद्धांतों के विकास प्रक्रियाओं धातु, मिश्र धातु, धातु पाउडर और मिश्रित सामग्री और कोटिंग्स का उत्पादन।
लौह धातुओं में आयरन, मैंगनीज, क्रोमियम, वेनेडियम शामिल हैं। बाकी सभी रंगीन हैं। उनके भौतिक गुणों और उद्देश्य के अनुसार, अलौह धातुओं को पारंपरिक रूप से भारी (तांबा, सीसा, जस्ता, टिन, नी) और प्रकाश (एल्यूमीनियम, मैग्नीशियम) में विभाजित किया जाता है।
मुख्य तकनीकी प्रक्रिया के अनुसार, इसे पाइरोमेट्रिआलिटेशन (गलाने) और हाइड्रोमिटेथेक्टिक (रासायनिक समाधानों में धातुओं का निष्कर्षण) में विभाजित किया गया है। पाइरोमेटैविटी की एक किस्म प्लाज्मा धातु विज्ञान है।
प्लाज्मा धातुकर्म - प्लाज्मा के प्रभाव में धातुओं और मिश्र धातुओं के अयस्कों, गलाने और प्रसंस्करण से निष्कर्षण।
प्लाज्मा में उनके थर्मल अपघटन द्वारा अयस्कों (ऑक्साइड, आदि) का प्रसंस्करण किया जाता है। रिवर्स प्रतिक्रियाओं को रोकने के लिए, एक कम करने वाले एजेंट का उपयोग किया जाता है (कार्बन, हाइड्रोजन, मीथेन, आदि), या प्लाज्मा धारा की एक तेज शीतलन, जो थर्मोडायनामिक संतुलन का उल्लंघन करती है।
प्लाज्मा धातुकर्म अयस्क से धातु की प्रत्यक्ष कमी की अनुमति देता है, धातुकर्म प्रक्रियाओं में काफी तेजी लाता है, स्वच्छ सामग्री प्राप्त करता है, ईंधन की खपत को कम करता है (एजेंट को कम करता है)। प्लाज्मा धातु विज्ञान का नुकसान प्लाज्मा उत्पन्न करने के लिए उपयोग की जाने वाली बिजली की उच्च खपत है।

कहानी
पहला प्रमाण जो एक व्यक्ति 5-6 सहस्राब्दी ईसा पूर्व में धातु विज्ञान की तारीखों में लगा हुआ था। ई। और माजानपेक, प्लोक्निक और सर्बिया के अन्य स्थानों (तांबे की कुल्हाड़ी सहित 5500 ईसा पूर्व, विन्का संस्कृति से संबंधित), बुल्गारिया (5000 ईसा पूर्व), पाल्मेले (), स्पेन, स्टोनहेंज में पाए गए ()। हालांकि, जैसा कि अक्सर लंबे समय से चली आ रही घटनाओं के साथ होता है, आयु हमेशा सटीक रूप से निर्धारित नहीं की जा सकती है।
शुरुआती समय की संस्कृति में, सिल्वर, कॉपर, टिन और उल्कापिंड आयरन हैं, जो सीमित धातुओं की अनुमति देते हैं। इस प्रकार, "स्वर्गीय खंजर" अत्यधिक मूल्यवान थे - मिस्र के हथियार 3000 साल ईसा पूर्व उल्कापिंड लोहे से बनाए गए थे। ई। लेकिन, कॉपर और टिन से खान सीखना चट्टान और कांस्य नामक एक मिश्र धातु प्राप्त करते हैं, 3500 ईसा पूर्व में लोग। ई। कांस्य युग में प्रवेश किया।
अयस्क से लोहा प्राप्त करना और धातु को गलाना अधिक कठिन था। ऐसा माना जाता है कि प्रौद्योगिकी का आविष्कार 1200 ईसा पूर्व के आसपास हित्तियों द्वारा किया गया था। ई।, वह लौह युग की शुरुआत थी। पलिश्तियों के शासन में खनन और निर्माण लोहा का रहस्य एक महत्वपूर्ण कारक बन गया है।
कई अतीत की संस्कृतियों और सभ्यताओं में फेरस धातु विज्ञान के विकास के निशान का पता लगाया जा सकता है। इसमें मध्य पूर्व और मध्य पूर्व के प्राचीन और मध्ययुगीन साम्राज्य और साम्राज्य शामिल हैं, प्राचीन मिस्र और अनातोलिया (), कार्थेज, ग्रीक और प्राचीन और मध्ययुगीन रोमन यूरोप का, चीन, आदि। यह ध्यान दिया जाना चाहिए कि धातु विज्ञान के कई तरीकों, उपकरणों और प्रौद्योगिकियों का मूल रूप से प्राचीन चीन में आविष्कार किया गया था, और फिर यूरोपीय लोगों ने इस शिल्प में महारत हासिल की (ब्लास्ट फर्नेस का आविष्कार किया,) कच्चा लोहा, इस्पात, हाइड्रोलिक हथौड़ों, आदि)। हालाँकि, हाल के शोध से पता चलता है कि रोमन तकनीक पहले की तुलना में बहुत अधिक उन्नत थी, खासकर खनन और फोर्जिंग के क्षेत्रों में।
निष्कर्षण धातु विज्ञान
खनन धातुकर्म में अयस्क से मूल्यवान धातुओं के निष्कर्षण और निकाले गए कच्चे पदार्थों को शुद्ध धातु में गलाने का काम होता है। धातु ऑक्साइड या सल्फाइड को शुद्ध धातु में परिवर्तित करने के लिए, अयस्क को भौतिक, रासायनिक या इलेक्ट्रोलाइटिक तरीकों से अलग किया जाना चाहिए।
धातु विज्ञानी तीन मुख्य घटकों के साथ काम करते हैं: कच्चे माल, ध्यान केंद्रित करना (धातु का मूल्यवान ऑक्साइड या सल्फाइड) और अपशिष्ट। खनन के बाद, अयस्क के बड़े टुकड़ों को उस बिंदु पर कुचल दिया जाता है जहां प्रत्येक कण या तो एक मूल्यवान ध्यान केंद्रित करता है या बर्बाद होता है।
पहाड़ काम वैकल्पिक अगर अयस्क और पर्यावरण लीचिंग की अनुमति दें। इस तरह, कोई भी खनिज के साथ समृद्ध समाधान को भंग और प्राप्त कर सकता है।
अयस्क में अक्सर कई मूल्यवान धातुएँ होती हैं। इस मामले में, एक प्रक्रिया से निकलने वाले कचरे का उपयोग किसी अन्य प्रक्रिया के लिए कच्चे माल के रूप में किया जा सकता है।
मिश्र धातु
मिश्र धातु घटकों की प्रबलता के साथ दो या अधिक रासायनिक तत्वों का एक मैक्रोस्कोपिक रूप से सजातीय मिश्रण है। मिश्र धातु का मुख्य या एकमात्र चरण, एक नियम के रूप में, धातु में मिश्र धातु तत्वों का एक ठोस समाधान है, जो मिश्र धातु का आधार है।
मिश्र धातुओं में धातु गुण होते हैं, उदाहरण के लिए: धातु की चमक, उच्च विद्युत चालकता और तापीय चालकता। कभी-कभी मिश्र धातु घटक न केवल रासायनिक तत्व हो सकते हैं, बल्कि धातु के गुणों के साथ रासायनिक यौगिक भी हो सकते हैं। उदाहरण के लिए, कार्बाइड के मुख्य घटक टंगस्टन या टाइटेनियम कार्बाइड हैं। मिश्र धातुओं के मैक्रोस्कोपिक गुण हमेशा उनके घटकों के गुणों से भिन्न होते हैं, और धातु के मैट्रिक्स में अशुद्धता चरणों के समान वितरण के कारण मल्टीफ़ेज़ (विषम) मिश्र धातुओं की मैक्रोस्कोपिक समरूपता प्राप्त की जाती है।
आमतौर पर पिघला हुआ राज्य में घटकों को मिलाकर मिश्र धातुओं को प्राप्त किया जाता है, इसके बाद ठंडा किया जाता है। घटकों के उच्च पिघलने वाले तापमान पर, धातुओं को बाद के सिंटरिंग (जिसमें यह है, उदाहरण के लिए, कई टंगस्टन मिश्र धातुएं प्राप्त की जाती हैं) के साथ धातुओं के पाउडर को मिलाकर उत्पादित किया जाता है।
मिश्र मुख्य संरचनात्मक सामग्रियों में से एक हैं। उनमें से, सबसे महत्वपूर्ण लौह और एल्यूमीनियम पर आधारित मिश्र हैं। गैर धातुओं जैसे कार्बन, सिलिकॉन, बोरान आदि को कई मिश्र धातुओं की संरचना में पेश किया जा सकता है। तकनीक में 5 हजार से अधिक मिश्र धातुओं का उपयोग किया जाता है।
सूत्रों का कहना है
http://ru.wikipedia.org/
निवेशक का विश्वकोश. 2013 .
समानार्थी:- - धातु, धातु पति।, लाट। krushets; और एक छोटे रूप में, गलाने में: कोरोलेक। रोजमर्रा की जिंदगी में, मूल्यवान, महंगी धातुएं: सोना, प्लैटिनम, चांदी; सरल: लोहा, तांबा, जस्ता, टिन, सीसा; रसायन विज्ञान ने लगभग सभी खनिजों के ऐसे सिद्धांतों की खोज की ... डाह का व्याख्यात्मक शब्दकोश
वर्तमान में ज्ञात रासायनिक तत्वों के विशाल बहुमत (117 में से 93) धातु हैं।
विभिन्न धातुओं के परमाणुओं की संरचना में बहुत कुछ सामान्य है, और उनके द्वारा गठित सरल और जटिल पदार्थों में समान गुण (भौतिक और रासायनिक) हैं।
आवधिक प्रणाली में स्थिति और धातु परमाणुओं की संरचना।
आवधिक प्रणाली में, धातुएं बाईं ओर स्थित हैं और सशर्त टूटी हुई रेखा से बोरान से एस्टाटाइन (तालिका देखें) से गुजर रही हैं। लगभग सभी एस-तत्व (एच, हे के अपवाद के साथ) धातुओं के हैं, लगभग आधा आर-वह, सभी घ- और च-सेवाएँ ( lanthanides और एक्टिनाइड्स).
बाहरी ऊर्जा स्तर पर अधिकांश धातु के परमाणुओं में एक छोटी संख्या (3 तक) इलेक्ट्रॉन होते हैं, केवल कुछ पी-तत्व परमाणु (एसएन, पब, बीआई, पीओ) में अधिक (चार से छह) होते हैं। धातु परमाणुओं के वैलेंस इलेक्ट्रॉनों को कमजोर रूप से (गैर-धातु परमाणुओं की तुलना में) नाभिक के साथ जोड़ा जाता है। इसलिए, धातु परमाणु अपेक्षाकृत आसानी से इन इलेक्ट्रॉनों को अन्य परमाणुओं को दे देते हैं, केवल रासायनिक प्रतिक्रियाओं में अभिनय करते हैं जो एजेंटों को कम करते हैं और सकारात्मक रूप से छिद्र में बदल जाते हैं:
मुझे - ने - \u003d मुझे n +।
गैर-धातुओं के विपरीत, धातु परमाणुओं को केवल +1 से +8 तक सकारात्मक ऑक्सीकरण राज्यों द्वारा विशेषता है।
किस आसानी के साथ धातु के परमाणु अपने परमाणुओं को अन्य परमाणुओं को दान करते हैं, इस धातु की कमी गतिविधि की विशेषता है। धातु परमाणु जितनी आसानी से अपने इलेक्ट्रॉनों को देता है, उतना ही कम करने वाला एजेंट। यदि धातुओं को जलीय घोलों में उनकी कमी करने की क्षमता के क्रम में एक पंक्ति में व्यवस्थित किया जाता है, तो हम प्राप्त करते हैं धातु विस्थापन श्रृंखला, जिसे वोल्टेज की विद्युत श्रृंखला (या) भी कहा जाता है निकट गतिविधि) धातुएँ (नीचे तालिका देखें)।
व्यापकता एमप्रकृति में धातु.
पृथ्वी की पपड़ी में पहले तीन सबसे आम धातुएं (यह हमारे ग्रह की सतह की परत लगभग 16 किमी मोटी है) में एल्यूमीनियम, लोहा और कैल्शियम शामिल हैं। कम आम सोडियम, पोटेशियम और मैग्नीशियम हैं। नीचे दी गई तालिका पृथ्वी की पपड़ी में कुछ धातुओं के द्रव्यमान अंशों को दिखाती है।
लोहा और कैल्शियम। कम आम सोडियम, पोटेशियम और मैग्नीशियम हैं। नीचे दी गई तालिका पृथ्वी की पपड़ी में कुछ धातुओं के द्रव्यमान अंशों को दिखाती है।
पृथ्वी की पपड़ी में धातुओं का प्रसार
| धातु | धातु | पृथ्वी की पपड़ी में द्रव्यमान अंश,% | |
|---|---|---|---|
| अल | 8,8 | सीआर | 8,3 ∙ 10 -3 |
| फे | 4,65 | Zn | 8,3 ∙ 10 -3 |
| सीए | 3,38 | नी | 8 ∙ 10 -3 |
| ना | 2,65 | Cu | 4,7 ∙ 10 -3 |
| कश्मीर | 2,41 | Pb | 1,6 ∙ 10 -3 |
| मिलीग्राम | 2,35 | एजी | 7 ∙ 10 -6 |
| ती | 0,57 | एचजी | 1,35 ∙ 10 -6 |
| Mn | 0,10 | Au | 5 ∙ 10 -8 |
ऐसे तत्व जिनके पृथ्वी की पपड़ी में बड़े पैमाने पर अंश 0.01% से कम हैं, कहा जाता है विरल। दुर्लभ धातुओं में शामिल हैं, उदाहरण के लिए, सभी लैंथेनाइड्स। यदि कोई तत्व पृथ्वी की पपड़ी में ध्यान केंद्रित करने में सक्षम नहीं है, अर्थात् वह अपने स्वयं के अयस्कों का निर्माण नहीं करता है, लेकिन अन्य तत्वों के साथ अशुद्धता के रूप में होता है, तो इसे संदर्भित किया जाता है विचलित तत्वों। निम्न धातुएं बिखरी हुई हैं, उदाहरण के लिए: एससी, गा, इन, टीएल, एचएफ।
XX सदी के 40 के दशक में। जर्मन वैज्ञानिकों वाल्टर और इडा नोला ने सुझाव दिया कि। फुटपाथ पर हर कोबलस्टोन में आवधिक प्रणाली के सभी रासायनिक तत्व होते हैं। सबसे पहले, ये शब्द उनके सहयोगियों द्वारा सर्वसम्मति से दूर से मिले थे। हालांकि, विश्लेषण के अधिक से अधिक सटीक तरीके दिखाई देते हैं, वैज्ञानिक इन शब्दों की वैधता के बारे में अधिक से अधिक आश्वस्त हैं।
चूंकि सभी जीवित जीव पर्यावरण के निकट संपर्क में हैं, तो उनमें से प्रत्येक को शामिल होना चाहिए, यदि सभी नहीं, तो आवधिक प्रणाली के अधिकांश रासायनिक तत्व। उदाहरण के लिए, एक वयस्क के शरीर में, अकार्बनिक पदार्थों का द्रव्यमान अंश 6% है। इन यौगिकों में धातुओं में से, Mg, Ca, Na, K. मौजूद हैं। हमारे शरीर में कई एंजाइम और अन्य जैविक रूप से सक्रिय कार्बनिक यौगिकों में V, Mn, Fe, Cu, Zn, Co, Ni, Mo, Cr और कुछ अन्य धातुएं हैं।
एक वयस्क के शरीर में लगभग 140 ग्राम पोटेशियम आयन और लगभग 100 ग्राम सोडियम आयन होते हैं। भोजन के साथ, हम प्रतिदिन 1.5 ग्राम से 7 ग्राम पोटेशियम आयनों और 2 ग्राम से 15 ग्राम सोडियम आयनों का उपभोग करते हैं। सोडियम आयनों की आवश्यकता इतनी महान है कि उन्हें विशेष रूप से भोजन में जोड़ा जाना चाहिए। सोडियम आयनों का एक महत्वपूर्ण नुकसान (मूत्र और पसीने के साथ NaCl के रूप में) मानव स्वास्थ्य पर प्रतिकूल प्रभाव डालता है। इसलिए, गर्म मौसम में, डॉक्टर मिनरल वाटर पीने की सलाह देते हैं। हालांकि, भोजन में नमक की अतिरिक्त सामग्री हमारे आंतरिक अंगों (मुख्य रूप से दिल और गुर्दे) के काम को नकारात्मक रूप से प्रभावित करती है।
आपको वोट देने के लिए जावास्क्रिप्ट सक्रिय होना चाहिए।और अन्य रासायनिक यौगिक। शुद्ध धातुओं और उनके आगे के आवेदन को प्राप्त करने के लिए, उन्हें अयस्कों से अलग करना और सफाई करना आवश्यक है। यदि आवश्यक हो मिश्रधातु और अन्य धातु प्रसंस्करण। विज्ञान इसका अध्ययन कर रहा है। धातुकर्म । धातुकर्म फेरस अयस्कों (पर आधारित) को अलग करता है ग्रंथि) और अलौह (उनमें लोहा शामिल नहीं है, केवल लगभग 70 तत्व हैं)। सोना, चांदी और प्लैटिनम के लिए भी लागू होते हैं कीमती (महान) धातु । इसके अलावा, छोटी मात्रा में वे समुद्र के पानी, पौधों, जीवित जीवों (एक महत्वपूर्ण भूमिका निभाते हुए) में मौजूद हैं।
यह ज्ञात है कि मानव शरीर में 3% होते हैं धातुओं की । हम में से अधिकांश कोशिकाओं कैल्शियम और सोडियम में केंद्रित है लसीका प्रणाली. मैग्नीशियम में जमा हो जाता है मांसपेशियों और तंत्रिका तंत्र , तांबा - में जिगर , लोहा - में रक्त.
निष्कर्षण
धातुओं को अक्सर खनन से पृथ्वी से निकाला जाता है, परिणाम - खनन अयस्क - आवश्यक तत्वों के अपेक्षाकृत समृद्ध स्रोत के रूप में काम करते हैं। अयस्कों के स्थान का पता लगाने के लिए, विशेष खोज विधियों का उपयोग किया जाता है, जिसमें अयस्क की खोज और जमा की खोज शामिल है। जमा को आम तौर पर विभाजित किया जाता है व्यवसाय (सतह अयस्कों), जिसमें भारी उपकरण, साथ ही भूमिगत का उपयोग करके मिट्टी निकालने के द्वारा खनन किया जाता है मेरा.
धातुओं को अयस्क खनन से निकाला जाता है, आमतौर पर रासायनिक या इलेक्ट्रोलाइटिक कमी से। अग्निछाया अयस्क को धातु के कच्चे माल में बदलने के लिए उच्च तापमान का उपयोग किया जाता है hydrometallurgy एक ही उद्देश्य के लिए पानी रसायन शास्त्र लागू होते हैं। उपयोग की जाने वाली विधियाँ धातु के प्रकार और संदूषण के प्रकार पर निर्भर करती हैं।
जब धातु अयस्क धातु और गैर-धातु का एक आयनिक यौगिक होता है, तो इसे आमतौर पर पिघलाया जाता है - शुद्ध धातु को पुनर्प्राप्त करने के लिए कम करने वाले एजेंट के साथ गर्म किया जाता है। कई सामान्य धातुएँ जैसे कि लोहा एक कम करने वाले एजेंट के रूप में इस्तेमाल किया गया कार्बन (जलते कोयले से प्राप्त)। कुछ धातुएँ, जैसे कि अल्युमीनियम और सोडियम कोई आर्थिक रूप से व्यवहार्य रिडक्टेंट नहीं है और इसका उपयोग करके पुनर्प्राप्त किया जाता है इलेक्ट्रोलीज़.
कुछ धातुओं की मोह कठोरता:
| कठोरता | धातु |
|---|---|
| 0.2 | सीज़ियम |
| 0.3 | रूबिडीयाम |
| 0.4 | पोटैशियम |
| 0.5 | सोडियम |
| 0.6 | लिथियम |
| 1.2 | ईण्डीयुम |
| 1.2 | थालियम |
| 1.25 | बेरियम |
| 1.5 | स्ट्रोंटियम |
| 1.5 | गैलियम |
| 1.5 | टिन |
| 1.5 | नेतृत्व |
| 1.5 | |
| 1.75 | कैल्शियम |
| 2.0 | कैडमियम |
| 2.25 | विस्मुट |
| 2.5 | मैग्नीशियम |
| 2.5 | जस्ता |
| 2.5 | लेण्टेनियुम |
| 2.5 | चांदी |
| 2.5 | सोना |
| 2.59 | yttrium |
| 2.75 | अल्युमीनियम |
| 3.0 | तांबा |
| 3.0 | सुरमा |
| 3.0 | थोरियम |
| 3.17 | स्कैंडियम |
| 3.5 | प्लैटिनम |
| 3.75 | कोबाल्ट |
| 3.75 | दुर्ग |
| 3.75 | zirconium |
| 4.0 | लोहा |
| 4.0 | निकल |
| 4.0 | हेफ़नियम |
| 4.0 | मैंगनीज |
| 4.5 | वैनेडियम |
| 4.5 | मोलिब्डेनम |
| 4.5 | रोडियाम |
| 4.5 | टाइटन |
| 4.75 | नाइओबियम |
| 5.0 | इरिडियम |
| 5.0 | दयाता |
| 5.0 | टैंटलम |
| 5.0 | टेक्नेटियम |
| 5.0 | क्रोम |
| 5.5 | फीरोज़ा |
| 5.5 | आज़मियम |
| 5.5 | रेनीयाम |
| 6.0 | टंगस्टन |
| 6.0 | β-यूरेनस |
इलेक्ट्रॉनों के आसान पुनरावृत्ति के कारण, धातुओं का ऑक्सीकरण संभव है, जिससे हो सकता है जंग और गुणों का और अधिक क्षरण। ऑक्सीकरण करने की क्षमता को धातुओं की गतिविधि की मानक श्रृंखला द्वारा पहचाना जा सकता है। यह तथ्य अन्य तत्वों के साथ संयोजन में धातुओं का उपयोग करने की आवश्यकता की पुष्टि करता है ( मिश्र धातु जो सबसे महत्वपूर्ण है इस्पात), उनके मिश्र धातु और विभिन्न कोटिंग्स के आवेदन।
धातुओं के इलेक्ट्रॉनिक गुणों के अधिक सही विवरण के लिए, इसका उपयोग करना आवश्यक है क्वांटम यांत्रिकी । पर्याप्त के साथ सभी ठोस में समरूपता अलग-अलग परमाणुओं के इलेक्ट्रॉनों का ऊर्जा स्तर ओवरलैप करता है और अनुमत क्षेत्र बनाता है, और वैलेंस इलेक्ट्रॉनों द्वारा गठित क्षेत्र को कहा जाता है वैलेंस बैंड । धातुओं में वैलेंस इलेक्ट्रॉनों का कमजोर बंधन इस तथ्य की ओर जाता है कि धातुओं में वैलेंस बैंड बहुत व्यापक है, और सभी वैलेंस इलेक्ट्रॉनों को पूरी तरह से भरने के लिए पर्याप्त नहीं है।
इस तरह के आंशिक रूप से भरे क्षेत्र की मूलभूत विशेषता यह है कि नमूना में एक न्यूनतम लागू वोल्टेज के साथ भी, वैलेंस इलेक्ट्रॉनों का पुनर्गठन शुरू होता है, अर्थात, यह बहता है विद्युत प्रवाह.
वही उच्च इलेक्ट्रॉन गतिशीलता उच्च तापीय चालकता की ओर जाता है, साथ ही विद्युत चुम्बकीय विकिरण को दर्पण करने की क्षमता (जो धातुओं को एक विशिष्ट चमक देता है)।
कुछ धातु
- प्रकाश:
- अन्य:
धातु आवेदन
निर्माण सामग्री
उपकरण सामग्री
धातुओं के बारे में विचारों के विकास का इतिहास
धातुओं से मनुष्य का परिचय शुरू हुआ सोना , चांदी और तांबा , अर्थात्, पृथ्वी की सतह पर मुक्त अवस्था में पाए जाने वाले धातुओं से; बाद में वे धातुओं से जुड़ गए जो प्रकृति में काफी आम हैं और आसानी से उनके यौगिकों से अलग हैं: टिन , नेतृत्व , लोहा और। ये सात धातुएं प्राचीन काल में मानव जाति के लिए परिचित थीं। मिस्र की प्राचीन कलाकृतियों में सोने और तांबे के उत्पाद हैं, जो कि कुछ स्रोतों के अनुसार, ईसा पूर्व 3000-4000 वर्ष पूर्व सुदूरवर्ती युग के हैं। ई।
केवल सात प्रसिद्ध धातुओं में मध्यम आयु जोड़ा गया था जस्ता , विस्मुट , सुरमा और XVIII सदी की शुरुआत में हरताल । 18 वीं शताब्दी के मध्य से, खोज की गई धातुओं की संख्या तेजी से बढ़ रही है और 20 वीं शताब्दी की शुरुआत तक 65 तक पहुंच गई, और 21 वीं शताब्दी की शुरुआत तक 96।
किसी भी रासायनिक उद्योग ने रासायनिक ज्ञान के विकास में इतना योगदान नहीं दिया जितना धातुओं के उत्पादन और प्रसंस्करण से जुड़ी प्रक्रियाओं में; उनका इतिहास रसायन विज्ञान के इतिहास के सबसे महत्वपूर्ण क्षणों से जुड़ा हुआ है। धातुओं के गुण इतने विशिष्ट होते हैं कि पहले से ही शुरुआती युग में, सोना, चांदी, तांबा, सीसा, टिन, लोहा और पारा सजातीय पदार्थों के एक प्राकृतिक समूह का गठन करते हैं, और "धातु" की अवधारणा सबसे पुरानी रासायनिक अवधारणाओं को संदर्भित करती है। हालांकि, अधिक या कम विशिष्ट रूप में उनकी प्रकृति पर विचार केवल मध्य युग में दिखाई देते हैं alchemists । सत्य विचार अरस्तू प्रकृति के बारे में: चार तत्वों (अग्नि, पृथ्वी, जल और वायु) से मौजूद हर चीज का निर्माण पहले से ही धातुओं की जटिलता को इंगित करता है; लेकिन ये विचार बहुत अस्पष्ट और सार थे। रसायनविदों में धातुओं की जटिलता की अवधारणा है और इसके परिणामस्वरूप, कुछ धातुओं को दूसरों में बदलने की क्षमता, उन्हें कृत्रिम रूप से बनाने की क्षमता में विश्वास, उनके विश्वदृष्टि की मूल अवधारणा है। यह अवधारणा धातुओं के रासायनिक परिवर्तनों से संबंधित तथ्यों के द्रव्यमान से एक प्राकृतिक निष्कर्ष है जो उस समय तक जमा हो गई थी। वास्तव में, धातु में एक ऑक्साइड में परिवर्तन हवा में साधारण संचय द्वारा पूरी तरह से अलग है और एक ऑक्साइड से एक धातु की रिवर्स तैयारी, दूसरों से कुछ धातुओं की वर्षा, मूल रूप से ली गई धातुओं की तुलना में अन्य गुणों वाले मिश्र धातुओं का गठन, और इसी तरह - यह सब कुछ लग रहा था उनकी प्रकृति की जटिलता को इंगित करें।
सोने के लिए धातुओं के वास्तविक रूपांतरण के लिए, इस की संभावना में विश्वास कई दृश्य तथ्यों पर आधारित था। सबसे पहले, सोने के समान एक रंग में मिश्र धातुओं का निर्माण, उदाहरण के लिए, कीमियागरों की आँखों में तांबा और जस्ता पहले से ही उन्हें सोने में बदल रहे थे। यह उन्हें लग रहा था कि केवल रंग बदलना आवश्यक था, और धातु के गुण भी भिन्न हो जाएंगे। विशेष रूप से, खराब तरीके से स्थापित प्रयोगों ने इस विश्वास में योगदान दिया, जब इस सोने के मिश्रण को आधार धातु में बदलने के लिए लिया गया। उदाहरण के लिए, पहले से ही 18 वीं शताब्दी के अंत में, एक कोपेनहेगन फार्मासिस्ट ने दावा किया कि आर्सेनिक के साथ जुड़े होने पर रासायनिक रूप से शुद्ध चांदी आंशिक रूप से सोने में बदल जाती है। इस तथ्य की पुष्टि एक प्रसिद्ध रसायनज्ञ ने की थी। गुइटन डी मोरोवो और बहुत शोर मचाया। इसके तुरंत बाद यह दिखाया गया कि प्रयोग के लिए इस्तेमाल किए जाने वाले आर्सेनिक में चांदी और सोने के निशान थे।
तब ज्ञात सात धातुओं के बाद से, कुछ रासायनिक परिवर्तनों से गुजरना आसान था, दूसरों को और अधिक कठिन, कीमियागरों ने उन्हें महान - पूर्ण और अज्ञान - अपूर्ण में विभाजित किया। पूर्व सोने और चांदी के थे, बाद वाले तांबा, टिन, सीसा, लोहा और पारा। उत्तरार्द्ध, महान धातुओं के गुणों को रखने, लेकिन एक ही समय में इसकी तरल अवस्था और अस्थिरता में सभी धातुओं से अलग, उस समय के बेहद व्यस्त वैज्ञानिकों, और कुछ ने इसे एक विशेष समूह में प्रतिष्ठित किया; उसके प्रति आकर्षित होने वाला ध्यान इतना महान था कि वे उन तत्वों के बीच पारे पर विचार करने लगे, जिनसे धातुएँ स्वयं बनती थीं, और यह ठीक है कि उन्होंने धातु के गुणों का वाहक देखा था। दूसरों के लिए कुछ धातुओं के संक्रमण की प्रकृति में अस्तित्व को स्वीकार करते हुए, परिपूर्ण करने के लिए अपूर्ण, कीमियावादियों ने माना कि सामान्य परिस्थितियों में यह परिवर्तन सदियों से बेहद धीमा है, और शायद खगोलीय पिंडों की रहस्यमय भागीदारी के बिना, जो उस समय इतनी बड़ी भूमिका के साथ श्रेय दिया गया था। और मनुष्य के भाग्य में। संयोग से, सात ज्ञात धातुएं थीं, साथ ही ज्ञात ग्रह भी थे, और इसने उनके बीच एक रहस्यमय संबंध का संकेत दिया। रसायनविदों के लिए, धातुओं को अक्सर ग्रह कहा जाता है; सोना कहलाता है सूरज चांदी - चाँद तांबा - शुक्र , टिन - बृहस्पति सीसा - शनि ग्रह लोहा - मंगल ग्रह और पारा - पारा । जब जिंक, बिस्मथ, एंटीमनी और आर्सेनिक की खोज की गई, तो शरीर ऐसे हैं जो सभी तरह के धातुओं के समान हैं, लेकिन जिनके पास धातु, मैलाबैलिटी के सबसे विशिष्ट गुणों में से एक है, खराब रूप से विकसित हैं, उन्हें एक विशेष समूह में बाहर निकाल दिया गया है - semimetals। 18 वीं शताब्दी के मध्य तक धातुओं में धातु का विभाजन और उचित रूप से अस्तित्व में था।
धातु की संरचना का निर्धारण शुरू में विशुद्ध रूप से सट्टा था। सबसे पहले, कीमियों ने स्वीकार किया कि वे दो तत्वों से बने थे - और गंधक । इस दृश्य की उत्पत्ति अज्ञात है, यह पहले से ही आठवीं शताब्दी में मौजूद है। पर GEBERIT धातुओं में पारा की उपस्थिति का प्रमाण यह है कि यह उन्हें घोल देता है, और इन समाधानों में उनका व्यक्तित्व गायब हो जाता है, पारा द्वारा अवशोषित होता है, जो कि पारा के साथ सामान्य रूप से एक चीज नहीं होने पर नहीं होता। इसके अलावा, सीसा के साथ पारे ने टिन के समान कुछ दिया। सल्फर के रूप में, शायद यह लिया गया था क्योंकि सल्फर यौगिकों को ज्ञात था जो धातुओं के समान थे। भविष्य में, ये सरल विचार, संभवतः धातुओं को कृत्रिम रूप से प्राप्त करने के असफल प्रयासों के कारण, बेहद जटिल और भ्रमित हो जाते हैं। कीमियागर की अवधारणाओं में, X-XIII सदियों के उदाहरण के लिए, पारा और सल्फर जिसमें से धातुएं बनती हैं, पारा और सल्फर नहीं थे जो कि अल्केमिस्ट के हाथों में थे। यह उनके लिए केवल कुछ समान था, विशेष गुण रखने; साधारण गंधक और पारे में मौजूद कुछ चीज़ों को अन्य शरीरों की तुलना में अधिक मात्रा में व्यक्त किया गया था। पारा के तहत, जो धातुओं का हिस्सा है, उन्होंने एक ऐसी चीज़ का प्रतिनिधित्व किया, जो एक धातु-प्रकार के समर्थन में उनकी अपरिवर्तनीयता, धातु की चमक, नमनीयता को एक शब्द में निर्धारित करता है; सल्फर का अर्थ धातुओं की परिवर्तनशीलता, क्षीणता और दहनशीलता का वाहक था। ये दोनों तत्व अलग-अलग अनुपात में धातुओं में थे और जैसा कि उन्होंने कहा, विभिन्न तरीकों से तय किया गया; इसके अलावा, वे शुद्धता की अलग-अलग डिग्री हो सकते हैं। गेबर के अनुसार, उदाहरण के लिए, सोने में पारा की एक बड़ी मात्रा और शुद्धता की उच्चतम डिग्री में सल्फर की एक छोटी मात्रा और सबसे निश्चित शामिल थे; टिन में, इसके विपरीत, उन्होंने बहुत सारे सल्फर और थोड़ा पारा ग्रहण किया, जो साफ नहीं थे, खराब रूप से तय किए गए और इतने पर। यह सब, निश्चित रूप से, वे उस समय के एकमात्र शक्तिशाली रासायनिक एजेंट के लिए धातुओं के एक अलग दृष्टिकोण को व्यक्त करना चाहते थे - आग। इन विचारों के आगे के विकास के साथ, दो तत्व - पारा और सल्फर - धातुओं की संरचना की व्याख्या करने के लिए रसायनविदों के लिए अपर्याप्त लग रहे थे; नमक उन्हें जोड़ा गया था, और कुछ आर्सेनिक। वे इसके द्वारा यह संकेत देना चाहते थे कि धातुओं के सभी परिवर्तनों के साथ कुछ गैर-अस्थिर, स्थिर रहता है। अगर प्रकृति में "आधार धातुओं के परिवर्तन को महान धातुओं में शताब्दियों का समय लगता है," तो रसायनविदों ने ऐसी स्थिति बनाने की कोशिश की, जिसमें पूर्णता, परिपक्वता की यह प्रक्रिया त्वरित और आसान हो। तत्कालीन चिकित्सा और फिर जीव विज्ञान के साथ रसायन विज्ञान के घनिष्ठ संबंध के कारण, धातुओं को बदलने का विचार स्वाभाविक रूप से संगठित निकायों के विकास और विकास के विचार से पहचाना गया था: संक्रमण, उदाहरण के लिए, सोने में सीसा, जमीन में फेंके गए अनाज से एक पौधे का निर्माण और, जैसा कि यह विघटित, किण्वन था। एक व्यक्ति में एक बीमार अंग की चिकित्सा - ये सभी एक सामान्य रहस्यमय जीवन प्रक्रिया, सुधार की विशेष घटना थे, और केवल प्रोत्साहन के कारण हुए थे। इससे यह कहे बिना चला जाता है कि रहस्यमय सिद्धांत, जो सोना प्राप्त करना संभव बनाता है, बीमारियों को ठीक करना था, पुराने मानव शरीर को एक युवा में बदल दें और इसी तरह। तो एक अद्भुत दार्शनिक के पत्थर की अवधारणा थी।
भूमिका के बारे में दार्शनिक का पत्थर बेस मेटल्स को नोबल में परिवर्तित करने में, सोने में उनके रूपांतरण के बारे में सभी संकेत मिलते हैं, थोड़ा चांदी के बारे में कहा जाता है। कुछ लेखकों के अनुसार, एक ही दार्शनिक का पत्थर धातुओं को चांदी और सोने में बदल देता है; दूसरों के अनुसार, इस पदार्थ के दो प्रकार हैं: एक परिपूर्ण, दूसरा कम परिपूर्ण, और यह अंतिम रूप से चांदी का उत्पादन करता है। परिवर्तन के लिए आवश्यक दार्शनिक के पत्थर की मात्रा के संबंध में, दिशाएं भी अलग हैं। एक में, इसका 1 हिस्सा धातु के 10,000,000 भागों को सोने में बदलने में सक्षम है, दूसरों में - 100 भाग और यहां तक \u200b\u200bकि केवल 2 भागों में। सोना प्राप्त करने के लिए, कुछ आधार धातु को पिघला दिया गया या पारा ले जाया गया और एक दार्शनिक का पत्थर वहां फेंक दिया गया; कुछ ने आश्वासन दिया कि परिवर्तन तुरंत होता है, जबकि अन्य - थोड़ा कम। धातुओं की प्रकृति और XVII सदी तक कई शताब्दियों तक सामान्य रूप से पकड़ में बदलने की उनकी क्षमता पर ये विचार, जब वे इस सब से तेजी से इनकार करना शुरू करते हैं, तब से इन सभी विचारों ने कई चारलातनों की उपस्थिति का कारण बना, जिन्होंने सोने को पाने के लिए भोला की उम्मीद का शोषण किया। विशेष रूप से, वह कीमियागर के विचारों से जूझता रहा बॉयल "मैं जानना चाहूंगा," वह एक जगह कहता है, "कैसे सोना पारा, सल्फर और नमक में विघटित हो सकता है; मैं इस अनुभव की लागत का भुगतान करने को तैयार हूं; मेरे लिए, मैं इसे हासिल नहीं कर सकता। ”
सदियों से फल-फूलने की कोशिशों के बाद, कृत्रिम रूप से धातुओं का उत्पादन करने की कोशिश की और 17 वीं शताब्दी तक जितने तथ्य जमा हुए, उदाहरण के लिए, दहन में हवा की भूमिका के बारे में, ऑक्सीकरण में धातु के वजन में वृद्धि, जो संयोगवश, मुझे अभी भी पता था Geber आठवीं शताब्दी में, धातु की मौलिक रचना का सवाल अंत के बहुत करीब लग रहा था; लेकिन रसायन विज्ञान में एक नया प्रवाह दिखाई दिया, जिसके परिणामस्वरूप एक फ्लॉजिस्टन सिद्धांत था, और इस प्रश्न का समाधान अभी भी लंबे समय तक विलंबित था।
उस समय के वैज्ञानिक दहन की घटनाओं में बहुत रुचि रखते थे। उस समय के दर्शन के मूल विचार से आगे बढ़ते हुए, कि निकायों के गुणों में समानता समान सिद्धांतों से आनी चाहिए, जो तत्व उन्हें बनाते हैं, यह माना गया था कि दहनशील शरीर एक सामान्य तत्व को घेरते हैं। जलने के कार्य को अपघटन का एक तत्व माना जाता था, तत्वों में क्षय; जबकि दहनशीलता का तत्व एक लौ के रूप में बाहर खड़ा था, जबकि अन्य बने रहे। तीन तत्वों, पारा, सल्फर और नमक से धातुओं के निर्माण पर कीमियों के दृष्टिकोण को पहचानने और धातु में उनके वास्तविक अस्तित्व को स्वीकार करते हुए, सल्फर को दहनशील सिद्धांत के रूप में मान्यता दी जानी थी। तब धातु के अन्य घटक, जाहिर है, धातु के शेषकरण को पहचानना था - "पृथ्वी", जैसा कि उन्होंने तब कहा था; इसलिए, इसका पारा से कोई लेना-देना नहीं है। दूसरी ओर, सल्फर, बाहर जलता है सल्फ्यूरिक एसिड , जो कई, जो कहा गया है, के आधार पर, सल्फर की तुलना में एक सरल शरीर माना जाता था, और प्राथमिक निकायों की संख्या में शामिल था। भ्रम और विरोधाभास था। बेकेर पुरानी अवधारणाओं को नए लोगों के साथ सामंजस्य बनाने के लिए, उन्होंने पृथ्वी की धातु में तीन ग्रेड के अस्तित्व को स्वीकार किया: वास्तव में "पृथ्वी", "दहनशील पृथ्वी" और "पारा पृथ्वी"। इन स्थितियों में स्टाल अपने सिद्धांत का प्रस्ताव रखा। उनकी राय में, ज्वलनशीलता की शुरुआत सल्फर या किसी अन्य ज्ञात पदार्थ नहीं है, लेकिन कुछ अज्ञात, उसके द्वारा नामित ज्वलनशीलता । धातुओं को माना जाता है कि वे फ्लॉजिस्टन और पृथ्वी से बने हैं; हवा में धातु का कैल्सीकरण फ्लॉजिस्टन की रिहाई के साथ होता है; कोयले का उपयोग करके उसकी भूमि से धातुओं की रिवर्स रसीद - एक पदार्थ जो फ्लॉजिस्टन में समृद्ध है - पृथ्वी के साथ फ्लॉजिस्टन के संयोजन का कार्य है। यद्यपि कई धातुएँ थीं और उनमें से प्रत्येक को, जब शांत किया गया था, अपनी जमीन दी थी, बाद वाला, एक तत्व के रूप में, एक था, इसलिए धातु का यह घटक फॉल्लिस्टन के समान काल्पनिक प्रकृति का था; हालाँकि, Stahl के अनुयायियों ने कभी-कभी "प्राथमिक भूमि" को भी ले लिया था क्योंकि वहाँ धातुएँ थीं। जब टुकड़ेवाला तंबाकू जब एसिड में धातुओं को भंग कर दिया हाइड्रोजन और इसके गुणों का अध्ययन किया (दहन को बनाए रखने में असमर्थता, हवा के साथ मिश्रण में इसकी विस्फोटकता, आदि), उन्होंने इसमें स्टाहल फ्लॉजिस्टन को मान्यता दी; धातुओं, उनकी अवधारणाओं के अनुसार, हाइड्रोजन और "पृथ्वी" से मिलकर बनता है। इस दृष्टिकोण को फ्लॉजिस्टन सिद्धांत के कई अनुयायियों द्वारा स्वीकार किया गया है।
फ्लॉजिस्टन सिद्धांत के स्पष्ट सामंजस्य के बावजूद, ऐसे प्रमुख तथ्य थे जो इसके साथ जुड़े नहीं हो सकते थे। हेबर यह भी जानता था कि जब जलाया जाता है तो वजन में वृद्धि होती है; इस बीच, स्टाल के अनुसार, उन्हें फ़्लॉजिस्टन को खोना होगा: जब फ़्लॉजिस्टन को "पृथ्वी" से फिर से जोड़ा जाता है, तो प्राप्त धातु का वजन "पृथ्वी" के वजन से कम होता है। इस प्रकार, यह पता चला कि फ्लॉजिस्टन के पास कुछ विशेष गुण होना चाहिए - नकारात्मक गुरुत्व। इस घटना को समझाने के लिए सभी मजाकिया परिकल्पनाओं के बावजूद, यह समझ से बाहर था और गूढ़ था।
जब ळवोइसिएर दहन में हवा की भूमिका का पता चला और पता चला कि जलने के दौरान धातुओं के वजन में लाभ हवा से धातुओं में ऑक्सीजन के अलावा होता है, और इस तरह स्थापित किया गया है कि धातुओं को जलाने का कार्य तत्वों में अपघटन नहीं है, लेकिन, इसके विपरीत, जुड़ने के कार्य, धातुओं की जटिलता का सवाल नकारात्मक तरीके से हल किया गया था। लवॉज़ियर के मुख्य विचार के आधार पर, धातुओं को सरल रासायनिक तत्वों को सौंपा गया था, सरल शरीर वे होते हैं जिनसे अन्य निकायों को अलग करना संभव नहीं था। सृष्टि के साथ रासायनिक तत्वों की आवधिक प्रणाली मेंडलीव धातु तत्वों ने इसमें अपना सही स्थान ले लिया।
यह भी देखें
नोट
संदर्भ
- एस.पी. वुकोलोव: // ब्रोकहॉस और एफ्रॉन एनसाइक्लोपीडिक शब्दकोश : 86 मात्राओं में (82 खंड और 4 अतिरिक्त)। - एसपीबी। , 1890-1907। (ऐतिहासिक भाग)
| आवर्त सारणी | |
|---|---|
| दिमित्री इवानोविच मेंडेलीव · आवधिक कानून · आइटम समूह | |
| प्रारूपों | कम · ब्लॉकों द्वारा · विस्तारित बढ़े हुए · इलेक्ट्रॉनिक कॉन्फ़िगरेशन · वैद्युतीयऋणात्मकता · विकल्प · तत्वों के समस्थानिक |
| आइटम सूची पर | नाम ·
शब्द-साधन (स्थानों के सम्मान में, खोजकर्ताओं के सम्मान में) · खुलने का समय ऑक्सीकरण अवस्था · की व्यापकता (आदमी में) · समस्थानिकों की स्थिरता · |


