27.07.2019
1 क्षार धातु। आप जानते हैं कि कैसे
विषय पर ग्रेड 9 में एक रसायन विज्ञान पाठ का सार:
"क्षार धातु के यौगिक और उनका उपयोग।"
लक्ष्यों: क्षार धातुओं और उनके यौगिकों के बारे में ज्ञान को सामान्य बनाने और व्यवस्थित करने के लिए; रोजमर्रा के जीवन और उत्पादन में इन यौगिकों के उपयोग से परिचित हों, जीवों के जीवन में उनका महत्व
पाठ के उद्देश्य:
1. पाठ के दौरान यह सुनिश्चित करने के लिए कि क्षार धातु के यौगिकों के रासायनिक गुणों का आत्मसात, रोजमर्रा के जीवन और उत्पादन में उनका उपयोग, और जीवों के जीवन में उनका महत्व।
सामान्य शैक्षिक और रासायनिक अभिकर्मक कौशल विकसित करना जारी रखें।
2. घटना के बीच कारण-प्रभाव संबंधों के बुनियादी दार्शनिक विचारों का गठन, एक क्षार धातु परमाणु की संरचना - एक साधारण पदार्थ के गुण - क्षार धातु यौगिकों के गुण और गुणों के आधार पर उनका अनुप्रयोग।
3. तुलना करने की क्षमता विकसित करें, अध्ययन किए गए तथ्यों को संक्षेप में दें, उत्तर देते समय तार्किक रूप से अपने विचार व्यक्त करें। स्कूली बच्चों की संज्ञानात्मक रुचि को विकसित करने के लिए, जीवन में अध्ययन की गई घटनाओं के आवेदन पर डेटा का उपयोग करना।
पाठ प्रकार: संयुक्त - आईसीटी का उपयोग करके नई सामग्री का अध्ययन।
उपकरण: पाठ्यपुस्तक, चाक, ब्लैकबोर्ड, कंप्यूटर, मीडिया प्रोजेक्टर, स्क्रीन, पाठ विषय प्रस्तुति, छात्रों के लिए पाठ प्रवाह चार्ट, रसायन (समाधान: सोडियम हाइड्रोक्साइड, हाइड्रोक्लोरिक एसिड, कॉपर सल्फेट, जस्ता हाइड्रोक्साइड, फेनोलेफेनिन) और प्रयोगशाला कांच के बने पदार्थ (टेस्ट ट्यूब रैक)।
प्रक्रिया
मैं .ऑर्गनाइजेशन मोमेंट.
द्वितीय । नई सामग्री सीखना।
1. "क्षारीय धातुओं" विषय पर पहले से अध्ययन की गई सामग्री का सत्यापन।
पहेलियों का अनुमान लगाएं:
1. वे आम तौर पर मिट्टी के तेल में संग्रहीत करते हैं, और वह पानी पर चलता है,
प्रकृति में, अब याद रखें,
फ्री कहीं मौजूद नहीं है
इसे लवण में खोलना संभव है
लपटें उससे पीली हो जाती हैं
और आप नमक से प्राप्त कर सकते हैं
डेवी को कैसे मिली।
हम किस तत्व की बात कर रहे हैं? (ना)
2. यह सख्ती से बाहर निकलता है
नमी से - शुद्ध हाइड्रोजन,
इसे बदल देता है
और दृढ़ता से ऑक्सीजन बुनता है।
पौधों में वह तत्व छिपा हुआ है
बैंगनी रंग के द्वारा
यह लवण में खुला हो सकता है।
हम किस तत्व की बात कर रहे हैं? (के)।
1. आखिरी पाठ में हम किन धातुओं से मिले?
2. उन्हें ऐसा क्यों कहा जाता है?
3. सभी क्षार धातुओं के परमाणुओं की संरचना में सामान्य विशेषता क्या है?
संबंधित परीक्षण: क्षार धातु.
1. क्षार धातुओं पर लागू नहीं होता है: ए) रूबिडियम; ग) पोटेशियम; बी) सीज़ियम; घ) तांबा।
2. इलेक्ट्रॉनिक सूत्र) 2) 8) 8) 1 तत्व से मेल खाती है: ए) लिथियम; ग) पोटेशियम; बी) सोडियम;
3. परमाणु प्रभार बढ़ाने के साथ मुख्य उपसमूह के समूह I के तत्वों की परमाणु त्रिज्या:
ए) समय-समय पर बदलता है; ग) नहीं बदलता है; बी) बढ़ता है;
4. क्षारीय धातुएं बहुत मजबूत होती हैं:
क) ऑक्सीकरण गुण; ग) संपत्तियों को कम करना; बी) एम्फोटेरिक गुण;
5 .. क्षार धातुओं के भौतिक गुण लागू नहीं होते हैं:
क) चांदी-सफेद; बी) नरम और हल्का; डी) दुर्दम्य।
6. पानी के साथ मुख्य उपसमूह के समूह I के तत्वों की बातचीत में,
ए) एसिड; बी) क्षार और हाइड्रोजन जारी किया जाता है; d) नमक।
7. सोडियम और पोटेशियम केरोसीन में जमा होते हैं क्योंकि वे:
क) एक तीखी गंध है; बी) आसानी से हवा में ऑक्सीकरण कर रहे हैं;
आत्म-नियंत्रण: कोई त्रुटि नहीं - "5", 1.2 त्रुटियां - "4", 3 त्रुटियां - "3", अधिक - "2"
उत्तर: 1 - 2 - 3 में - 4 - 5 में - 6 - 6 7 - बी।
आत्म-नियंत्रण: कोई त्रुटि नहीं - "5", 1.2 त्रुटियां - "4", 3.4 त्रुटियां - "3", अधिक - "2"
2. ज्ञान का बोध.
क्या प्रकृति में मुक्त रूप में क्षार धातुओं से मिलना संभव है? क्यों?
मान लीजिए, प्रकृति में उन्हें किन यौगिकों के रूप में पाया जा सकता है?
प्रकृति में, क्षार धातुएं केवल यौगिकों के रूप में पाई जाती हैं।
Na और K स्वाभाविक रूप से क्लोराइड, सल्फेट्स, सिलिकेट्स, आदि के रूप में होते हैं।
ली, आरबी, सीएस विभिन्न खनिजों का हिस्सा हैं।
Fr रेडियोधर्मी अयस्कों में पाया जाता है Ac और U।
मेज पर: क्षार धातुओं (सोडा, नमक, उंगली बैटरी, साबुन) के यौगिकों से युक्त वस्तुएं और एक प्रश्न पूछते हैं।
इन वस्तुओं को देखो। आपको क्या लगता है उन्हें एकजुट करता है?
1 आनुवंशिक लिंक क्या है?
2. सोडियम की एक आनुवंशिक श्रृंखला बनाएं।
ना → ना २ ओ → २ नाहो → न २ सीओ ३
3. यौगिकों के किस वर्ग में क्षार धातुएँ होती हैं? उनके गुणों पर विचार करें।
सामग्री की व्याख्या करने और स्लाइड्स को देखने के क्रम में, छात्रों ने गुणों और अनुप्रयोगों का खुलासा करते हुए योजना के अनुसार नोट रखे।
क्षार धातु ऑक्साइड
कठोर, सफेद, आसानी से घुलनशील।
बी) रासायनिक गुण; छात्र एक नोटबुक में लिखते हैं: क्षार धातु ऑक्साइड विशिष्ट बुनियादी ऑक्साइड हैं। सभी बुनियादी ऑक्साइड की तरह, क्षार धातु के ऑक्साइड एसिड के साथ, एसिड ऑक्साइड के साथ, पानी के साथ प्रतिक्रिया करते हैं।
बोर्ड पर और नोटबुक में लोग एक उदाहरण के रूप में सोडियम ऑक्साइड का उपयोग करके रासायनिक प्रतिक्रियाओं के समीकरण लिखते हैं:
ना 2 ओ + एच 2 ओ → 2 नोहा;
ना २ ओ + सीओ २ → ना २ सीओ ३;
ना २ ओ + एच २ सीओ ३ → ना २ सीओ ३ + एच २ ओ
क्षार धातु हाइड्रॉक्साइड्स
.
ए) भौतिक गुण; छात्र नोटबुक गुणों में लिखते हैं: कठोर, सफ़ेद, अच्छी तरह से घुलनशील, ऊष्मीय रूप से स्थिर, खुरचना कपड़े और कागज।
b) रासायनिक गुण
सुरक्षा प्रशिक्षण जब प्रयोगशाला काम कर रही हो।
सोडियम हाइड्रॉक्साइड के रासायनिक गुण।
उद्देश्य: प्रयोगात्मक रूप से एक उदाहरण के रूप में हाइड्रोक्साइड का उपयोग करके क्षार धातुओं के रासायनिक गुणों को साबित करना सोडियम।
निर्देश मैनुअल
एक साफ ट्यूब में सोडियम हाइड्रॉक्साइड डालो, फेनोल्फथेलिन की कुछ बूँदें जोड़ें। आप क्या देख रहे हैं?
उसी ट्यूब में हाइड्रोक्लोरिक एसिड समाधान जोड़ें। आप क्या देख रहे हैं? प्रतिक्रिया समीकरण लिखिए।
NaOH + HCl → NaCl + H 2 O बोर्ड पर और नोटबुक में लोग आयनिक रूप में रासायनिक प्रतिक्रिया समीकरण लिखते हैं।
सोडियम हाइड्रॉक्साइड को एक साफ ट्यूब में डालें और कॉपर सल्फेट घोल डालें। आप क्या देख रहे हैं? प्रतिक्रिया समीकरण लिखिए।
2NaOH + CuSO 4 → Na 2 SO 4 + Cu (OH) 2 बोर्ड पर और नोटबुक में लोग आयनिक रूप में रासायनिक प्रतिक्रिया समीकरण लिखते हैं।
क्षार धातु हाइड्रॉक्साइड के रासायनिक गुणों के बारे में एक निष्कर्ष निकालें।
क्षार धातु हाइड्रॉक्साइड्स एसिड, लवण) के साथ प्रतिक्रिया करते हैं - स्लाइड नंबर 5।
सोडियम हाइड्रोक्साइड - NaOH - कास्टिक सोडा, कास्टिक सोडा, कास्टिक।
पोटेशियम हाइड्रॉक्साइड - KOH - पोटेशियम हाइड्रॉक्साइड।
NaOH और कोह - कास्टिक क्षार, कपड़े और कागज। छात्रों का रिकॉर्ड:आवेदन: कृत्रिम रेयान के लिए में साबुन और एसएमएस, सौंदर्य प्रसाधन, दवाओं, आदि का उत्पादन।
क्षार लवण
.
भौतिक गुण। छात्र एक नोटबुक में गुण लिखते हैं ठोस क्रिस्टलीय पदार्थ, लगभग सभी पानी में घुलनशील होते हैं।
पाठ्यपुस्तक पाठ के साथ स्वतंत्र कार्य।
आवेदन: स्लाइड नंबर 5 से तालिका में भरना। पाठ्यपुस्तक पी। 56 - 57 पर काम करें
नमक का सूत्र
नाम
आवेदन
नाहको ३
के 2 सीओ 3
सोडियम क्लोराइड
ना 2 एसओ 4 H 10 एच 2 ओ
ना २ सीओ ३ H १० एच २ ओ
जीवों के जीवन में महत्व - स्लाइड नंबर 6।
विषय पर छात्र का संदेश: "जीवों के जीवन में क्षार धातु के यौगिकों का मूल्य।"
सोडियम और पोटेशियम आयन एक बड़ी जैविक भूमिका निभाते हैं: Na + रक्त और लसीका में पाया जाने वाला मुख्य बाह्य आयन है, और K + मुख्य अंतःकोशिकीय आयन है। "काम" एक साथ। इन आयनों की सांद्रता का अनुपात एक जीवित जीव में रक्तचाप को नियंत्रित करता है और जड़ों से पौधों की पत्तियों तक नमक के समाधान को सुनिश्चित करता है। पोटेशियम आयन - हृदय की मांसपेशियों के काम का समर्थन करते हैं, गठिया के साथ मदद करते हैं, आंत्र समारोह में सुधार करते हैं। पोटेशियम यौगिक - सूजन को खत्म करते हैं।
वी फिक्सिंग
छठी। पाठ का सारांश। ग्रेडिंग।
पाठ सारांश:
ऑक्साइड धातुओं के ऑक्साइड, हाइड्रॉक्साइड के लिए कौन से भौतिक और रासायनिक गुण हैं?
हाइड्रॉक्साइड और क्षार धातु के लवण कहां उपयोग किए जाते हैं?
अतिरिक्त सामग्री। यह दिलचस्प है।
कार्य: प्राचीन ग्रीस में, गर्म मौसम में लंबी यात्राओं से पहले, सैनिकों को रोटी, नमकीन, और पानी से धोया गया एक टुकड़ा खाने की सिफारिश की गई थी?
इलेक्ट्रोलाइट आयन आसानी से हाइड्रेटेड होते हैं, इसलिए शरीर में सोडियम क्लोराइड जाल पानी।
उद्देश्य: एस्किमो बहुत कम नमक क्यों खाते हैं?
एक वैज्ञानिक सिद्धांत के अनुसार, पृथ्वी पर रहने वाले सभी जानवर, जिनमें मनुष्य भी शामिल हैं, जीवों के वंशज हैं जो समुद्र में दिखाई दिए और रहते थे। इन प्राणियों के शरीर का द्रव रचना में समुद्री जल था। भूमि पर जाने के बाद, उन्होंने अपने शरीर के तरल पदार्थ के रूप में समुद्र के पानी को बचाया। लेकिन प्रकृति अपने प्राकृतिक रूप में पर्याप्त मात्रा में नमक के साथ जीवित जीवों को प्रदान करने में सक्षम नहीं है। चूंकि नमक पानी में घुल जाता है, इसलिए इसका एक महत्वपूर्ण हिस्सा बारिश के पानी से नदियों, समुद्रों और महासागरों में बह जाता है। नतीजतन, जमीन पर उगने वाले पौधों में पर्याप्त नमक नहीं होता है। इसीलिए पौधों को खिलाने वाले पशुओं को नमक की आवश्यकता होती है। हर दिन, शरीर नमक युक्त तरल पदार्थ की एक निश्चित मात्रा खो देता है, और पौधे खाद्य पदार्थ इसके लिए नहीं बनाते हैं। अन्य जानवरों को खिलाने वाले जानवरों को अतिरिक्त नमक की आवश्यकता नहीं होती है। उन्हें अपने पीड़ितों के जीवों से जो नमक चाहिए वह मिलता है। एस्किमो मुख्य रूप से मांस खाते हैं, इसलिए नमक की उनकी जरूरत बहुत कम है।
कार्य: हाल के दशकों में इंग्लैंड में सेरेब्रोवास्कुलर बीमारी से मृत्यु दर में कमी क्यों आई है?
इसका कारण ताजे फल और सब्जियों की बढ़ती खपत है। ताजी सब्जियों और फलों में हमेशा पोटेशियम और थोड़ा सोडियम होता है। सोडियम शरीर में पानी को बनाए रखता है, जिससे रक्तचाप बढ़ता है, और इसके विपरीत पोटेशियम, इसे कम करने में मदद करता है। इसीलिए, विशेष रूप से सेब में सब्जियों, फलों की खपत में वृद्धि को मस्तिष्क संबंधी बीमारियों की रोकथाम के लिए एक आवश्यक उपाय माना जा सकता है।
जहां बिक्री के लिए लोगों में प्यार है .
नमक का उपयोग भोजन को खराब होने और सड़ने से बचाने के लिए किया जाता है। भोजन को बचाने के लिए (जब रेफ्रिजरेटर और फ्रीजर नहीं थे), नमक का उपयोग किया गया था। नमकीन से सब्जियों की कोशिश करने के बाद, लोगों ने नमक, किण्वन और ताजी सब्जियों को खाना शुरू कर दिया। एक व्यक्ति को हर चीज को नमक करने के लिए इस्तेमाल किया जाता है, ताकि वह कुछ बीमारियों के साथ तैयार होने के लिए तैयार हो, बस नमक रहित आहार पर स्विच न करें। धीरे-धीरे, बिना कोशिश किए भी सभी भोजन को नमक करने की आदत विकसित की गई।
SALT के बहुत सारे - LITTLE POTASSIUM, LITTLE POTASSIUM - बहुत सारे
नमक का प्रश्न पोटेशियम-सोडियम संतुलन का मामला है। यह शरीर में अत्यंत महत्वपूर्ण है। पोटेशियम और सोडियम कोशिकाओं में उनकी उपस्थिति पर लगातार बहस कर रहे हैं। सोडियम क्लोराइड में पोटेशियम नहीं है, यह पूरी तरह से सोडियम है। हमारे शरीर को पोटेशियम की सख्त जरूरत है, जो सोडियम से 4 गुना अधिक होना चाहिए। शरीर हर जगह पोटेशियम एकत्र करता है, लेकिन टेबल नमक का अत्यधिक उपयोग इसके सभी प्रयासों को कम कर देता है। इसलिए, नमक के अधिक सेवन के साथ, पोटेशियम की कमी होती है, जो समय के साथ कई बीमारियों की ओर ले जाती है: शारीरिक और मानसिक थकान, खराब नींद, ऐंठन, जोड़ों का दर्द।
अतिरिक्त सोडियम (नमक) दिल को अधिभारित करता है। पता लगाना चाहते हैं कि क्या आप बहुत अधिक नमक खाते हैं? दर्पण पर जाएं: परितारिका के चारों ओर एक सफेद चक्र नमक के अत्यधिक सेवन का संकेत देता है।
पोटेशियम हाइड्रॉक्साइड
कास्टिक पोटेशियम का उपयोग उर्वरकों, सिंथेटिक रबर, बैटरी, अभिकर्मकों के लिए इलेक्ट्रोलाइट्स के उत्पादन के लिए किया जाता है, और इसका उपयोग दवा उद्योग और अर्थव्यवस्था के अन्य क्षेत्रों में किया जाता है।
कास्टिक पोटेशियम इस प्रकार के परिवहन पर माल की ढुलाई के लिए नियमों के अनुसार सड़क द्वारा रेल द्वारा ले जाया जाता है।
कास्टिक पोटेशियम को कसकर बंद कंटेनर में संग्रहीत किया जाता है, जैसा कि यह हवा में "फैलता है", इससे नमी को अवशोषित करता है।
इसका पारंपरिक नाम "कास्टिक पोटेशियम" जीवित ऊतक पर इस पदार्थ के संक्षारक प्रभाव को दर्शाता है। यदि कास्टिक पोटेशियम त्वचा पर मिलता है, तो रासायनिक जलन संभव है।
हल्के साबुन कास्टिक पोटेशियम के साथ तेल और वसा के saponification द्वारा प्राप्त किए जाते हैं। इन सभी साबुनों में एक नरम मलाईदार स्थिरता होती है।
कास्टिक सोडा।
सबसे आम क्षार। प्रति वर्ष दुनिया में 57 मिलियन टन से अधिक कास्टिक क्षार का उत्पादन और खपत होती है।
कास्टिक सोडा का उपयोग विभिन्न प्रकार के उद्योगों में और घरेलू उपयोग के लिए किया जाता है:
कागज, गत्ता, कृत्रिम फाइबर, लकड़ी-फाइबर बोर्डों के उत्पादन में लुगदी और कागज उद्योग में।
साबुन, शैम्पू और अन्य डिटर्जेंट के निर्माण में वसा के saponification के लिए।
रासायनिक उद्योगों में - एसिड और एसिड ऑक्साइड को बेअसर करने के लिए, रासायनिक अभिक्रियाओं में अभिकर्मक या उत्प्रेरक के रूप में, आदि।
कास्टिक सोडियम (सोडियम हाइड्रॉक्साइड) एक कास्टिक और संक्षारक पदार्थ है। यह द्वितीय खतरा वर्ग के पदार्थों को संदर्भित करता है। इसलिए, इसके साथ काम करते समय, देखभाल की जानी चाहिए।
त्वचा, श्लेष्म झिल्ली और आंखों के संपर्क के मामले में, गंभीर रासायनिक जलन बनते हैं। यदि श्लेष्म सतह कास्टिक क्षार के संपर्क में आते हैं, तो प्रभावित क्षेत्र को पानी की एक धारा के साथ धोना आवश्यक है, और यदि यह एसिटिक एसिड के कमजोर समाधान के संपर्क में आता है।
लिथियम पर - सितारों के लिए
सेल फोन, पॉकेट गैजेट और लैपटॉप के निर्माता इस धातु की सख्त जरूरत है। परमाणु ऊर्जा बड़ी मात्रा में लिथियम (ली) का उपभोग करती है; सिद्धांतकारों द्वारा गणना के अनुसार, यह यह क्षार धातु है जो थर्मोन्यूक्लियर ऊर्जा की कुंजी प्रदान कर सकती है। एक शक्तिशाली साइकोट्रोपिक पदार्थ होने के नाते, ली का उपयोग सैन्य और अनुप्रयुक्त मनोरोग में किया जाता है (और मानव मानस पर ली के प्रभाव की प्रकृति को पूरी तरह से समझा नहीं गया है)। लिथियम बम का उपयोग हाइड्रोजन बम में काम करने वाले पदार्थ के रूप में और विस्फोटक शक्ति नियामक के रूप में किया जाता है।
गहरे अंतरिक्ष अन्वेषण के लिए भी इस धातु की आवश्यकता होती है।
पाठ के लिए छात्रों के लिए वर्कफ़्लो
विषय: क्षार धातु यौगिक।
कसौटी
हाइड्राइड। सबसे स्थिर लिथियम हाइड्राइड, जो आसानी से गर्म लिथियम से अधिक हाइड्रोजन को पारित करके प्राप्त किया जाता है। LiH एक सफेद क्रिस्टलीय पाउडर होता है, जो कि 680 ° C के गलनांक के साथ होता है। उच्च तापमान पर, LiH अत्यंत प्रतिक्रियाशील होता है। पानी से सख्ती से विघटित:
LiH + H 2 O \u003d LiOH + H 2
आक्साइड। सबसे स्थिर ली 2 ओ है। लिथियम और सोडियम ऑक्साइड सफेद हैं, बाकी पीले हैं। इसके अलावा, तत्व की बढ़ती सीरियल संख्या के साथ रंग की तीव्रता बढ़ जाती है।
पेरोक्साइड। वे अधिक ऑक्सीजन में धातुओं को जलाने से प्राप्त होते हैं। क्षार धातु पेरोक्साइड के बाद से हाइड्रोजन पेरोक्साइड के डेरिवेटिव माना जा सकता है वे हाइड्रोजन पेरोक्साइड बनाने के लिए एसिड और पानी के साथ बातचीत करते हैं:
एम 2 ओ 2 + एच 2 एसओ 4 \u003d एम 2 एसओ 4 + एच 2 ओ 2
एम 2 ओ 2 + 2 एच 2 ओ \u003d 2 एमओएच + एच 2 ओ 2
सोडियम पेरोक्साइड का सबसे बड़ा महत्व है, जिसका उपयोग संलग्न स्थानों में ऑक्सीजन का उत्पादन करने के लिए किया जाता है (उदाहरण के लिए, एक पनडुब्बी):
2Na 2 O 2 + 2CO 2 \u003d 2Na 2 CO 3 + 2O 2
हाइड्रॉक्साइड। तकनीक को कास्टिक क्षार, (NaOH - कास्टिक सोडा, KOH - कास्टिक पोटेशियम) कहा जाता है। ये रंगहीन, फ्युसिबल पदार्थ होते हैं। पिघले हुए राज्य में वे कांच, चीनी मिट्टी के बरतन, प्लेटिनम के साथ बातचीत करते हैं। इसलिए, क्षार के पिघलने को चांदी या लोहे के क्रूस में किया जाता है, जिसके साथ वे बातचीत नहीं करते हैं। उच्च गर्मी उत्पादन के साथ हाइड्रॉक्साइड पानी में आसानी से घुलनशील होते हैं।
हाइड्रॉक्साइड निम्नलिखित तरीकों से तैयार किए जाते हैं:
क) पानी के साथ धातुओं या आक्साइड की बातचीत:
ली 2 ओ + एच 2 ओ \u003d 2 एलआईओएच
यह प्रतिक्रिया केवल बहुत शुद्ध हाइड्रोक्साइड्स का उत्पादन करने के लिए उपयोग की जाती है।
ख) कास्टिक सोडा के उत्पादन के लिए कास्टाइजेशन प्रतिक्रिया सबसे पुराना ज्ञात तरीका है। इस विधि में उबलते समय कैल्शियम हाइड्रॉक्साइड (स्लेक्ड चूना) के साथ सोडा के घोल का उपचार किया जाता है। जिसके परिणामस्वरूप अघुलनशील कैल्शियम कार्बोनेट को फ़िल्टर किया जाता है या उससे एक स्पष्ट तरल निकाला जाता है:
Na 2 CO 3 + Ca (OH) 2 \u003d 2NaOH + CaCO 3
परिणामी सोडियम हाइड्रॉक्साइड घोल वाकुओ में वाष्पीकरण द्वारा केंद्रित था। ठोस सोडियम हाइड्रोक्साइड को पानी को पूरी तरह से हटाने के लिए 500 ° C पर पिघलाया गया और NaOH युक्त 3-4% Na 2 CO 3 प्राप्त किया गया। इस तरह से प्राप्त NaOH को "कास्टिक सोडा" कहा जाता है।
ग) जलीय घोल में क्षार धातु क्लोराइड्स के इलेक्ट्रोलिसिस NaOH और KOH के एक साथ क्लोरीन के उत्पादन के लिए एक आधुनिक औद्योगिक विधि है। जब एक NaCl समाधान को निष्क्रिय इलेक्ट्रोड (प्लैटिनम, ग्रेफाइट) के साथ इलेक्ट्रोलिसिस के अधीन किया जाता है, तो कैथोड में एनोड और हाइड्रोजन में क्लोरीन जारी किया जाता है। Na + आयन और OH - आयन कैथोड स्थान में जमा होते हैं, जो NaOH का निर्माण करते हैं।
डी) ऑक्साइड के साथ क्षार धातु कार्बोनेट का संलयन और बाद में जल वाष्प के साथ मिश्र धातु का उपचार:
Fe 2 O 3 + Na 2 CO 3 \u003d 2NaFeO 2 + CO 2
2NaFeO 2 + H 2 O \u003d 2NaOH + Fe 2 O 3
रसायन उद्योग में डाई, चश्मा, साबुन, कागज, कृत्रिम रेशे और दवाइयों के लिए सबसे महत्वपूर्ण कच्चा माल है।
नमक। NaCl और KCl प्रकृति में बड़ी मात्रा में पाए जाते हैं। NaCl (टेबल नमक) समुद्र के पानी में (औसतन 2.7%) और कई किलोमीटर तक की क्षमता के साथ जमा राशि में सेंधा नमक के रूप में पाया जाता है। शुद्ध NaCl और KCl को पुनर्नवीनीकरण द्वारा प्राकृतिक क्लोराइड से प्राप्त किया जाता है। लिथियम लवण प्राकृतिक लिथियम कार्बोनेट से प्राप्त होते हैं। रुबिडियम और सीज़ियम के लवण प्राप्त करना कठिनाइयों से जुड़ा हुआ है, क्योंकि उनकी घुलनशीलता पोटेशियम लवण की घुलनशीलता के बहुत करीब है। आमतौर पर, माँ के कारनेलाइट के बाद बची हुई शराब को पुनः उपयोग में लाया जाता है और फिटकरी रूबिडियम और सीज़ियम को उनसे अलग कर दिया जाता है, जिसे पुनः क्रिस्टलीकरण द्वारा शुद्ध किया जाता है। अल्कोहल में अपने कार्बोनेट की विभिन्न घुलनशीलता का उपयोग करके सीज़ियम से रुबिडियम को अलग किया जाता है।
नाइट्रेट्स में से, NaNO 3 और KNO 3 व्यावहारिक महत्व के हैं। तकनीकी नाम सोडियम नाइट्रेट और पोटेशियम नाइट्रेट हैं। दोनों लवण खनिज उर्वरकों के रूप में उपयोग किए जाते हैं। KNO 3 का उपयोग काले पाउडर के उत्पादन के लिए भी किया जाता है (NaNO 3 का उपयोग इसकी हाइज्रोस्कोपिसिटी के कारण नहीं किया जाता है)।
कार्बोनिक एसिड H 2 CO 3 क्षार धातु कार्बोनेट की दो पंक्तियाँ देता है, अम्लीय (MHCO 3) और माध्यम (M 2 CO 3)। अम्लीय कार्बोनेट (बाइकार्बोनेट, बाइकार्बोनेट) लिथियम को छोड़कर सभी क्षार के लिए जाना जाता है। लिथियम कार्बोनेट के अपवाद के साथ, सभी तटस्थ कार्बोनेट पानी में अत्यधिक घुलनशील हैं। ना 2 सीओ 3 - सोडा, कभी-कभी कुछ झीलों के पानी में और खनिज स्प्रिंग्स में प्रकृति में पाया जाता है। सोडा अमोनिया तरीका प्राप्त करें: सोडियम क्लोराइड का एक समाधान अमोनिया और कार्बन डाइऑक्साइड से संतृप्त है। इस मामले में, NaHCO 3 उपसर्ग करता है, क्योंकि सोडा एनएच 4 सीएल की तुलना में अधिक घुलनशील है:
NaCl + H 2 O + CO 2 + NH 3 \u003d NaHCO 3 4 + NH 4 Cl
2 नाहो 3 → ना 2 सीओ 3 + सीओ 2 + एच 2 ओ
के 2 सीओ 3 - पोटाश, हीड्रोस्कोपिक सफेद पाउडर, पानी में अत्यधिक घुलनशील। पोटेशियम हाइड्रॉक्साइड के कार्बनीकरण द्वारा प्राप्त करें:
2KOH + CO 2 \u003d K 2 CO 3 + H 2 O
पोटाश का उपयोग साबुन और कांच के उद्योगों में, रंगाई और विरंजन ऊन के लिए, पोटेशियम साइनाइड के उत्पादन में, कार्बनिक संश्लेषण में किया जाता है।
सल्फ्यूरिक एसिड क्षार धातु सल्फेट्स की दो पंक्तियाँ देता है - अम्लीय और मध्यम।
सोडियम क्लोराइड और सल्फ्यूरिक एसिड से हाइड्रोक्लोरिक एसिड के उत्पादन में ना 2 एसओ 4 को एक उप-उत्पाद के रूप में प्राप्त किया जाता है। जलीय विलयन से, सोडियम सल्फेट Na 2 SO 4 के रूप में क्रिस्टलीकृत होता है। 10H 2 O, कला में इस क्रिस्टलीय हाइड्रेट को Glauber नमक कहा जाता है। चिकित्सा में, सूती कपड़ों की रंगाई के लिए उपयोग किया जाता है।
· · ·Kal 96. क्षारीय
क्षार धातुओं के समूह में धातुओं की निम्नलिखित श्रृंखला शामिल है; Li, Na, K, Rb, Cs, Fr. वे आवधिक प्रणाली के समूह के मुख्य उपसमूह I में हैं।
ये सभी समान हैं कि बाहरी इलेक्ट्रॉन परत (तालिका 18) पर उनका एक इलेक्ट्रॉन है /।
क्षारीय एस-तत्व हैं। इसी अवधि के अन्य तत्वों की तुलना में, एक क्षार धातु परमाणु की बाहरी इलेक्ट्रॉन परत, नाभिक से सबसे दूर होती है, अर्थात्, इसी अवधि के अन्य तत्वों के परमाणुओं की त्रिज्या की तुलना में क्षार धातु परमाणु की त्रिज्या सबसे बड़ी होती है। संबंध में
|
कोर चार्ज |
ऊर्जा स्तरों पर इलेक्ट्रॉनों की संख्या |
परमाणु त्रिज्या |
|||||||
इसके साथ, क्षार धातु के परमाणुओं की बाहरी परत का वैलेंस इलेक्ट्रॉन आसानी से टूट जाता है, जिससे वे सकारात्मक रूप से चार्ज किए गए आयनों में बदल जाते हैं। यह इस तथ्य के कारण है कि अन्य तत्वों के साथ क्षार धातुओं के यौगिकों का निर्माण आयनिक बंधन के प्रकार के अनुसार किया जाता है।
रेडॉक्स प्रतिक्रियाओं में, वे मजबूत कम करने वाले एजेंटों के रूप में व्यवहार करते हैं, और यह क्षमता परमाणु नाभिक के बढ़ते प्रभार के साथ धातु से धातु तक बढ़ जाती है।
Sodium 97. सोडियम
सोडियम परमाणु का इलेक्ट्रॉनिक विन्यास 2 2s 2 2p 6 3s 1। इसकी बाहरी परत की संरचना:
सोडियम प्रकृति में केवल लवण के रूप में पाया जाता है। सबसे आम सोडियम नमक सोडियम क्लोराइड NaCl है, साथ ही खनिज सिल्विनाइट KCl · NaCl और कुछ सल्फेट लवण हैं, उदाहरण के लिए, Glauber नमक Na2SO4 · 10H2O, जो कैस्पियन सागर कारा-बोगाज़-गोल में बड़ी मात्रा में पाया जाता है।
इस नमक के पिघलने के इलेक्ट्रोलिसिस द्वारा सोडियम क्लोराइड से सोडियम धातु प्राप्त की जाती है। इलेक्ट्रोलिसिस के लिए अधिष्ठापन अंजीर में दिखाया गया है। 76. इलेक्ट्रोड को पिघले हुए नमक में उतारा जाता है। एनोड और कैथोड स्पेस को एक डायफ्राम द्वारा अलग किया जाता है, जो गठित सोडियम को अलग करता है ताकि रिवर्स प्रतिक्रिया न हो। एक सकारात्मक सोडियम आयन कैथोड से एक इलेक्ट्रॉन प्राप्त करता है और एक तटस्थ सोडियम परमाणु में बदल जाता है। तटस्थ सोडियम परमाणुओं को पिघला हुआ धातु के रूप में कैथोड पर एकत्र किया जाता है। कैथोड पर होने वाली प्रक्रिया को निम्नलिखित योजना द्वारा दर्शाया जा सकता है:
ना + + ना ०।
चूंकि इलेक्ट्रॉनों को गोद लेना कैथोड पर होता है, और परमाणु या आयन द्वारा इलेक्ट्रॉनों की किसी भी स्वीकृति में कमी होती है, कैथोड पर सोडियम आयन कम हो जाते हैं। एनोड पर, क्लोरीन आयन इलेक्ट्रॉनों का दान करते हैं, अर्थात, ऑक्सीकरण की प्रक्रिया और मुक्त होने की प्रक्रिया
क्लोरीन गैस, जिसे निम्नलिखित योजना द्वारा दर्शाया जा सकता है:
सीएल - ई - → क्लस्टर 0
परिणामी धातु सोडियम में एक चांदी-सफेद रंग होता है और इसे आसानी से चाकू से काट दिया जाता है। सोडियम में एक टुकड़ा, अगर कट के तुरंत बाद जांच की जाती है, तो एक उज्ज्वल धातु चमक होती है, लेकिन धातु के अत्यंत तीव्र ऑक्सीकरण के कारण जल्दी से मर जाता है।
![]()
अंजीर। 76. पिघले हुए सोडियम क्लोराइड के इलेक्ट्रोलिसिस के लिए स्थापना आरेख।
1 - रिंग कैथोड; 2 - एनोड स्पेस से गैसीय क्लोरीन को हटाने की घंटी
यदि सोडियम लगभग 180 डिग्री के तापमान पर ऑक्सीजन की एक छोटी मात्रा में ऑक्सीकरण होता है, तो सोडियम ऑक्साइड प्राप्त होता है:
4Na + O2 \u003d 2Na2O।
ऑक्सीजन में जलने पर, सोडियम पेरोक्साइड प्राप्त होता है:
2Na + O2 \u003d Na2O2।
इस मामले में, चमकदार चमकदार लौ के साथ सोडियम जलता है।
सोडियम के आसान और त्वरित ऑक्सीकरण के कारण, इसे मिट्टी के तेल या पैराफिन की एक परत के तहत संग्रहीत किया जाता है, और यह बेहतर होता है, क्योंकि एक निश्चित मात्रा में हवा मिट्टी के तेल और सोडियम ऑक्सीकरण में घुल जाती है, हालांकि धीरे-धीरे, अभी भी होती है।
सोडियम हाइड्रोजन के साथ एक यौगिक दे सकता है - NaH हाइड्राइड, जिसमें यह 1 के ऑक्सीकरण की स्थिति को प्रदर्शित करता है। यह एक नमक जैसा यौगिक है, जो रासायनिक बंधन की प्रकृति और ऑक्सीकरण की डिग्री के समूह IV-VII के मुख्य उपसमूह के तत्वों के अस्थिर हाइड्राइड से भिन्न होता है।
सोडियम धातु न केवल ऑक्सीजन और हाइड्रोजन के साथ, बल्कि कई सरल और जटिल पदार्थों के साथ भी प्रतिक्रिया कर सकती है। उदाहरण के लिए, सल्फर के साथ मोर्टार में पीसते समय, सोडियम इसके साथ हिंसक रूप से प्रतिक्रिया करता है:
2Na + S \u003d Na2S
प्रकोप के साथ प्रतिक्रिया होती है, इसलिए मोर्टार को आंखों से दूर रखा जाना चाहिए और अपने हाथ के चारों ओर एक तौलिया लपेटना चाहिए। प्रतिक्रिया के लिए सोडियम के छोटे टुकड़ों को लिया जाना चाहिए।
सोडियम क्लोरीन में सोडियम क्लोराइड के गठन के साथ सख्ती से जलता है, जो क्लोरीन-कैल्शियम ट्यूब में निरीक्षण करने के लिए विशेष रूप से अच्छा है, जिसमें क्लोरीन की एक धारा पिघली हुई और बहुत गर्म सोडियम से गुजरती है:
2Na + Cl2 \u003d 2NaCl
सोडियम न केवल सरल के साथ, बल्कि जटिल पदार्थों के साथ भी प्रतिक्रिया करता है, उदाहरण के लिए, पानी के साथ, इससे विस्थापित, क्योंकि यह एक बहुत ही सक्रिय धातु है, तनाव की एक श्रृंखला में यह हाइड्रोजन के बाईं ओर बहुत है और पानी से उत्तरार्द्ध को आसानी से विस्थापित करता है:
2Na + 2H2O \u003d 2NaOH + H2
जलते हुए क्षार धातु को जल से नहीं बुझाना चाहिए। सोडा ऐश पाउडर के साथ इसे भरना सबसे अच्छा है। सोडियम की उपस्थिति में, गैस बर्नर की रंगहीन लौ पीले रंग की हो जाती है।
सोडियम धातु का उपयोग कार्बनिक संश्लेषण में उत्प्रेरक के रूप में किया जा सकता है, उदाहरण के लिए, ब्यूटेडीन से सिंथेटिक रबर के उत्पादन में। यह अन्य सोडियम यौगिकों की तैयारी के लिए एक शुरुआती सामग्री के रूप में कार्य करता है, उदाहरण के लिए सोडियम पेरोक्साइड।
■ 27. धातु सोडियम से जुड़े प्रतिक्रियाओं के पाठ में दिए गए प्रतिक्रियाओं के समीकरणों का उपयोग करके साबित करें कि यह एक कम करने वाले एजेंट के रूप में व्यवहार करता है।
28. सोडियम को हवा में क्यों नहीं रखा जा सकता है?
29. छात्र ने सोडियम सल्फेट के घोल में सोडियम का एक टुकड़ा डुबोया, जिससे नमक से धातु को विस्थापित होने की उम्मीद थी। लाल धातु के बजाय, एक जिलेटिनस नीला अवक्षेप दिखाई दिया। हुई प्रतिक्रियाओं का वर्णन करें और आणविक और आयनिक रूपों में उनके समीकरण लिखें। प्रतिक्रिया की स्थितियों को कैसे बदला जाना चाहिए ताकि प्रतिक्रिया वांछित परिणाम की ओर बढ़े? आणविक, पूर्ण और संक्षिप्त आयनिक रूपों में समीकरण लिखें।
30. सोडियम धातु का 2.3 ग्राम एक बर्तन में 45 मिली पानी के साथ रखा गया था। प्रतिक्रिया के अंत में कास्टिक सोडा क्या बनता है।
31. जलते हुए सोडियम को बुझाने के लिए किन एजेंटों का उपयोग किया जा सकता है? यथोचित उत्तर दें।
Ygen 98. सोडियम के ऑक्सीजन यौगिक। कास्टिक सोडा
सोडियम के ऑक्सीजन यौगिक, जैसा कि पहले ही उल्लेख किया गया है, सोडियम ऑक्साइड Na2O और सोडियम पेरोक्साइड Na2O2 हैं।
सोडियम ऑक्साइड Na2O विशेष रूप से महत्वपूर्ण नहीं है। कास्टिक सोडा बनाने पर यह पानी के साथ तीव्र प्रतिक्रिया करता है:
Na2O + H2O \u003d 2NaOH
सोडियम पेरोक्साइड Na202 एक पीले रंग का पाउडर है। इसे एक प्रकार का हाइड्रोजन पेरोक्साइड नमक माना जा सकता है, क्योंकि इसकी संरचना H2O2 जैसी ही है। जैसे सोडियम पेरोक्साइड एक शक्तिशाली ऑक्सीकरण एजेंट है। पानी की कार्रवाई के तहत, यह एक क्षार बनाता है और:
Na2O2 + H2O \u003d H2O2 + 2NOH
सोडियम पेरोक्साइड पर तनु अम्ल की क्रिया द्वारा गठित:
Na2O2 + H2SO4 \u003d H2O2 + Na2SO4
सोडियम पेरोक्साइड के सभी उपरोक्त गुण इसे सभी संभव सामग्रियों को ब्लीच करने के लिए उपयोग करने की अनुमति देते हैं।
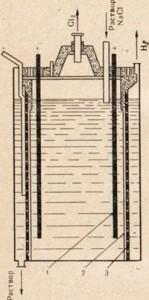
अंजीर। 77. सोडियम क्लोराइड समाधान के इलेक्ट्रोलिसिस के लिए स्थापना आरेख।
1 - एनोड; 2 - एनोड और कैथोड स्पेस को अलग करने वाला एक डायाफ्राम; 3 कैथोड
सोडियम हाइड्रॉक्साइड, या कास्टिक सोडा, NaOH का एक बहुत महत्वपूर्ण सोडियम यौगिक है। इसे कास्टिक सोडा या बस कास्टिक भी कहा जाता है।
कास्टिक सोडा प्राप्त करने के लिए, सोडियम क्लोराइड का उपयोग किया जाता है - सबसे सस्ता प्राकृतिक सोडियम यौगिक, इसे इलेक्ट्रोलाइजिंग, लेकिन इस मामले में, पिघल नहीं, लेकिन एक नमक समाधान का उपयोग किया जाता है (छवि 77)। सोडियम क्लोराइड समाधान के इलेक्ट्रोलिसिस के विवरण के लिए,। 33 देखें। अंजीर में। 77 से पता चलता है कि एनोड और कैथोड स्पेस को एक डायफ्राम द्वारा अलग किया जाता है। यह एक दूसरे के साथ बातचीत से बनने वाले उत्पादों को रोकने के लिए किया गया था, उदाहरण के लिए, Сl2 + 2NaOH \u003d NaClO + NaCl + Н2O।
कास्टिक सोडा - सफेद रंग का एक ठोस क्रिस्टलीय पदार्थ, पानी में पूरी तरह से घुलनशील। जब सोडियम हाइड्रॉक्साइड पानी में घुल जाता है, तो बड़ी मात्रा में गर्मी निकलती है और घोल बहुत गर्म होता है। कास्टिक सोडा को अच्छी तरह से सील किए गए जहाजों में संग्रहीत किया जाना चाहिए ताकि इसे जल वाष्प में प्रवेश करने से रोका जा सके, जिसके प्रभाव में यह बहुत गीला हो सकता है, साथ ही कार्बन डाइऑक्साइड, जिसके प्रभाव में कास्टिक सोडा धीरे-धीरे सोडियम कार्बोनेट में बदल सकता है।
2NaOH + CO2 \u003d Na2CO3 + H2O।
कास्टिक सोडा एक विशिष्ट क्षार है, इसलिए किसी अन्य क्षार के साथ काम करते समय इसके साथ काम करने की सावधानियां समान हैं।
कई उद्योगों में कास्टिक सोडा का उपयोग किया जाता है, उदाहरण के लिए, पेट्रोलियम उत्पादों को परिष्कृत करने के लिए, वसा से साबुन का उत्पादन, कागज उद्योग में, कृत्रिम फाइबर और रंजक के निर्माण में, दवाओं के उत्पादन में, आदि (चित्र। 78)।
नोटबुक में कास्टिक सोडा के आवेदन के क्षेत्र लिखें।
सोडियम लवणों में से, सबसे पहले, सोडियम क्लोराइड, NaCl, जो सोडियम हाइड्रोक्साइड और धातु सोडियम के लिए मुख्य कच्चे माल के रूप में कार्य करता है (इस नमक पर विवरण के लिए, पृष्ठ 164 देखें), Na2CO3 सोडा (पृष्ठ 278 देखें), Na2SO4 (पृष्ठ देखें) 224), NaNO3 (पी। 250 देखें), आदि।
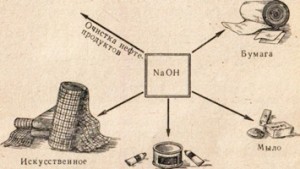
अंजीर। 78. कास्टिक सोडा का उपयोग
■ 32. सोडियम क्लोराइड के इलेक्ट्रोलिसिस द्वारा कास्टिक सोडा के उत्पादन की विधि का वर्णन करें।
33. कास्टिक सोडा ढले हुए चूने के साथ सोडियम कार्बोनेट पर अभिनय करके प्राप्त किया जा सकता है। इस प्रतिक्रिया के लिए समीकरण का एक आणविक और आयनिक रूप बनाएं, और यह भी गणना करें कि 40 किलोग्राम कास्टिक सोडा प्राप्त करने के लिए 95% कार्बोनेट युक्त कितना सोडा आवश्यक है।
34. क्यों, जब जमीन के स्टॉपर्स के साथ बोतलों में कास्टिक सोडा का घोल रखा जाता है, तो क्या प्लग "अटक" जाते हैं और उन्हें हटाया नहीं जा सकता? यदि, एक निश्चित अवधि के लिए, बोतल को पानी में उल्टा रखा जाता है, तो कॉर्क को स्वतंत्र रूप से हटाया जा सकता है। समझाएं, प्रतिक्रिया समीकरणों को देखते हुए, इस मामले में किस तरह की प्रक्रियाएं होती हैं।
35. एक विशिष्ट क्षार के रूप में कास्टिक सोडा के गुणों की विशेषता आणविक और आयनिक रूपों में प्रतिक्रियाओं के समीकरण लिखें।
36. कास्टिक सोडा के साथ काम करते समय क्या सावधानियां बरतनी चाहिए? कास्टिक सोडा के साथ जलने के लिए कौन से प्राथमिक उपचार के उपाय उपलब्ध कराने चाहिए?
§ 99. पोटेशियम
पोटेशियम के भी एक काफी सामान्य क्षार धातु है, जो सोडियम से अपने परमाणु त्रिज्या (चौथी अवधि) से भिन्न होता है और इसलिए इसमें सोडियम की तुलना में अधिक रासायनिक गतिविधि होती है। पोटेशियम परमाणु का इलेक्ट्रॉनिक विन्यास 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 है।
इसकी बाहरी इलेक्ट्रॉनिक परत की संरचना
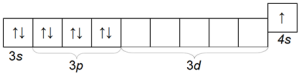
पोटेशियम एक नरम धातु है जिसे चाकू से अच्छी तरह से काटा जाता है। ऑक्सीकरण से बचने के लिए, यह, सोडियम की तरह, मिट्टी के तेल की एक परत के नीचे जमा होता है।
पोटेशियम सोडियम की तुलना में पानी के साथ और भी हिंसक रूप से प्रतिक्रिया करता है, क्षार के गठन के साथ और हाइड्रोजन की रिहाई के साथ, जो प्रज्वलित होता है:
2K + 2H2O \u003d 2KOH + H2।
ऑक्सीजन में जलने पर (सोडियम को जलाने के लिए धातु के छोटे टुकड़ों को भी लेने की सिफारिश की जाती है), सोडियम की तरह, यह पोटेशियम पेरोक्साइड के निर्माण के साथ बहुत तेजी से जलता है।
यह ध्यान दिया जाना चाहिए कि सोडियम की तुलना में पोटेशियम परिसंचरण में बहुत अधिक खतरनाक है। पोटेशियम को काटते समय एक मजबूत विस्फोट भी हो सकता है, इसलिए आपको इसे और भी सावधानी से संभालने की आवश्यकता है।
पोटेशियम हाइड्रॉक्साइड या पोटेशियम हाइड्रॉक्साइड KOH एक सफेद क्रिस्टलीय पदार्थ है। कास्टिक पोटेशियम हर तरह से कास्टिक सोडा के समान है। वे साबुन उद्योग में व्यापक रूप से उपयोग किए जाते हैं, लेकिन इसका उत्पादन कुछ अधिक महंगा है, इसलिए इसे NaOH के रूप में ऐसा कोई आवेदन नहीं मिलता है।
पोटेशियम लवण को विशेष रूप से ध्यान दिया जाना चाहिए, क्योंकि उनमें से कुछ का व्यापक रूप से उर्वरकों के रूप में उपयोग किया जाता है। ये पोटेशियम क्लोराइड KCl, पोटेशियम नाइट्रेट KNO3 हैं, जो एक नाइट्रोजन उर्वरक भी है।
■ 37. हम इस तथ्य को कैसे समझा सकते हैं कि कास्टिक पोटाश रासायनिक रूप से कास्टिक सोडा से अधिक सक्रिय है?
38. पोटेशियम का एक टुकड़ा पानी के साथ मोल्ड में उतारा गया। प्रतिक्रिया समाप्त होने के बाद, सफेद जिलेटिनस अवक्षेप के रूप में थोड़ा जस्ता वहां रखा गया था। अवक्षेप गायब हो गया, और फिनोलफथेलिन के साथ समाधान का परीक्षण करते समय, बाद वाले ने एक क्रिमसन रंग बदल दिया। यहां क्या रासायनिक प्रक्रियाएं हुई हैं?
जो समाधान में हैं? यथोचित उत्तर दें।
39. सभी क्षार धातुओं की तरह पोटेशियम, एस-तत्व परिवार का सदस्य क्यों है?
क्षार धातु आसानी से गैर-धातुओं के साथ प्रतिक्रिया करते हैं:
2K + I 2 \u003d 2KI
2Na + H 2 \u003d 2NaH
6Li + N 2 \u003d 2Li 3 N (प्रतिक्रिया पहले से ही कमरे के तापमान पर है)
2Na + S \u003d Na 2 S
2Na + 2C \u003d Na 2 C 2
ऑक्सीजन के साथ प्रतिक्रिया में, प्रत्येक क्षार धातु अपनी व्यक्तिगतता दिखाती है: जब हवा में जलता है, तो लिथियम ऑक्साइड, सोडियम - पेरोक्साइड, पोटेशियम - पेरोक्साइड बनाता है।
4Li + O 2 \u003d 2Li 2 O
2Na + O 2 \u003d Na 2 O 2
के + ओ २ \u003d केओ २
सोडियम ऑक्साइड प्राप्त करना:
10Na + 2NaNO 3 \u003d 6Na 2 O + N 2
2Na + Na 2 O 2 \u003d 2Na 2 O
2Na + 2NaON \u003d 2Na 2 O + H 2
पानी के साथ संपर्क क्षार और हाइड्रोजन के गठन की ओर जाता है।
2Na + 2H 2 O \u003d 2NaOH + H 2
एसिड के साथ प्रतिक्रिया:
2Na + 2HCl \u003d 2NaCl + H 2
8Na + 5H 2 SO 4 (कांसेप्ट) \u003d 4Na 2 SO 4 + H 2 S + 4H 2 O
2 एलआई + 3 एच 2 एसओ 4 (कॉन्सेप्ट) \u003d 2 एलआईएचएसओ 4 + एसओ 2 + 2 एच 2 ओ
8Na + 10HNO 3 \u003d 8NNO 3 + NH 4 NO 3 + 3H 2 O
अमोनिया के साथ बातचीत करते समय, एमाइड और हाइड्रोजन बनते हैं:
2 एलआई + 2 एनएच 3 \u003d 2 एलआईएनएच 2 + एच 2
कार्बनिक यौगिकों के साथ सहभागिता:
H N C ─ C + H + 2Na → ना ≡ C─C ─ ना + एच 2
2CH 3 Cl + 2Na → C 2 H 6 + 2NaCl
2 सी 6 एच 5 ओएच + 2 एनए → 2 सी 6 एच 5 ओना + एच 2
2CH 3 ओएच + 2 एनए → 2 सीएच 3 ओना + एच 2
2CH 3 COOH + 2Na → 2CH 3 COOONa + H 2
क्षार धातुओं के लिए एक गुणात्मक प्रतिक्रिया उनके पिंजरों के साथ लौ का रंग है। ली + आयन कार्माइन लाल लौ, ना + आयन पीले, के + वायलेट को रंग देता है
क्षार धातु यौगिक
आक्साइड।
क्षार धातु ऑक्साइड विशिष्ट बुनियादी ऑक्साइड हैं। एसिड और एम्फ़ोटेरिक ऑक्साइड, एसिड, पानी के साथ प्रतिक्रिया करें।
3Na 2 O + P 2 O 5 \u003d 2Na 3 PO 4
ना 2 ओ + अल 2 ओ 3 \u003d 2 एनएएलओ 2
ना 2 O + 2HCl \u003d 2NaCl + H 2 O
ना 2 ओ + 2 एच + \u003d 2 एन + + एच 2 ओ
ना 2 ओ + एच 2 ओ \u003d 2 नो
पेरोक्साइड.
2Na 2 O 2 + CO 2 \u003d 2Na 2 CO 3 + O 2
ना २ ओ २ + सीओ \u003d ना २ सीओ ३
ना २ ओ २ + एसओ २ \u003d ना २ एसओ ४
2Na 2 O + O 2 \u003d 2Na 2 O 2
ना २ ओ + न + न २ \u003d २ नानो २
2Na 2 O 2 \u003d 2Na 2 O + O 2
Na 2 O 2 + 2H 2 O (ठंडा) \u003d 2NOH + H 2 O 2
2Na 2 O 2 + 2H 2 O (क्षैतिज) \u003d 4NOH + O 2
Na 2 O 2 + 2HCl \u003d 2NaCl + H 2 O 2
2Na 2 O 2 + 2H 2 SO 4 (अपघटन। क्षैतिज) \u003d 2Na 2 SO 4 + 2H 2 O + O 2
2Na 2 O 2 + S \u003d Na 2 SO 3 + Na 2 O
5Na 2 O 2 + 8H 2 SO 4 + 2KMnO 4 \u003d 5O 2 + 2MnSO 4 + 8H 2 O + 5Na 2 SO 4 + K 2 SO 4
Na 2 O 2 + 2H 2 SO 4 + 2NaI \u003d I 2 + 2Na 2 SO 4 + 2H 2 O
Na 2 O 2 + 2H 2 SO 4 + 2 FeSO 4 \u003d Fe 2 (SO 4) 3 + Na 2 SO 4 + 2HH O
3Na 2 O 2 + 2Na 3 \u003d 2Na 2 CrO 4 + 8NaOH + 2H 2 O
आधार (क्षार)।
2NOH (अतिरिक्त) + CO 2 \u003d Na 2 CO 3 + H 2 O
NaOH + CO 2 (अतिरिक्त) \u003d NaHCO 3
SO 2 + 2NOH (अतिरिक्त) \u003d Na 2 SO 3 + H 2 O
SiO 2 + 2NaOH Na 2 SiO 3 + H 2 O
2NaOH + Al 2 O 3 2NAAlO 2 + H 2 O
2NOH + Al 2 O 3 + 3H 2 O \u003d 2Na
नोह + अल (ओएच) 3 \u003d ना
2NaOH + 2Al + 6H 2 O \u003d 2Na + 3H 2
2KOH + 2NO 2 + O 2 \u003d 2KNO 3 + H 2 O
कोह + केएचओ 3 \u003d के २ सीओ ३ + एच २ ओ
2NOH + Si + H 2 O \u003d Na 2 SiO 3 + H 2
3KOH + P 4 + 3H 2 O \u003d 3KH 2 PO 2 + PH 3
2KOH (ठंडा) + Cl 2 \u003d KClO + KCl + H 2 O
6KOH (गर्म) + 3Cl 2 \u003d KClO 3 + 5KCl + 3H 2 O
6NOH + 3S \u003d 2Na 2 S + Na 2 SO 3 + 3H 2 O
2NaNO 3 2NaNO 2 + O 2
NaHCO 3 + HNO 3 \u003d NaNO 3 + CO 2 + H 2 O
NaI → ना + + I -
कैथोड पर: 2 g 2 2 + 2e → H 2 + 2OH - 1
एनोड पर: 2I - - 2e → I 2 1
2H 2 O + 2I - ![]() H 2 + 2OH - + I 2
H 2 + 2OH - + I 2
2 एच 2 ओ + 2 एनएआई ![]() H 2 + 2NOH + I 2
H 2 + 2NOH + I 2
2NaCl ![]() 2Na + Cl 2
2Na + Cl 2
एनोड पर कैथोड पर
2Na 2 एचपीओ 4 ना 4 पी 2 ओ 7 + एच 2 ओ
KNO 3 + 4Mg + 6H 2 O \u003d NH 3 + 4Mg (OH) 2 + KOH
4KClO 3 KCl + 3KClO 4
2KClO 3 ![]() 2KCl + 3O 2
2KCl + 3O 2
KClO 3 + 6HCl \u003d KCl + 3Cl 2 + 3H 2 O
ना 2 एसओ 3 + एस \u003d ना 2 एस 2 ओ 3
Na 2 S 2 O 3 + H 2 SO 4 \u003d Na 2 SO 4 + S 2 + SO 2 + H 2 O
2NaI + Br 2 \u003d 2NaBr + I 2
2NBBr + Cl 2 \u003d 2NaCl + Br 2
मैं एक समूह।
1. इलेक्ट्रिक डिस्चार्ज को कास्टिक सोडा समाधान की सतह पर फ्लास्क में डाला गया था, और फ्लास्क में हवा का रंग भूरा था, जो थोड़ी देर बाद गायब हो जाता है। परिणामस्वरूप समाधान सावधानी से वाष्पित हो गया था और यह पाया गया था कि ठोस अवशेष दो लवणों का मिश्रण था। जब इस मिश्रण को गर्म किया जाता है, तो गैस निकलती है और एकमात्र पदार्थ बच जाता है। वर्णित प्रतिक्रियाओं के समीकरण लिखिए।
2. सोडियम क्लोराइड पिघल के इलेक्ट्रोलिसिस के दौरान कैथोड पर छोड़ा गया पदार्थ ऑक्सीजन में जल गया था। परिणामी उत्पाद को कार्बन डाइऑक्साइड से भरे गैस मीटर में रखा गया था। परिणामस्वरूप पदार्थ को अमोनियम क्लोराइड के एक समाधान में जोड़ा गया था और समाधान गरम किया गया था। वर्णित प्रतिक्रियाओं के समीकरण लिखिए।
3) नाइट्रिक एसिड को बेकिंग सोडा के साथ बेअसर किया गया था, तटस्थ समाधान को ध्यान से वाष्पित किया गया था और अवशेषों को शांत किया गया था। परिणामस्वरूप पदार्थ को सल्फ्यूरिक एसिड के साथ अम्लीकृत पोटेशियम परमैंगनेट के एक समाधान में पेश किया गया था, और समाधान को हटा दिया गया था। नाइट्रोजन युक्त प्रतिक्रिया उत्पाद को सोडियम हाइड्रॉक्साइड समाधान में रखा गया था और जस्ता धूल जोड़ा गया था, और एक तीखी गंध वाली गैस जारी की गई थी। वर्णित प्रतिक्रियाओं के समीकरण लिखिए।
4) सोडियम आयोडाइड के अक्रिय इलेक्ट्रोड के समाधान के इलेक्ट्रोलिसिस के दौरान एनोड में प्राप्त पदार्थ पोटेशियम के साथ प्रतिक्रिया में पेश किया गया था। प्रतिक्रिया उत्पाद को केंद्रित सल्फ्यूरिक एसिड के साथ गरम किया गया था, और विकसित गैस को पोटेशियम क्रोमेट के एक गर्म समाधान के माध्यम से पारित किया गया था। वर्णित प्रतिक्रियाओं के समीकरण लिखिए
5) सोडियम क्लोराइड पिघल के इलेक्ट्रोलिसिस के दौरान कैथोड पर प्राप्त पदार्थ को ऑक्सीजन में जला दिया गया था। प्राप्त उत्पाद को बाद में सल्फर डाइऑक्साइड और बेरियम हाइड्रॉक्साइड के समाधान के साथ इलाज किया गया था। वर्णित प्रतिक्रियाओं के समीकरण लिखिए
6) सफेद फास्फोरस गैस के विकास के साथ कास्टिक पोटेशियम के एक घोल में घुल जाता है, जिसमें लहसुन की गंध होती है, जो हवा में अनायास निकलता है। दहन प्रतिक्रिया के ठोस उत्पाद ने सोडियम हाइड्रॉक्साइड के साथ इस अनुपात में प्रतिक्रिया की कि परिणामस्वरूप सफेद पदार्थ में एक हाइड्रोजन परमाणु होता है; जब बाद को शांत किया जाता है, तो सोडियम पाइरोफॉस्फेट बनता है। वर्णित प्रतिक्रियाओं के समीकरण लिखिए
7) अज्ञात धातु ऑक्सीजन में जल गई। प्रतिक्रिया उत्पाद, कार्बन डाइऑक्साइड के साथ बातचीत करता है, दो पदार्थ बनाता है: एक ठोस, जो कार्बन डाइऑक्साइड की रिहाई के साथ हाइड्रोक्लोरिक एसिड के समाधान के साथ बातचीत करता है, और एक गैसीय सरल पदार्थ जो दहन का समर्थन करता है। वर्णित प्रतिक्रियाओं के समीकरण लिखिए।
8) हवा की एक बड़ी मात्रा की उपस्थिति में ब्राउन गैस को पोटेशियम हाइड्रॉक्साइड समाधान की अधिकता से पारित किया गया था। मैग्नीशियम छीलन को परिणामस्वरूप समाधान में जोड़ा गया और गर्म किया गया, और नाइट्रिक एसिड को गैस के साथ बेअसर कर दिया गया। परिणामस्वरूप समाधान सावधानी से वाष्पित हो गया था, और ठोस प्रतिक्रिया उत्पाद को शांत किया गया था। वर्णित प्रतिक्रियाओं के समीकरण लिखिए।
9) मैंगनीज डाइऑक्साइड, बाइनरी नमक बी और एक गैस की उपस्थिति में नमक ए के थर्मल अपघटन के दौरान जो दहन का समर्थन करते हैं और हवा का हिस्सा होते हैं; जब यह नमक एक उत्प्रेरक के बिना गर्म किया जाता है, तो नमक बी और एक उच्च ऑक्सीजन युक्त एसिड नमक बनता है। हाइड्रोक्लोरिक एसिड के साथ नमक ए की बातचीत के दौरान, एक पीले-हरे रंग की गैस (एक सरल पदार्थ) निकलता है और नमक बी बनता है। नमक बी लौ बैंगनी को बदल देता है, जब यह चांदी नाइट्रेट के समाधान के साथ बातचीत करता है, तो एक सफेद अवक्षेप बनता है। वर्णित प्रतिक्रियाओं के समीकरण लिखिए।
10) कॉपर शेविंग्स को गर्म केंद्रित सल्फ्यूरिक एसिड में जोड़ा गया और विकसित गैस कास्टिक सोडा (अधिकता) के घोल के माध्यम से पारित किया गया। प्रतिक्रिया उत्पाद को अलग कर दिया गया, पानी में घोल दिया गया और सल्फर के साथ गर्म किया गया, जो प्रतिक्रिया के परिणामस्वरूप भंग हो गया। परिणामस्वरूप समाधान में पतला सल्फ्यूरिक एसिड जोड़ा गया था। वर्णित प्रतिक्रियाओं के समीकरण लिखिए।
11) नमक का उपचार केंद्रित सल्फ्यूरिक एसिड के साथ किया जाता था। परिणामस्वरूप नमक को सोडियम हाइड्रॉक्साइड के साथ इलाज किया गया था। परिणामी उत्पाद को अतिरिक्त कोयले के साथ शांत किया गया था। इस मामले में जारी गैस ने क्लोरीन उत्प्रेरक की उपस्थिति में प्रतिक्रिया की। वर्णित प्रतिक्रियाओं के समीकरण लिखिए।
12) सोडियम ने हाइड्रोजन के साथ प्रतिक्रिया की। प्रतिक्रिया उत्पाद को पानी में भंग कर दिया गया था, एक गैस का गठन किया गया था जो क्लोरीन के साथ प्रतिक्रिया करता था, और परिणामस्वरूप समाधान क्लोरीन के साथ प्रतिक्रिया करता था जब दो लवण का मिश्रण बनता था। वर्णित प्रतिक्रियाओं के समीकरण लिखिए।
13) सोडियम को अधिक ऑक्सीजन में जला दिया गया था, जिसके परिणामस्वरूप क्रिस्टलीय पदार्थ को एक ग्लास ट्यूब में रखा गया था और कार्बन डाइऑक्साइड इसके माध्यम से पारित किया गया था। ट्यूब से निकलने वाली गैस को एकत्र किया गया और उसके वायुमंडल में फास्फोरस को जलाया गया। परिणामस्वरूप सामग्री सोडियम हाइड्रॉक्साइड समाधान की अधिकता के साथ बेअसर हो गई थी। वर्णित प्रतिक्रियाओं के समीकरण लिखिए।
14) जब तक प्रतिक्रिया पूरी नहीं हो जाती, तब तक पानी के साथ सोडियम पेरोक्साइड की बातचीत द्वारा प्राप्त समाधान में हाइड्रोक्लोरिक एसिड का एक समाधान जोड़ा गया था। गठित नमक का एक समाधान अक्रिय इलेक्ट्रोड के साथ इलेक्ट्रोलाइज्ड था। एनोड पर इलेक्ट्रोलिसिस द्वारा उत्पन्न गैस को कैल्शियम हाइड्रोक्साइड के निलंबन के माध्यम से पारित किया गया था। वर्णित प्रतिक्रियाओं के समीकरण लिखिए।
15) मध्य नमक बनाने के लिए सल्फर गैस को सोडियम हाइड्रॉक्साइड घोल से गुजारा गया। पोटेशियम परमैंगनेट के एक जलीय घोल को परिणामस्वरूप समाधान में जोड़ा गया था। परिणामस्वरूप अवक्षेप को अलग किया गया और हाइड्रोक्लोरिक एसिड के साथ इस पर कार्य किया गया। जारी गैस को पोटेशियम हाइड्रॉक्साइड के ठंडे समाधान के माध्यम से पारित किया गया था। वर्णित प्रतिक्रियाओं के समीकरण लिखिए।
16) सिलिका (IV) और मैग्नीशियम धातु के मिश्रण को शांत किया गया। परिणामी सरल पदार्थ को एक केंद्रित सोडियम हाइड्रॉक्साइड समाधान के साथ इलाज किया गया था। जारी की गई गैस को गर्म सोडियम पर पारित किया गया था। परिणामस्वरूप पदार्थ को पानी में रखा गया था। वर्णित प्रतिक्रियाओं के समीकरण लिखिए।
17) नाइट्रोजन के साथ लिथियम के संपर्क का उत्पाद पानी के साथ इलाज किया गया था। परिणामस्वरूप गैस को रासायनिक प्रतिक्रियाओं की समाप्ति तक सल्फ्यूरिक एसिड के समाधान के माध्यम से पारित किया गया था। परिणामस्वरूप समाधान बेरियम क्लोराइड के समाधान के साथ इलाज किया गया था। घोल को छान लिया गया था, और छानना सोडियम नाइट्रेट और गर्म के घोल के साथ मिलाया गया था। वर्णित प्रतिक्रियाओं के समीकरण लिखिए।
१) सोडियम हाइड्रोजन के वातावरण में गर्म होता था। जब पानी को प्राप्त पदार्थ में जोड़ा गया, तो गैस विकास और एक स्पष्ट समाधान का गठन देखा गया। इस समाधान के माध्यम से ब्राउन गैस को पारित किया गया था, जो नाइट्रिक एसिड के एक केंद्रित समाधान के साथ तांबे की बातचीत के परिणामस्वरूप प्राप्त किया गया था। वर्णित प्रतिक्रियाओं के समीकरण लिखिए।
19) सोडियम बाइकार्बोनेट को शांत किया गया। परिणामस्वरूप नमक को पानी में भंग कर दिया गया था और एक एल्यूमीनियम समाधान के साथ मिलाया गया था, परिणामस्वरूप, एक उपजीवन और एक बेरंग गैस जारी किया गया था। अवक्षेप को नाइट्रिक एसिड के एक घोल के अतिरिक्त के साथ इलाज किया गया था, और गैस को पोटेशियम सिलिकेट के समाधान के माध्यम से पारित किया गया था। वर्णित प्रतिक्रियाओं के समीकरण लिखिए।
20) सोडियम को सल्फर के साथ मिलाया गया था। परिणामस्वरूप यौगिक को हाइड्रोक्लोरिक एसिड के साथ इलाज किया गया था, विकसित गैस ने सल्फर डाइऑक्साइड के साथ पूरी तरह से प्रतिक्रिया की। परिणामी सामग्री को केंद्रित नाइट्रिक एसिड के साथ इलाज किया गया था। वर्णित प्रतिक्रियाओं के समीकरण लिखिए।
21) सोडियम अधिक ऑक्सीजन में जल गया। परिणामी पदार्थ को पानी के साथ इलाज किया गया था। परिणामस्वरूप मिश्रण उबला हुआ था, जिसके बाद क्लोरीन को गर्म समाधान में जोड़ा गया था। वर्णित प्रतिक्रियाओं के समीकरण लिखिए।
22) नाइट्रोजन के वातावरण में पोटेशियम को गर्म किया गया। परिणामस्वरूप पदार्थ को हाइड्रोक्लोरिक एसिड की अधिकता के साथ इलाज किया गया था, जिसके बाद कैल्शियम हाइड्रॉक्साइड का एक निलंबन लवण और गर्म के परिणामस्वरूप मिश्रण में जोड़ा गया था। परिणामस्वरूप गैस को खुशी से उज्ज्वल कॉपर ऑक्साइड (II) पारित किया गया था। वर्णित प्रतिक्रियाओं के समीकरण लिखिए।
23) क्लोरीन के वातावरण में पोटेशियम को जला दिया गया था, जिसके परिणामस्वरूप नमक को चांदी नाइट्रेट के एक जलीय घोल के अतिरिक्त के साथ इलाज किया गया था। गठित वेग को फ़िल्टर्ड किया गया था, छानना वाष्पित हो गया था और मिश्रण को सावधानी से गर्म किया गया था। परिणामस्वरूप नमक को एक जलीय ब्रोमिन समाधान के साथ इलाज किया गया था। वर्णित प्रतिक्रियाओं के समीकरण लिखिए।
24) लिथियम ने हाइड्रोजन के साथ प्रतिक्रिया की। प्रतिक्रिया उत्पाद को पानी में भंग कर दिया गया था, एक गैस का गठन किया गया था जो ब्रोमीन के साथ प्रतिक्रिया करता था, और परिणामस्वरूप समाधान क्लोरीन के साथ प्रतिक्रिया करता था जब दो लवणों का मिश्रण बनता है। वर्णित प्रतिक्रियाओं के समीकरण लिखिए।
25) सोडियम हवा में जल गया। परिणामस्वरूप ठोस ऑक्सीजन और नमक की रिहाई के साथ कार्बन डाइऑक्साइड को अवशोषित करता है। बाद के नमक को हाइड्रोक्लोरिक एसिड में भंग कर दिया गया था, और परिणामस्वरूप समाधान में एक चांदी नाइट्रेट समाधान जोड़ा गया था। एक सफ़ेद अवक्षेप सामने आया। वर्णित प्रतिक्रियाओं के समीकरण लिखिए।
26) ऑक्सीजन को एक ओजोनाइज़र में बिजली के निर्वहन के अधीन किया गया था। परिणामी गैस को पोटेशियम आयोडाइड के एक जलीय घोल के माध्यम से पारित किया गया था, जबकि एक नई गैस को रंग और गंध के बिना जारी किया गया था, जो दहन और श्वसन का समर्थन करता है। सोडियम को अंतिम गैस के वातावरण में जलाया गया था, और इसके साथ प्राप्त ठोस कार्बन डाइऑक्साइड के साथ प्रतिक्रिया करता था। वर्णित प्रतिक्रियाओं के समीकरण लिखिए।
मैं एक समूह।
1. एन 2 + ओ 2 ![]() 2NO
2NO
2NO + O 2 \u003d 2NO 2
2NO 2 + 2NaOH \u003d NaNO 3 + NaNO 2 + H 2 O
2NaNO 3 2NaNO 2 + O 2
2. 2NaCl ![]() 2Na + Cl 2
2Na + Cl 2
एनोड पर कैथोड पर
2Na + O 2 \u003d Na 2 O 2
2Na 2 O 2 + 2CO 2 \u003d 2Na 2 CO 3 + O 2
Na 2 CO 3 + 2NH 4 Cl \u003d 2NaCl + CO 2 + 2NH 3 + H 2 O
3. NaHCO 3 + HNO 3 \u003d NaNO 3 + CO 2 + H 2 O
2NaNO 3 2NaNO 2 + O 2
5NaNO 2 + 2KMnO 4 + 3H 2 SO 4 \u003d 5NaNO 3 + 2MnSO 4 + K 2 SO 4 + 3H 2 O
NaNO 3 + 4Zn + 7NaOH + 6H 2 O \u003d 4Na 2 + NH 3
4.2H 2 O + 2 NaI ![]() H 2 + 2NOH + I 2
H 2 + 2NOH + I 2
2K + I 2 \u003d 2KI
8KI + 5H 2 SO 4 (कांसेप्ट) \u003d 4K 2 SO 4 + H 2 S + 4I 2 + 4H 2 O
3H 2 S + 2K 2 CrO 4 + 2H 2 O \u003d 2Cr (OH) 3 ↓ + 3S 2K + 4KOH
5. 2NaCl ![]() 2Na + Cl 2
2Na + Cl 2
एनोड पर कैथोड पर
2Na + O 2 \u003d Na 2 O 2
ना २ ओ २ + एसओ २ \u003d ना २ एसओ ४
Na 2 SO 4 + बा (OH) 2 \u003d BaSO 4 2 + 2NaOH
6. P 4 + 3KOH + 3H 2 O \u003d 3KH 2 PO 2 + PH 3
2PH 3 + 4O 2 \u003d P 2 O 5 + 3H 2 O
P 2 O 5 + 4NaOH \u003d 2Na 2 HPO 4 + H 2 O


