14.08.2019
ما هي الخصائص الشائعة للعناصر الكيميائية للمعادن. المعادن كعناصر كيميائية
منذ الطفولة المبكرة ، صادفنا عبارة أن هذا الجسم مصنوع من المعدن. ما هو المعدن؟
المعادن هي مجموعة معينة من العناصر الكيميائية (وكذلك سبائكها) التي لها خصائص مشتركة في المجموعة بأكملها ، مثل زيادة القوة والتوصيل الحراري والكهربائي الجيد ، ليونة ، ليونة ، وبريق معدني.
ما يقرب من 80 ٪ من جميع العناصر الكيميائية المعروفة تنتمي إلى المعادن (96 من أصل 118).
الخصائص الفيزيائية للمعادن
جميع المعادن ، باستثناء الزئبق ، تكون عادة صلبة. من حيث صلابة ، أنعم المعدن هو السيزيوم (0.2 نقطة على مقياس موس 10 نقطة). الأصعب هو التنغستن. صلابة 6 نقاط. صلابة الحديد 4 نقاط.
تختلف درجات حرارة الانصهار (الانتقال إلى الحالة السائلة) للمعادن: من - 39 درجة مئوية إلى الزئبق إلى 410 درجة مئوية للتنغستن. جميع المعادن القلوية لها نقاط انصهار منخفضة ، والقصدير والرصاص هما المعتادان. يمكن صهرها حتى في المنزل على موقد الغاز. يتم صهر معظم المعادن في أفران خاصة ذات درجات حرارة عالية.
نظرًا لوجود إلكترونات متنقلة مجانية في المشابك البلورية للمعادن ، فإنها جميعًا تقوم بتوصيل الكهرباء والحرارة جيدًا. أفضل الموصلات للكهرباء من المعادن هي الفضة والنحاس والألمنيوم. ليس من قبيل المصادفة أنه من آخر اثنين من المعادن التي تجعل الأسلاك الكهربائية.
مع التوصيل الحراري الممتاز للمعادن ، نواجه أيضًا غالبًا في الحياة اليومية. لغلي الماء ، نسكبه في مقلاة معدنية ونضعها على الموقد. تنغ تسخين المعدن ، وينقل المعدن تقريبا كل الطاقة الحرارية إلى الماء.
الخواص الكيميائية للمعادن
أثناء التفاعلات الكيميائية ، تتبرع جميع المعادن بسهولة بإلكتروناتها وتعمل كعوامل اختزال.
تتأكسد جميع المعادن تقريبا بواسطة الأكسجين. تتفاعل المعادن القلوية (الليثيوم والكالسيوم) مع الأكسجين في الظروف العادية. يتطلب أكسدة المعادن الأخرى بالأكسجين درجة حرارة مرتفعة. على سبيل المثال ، إذا قمت بتسخين سلك نحاسي على النار ، فسيتفاعل النحاس مع الأكسجين من الهواء ويصبح مغطىًا بفيلم أسود (أكسيد النحاس):
- 2Cu + O 2 → 2CuO
الذهب والبلاتين لا تتفاعل مع الأكسجين.
من العوامل المؤكسدة الأخرى ، يتفاعل الكلور والكبريت مع المعادن. إذا قمت بخلط برادة الحديد ومسحوق الكبريت وقمت بتسخين الخليط ، فعند أعيننا نحصل على كبريتيد الحديد
- Fe + S → FeS
نشاط الحد من المعادن المختلفة هو مختلف. في نشاطهم ، يتم توزيع المعادن على النحو التالي:
- Li - K - Ba - Sr - Ca - Na - Mg - Al - Mn - Zn - Cr - Fe - Ca - Co - Ni - Sn - Pb - (H2) - Cu - Hg - Ag - Pt - Au.
كلما زاد يسار المعدن في هذا الصف ، زاد نشاطه. العنصر السابق قد يحل محل المعدن إلى اليمين. على سبيل المثال ، إذا تم وضع قطعة من الحديد في أنبوب اختبار بمحلول من كبريتات النحاس ، فسيتم تغطيتها بطبقة بنية (فيلم من النحاس):
- Fe + CuSO4 → FeSO4 + Cu
يمكن للمعادن الموجودة على يسار الهيدروجين (H2) أن تحل محلها من حمض الهيدروكلوريك. إذا تم خفض جزء من الزنك إلى حمض الهيدروكلوريك ، فسيبدأ إطلاق الهيدروجين:
- HCl + Zn → ZnCl2 + H2
تتفاعل المعادن القلوية بسهولة مع الماء. إذا تم وضع قطعة من الصوديوم في حاوية من الماء ، فسيتم إطلاق الهيدروجين بفعالية وستتشكل القلويات:
- 2Na + 2H2O → 2NaOH + H2
تطبيق المعادن
بسبب خصائصه المفيدة ، فقد دخلت المعادن بحزم حياة الإنسان. يستخدم الرجل قوة المعادن ، مما يجعلها جثث للمباني (من الأجنحة الصغيرة إلى ناطحات السحاب الضخمة) ، هياكل السيارات (السيارات ، العربات ، السفن ، الأدوات الآلية) ، وكذلك أجزاء العمل من الأدوات المختلفة.
تعريف
يجري في الطبيعة
الخواص المعدنية
الخصائص المميزة المعادن
الخصائص الفيزيائية المعادن
الخواص الكيميائية للمعادن
التركيب المجهري
المعادن القلوية
الخصائص العامة للمعادن القلوية
الخواص الكيميائية للمعادن القلوية
إنتاج المعادن القلوية
هيدروكسيدات
الكربونات
الروبيديوم عنصر فلزي
المعادن الأرضية القلوية
الكلسيوم
الإسترونتيوم عنصر فلزي
المعادن الانتقالية
الخصائص العامة للعناصر الانتقالية
تطبيق المعادن
مواد البناء
المواد الكهربائية
المواد أداة
القصة
مقتطف علم المعادن
المعدن هو (الاسم يأتي من lat. metallum - mine) - مجموعة من العناصر ذات الخصائص المعدنية المميزة ، مثل الموصلية الحرارية والكهربائية العالية ، معامل درجة حرارة إيجابي للمقاومة ، ليونة عالية ، إلخ. ما يقرب من 70 ٪ من جميع العناصر الكيميائية تنتمي إلى المعادن.
المعدن هو











![]()





















![]()


![]()





يجري في الطبيعة
معظم المعادن موجودة في الطبيعة في شكل خامات ومركبات. وهي تشكل أكاسيد وكبريتيدات وكربونات ومركبات كيميائية أخرى. للحصول على المعادن النقية وتطبيقاتها الإضافية ، من الضروري عزلها عن الخامات وإجراء التنظيف. إذا لزم الأمر ، يتم تنفيذ صناعة السبائك ومعالجة المعادن الأخرى. العلم يدرس هذا. علم المعادن. المعادن يميز الخامات الحديدية (على أساس غدة) واللون (غير المدرجة حديد، حوالي 70 البنود في المجموع). ، والبلاتين تنطبق أيضا على المعادن الثمينة. بالإضافة إلى ذلك ، فهي موجودة بكميات صغيرة في مياه البحر ، والنباتات ، والكائنات الحية (بينما تلعب دورًا مهمًا).
من المعروف أن جسم الإنسان يتكون من 3٪ من المعادن. الأهم من ذلك كله في خلايانا هي الكالسيوم والصوديوم ، تتركز في النظم اللمفاوية. يتراكم المغنيسيوم في العضلات والجهاز العصبي ، نحاس - في الكبد - في الدم.
الخواص المعدنية
المعدن هو
الخصائص المميزة للمعادن
بريق معدني (باستثناء اليود والكربون في شكل جرافيت. على الرغم من بريقه المعدني ، إلا أن اليود البلوري والجرافيت غير فلز).
الموصلية الكهربائية جيدة (باستثناء الكربون.)
إمكانية الآلات سهلة.
عالية الكثافة (عادة ما تكون المعادن أثقل من المعادن غير).
نقطة انصهار عالية (باستثناء: الزئبق ، الغاليوم ، والمعادن القلوية.)
الموصلية الحرارية العالية
في ردود الفعل ، فهي دائما تقليل العوامل.
الخصائص الفيزيائية للمعادن
جميع المعادن (باستثناء الزئبق ، وبشكل مشروط) في ظروف صلبة في حالة صلبة ، ولكن لديهم صلابة مختلفة. لذلك ، يتم قطع المعادن القلوية بسهولة بسكين المطبخ ، والمعادن بسهولة مثل الفاناديوم والتنغستن والكروم تخدش بسهولة الأصعب والزجاج. فيما يلي صلابة بعض المعادن على مقياس موس.
تتراوح نقاط الانصهار من −39 درجة مئوية (الزئبق) إلى 3410 درجة مئوية (التنغستن). نقطة انصهار معظم المعادن (باستثناء القلويات) مرتفعة ، ولكن بعض المعادن "العادية" ، على سبيل المثال قصدير و الرصاصيمكن صهرها على موقد كهربائي أو غاز تقليدي.
اعتمادًا على الكثافة ، يتم تقسيم المعادن إلى ضوء (الكثافة 0.53 h 5 جم / سم_) وثقيلة (5 ساعات 22.5 جم / سم_). أخف المعدن هو الليثيوم (الكثافة 0.53 جم / سم_). من المستحيل حاليًا تسمية أثقل المعدن ، نظرًا لأن كثافتي الأوسميوم والإيريديوم - وهما أثقل الفلزات - متساوية تقريبًا (حوالي 22.6 جم / سم 2 - أعلى مرتين من الكثافة بالضبط الرصاص) ، ومن الصعب للغاية حساب كثافتها بالضبط: لهذا تحتاج إلى تنظيف المعادن بالكامل ، لأن أي شوائب تقلل من كثافتها.
معظم المعادن من البلاستيك ، وهذا يعني أن الأسلاك المعدنية يمكن ثنيها ولن تنكسر. هذا بسبب إزاحة طبقات الذرات المعدنية دون كسر الرابطة بينهما. معظم البلاستيك الذهب, فضة و نحاس. من الذهب من الممكن صناعة رقائق معدنية بسمك 0.003 مم ، وهي تستخدم في مواد التذهيب التجارية. ومع ذلك ، ليست كل المعادن هي الدكتايل. سلك من زنك أو قصدير الجرش عند الانحناء ؛ عند حدوث تشوه ، لا ينحني المنجنيز والبزموت أبدًا تقريبًا ، ولكن ينكسر فورًا. اللدونة تعتمد أيضا على نقاء المعدن. وبالتالي ، فإن الكروم النقي للغاية مصنوع من البلاستيك ، ولكن ، حتى إذا كان ملوثًا بشوائب بسيطة ، يصبح هشًا وأصعب.
جميع المعادن تجري الكهرباء بشكل جيد. ويرجع ذلك إلى وجود المشابك البلورية للإلكترونات المتحركة التي تتحرك تحت تأثير مجال كهربائي. فضةالنحاس و الألومنيوم لديهم أكبر الموصلية الكهربائية. لهذا السبب ، غالبًا ما يتم استخدام آخر معادن كمواد للأسلاك. يحتوي الصوديوم أيضًا على موصلية كهربائية عالية جدًا ؛ ومحاولات استخدام موصلات الصوديوم في شكل أنابيب فولاذية غير ملحومة ذات جدران رقيقة مملوءة بالصوديوم معروفة في المعدات التجريبية. بسبب الثقل النوعي المنخفض للصوديوم ، بمقاومة متساوية ، فإن "أسلاك" الصوديوم أخف بكثير من النحاس وأخف وزناً من الألمنيوم.
تعتمد الموصلية الحرارية العالية للمعادن أيضًا على حركة الإلكترونات الحرة. لذلك ، هناك عدد من التوصيلات الحرارية تشبه سلسلة التوصيلات الكهربائية ، وأفضل موصل للحرارة ، مثل الكهرباء ، هو. يجد الصوديوم أيضا استخدام كقائد جيد للحرارة. من المعروف على نطاق واسع ، على سبيل المثال ، استخدام الصوديوم في صمامات محركات السيارات لتحسين تبريدها.
يعكس السطح الأملس للمعادن الكثير من الضوء - وتسمى هذه الظاهرة بريق معدني. ومع ذلك ، في حالة مسحوق ، تفقد معظم المعادن بريقها. الألومنيوم والمغنيسيوم ، ومع ذلك ، تحتفظ بريقها في مسحوق. الأكثر تعكس الضوء والفضة والمرايا مصنوعة من هذه المعادن. يستخدم الروديوم أحيانًا أيضًا في صناعة المرايا ، على الرغم من سعره المرتفع بشكل استثنائي: نظرًا لارتفاع صلابة ومقاومة كيميائية أعلى من الفضة أو حتى البلاديوم ، يمكن أن تكون طبقة الروديوم أرق بكثير من الفضة.
لون معظم المعادن هو نفسه تقريبا - رمادي فاتح مع لون مزرق. والنحاس والسيزيوم ، على التوالي ، الأصفر والأحمر والأصفر الفاتح.
الخواص الكيميائية للمعادن
المعدن هو
تحتوي معظم المعادن على كمية صغيرة من الإلكترونات على طبقة الإلكترون الخارجية (1-3) ، وبالتالي ، في معظم التفاعلات تعمل كعوامل اختزال (أي أنها "تعيد" إلكتروناتها)
1. ردود الفعل مع مواد بسيطة
تتفاعل جميع المعادن مع الأكسجين ، باستثناء الذهب والبلاتين. يحدث التفاعل مع الفضة في درجات حرارة عالية ، لكن أكسيد الفضة (II) لا يتشكل عملياً ، لأنه غير مستقر حرارياً. اعتمادا على المعدن ، قد يكون الإخراج أكاسيد ، بيروكسيدات ، بيروكسيدات:
4Li + O2 \u003d أكسيد الليثيوم 2Li2O
2Na + O2 \u003d Na2O2 بيروكسيد الصوديوم
K + O2 \u003d KO2 أول أكسيد البوتاسيوم
للحصول على أكسيد من بيروكسيد ، يتم تقليل بيروكسيد بمعدن:
Na2O2 + 2Na \u003d 2Na2O
مع المعادن متوسطة ومنخفضة النشاط ، يحدث التفاعل عند التسخين:
3Fe + 2O2 \u003d Fe3O4
تتفاعل فقط مع المعادن الأكثر نشاطا مع النيتروجين ، الليثيوم فقط يتفاعل في درجة حرارة الغرفة ، وتشكيل النتريد
6Li + N2 \u003d 2Li3N
عند تسخينها:
3Ca + N2 \u003d Ca3N2
جميع المعادن تتفاعل مع الكبريت باستثناء الذهب و بلاتين:
الحديد يتفاعل مع رمادي عند التسخين ، وتشكيل كبريتيد:
تتفاعل فقط المعادن الأكثر نشاطًا مع الهيدروجين ، أي معادن المجموعات IA و IIA باستثناء Be. تتم التفاعلات عن طريق التسخين ، وتتشكل الهيدريد. في التفاعلات ، يعمل المعدن كعامل اختزال ؛ حالة أكسدة الهيدروجين هي −1:
فقط المعادن الأكثر نشاطا تتفاعل مع الكربون. في هذه الحالة ، يتم تشكيل الأسيتيلينيدات أو الميثانيدات. أسيتيلينيدات ، عندما تتفاعل مع الماء ، تعطي الأسيتيلين ، الميثانيدات - الميثان.
2Na + 2C \u003d Na2C2
Na2C2 + 2H2O \u003d 2NaOH + C2H2
تعاطي المنشطات هو إدخال عناصر إضافية في الذوبان التي تعدل الخواص الميكانيكية والفيزيائية والكيميائية للمواد الأساسية.
التركيب المجهري
يمكن فهم الخصائص المميزة للمعادن على أساس هيكلها الداخلي. كل منهم لديهم اتصال ضعيف من الإلكترونات من مستوى الطاقة الخارجية (وبمعنى آخر ، إلكترونات التكافؤ) مع النواة. نتيجة لهذا ، يؤدي الفرق المحتمل الناتج في الموصل إلى حركة تشبه الانهيار الجليدي للإلكترونات (تسمى إلكترونات التوصيل) في الشبكة البلورية. وغالبا ما تسمى مجموعة من هذه الإلكترونات غاز الإلكترون. بالإضافة إلى الإلكترونات ، تساهم الفونونات (اهتزازات شعرية) في التوصيل الحراري. اللدونة ناتجة عن حاجز الطاقة الصغير لحركة الخلع وتحول الطائرات البلورية. يمكن تفسير الصلابة بعدد كبير من العيوب الهيكلية (الذرات الخلالية ، إلخ).
بسبب الارتداد السهل للإلكترونات ، فإن أكسدة المعادن ممكنة ، مما قد يؤدي إلى التآكل والمزيد من تدهور الخواص. يمكن التعرف على القدرة على التأكسد من خلال السلسلة القياسية لنشاط المعادن. تؤكد هذه الحقيقة على الحاجة إلى استخدام المعادن مع العناصر الأخرى (السبائك ، وأهمها هو صلب) ، صناعة السبائك وتطبيق الطلاء المختلفة.
للحصول على وصف أكثر دقة للخصائص الإلكترونية للمعادن ، من الضروري استخدام ميكانيكا الكم. في جميع المواد الصلبة ذات التماثل الكافي ، تتداخل مستويات طاقة الإلكترون للذرات الفردية وتشكل نطاقات مسموح بها ، ويطلق على الفرقة المكونة من إلكترونات التكافؤ نطاق التكافؤ. يؤدي الارتباط الضعيف لإلكترونات التكافؤ في المعادن إلى حقيقة أن نطاق التكافؤ في المعادن واسع للغاية ، وأن جميع إلكترونات التكافؤ لا تكفي لملئه تمامًا.
السمة الرئيسية لهذه المنطقة المملوءة جزئياً هي أنه حتى مع الحد الأدنى من الجهد المطبق ، تبدأ إعادة هيكلة إلكترونات التكافؤ في العينة ، أي تدفق التيار الكهربائي.
نفس الحركة عالية الإلكترون تؤدي إلى الموصلية الحرارية العالية ، وكذلك القدرة على مرآة الإشعاع الكهرومغناطيسي (الذي يعطي للمعادن بريق مميز).
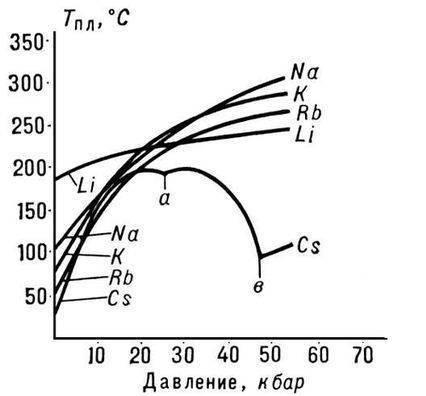
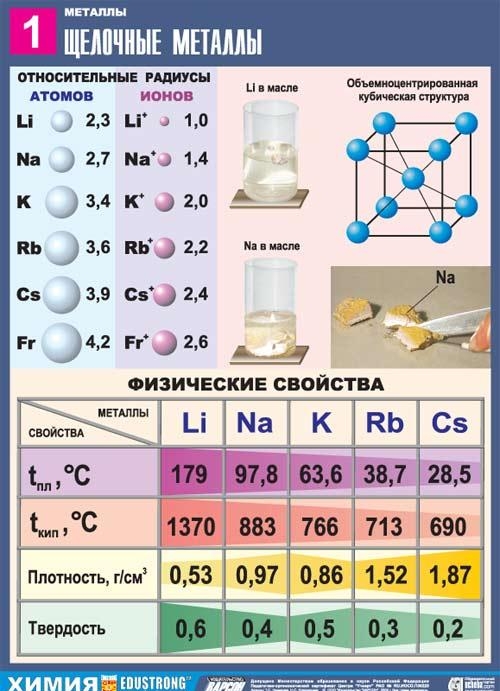
المعادن القلوية
المعدن هو
الفلزات القلوية - عناصر المجموعة الفرعية الرئيسية للمجموعة الأولى من النظام الدوري للعناصر الكيميائية لـ DI Dmitry Ivanovich Mendeleev: الليثيوم Li ، الصوديوم Na ، البوتاسيوم K ، الروبيديوم Rb ، السيزيوم Cs و France Fr. وتسمى هذه المعادن القلوية لأن معظم مركباتها قابلة للذوبان في الماء. في السلافية ، تعني كلمة "ترشيح" "الذوبان" ، وهذا يحدد اسم هذه المجموعة من المعادن. عندما تذوب المعادن القلوية في الماء ، تتشكل هيدروكسيدات قابلة للذوبان ، تسمى القلويات.
الخصائص العامة للمعادن القلوية
في النظام الدوري ، يتبعون الغازات الخاملة فورًا ؛ لذلك ، فإن إحدى سمات بنية ذرات الفلزات القلوية هي أنها تحتوي على إلكترون واحد بمستوى طاقة جديد: التكوين الإلكتروني هو ns1. من الواضح أن إلكترونات التكافؤ للمعادن القلوية يمكن إزالتها بسهولة ، لأنها مفيدة بقوة للذرة للتبرع بالإلكترون والحصول على تكوين غاز خامل. لذلك ، تتميز جميع المعادن القلوية بتقليل الخواص. وهذا ما تؤكده القيم المنخفضة لإمكانيات التأين الخاصة بهم (تعد إمكانات التأين لذرة السيزيوم واحدة من أقلها) والقدرة الكهربية (EO).
جميع المعادن في هذه المجموعة الفرعية لها لون فضي-أبيض (باستثناء السيزيوم الأصفر الفضي) ، فهي ناعمة جدًا ، ويمكن قطعها بمشرط. الليثيوم والصوديوم والبوتاسيوم أخف من الماء وتطفو على سطحه ، وتتفاعل معه.
تم العثور على المعادن القلوية في الطبيعة في شكل مركبات تحتوي على كاتيونات مفردة الشحنة. تحتوي العديد من المعادن على معادن من المجموعة الفرعية الرئيسية للمجموعة الأولى. على سبيل المثال ، تتكون أورثوكلاز ، أو الفلسبار ، من ألومينوسيليكات البوتاسيوم K2 ، مشابه معدنييحتوي على الصوديوم - Albite - له تكوين Na2. تحتوي مياه البحر على كلوريد الصوديوم كلوريد الصوديوم ، وتحتوي التربة على أملاح البوتاسيوم - سيلفين كلوريد الصوديوم ، سيلفينيت كلوريد الصوديوم. KCl ، carnallite KCl. MgCl2. 6H2O ، polygalite K2SO4. MgSO4. CaSO4. 2H2O.
الخواص الكيميائية للمعادن القلوية
المعدن هو
بسبب النشاط الكيميائي العالي للمعادن القلوية فيما يتعلق بالماء والأكسجين والنيتروجين ، يتم تخزينها تحت طبقة من الكيروسين. لتنفيذ التفاعل باستخدام فلز قلوي ، يتم قطع قطعة من الحجم المطلوب بعناية باستخدام مشرط أسفل الطبقة كيروسينفي جو الأرجون ، يتم تنظيف السطح المعدني تمامًا من منتجات تفاعله مع الهواء وعندها فقط يتم وضع العينة في وعاء التفاعل.
1. التفاعل مع الماء. من الخصائص المهمة للمعادن القلوية نشاطها العالي فيما يتعلق بالمياه. يتفاعل الليثيوم بهدوء شديد (بدون انفجار) مع الماء.
في تفاعل مماثل ، يحترق الصوديوم بلهب أصفر ويحدث انفجار صغير. البوتاسيوم أكثر نشاطًا: في هذه الحالة ، يكون الانفجار أقوى بكثير ، ويكون اللهب أرجواني اللون.
2. التفاعل مع الأكسجين. منتجات الاحتراق من الفلزات القلوية في الهواء لها تركيبة مختلفة حسب نشاط المعدن.
الليثيوم فقط يحترق في الهواء مع تكوين أكسيد متكافئ.
أثناء حرق الصوديوم ، يتكون بيروكسيد Na2O2 أساسًا مع خليط صغير من بيروكسيد NaO2.
منتجات الاحتراق من البوتاسيوم ، الروبيديوم والسيزيوم تحتوي أساسا الفائق.
للحصول على أكاسيد الصوديوم والبوتاسيوم ، يتم تسخين مخاليط هيدروكسيد أو بيروكسيد أو فوق أكسيد معادن زائدة في غياب الأكسجين.
يعتبر الانتظام التالي نموذجيًا لمركبات الأكسجين من الفلزات القلوية: مع زيادة نصف قطر الكاتيون المعدني القلوي ، يزداد استقرار مركبات الأكسجين المحتوية على بيروكسيد أيون O22 وفوق الأكسيد الفائق O2-.
بالنسبة للمعادن القلوية الثقيلة ، فإن تكوين الأوزونيات المستقرة إلى حد ما من التكوين EO3 هو خاصية مميزة. جميع مركبات الأكسجين لها لون مختلف ، تتعمق شدته في سلسلة من Li إلى Cs.
تمتلك أكاسيد الفلزات القلوية جميع الخصائص الكامنة في الأكاسيد الأساسية: تتفاعل مع الماء ، أكاسيد الحمض والأحماض.
البيروكسيدات وأكسيد الفائق يحمل خصائص عوامل مؤكسدة قوية.
تتفاعل البيروكسيدات وأكسيد الفوسفات بشكل مكثف مع الماء ، وتشكل هيدروكسيدات.
3. التفاعل مع المواد الأخرى. تتفاعل المعادن القلوية مع العديد من المعادن غير المعدنية. عند تسخينها ، تتحد مع الهيدروجين لتكوين هيدريدات ، مع الهالوجين ، رماديوالنيتروجين والفوسفور والكربون والسيليكون لتشكيل ، على التوالي ، الهاليدات ، والكبريتيدات ، النتريد ، الفوسفيدات ، كربيدات ومبيدات السيليكون.
عند تسخينها ، تكون الفلزات القلوية قادرة على التفاعل مع المعادن الأخرى ، وتشكيل مركبات معدنية. تتفاعل المعادن القلوية مع الأحماض بنشاط (مع انفجار).
تذاب المعادن القلوية في الأمونيا السائلة ومشتقاتها - الأمينات والأميدات.
عندما يذوب في الأمونيا السائلة ، يفقد المعدن القلوي إلكترونًا ، تذوبه جزيئات الأمونيا ويمنح المحلول لونًا أزرق. تتحلل الأميدات الناتجة بسهولة عن طريق الماء مع تكوين القلويات والأمونيا.
تتفاعل المعادن القلوية مع المواد العضوية مع الكحول (مع تكوين المشروبات الكحولية) والأحماض الكربوكسيلية (مع تشكيل الأملاح).
4. التحديد النوعي للمعادن القلوية. نظرًا لأن إمكانات التأين للمعادن القلوية صغيرة ، عندما يتم تسخين المعدن أو مركباته في لهب ، فإن الذرة تتأين وتلون الشعلة بلون معين.
إنتاج المعادن القلوية
1. لإنتاج المعادن القلوية ، وخاصة التحليل الكهربائي للذوبان في هاليداتها ، وغالبًا ما تكون الكلورايد مكونة طبيعية المعادن:
الكاثود: Li + + e → Li
الأنود: 2Cl- - 2e → Cl2
2. في بعض الأحيان ، للحصول على المعادن القلوية ، يتم إجراء التحليل الكهربائي لصهور الهيدروكسيد:
الكاثود: Na + + e → Na
الأنود: 4OH- - 4e → 2H2O + O2
نظرًا لأن المعادن القلوية الموجودة في السلسلة الكهروكيميائية من الفولتية تقع على يسار الهيدروجين ، فإن تحضيرها الكهربائي من المحاليل الملحية أمر مستحيل ؛ في هذه الحالة ، يتم تشكيل القلويات المقابلة والهيدروجين.
هيدروكسيدات
للحصول على هيدروكسيدات الفلزات القلوية ، تستخدم طرق التحليل الكهربائي أساسًا. الأكثر انتشارًا هو إنتاج هيدروكسيد الصوديوم عن طريق التحليل الكهربائي لمحلول مائي مركّز من كلوريد الصوديوم.
أولاً ، تم الحصول على القلويات من خلال تفاعل التبادل.
كانت القلويات التي تم الحصول عليها بهذه الطريقة ملوثة بشدة بصودا Na2CO3.
هيدروكسيدات الفلزات القلوية عبارة عن مواد استرطابية بيضاء ، المحاليل المائية لها قواعد قوية. يشاركون في جميع ردود الفعل المميزة للقواعد - تتفاعل مع الأحماض وأكاسيد الحمضية والمذبذبة ، وهيدروكسيدات مذبذبة.
عند تسخينها ، يتم تسخين هيدروكسيدات الفلزات القلوية دون تحللها عند تسخينها ، باستثناء هيدروكسيد الليثيوم ، الذي يتحلل ، مثل هيدروكسيدات الفلز في المجموعة الفرعية الرئيسية للمجموعة الثانية ، إلى أكسيد وماء عند التكلس.
يستخدم هيدروكسيد الصوديوم لصنع الصابون والمنظفات الصناعية والألياف الصناعية والمركبات العضوية ، مثل الفينول.
الكربونات
أحد المنتجات المعدنية القلوية المهمة هو Na2CO3 الصودا. يتم إنتاج الجزء الأكبر من الصودا في العالم بأسره وفقًا لطريقة Solve ، التي تم اقتراحها في بداية القرن العشرين. يكمن جوهر الطريقة على النحو التالي: يتم تشريب محلول مائي من كلوريد الصوديوم ، تضاف إليه الأمونيا ، بثاني أكسيد الكربون عند درجة حرارة 26 - 30 درجة مئوية. في هذه الحالة ، يتم تشكيل بيكربونات الصوديوم القابلة للذوبان بشكل دائم ، والتي تسمى صودا الخبز.
تضاف الأمونيا لتحييد البيئة الحمضية التي تحدث عندما يتم تمرير ثاني أكسيد الكربون في المحلول وإنتاج أيون HCO3 - بيكربونات ، وهو أمر ضروري لترسيب بيكربونات الصوديوم. بعد فصل شرب الصودا ، يتم تسخين المحلول الذي يحتوي على كلوريد الأمونيوم بالليمون ويتم إطلاق الأمونيا ، والتي يتم إرجاعها إلى منطقة التفاعل.
وبالتالي ، في طريقة الأمونيا لإنتاج الصودا ، فإن النفايات الوحيدة هي كلوريد الكالسيوم المتبقي في المحلول ويكون له استخدام محدود.
يتم الحصول على التكلس ، أو الغسيل ، صودا Na2CO3 وثاني أكسيد الكربون ، المستخدم في عملية إنتاج بيكربونات الصوديوم ، عن طريق تحميص بيكربونات الصوديوم.
المشتري الرئيسي للصودا هو الزجاج.
على عكس ملح حامض قليل الذوبان في NaHCO3 ، فإن كربونات البوتاسيوم الهيدروجينية KHCO3 قابلة للذوبان بشدة في الماء ، وبالتالي كربونات البوتاسيوم ، أو البوتاس ، يتم إنتاج K2CO3 من خلال عمل ثاني أكسيد الكربون على محلول هيدروكسيد البوتاسيوم.
يستخدم البوتاس في صناعة الزجاج والصابون السائل.
الليثيوم هو المعدن القلوي الوحيد الذي لم يتم الحصول على الهيدروكربونات. السبب في هذه الظاهرة هو دائرة نصف قطرها صغيرة جدا من أيون الليثيوم ، والذي لا يسمح لها بحمل أيون HCO3- كبير إلى حد ما.
الليثيوم
المعدن هو
الليثيوم - عنصر من عناصر المجموعة الفرعية الرئيسية للمجموعة الأولى ، الفترة الثانية للنظام الدوري للعناصر الكيميائية D. منديليف ديمتري إيفانوفيتش، مع الرقم الذري 3. تم تعيينه بواسطة الرمز Li (lat. Lithium). الليثيوم مادة بسيطة (رقم CAS: 7439-93-2) هو معدن قلوي لينة من اللون الفضي الأبيض.
تم اكتشاف الليثيوم في عام 1817 من قبل الكيميائي السويدي وعالم المعادن أرفيدسون ، أولاً في الصخور المعدنية (Li، Na) ، ثم في Spodumene LiAl وفي lepidolite KLi1.5Al1.5 (F، OH) 2. تلقى همفري ديفي أول معدن الليثيوم في عام 1825.
حصلت الليثيوم اسمها بسبب حقيقة أنه تم العثور عليها في "الحجارة" (اليونانية. ςος - الحجر). كانت تسمى في الأصل "lithion" ، وقد اقترح Berzelius الاسم الحديث.
الليثيوم هو معدن أبيض فضي ، ناعم وطويل ، أصعب من الصوديوم ، لكنه أكثر ليونة من الرصاص. يمكن معالجتها عن طريق الضغط والمتداول.
في درجة حرارة الغرفة ، يحتوي معدن الليثيوم على شعرية مركزية على الجسم (التنسيق رقم 8) ، عندما يتحول البرد إلى شبكة شعرية مكعبة ، حيث يحيط كل ذرة بها تنسيق مزدوج الشكل بكوكتاهدرايد بواسطة 12 أخرى. أقل من 78 كلفن ، الشكل البلوري المستقر عبارة عن هيكل سداسي الشكل معبأ فيه كل ذرة من الليثيوم بها 12 من الجيران الأقرب تقع في رؤوس كوبوكتاهيدرون.
من بين جميع المعادن القلوية ، يتميز الليثيوم بأعلى درجة انصهار وغليان (180.54 و 1340 درجة مئوية ، على التوالي) ، ولديه أدنى كثافة في درجة حرارة الغرفة بين جميع المعادن (0.533 جم / سم 2 ، أي ما يقرب من نصف كثافة الماء).
صغر حجم ذرة الليثيوم يؤدي إلى ظهور خصائص خاصة من المعدن. على سبيل المثال ، يختلط مع الصوديوم فقط عند درجات حرارة أقل من 380 درجة مئوية ولا يختلط مع البوتاسيوم المنصهر ، الروبيديوم والسيزيوم ، بينما تختلط أزواج أخرى من المعادن القلوية مع بعضها البعض بأي نسبة.
المعادن القلوية ، غير مستقرة في الهواء. الليثيوم هو أقل المعادن القلوية نشاطًا ، ولا يتفاعل عملياً مع الهواء الجاف (وحتى مع الأكسجين الجاف) في درجة حرارة الغرفة.
في الهواء الرطب ، يتأكسد ببطء ، ويتحول إلى نيتريد Li3N ، هيدروكسيد LiOH ، وكربونات Li2CO3. عند تسخينها بالأكسجين ، تحترق وتتحول إلى أكسيد Li2O. هناك ميزة مثيرة للاهتمام وهي أنه في درجة الحرارة تتراوح من 100 درجة مئوية إلى 300 درجة مئوية ، يتم طلاء الليثيوم بغشاء أكسيد أكسيد كثيف ، ولا يتأكسد في المستقبل.
في عام 1818 ، أسس الكيميائي الألماني ليوبولد جميلين أن الليثيوم وأملاحه تلون لهب كارمين الأحمر ، وهو علامة نوعية لتحديد الليثيوم. درجة حرارة الاشتعال حوالي 300 درجة مئوية. منتجات الاحتراق تهيج الغشاء المخاطي للبلعوم الأنفي.
بهدوء ، دون انفجار وحريق ، يتفاعل مع الماء ، وتشكيل LiOH و H2. يتفاعل أيضًا مع كحول الإيثيل ، مكونًا للكحوليات ، مع الأمونيا ومع الهالوجينات (مع اليود - فقط عند تسخينه).
يتم تخزين الليثيوم في أيثر البترول ، البارافين ، البنزين و / أو الزيوت المعدنية في صناديق من القصدير محكمة الغلق. يؤدي معدن الليثيوم إلى حروق في الجلد والأغشية المخاطية وفي العينين.
في المعادن الحديدية وغير الحديدية ، يتم استخدام الليثيوم لإزالة الأكسجين وزيادة ليونة وقوة السبائك. يستخدم الليثيوم في بعض الأحيان لاستعادة المعادن النادرة عن طريق طرق المعادن.
كربونات الليثيوم هي أهم مادة مساعدة (تضاف إلى المنحل بالكهرباء) في صهر الألمنيوم ويزيد استهلاكه كل عام بما يتناسب مع حجم إنتاج الألومنيوم العالمي (استهلاك كربونات الليثيوم من 2.5 إلى 3.5 كجم لكل طن من الألومنيوم المصهور).
سبائك الليثيوم مع الفضة والذهب ، وكذلك cuprum ، هم الجنود فعالة للغاية. سبائك الليثيوم مع المغنيسيوم ، سكانديوم ، cuprum ، الكادميوم والألومنيوم هي مواد جديدة واعدة في مجال الطيران والفضاء. بناءً على ألومينات وسيليكات الليثيوم ، تم صناعة السيراميك الذي تم تشديده في درجة حرارة الغرفة واستخدم في المعدات العسكرية ، والمعادن ، وفي الطاقة النووية الحرارية في المستقبل. يعتمد الزجاج على سيليكات الليثيوم والألمنيوم المقوى بألياف كربيد السيليكون. الليثيوم يصلب بشكل فعال للغاية سبائك الرصاص ويمنحهم ليونة ومقاومة التآكل.
أملاح الليثيوم لها تأثير عقلي وتستخدم في الطب في الوقاية والعلاج من عدد من الأمراض العقلية. الأكثر شيوعا في هذه القدرة هو كربونات الليثيوم. المستخدمة في الطب النفسي لتحقيق الاستقرار في مزاج الأشخاص الذين يعانون من اضطراب ثنائي القطب وتقلب المزاج المتكرر. إنه فعال في الوقاية من الهوس الناتج عن الاكتئاب ويقلل من الانتحار ، وقد لاحظ المسعفون مرارًا أن بعض مركبات الليثيوم (في الجرعات المناسبة ، بالطبع) لها تأثير إيجابي على المرضى الذين يعانون من الاكتئاب الهوسي. وأوضح هذا التأثير بطريقتين. من ناحية ، وجد أن الليثيوم قادر على تنظيم نشاط بعض الإنزيمات المشاركة في نقل أيونات الصوديوم والبوتاسيوم من السائل خارج الخلية إلى خلايا الدماغ. من ناحية أخرى ، لوحظ أن أيونات الليثيوم تؤثر بشكل مباشر على التوازن الأيوني للخلية. وتعتمد حالة المريض إلى حد كبير على توازن الصوديوم والبوتاسيوم: فائض الصوديوم في الخلايا هو سمة للمرضى المصابين بالاكتئاب ، ونقصه هو بسبب معاناة الهوس. محاذاة توازن البوتاسيوم الصوديوم ، وأملاح الليثيوم لها تأثير إيجابي على تلك وغيرها.
صوديوم
المعدن هو
الصوديوم - عنصر من عناصر المجموعة الفرعية الرئيسية للمجموعة الأولى ، المجموعة الثالثة فترة النظام الدوري للعناصر الكيميائية D. I. ديمتري إيفانوفيتش منديليف، مع العدد الذري 11. يتم تعيينه بواسطة الرمز Na (lat. Natrium). المادة البسيطة هي الصوديوم (رقم سجل المستخلصات الكيميائية: 7440-23-5) - وهو معدن قلوي ناعم من اللون الفضي الأبيض.
في الماء ، يتصرف الصوديوم بنفس طريقة الليثيوم: يتفاعل التفاعل مع التطور السريع للهيدروجين ، ويتكون هيدروكسيد الصوديوم في المحلول.
تم استخدام الصوديوم (أو بالأحرى مركباته) منذ العصور القديمة. على سبيل المثال ، الصودا (النترون) ، الموجودة بشكل طبيعي في مياه بحيرات الصودا في مصر. استخدم المصريون القدماء الصودا الطبيعية لتحنيط قماش التبييض وطهي الطعام وصناعة الدهانات والزجاج. يكتب بليني الأكبر أنه في صودا دلتا النيل (كانت هناك نسبة كافية من الشوائب فيه) كان معزولا عن مياه النهر. تم بيعه على شكل قطع كبيرة ، بسبب خليط من الفحم مطلي باللون الرمادي أو حتى الأسود.
تم الحصول على الصوديوم لأول مرة من قبل الكيميائي الإنجليزي همفري ديفي في عام 1807 عن طريق التحليل الكهربائي من هيدروكسيد الصوديوم الصلب.
اسم "الصوديوم" (natrium) يأتي من النطرون العربي (باللغة اليونانية - نيترون) ويشير في الأصل إلى الصودا الطبيعية. العنصر نفسه كان يسمى سابقا الصوديوم (اللات. الصوديوم).

الصوديوم معدن فضي-أبيض ، في طبقات رقيقة مع صبغة بنفسجية ، من البلاستيك ، حتى ناعم (سهل القطع بسكين) ، شريحة جديدة من بريق الصوديوم. الموصلية الكهربائية والتوصيل الحراري للصوديوم عالية جداً ، والكثافة هي 0.96842 جم / سم 2 (عند 19.7 درجة مئوية) ، ونقطة الانصهار هي 97.86 درجة مئوية ، ونقطة الغليان هي 883.15 درجة مئوية.
تتأكسد بسهولة القلوية المعدنية في الهواء. للحماية من الأكسجين ، يتم تخزين الصوديوم المعدني تحت طبقة كيروسين. الصوديوم أقل نشاطًا من الليثيوم ، لذلك يتفاعل مع النيتروجين فقط عند تسخينه:
مع زيادة كبيرة من الأكسجين ، يتم تشكيل بيروكسيد الصوديوم
2Na + O2 \u003d Na2O2
يستخدم معدن الصوديوم على نطاق واسع في الكيمياء التحضيرية و صناعة كعامل تخفيض قوي ، بما في ذلك في المعادن. يستخدم الصوديوم في إنتاج بطاريات كبريت الصوديوم عالية الطاقة. يتم استخدامه أيضًا في صمامات عوادم الشاحنات كمغسلة للحرارة. في بعض الأحيان ، يتم استخدام الصوديوم المعدني كمادة للأسلاك الكهربائية المخصصة للتيارات العالية للغاية.
في سبيكة مع البوتاسيوم ، وكذلك مع الروبيديوم والسيزيوم ، يتم استخدامه كوسيلة نقل الحرارة عالية الكفاءة. على وجه الخصوص ، تتميز سبيكة تشتمل على تركيبة من الصوديوم بنسبة 12٪ ، والبوتاسيوم بنسبة 47٪ ، والسيزيوم بنسبة 41٪ بنقطة انصهار منخفضة قياسية تبلغ -78 درجة مئوية ، وتم اقتراحها كمائع يعمل في محركات الصواريخ الأيونية ومبردًا لمحطات الطاقة النووية.
يستخدم الصوديوم أيضًا في مصابيح تفريغ الضغط العالي والمنخفض (NLVD و NLND). تستخدم مصابيح NLVD من النوع DNaT (Arc Sodium Tubular) على نطاق واسع في إضاءة الشوارع. أنها تعطي الضوء الأصفر الساطع. عمر خدمة مصابيح DNaT هو 12-24000 ساعة. لذلك ، لا غنى عن مصابيح تفريغ نوع DNaT للإضاءة الحضرية والمعمارية والصناعية. هناك أيضًا مصابيح DNaS و DNaMT (Arc Sodium Matte) و DNaZ (Arc Sodium Mirror) و DNaTBR (Arc Sodium Tube بدون عطارد).
يستخدم معدن الصوديوم في التحليل النوعي للمواد العضوية. يتم تحييد سبيكة الصوديوم ومواد الاختبار باستخدام الإيثانول ، حيث تتم إضافة عدة ملليلتر من الماء المقطر وتنقسم إلى 3 أجزاء ، J. Lassenya (1843) ، بهدف تحديد النيتروجين والكبريت والهالوجينات ( اختبار في Beilstein)
كلوريد الصوديوم (ملح الطعام) هو أقدم عامل توابل والحفاظ عليه.
يستخدم أزيد الصوديوم (Na3N) كعامل نيتريد في المعادن وفي إنتاج أزيد الرصاص.
يستخدم سيانيد الصوديوم (NaCN) في الطريقة الهيدرولوجية للمعادن لغسيل الذهب من الصخور ، وكذلك في الصلب النيتروجيني وفي الطلاء الكهربائي (الجدرانيات ، التذهيب).
يستخدم كلورات الصوديوم (NaClO3) لتدمير النباتات غير المرغوب فيها على مسارات السكك الحديدية.
بوتاسيوم
كالي - عنصر من عناصر المجموعة الفرعية الرئيسية للمجموعة الأولى ، الرابعة فترة النظام الدوري للعناصر الكيميائية D. I. Mendeleev Dmitry Ivanovich ، بالرقم الذري 19. تم تعيينه بواسطة الرمز K (lat. Kalium). المادة البسيطة هي البوتاسيوم (رقم سجل المستخلصات الكيميائية: 7440-09-7) - وهو معدن قلوي ناعم من اللون الفضي الأبيض.
في الطبيعة ، يوجد البوتاسيوم فقط في المركبات ذات العناصر الأخرى ، على سبيل المثال ، في مياه البحر ، وكذلك في العديد من المعادن. يتأكسد بسرعة كبيرة في الهواء ويتفاعل بسهولة كيميائيًا ، لا سيما مع الماء ، ويشكل قلويًا. في كثير من النواحي ، تكون الخواص الكيميائية للبوتاسيوم قريبة جدًا من الصوديوم ، ولكن من وجهة نظر الوظيفة البيولوجية واستخدامها من قبل خلايا الكائنات الحية ، فإنها لا تزال مختلفة.
تم استخدام البوتاسيوم (بشكل أكثر دقة ، مركباته) منذ العصور القديمة. لذلك ، كان إنتاج البوتاس (الذي كان يستخدم كمنظف) موجودًا بالفعل في القرن الحادي عشر. تم معالجة الرماد المتشكل أثناء حرق القش أو الخشب بالماء ، وتم تبخير المحلول الناتج (الخمور) بعد الترشيح. المخلفات الجافة ، بالإضافة إلى كربونات البوتاسيوم ، تحتوي على كبريتات البوتاسيوم K2SO4 ، الصودا وكلوريد البوتاسيوم KCl.
في عام 1807 ، قام الكيميائي الإنجليزي ، ديفي ، بعزل البوتاسيوم عن طريق التحليل الكهربائي للبوتاسيوم الكاوية الصلب (KOH) ودعا "البوتاسيوم" (البوتاسيوم اللاتيني ؛ هذا الاسم لا يزال يستخدم في الإنجليزية والفرنسية والإسبانية والبرتغالية والبولندية) في عام 1809 ، اقترح L.V. Gilbert اسم "البوتاسيوم" (lat. Kalium ، من العربية kali - البوتاس). دخل هذا الاسم اللغة الألمانية ، ومن هناك إلى معظم لغات شمال وشرق أوروبا (بما في ذلك الروسية) و "فاز" عند اختيار رمز لهذا العنصر - K.
البوتاسيوم مادة فضية ذات بريق مميز على سطح طازج. خفيف جدا وقابل للانصهار. يذوب بشكل جيد نسبيا في الزئبق ، ويشكل الملغم. عند إدخاله في لهب الموقد ، فإن البوتاسيوم (وكذلك مركباته) يلون اللهب بلون وردي بنفسجي مميز.
البوتاسيوم ، مثل الفلزات القلوية الأخرى ، يُظهر خواص معدنية نموذجية وهو نشط كيميائيًا جدًا ، ويسهل إطلاقًا إلكترونات.
إنه عامل تخفيض قوي. إنه يجمع بنشاط كبير مع الأكسجين بحيث لا يشكل أكسيد ، ولكن فوق أكسيد البوتاسيوم KO2 (أو K2O4). عند تسخينها في جو الهيدروجين ، يتم تشكيل هيدريد البوتاسيوم KH. يتفاعل بشكل جيد مع جميع المواد غير المعدنية ، وتشكيل الهاليدات ، والكبريتيدات ، والنيتريدات ، والفوسفيدات ، وما إلى ذلك ، وكذلك مع المواد المعقدة مثل الماء (يحدث التفاعل مع انفجار) ، ومختلف الأكاسيد والأملاح. في هذه الحالة ، فإنها تقلل المعادن الأخرى إلى حالة حرة.
يتم تخزين البوتاسيوم تحت طبقة من الكيروسين.
يتم استخدام سائل في درجة حرارة الغرفة من البوتاسيوم والصوديوم كمبرد في الأنظمة المغلقة ، على سبيل المثال ، في محطات الطاقة الذرية سريعة النيترون. بالإضافة إلى ذلك ، تستخدم سبائكها السائلة مع الروبيديوم والسيزيوم على نطاق واسع. تكوين سبيكة الصوديوم 12 ٪ ، البوتاسيوم 47 ٪ ، السيزيوم 41 ٪ لديه نقطة انصهار منخفضة قياسية −78 درجة مئوية.
مركبات البوتاسيوم هي أهم العناصر الغذائية وبالتالي تستخدم كأسمدة.
تستخدم أملاح البوتاسيوم على نطاق واسع في الطلاء بالكهرباء ، لأنها على الرغم من التكلفة المرتفعة نسبيًا ، فإنها غالبًا ما تكون قابلة للذوبان أكثر من أملاح الصوديوم المقابلة ، وبالتالي توفر عملية مكثفة للكهارل عند كثافات تيار عالية.
البوتاسيوم عنصر غذائي أساسي ، خاصة في عالم النبات. مع نقص البوتاسيوم في التربة ، تنمو النباتات بشكل سيئ للغاية وتنخفض ، لذلك يتم استخدام حوالي 90 ٪ من أملاح البوتاسيوم المستخرجة كأسمدة.
البوتاسيوم ، جنبا إلى جنب مع النيتروجين والفوسفور ، هي من بين العناصر الرئيسية لتغذية النبات. وظيفة البوتاسيوم في النباتات ، وكذلك العناصر الأخرى اللازمة لها ، هي محددة بدقة. في النباتات ، البوتاسيوم في شكل أيوني. يوجد البوتاسيوم بشكل رئيسي في السيتوبلازم وفراغات الخلايا. حوالي 80 ٪ من البوتاسيوم في عصارة الخلية.
وظائف البوتاسيوم متنوعة جدا. وقد وجد أنه يحفز المسار الطبيعي لعملية التمثيل الضوئي ، ويعزز تدفق الكربوهيدرات من شفرات الأوراق إلى الأعضاء الأخرى ، وكذلك توليف السكريات.
يعزز البوتاسيوم من تراكم السكريات الأحادية في محاصيل الفاكهة والخضروات ، ويزيد من نسبة السكر في المحاصيل الجذرية ، والنشا في البطاطس ، ويثخن جدران خلايا قش محاصيل الحبوب ويزيد من مقاومة الخبز للسكن ، ويحسن نوعية الألياف في الكتان والقنب.
المساهمة في تراكم الكربوهيدرات في الخلايا النباتية ، يزيد البوتاسيوم من الضغط الاسموزي لعصير الخلية وبالتالي يزيد من مقاومة البرد ومقاومة الصقيع للنباتات.
تمتص البوتاسيوم من النباتات في شكل الكاتيونات ، ومن الواضح أنه لا يزال في هذا الشكل في الخلايا ، وينشط أهم الكيمياء الحيوية العمليات في الخلايا النباتية ، يزيد البوتاسيوم من مقاومته لمختلف الأمراض ، خلال موسم النمو وما بعد الحصاد ، ويحسن بشكل كبير من الحفاظ على جودة الفواكه والخضروات.
يتسبب نقص البوتاسيوم في العديد من الاضطرابات الأيضية في النباتات ، ويضعف نشاط عدد من الإنزيمات ، ويضرب الكربوهيدرات وأيض البروتين ، التكاليف الكربوهيدرات للتنفس. نتيجة لذلك ، تقل إنتاجية المصنع ، وتنخفض جودة المنتج.



الروبيديوم عنصر فلزي
يعتبر الروبيديوم أحد عناصر المجموعة الفرعية الرئيسية للمجموعة الأولى ، وهي الفترة الخامسة للنظام الدوري للعناصر الكيميائية لـ DI Dmitry Ivanovich Mendeleev ، برقم ذري 37. تم تعيينه بواسطة الرمز Rb (lat. Rubidium). المادة البسيطة هي الروبيديوم (رقم سجل المستخلصات الكيميائية: 7440-17-7) - وهو معدن قلوي ناعم من اللون الفضي الأبيض.
في عام 1861 ، اكتشف العلماء الألمان روبيرت فيلهلم بونسن وجوستاف روبرت كيرشوف ، الذين درسوا الألومينوسيليكات الطبيعية باستخدام التحليل الطيفي ، عنصرًا جديدًا فيهم ، أطلق عليهم فيما بعد اسم الروبيديوم بلون أقوى خطوط الطيف.
يشكل الروبيديوم بلورات بيضاء ناعمة فضية ذات لمعان معدني على قطعة جديدة. صلابة برينل 0.2 مليون / متر مكعب (0.02 كلغ / م 2). تتميز الشبكة البلورية لروبيديوم بالحجم المكعب ، وهي \u003d 5.71 Е (في درجة حرارة الغرفة). نصف القطر الذري هو 2.48 E ، ونصف قطر الأيونات هو Rb + 1.49 E. والكثافة 1.525 جم / سم 2 (0 درجة مئوية) ، النائب 38.9 درجة مئوية ، النائب 703 درجة مئوية. الحرارة المحددة هي 335.2 j / (kg · K) ، والمعامل الحراري للتمدد الخطي هو 9.0 · 10-5 deg-1 (0-38 ° C) ، ومعامل المرونة هو 2.4 GN / m² (240 kgf / mm²) ، حجم معين المقاومة الكهربائية 11.29 · 10-6 أوم · سم (20 درجة مئوية) ؛ الروبيديوم مغناطيسي.
المعدن القلوي ، غير مستقر للغاية في الهواء (يتفاعل مع الهواء في وجود آثار من الماء مع الاشتعال). إنها تشكل جميع أنواع الأملاح - معظمها قابلة للذوبان (الكلورات والبيركلورات قابلة للذوبان بشكل طفيف). هيدروكسيد الروبيديوم هو مادة عدوانية للغاية للزجاج والمواد الإنشائية والحاويات الأخرى ، ويدمر المنصهر معظم المعادن (حتى البلاتين).
استخدام الروبيديوم متنوع ، وعلى الرغم من حقيقة أنه في عدد من مجالات تطبيقه ، فإنه أدنى من السيزيوم في خصائصه الفيزيائية الأكثر أهمية ، ومع ذلك ، يلعب هذا المعدن القلوي النادر دورًا مهمًا في التقنيات الحديثة. يمكن ملاحظة تطبيقات الروبيديوم التالية: الحفز الكيميائي الإلكتروني صناعةوالبصريات الخاصة والطب الذري.
يستخدم الروبيديوم ليس فقط في شكله النقي ، ولكن أيضًا في شكل عدد من السبائك والمركبات الكيميائية. من المهم أن نلاحظ أن الروبيديوم له قاعدة جيدة ومواتية للغاية من المواد الخام ، ولكن الوضع مع توافر الموارد هو أفضل بكثير مما كان عليه في حالة السيزيوم والروبيديوم يمكن أن يكون له دور أكثر أهمية ، على سبيل المثال ، في الحفز الكيميائي (حيث أثبتت نفسها بنجاح).
يستخدم نظير الروبيديوم 86 على نطاق واسع في فحص أشعة غاما ، ومعدات القياس ، وكذلك في تعقيم عدد من الأدوية والمنتجات الغذائية الهامة. يعتبر الروبيديوم وسبائكه مع السيزيوم وسيطًا واعدًا واعدًا للغاية لوحدات التوربينات ذات درجة الحرارة المرتفعة (في هذا الصدد ، أصبح الروبيديوم والسيزيوم مهمًا في السنوات الأخيرة ، وتم إحالة التكلفة العالية للغاية للمعادن إلى الخلفية فيما يتعلق بإمكانيات زيادة كفاءة وحدات التوربينات بشكل حاد ، مما يعني و أقل نفقات الوقود والتلوث البيئي). النظم الأكثر استخدامًا القائمة على الروبيديوم كناقلات حرارية هي السبائك الثلاثية: الصوديوم - البوتاسيوم - الروبيديوم ، والصوديوم - الروبيديوم - السيزيوم.
في الحفز الكيميائي ، يستخدم الروبيديوم في التخليق العضوي وغير العضوي. النشاط التحفيزي للروبيديوم يستخدم بشكل رئيسي في تكرير عدد من المنتجات المهمة. يستخدم أسيتات الروبيديوم ، على سبيل المثال ، في تصنيع الميثانول وعدد من الكحوليات المرتفعة من غاز الماء ، وهذا بدوره مهم للغاية فيما يتعلق بالتغويز الجوفي للفحم وإنتاج الوقود السائل الاصطناعي للسيارات والوقود النفاث. لدى عدد من سبائك الروبيديوم مع التيلوريوم حساسية أعلى في منطقة الأشعة فوق البنفسجية من الطيف مقارنة بمركبات السيزيوم ، وفي هذا الصدد ، فهي قادرة في هذه الحالة على التنافس مع السيزيوم -133 كمواد للناقلات الضوئية. كجزء من تركيبات التشحيم الخاصة (السبائك) ، يتم استخدام الروبيديوم كمواد تشحيم فعالة للغاية في الفراغ (تكنولوجيا الصواريخ والفضاء).
يستخدم هيدروكسيد الروبيديوم لإعداد المنحل بالكهرباء في الشيت ذي درجة الحرارة المنخفضة ، بالإضافة إلى إضافة إلى محلول هيدروكسيد البوتاسيوم لتحسين أدائه في درجات حرارة منخفضة وزيادة الموصلية المنحلقة بالكهرباء. في خلايا وقود الهيدريد ، يتم استخدام الروبيديوم المعدني.
يستخدم كلوريد الروبيديوم في سبيكة مع كلوريد الكبريت لقياس درجات الحرارة العالية (تصل إلى 400 درجة مئوية).
يستخدم روبيديوم بلازما لإثارة إشعاع الليزر.
يستخدم كلوريد الروبيديوم ككهارل في خلايا الوقود ، ويمكن قول الشيء نفسه بالنسبة لهيدروكسيد الروبيديوم ، وهو فعال للغاية ككهارل في خلايا الوقود التي تستخدم أكسدة الفحم المباشرة.
سيزيوم
يعتبر السيزيوم عنصرًا في المجموعة الفرعية الرئيسية للمجموعة الأولى ، وهي الفترة السادسة للنظام الدوري للعناصر الكيميائية لـ DI Mendeleev Dmitry Ivanovich ، برقم ذري 55. تم تعيينه بواسطة الرمز Cs (lat. Cesium). المادة البسيطة هي السيزيوم (رقم سجل المستخلصات الكيميائية: 7440-46-2) - وهو معدن قلوي ناعم من اللون الفضي الأصفر. حصلت السيزيوم على اسمها لوجود خطين أزرقين مشرقين في طيف الانبعاث (من خط العرض. Caesius - السماء الزرقاء).
اكتشف السيزيوم في عام 1860 من قبل العلماء الألمان R.V. Bunsen و G.R. Kirchhoff في مياه الينابيع المعدنية Dürhheim في جمهورية ألمانيا بواسطة التحليل الطيفي ، وبالتالي أصبح العنصر الأول الذي اكتشفه التحليل الطيفي. في شكله النقي ، تم عزل السيزيوم لأول مرة في عام 1882 من قبل الكيميائي السويدي K. Setterberg خلال التحليل الكهربائي لمذاب بمزيج من سيانيد السيزيوم (CsCN) والباريوم.
معادن السيزيوم الرئيسية هي بولوكيت و avogadrite نادرة جدا (K، Cs). بالإضافة إلى ذلك ، في شكل شوائب ، يتم تضمين السيزيوم في عدد من الألوميني سيليكات: الليبيدوليت ، phlogopite ، البيوتيت ، الأمازونيت ، بيتاليت ، البريل ، السينفالديت ، الليوسيت ، الكارنيت. يستخدم بولوكيت و lepidolite كمواد خام صناعية.
في الإنتاج الصناعي للسيزيوم في شكل مركبات ، يتم استخلاصه من الملوثات المعدنية. يتم ذلك عن طريق فتح كلوريد أو كبريتات. الأول ينطوي على معالجة معدن الانطلاق بحمض الهيدروكلوريك الساخن ، وإضافة كلوريد الأنتيمون SbCl3 لترسيب مركب Cs3 ، والغسل بالماء الساخن أو محلول الأمونيا لتشكيل كلوريد السيزيوم CsCl. في الحالة الثانية ، تتم معالجتها بحمض الكبريتيك الساخن لتكوين CsAl (SO4) 2 · 12H2O الشب السيزيوم الشب.
في الاتحاد الروسي ، بعد انهيار اتحاد الجمهوريات الاشتراكية السوفياتية ، لم يتم الإنتاج الصناعي من نصف وسيت ، على الرغم من اكتشاف احتياطيات هائلة من المعادن في تندرا فورونوي بالقرب من مورمانسك في العهد السوفيتي. بحلول الوقت الذي تمكنت فيه الصناعة الروسية من الوقوف على قدميها ، اتضح أن الترخيص الكندي قد حصل على ترخيص لتطوير هذا الحقل. حاليا ، تتم معالجة واستخراج أملاح السيزيوم من اللقاح في نوفوسيبيرسك في مصنع ZAO Rare Metals.
هناك العديد من الطرق المعملية لإنتاج السيزيوم. يمكن الحصول عليها:
التسخين في الفراغ بمزيج من الكروم أو ثاني كرومات السيزيوم مع الزركونيوم ؛
تحلل أزيد السيزيوم في فراغ ؛
تسخين خليط من كلوريد السيزيوم والكالسيوم المحضرة خصيصًا.
جميع الطرق تستهلك الكثير من الوقت. الثاني يسمح لك بالحصول على معدن عالي النقاء ، لكنه متفجر ويتطلب تنفيذه لعدة أيام.
وجد السيزيوم تطبيقًا فقط في بداية القرن العشرين ، عندما تم اكتشاف معادنه وتم تطوير تقنية إنتاجه في شكل نقي. حاليا ، يتم استخدام السيزيوم ومركباته في الإلكترونيات والراديو والكهرباء والأشعة السينية والصناعة الكيميائية والبصريات والطب والطاقة النووية. يستخدم السيزيوم الطبيعي المستقر في الغالب ، وبدرجة محدودة ، نظيره المشع سيزيوم - 137 ، المستخلص من مجموع شظايا الانشطار من اليورانيوم والبلوتونيوم والثوريوم في مفاعلات محطات الطاقة النووية.
المعادن الأرضية القلوية
المعادن الأرضية القلوية هي عناصر كيميائية: الكالسيوم Ca ، السترونتيوم Sr ، الباريوم Ba ، الراديوم Ra (أحيانًا البريليوم Be والمغنيسيوم Mg يُشار إليهم بطريق الخطأ على المعادن الأرضية القلوية). تم تسميتها على هذا النحو لأن أكاسيدها - "تراب" (في مصطلحات الكيميائيين) - تنقل تفاعل قلوي إلى الماء. يتم توزيع أملاح المعادن الأرضية القلوية ، باستثناء الراديوم ، على نطاق واسع في الطبيعة في شكل معادن.
الكلسيوم
الكالسيوم عنصر من عناصر المجموعة الفرعية الرئيسية للمجموعة الثانية ، وهي الفترة الرابعة من النظام الدوري للعناصر الكيميائية لـ DI Dmitry Ivanovich Mendeleev ، برقم ذري 20. ويشار إليه بالرمز Ca (lat. Calcium). مادة الكالسيوم البسيطة (رقم سجل المستخلصات الكيميائية: 7440-70-2) عبارة عن معدن أرضي قلوي ناعم وناشط كيميائيًا ذو لون فضي وأبيض.
معدن الكالسيوم موجود في اثنين من التعديلات allotropic. إلى 443 درجة مئوية ، تكون α-Ca مستقرة مع شعرية مكعبة محورها الوجه (المعلمة a \u003d 0.558 نانومتر) ، β-Ca مستقرة مع شعرية محورها الجسم مكعب من نوع α-Fe (المعلمة a \u003d 0.448 نانومتر). إن المحتوى الحراري القياسي ΔH0 للانتقال α → β هو 0.93 كيلو جول / مول.
الكالسيوم هو معدن قلوي نموذجي للأرض. تفاعل الكالسيوم مرتفع ، ولكنه أقل من جميع المعادن الأرضية القلوية. يتفاعل بسهولة مع الأكسجين وثاني أكسيد الكربون ورطوبة الهواء ، ولهذا السبب عادة ما يكون سطح معدن الكالسيوم رماديًا باهتًا ، لذلك يتم تخزين الكالسيوم عادة في المختبر ، مثل المعادن الأرضية القلوية الأخرى ، في جرة مغلقة بإحكام تحت طبقة من الكيروسين أو البارافين السائل.
من بين الإمكانات القياسية ، يقع الكالسيوم على يسار الهيدروجين. تبلغ إمكانات الإلكترود القياسية لزوج Ca2 + / Ca0 2.84 فولت ، بحيث يتفاعل الكالسيوم بنشاط مع الماء ، ولكن دون اشتعال:
Ca + 2H2O \u003d Ca (OH) 2 + H2 + Q.
مع المواد غير الفعالة النشطة (الأكسجين ، الكلور ، البروم) ، يتفاعل الكالسيوم في الظروف العادية:
2Ca + O2 \u003d 2CaO ، Ca + Br2 \u003d CaBr2.
عندما يسخن في الهواء أو في الأكسجين ، فإن الكالسيوم يشتعل. مع المواد غير المعدنية الأقل نشاطًا (الهيدروجين ، البورون ، الكربون ، السيليكون ، النيتروجين ، الفوسفور وغيرها) ، يتفاعل الكالسيوم عند تسخينه ، على سبيل المثال:
Ca + H2 \u003d CaH2 ، Ca + 6B \u003d CaB6 ،
3Ca + N2 \u003d Ca3N2 ، Ca + 2C \u003d CaC2 ،
3Ca + 2P \u003d Ca3P2 (فوسفيد الكالسيوم) ؛ ومن المعروف أيضًا أن فسفيدات الكالسيوم في التراكيب CaP و CaP5 ؛
2Ca + Si \u003d Ca2Si (سيليسيد الكالسيوم) ؛ ومبيدات سيليكات الكالسيوم في التراكيب CaSi و Ca3Si4 و CaSi2 معروفة أيضًا.
عادةً ما يكون مسار التفاعلات المذكورة أعلاه مصحوبًا بإطلاق كمية كبيرة من الحرارة (أي أن هذه التفاعلات طاردة للحرارة). في جميع المركبات غير المعدنية ، تكون حالة أكسدة الكالسيوم +2. معظم مركبات الكالسيوم غير المعدنية تتحلل بسهولة عن طريق الماء ، على سبيل المثال:
CaH2 + 2H2O \u003d Ca (OH) 2 + 2H2 ،
Ca3N2 + 3H2O \u003d 3Ca (OH) 2 + 2NH3.
و Ca2 + أيون عديم اللون. عندما يتم إدخال أملاح الكالسيوم القابلة للذوبان في اللهب ، يتحول اللهب إلى الطوب الأحمر.
أملاح الكالسيوم مثل كلوريد CaCl2 ، بروميد CaBr2 ، CaI2 iodide و Ca (NO3) 2 نترات قابلة للذوبان في الماء بسهولة. لا يذوب في الماء فلوريد CaF2 ، كربونات CaCO3 ، كبريتات CaSO4 ، Ca3 (PO4) 2 orthophosphate ، CaC2O4 oxalate وبعضها الآخر.
المهم هو أنه على عكس كربونات الكالسيوم CaCO3 ، فإن كربونات الكالسيوم الحمضية (بيكربونات) Ca (HCO3) 2 قابلة للذوبان في الماء. في الطبيعة ، وهذا يؤدي إلى العمليات التالية. عندما تخترق الأمطار الباردة أو مياه النهر ، المشبعة بثاني أكسيد الكربون ، تحت الأرض وتدخل إلى الحجر الجيري ، يلاحظ انحلالها:
CaCO3 + CO2 + H2O \u003d Ca (HCO3) 2.
في نفس الأماكن التي تصل فيها المياه المشبعة ببيكربونات الكالسيوم إلى سطح الأرض ويتم تسخينها بواسطة الشمس ، يحدث التفاعل العكسي:
Ca (HCO3) 2 \u003d CaCO3 + CO2 + H2O.
حتى في الطبيعة هناك نقل كميات كبيرة من المواد. نتيجة لذلك ، يمكن أن تتشكل فجوات ضخمة تحت الأرض ، وتتشكل "جليد" حجري جميل - هوابط وسدود - في الكهوف.
إن وجود بيكربونات الكالسيوم المذابة في الماء يحدد إلى حد كبير الصلابة المؤقتة للمياه. يطلق عليه مؤقت لأنه عندما يغلي الماء ، يتحلل الهيدروكربونات ويترسب CaCO3. هذه الظاهرة ، على سبيل المثال ، تؤدي إلى تكوين مقياس في الغلاية مع مرور الوقت.
الإسترونتيوم عنصر فلزي
السترونتيوم - عنصر من عناصر المجموعة الفرعية الرئيسية للمجموعة الثانية ، وهي الفترة الخامسة للنظام الدوري للعناصر الكيميائية D. I. Mendeleev Dmitry Ivanovich ، برقم ذري 38. تم تعيينه بواسطة الرمز Sr (lat. Strontium). إن المادة البسيطة من السترونتيوم (رقم سجل المستخلصات الكيميائية: 7440-24-6) عبارة عن معدن أرضي قلوي ناعم وطري وقابل للالتصميم بلون فضي-أبيض. لديها نشاط كيميائي عالي ، يتفاعل بسرعة مع الرطوبة والأكسجين في الهواء ، ويصبح مغطى بغشاء أكسيد أصفر.
تم العثور على عنصر جديد في السترونيانيت المعدني ، والذي تم العثور عليه في عام 1764 في منجم رصاص بالقرب من قرية سترونشيان الاسكتلندية ، والتي أعطت الاسم لاحقًا للعنصر الجديد. تم تأسيس وجود أكسيد فلز جديد في هذا المعدن بعد 30 عامًا تقريبًا بواسطة William Kruykshenk و Ader Crawford. خصصها السيد همفري ديفي في عام 1808.
السترونتيوم - معدن من الفضة الناعمة البيضاء ، به ليونة ويونة ، يمكن قطعه بسكين بسهولة.
متعدد الأشكال - ثلاثة من تعديلاته معروفة. يصل إلى 215 درجة مئوية ، يكون التعديل الذي يتمحور حول وجه مكعب (α-Sr) مستقرًا ، بين 215 و 605 درجة مئوية - سداسي (β-Sr) ، أعلى من 605 درجة مئوية - تعديل محوره مكعب (Sr-Sr).
درجة انصهار - 768 درجة مئوية ، نقطة الغليان - 1390 درجة مئوية
السترونتيوم دائما يبدي توازنا +2 في مركباته. بفضل خصائصه ، فإن السترونتيوم قريب من الكالسيوم والباريوم ، ويحتل موقعًا وسيطًا بينهما.
في سلسلة الإجهادات الكهروكيميائية ، يكون السترونتيوم من بين أكثر المعادن نشاطًا (إمكاناته القطبية العادية هي .82.89 فولت. يتفاعل بنشاط مع الماء ، ويشكل هيدروكسيد:
Sr + 2H2O \u003d Sr (OH) 2 + H2
يتفاعل مع الأحماض ، ويزيل المعادن الثقيلة من أملاحها. مع الأحماض المركزة (H2SO4 ، HNO3) يتفاعل بضعف.
تتأكسد السترونتيوم المعدني سريعًا في الهواء ، مكونًا فيلمًا مصفرًا ، بالإضافة إلى أكسيد SrO ، يتواجد SrO2 peroxide و Sr3N2 دائمًا. عندما يتم تسخينه في الهواء ، فإنه يشعل ؛ السترونتيوم المسحوق في الهواء عرضة للاشتعال الذاتي.
يتفاعل بقوة مع غير المعادن - الكبريت ، الفوسفور ، الهالوجينات. يتفاعل مع الهيدروجين (فوق 200 درجة مئوية) ، والنيتروجين (فوق 400 درجة مئوية). عمليا لا تتفاعل مع القلويات.
في درجات الحرارة العالية ، يتفاعل مع ثاني أكسيد الكربون لتكوين كربيد:
5Sr + 2CO2 \u003d SrC2 + 4SrO
أملاح السترونتيوم القابلة للذوبان قليلاً مع الأنيونات Cl- ، I- ، NO3-. الأملاح مع الأنيونات F- ، SO42- ، CO32- ، PO43- قابلة للذوبان قليلاً.
يستخدم السترونتيوم في صناعة السبائك الكبرية وبعض سبائكها ، لإدخالها في خلائط الرصاص بالبطاريات ، لإزالة الكبريت من الحديد الزهر ، الكب الفولاذ.
الباريوم
الباريوم عنصر من عناصر المجموعة الفرعية الرئيسية للمجموعة الثانية ، وهي الفترة السادسة للنظام الدوري للعناصر الكيميائية لـ DI Dmitry Ivanovich Mendeleev ، برقم ذري 56. وقد تم تعيينه بواسطة الرمز Ba (lat. Barium). المادة البسيطة هي الباريوم (رقم سجل المستخلصات الكيميائية: 7440-39-3) - وهو معدن أرضي قلوي ناعم ومرن من اللون الفضي الأبيض. لديها نشاط كيميائي عالي.
تم اكتشاف الباريوم كأكسيد الباو في عام 1774 من قبل كارل شيل. في عام 1808 ، حصل الكيميائي الإنجليزي همفري ديفي على التحليل الكهربائي لهيدروكسيد الباريوم الرطب مع كاثود الزئبق ملغم الباريوم. بعد تبخر الزئبق ، عزل الباريوم المعدني عند التسخين.
الباريوم هو معدن قابل للطي أبيض فضي. عندما تنفجر ضربة حادة. هناك تعديلان متآثران للباريوم: يصل إلى 375 درجة مئوية ، α-Ba مستقرة مع شعرية محورها الجسم (المعلمة a \u003d 0.501 نانومتر) ؛ أعلى ، β-Ba مستقرة.
صلابة على نطاق المعدنية 1.25 ؛ على مقياس موس 2.
يتم تخزين الباريوم المعدني في الكيروسين أو تحت طبقة من البارافين.
الباريوم هو معدن الأرض القلوية. يتأكسد بشكل مكثف في الهواء ، ويشكل أكسيد الباريوم باو ونيتريد الباريوم Ba3N2 ، ويشتعل مع تسخين بسيط. يتفاعل بقوة مع الماء لتكوين هيدروكسيد الباريوم Ba (OH) 2:
Ba + 2H2O \u003d Ba (OH) 2 + H2
يتفاعل بنشاط مع الأحماض المخففة. كثير من أملاح الباريوم غير قابلة للذوبان أو قابلة للذوبان في الماء قليلاً: كبريتات الباريوم BaSO4 ، كبريتات الباريوم BaSO3 ، كربونات الباريوم BaCO3 ، فوسفات الباريوم Ba3 (PO4) 2. كبريتيد الباريوم BaS ، على عكس كبريتيد الكالسيوم CaS ، شديد الذوبان في الماء.
يتفاعل بسهولة مع الهالوجينات لتشكيل الهاليدات.
عند تسخينها بالهيدروجين ، فإنها تشكل هيدريد الباريوم BaH2 ، والذي بدوره مع هيدريد الليثيوم LiH يعطي مجمع Li.
يتفاعل عند تسخينها مع الأمونيا:
6Ba + 2NH3 \u003d 3BaH2 + Ba3N2
عند تسخين نيتريد الباريوم Ba3N2 ، يتفاعل مع ثاني أكسيد الكربون ، مكونًا السيانيد:
Ba3N2 + 2CO \u003d Ba (CN) 2 + 2BaO
مع الأمونيا السائلة ، يعطي محلولًا أزرق داكن يمكن من خلاله عزل الأمونيا ، والتي لها لمعان ذهبي وتتحلل بسهولة مع إزالة NH3. في وجود محفز بلاتيني ، تتحلل الأمونيا لتكوين أميد الباريوم:
Ba (NH2) 2 + 4NH3 + H2
يمكن الحصول على كربيد الباريوم BaC2 بالتسخين في فرن الفحم باو.
إنه يشكل الفسفور Ba3P2 مع الفسفور.
الباريوم يقلل من أكاسيد الهاليدات والكبريتيدات من العديد من المعادن إلى المعدن المقابل.
يستخدم معدن الباريوم ، غالبًا ما يكون من السبائك المزودة بألومنيوم ، كجاصب (حاصل) في الأجهزة الإلكترونية عالية الفراغ ، ويضاف أيضًا مع الزركونيوم إلى مبردات المعادن السائلة (الصوديوم ، البوتاسيوم ، الروبيديوم ، الليثيوم ، سبائك السيزيوم) لتقليل العدوانية إلى خطوط الأنابيب ، وفي المعادن.
المعادن الانتقالية
الفلزات الانتقالية (عناصر الانتقال) هي عناصر من المجموعات الفرعية الجانبية للجدول الدوري للعناصر الكيميائية لـ D. I. Mendeleev Dmitry Ivanovich ، وفي ذراتها تظهر الإلكترونات على مدارات و d و. بشكل عام ، يمكن تمثيل الهيكل الإلكتروني لعناصر الانتقال على النحو التالي:. تحتوي مدارات ns على إلكترون واحد أو إثنين ؛ توجد إلكترونات التكافؤ المتبقية على المدارات. نظرًا لأن عدد إلكترونات التكافؤ أصغر بشكل ملحوظ من عدد المدارات ، فإن المواد البسيطة التي تتكون من عناصر انتقالية هي معادن.
الخصائص العامة للعناصر الانتقالية
جميع عناصر الانتقال لها الخصائص الشائعة التالية:
قيم صغيرة من الكهربية.
حالات الأكسدة المتغيرة. بالنسبة لجميع العناصر d تقريبًا ، في ذراتها إلكترونان متساويان على الطبقة الخارجية ns-suplevel ، فإن حالة الأكسدة +2 معروفة.
بدايةً من العناصر d المجموعة الثالثة من الجدول الدوري للعناصر الكيميائية لـ D. I. Dmitri Ivanovich Mendeleev ، تشكل العناصر الموجودة في حالة الأكسدة السفلية المركبات التي تظهر الخواص الأساسية ، في الأعلى - الحمضي ، في الوسط - المذبذب
حديد
الحديد عنصر من عناصر مجموعة فرعية من المجموعة الثامنة من الفترة الرابعة للنظام الدوري للعناصر الكيميائية لـ DI Mendeleev Dmitry Ivanovich ، الرقم الذري 26. تم تعيينه بواسطة الرمز Fe (lat. Ferrum). أحد أكثر المعادن شيوعًا في قشرة الأرض (المرتبة الثانية بعد الألومنيوم).
مادة الحديد البسيطة (رقم سجل المستخلصات الكيميائية: 7439-89-6) عبارة عن معدن قابل للطرق أبيض فضي مع تفاعل كيميائي عالٍ: يتآكل الحديد بسرعة في درجات حرارة عالية أو في رطوبة عالية في الهواء. في الأكسجين النقي ، يحترق الحديد ، وفي حالة تشتت بدقة ، فإنه يشعل تلقائيًا في الهواء.
في الواقع ، يُطلق على الحديد عادةً خلائطه التي تحتوي على نسبة منخفضة من الشوائب (تصل إلى 0.8 ٪) ، والتي تحتفظ بنعومة ونعومة المعدن النقي. ولكن في الممارسة العملية ، يتم استخدام سبائك الحديد مع الكربون في كثير من الأحيان: (ما يصل إلى 2 ٪ الكربون) و (أكثر من 2 ٪ الكربون) ، وكذلك الفولاذ المقاوم للصدأ (المخلوط) مع المضافات المعدنية السبائك (الكروم ، المنغنيز ، ني ، الخ). مزيج من الخصائص المحددة للحديد وسبائكه يجعله "معدن رقم 1" في الأهمية للبشر.
في الطبيعة ، نادرًا ما يوجد الحديد في شكله النقي ، وغالبًا ما يتم العثور عليه في نيازك النيكل الحديدية. معدل انتشار الحديد في قشرة الأرض هو 4.65 ٪ (المركز الرابع بعد O ، Si ، Al). ويعتقد أيضا أن الحديد يشكل جزءا كبيرا من جوهر الأرض.




الحديد معدن نموذجي ، في حالته الحرة لونه أبيض فضي مع صبغة رمادية. المعدن النقي من البلاستيك ، الشوائب المختلفة (خاصة الكربون) تزيد من صلابتها وهشاشتها. وقد أعلن الخصائص المغناطيسية. غالبًا ما ينبعث منها ما يسمى بـ "ثالوث الحديد" - مجموعة من ثلاثة معادن (حديد الحديد ، شركة الكوبالت ، ني ني) ، والتي لها خصائص فيزيائية مماثلة ، نصف القطر الذري ، وقيم الكهربية.
يتميز الحديد بأشكال متعددة ، له أربعة تعديلات بلورية:
ما يصل إلى 769 درجة مئوية ، يوجد α-Fe (الفريت) مع شعرية مكعب محورها الجسم وخصائص المغناطيس المغناطيس (769 درجة مئوية ≈ 1043 K - نقطة كوري للحديد)
في نطاق درجة الحرارة 769–917 درجة مئوية ، توجد β-Fe ، والتي تختلف عن α-Fe فقط في معلمات الشبكة المكعبة المتمركزة حول الجسم والخصائص المغناطيسية للشبكة المغناطيسية
في نطاق درجة الحرارة 917-1394 درجة مئوية ، يوجد Fe-Fe (الأوستينيت) مع شعرية مكعب محورها الوجه
فوق 1394 درجة مئوية ، δ-Fe مستقرة مع شعرية مكعب محورها الحجم
لا تعزل المعادن β-Fe كمرحلة منفصلة ، وتعتبرها كنوع من α-Fe. عندما يتم تسخين الحديد أو الفولاذ فوق نقطة كوري (769 درجة مئوية ≈ 1043 كلفن) ، تزعج الحركة الحرارية للأيونات اتجاه لحظات مغنطيسية الإلكترون ، يصبح المغناطيس المغنطيسي مغناطيسيًا - يحدث انتقال طور من الدرجة الثانية ، ولكن لا يحدث انتقال طور من الدرجة الأولى مع تغيير في المعلمات الفيزيائية الأساسية للبلورات.
بالنسبة للحديد النقي عند الضغط العادي ، من وجهة علم المعادن ، توجد التعديلات المستقرة التالية:
من الصفر المطلق إلى 910 درجة مئوية ، يكون تعديل α مع شعرية بلورية مكعب (bcc) محورها الجسم مستقر. ويسمى محلول صلب من الكربون في الحديد ألفا الفريت.
من 910 إلى 1400 درجة مئوية ، يكون التعديل with مع شعرية بلورية مكعب (fcc) محورها الوجه مستقر. يُسمى المحلول الصلب للكربون في الحديد iron الأوستينيت.
من 910 إلى 1539 درجة مئوية ، يكون تعديل δ مع شعرية بلورية مكعب (bcc) محورها الجسم مستقر. يُسمى المحلول الصلب للكربون في الحديد δ (وكذلك في الحديد α) الفريت. في بعض الأحيان يتم تمييز الفريت temperature الفريت ذو درجة الحرارة العالية والفريت (α الفريت) (درجات الحرارة المنخفضة) (أو الفريت فقط) في بعض الأحيان ، على الرغم من أن بنياتها الذرية هي نفسها.
إن وجود عناصر الكربون والسبائك في الفولاذ يغير بدرجة كبيرة درجة حرارة التحولات الطورية.
في منطقة الضغط العالي (أعلى من 104 ميجا باسكال ، 100 ألف غلاف جوي) ، ينشأ تعديل للحديد with مع شعرية سداسية الشكل (HCP).
ظاهرة تعدد الأشكال هي في غاية الأهمية لعلم المعادن. إنه بفضل التحولات α-of للشبكة البلورية التي تتم معالجتها بالحرارة. وبدون هذه الظاهرة ، لما كان الحديد ، كأساس للصلب ، قد تلقى مثل هذا الاستخدام الواسع النطاق.
الحديد صهر ، ويشير إلى المعادن متوسطة النشاط. درجة انصهار الحديد هي 1539 درجة مئوية ، ونقطة الغليان حوالي 3200 درجة مئوية.
يعد الحديد أحد أكثر المعادن استخدامًا ؛ حيث يمثل ما يصل إلى 95٪ من الإنتاج المعدني العالمي.
الحديد هو المكون الرئيسي للفولاذ والحديد الزهر - أهم المواد الهيكلية.
يمكن أن يكون الحديد جزءًا من السبائك القائمة على معادن أخرى - مثل النيكل.
أكسيد الحديد المغناطيسي (المغنتيت) هو مادة مهمة في إنتاج أجهزة ذاكرة الكمبيوتر طويلة الأجل: محركات الأقراص الصلبة ، والأقراص المرنة ، إلخ.
يستخدم مسحوق المغنتيت فائق الدقة كحبر في طابعات الليزر بالأبيض والأسود.
تساهم الخصائص المغناطيسية الفريدة لعدد من السبائك القائمة على الحديد في استخدامها على نطاق واسع في الهندسة الكهربائية للمراكز المغناطيسية للمحولات والمحركات الكهربائية.
يستخدم كلوريد الحديد (III) (كلوريد الحديديك) في ممارسة راديو الهواة لتخليل لوحات الدوائر المطبوعة.
كبريتات الحديدوز (كبريتات الحديد) في خليط مع كبريتات النحاس تستخدم للسيطرة على الفطريات الضارة في البستنة والبناء.
يستخدم الحديد كأنود في بطاريات الحديد والنيكل وبطاريات الحديد.
نحاس
يعد النحاس عنصرًا في مجموعة فرعية من المجموعة الأولى ، وهي الفترة الرابعة للنظام الدوري للعناصر الكيميائية لـ DI Dmitry Ivanovich Mendeleev ، برقم ذري 29. تم تعيينه بواسطة الرمز Cu (lat. Cuprum). مادة النحاس البسيطة (رقم سجل المستخلصات الكيميائية: 7440-50-8) عبارة عن معدن انتقالي من البلاستيك بلون وردي ذهبي (اللون الوردي في حالة عدم وجود فيلم أكسيد). منذ فترة طويلة تستخدم على نطاق واسع من قبل الرجل.



يعد النحاس من المعدن المطلي باللون الوردي والذهبي ، ويتم تغليفه بسرعة بغشاء أكسيد في الهواء ، مما يوفر له صبغة مميزة حمراء صفراء. النحاس لديه الموصلية الحرارية والكهربائية العالية (في المرتبة الثانية في الموصلية الكهربائية بعد الفضة). لديها نظيران ثابتان - 63Cu و 65Cu ، والعديد من النظائر المشعة. عمر أطول ، 64Cu ، لديه عمر نصف يبلغ 12.7 ساعة وخياران من التحلل مع مختلف المنتجات.
الكثافة - 8.94 * 10і كجم / متر مكعب
حرارة محددة عند 20 درجة مئوية - 390 ج / كغ * ك
المقاومة الكهربائية عند 20-100 درجة مئوية - 1.78 · 10 ·8 أوم · م
درجة انصهار - 1083 درجة مئوية
درجة الغليان - 2600 درجة مئوية
هناك عدد من سبائك cuprum: النحاس - سبيكة من cuprum مع الزنك - - سبيكة من cuprum مع القصدير ، cupronickel - سبيكة من cuprum والنيكل ، وغيرها.
زنك
الزنك هو عنصر من مجموعة فرعية فرعية من المجموعة الثانية ، وهي الفترة الرابعة من النظام الدوري للعناصر الكيميائية لـ DI Mendeleev Dmitry Ivanovich ، برقم ذري 30. تم تعيينه بواسطة الرمز Zn (lat. Zinkum). مادة بسيطة (رقم سجل المستخلصات الكيميائية: 7440-66-6) في الظروف العادية هي معدن انتقالي هش بلون أبيض مزرق (يتلاشى في الهواء ، ويغطى بطبقة رقيقة من أكسيد الزنك).
في شكله النقي ، وهو معدن فضي اللون مطيل إلى حد ما. لديها شبكة سداسية مع المعلمات \u003d 0.26649 نانومتر ، ج \u003d 0.49468 نانومتر. تكون هشة في درجة حرارة الغرفة ، عندما تكون اللوحة مثنية ، يسمع طقطقة من احتكاك البلورات (عادة أقوى من "صفيح القصدير"). في 100-150 درجة مئوية ، والزنك من البلاستيك. الشوائب ، حتى الشوائب ، تزيد من هشاشة الزنك بشكل حاد.
المعادن مذبذب نموذجي. إمكانات الإلكترود القياسية هي -0.76 فولت ، وتقع في سلسلة من الإمكانات القياسية حتى الحديد.
في الهواء ، يتم طلاء الزنك بغشاء رقيق من أكسيد الزنك. مع تسخين قوي ، يحترق بتكوين أكسيد ZnO الأبيض المبتور:
2Zn + O2 \u003d 2ZnO.
يتفاعل أكسيد الزنك مع المحاليل الحمضية:
ZnO + 2HNO3 \u003d Zn (NO3) 2 + H2O
والقلويات:
ZnO + 2NaOH \u003d Na2ZnO2 + H2O ،
يتفاعل الزنك ذو النقاء الطبيعي بنشاط مع المحاليل الحمضية:
Zn + 2HCl \u003d ZnCl2 + H2 ،
Zn + H2SO4 (decomp.) \u003d ZnSO4 + H2
والحلول القلوية:
Zn + 2NaOH + 2H2O \u003d Na2 + H2 ،
تشكيل hydroxyzincates. الزنك النقي جدا لا يتفاعل مع محاليل الأحماض والقلويات. يبدأ التفاعل بإضافة بضع قطرات من محلول كبريتات الكبريت CuSO4.
عند تسخينه ، يتفاعل الزنك مع الهالوجينات لتكوين هاليدات ZnHal2. مع الفسفور ، يشكل الزنك فسفيدات Zn3P2 و ZnP2. مع الكبريت ونظائرها - السيلينيوم والتيلوريوم - العديد من مركبات الكالكوجين ، ZnS ، ZnSe ، ZnSe2 و ZnTe.
لا يتفاعل الزنك مباشرة مع الهيدروجين والنيتروجين والكربون والسيليكون والبورون. يتم الحصول على نيتريد Zn3N2 بتفاعل الزنك مع الأمونيا عند 550-600 درجة مئوية.
في المحاليل المائية ، تشكل أيونات الزنك Zn2 + أكوا كومبلكس 2+ و 2+.
يستخدم الزنك المعدني النقي لاستعادة المعادن النبيلة الملغومة بالرشح تحت الأرض (الذهب والفضة). بالإضافة إلى ذلك ، يتم استخدام الزنك لاستخراج الفضة والذهب (والمعادن الأخرى) من الرصاص الخام في شكل مركبات الزنك intermetallic مع الفضة والذهب (ما يسمى "رغوة الفضة") ، والتي يتم معالجتها بعد ذلك عن طريق طرق التكرير التقليدية.
يتم استخدامه لحماية الصلب من التآكل (غلفنة الأسطح غير الخاضعة للضغط الميكانيكي ، أو المعدنة - للجسور ، الخزانات ، الهياكل المعدنية). يستخدم أيضًا كمادة للإلكترود السالب في مصادر التيار الكيميائي ، أي في البطاريات والمراكم ، على سبيل المثال: عنصر الزنك المنغنيز ، بطارية الزنك الفضي (EMF 1.85 V ، 150 W · h / kg ، 650 W · h / dmі ، التيارات منخفضة المقاومة والتصريف الهائل ، عنصر الزنك والزنك (EMF 1.35 V ، 135 W / h / kg ، 550-650 W · h / dmі) ، عنصر dioxisulfate-mercury ، عنصر يودات الزنك ، أكسيد النحاس خلية كلفانية (EMF 0.7-1.6 فولت ، 84-127 واط · ساعة / كجم ، 410-570 واط · ساعة / يوم) ، عنصر الكروم والزنك ، عنصر الزنك-الفضة-الفضة nt ، بطارية النيكل والزنك (EMF 1.82 فولت ، 95-118 واط · ساعة / كجم ، 230-295 واط · ساعة / ساعة) ، عنصر الرصاص والزنك ، بطارية الزنك والكلور ، بطارية الزنك والبروم ، إلخ). دور الزنك في بطاريات الزنك - الهواء مهم جدًا ، ففي السنوات الأخيرة ، تم تطوير بطاريات الزنك - بطاريات لأجهزة الكمبيوتر (أجهزة الكمبيوتر المحمولة) بشكل مكثف استنادًا إلى نظام الزنك - الهواء ، وقد تحقق نجاح كبير في هذا المجال (أكبر من بطاريات الليثيوم ، والسعة والموارد أقل من 3 أضعاف التكلفة) ، كما يعد هذا النظام واعداً للغاية لتشغيل المحركات (بطارية الرصاص - 55 واط · ساعة / كجم ، الزنك الهواء - 220-300 واط · ساعة / كجم) وللسيارات الكهربائية (يصل عدد الكيلومترات إلى 900 كم). المدرجة في العديد من الجنود للحد من نقطة انصهارهم. الزنك هو عنصر مهم من النحاس. يستخدم أكسيد الزنك على نطاق واسع في الطب كعامل مطهر ومضاد للالتهابات. كما يستخدم أكسيد الزنك لإنتاج أكسيد الزنك الطلاء.
كلوريد الزنك هو تدفق مهم لحام المعادن ومكون في صناعة الألياف.
تستخدم على نطاق واسع أشباه الموصلات تيلورايد ، سيلينيد ، الفوسفيد ، كبريتيد الزنك.
يستخدم سيلينيد الزنك في صنع نظارات بصرية ذات معامل امتصاص منخفض للغاية في نطاق الأشعة تحت الحمراء المتوسطة ، على سبيل المثال ، في ليزر ثاني أكسيد الكربون.
زئبق
الزئبق هو عنصر من مجموعة فرعية فرعية من المجموعة الثانية ، وهي الفترة السادسة للنظام الدوري للعناصر الكيميائية لـ DI Dmitry Ivanovich Mendeleev ، برقم ذري 80. وهو مُعيّن بواسطة الرمز Hg (خط الطول Hydrargyrum). مادة الزئبق البسيطة (رقم سجل المستخلصات الكيميائية: 7439-97-6) عبارة عن فلز انتقالي ، في درجة حرارة الغرفة يكون سائل فضي أبيض ثقيل ومتطاير بشكل ملحوظ ، والأبخرة شديدة السمية. الزئبق هو واحد من عنصرين كيميائيين (والمعدن الوحيد) ، والمواد البسيطة التي في ظل الظروف العادية تكون في حالة سائلة من التجميع (العنصر الثاني هو البروم). وجدت في الطبيعة سواء في شكل أصلي وتشكيل عدد من المعادن. في معظم الأحيان ، يتم الحصول على الزئبق عن طريق الحد من المعدن الأكثر شيوعا - الزنجفر. يتم استخدامه لتصنيع أدوات القياس ومضخات التفريغ ومصادر الإضاءة وغيرها من مجالات العلوم والتكنولوجيا.
الزئبق هو السائل المعدني الوحيد في درجة حرارة الغرفة. لديها خصائص diamagnet. يشكل سبائك سائلة مع العديد من المعادن - حشو. فقط الحديد والمنغنيز و ني.
الزئبق معدن منخفض النشاط.
عند تسخينه إلى 300 درجة مئوية ، يتفاعل الزئبق مع الأكسجين: 2Hg + O2 → 2HgO يتكون أكسيد الزئبق الأحمر (II). يكون رد الفعل قابلاً للانعكاس: عند تسخينه فوق 340 درجة مئوية ، يتحلل أكسيد إلى مواد بسيطة. كان تفاعل التحلل لأكسيد الزئبق تاريخياً أحد الأساليب الأولى لإنتاج الأكسجين.
عندما يتم تسخين الزئبق بالكبريت ، يتم تشكيل كبريتيد الزئبق (II).
لا يذوب الزئبق في محاليل الأحماض التي ليس لها خصائص مؤكسدة ، ولكنه يذوب في الماء المائي وحمض النتريك ، مما يشكل أملاح الزئبق ثنائي التكافؤ. عندما يذوب الزئبق الزائد في حامض النتريك في البرد ، تتشكل نترات Hg2 (NO3) 2.
من بين عناصر المجموعة IIB الخاصة بمجموعة الزئبق ، من الممكن تدمير قشرة إلكترونية 6d10 مستقرة جدًا ، مما يؤدي إلى احتمال وجود مركبات زئبقية (+4). لذلك ، بالإضافة إلى Hg2F2 القابلة للذوبان بشكل متفرق و HgF2 المتحللة بالماء ، هناك أيضًا HgF4 التي تم الحصول عليها بتفاعل ذرات الزئبق ومزيج من النيون والفلور عند درجة حرارة 4 K.
يستخدم الزئبق في صناعة موازين الحرارة ؛ تمتلئ مصابيح الزئبق والكوارتز بالبخار الزئبقي. اتصالات الزئبق بمثابة أجهزة استشعار الموقف. بالإضافة إلى ذلك ، يستخدم الزئبق المعدني لإنتاج مجموعة من السبائك الحرجة.
في السابق ، كان يتم استخدام العديد من مزيج المعادن ، وخاصة مزيج الذهب والفضة ، على نطاق واسع في المجوهرات ، في صناعة المرايا وحشوات الأسنان. في التكنولوجيا ، تم استخدام الزئبق على نطاق واسع لبارومترات ومقاييس الضغط. تم استخدام مركبات الزئبق كمطهر (كلوريد الزئبق) ، ملين (كالوميل) ، في إنتاج القبعة ، وما إلى ذلك ، ولكن بسبب سميته العالية ، بحلول نهاية القرن العشرين تم استبعادها عملياً من هذه المناطق (استبدال الملغم بالرش والإفراز الكهربائي للمعادن والبوليمرات الحشوات في طب الأسنان).
يستخدم سبائك الزئبق الثاليوم في موازين الحرارة المنخفضة الحرارة.
يعمل الزئبق المعدني كاثود للإنتاج الكهربائي لعدد من المعادن الفعالة ، الكلور والقلويات ، في بعض مصادر التيار الكيميائي (على سبيل المثال ، الزئبق من نوع RC) ، في مصادر الجهد المرجعية (خلية ويستون). يحتوي عنصر الزئبق والزنك (emf 1.35 فولت) على طاقة ووزن عالٍ للغاية (130 واط / ساعة / كجم ، 550 واط / ساعة / dm).
يستخدم الزئبق لإعادة تدوير تعدين الألومنيوم والذهب الثانوي (انظر الملغم).
يستخدم الزئبق أيضًا في بعض الأحيان كسائل يعمل في المحامل الهيدروديناميكية المحملة بكثافة.
الزئبق هو جزء من بعض الدهانات التي ترتكب جريمة الإبادة البيولوجية لمنع تلوث هياكل السفن في مياه البحر.
يستخدم Mercury-203 (T1 / 2 \u003d 53 ثانية) في علم الأشعة الإشعاعي.
تستخدم أملاح الزئبق أيضًا:
يستخدم يوديد الزئبق ككاشف إشعاع أشباه الموصلات.
منذ فترة طويلة يستخدم فلامينت الزئبق ("الزئبق المتفجر") كمتفجر مبدئي (المتفجرات).
يستخدم بروميد الزئبق في التحلل الكيميائي الحراري للمياه في الهيدروجين والأكسجين (طاقة الهيدروجين الذري).
تستخدم بعض مركبات الزئبق كأدوية (على سبيل المثال ، الميرثوليت في الحفاظ على اللقاحات) ، ولكن بسبب السمية ، تم استبدال الزئبق من الأدوية (كلوريد الزئبق ، أوكسي أوكسيد الزئبق - المطهرات ، الكالوميل - ملين ، إلخ) في منتصف القرن العشرين.

الألومنيوم
يمثل الألومنيوم عنصرًا في المجموعة الفرعية الرئيسية للمجموعة الثالثة من الفترة الثالثة للنظام الدوري للعناصر الكيميائية لـ DI Mendeleev Dmitry Ivanovich ، الرقم الذري 13. ويشار إليه بالرمز Al (lat. Aluminium). انه ينتمي الى مجموعة من المعادن الخفيفة. المعدن الأكثر شيوعا والثالث الأكثر شيوعا (بعد الأكسجين والسليكون) العنصر الكيميائي في قشرة الأرض.
مادة الألومنيوم البسيطة (CAS-number: 7429-90-5) - معدن فضي-فضي غير مغناطيسي خفيف الوزن يمكن تشكيله بسهولة وصب وتشكيله. الألومنيوم لديه الموصلية الحرارية والكهربائية العالية ، ومقاومة التآكل بسبب التكوين السريع للأفلام أكسيد قوية التي تحمي السطح من مزيد من التفاعل.
وفقًا لبعض الدراسات البيولوجية ، تم اعتبار تناول الألمنيوم في جسم الإنسان عاملاً في تطور مرض الزهايمر ، ولكن تم انتقاد هذه الدراسات لاحقًا وتم دحض الاستنتاج حول علاقة أحدهما بالآخر.
معدن فضي-أبيض ، خفيف الوزن ، الكثافة 2.7 جم / سم 2 ، نقطة انصهار لـ 658 درجة مئوية تقنيًا ، ألومنيوم عالي النقاء 660 درجة مئوية ، نقطة غليان 2500 درجة مئوية ، مقاومة مؤقتة للقالب 10-12 كجم / مم 2 ، قابلة للتشوه 18 -25 كجم / مم 2 ، سبائك 38-42 كجم / مم 2.
صلابة برينل 24-32 كجم / مم 2 ، ليونة عالية: 35 ٪ التقنية ، 50 ٪ نقي ، ملفوفة في ورقة رقيقة وحتى رقائق.
الألومنيوم لديه الموصلية الكهربائية العالية والموصلية الحرارية ، 65 ٪ من الموصلية الكهربائية من Cuprum ، لديه انعكاسية عالية.
أشكال الألمنيوم السبائك مع جميع المعادن تقريبا.
في الظروف العادية ، يكون الألومنيوم مغلفًا بغشاء أكسيد رقيق وقوي ، وبالتالي لا يتفاعل مع عوامل مؤكسدة كلاسيكية: مع H2O (t °) ؛ O2 ، HNO3 (بدون تدفئة). نتيجة لهذا ، فإن الألمنيوم غير قابل للتآكل عملياً وبالتالي فهو مطلب واسع النطاق في الصناعة الحديثة. ومع ذلك ، أثناء تدمير فيلم الأكسيد (على سبيل المثال ، عند ملامسة محاليل أملاح الأمونيوم NH4 + ، القلويات الساخنة ، أو نتيجة الاندماج) ، يعمل الألومنيوم كعامل نشط لتخفيض المعادن.
يتفاعل بسهولة مع مواد بسيطة:
مع الأكسجين:
4Al + 3O2 \u003d 2Al2O3
مع الهالوجينات:
2Al + 3Br2 \u003d 2AlBr3
يتفاعل مع غير المعادن الأخرى عند تسخينها:
مع الكبريت ، تشكيل كبريتيد الألومنيوم:
2Al + 3S \u003d Al2S3
مع النيتروجين لتشكيل نيتريد الألومنيوم:
مع الكربون ، وتشكيل كربيد الألومنيوم:
4Al + 3C \u003d Al4C3
يتم تحلل كبريتيد الألومنيوم وكربيد الألومنيوم بالكامل:
Al2S3 + 6H2O \u003d 2Al (OH) 3 + 3H2S
Al4C3 + 12H2O \u003d 4Al (OH) 3+ 3CH4
مع المواد المعقدة:
بالماء (بعد إزالة فيلم الأكسيد الواقي ، على سبيل المثال ، الاندماج أو حلول القلويات الساخنة):
2Al + 6H2O \u003d 2Al (OH) 3 + 3H2
مع القلويات (مع تكوين رباعي هيدروكسي ألومينات وغيرها من ألومينات):
2Al + 2NaOH + 6H2O \u003d 2Na + 3H2
2 (NaOH.H2O) + 2Al \u003d 2NaAlO2 + 3H2
قابل للذوبان بسهولة في أحماض الهيدروكلوريك والمخففة:
2Al + 6HCl \u003d 2AlCl3 + 3H2
2Al + 3H2SO4 (ديسمبر) \u003d Al2 (SO4) 3 + 3H2
عند تسخينه ، يذوب في الأحماض - العوامل المؤكسدة التي تشكل أملاح الألومنيوم القابلة للذوبان:
2Al + 6H2SO4 (conc) \u003d Al2 (SO4) 3 + 3SO2 + 6H2O
Al + 6HNO3 (conc) \u003d Al (NO3) 3 + 3NO2 + 3H2O
يعيد المعادن من أكاسيدها (الألمنيوم):
8Al + 3Fe3O4 \u003d 4Al2O3 + 9Fe
2Al + Cr2O3 \u003d Al2O3 + 2Cr
تستخدم على نطاق واسع كمادة هيكلية. المزايا الرئيسية للألمنيوم في هذه الجودة هي الخفة ، مرونة الختم ، مقاومة التآكل (في الهواء ، يتم طلاء الألومنيوم على الفور مع فيلم Al2O3 دائم ، والذي يمنع أكسدة أخرى) ، الموصلية الحرارية العالية ، وعدم سمية مركباتها. على وجه الخصوص ، جعلت هذه الخصائص الألومنيوم شعبية للغاية في صناعة تجهيزات المطابخ ، رقائق الألومنيوم في صناعة المواد الغذائية والتعبئة والتغليف.
العيب الرئيسي للألمونيوم كمواد هيكلية هو قوته المنخفضة ، لذلك عادة ما يتم صهره بكمية صغيرة من Cuprum والمغنيسيوم (تسمى سبيكة duralumin).
الموصلية الكهربائية للألمنيوم هي أقل 1.7 مرة من تلك الموجودة في Cuprum ، في حين أن الألمنيوم أرخص مرتين تقريبًا. لذلك ، يستخدم على نطاق واسع في الهندسة الكهربائية لتصنيع الأسلاك ، التدريع ، وحتى في الإلكترونيات الدقيقة في تصنيع الموصلات في الرقائق. يتم تعويض الموصلية الكهربائية المنخفضة للألمنيوم (37 1 / أوم) مقارنة بـ Cuprum (63 1 / أوم) بزيادة في المقطع العرضي لموصلات الألومنيوم. عيب الألومنيوم كمادة كهربائية هو فيلم أكسيد قوي يجعل من الصعب لحام.
بسبب مجمع خصائصه ، فإنه يتم توزيعه على نطاق واسع في المعدات الحرارية.
يحتفظ الألومنيوم وسبائكه بقوتهم في درجات حرارة منخفضة للغاية. بسبب هذا ، يستخدم على نطاق واسع في التكنولوجيا المبردة.
إن الانعكاس العالي مع التكلفة المنخفضة وسهولة الرش يجعل الألومنيوم مادة مثالية لتصنيع المرايا.
في إنتاج مواد البناء كعامل لتوليد الغاز.
يتم استخدام التآكل والقياس لتغيير الصلب والسبائك الأخرى ، على سبيل المثال ، صمامات محرك الاحتراق الداخلي للمكبس ، وشفرات التوربينات ، وأبراج استرداد الزيت ، ومعدات التبادل الحراري ، واستبدال الجلفنة أيضًا.
يستخدم كبريتيد الألومنيوم لإنتاج كبريتيد الهيدروجين.
البحوث جارية لتطوير الألومنيوم الرغوي كمادة قوية وخفيفة الوزن بشكل خاص.
عندما كان الألومنيوم باهظ الثمن ، تم تصنيع مجموعة متنوعة من المجوهرات منه. مرت الموضة على الفور عندما ظهرت تقنيات جديدة (تطورات) في إنتاجها ، الأمر الذي قلل عدة مرات. في أيامنا هذه ، يستخدم الألومنيوم في بعض الأحيان في صناعة المجوهرات.


معادن أخرى
الرصاص
الرصاص هو عنصر في المجموعة الفرعية الرئيسية للمجموعة الرابعة ، الفترة السادسة للنظام الدوري للعناصر الكيميائية لـ DI Dmitry Ivanovich Mendeleev ، برقم ذري 82. ويشار إليه بالرمز Pb (lat. Plumbum). مادة الرصاص البسيطة (رقم CAS: 7439-92-1) عبارة عن معدن رمادي قابل للذوبان منخفضًا نسبيًا.
الرصاص لديه الموصلية الحرارية منخفضة إلى حد ما ، فهو 35.1 W / (م · K) ، عند درجة حرارة 0 درجة مئوية. المعدن ناعم ، سهل القطع بسكين. على السطح ، غالبًا ما يكون مغطى بغشاء أكاسيد أكثر أو أقل ؛ عند القص ، يفتح سطح لامع ، يتلاشى في الهواء مع مرور الوقت.
درجة انصهار: 327.4 درجة مئوية
درجة الغليان: 1740 درجة مئوية
يستخدم نترات الرصاص لإنتاج متفجرات مختلطة قوية. يستخدم الرصاص آزيد باعتباره المفجر الأكثر استخدامًا على نطاق واسع (بدء المتفجرات). يستخدم بيركلورات الرصاص لإعداد السوائل الثقيلة (الكثافة 2.6 جم / سم 2) المستخدمة في معالجة التعويم من الخامات ، ويستخدم في بعض الأحيان في متفجرات مختلطة قوية كعامل مؤكسد. يستخدم فلوريد الرصاص وحده ، وكذلك فلوريد البزموت ، Kuprum ، الفضة ، كمادة الكاثود في مصادر التيار الكيميائي. يستخدم البزموت الرصاصي ، كبريتيد الرصاص PbS ، يوديد الرصاص كمواد الكاثود في بطاريات الليثيوم. الرصاص كلوريد PbCl2 كمادة الكاثود في مصادر الاستعداد الحالية. يستخدم التيلورايد الرصاص PbTe على نطاق واسع كمادة حرارية (طاقة حرارية مع 350 μV / K) ، وهي المادة الأكثر استخدامًا في إنتاج المولدات الحرارية الحرارية والثلاجات الحرارية. يستخدم ثاني أكسيد الرصاص PbO2 على نطاق واسع ليس فقط في بطارية حمض الرصاص ، ولكن أيضًا يتم إنتاج العديد من مصادر التيار الكيميائي الاحتياطي على أساسها ، على سبيل المثال ، عنصر كلور الرصاص ، عنصر فلوريد الرصاص ، إلخ.
الرصاص الأبيض ، الكربونات الرئيسية Pb (OH) 2.PbCO3 ، مسحوق أبيض كثيف ، يتم الحصول عليه من الرصاص في الهواء تحت تأثير ثاني أكسيد الكربون وحمض الخليك. استخدام الرصاص الأبيض كصبغة تلوين غير شائع الآن كما كان من قبل ، وذلك بسبب تحللها تحت تأثير كبريتيد الهيدروجين H2S. يستخدم تبييض الرصاص في إنتاج المعجون ، في تكنولوجيا الأسمنت وورق كربونات الرصاص.
يستخدم الزرنيخ الرصاصي والزرنيخيت في تكنولوجيا مبيدات الحشرات لقتل الحشرات - الآفات الزراعية (دودة القز غير المنسوجة وسوسة القطن). الرصاص Borate Pb (BO2) 2 · H2O ، مسحوق أبيض غير قابل للذوبان ، يستخدم لتجفيف اللوحات والورنيش ، ومعه معادن أخرى - كطلاء من الزجاج والخزف. الرصاص كلوريد PbCl2 ، مسحوق بلوري أبيض ، قابل للذوبان في الماء الساخن ، ومحاليل كلوريد أخرى وخاصة كلوريد الأمونيوم NH4Cl. يتم استخدامه لإعداد المراهم في علاج الأورام.
يُعرف الرصاص Chromate PbCrO4 باسم الصبغة الصفراء من الكروم ، وهو صبغة مهمة لإعداد الدهانات ، لتلوين الخزف والأقمشة. في الصناعة ، يستخدم كرومات بشكل رئيسي في إنتاج أصباغ صفراء. الرصاص نترات الرصاص (NO3) 2 هو مادة بلورية بيضاء قابلة للذوبان في الماء بسهولة. وهو الدواء القابض للاستخدام المحدود. في الصناعة ، يتم استخدامه في إنتاج المباريات ، والصباغة وطباعة المنسوجات ، قرون الصباغة والنقش. كبريتات الرصاص Pb (SO4) 2 ، مسحوق أبيض غير قابل للذوبان في الماء ، تستخدم كصبغة في البطاريات ، الطباعة الحجرية ، وتكنولوجيا النسيج المطبوعة.
يستخدم الرصاص كبريتيد الرصاص ، مسحوق أسود غير قابل للذوبان في الماء ، لإطلاق الفخار وكشف أيونات الرصاص.
بما أن الرصاص يمتص الإشعاع جيدًا ، فإنه يستخدم للحماية من الإشعاع في منشآت الأشعة السينية والمفاعلات النووية. بالإضافة إلى ذلك ، يعتبر الرصاص سائل تبريد في مشاريع المفاعلات النيوترونية السريعة الواعدة.
السبائك الرصاص تجد تطبيق كبير. Puter (سبيكة الرصاص - القصدير) ، التي تحتوي على 85-90٪ من معدن القصدير و 15-10٪ Pb ، مصبوب وغير مكلف ويستخدم في صناعة الأدوات المنزلية. يستخدم اللحام الذي يحتوي على 67٪ Pb و 33٪ Tin metal في الهندسة الكهربائية. تستخدم سبائك الرصاص والأنتيمون في صناعة الرصاص والطباعة ، وتستخدم سبائك الرصاص والأنتيمون وسبائك القصدير والمحامل. تستخدم سبائك الرصاص الأنتيمون شائعة الاستخدام في أغلفة الكابلات ولوحات البطارية الكهربائية. تستخدم مركبات الرصاص في صناعة الأصباغ والدهانات والمبيدات الحشرية والزجاج البنود التجارة وكإضافات للبنزين في شكل رباعي إيثيل الرصاص (C2H5) 4Pb (سائل متطاير بشكل معتدل ، يتمتع زوج من الجروح بتركيزات منخفضة برائحة فواكه حلوة ، في رائحة كبيرة توجد رائحة كريهة ؛ Tm \u003d 130 ° C ، Bp \u003d 80 ° C / 13 mm RT .st. ؛ أقل من 1650 جم / سم ؛ nD2v \u003d 1،5198 ؛ غير قابل للذوبان في الماء ، يمزج مع المذيبات العضوية ؛ شديد السمية ، يخترق الجلد بسهولة ؛ MPC \u003d 0.005 مجم / م ؛ LD50 \u003d 12.7 ملغ / كجم (الفئران ، عن طريق الفم)) لزيادة تصنيف الأوكتان.

قصدير
القصدير هو عنصر من عناصر المجموعة الفرعية الرئيسية للمجموعة الرابعة ، الفترة الخامسة للنظام الدوري للعناصر الكيميائية DI Mendeleev Dmitry Ivanovich ، برقم ذري 50. وقد تم تعيينه بواسطة الرمز Tin metal (lat. Stannum). في ظل الظروف العادية ، تكون المادة البسيطة عبارة عن معدن لامع وقابل للانصهار وقابل للانصهار من اللون الفضي الأبيض. يشكل القصدير عدة تعديلات متآزرة: أقل من 13.2 درجة مئوية α-tin (رمادي Tin) مع شعرية مكعبة من نوع الماس ، أعلى من 13.2 درجة مئوية stable-tin (Tin أبيض) مع شعرية بلورية tetragonal.
يستخدم القصدير بشكل أساسي كطلاء آمن وغير سام ومقاوم للتآكل في شكله النقي أو في سبائك مع معادن أخرى. التطبيقات الصناعية الرئيسية للقصدير هي في صفيح (الحديد المعلب) لتصنيع الحاويات من المنتجات الغذائية ، في الجنود للإلكترونيات ، وخطوط الأنابيب المنزلية ، في تحمل سبائك وطلاء القصدير وسبائكها. سبائك القصدير الأكثر أهمية هو برونز (مع Cuprum). سبيكة أخرى معروفة - كمبيوتر - تستخدم لصنع الأطباق. في الآونة الأخيرة ، تم إحياء الاهتمام باستخدام المعادن ، لأنه الأكثر "صديقة للبيئة" بين المعادن الثقيلة غير الحديدية. يستخدم لإنشاء أسلاك فائقة التوصيل بناءً على مركب Nb3Sn المتعدد الفلزات.
أسعار على معدن القصدير في عام 2006 بلغ متوسط \u200b\u200b12-18 دولار / كغ ، وثاني أكسيد القصدير عالية النقاء حوالي 25 دولار / كغ ، وضوح الشمس واحد القصدير عالية النقاء حوالي 210 دولار / كغ.
تحتوي مركبات القصدير والزركونيوم المعدنية على نقاط انصهار عالية (تصل إلى 2000 درجة مئوية) ومقاومة الأكسدة عند تسخينها في الهواء ولديها عدد من التطبيقات.
القصدير هو أهم عنصر صناعة السبائك في إنتاج سبائك التيتانيوم الإنشائية.
ثاني أكسيد القصدير هو مادة كاشطة فعالة للغاية تستخدم "لإنهاء" سطح الزجاج البصري.
تم استخدام مزيج من أملاح القصدير - "التكوين الأصفر" - في السابق كصبغة للصوف.
يستخدم القصدير أيضًا في مصادر التيار الكيميائي كمادة أنود ، على سبيل المثال: عنصر القصدير المنغنيز ، عنصر أكسيد الزئبق والقصدير. الواعد هو استخدام القصدير في بطارية الرصاص والقصدير ؛ لذلك ، على سبيل المثال ، في الجهد المتساوي مع بطارية الرصاص ، تتمتع بطارية الرصاص والقصدير بقدرة أكبر مرتين ونصف وبكثافة طاقة أعلى بمقدار 5 أضعاف لكل وحدة حجم ، وتكون مقاومتها الداخلية أقل بكثير.
معدن القصدير غير سامة ، والذي يسمح باستخدامه في صناعة المواد الغذائية. لا يتم إطلاق الشوائب الضارة الموجودة في القصدير في ظل ظروف التخزين والاستخدام العادية ، بما في ذلك الذوبان في درجات حرارة تصل إلى 600 درجة مئوية ، في الهواء في منطقة العمل بأحجام تتجاوز التركيز الأقصى المسموح به وفقًا لـ GOST. إن التعرض لفترات طويلة (15-20 سنة) لغبار القصدير له تأثير فيبروجيني على الرئتين ويمكن أن يتسبب في الإصابة بمرض المصابين بالتهاب رئوي.
تطبيق المعادن
مواد البناء
المعادن وسبائكها هي واحدة من المواد الهيكلية الرئيسية للحضارة الحديثة. يتم تحديد ذلك في المقام الأول من خلال قوتها العالية وتوحيدها ونفاذية السوائل والغازات. بالإضافة إلى ذلك ، من خلال تغيير تكوين السبائك ، من الممكن تغيير خصائصها على نطاق واسع جدًا.
المواد الكهربائية
تستخدم المعادن كما الموصلات جيدة الطاقة الكهربائية (النحاس والألومنيوم) ، وكمادة ذات مقاومة عالية للمقاومات وعناصر التدفئة الكهربائية (نيتشروم ، إلخ).
المواد أداة
تستخدم المعادن وسبائكها على نطاق واسع لتصنيع الأدوات (أجزاء العمل الخاصة بهم). هذه هي أساسا أداة الفولاذ والكربيدات. كما يتم استخدام الماس ونيتريد البورون والسيراميك كمواد أدوات.
علم المعادن
علم المعادن أو المعادن هو مجال علوم المواد الذي يدرس السلوك الفيزيائي والكيميائي للمعادن والمركبات والسبائك المعدنية. تشمل المعادن أيضًا التطبيق العملي للمعرفة الحالية حول المعادن - من استخراج المواد الخام إلى الانبعاثات النقدية للمنتجات النهائية.
دراسة بنية الخواص الفيزيائية والكيميائية للذوبان في المعادن والأكسيد والحلول الصلبة وتطوير نظرية الحالة المكثفة للمادة ؛
دراسة الديناميكا الحرارية والحركية وآلية التفاعلات المعدنية ؛
تطوير الأسس العلمية والتقنية والاقتصادية للاستخدام المتكامل للمواد الخام المعدنية المتعددة المعادن والنفايات الصناعية مع حل المشاكل البيئية ؛
تطور نظرية أساسيات المعالجة الحرارية للمعادن الحرارية والكهربائية والحرارية والمائية والغازية العمليات إنتاج المعادن والسبائك والمساحيق المعدنية والمواد المركبة والطلاء.
المعادن الحديدية وتشمل الحديد والمنغنيز والكروم والفاناديوم. كل الباقي ملون. وفقا لخصائصها الفيزيائية والغرض منها ، تنقسم المعادن غير الحديدية تقليديا إلى ثقيلة (النحاس ، الرصاص ، الزنك ، القصدير ، النيكل) والضوء (الألومنيوم ، المغنيسيوم).
وفقًا للعملية التكنولوجية الرئيسية ، يتم تقسيمها إلى المعادن الحرارية (الصهر) والمعادن الحرارية (استخراج المعادن في المحاليل الكيميائية). مجموعة متنوعة من المعادن الحرارية والمعادن البلازما.
تعدين البلازما - الاستخلاص من الخامات وصهر ومعالجة المعادن والسبائك تحت تأثير البلازما.
تتم معالجة الخامات (الأكاسيد ، إلخ) من خلال تحللها الحراري في البلازما. لمنع ردود الفعل العكسية ، يتم استخدام عامل اختزال (كربون ، هيدروجين ، ميثان ، إلخ) ، أو تبريد حاد لتيار البلازما ، ينتهك التوازن الديناميكي الحراري.
يسمح Plasma Metallurgy بالتخفيض المباشر للمعادن من الركاز ، وتسريع العمليات المعدنية بشكل كبير ، والحصول على مواد نظيفة ، وتقليل استهلاك الوقود (عامل الاختزال). عيب تعدين البلازما هو ارتفاع استهلاك الكهرباء المستخدمة لتوليد البلازما.

القصة
يعود أول دليل على أن شخصًا ما قد شارك في علم المعادن إلى 5-6 آلاف سنة قبل الميلاد. ه. ووجدت في ماجدانبيك ، بلوشنيك وغيرها من الأماكن في صربيا (بما في ذلك الفأس النحاسي 5500 قبل الميلاد ، المتعلقة بثقافة فينكا) ، بلغاريا (5000 قبل الميلاد) ، بالميلي () ، إسبانيا ، ستونهنج (). ومع ذلك ، كما يحدث غالبًا مع مثل هذه الظواهر القديمة ، لا يمكن دائمًا تحديد العمر بدقة.
في ثقافة الأزمنة المبكرة ، هناك الفضة والنحاس والقصدير والحديد نيزك ، والتي سمحت محدودة المعادن. وهكذا ، "الخناجر السماوية" كانت ذات قيمة عالية - الأسلحة المصرية التي تم إنشاؤها من الحديد نيزك 3000 سنة قبل الميلاد. ه. ولكن بعد أن تعلمت مناجم النحاس والقصدير صخرة واحصل على سبيكة تسمى البرونز ، عام 3500 ق.م. ه. دخل العصر البرونزي.
كان الحصول على الحديد من خام وصهر المعادن أكثر صعوبة بكثير. ويعتقد أن هذه التقنية اخترعت من قبل الحثيين حوالي 1200 قبل الميلاد. ه. ، تلك كانت بداية العصر الحديدي. أصبح سر صناعة التعدين والحديد عاملاً رئيسياً في حكم الفلسطينيين.
يمكن تتبع آثار تطور المعادن الحديدية في العديد من الثقافات والحضارات الماضية. يشمل ذلك الممالك والإمبراطوريات القديمة والعصور الوسطى في الشرق الأوسط والشرق الأوسط ، مصر القديمة والأناضول () ، قرطاج ، الإغريق والرومان من العصور القديمة والعصور الوسطى من أوروبا، الصين ، إلخ. تجدر الإشارة إلى أن العديد من أساليب وأجهزة وتقنيات المعادن تم اختراعها أصلاً في الصين القديمة ، ثم أتقن الأوروبيون هذه الحرفة (اختراع أفران الصهر ، الحديد الزهر، الصلب ، المطارق الهيدروليكية ، الخ). ومع ذلك ، تشير الأبحاث الحديثة إلى أن التكنولوجيا الرومانية كانت أكثر تطوراً مما كان يعتقد سابقًا ، خاصة في مجالات التعدين والتزوير.
المعادن الاستخراجية
يتكون تعدين التعدين في استخراج المعادن الثمينة من الخام وصهر المواد الخام المستخرجة إلى معادن نقية. من أجل تحويل أكسيد المعادن أو الكبريتيد إلى معدن نقي ، يجب فصل الخام عن طريق طرق فيزيائية أو كيميائية أو كهربائيا.
يعمل علماء المعادن مع ثلاثة مكونات رئيسية: المواد الخام ، والتركيز (أكسيد القيمة أو كبريتيد المعدن) والنفايات. بعد التعدين ، يتم سحق قطع كبيرة من الخام إلى النقطة التي يكون فيها كل جسيم مركزًا أو نفايات قيمة.
جبل عمل اختياري إذا كان خام البيئة يسمح بالتسرب. بهذه الطريقة ، يمكن للمرء أن يذوب ويحصل على محلول غني بالمعادن.
خام يحتوي على العديد من المعادن الثمينة في كثير من الأحيان. في هذه الحالة ، يمكن استخدام النفايات الناتجة عن إحدى العمليات كمادة خام لعملية أخرى.
أشابة
السبائك عبارة عن خليط متجانس من مكونات عنصرية كيميائية أو أكثر مع غلبة المكونات المعدنية. المرحلة الرئيسية أو الوحيدة من السبائك ، كقاعدة عامة ، هي محلول صلب لعناصر صناعة السبائك في المعدن ، والذي هو أساس السبائك.
السبائك لها خصائص معدنية ، على سبيل المثال: لمعان معدني ، الموصلية الكهربائية العالية والتوصيل الحراري. في بعض الأحيان لا يمكن أن تكون مكونات السبائك عناصر كيميائية فقط ، ولكن أيضًا مركبات كيميائية ذات خواص معدنية. على سبيل المثال ، المكونات الرئيسية للكربيدات هي كربيد التنغستن أو التيتانيوم. تختلف الخواص العيانية للسبائك دائمًا عن خصائص مكوناتها ، ويتحقق التجانس العياني للسبائك متعددة الطور (غير المتجانسة) نظرًا للتوزيع الموحد لمراحل النجاسة في المصفوفة المعدنية.
يتم الحصول على السبائك عادة عن طريق خلط المكونات في حالة منصهرة ، تليها التبريد. في درجات حرارة الانصهار العالية للمكونات ، يتم إنتاج السبائك عن طريق خلط مساحيق المعادن مع التلبيد اللاحق (هكذا ، على سبيل المثال ، يتم الحصول على العديد من سبائك التنغستن).
السبائك هي واحدة من المواد الإنشائية الرئيسية. من بينها ، أهمها السبائك القائمة على الحديد والألومنيوم. يمكن إدخال غير المعادن مثل الكربون والسيليكون والبورون وما إلى ذلك في تكوين العديد من السبائك ، ويستخدم أكثر من 5 آلاف سبيكة في هذه التقنية.
مصادر
http://ru.wikipedia.org/
موسوعة المستثمر. 2013 .
مرادفات:- - المعادن ، الزوج المعدني ، اللات. krushets. وفي شكل صغير ، في الصهر: كوروليك. في الحياة اليومية ، المعادن الثمينة باهظة الثمن: الذهب والبلاتين والفضة. بسيطة: الحديد ، النحاس ، الزنك ، القصدير ، الرصاص ؛ لقد اكتشفت الكيمياء مثل هذه المبادئ تقريبًا لجميع المعادن التي تتكون من ... ... قاموس دال التوضيحي
الغالبية العظمى (93 من 117) من العناصر الكيميائية المعروفة حاليا هي المعادن.
تشترك ذرات الفلزات المختلفة بشكل كبير في التركيب ، والمواد البسيطة والمعقدة التي تشكلها لها خواص متشابهة (فيزيائية وكيميائية).
الموقف في النظام الدوري وهيكل الذرات المعدنية.
في النظام الدوري ، توجد المعادن على اليسار وتحت الخط المكسور المشروط الذي يمر من البورون إلى الاستاتين (انظر الجدول أدناه). تقريبا جميع العناصر s (باستثناء H ، He) تنتمي إلى المعادن ، حوالي نصفها ص-العناصر ، كل شيء د- و و-العناصر ( اللانثانيدات و الأكتينات).
تحتوي معظم ذرات المعادن على مستوى الطاقة الخارجية على عدد صغير (يصل إلى 3) إلكترونات ، فقط بعض ذرات عنصر p (Sn ، Pb ، Bi ، Po) تحتوي على أكثر من (أربعة إلى ستة). ترتبط إلكترونات التكافؤ في ذرات المعدن بضعف (مقارنة بالذرات غير المعدنية) بالنواة. لذلك ، فإن ذرات المعدن تعطي هذه الإلكترونات بسهولة نسبية إلى ذرات أخرى ، تعمل في تفاعلات كيميائية فقط كعوامل اختزال وتتحول إلى كاتيونات موجبة الشحنة:
Me - ne - \u003d Me n +.
على النقيض من غير المعادن ، تتميز ذرات المعادن بحالات أكسدة موجبة فقط من +1 إلى +8.
إن السهولة التي تتبرع بها ذرات المعادن بإلكترونات التكافؤ لذرات أخرى تميز نشاط الاختزال لهذا المعدن. كلما كانت ذرة المعدن أسهل للإلكترونات ، زادت قوة عامل الاختزال. إذا تم ترتيب المعادن في صف واحد بترتيب تقليل قدرتها على الاختزال في المحاليل المائية ، نحصل عليها سلسلة النزوح المعدنية، والذي يسمى أيضا سلسلة الكهروكيميائية من الفولتية (أو قرب النشاط) المعادن (انظر الجدول أدناه).
انتشار مالمعادن في الطبيعة.
المعادن الثلاثة الأولى الأكثر شيوعًا في قشرة الأرض (هذه هي الطبقة السطحية لكوكبنا الذي يبلغ سمكه حوالي 16 كم) وتشمل الألمنيوم والحديد والكالسيوم. أقل شيوعا هي الصوديوم والبوتاسيوم والمغنيسيوم. يوضح الجدول أدناه الكسور الجماعية لبعض المعادن في قشرة الأرض.
الحديد والكالسيوم. أقل شيوعا هي الصوديوم والبوتاسيوم والمغنيسيوم. يوضح الجدول أدناه الكسور الجماعية لبعض المعادن في قشرة الأرض.
انتشار المعادن في قشرة الأرض
| معدن | معدن | الكسر الشامل في قشرة الأرض ، ٪ | |
|---|---|---|---|
| شركة | 8,8 | كر | 8,3 ∙ 10 -3 |
| الحديد | 4,65 | الزنك | 8,3 ∙ 10 -3 |
| كاليفورنيا | 3,38 | ني | 8 ∙ 10 -3 |
| نا | 2,65 | النحاس | 4,7 ∙ 10 -3 |
| K | 2,41 | برميل | 1,6 ∙ 10 -3 |
| ملغ | 2,35 | حج | 7 ∙ 10 -6 |
| منظمة الشفافية الدولية | 0,57 | زئبق | 1,35 ∙ 10 -6 |
| مليون | 0,10 | الاتحاد الافريقي | 5 ∙ 10 -8 |
تسمى العناصر التي تكون نسبة كتلتها في قشرة الأرض أقل من 0.01٪ نادر. المعادن النادرة تشمل ، على سبيل المثال ، جميع اللانثانيدات. إذا كان العنصر غير قادر على التركيز في قشرة الأرض ، أي أنه لا يشكّل خاماته الخاصة ، ولكنه يحدث كشوائب مع عناصر أخرى ، يُشار إليه مشتتا عناصر. المعادن التالية مبعثرة ، على سبيل المثال: Sc ، Ga ، In ، Tl ، Hf.
في الأربعينيات من القرن العشرين. اقترح العلماء الألمان والتر وإيدا نولا ذلك. أنه في كل حصاة على الرصيف توجد جميع العناصر الكيميائية للنظام الدوري. في البداية ، استقبل زملائهم هذه الكلمات بموافقة إجماعية. ومع ذلك ، مع ظهور طرق أكثر دقة للتحليل ، أصبح العلماء أكثر اقتناعًا بصحة هذه الكلمات.
نظرًا لأن جميع الكائنات الحية على اتصال وثيق بالبيئة ، فيجب أن يحتوي كل منها ، إن لم يكن جميعها ، على معظم العناصر الكيميائية للنظام الدوري. على سبيل المثال ، في جسم شخص بالغ ، يكون جزء كتلة المواد غير العضوية 6٪. من المعادن الموجودة في هذه المركبات ، يوجد Mg و Ca و Na و K. تحتوي العديد من الإنزيمات والمركبات العضوية النشطة بيولوجيًا الأخرى في جسمنا على V و Mn و Fe و Cu و Zn و Co و Ni و Mo و Cr و بعض المعادن الأخرى.
يحتوي جسم الشخص البالغ على حوالي 140 غرام من أيونات البوتاسيوم وحوالي 100 غرام من أيونات الصوديوم. مع الطعام ، نستهلك يومياً من 1.5 غرام إلى 7 غرام من أيونات البوتاسيوم ومن 2 غرام إلى 15 غرام من أيونات الصوديوم. الحاجة إلى أيونات الصوديوم كبيرة للغاية بحيث يجب إضافتها بشكل خاص إلى الطعام. يؤثر فقدان أيونات الصوديوم بشكل كبير (في صورة كلوريد الصوديوم مع البول والعرق) تأثيراً سلبياً على صحة الإنسان. لذلك ، في الطقس الحار ، يوصي الأطباء بشرب المياه المعدنية. ومع ذلك ، فإن محتوى الملح الزائد في الطعام يؤثر سلبًا على عمل أعضائنا الداخلية (بشكل أساسي القلب والكلى).
تحتاج إلى تشغيل الجافا سكريبت للتصويت.والمركبات الكيميائية الأخرى. للحصول على المعادن النقية وتطبيقاتها الإضافية ، من الضروري عزلها عن الخامات وإجراء التنظيف. إذا لزم الأمر صناعة السبائك ومعالجة المعادن الأخرى. العلم يدرس هذا. علم المعادن . المعادن يميز الخامات الحديدية (على أساس غدة) وغير الحديدية (لا تشمل الحديد ، فقط حوالي 70 عنصرا). الذهب والفضة و بلاتين تنطبق أيضا على المعادن الثمينة (النبيلة) . بالإضافة إلى ذلك ، فهي موجودة بكميات صغيرة في مياه البحر ، والنباتات ، والكائنات الحية (بينما تلعب دورًا مهمًا).
من المعروف أن جسم الإنسان يتكون من 3٪ المعادن . الأهم من ذلك كله في منطقتنا خلايا الكلسيوم و صوديوم تتركز في النظم اللمفاوية. المغنيسيوم يتراكم في العضلات و الجهاز العصبي , نحاس - في كبد , حديد - في دم.
استخلاص
غالبًا ما يتم استخراج المعادن من الأرض عن طريق التعدين ، وتكون النتيجة - الخامات الملغومة - مصدراً غنياً نسبياً للعناصر الضرورية. لمعرفة موقع الخامات ، يتم استخدام طرق بحث خاصة ، بما في ذلك استكشاف خام واستكشاف الرواسب. الودائع تنقسم عموما إلى مهنة (الخامات السطحية) ، حيث يتم التعدين عن طريق استخراج التربة باستخدام المعدات الثقيلة ، وكذلك تحت الأرض منجم.
يتم استخراج المعادن من خام التعدين ، عادة عن طريق الحد الكيميائي أو الكهربائي. ال بايرو تستخدم درجات الحرارة المرتفعة لتحويل خام المعادن الخام إلى مواد خام الخامات بالمحاليل المائية تقدم لنفس الغرض كيمياء المياه. تعتمد الطرق المستخدمة على نوع المعدن ونوع التلوث.
عندما يكون خام المعادن مركبًا أيونيًا للمعادن وغير المعدنية ، فإنه يتم صهره عادةً - تسخينه باستخدام عامل اختزال - لاستعادة المعدن النقي. العديد من المعادن الشائعة مثل حديد ذاب باستخدام كعامل الحد كربون (تم الحصول عليها من حرق الفحم). بعض المعادن ، مثل الألومنيوم و صوديوم ليس لديهم اختزال قابلة للحياة اقتصاديا ويتم استردادها باستخدام التحليل الكهربائي.
صلابة موس لبعض المعادن:
| صلابة | معدن |
|---|---|
| 0.2 | سيزيوم |
| 0.3 | الروبيديوم عنصر فلزي |
| 0.4 | بوتاسيوم |
| 0.5 | صوديوم |
| 0.6 | الليثيوم |
| 1.2 | الإنديوم عنصر فلزي |
| 1.2 | الثليوم عنصر فلزي |
| 1.25 | الباريوم |
| 1.5 | الإسترونتيوم عنصر فلزي |
| 1.5 | الغاليوم عنصر فلزي نادر |
| 1.5 | قصدير |
| 1.5 | الرصاص |
| 1.5 | |
| 1.75 | الكلسيوم |
| 2.0 | الكادميوم |
| 2.25 | البزموت عنصر فلزي |
| 2.5 | المغنيسيوم |
| 2.5 | زنك |
| 2.5 | اللنثانوم عنصر فلزي |
| 2.5 | فضة |
| 2.5 | الذهب |
| 2.59 | الايتريوم عنصر فلزي |
| 2.75 | الألومنيوم |
| 3.0 | نحاس |
| 3.0 | الأنتيمون |
| 3.0 | الثوريوم |
| 3.17 | سكانديوم |
| 3.5 | بلاتين |
| 3.75 | الكوبالت |
| 3.75 | البلاديوم |
| 3.75 | الزركونيوم |
| 4.0 | حديد |
| 4.0 | النيكل |
| 4.0 | الهفنيوم عنصر فلزي |
| 4.0 | المنغنيز |
| 4.5 | الفاناديوم |
| 4.5 | الموليبدينوم |
| 4.5 | الروديوم |
| 4.5 | عملاق |
| 4.75 | النيوبيوم |
| 5.0 | الايريديوم |
| 5.0 | الروثينيوم عنصر فلزي |
| 5.0 | التنتالوم عنصر فلزي |
| 5.0 | تكنيتيوم |
| 5.0 | الكروم |
| 5.5 | البيريليوم عنصر فلزي |
| 5.5 | الأوزميوم عنصر فلزي |
| 5.5 | الرينيوم عنصر فلزي |
| 6.0 | التنغستن |
| 6.0 | β-أورانوس |
بسبب الارتداد السهل للإلكترونات ، فإن أكسدة المعادن أمر ممكن ، مما قد يؤدي إلى ذلك تآكل وزيادة تدهور الخصائص. يمكن التعرف على القدرة على التأكسد من خلال السلسلة القياسية لنشاط المعادن. تؤكد هذه الحقيقة الحاجة إلى استخدام المعادن مع العناصر الأخرى ( أشابة وأهمها هو صلب) ، صناعة السبائك وتطبيق الطلاء المختلفة.
للحصول على وصف أكثر دقة للخصائص الإلكترونية للمعادن ، من الضروري استخدامها ميكانيكا الكم . في جميع المواد الصلبة مع ما يكفي تناظر تتداخل مستويات الطاقة في إلكترونات الذرات الفردية وتشكل مناطق مسموح بها ، وتسمى المنطقة المكونة من إلكترونات التكافؤ فرقة التكافؤ . يؤدي الارتباط الضعيف لإلكترونات التكافؤ في المعادن إلى حقيقة أن نطاق التكافؤ في المعادن واسع جدًا ، وأن جميع إلكترونات التكافؤ لا تكفي لملئه تمامًا.
السمة الأساسية لهذه المنطقة المملوءة جزئياً هي أنه حتى مع وجود حد أدنى من الجهد المطبق في العينة ، تبدأ إعادة هيكلة إلكترونات التكافؤ ، أي أنها تتدفق التيار الكهربائي.
نفس الحركة عالية الإلكترون تؤدي إلى الموصلية الحرارية العالية ، وكذلك القدرة على مرآة الإشعاع الكهرومغناطيسي (الذي يعطي للمعادن بريق مميز).
بعض المعادن
- ضوء:
- البعض:
تطبيق المعادن
مواد البناء
المواد أداة
تاريخ تطور الأفكار حول المعادن
بدأت معرفة الإنسان بالمعادن الذهب , فضة و نحاس أي من معادن موجودة في حالة حرة على سطح الأرض ؛ بعد ذلك تم ربطها بمعادن شائعة بشكل كبير في الطبيعة ويمكن تمييزها بسهولة عن مركباتها: قصدير , الرصاص , حديد و. هذه المعادن السبعة كانت مألوفة للبشرية في العصور القديمة. من بين القطع الأثرية المصرية القديمة ، هناك منتجات من الذهب والنحاس ، والتي ، وفقًا لبعض المصادر ، ترجع إلى عصر ما بعد 3000-4000 سنة قبل الميلاد. ه.
إلى سبعة معادن مشهورة ، فقط في العصور الوسطى أضيفت زنك , البزموت عنصر فلزي , الأنتيمون وفي بداية القرن الثامن عشر زرنيخ . منذ منتصف القرن الثامن عشر ، ارتفع عدد المعادن المكتشفة بسرعة ووصل إلى 65 مع بداية القرن العشرين ، و 96 بحلول بداية القرن الحادي والعشرين.
لم تساهم أي من الصناعات الكيميائية كثيراً في تطوير المعرفة الكيميائية مثل العمليات المرتبطة بإنتاج ومعالجة المعادن ؛ يرتبط تاريخهم بأهم اللحظات في تاريخ الكيمياء. إن خواص المعادن مميزة للغاية لدرجة أنه في فترة مبكرة ، شكلت الذهب والفضة والنحاس والرصاص والقصدير والحديد والزئبق مجموعة طبيعية واحدة من المواد المتجانسة ، ويشير مفهوم "المعادن" إلى أقدم المفاهيم الكيميائية. ومع ذلك ، فإن وجهات النظر حول طبيعتها بشكل أو بآخر محددة لا تظهر إلا في العصور الوسطى الكيميائيون . أفكار حقيقية أرسطو حول الطبيعة: إن تشكيل كل شيء موجود من أربعة عناصر (النار والأرض والمياه والهواء) يدل بالفعل على تعقيد المعادن ؛ لكن هذه الأفكار كانت غامضة ومجردة. لدى الخيميائيون مفهوم تعقيد المعادن ، ونتيجة لذلك ، فإن الإيمان بالقدرة على تحويل بعض المعادن إلى أخرى ، لإنشاءها بشكل مصطنع ، هو المفهوم الأساسي لوجهة نظرهم العالمية. هذا المفهوم هو استنتاج طبيعي من كتلة الحقائق المتعلقة بالتحولات الكيميائية للمعادن التي تراكمت بحلول ذلك الوقت. في الواقع ، فإن تحويل المعدن إلى أكسيد مختلف تمامًا عنهما عن طريق التكلس البسيط في الهواء والإعداد العكسي للمعادن من أكسيد ، وتهطال بعض المعادن من الآخرين ، وتشكيل السبائك التي لها خصائص أخرى غير المعادن التي تم أخذها في الأصل ، وهكذا - يبدو أن كل هذا تشير إلى تعقيد طبيعتها.
أما بالنسبة للتحويل الفعلي للمعادن إلى الذهب ، فقد اعتمد الاعتقاد في إمكانية ذلك على العديد من الحقائق المرئية. في البداية ، كان تشكيل السبائك بلون مشابه للذهب ، على سبيل المثال من النحاس والزنك ، في عيون الكيميائيين ، يحولهم بالفعل إلى ذهب. بدا لهم أنه كان من الضروري فقط تغيير اللون ، وستصبح خصائص المعدن مختلفة أيضًا. على وجه الخصوص ، ساهمت التجارب غير المستقرة في هذا الاعتقاد ، عندما أخذت المواد التي تحتوي على مزيج من هذا الذهب لتحويل المعدن الأساسي إلى ذهب. على سبيل المثال ، في نهاية القرن الثامن عشر ، ادعى صيدلي في كوبنهاغن أن الفضة النقية كيميائيًا يتم تحويلها جزئيًا إلى ذهب عندما تنصهر بالزرنيخ. وأكد هذه الحقيقة من قبل الصيدلي الشهير. غيتون دي مورفو وجعلت الكثير من الضوضاء. بعد فترة وجيزة تبين أن الزرنيخ المستخدم في التجربة يحتوي على آثار من الفضة والذهب.
نظرًا للمعادن السبعة المعروفة آنذاك ، فقد كان من الأسهل الخضوع لتحولات كيميائية ، والبعض الآخر أكثر صعوبة ، قسمها الكيميائيون إلى الكمال النبيل والعيوب. السابق ينتمي إلى الذهب والفضة ، والأخير من النحاس والقصدير والرصاص والحديد والزئبق. هذا الأخير ، يمتلك خواص المعادن النبيلة ، لكن في الوقت نفسه يختلف اختلافًا حادًا عن جميع المعادن في حالته السائلة وتقلبه ، علماء مشغولون للغاية في ذلك الوقت ، وقد ميزها البعض في مجموعة خاصة ؛ كان الاهتمام الذي حظي بها كبيرًا للغاية لدرجة أنهم بدأوا يفكرون في الزئبق بين العناصر التي تشكلت منها المعادن نفسها ، وكان عليها بالتحديد أن يروا حاملًا لخصائص معدنية. بقبول وجود بعض الفلزات بطبيعتها في الانتقال إلى أخرى ، غير مكتمل إلى الكمال ، افترض الكيميائيون أن هذا التحول في ظل الظروف العادية بطيء للغاية ، لعدة قرون ، وربما لا يخلو من المشاركة الغامضة للأجرام السماوية ، والتي كان لها الفضل في ذلك الوقت في هذا الدور الكبير وفي مصير الرجل. من قبيل الصدفة ، كان هناك سبعة معادن معروفة ، وكذلك الكواكب المعروفة آنذاك ، وهذا يدل كذلك على وجود علاقة غامضة بينهما. بالنسبة للكيميائيين ، غالبًا ما تسمى المعادن بالكواكب. يسمى الذهب الشمس الفضة - القمر النحاس - فينوس والقصدير - كوكب المشتري الرصاص - زحل حديد - المريخ والزئبق - عطارد . عندما تم اكتشاف الزنك والبزموت والأنتيمون والزرنيخ ، فإن الأجسام التي تشبه المعادن من جميع النواحي ، والتي تتميز بأحد الخصائص المميزة للمعادن والقدرة على التحمل ، يتم تطويرها بشكل سيء ، وقد تم تحديدها في مجموعة خاصة - semimetals. كان تقسيم المعادن إلى معادن وشبه المعادن موجودًا في منتصف القرن الثامن عشر.
وكان تحديد تكوين المعدن في البداية مضاربة بحتة. في البداية ، قبل الكيميائيون أنها تشكلت من عنصرين - و كبريت . أصل هذا الرأي غير معروف ، إنه موجود بالفعل في القرن الثامن. في GEBERIT دليل على وجود الزئبق في المعادن هو أنه يذوبها ، وفي هذه الحلول تختفي شخصيتها ، يتم امتصاصه بواسطة الزئبق ، وهو ما لم يحدث لو لم يكن لديهم شيء واحد مشترك مع الزئبق. بالإضافة إلى ذلك ، أعطى الزئبق مع الرصاص شيئا مشابها للقصدير. أما بالنسبة للكبريت ، فربما تم أخذه لأن مركبات الكبريت كانت معروفة في مظهرها مع المعادن. في المستقبل ، تصبح هذه الأفكار البسيطة ، ويرجع ذلك إلى محاولات فاشلة للحصول على المعادن بشكل مصطنع ، معقدة للغاية ومرتبكة. في مفاهيم الكيميائيين ، على سبيل المثال في القرنين الثالث عشر ، لم يكن الزئبق والكبريت الذي تتشكل منه المعادن الزئبق والكبريت اللذين كان في أيدي الخيميائيين. كان مجرد شيء مشابه لهم ، يمتلك خصائص خاصة ؛ تم التعبير عن شيء موجود حقًا في الكبريت العادي والزئبق داخلهما إلى حد كبير مقارنةً بالهيئات الأخرى. تحت الزئبق ، الذي هو جزء من المعادن ، مثلوا شيئًا تسبب في ثباتها ، بريقها المعدني ، ليونة ، بكلمة ، دعم من نوع معدني ؛ بواسطة الكبريت كان المقصود الناقل للتغيير ، وقابلية التحلل ، واحتراق المعادن. كان هذان العنصران في المعادن بنسب مختلفة ، وكما قالا في ذلك الحين ، بطرق مختلفة ثابتة ؛ بالإضافة إلى ذلك ، يمكن أن تكون بدرجات متفاوتة من النقاء. وفقًا لـ Geber ، على سبيل المثال ، يتكون الذهب من كمية كبيرة من الزئبق وكمية صغيرة من الكبريت في أعلى درجة من النقاء والأكثر ثباتًا ؛ في القصدير ، على العكس من ذلك ، افترضوا الكثير من الكبريت والقليل من الزئبق ، والتي لم تكن نظيفة ، سيئة الثبات وهلم جرا. كل هذا ، بالطبع ، أرادوا التعبير عن موقف مختلف للمعادن للعامل الكيميائي القوي الوحيد في ذلك الوقت - النار. مع زيادة تطوير هذه الآراء ، بدا أن عنصرين - الزئبق والكبريت - غير كافيين لشرح الكيميائيون تركيبة المعادن ؛ تم إضافة الملح لهم ، وبعض الزرنيخ. أرادوا أن يشيروا إلى هذا أنه مع كل تحولات المعادن ، يبقى شيء ما غير مستقر وثابت. إذا كان "تحويل المعادن الأساسية إلى معادن نبيلة في الطبيعة يستغرق قرونًا" ، فقد سعى الكيميائيون إلى تهيئة الظروف التي تكون فيها عملية الكمال هذه ، سيكون النضج سريعًا وسهلاً. نظرًا للارتباط الوثيق بين الكيمياء والطب ثم البيولوجيا ، تم تحديد فكرة تحويل المعادن بشكل طبيعي مع فكرة نمو وتطور الهيئات المنظمة: الانتقال ، على سبيل المثال ، من الرصاص إلى الذهب ، وتشكيل مصنع من الحبوب التي ألقيت في الأرض ، وكما كانت متحللة ، التخمير ، شفاء عضو مريض في شخص - كل هذه كانت ظواهر خاصة لعملية حياة غامضة شائعة واحدة ، والتحسين ، وكان سببها فقط الحوافز. ومن هذا المنطلق ، فإن المبدأ الغامض ، الذي يجعل من الممكن الحصول على الذهب ، هو علاج الأمراض ، وتحويل جسم الإنسان القديم إلى جسم صغير وما إلى ذلك. لذلك كان هناك مفهوم حجر الفيلسوف الرائع.
فيما يتعلق بالدور حجر الفيلسوف في تحويل المعادن الأساسية إلى النبيلة ، هناك أكثر من ذلك الدلائل المتعلقة بتحويلها إلى الذهب ؛ ولا يُقال إلا القليل عن الحصول على الفضة. وفقًا لبعض المؤلفين ، فإن حجر الفيلسوف نفسه يحول المعادن إلى الفضة والذهب ؛ وفقا للآخرين ، هناك نوعان من هذه المادة: واحد مثالي والآخر أقل كمالا ، وهذا الأخير يخدم لإنتاج الفضة. فيما يتعلق بحجم حجر الفيلسوف المطلوب للتحول ، فإن الاتجاهات مختلفة أيضًا. في جزء واحد ، يستطيع جزء واحد منه تحويل 10،000،000 جزء من المعدن إلى ذهب ، في أجزاء أخرى - 100 جزء وحتى جزءان فقط. للحصول على الذهب ، تم ذوبان بعض المعادن الأساسية أو أخذ الزئبق وتم إلقاء حجر فيلسوف هناك ؛ أكد البعض أن التحول يحدث على الفور ، في حين أن البعض الآخر - شيئا فشيئا. هذه الآراء حول طبيعة المعادن وقدرتها على تحويل الثبات بشكل عام لعدة قرون حتى القرن السابع عشر ، عندما تبدأ في إنكار كل هذا بحدة ، بشكل خاص لأن هذه الآراء تسببت في ظهور العديد من المشعوذين الذين استغلوا الأمل في الحصول على الذهب الساذج. على وجه الخصوص ، كافح مع أفكار الكيميائيين بويل يقول في مكان واحد: "أود أن أعرف" كيف يمكن أن يتحلل الذهب إلى الزئبق والكبريت والملح ؛ أنا على استعداد لدفع تكاليف هذه التجربة ؛ بالنسبة لي ، لم أتمكن من تحقيق ذلك أبدًا ".
بعد قرون من المحاولات غير المثمرة لإنتاج المعادن بشكل مصطنع وعدد الحقائق التي تراكمت بحلول القرن السابع عشر ، على سبيل المثال ، دور الهواء في الاحتراق ، وزيادة وزن المعادن في الأكسدة ، والتي ، بالمناسبة ، جابر بن حيان في القرن الثامن ، بدت مسألة التكوين الأولي للمعادن قريبة جداً من النهاية ؛ لكن ظهر تيار جديد في الكيمياء ، وكانت نتائجه نظرية phlogiston ، ولا يزال حل هذا السؤال يتأخر لفترة طويلة.
كان العلماء في ذلك الوقت مهتمين جدًا بظواهر الاحتراق. انطلاقًا من الفكرة الأساسية لفلسفة ذلك الوقت ، وهي أن أوجه التشابه في خواص الهيئات يجب أن تأتي من نفس المبادئ ، والعناصر التي تتكون منها ، كان من المفترض أن الأجسام القابلة للاحتراق تتضمن عنصرًا مشتركًا. يعتبر عمل الحرق عملية تحلل ، تحلل إلى عناصر ؛ بينما تميز عنصر الاحتراق في شكل لهب ، بينما بقي الآخرون. وإدراكًا لوجهة نظر الكيميائيين حول تكوين المعادن من العناصر الثلاثة ، الزئبق والكبريت والملح ، وقبول وجودهم الحقيقي في المعدن ، يجب الاعتراف بالكبريت كمبدأ قابل للاشتعال. ثم كان من الواضح أن المكون الآخر من المعدن يجب أن يتعرف على باقي تكليس المعدن - "الأرض" ، كما قالوا آنذاك ؛ لذلك ، لا يوجد شيء له علاقة بالزئبق. الكبريت ، من ناحية أخرى ، يحترق فيه حمض الكبريتيك ، التي اعتبرها كثيرون ، بحكم ما قيل ، هيئة أبسط من الكبريت ، وأدرجت في عدد الهيئات الأولية. كان هناك ارتباك وتناقض. بيشر من أجل التوفيق بين المفاهيم القديمة ومفاهيم جديدة ، وافق على وجود ثلاث درجات في معدن الأرض: في الواقع "الأرض" ، "الأرض القابلة للاحتراق" و "الأرض الزئبقية". في هذه الظروف ستال اقترح نظريته. في رأيه ، فإن بداية القابلية للاشتعال ليست الكبريت أو أي مادة أخرى معروفة ، ولكن شيء غير معروف ، واسمه اللاهوب مادة كيميائية . من المفترض أن تكون المعادن من فلوجيستون والأرض ؛ ويرافق تكليس المعادن في الهواء عن طريق إطلاق phlogiston. الإيصال العكسي للمعادن من أرضه باستخدام الفحم - مادة غنية بالفلوجستون - هو عملية الجمع بين المدونة الفلكية والأرض. على الرغم من وجود العديد من المعادن ، وكل منها ، عندما تكلس ، أعطى أرضه الخاصة ، إلا أن الأخير ، كعنصر ، كان واحدًا ، لذلك كان هذا المكون من المعدن له نفس الطبيعة الافتراضية مثل phlogiston ؛ ومع ذلك ، أخذ أتباع Stahl في بعض الأحيان "الأرض عنصري" بقدر وجود المعادن. عندما كافنديش عندما تذوب المعادن في الأحماض الواردة هيدروجين ودرس خصائصه (عدم القدرة على الحفاظ على الاحتراق ، وانفجاره في خليط مع الهواء ، وما إلى ذلك) ، تعرف على Stahl phlogiston فيه ؛ المعادن ، وفقا لمفاهيمه ، تتكون من الهيدروجين و "الأرض". تم قبول هذا الرأي من قبل العديد من أتباع نظرية phlogiston.
على الرغم من الانسجام الواضح في نظرية phlogiston ، كانت هناك حقائق كبيرة لا يمكن ربطها بها. عرف هيبير أيضًا أن المعادن عندما تحترق تزيد في الوزن ؛ في هذه الأثناء ، وفقًا لستال ، يجب أن يفقدوا المدون: عندما يتم إعادة توصيل المدون إلى "الأرض" ، يكون وزن المعدن الذي تم الحصول عليه أقل من وزن "الأرض". وهكذا ، اتضح أن phlogiston يجب أن يكون لها بعض الممتلكات الخاصة - الجاذبية السلبية. على الرغم من جميع الفرضيات البارعة التي تم التعبير عنها لشرح هذه الظاهرة ، إلا أنها كانت غير مفهومة ومحيرة.
عندما افوازييه اكتشف دور الهواء في الاحتراق وأظهر أن الربح في وزن المعادن أثناء الاحتراق يأتي من إضافة الأكسجين من الهواء إلى المعادن ، وبالتالي أثبت أن عمل حرق المعادن لا يتحلل إلى عناصر ، بل على العكس ، فعل الانضمام ، مسألة تعقيد المعادن تم حلها سلبا. تم تعيين المعادن لعناصر كيميائية بسيطة ، بحكم فكرة لافوازييه الرئيسية أن الأجسام البسيطة هي التي لم يكن من الممكن عزل الأجسام الأخرى عنها. مع الخلق النظام الدوري للعناصر الكيميائية مندليف أخذت العناصر المعدنية مكانها الصحيح في ذلك.
انظر أيضا
الملاحظات
مراجع
- إس بي فوكولوف: // قاموس بروكهوس وإيفرون الموسوعي : في 86 مجلدًا (82 مجلدًا و 4 مجلدات إضافية). - SPB. ، ١٨٩٠-١٩٠٧. (الجزء التاريخي)
| الجدول الدوري | |
|---|---|
| ديمتري إيفانوفيتش منديليف · القانون الدوري · مجموعات العناصر | |
| صيغ | باختصار بواسطة الكتل · مدد الموسع التكوينات الإلكترونية · الكهربية · البديل · نظائر العناصر |
| قوائم المواد في | اسم ·
بسط و علل (تكريما للأماكن ، تكريما للاكتشافات) · وقت الافتتاح حالة الأكسدة · انتشار (في الرجل) · استقرار النظائر · |


