30.08.2019
تكنولوجيا تصنيع الألومنيوم. العملية التكنولوجية لإنتاج الألومنيوم
1.1 الحصول على الألومينا من الخامات
يتم إنتاج الألومينا بثلاث طرق: القلوية ، الحمضية والكهارل. يتم استخدام الطريقة القلوية على نطاق واسع (طريقة K. I. Bayer ، التي تم تطويرها في روسيا في نهاية القرن قبل الماضي وتستخدم لمعالجة البوكسيت عالي الجودة بكمية صغيرة (تصل إلى 5-6 ٪) من السيليكا). منذ ذلك الحين ، تم تحسين تنفيذها الفني بشكل كبير. يظهر مخطط إنتاج الألومينا وفقًا لطريقة باير في الشكل. 1.
جوهر هذه الطريقة هو أن حلول الألومنيوم تتحلل بسرعة عند إدخال هيدروكسيد الألومنيوم فيها ، والحل المتبقي بعد التحلل بعد التبخر تحت التحريك الشديد عند 169-170 درجة مئوية يمكن أن يعيد إذابة الألومينا الموجودة في البوكسيت. تتكون هذه الطريقة من العمليات الأساسية التالية:
تحضير البوكسيت ، يتكون في تكسيره وطحنه في المطاحن ؛ يتم تغذية البوكسيت والقلويات الكاوية وكمية صغيرة من الجير إلى المطاحن ، مما يحسن من إطلاق Al 2 O 3 ؛ يتم تغذية اللب الناتج إلى الترشيح ؛
غسل البوكسيت (يتم استبدال كتل الأوتوكلاف الدائرية المستخدمة مؤخرًا جزئيًا بواسطة الأوتوكلاف الأنبوبي الذي يحدث فيه الترشيح عند درجات حرارة تتراوح بين 230 و 250 درجة مئوية (500-520 كلفن)) ، والذي يتكون في تحللها الكيميائي من التفاعل مع محلول قلوي مائي ؛ تنتقل هيدرات أكسيد الألومنيوم الملامسة للقلويات إلى المحلول في شكل ألومينات الصوديوم:
الوه + نوه → نالو 2 + ح 2 س
Al (OH) 3 + NaOH → NaAlO 2 + 2H 2 O؛
SiO 2 + 2NaOH → Na 2 SiO 3 + H 2 O؛
في محلول ، يشكل ألومينات الصوديوم وسيليكات الصوديوم ألومينات سيليكات الصوديوم غير القابلة للذوبان ؛ تمر أكاسيد التيتانيوم والحديد في البقايا غير القابلة للذوبان ، مما يجعل البقايا حمراء ؛ تسمى هذه البقايا بالطين الأحمر. عند الانتهاء من الذوبان ، يتم تخفيف ألومينات الصوديوم الناتجة بمحلول قلوي مائي مع خفض درجة الحرارة بمقدار 100 درجة مئوية ؛
عادة ما يتم فصل محلول ألومينات عن الطين الأحمر عن طريق الغسيل في مثخن خاص ؛ نتيجة لذلك ، يستقر الطين الأحمر ، ويتم استنزاف محلول الألومينات ثم تصفيته (موضح). بكميات محدودة ، يتم استخدام الحمأة ، على سبيل المثال ، كمضاف للإسمنت. اعتمادًا على درجة البوكسيت ، يمثل 1-1 طن من أكسيد الألمنيوم الناتج من 0.6-1.0 طن من الطين الأحمر (بقايا جافة) ؛
تحلل ألومينات الحل. يتم ترشيحها وضخها في حاويات كبيرة مع خلاطات (أجهزة تحلل). عند التبريد عند 60 درجة مئوية (330 كلفن) والتحريك المستمر ، يتم استخراج هيدروكسيد الألومنيوم Al (OH) 3 من محلول فائق التشبع. نظرًا لأن هذه العملية تسير ببطء وبصورة غير متساوية ، كما أن تكوين ونمو بلورات هيدروكسيد الألومنيوم لهما أهمية كبيرة أثناء المعالجة الإضافية ، تتم إضافة كمية كبيرة من هيدروكسيد الصلب إلى أجهزة التحلل:
نا 2 O ּ آل 2 O 3 + 4H 2 O → سورة (OH) 3 + 2NaOH.
تخصيص هيدروكسيد الألومنيوم وتصنيفه ؛ يحدث هذا في الهيدروكلونات والفلاتر الفراغ ، حيث يتم عزل الراسب الذي يحتوي على 50-60٪ من جزيئات Al (OH) من محلول ألومينات. يتم إرجاع جزء كبير من هيدروكسيد إلى عملية التحلل كمادة البذور ، والتي لا تزال متداولة بكميات ثابتة. بقايا بعد الغسيل بالماء يذهب إلى تكلس. يتم أيضًا إعادة الترشيح إلى الدورة الدموية (بعد التركيز في المبخرات ، لإلقاء البوكسيت الجديد) ؛
الجفاف من هيدروكسيد الألومنيوم (تكليس) ؛ هذه هي عملية إنتاج الألومينا النهائية. يتم تنفيذها في الأفران الدوارة الأنبوبية ، وكذلك في الأفران ذات الحركة المضطربة للمادة عند درجة حرارة 1150-1300 درجة مئوية ؛ هيدروكسيد الألومنيوم الخام ، يمر عبر فرن دوار ، يتم تجفيفه وتجفيفه ؛ عند التسخين ، تحدث التحولات الهيكلية التالية بالتتابع:
| Al (OH) 3 → AlOOH → γ-Al 2 O 3 → α-Al 2 O 3 |
في الألومينا المكلسة أخيرًا تحتوي على 30-50٪ α-Al 2 O 3 (اكسيد الالمونيوم) ، والباقي هو Al-Al 2 O 3.
تستخلص هذه الطريقة 85-87٪ من إجمالي الألومينا الناتج. الألومينا الناتجة عبارة عن مركب كيميائي قوي له نقطة انصهار 2050 حول C.
1.2 الحصول على الألومنيوم من أكسيدها
يتم إجراء التحليل الكهربي للألومينا المذاب في ذوبان يعتمد على الكريوليت على درجة حرارة 950-970 درجة مئوية في محلل كهربائي. تتكون الخلية من حمام مبطن بكتل كربونية ، يوجد في أسفله تيار كهربائي. يترسب الألمنيوم السائل في القاع أثناء عمل الكاثود أثقل من ذوبان ملح المنحل بالكهرباء ؛ لذلك ، يتم جمعه على قاعدة الفحم ، حيث يتم ضخه بشكل دوري (الشكل 2). من الأعلى ، يتم غمر أنودات الكربون في المنحل بالكهرباء ، الذي يحترق في جو الأكسجين المنطلق من أكسيد الألومنيوم ، أو يطلق أول أكسيد الكربون (CO) أو ثاني أكسيد الكربون (CO 2). في الممارسة العملية ، يتم استخدام نوعين من الأنودات:
أ) الأنودات Zederberg الخبز الذاتي ، تتكون من قوالب ، ما يسمى "أرغفة" من كتلة Zederberg (الفحم منخفضة الرماد مع 25-35 ٪ من قطران قطران الفحم الفحم) محشوة في قذيفة الألومنيوم ؛ تحت تأثير ارتفاع درجة الحرارة ، يتم حرق كتلة الأنود (متكلس) ؛
ب) أنودات صلب أو "مستمر" من كتل الفحم الكبيرة (على سبيل المثال ، 1900 × 600 × 500 مم بوزن حوالي 1.1 طن).
القوة الحالية على المحولات الكهربائية هي 150،000 أ. وهي متصلة بالشبكة في سلسلة ، أي يتم الحصول على نظام (سلسلة) - سلسلة طويلة من المحولات الكهربائية.
يكون جهد التشغيل على الحمام ، والذي يتراوح من 4 إلى 5 فولت ، أعلى بكثير من الجهد الذي يحدث عنده تحلل أكسيد الألومنيوم ، نظرًا لأن فقد الجهد في أجزاء مختلفة من النظام أمر لا مفر منه أثناء التشغيل. يوضح الشكل التالي توازن المواد الخام والطاقة في إنتاج 1 طن من الألومنيوم. 3.
التحليل الكهربائي لكلوريد الألومنيوم (طريقة ألكوا)
في وعاء التفاعل ، يتم تحويل الألومينا أولاً إلى كلوريد الألومنيوم. ثم ، في حمام كثيف معزول ، يذوب التحليل الكهربائي لـ AlCl 3 في الملح المنصهر من KCl ، يحدث كلوريد الصوديوم. يتم امتصاص الكلور المنطلق خلال هذه العملية وتزويده للاستخدام الثانوي ؛ يودع الألومنيوم في الكاثود.
تتمثل مزايا هذه الطريقة في التحليل الكهربائي الحالي لصهر الكريوليت والألومينا السائل (Al 2 O 3 ، المذاب في كريوليت Na 3 AlF 6): توفير ما يصل إلى 30 ٪ من الطاقة ؛ إمكانية استخدام أكسيد الألومنيوم ، وهو غير مناسب للتحليل الكهربائي التقليدي (على سبيل المثال ، Al 2 O 3 مع نسبة عالية من السيليكون) ؛ استبدال الكريوليت الغالي بأملاح أرخص ؛ اختفاء خطر إطلاق الفلوريد.
الحد من كلوريد الألومنيوم مع المنغنيز (توث - طريقة)
عندما يتم تقليل المنغنيز من كلوريد الألومنيوم ، يتم تحرير الألمنيوم. من خلال التكثيف المتحكم فيه ، يتم إطلاق الملوثات المتعلقة بالكلور من تيار كلوريد المنجنيز. عندما يتم إطلاق الكلور ، يتأكسد كلوريد المنجنيز إلى أكسيد المنجنيز ، والذي يتم بعد ذلك اختزاله إلى المنجنيز القابل لإعادة التدوير. المعلومات الموجودة في المنشورات الحالية غير دقيقة للغاية ، لذلك في هذه الحالة يجب عليك التخلي عن تقييم الطريقة.
تقول إحدى الأساطير المشكوك فيها أنه عندما وصل رجل يحمل وعاء معدني غير قابل للكسر إلى الإمبراطور الروماني تيبيريوس (42 ق.م. - 37 م). زُعم أن مادة الوعاء قد تم الحصول عليها من الألومينا (Al 2 O 3) ، وبالتالي ، يجب أن تكون من الألمنيوم. خوفا من أن مثل هذا المعدن الطيني يمكن أن تنخفض قيمة الذهب والفضة ، أمر Tiberius قطع الرجل في حالة. بالطبع ، يصعب تصديق هذه القصة: الألمنيوم الأصلي لا يحدث في الطبيعة ، وخلال فترة الإمبراطورية الرومانية لم يكن هناك أي وسيلة تقنية تسمح باستخراج الألومنيوم من مركباته.
من حيث الانتشار في الطبيعة ، يحتل الألومنيوم المرتبة الأولى بين المعادن. محتواه في قشرة الأرض هو 7.45 ٪. ومع ذلك ، على الرغم من انتشاره على نطاق واسع في الطبيعة ، كان الألومنيوم أحد المعادن النادرة حتى نهاية القرن التاسع عشر. في شكله النقي ، لا يحدث الألمنيوم بسبب نشاطه الكيميائي العالي. يوجد أساسًا في شكل مركبات تحتوي على الأكسجين والسيليكون - ألومينوسيليكات.
يمكن لخامات الألومنيوم أن تخدم فقط الصخور الغنية بالألومينا (Al 2 O 3) والتي تحدث في كتل كبيرة على سطح الأرض. وتشمل هذه الأنواع bauxites، سينيت - (نا، K) 2 O ּ آل 2 O 3 ּ 2 شافي 2، alunite - (نا، K) 2 SO 4 ּ آل 2 (SO 4) 3 ּ 4 سورة (OH) 3 والكاولين (الطين)، الميدان الفلسبار (أورثوكلاز) - K 2 O ּ آل 2 O 3 شافي 2 ּ 6.
والخام الرئيسي لإنتاج الألومنيوم هو البوكسيت. الألومنيوم الواردة فيها كما هيدروكسيدات سورة (OH)، AlOOH، اكسيد الالمونيوم آل 2 O 3 والكاولينيت آل 2 O 3 شافي 2 ּ ּ 2 2 H 2 O. والتركيب الكيميائي للالبوكسيت معقدة: 28-70٪ الألومينا. 0.5-20 ٪ السيليكا. 2-50 ٪ أكسيد الحديد. 0.1-10 ٪ أكسيد التيتانيوم. في الآونة الأخيرة ، تم استخدام النيفلين والألونيت كخامات.
توجد رواسب البوكسيت الكبيرة في الأورال ، في منطقة تيخفين بمنطقة لينينغراد ، في إقليمي التاي وكراسنويارسك.
سينيت (K ּ نا 2 O ּ آل 2 O 3 شافي 2 ּ 2) هو جزء من الأباتيت الصخور (شبه جزيرة كولا).
لأول مرة في شكل حر ، تم عزل الألومنيوم في عام 1825 من قبل الفيزيائي الدنماركي Oersted بواسطة عمل ملغم البوتاسيوم على كلوريد الألومنيوم. في عام 1827 حسن الكيميائي الألماني ويلر طريقة أورستد من خلال استبدال ملغم البوتاسيوم بالبوتاسيوم المعدني:
AlCl 3 + 3K → 3KCl + Al (يستمر التفاعل مع إطلاق الحرارة).
في عام 1854 ، طبق القديس كلير ديفيل في فرنسا لأول مرة طريقة Weler للإنتاج الصناعي للألمنيوم ، باستخدام صوديوم أرخص بدلاً من البوتاسيوم ، وبدلاً من كلوريد الألومنيوم الرطب ، كلوريد الألومنيوم المزدوج والصوديوم. في عام 1865 ، أظهر العالم الفيزيائي والكيميائي الروسي NN Beketov إمكانية استبدال الألومنيوم بالمغنيسيوم من الكريوليت المصهور. تم استخدام هذا التفاعل في عام 1888 لإنتاج الألمنيوم في أول مصنع ألماني في Gmelingen. تم إنتاج الألومنيوم باستخدام هذه الأساليب "الكيميائية" المزعومة من 1854 إلى 1890. لمدة 35 عامًا باستخدام هذه الطرق ، تم الحصول على ما مجموعه حوالي 20 طنًا من الألومنيوم.
في نهاية الثمانينيات من القرن الماضي ، حلت الأساليب الكيميائية محل الطريقة الإلكتروليتية ، التي مكّنت من خفض تكلفة الألومنيوم بشكل كبير وخلق الشروط المسبقة للتطور السريع لصناعة الألمنيوم. قدم مؤسسو الطريقة الإلكتروليتية الحديثة لإنتاج الألمنيوم ، Eru in France و Hall في الولايات المتحدة الأمريكية بشكل مستقل في عام 1886 تقريبا نفس الطلبات للحصول على براءة اختراع طريقة لإنتاج الألومنيوم عن طريق التحليل الكهربي للألومينا المذابة في الكريوليت المنصهر. منذ ظهور براءات الاختراع Eru و Hall ، بدأت صناعة الألومنيوم الحديثة ، والتي نمت في أكثر من 115 عامًا من وجودها لتصبح واحدة من أكبر الصناعات في مجال المعادن.
تتكون عملية إنتاج الألومنيوم من ثلاث مراحل رئيسية:
1). الحصول على الألومينا (Al 2 O 3) من خامات الألومنيوم ؛
2). الحصول على الألومنيوم من الألومينا ؛
3). تكرير الألومنيوم.
الحصول على الألومينا من الخامات.
يتم إنتاج الألومينا بثلاث طرق: القلوية ، الحمضية والكهارل. يتم استخدام الطريقة القلوية على نطاق واسع (طريقة K. I. Bayer ، التي تم تطويرها في روسيا في نهاية القرن قبل الماضي وتستخدم لمعالجة البوكسيت عالي الجودة بكمية صغيرة (تصل إلى 5-6 ٪) من السيليكا). منذ ذلك الحين ، تم تحسين تنفيذها الفني بشكل كبير. يظهر مخطط إنتاج الألومينا وفقًا لطريقة باير في الشكل. 1.
جوهر هذه الطريقة هو أن حلول الألومنيوم تتحلل بسرعة عند إدخال هيدروكسيد الألومنيوم فيها ، والحل المتبقي بعد التحلل بعد التبخر تحت التحريك الشديد عند 169-170 درجة مئوية يمكن أن يعيد إذابة الألومينا الموجودة في البوكسيت. تتكون هذه الطريقة من العمليات الأساسية التالية:
1). تحضير البوكسيت ، يتكون في تكسيره وطحنه في المطاحن ؛ يتم تغذية البوكسيت والقلويات الكاوية وكمية صغيرة من الجير إلى المطاحن ، مما يحسن من إطلاق Al 2 O 3 ؛ يتم تغذية اللب الناتج إلى الترشيح ؛
2). غسل البوكسيت (يتم استبدال كتل الأوتوكلاف الدائرية المستخدمة مؤخرًا جزئيًا بواسطة الأوتوكلاف الأنبوبي الذي يحدث فيه الترشيح عند درجات حرارة تتراوح بين 230 و 250 درجة مئوية (500-520 كلفن)) ، والذي يتكون في تحللها الكيميائي من التفاعل مع محلول قلوي مائي ؛ تنتقل هيدرات أكسيد الألومنيوم الملامسة للقلويات إلى المحلول في شكل ألومينات الصوديوم:
الوه + نوه → نالو 2 + ح 2 س
Al (OH) 3 + NaOH → NaAlO 2 + 2H 2 O؛
SiO 2 + 2NaOH → Na 2 SiO 3 + H 2 O؛
في محلول ، يشكل ألومينات الصوديوم وسيليكات الصوديوم ألومينات سيليكات الصوديوم غير القابلة للذوبان ؛ تمر أكاسيد التيتانيوم والحديد في البقايا غير القابلة للذوبان ، مما يجعل البقايا حمراء ؛ تسمى هذه البقايا بالطين الأحمر. عند الانتهاء من الذوبان ، يتم تخفيف ألومينات الصوديوم الناتجة بمحلول قلوي مائي مع خفض درجة الحرارة بمقدار 100 درجة مئوية ؛
3). عادة ما يتم فصل محلول ألومينات عن الطين الأحمر عن طريق الغسيل في مثخن خاص ؛ نتيجة لذلك ، يستقر الطين الأحمر ، ويتم استنزاف محلول الألومينات ثم تصفيته (موضح). بكميات محدودة ، يتم استخدام الحمأة ، على سبيل المثال ، كمضاف للإسمنت. اعتمادًا على درجة البوكسيت ، يمثل 1-1 طن من أكسيد الألمنيوم الناتج من 0.6-1.0 طن من الطين الأحمر (بقايا جافة) ؛
4). تحلل ألومينات الحل. يتم ترشيحها وضخها في حاويات كبيرة مع خلاطات (أجهزة تحلل). عند التبريد عند 60 درجة مئوية (330 كلفن) والتحريك المستمر ، يتم استخراج هيدروكسيد الألومنيوم Al (OH) 3 من محلول فائق التشبع. نظرًا لأن هذه العملية تسير ببطء وبصورة غير متساوية ، كما أن تكوين ونمو بلورات هيدروكسيد الألومنيوم لهما أهمية كبيرة أثناء المعالجة الإضافية ، تتم إضافة كمية كبيرة من هيدروكسيد الصلب إلى أجهزة التحلل:
نا 2 O ּ آل 2 O 3 + 4H 2 O → سورة (OH) 3 + 2NaOH.
5). تخصيص هيدروكسيد الألومنيوم وتصنيفه ؛ يحدث هذا في الهيدروكلونات والفلاتر الفراغ ، حيث يتم عزل الراسب الذي يحتوي على 50-60٪ من جزيئات Al (OH) من محلول ألومينات. يتم إرجاع جزء كبير من هيدروكسيد إلى عملية التحلل كمادة البذور ، والتي لا تزال متداولة بكميات ثابتة. بقايا بعد الغسيل بالماء يذهب إلى تكلس. يتم أيضًا إعادة الترشيح إلى الدورة الدموية (بعد التركيز في المبخرات ، لإلقاء البوكسيت الجديد) ؛
6). الجفاف من هيدروكسيد الألومنيوم (تكليس) ؛ هذه هي عملية إنتاج الألومينا النهائية. يتم تنفيذها في الأفران الدوارة الأنبوبية ، وكذلك في الأفران ذات الحركة المضطربة للمادة عند درجة حرارة 1150-1300 درجة مئوية ؛ هيدروكسيد الألومنيوم الخام ، يمر عبر فرن دوار ، يتم تجفيفه وتجفيفه ؛ عند التسخين ، تحدث التحولات الهيكلية التالية بالتتابع:
| Al (OH) 3 → AlOOH → γ-Al 2 O 3 → α-Al 2 O 3 | |||
| 200 حول C– | 950 درجة | 1200 عن س. | |
في الألومينا المكلسة أخيرًا تحتوي على 30-50٪ α-Al 2 O 3 (اكسيد الالمونيوم) ، والباقي هو Al-Al 2 O 3.
تستخلص هذه الطريقة 85-87٪ من إجمالي الألومينا الناتج. الألومينا الناتجة عبارة عن مركب كيميائي قوي له نقطة انصهار 2050 حول C.
الحصول على الألومنيوم من أكسيدها
التحليل الكهربائي من الألومينا
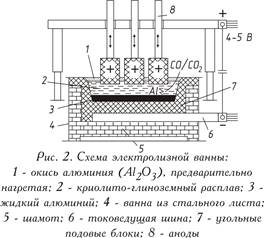 يتم إجراء التحليل الكهربي للألومينا المذاب في ذوبان يعتمد على الكريوليت على درجة حرارة 950-970 درجة مئوية في محلل كهربائي. تتكون الخلية من حمام مبطن بكتل كربونية ، يوجد في أسفله تيار كهربائي. يكون للألمونيوم السائل المترسبة في الجزء السفلي من الكاثود أثقل من ذوبان الملح بالكهرباء ، وبالتالي يتم جمعه على قاعدة الفحم ، حيث يتم ضخه بشكل دوري (الشكل 2). من الأعلى ، يتم غمر أنودات الكربون في المنحل بالكهرباء ، الذي يحترق في جو الأكسجين المنطلق من أكسيد الألومنيوم ، أو يطلق أول أكسيد الكربون (CO) أو ثاني أكسيد الكربون (CO 2). في الممارسة العملية ، يتم استخدام نوعين من الأنودات:
يتم إجراء التحليل الكهربي للألومينا المذاب في ذوبان يعتمد على الكريوليت على درجة حرارة 950-970 درجة مئوية في محلل كهربائي. تتكون الخلية من حمام مبطن بكتل كربونية ، يوجد في أسفله تيار كهربائي. يكون للألمونيوم السائل المترسبة في الجزء السفلي من الكاثود أثقل من ذوبان الملح بالكهرباء ، وبالتالي يتم جمعه على قاعدة الفحم ، حيث يتم ضخه بشكل دوري (الشكل 2). من الأعلى ، يتم غمر أنودات الكربون في المنحل بالكهرباء ، الذي يحترق في جو الأكسجين المنطلق من أكسيد الألومنيوم ، أو يطلق أول أكسيد الكربون (CO) أو ثاني أكسيد الكربون (CO 2). في الممارسة العملية ، يتم استخدام نوعين من الأنودات:
أ) الأنودات Zederberg الخبز الذاتي ، تتكون من قوالب ، ما يسمى "أرغفة" من كتلة Zederberg (الفحم منخفضة الرماد مع 25-35 ٪ من قطران قطران الفحم الفحم) محشوة في قذيفة الألومنيوم ؛ تحت تأثير ارتفاع درجة الحرارة ، يتم حرق كتلة الأنود (متكلس) ؛
ب) أنودات صلب أو "مستمر" من كتل الفحم الكبيرة (على سبيل المثال ، 1900 × 600 × 500 مم بوزن حوالي 1.1 طن).
القوة الحالية على المحولات الكهربائية هي 150،000 أ. وهي متصلة بالشبكة في سلسلة ، أي يتم الحصول على نظام (سلسلة) - سلسلة طويلة من المحولات الكهربائية.
يكون جهد التشغيل على الحمام ، والذي يتراوح من 4 إلى 5 فولت ، أعلى بكثير من الجهد الذي يحدث عنده تحلل أكسيد الألومنيوم ، نظرًا لأن فقد الجهد في أجزاء مختلفة من النظام أمر لا مفر منه أثناء التشغيل. يوضح الشكل التالي توازن المواد الخام والطاقة في إنتاج 1 طن من الألومنيوم. 3.
التحليل الكهربائي لكلوريد الألومنيوم (طريقة ألكوا)
 في وعاء التفاعل ، يتم تحويل الألومينا أولاً إلى كلوريد الألومنيوم. ثم ، في حمام كثيف معزول ، يذوب التحليل الكهربائي لـ AlCl 3 في الملح المنصهر من KCl ، يحدث كلوريد الصوديوم. يتم امتصاص الكلور المنطلق خلال هذه العملية وتزويده للاستخدام الثانوي ؛ يودع الألومنيوم في الكاثود.
في وعاء التفاعل ، يتم تحويل الألومينا أولاً إلى كلوريد الألومنيوم. ثم ، في حمام كثيف معزول ، يذوب التحليل الكهربائي لـ AlCl 3 في الملح المنصهر من KCl ، يحدث كلوريد الصوديوم. يتم امتصاص الكلور المنطلق خلال هذه العملية وتزويده للاستخدام الثانوي ؛ يودع الألومنيوم في الكاثود.
تتمثل مزايا هذه الطريقة في التحليل الكهربائي الحالي لصهر الكريوليت والألومينا السائل (Al 2 O 3 ، المذاب في كريوليت Na 3 AlF 6): توفير ما يصل إلى 30 ٪ من الطاقة ؛ إمكانية استخدام أكسيد الألومنيوم ، وهو غير مناسب للتحليل الكهربائي التقليدي (على سبيل المثال ، Al 2 O 3 مع نسبة عالية من السيليكون) ؛ استبدال الكريوليت الغالي بأملاح أرخص ؛ اختفاء خطر إطلاق الفلوريد.
الحد من كلوريد الألومنيوم مع المنغنيز (توث - طريقة)
 عندما يتم تقليل المنغنيز من كلوريد الألومنيوم ، يتم تحرير الألمنيوم. من خلال التكثيف المتحكم فيه ، يتم إطلاق الملوثات المتعلقة بالكلور من تيار كلوريد المنجنيز. عندما يتم إطلاق الكلور ، يتأكسد كلوريد المنجنيز إلى أكسيد المنجنيز ، والذي يتم بعد ذلك اختزاله إلى المنجنيز القابل لإعادة التدوير. المعلومات الموجودة في المنشورات الحالية غير دقيقة للغاية ، لذلك في هذه الحالة يجب عليك التخلي عن تقييم الطريقة.
عندما يتم تقليل المنغنيز من كلوريد الألومنيوم ، يتم تحرير الألمنيوم. من خلال التكثيف المتحكم فيه ، يتم إطلاق الملوثات المتعلقة بالكلور من تيار كلوريد المنجنيز. عندما يتم إطلاق الكلور ، يتأكسد كلوريد المنجنيز إلى أكسيد المنجنيز ، والذي يتم بعد ذلك اختزاله إلى المنجنيز القابل لإعادة التدوير. المعلومات الموجودة في المنشورات الحالية غير دقيقة للغاية ، لذلك في هذه الحالة يجب عليك التخلي عن تقييم الطريقة.
الحصول على الألومنيوم المكرر
بالنسبة للألمنيوم ، من غير الممكن تكرير التحليل الكهربي مع تحلل المحاليل الملحية المائية. نظرًا لأن درجة تنقية الألمنيوم الصناعي (Al 99.5 - Al 99.8) التي يتم الحصول عليها عن طريق التحليل الكهربي من ذوبان الكريوليت والألومينا غير كافية لبعض الأغراض ، يتم الحصول على الألومنيوم النقي أكثر (Al 99 ، 99 R) من الألمنيوم الصناعي أو النفايات المعدنية عن طريق التكرير. طريقة التكرير الأكثر شهرة هي التحليل الكهربائي ثلاثي الطبقات.
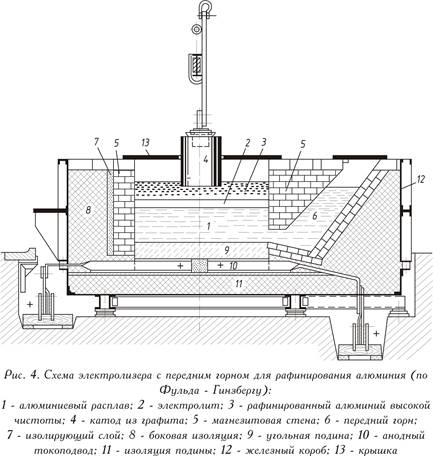
تكرير التحليل الكهربائي بثلاث طبقات
يتكون حمام التكرير ، المزين بطبقة من الصلب ، ويعمل عند التيار المباشر (كما هو موضح في الشكل 4 - انظر أعلاه) ، من موقد الفحم مع الخيوط الحالية وبطانة من المغنسيت العازلة للحرارة. على عكس التحليل الكهربائي للذوبان في الكريوليت والألومينا ، فإن المعدن المنصهر المكرر (طبقة الأنود السفلى) هو عادة الأنود هنا. يتكون المنحل بالكهرباء من فلوريد نقي أو خليط من كلوريد الباريوم وألومنيوم وفلورايد الصوديوم (الطبقة الوسطى). يتم تحرير ذوبان الألومنيوم من طبقة الأنود في المنحل بالكهرباء أعلى المنحل بالكهرباء (طبقة الكاثود العليا). يخدم المعدن النقي كاثود. يتم تزويد التيار إلى طبقة الكاثود بواسطة قطب كهربائي من الجرافيت.
يعمل الحمام عند 750-800 درجة مئوية ، واستهلاك الطاقة هو 20 كيلو واط في الساعة لكل كيلوغرام من الألمنيوم النقي ، أي أعلى قليلاً من التحليل الكهربائي التقليدي للألمنيوم.
معدن الأنود يحتوي على 25-35 ٪ النحاس. 7-12 ٪ زنك ؛ 6-9 ٪ سي ؛ ما يصل إلى 5 ٪ Fe وكمية صغيرة من المنغنيز والنيكل والرصاص والقصدير ، والباقي (40-55 ٪) من الألومنيوم. تبقى جميع المعادن الثقيلة والسليكون أثناء التكرير في طبقة الأنود. وجود المغنيسيوم في المنحل بالكهرباء يؤدي إلى تغييرات غير مرغوب فيها في تكوين المنحل بالكهرباء أو إلى الخبث القوي. لإزالة المغنيسيوم ، يتم التعامل مع الخبث المغنيسيوم المحتوي على تدفقات أو الكلور الغازي.
نتيجة للتكرير ، يتم الحصول على منتجات الألمنيوم النقي (99.99٪) ومنتجات العزل (منتج zager) ، والتي تحتوي على معادن ثقيلة وسليكون ويتم إطلاقها في صورة محلول قلوي وبقايا بلورية. المحلول القلوي مضيعة ، ويتم استخدام البقايا الصلبة لإزالة الأكسدة.
يحتوي الألومنيوم المكرر عادة على التكوين التالي ،٪: Fe 0.0005-0.002؛ Si 0.002-0.005؛ Cu 0.0005-0.002 ؛ Zn 0.0005-0.002 ؛ آثار ملغ. آل الباقي.
تتم معالجة الألومنيوم المكرر إلى منتج نصف نهائي في التكوين المحدد أو المخلوط مع المغنيسيوم (انظر الجدول 1.2.).
الجدول 1.2. التركيب الكيميائي للألمنيوم عالي النقاء والألمنيوم الأساسي وفقًا لـ DIN 1712 ، ورقة 1.
| علامة | عدد | الشوائب المسموح بها * ، ٪ | |||||||
| فقط | بما في ذلك | ||||||||
| سي | الحديد | منظمة الشفافية الدولية | النحاس | الزنك | آخر | ||||
| A199،99R | 3.0400 | 0,01 | 0,006 | 0,005 | 0,002 | 0,003 | 0,005 | 0,001 | |
| A199،9H | 3.0300 | 0,1 | 0,050 | 0,035 | 0,006 | 0,005 | 0,04 | 0,003 | |
| A199،8H | 3.0280 | 0,2 | 0,15 | 0,15 | 0,03 | 0,01 | 0,06 | 0,01 | |
| A199،7H | 3.0270 | 0,3 | 0,20 | 0,25 | 0,03 | 0,01 | 0,06 | 0,01 | |
| A199.5H ** | 3.0250 | 0,5 | 0,30 | 0,40 | 0,03 | 0,02 | 0,07 | 0,03 | |
| A199H | 3.0200 | 1,0 | 0,5 | 0,6 | 0,03 | 0,02 | 0,08 | 0,03 | |
* قدر الإمكان لتحديد طرق البحث التقليدية. ** يتم توفير الألومنيوم النقي للهندسة الكهربائية (الموصلات الألومنيوم) في شكل الألومنيوم الأولي 99.5 ، التي لا تحتوي على أكثر من 0.03 ٪ (Ti + Cr + V + Mn) ؛ الرمز في هذه الحالة بواسطة E-A1 ، رقم المادة 3.0256. خلاف ذلك ، يتوافق مع VDE-0202. |
|||||||||
التكرير بواسطة المركبات المعقدة المصنوعة من الألومنيوم العضوي وذوبان المنطقة
يمكن الحصول على الألومنيوم ذو درجة نقاوة أعلى من الدرجة A1 99.99 R عن طريق تكرير التحليل الكهربائي للألمنيوم النقي أو النقي تقنيًا باستخدام مركبات الألمنيوم العضوي المعقدة من الألومنيوم ككهارل. يحدث التحليل الكهربائي عند درجة حرارة تبلغ حوالي 1000 درجة مئوية بين أقطاب الألمنيوم الصلب ، ومن حيث المبدأ ، يشبه التحليل الكهربائي المكرر للنحاس. تملي طبيعة المنحل بالكهرباء الحاجة إلى العمل بدون هواء وبكثافة منخفضة منخفضة.
هذا النوع من التحليل الكهربائي للتكرير ، الذي يستخدم في البداية فقط على نطاق المختبر ، يتم تنفيذه بالفعل على نطاق إنتاج صغير - يتم إنتاج عدة أطنان من المعدن سنويًا. الدرجة الاسمية لتنقية المعدن الناتج هي 99.999-99.9999 ٪. التطبيقات المحتملة لمعدن من هذا النقاء هي الهندسة الكهربائية والإلكترونية المبردة.
من الممكن استخدام طريقة التكرير المدروسة في الطلاء الكهربائي.
يمكن الحصول على درجة نقاء أعلى - اسمياً حتى A1 99.99999 - عن طريق ذوبان المنطقة اللاحقة من المعدن. عند معالجة الألمنيوم عالي النقاء إلى منتج أو ورقة أو سلك نصف نهائي ، يجب اتخاذ احتياطات خاصة ، مع الأخذ في الاعتبار درجة الحرارة المنخفضة لإعادة بلورة المعدن. من الخصائص المميزة للمعدن المكرر هو الموصلية الكهربائية العالية في منطقة درجات الحرارة المبردة.
الحصول على الألومنيوم الثانوية
معالجة المواد الخام الثانوية ونفايات الإنتاج قابلة للحياة اقتصاديًا. تلبي السبائك الثانوية الناتجة حوالي 25٪ من إجمالي الطلب على الألمنيوم.
 أهم مجال لتطبيق السبائك الثانوية هو إنتاج سبائك الألومنيوم. في DIN 1725 ، الورقة 2 ، إلى جانب الدرجات القياسية للسبائك ، يتم تقديم العديد من الدرجات السبائكية التي تنتجها المسابك. تحتوي قائمة السبائك التي تنتجها هذه النباتات ، بالإضافة إلى بعض السبائك غير القياسية.
أهم مجال لتطبيق السبائك الثانوية هو إنتاج سبائك الألومنيوم. في DIN 1725 ، الورقة 2 ، إلى جانب الدرجات القياسية للسبائك ، يتم تقديم العديد من الدرجات السبائكية التي تنتجها المسابك. تحتوي قائمة السبائك التي تنتجها هذه النباتات ، بالإضافة إلى بعض السبائك غير القياسية.
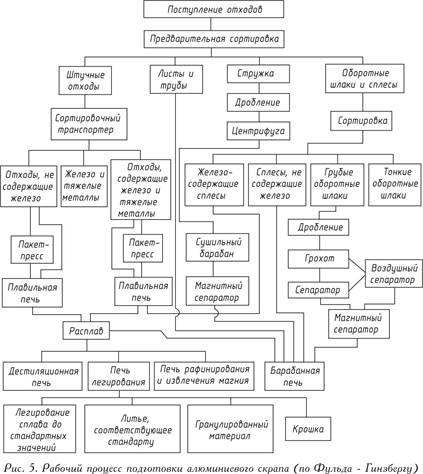
لا يمكن إجراء تحضير خردة الألومنيوم الخالي من العيوب بمجموعة واسعة من النسب إلا في مصاهر مجهزة خصيصًا. وترد فكرة سير العمل المعقد في مثل هذا النبات في الشكل. 5.
يتم صهر النفايات بعد فرزها تقريبيًا. يبقى الحديد أو النيكل أو النحاس الموجود في هذه النفايات ، والتي تكون نقطة انصهارها أعلى من نقطة انصهار الألومنيوم ، داخله أثناء الصهر في فرن عتبة الصهر ، ويتم صهر الألومنيوم. لإزالة الدرجات غير المعدنية من النفايات مثل الأكاسيد أو النيتريدات أو الكربيدات أو الغازات ، تتم معالجة المعدن المنصهر بالأملاح أو (وهو أكثر عقلانية) يتم تفجير الغاز بالكلور أو النيتروجين.
تُعرف الطرق المختلفة لإزالة الشوائب المعدنية من الذوبان ، على سبيل المثال ، إضافة المغنيسيوم والإخلاء - طريقة بيكش ؛ مضافات الزنك أو الزئبق تليها الإخلاء - طريقة subhalogen. تقتصر إزالة المغنيسيوم على إدخال الكلور في المعدن المنصهر. من خلال تقديم إضافات محددة بدقة من خلال تكوين الذوبان ، يتم الحصول على سبيكة مسبقة التحديد.
إنتاج الألومنيوم الصف الصناعي
طريقة التحليل الكهربائي هي الطريقة الوحيدة المستخدمة في جميع أنحاء العالم لإنتاج الألمنيوم المعدني ذي النقاء التقني. تم تطوير جميع الطرق الأخرى (الزنك الحرارية ، الكاربوثيرال ، كلورايد ، نيتريد ، وما إلى ذلك) ، والتي يمكن استخراج الألمنيوم من خامات الألومنيوم ، على نطاق المختبر والتجريبية ، ولكن لم يتم العثور على التطبيق العملي بعد.
للحصول على سبائك الألومنيوم والسليكون ، تم بنجاح استخدام الطريقة الكهروحرارية ، التي تم تطويرها وتنفيذها أولاً على نطاق صناعي في الاتحاد السوفيتي. يتكون من مرحلتين: في المرحلة الأولى ، يتم الحصول على سبيكة أولية من السليكون مع محتوى 60-63٪ Al من خلال الاختزال المباشر لخامات السليكون والألمنيوم في الأفران الكهربائية الحرارية الخام ؛ في المرحلة الثانية ، يتم تخفيف السبائك الرئيسية بالألمنيوم التقني ، للحصول على السيليكون وغيرها من سبائك الألمنيوم المطاوع والسليكون. الدراسات جارية لاستخراج الألومنيوم الصف الفني من السبائك الأولية.
بشكل عام ، يشمل إنتاج الألومنيوم بالطريقة الإلكتروليتية إنتاج الألومينا (أكسيد الألومنيوم) من خامات الألمنيوم ، وإنتاج أملاح الفلوريد (الكريوليت ، فلوريد الألومنيوم ، فلوريد الصوديوم) ، إنتاج كتلة أنود الكربون ، كتل أنود الكربون المكلس وكاثود ومواد بطانة أخرى ، الإنتاج الفعلي للإلكتروليت من الألومنيوم ، وهو المرحلة الأخيرة من تعدين الألمنيوم الحديث.
من الخصائص المميزة لإنتاج الألومينا وأملاح الفلوريد ومنتجات الكربون ضرورة الحصول على أقصى درجة من نقاوة هذه المواد ، نظرًا لأن ذوبان الكريوليت والألومينا الذي يخضع للتحليل الكهربائي يجب ألا يحتوي على شوائب لعناصر أكثر حساسية من الألومنيوم ، والتي ، إذا انبعثت في الكاثود أولاً ، من شأنها أن تلوث المعدن.
في درجات الألومينا G-00 و G-0 و G-1 ، والتي تستخدم بشكل رئيسي في التحليل الكهربائي ، فإن محتوى SiO 2 هو 0.02-0.05 ٪ ، aFe 2 O 3 - 0.03-0.05 ٪. في المتوسط \u200b\u200b، يحتوي الكريوليت على 0.36-0.38٪ SiO 2 و 0.05-0.06٪ Fe 2 O 3 ، وفلوريد الألومنيوم 0.30-0.35٪ (SiO 2 + Fe 2 O 3). لا تحتوي كتلة الأنود على أكثر من 0.25٪ SiO 2 و 0.20٪ Fe 2 O 3.
أهم خام الألومنيوم الذي يتم منه استخراج الألومينا ، البوكسيت. في البوكسيت ، الألومنيوم موجود في شكل هيدروكسيد الألومنيوم. في الاتحاد السوفياتي ، بالإضافة إلى البوكسيت ، يتم استخدام الصوديوم الكلوي الصوديوم والبوتاسيوم ألومينوسيليكات ، وكذلك صخور الألونايت ، حيث يكون الألومنيوم على شكل كبريتات ، لإنتاج الألومينا. المواد الخام لصناعة كتل الأنود وكتل الأنود المكلسة هي مواد كربونية نقية - فحم الكوك أو البترول وقار قطران الفحم كملصق ، وفلوريد الكالسيوم (الفلورسبار) لإنتاج كريوليت وأملاح الفلورايد الأخرى.
أثناء إنتاج الإلكتروليت من الألومنيوم ، تتحلل الألومينا Al 2 O 3 المذاب في كريوليت مصهور Na 3 AlF 6 إلكتروكيميائياً بتفريغ كاتيونات الألومنيوم في الكاثود (الألومنيوم السائل) والأيونات المحتوية على الأكسجين (أيونات الأكسجين) في أنود الكربون.
وفقًا للمفاهيم الحديثة ، ينفصل الكريوليت في الحالة المنصهرة إلى أيونات و: و الألومينا إلى أيونات معقدة و: ![]() التي هي في حالة توازن مع أيونات بسيطة:
التي هي في حالة توازن مع أيونات بسيطة: ![]() ,
, ![]() .
.
العملية الرئيسية التي تحدث في الكاثود هي الحد من أيونات الألومنيوم الثلاثية: Al 3+ + 3 البريد → آل (الأول).
جنبا إلى جنب مع العملية الرئيسية ، من الممكن تصريف غير كامل لأيونات الألمنيوم ثلاثي التكافؤ مع تشكيل أيونات أحادية التكافؤ: Al 3+ + 2 البريد → Al + (II) ، وأخيراً ، تصريف الأيونات الأحادية التكافؤ مع إطلاق المعدن: Al + + البريد → آل (الثالث).
في ظل ظروف معينة (تركيز عالٍ من أيونات Na + ، ارتفاع في درجة الحرارة ، وما إلى ذلك) ، يمكن أن يحدث تصريف لأيونات الصوديوم مع إطلاق المعدن: Na + + البريد → نا (الرابع). تتسبب تفاعلات (II) و (IV) في انخفاض في الإنتاج الحالي من الألومنيوم.
يتم تفريغ أيونات الأكسجين في أنود الكربون: 2O 2-4 البريد → يا 2. ومع ذلك ، لا يتم إطلاق الأكسجين في شكله الحر ، لأنه يتأكسد كربون الأنود لتشكيل خليط من ثاني أكسيد الكربون وثاني أكسيد الكربون.
يمكن تمثيل التفاعل الكلي الذي يحدث في المحلول الكهربائي بالمعادلة Al 2 O 3 + س C ↔ 2Al + (2 س –3) CO + (3– س) ثاني أكسيد الكربون.
يشمل تكوين المنحل بالكهرباء لخلايا التحليل الكهربائي للألمنيوم الصناعية ، بالإضافة إلى المكونات الرئيسية - الكريوليت ، فلوريد الألومنيوم والألومينا ، كميات صغيرة (تصل إلى 8-9 ٪) من بعض الأملاح الأخرى - CaF 2 ، MgF 2 ، NaCl و LiF (إضافات) ، والتي تعمل على تحسين بعض الخصائص الفيزيائية للالكهارل وبالتالي زيادة كفاءة الخلايا كهربائيا. الحد الأقصى لمحتوى الألومينا في المنحل بالكهرباء عادة ما يكون 6-8 ٪ ، يتناقص أثناء التحليل الكهربائي. نظرًا لأن المنحل بالكهرباء ينضب من الألومينا ، يتم إدخال جزء آخر من الألومينا فيه. للتشغيل العادي لمحلل الألمنيوم الكهربائي ، يتم الحفاظ على نسبة NaF: AlF 3 في المنحل بالكهرباء في حدود 2،7-2،8 ، إضافة أجزاء من الكريوليت وفلوريد الألومنيوم.
في إنتاج الألمنيوم ، يتم استخدام المحولات الكهربائية ذات الأنودات الكربونية ذاتية النيران وإمدادات التيار العلوي أو العلوي ، وكذلك المحولات الكهربائية ذات الأنودات الكربونية التي تم إطلاقها مسبقًا. التصميم الأكثر وعدًا للمحلل الكهربي مع الأنودات المخبوزة ، والذي يسمح بزيادة طاقة الوحدة للوحدة ، وخفض استهلاك الكهرباء المباشر الحالي المحدد للتحليل الكهربائي ، والحصول على معدن أنظف ، وتحسين ظروف العمل الصحية والنظافة وتقليل انبعاثات المواد الضارة في الجو.
وترد في الجدول المعلمات التقنية الرئيسية ومؤشرات الأداء من المحولات الكهربائية الألومنيوم من أنواع مختلفة. 1.3.
الجدول 1.3
المعلمات الفنية الأساسية ومؤشرات عمل كهربائيات الألمنيوم
| المعلمات والمؤشرات | مع الأنودات الخبز الذاتي | مع الأنودات المحترقة | |
جانبي العرض الحالي |
الرصاص الحالي أعلى | ||
| القوة الحالية ، كا | 60-120 | 60-155 | 160-255 |
| الإنتاجية اليومية للالكهربائي ، ر | 0,42-0,85 | 0,40-1,10 | 1,10-1,74 |
| كثافة تيار الأنود ، A / سم 2 | 0,80-0,90 | 0,65-0,70 | 0,70-0,89 |
| متوسط \u200b\u200bالجهد على الخلية ، الخامس | 4,45-4,65 | 4,50-4,70 | 4,30-4,50 |
| الانتاج الحالي ، ٪ | 85-88 | 84-86 | 85-89 |
| نسب الاستهلاك لكل 1 طن من الألومنيوم: | |||
| السلطة DC، كيلوواط ساعة ּ | 15100-16200 | 15500-17300 | 14500-15500 |
| الألومينا ، كجم | 1920-1940 | 1920-1940 | 1920-1940 |
| كتلة الأنود ، كجم | 520-560 | 560-620 | - |
| الأنودات المحترقة ، كجم | - | - | 540-600 |
| أملاح الفلوريد من حيث الفلور ، كجم | 20-30 | 25-35 | 15-25 |
يحتوي الألومنيوم الأولي المستخلص من الخلايا كهربائيا (الألومنيوم الخام) على عدد من الشوائب التي يمكن تقسيمها إلى ثلاث مجموعات: غير المعدنية (أملاح الفلورايد ، α- و γ-الألومينا ، كربيد الألومنيوم ونتريد ، جزيئات الفحم المحتبسة ميكانيكيا أثناء صب المعادن من المحلل الكهربائي) ؛ المعدن (الحديد والسيليكون) الذي يمر من المواد الخام ومواد الفحم والعناصر الهيكلية للمحلل الكهربائي ؛ الغازية - أساسًا الهيدروجين ، الذي يتكون في المعدن نتيجة التحلل الكهربائي للماء الذي يدخل بالكهرباء بالمواد الخام.
من الشوائب المعدنية ، بالإضافة إلى الحديد والسليكون ، توجد أكبر كمية من الغاليوم والزنك والتيتانيوم والمنغنيز والصوديوم والفاناديوم والكروم والنحاس. ويرد أدناه محتوى هذه العناصر وبعض العناصر النزرة المعدنية الأخرى في الألومنيوم كهربائيا ، ٪:
والمصدر الرئيسي للشوائب المعدنية في الألمنيوم هو الألومينا ، التي قد تحتوي على الغاليوم والزنك والبوتاسيوم والفوسفور والكبريت والفاناديوم والتيتانيوم والكروم حسب نوع المادة الوسيطة. تعمل المواد الكربونية (كتلة الأنود ، الأنودات المكلسة ، منتجات الكاثود) كمصدر للأحياء الدقيقة مثل الفاناديوم والتيتانيوم والمنغنيز والزنك على سبيل المثال.
عن طريق التحليل الكهربائي للذوبان في الكريوليت والألومينا ، شريطة أن يتم استخدام المواد الخام النقية (في المقام الأول الألومينا والمواد الكربونية) ، يمكن الحصول على الألومنيوم الخام من الدرجات A85 و A8 (99.85 و 99.80 ٪). يتم الحصول على أكبر حصة من المعدن من هذه الدرجات (60-70 ٪ من إجمالي الناتج) على المحلل الكهربائي مع الأنودات المخبوزة ، وكذلك على المحاليل الكهربائية مع العرض الحالي الجانبية (ما يصل إلى 70 ٪ من إجمالي الإنتاج). في أجهزة التحليل الكهربي التي تحتوي على أنودات الخبز الذاتي ورصاص التيار العلوي ، يكون إنتاج الألومنيوم A8 من الدرجة الخام منخفضًا (1-3٪) ، ولا يمكن الحصول على المعدن A85 بسبب شوائب كبيرة من الحديد الذي يدخل الألومنيوم من مصادر غير أولية (دبابيس الأنود ومقاطع الحديد المصبوب من مجمعات الغاز. ، والأداة التكنولوجية ، والتجمع الكاثود).
يدخل الألمنيوم الأولي المنصهر ، المستخرج من المحولات الكهربائية باستخدام مغرفة فراغية ، إلى مقصورة المسابك للتكرير من الشوائب غير المعدنية والغازات وللمزيد من المعالجة في المنتجات التجارية (سبائك ، سبيكة أسطوانية ومسطحة ، قضيب سلكي ، إلخ). قبل الصب ، يتم الاحتفاظ بالألمنيوم الخام في حالة منصهرة في أفران المقاومة الكهربائية (الخلاطات) أو في أفران عاكسة للغاز. في هذه الأفران ، لا يتم فقط إجراء عمليات تجميع عقلانية لدفاعات من الألمنيوم السائل بمختلف التركيبات ، ولكن يتم تنظيفها جزئيًا أيضًا من مواد غير معدنية وأفلام أكسيد الصوديوم.
يسكب الألومنيوم من الخلاط إلى سبائك باستخدام آلات الصب من نوع الناقل. يتم تصنيع سبائك أسطوانية ومسطحة من خلال طريقة الصب شبه المستمر ، وللحصول على قضيب السلك ، يتم استخدام وحدات الصب والدرفلة المدمجة.
في مصاهر الألمنيوم المحلية ، عند صب السبائك ، يتعرض الألومنيوم القادم من الخلاط إلى قالب ماكينة الصب لأبسط أشكال التكرير - تصفية المصهور من خلال الألياف الزجاجية بأحجام شبكية من 0.6 × 0.6 إلى 1.7 × 1.7 مم. تسمح لك هذه الطريقة بتنظيف الألمنيوم فقط من شوائب أكسيد خشن جدًا ؛ طريقة أكثر مثالية لتصفية الذوبان من خلال الألياف الزجاجية في المنبع. مع طريقة الترشيح هذه ، لا يتم التقاط جزيئات شوائب الأكسيد ، التي تصطدم بالشبكة ، بواسطة تدفق الذوبان ، ولكن يتم ترسبها في قاع حوض الصب.
للتنقية المتزامنة للألمنيوم ، سواء من الشوائب غير المعدنية أو من الهيدروجين ، يتم استخدام طريقة الترشيح من خلال مرشح التدفق في تركيبة مع تطهير النيتروجين. كما تدفق ، يمكنك استخدام المنحل بالكهرباء الحمضية من خلايا التحليل الكهربائي الألومنيوم. نتيجة لهذا التنظيف ، يتم تقليل محتوى الهيدروجين في الألومنيوم من 0.22 إلى 0.16 سم 3 لكل 100 غرام من المعدن.
في الألومنيوم الأولي المستخدم لإنتاج سبائك Al-Mg ، يجب ألا يتجاوز محتوى الصوديوم 0.001٪. ويرجع ذلك إلى حقيقة أن وجود الصوديوم في هذه السبائك يضعف الخواص الميكانيكية وغيرها من الخصائص التشغيلية للمنتجات المستخدمة في عدد من قطاعات الاقتصاد الوطني.
تتمثل الطريقة الأكثر فعالية لتكرير الألمنيوم من الشوائب الصوديوم والهيدروجينية وغير المعدنية في نفس الوقت في تطهير المعدن المنصهر بمزيج غاز من النيتروجين مع 2-10٪ من الكلور ، يتم إدخاله في الذوبان في صورة فقاعات صغيرة باستخدام أجهزة خاصة. تسمح طريقة التكرير هذه بتقليل محتوى الصوديوم في الألومنيوم إلى 0.0003-0.001٪ مع تدفق خليط الغاز من 0.8 إلى 1.5 متر مكعب / طن من المعدن.
استهلاك الكهرباء لإنتاج 1 طن من الألومنيوم القابل للبيع من المعدن الخام عند استخدام الأفران الكهربائية هو 150-200 كيلو واط ساعة ؛ تساوي خسائر المعادن التي لا يمكن استرجاعها في المسبك ما بين 1.5 إلى 5٪ حسب نوع المنتجات القابلة للتسويق.
الحصول على الألمنيوم عالي النقاء
للحصول على الألومنيوم عالي النقاء (الصفوف A995-A95) ، يتم تكرير الألومنيوم الأساسي للنقاء التقني إلكترونياً. هذا يسمح لتقليل محتوى الشوائب المعدنية والغازات في الألومنيوم وبالتالي زيادة كبيرة في التوصيل الكهربائي ، ليونة ، الانعكاسية ومقاومة التآكل.
تتم عملية التحليل الكهربائي للألمنيوم عن طريق التحليل الكهربائي للأملاح المنصهرة بطريقة ثلاثية الطبقات. جوهر الأسلوب هو على النحو التالي. في خلية التكرير هناك ثلاث طبقات منصهرة. أقل ، أثقل ، تقع على الموقد موصل ويكون بمثابة الأنود. تُسمى سبائك الأنود وهي سبيكة من الألومنيوم المكرر بالنحاس ، والتي يتم تقديمها لجعل الطبقة أثقل. الطبقة الوسطى هي المنحل بالكهرباء. تكون كثافته أقل من كثافة سبيكة الأنود وأعلى من كثافة الألمنيوم النقي المكرر (الكاثود) الموجود فوق المنحل بالكهرباء (الطبقة العليا الثالثة السائلة).
أثناء انحلال انوديك ، تكون جميع الشوائب أكثر حساسية من الألومنيوم (Fe ، Si ، Ti ، Cu ، وما إلى ذلك) وتبقى في سبيكة أنوديك دون المرور إلى المنحل بالكهرباء. سوف يذوب الألمنيوم وحده ، والذي ينتقل في شكل أيونات Al + 3 إلى المنحل بالكهرباء: Al– 3 البريد → آل 3+.
أثناء التحليل الكهربائي ، يتم نقل أيونات الألومنيوم إلى الكاثود ، حيث يتم تصريفها: Al 3+ + 3 البريد → آل. نتيجة لذلك ، تتراكم طبقة من الألومنيوم المكرر المنصهر في الكاثود.
إذا كانت الشوائب التي تكون أكثر كهربيًا من الألمنيوم (على سبيل المثال ، Ba، Na، Mg، Ca) موجودة في سبيكة الأنود ، فيمكن أن تذوب كهربائياً مع الألومنيوم على الأنود وتنتقل إلى المنحل بالكهرباء في شكل أيونات. نظرًا لأن محتوى الشوائب الكهربية في الألومنيوم الخام صغير ، فإنها لا تتراكم بكمية ملحوظة في المنحل بالكهرباء. لا يحدث تصريف هذه الأيونات في الكاثود عمليا ، حيث أن إمكاناتها من الإلكترود تكون سالبة للكهرباء من الألمنيوم.
بما أنه المنحل بالكهرباء في تكرير الألمنيوم كهربائيا في الاتحاد السوفيتي وفي معظم البلدان ، يتم استخدام إلكتروليت كلوريد الفلوريد ، الذي يتكون من 55-60 ٪ من BaCl 2 ، 35-40 ٪ AlF 4 + NaF و 0-4 ٪ NaCl. نسبة المولي من NaF: AlF 3 support 1.5-2.0؛ نقطة انصهار بالكهرباء 720-730 درجة مئوية ؛ درجة حرارة عملية التحليل الكهربائي حوالي 800 درجة مئوية ؛ كثافة المنحل بالكهرباء 2.7 غرام / سم 3.
يتم تحضير سبيكة الأنود من الألومنيوم والنحاس النقي (99.90-99.95 ٪ من النحاس) ، والذي يتم إدخاله في المعدن بنسبة 30-40 ٪. كثافة سبائك الأنود السائل من هذا التكوين هي 3-3.5 جم / سم 3 ؛ كثافة الألمنيوم الكاثودي المنصهر النقي هي 2.3 جم / سم 3. مع هذه النسبة من الكثافات ، يتم إنشاء الشروط اللازمة لفصل جيد بين الطبقات المنصهرة الثلاثة.
في نظام Al-Cu-Fe-Si الرباعي ، الذي تنتمي إليه سبيكة الأنود ، يتم تشكيل سهل الانصهار بنقطة انصهار تبلغ 520 درجة مئوية. تبريد سبيكة الأنود التي تحتوي على شوائب من الحديد والسيليكون بكميات أعلى من تركيزات سهلة الانصهار ، فمن الممكن فصل الحديد والسليكون في الطور الصلب في شكل مركبات intermetallic FeSiAl 5 و Cu 2 FeAl 7. نظرًا لأن درجة حرارة سبيكة الأنود في جيوب المحلل الكهربائي تقل بمقدار 30-40 درجة مئوية عن درجة حرارة سبيكة الأنود في مساحة العمل في الحمام ، سيتم إطلاق هطول الأمطار الصلب بين هذه المعادن (حيث يتراكم الحديد والسيليكون في سبيكة الأنود). يقوموا بشكل دوري بإزالة هذه الرواسب ، ويقومون بتنظيف سبيكة الأنود (دون تحديثها) من شوائب الحديد والسيليكون. نظرًا لأن الغاليوم يتركز في سبيكة الأنود ، فإن الرواسب المستخرجة من المحلل الكهربائي (30-40 كجم لكل 1 طن من الألومنيوم) يمكن أن تكون مصدرًا لهذا المعدن.
بالنسبة للتكرير الكهربائي ، يتم استخدام المحولات الكهربائية ، والتي تشبه في التحليل الكهربائي مع الأنودات المخبوزة لإنتاج التحليل الكهربائي للألمنيوم الأولي ، ولكن لها اتصال قطب مختلف: يعمل الموقد كأنود ، والصف العلوي من الأقطاب الكهربائية كالكاثود. صممت المحولات الكهربائية الحديثة لتكرير الألمنيوم كهربائيا للتيارات التي تصل إلى 75 كيلو أمبير.
فيما يلي أهم المؤشرات الفنية والاقتصادية لمحولات التحليل الكهربائي لعام 1979 التي حققتها المؤسسات المحلية (1 ، 2 ، 3).
كفاءة التيار الكهروكيميائي المحسوبة بواسطة المعدن المصبوبة من المحلل الكهربائي هي 97-98٪. الكفاءة الحالية الفعلية ، وتحسب من كمية المعادن القابلة للبيع ، هي 92-96 ٪.
| القوة الحالية ، كا | 23,5 | 62,9 | 69,8* |
| متوسط \u200b\u200bالجهد ، الخامس | 5,43 | 5,68 | 5,69 |
| الانتاج الحالي ، ٪ | 95,7 | 93,0 | 92,7 |
| العاصمة استهلاك الطاقة ، كيلوواط ּ ح / ر | 17 370 | 18 700 | 19 830 |
| إجمالي الكهرباء AC ، كيلوواط ּ ح / ر | 18 670 | 19 590 | 20 780 |
| المستويات ، سم | |||
| الألومنيوم الكاثود | 16,6 | 12,9 | 14,6 |
| المنحل بالكهرباء | 13,3 | 11,6 | 14,2 |
| سبائك الأنود | 40,1 | 29,5 | 30,0 |
| نسب الاستهلاك ، كجم / طن: | |||
| كلوريد الباريوم | 40,5 | 41,5 | 27,0 |
| الكرايوليت بعلم المعادن | 27,7 | 21,0 | 16,5 |
| فلوريد الألومنيوم | 6,7 | 13,1 | 3,8 |
| كلوريد الصوديوم | 1,0 | 4,8 | - |
| الألومنيوم الخام | 1020 | 1028 | 1032 |
| الجرافيت | 11,9 | 11,5 | 16,6 |
| نحاس | 9,8 | 15,5 | 16,4 |
| إنتاج الألمنيوم عالي النقاء ،٪ الدرجات: | |||
| A995 | 47,8** | 3,5 | 2,1 |
| A99 | 30,4 | 67,1 | 54,2 |
| A97 | 8,3 | 21,5 | 43,7 |
| A95 | 10,4 | 7,9 | - |
| أدناه A95 | 3,1 | - | - |
* ارتفاع معدلات إنتاج الألومنيوم النقاء. ** الصف للالكهربائي دون التوسع. |
|||
إن العامل الرئيسي الذي يحد من كفاءة التيار ، بالإضافة إلى خسائر التيار المباشر في تصريف أيونات أكثر إلكترونيا ، وفقدان المعادن بسبب أكسدة الألمنيوم وفقدانه الميكانيكي ، هو تشغيل المحلل الكهربائي مع إطلاق المعدن غير المصنف ، والذي يعود مرة أخرى إلى سبيكة الأنود لإعادة التكرير لاحقًا. تحدث فترات تشغيل هذه الخلايا أثناء بدء تشغيل الخلايا وانتهاكات النظام التكنولوجي.
تكرير الألمنيوم كهربائيا هو إنتاج كثيفة الاستخدام للطاقة. يتراوح استهلاك الطاقة الكهربائية في التيار المتناوب ، بما في ذلك الطاقة التي يتم إنفاقها في إعداد المنحل بالكهرباء وسبائك الأنود ، وتشغيل أجهزة التهوية والمركبات ، بالإضافة إلى فقدان تحويل التيار المتناوب إلى تيار مباشر ، ما بين 18.5 و 21.0 ألف كيلووات في الساعة لكل طن من الألومنيوم. لا تتجاوز كفاءة استخدام الطاقة لتكرير المحولات الكهربائية 5-7 ٪ ، أي يتم استهلاك 93-95 ٪ من الطاقة في شكل فقدان الحرارة المتولدة بشكل رئيسي في طبقة المنحل بالكهرباء (حوالي 80-85 ٪ من إجمالي مدخلات الحرارة). لذلك ، فإن الطرق الرئيسية لزيادة تقليل استهلاك الطاقة المحددة للتكرير الكهربائي للألمنيوم هي تحسين العزل الحراري للمحلل الكهربي (وخاصة الجزء العلوي من الهيكل) وتقليل طبقة الإلكتروليت (تقليل مسافة القطب الكهربائي).
نقاء الألومنيوم ، المكرر وفقا لطريقة ثلاث طبقات ، 99.995 ٪ ؛ يتم تحديده من خلال الفرق مع خمسة شوائب رئيسية - الحديد والسليكون والنحاس والزنك والتيتانيوم. يمكن أن تكون كمية المعادن المنتجة من هذه العلامة التجارية 45-48 ٪ من إجمالي الإنتاج (دون التوسع مع درجات أقل).
ومع ذلك ، تجدر الإشارة إلى أنه في الألومنيوم المكرر كهربائيا ، يتم احتواء شوائب المعادن الأخرى بكميات أصغر ، مما يقلل من النقاء المطلق لمثل هذا الألومنيوم. تحليل Radioactivation يسمح للكشف الألومنيوم المكرر الكهربائي و 30 الشوائب، والمحتوى الكلي منها حوالي 60٪ ּ 10 -4. لذلك ، فإن نقاء الألمنيوم المكرر في الاختلاف مع هذه الشوائب هو 99.994 ٪.
بالإضافة إلى الشوائب التي توفرها GOST (انظر الجدول 1.1) ، تحتوي الدرجة الأكثر شيوعًا (A99) على الألومنيوم المكرر كهربائيا ،٪: Cr 0.00016؛ V 0.0001 ؛ Ga 0.0006؛ Pb 0.002 ؛ Sn 0.00005 ؛ Ca 0.002-0.003 ؛ Na 0.001-0.008 ؛ مليون 0،01-0،007 ؛ Mg 0.001-0.007 ؛ كما<0,0001; Sb<0,00002; Bi<0,00001; Cd<0,000001; S 0,0007.
أحد مصادر تلوث الألومنيوم بالكاثود هو الجرافيت أسفل الموصلات التي تحتوي على أكسيد الحديد والسليكون وعلى اتصال دائم مع الألومنيوم المكرر. إذا تم تغذية التيار مباشرة إلى الألومنيوم الكاثود مع قضبان الألومنيوم واستخدمت أداة الجرافيت نقية جدا ، فمن الممكن الحصول على المعدن مع نقاء 99.999 ٪ بالاختلاف مع الشوائب المحددة (Fe ، Si ، Cu ، Zn و Ti). يحتوي هذا المعدن على متوسط \u200b\u200b،٪: Si 0،0002؛ Fe 0،00032؛ Cu 0،0002؛ Zn 0.0002 و Ti 0.00005. ومع ذلك ، بسبب الصعوبات التقنية ، لم تجد طريقة إمداد التيار هذا تطبيقًا صناعيًا واسع النطاق.
إنتاج الألومنيوم عالية النقاء
يمكن الحصول على ألومنيوم عالي النقاء (درجة A999) بثلاث طرق: ذوبان المنطقة ، والتقطير من خلال subhalides والتحليل الكهربائي لمركبات الألومنيوم العضوية. من الطرق المذكورة أعلاه لإنتاج الألمنيوم عالي النقاء ، تم الحصول على طريقة عملية لصهر المنطقة في الاتحاد السوفيتي.
مبدأ ذوبان المنطقة هو المرور المتعدد للمنطقة المنصهرة على طول سبيكة الألومنيوم. حسب قيمة معاملات التوزيع ك \u003d ج التلفزيون / ق ث (أين C التلفزيون هو تركيز الشوائب في الصلبة و C ز - في المرحلة السائلة) ، التي تحدد إلى حد كبير فعالية التطهير من الشوائب ، يمكن تقسيم هذه الشوائب إلى ثلاث مجموعات. تتضمن المجموعة الأولى الشوائب التي تقلل من درجة انصهار الألومنيوم ؛ K<1 أثناء ذوبان المنطقة ، تتركز في المنطقة المنصهرة ويتم نقلها بواسطتها إلى الجزء الأخير من السبائك. وتشمل هذه الشوائب Ga و Sn و Be و Sb و Ca و Th و Fe و Co و Ni و Ce و Te و Ba و Pt و Au و Bi و Pb و Cd و In و Na و Mg و Cu و Si و Ge ، الزنك. المجموعة الثانية تشمل الشوائب التي تزيد من نقطة انصهار الألومنيوم. أنها تتميز ك\u003e 1 وخلال ذوبان المنطقة ، تتركز في الجزء الصلب (الأولي) من السبائك. تتضمن هذه الشوائب Nb و Ta و Cr و Ti و Mo و V. أما المجموعة الثالثة فتحتوي على شوائب لها معامل توزيع قريب جدًا من الوحدة (Mn، Sc). عمليا لا تتم إزالة هذه الشوائب أثناء ذوبان المنطقة من الألمنيوم.
يتعرض الألومنيوم المخصص لصهر المنطقة إلى بعض التحضير ، والذي يتكون في التصفية وإزالة الغازات والنقش. الترشيح ضروري لإزالة من أكسيد الألمنيوم المقاوم للحرارة والمشتت في المعدن من الألومنيوم. يمكن لأكسيد الألومنيوم الموجود في الألومنيوم المصهور ، عندما يصلب ، إنشاء مراكز تبلور ، الأمر الذي يؤدي إلى تشكيل سبيكة بلورية وانتهاك لإعادة توزيع الشوائب بين المعدن الصلب والمنطقة المنصهرة. يتم ترشيح الألومنيوم في الفراغ (الضغط المتبقي 0.1-0.4 باسكال) من خلال فتحة في الجزء السفلي من بوتقة الجرافيت بقطر 1.5-2 ملم. يتم إجراء عملية إزالة أولية للألمنيوم قبل ذوبان المنطقة (تسخين أيضًا في فراغ) لمنع رش المعادن أثناء ذوبان المنطقة في حالة وجود عملية في فراغ عالي. تتمثل المرحلة الأخيرة من تحضير الألومنيوم لصهر المنطقة في حفر سطحه بمزيج من الأحماض الهيدروكلوريك والنتريك المركز.
نظرًا لأن للألومنيوم نشاطًا كيميائيًا كبيرًا ، ولا سيما الجرافيت النقي يستخدم كمواد رئيسية للحاويات (القوارب) ، فإن ذوبان المنطقة من الألومنيوم يتم تنفيذه في فراغ أو في جو غاز خامل (الأرجون والهيليوم).
يضمن ذوبان المنطقة في فراغ درجة نقاء عالية من الألومنيوم بسبب تطاير بعض الشوائب أثناء الفراغ (المغنيسيوم والزنك والكادميوم والقلويات والمعادن القلوية) ، وأيضًا تلوث المعدن المنقى بالشوائب نتيجة لاستخدام الغازات الخاملة الواقية. يمكن أن يتم ذوبان المنطقة من الألومنيوم في فراغ أثناء الضخ المستمر لأنبوب الكوارتز ، حيث يتم وضع قارب من الجرافيت مع سبيكة ألمنيوم ، وكذلك في أمبولات كوارتز محكمة الغلق ، يتم ضخ الهواء منها مبدئيًا إلى ضغط متبقٍ حوالي 1–10 باسكال.
لإنشاء منطقة منصهرة على سبيكة الألومنيوم أثناء ذوبان المنطقة ، يمكن استخدام التسخين باستخدام أفران صغيرة المقاومة أو التيارات عالية التردد. بالنسبة لإمداد الطاقة بأفران المقاومة الكهربائية ، فإن المعدات المعقدة غير مطلوبة ؛ فالأفران سهلة التشغيل. العيب الوحيد في طريقة التسخين هذه هو المقطع العرضي الصغير لسبائك الألمنيوم النقي.
يعد التسخين بالحث باستخدام التيارات عالية التردد طريقة مثالية لإنشاء منطقة منصهرة على سبيكة أثناء ذوبان المنطقة. تسمح طريقة التسخين عالي التردد (بالإضافة إلى السماح بصهر المنطقة من سبائك المقاطع العرضية الكبيرة) بميزة هامة تتمثل في خلط المعدن المنصهر باستمرار في المنطقة ؛ هذا يسهل نشر ذرات النجاسة من جبهة التبلور في عمق الذوبان.
لأول مرة ، تم إتقان الإنتاج الصناعي للألمنيوم عالي النقاء حسب المنطقة في مصنع فولخوف للألمنيوم في عام 1965 باستخدام تركيب UZPI-3 الذي طوره YOU. تم تجهيز هذا الإعداد بأربع معابد كوارتز بتدفئة التعريفي ، بينما كانت المحاثات متحركة ، والحاويات ذات المعدن كانت ثابتة. كانت إنتاجيتها 20 كجم من المعدن لكل دورة تنظيف. في وقت لاحق ، تم إنشاء UZPI-4 للتركيبات المعدنية عالية الأداء ، ودخلت حيز التشغيل التجاري في عام 1972 في مصنع فولخوف للألمنيوم.
يمكن وصف كفاءة تنقية الألمنيوم أثناء ذوبان المنطقة بالبيانات التالية. إذا كان المحتوى الكلي من الشوائب في الألومنيوم المكرر الكهربائي (30 ÷ 60) ּ 10 -4٪، وتنخفض إلى (2.8 ÷ 3،2) ּ 10 -4٪ بعد ذوبان المنطقة، م. E. 15-20 مرة. هذا يناظر المتبقية الألومنيوم المقاومة ρ ○ (في الهيليوم السائل في درجة الحرارة 4.2 K) على التوالي (20 ÷ 40) ּ 10 -10 و (1،8 ÷ 2،1) ּ 10 -10 أو 99،997-99،994 ونقاء 99،9997٪. في الجدول. 1.4 (انظر أدناه) يوضح بيانات التحليل الإشعاعي حول محتوى بعض الشوائب في الألومنيوم المنقى بالمنطقة والمكرر كهربائيا. تشير هذه البيانات إلى انخفاض كبير في محتوى معظم الشوائب ، على الرغم من أن الشوائب مثل المنجنيز وال سكانديوم لا تتم إزالتها عملياً أثناء ذوبان المنطقة.
في السنوات الأخيرة ، طورت VAMI واختبرت في الظروف الصناعية تقنية لإنتاج الألمنيوم بنقاء 99.9999 ٪ من ذوبان منطقة تتالي. يتمثل جوهر طريقة ذوبان منطقة التسلسل في أن تنقية الألومنيوم المصدر بنقاء A999 تتم من خلال تكرار دورات (شلالات) قطاع المنطقة بشكل متتابع. في هذه الحالة ، تكون مادة البدء لكل سلسلة لاحقة هي الجزء الأوسط والأكثر نقاءًا من السبائك التي تم الحصول عليها نتيجة لدورة التنظيف السابقة.
الجدول 1.4
| نجاسة | مصدر الألومنيوم (المكرر كهربائيا 99.993-99.994 ٪) | منطقة ذوبان الألمنيوم | |
| الجرافيت ، فراغ | الهواء الغزير | ||
| نحاس | 1,9 | 0,02 | 0,08 |
| زرنيخ | 0,15 | 0,0015 | 0,001 |
| الأنتيمون | 1,2 | 0,03 | 0,02 |
| أورانوس | 0,002 | - | - |
| حديد | 3 | ≤0,2 | ≤0,3 |
| الغاليوم عنصر فلزي نادر | 0,3 | 0,02 | 0,05 |
| المنغنيز | 0,2-0,3 | 0,1-0,2 | 0,15 |
| سكانديوم | 0,4-0,5 | 0,4-0,5 | 0,4-0,5 |
| الايتريوم عنصر فلزي | 0,02-0,04 | <<0,001 | <<0,001 |
| اللوتيتيوم | 0,002-0,004 | <<0,0001 | <<0,0001 |
| هولميوم | 0,005-0,01 | <<0,0001 | <<0,0001 |
| الغادولينيوم عنصر فلزي | 0,02-0,04 | <<0,01 | <<0,01 |
| التربيوم عنصر فلزي | 0,003-0,006 | <<0,001 | <<0,001 |
| السمريوم عنصر فلزي | 0,05-0,01 | <<0,0001 | <<0,0001 |
| النيوديميوم | 0,1-0,2 | <<0,01 | <<0,01 |
| البراسيوديميوم | 0,05-0,1 | <<0,001 | <<0,001 |
| السيريوم عنصر فلزي | 0,3-0,6 | <<0,01 | <<0,01 |
| اللنثانوم عنصر فلزي | 0,01 | <<0,001 | <<0,001 |
| النيكل | 2,3 | - | <1 |
| الكادميوم | 3,5 | <<0,01 | 0,02-0,07 |
| زنك | 20 | <<0,05 | 1 |
| الكوبالت | 0,01 | <<0,01 | <<0,01 |
| صوديوم | 1-2 | <0,2 | <0,2 |
| بوتاسيوم | 0,05 | 0,01 | 0,01 |
| الباريوم | 6 | - | - |
| الكلور | 0,01 | <0,01 | <0,01 |
| الفوسفور | 3 | 0,04 | - |
| كبريت | 15 | 0,5-1,5 | - |
| كربون | 1-2 | - | 1-2 |
| المذكرة. إن كميات التيلوريوم ، البزموت ، الفضة ، الموليبدينوم ، الكروم ، الزركونيوم ، الكالسيوم ، السترونتيوم ، الروبيديوم ، السيريوم ، الإنديوم ، السيلينيوم والزئبق في الألومنيوم بعد ذوبان المنطقة أقل من حساسية التحليل الإشعاعي. | |||
في الجدول. 1.5 (انظر أدناه) يوضح نتائج التحليل والقياس الطيفي الشامل R 293 ك / R 4.2 K من الألومنيوم التي تم الحصول عليها عن طريق ذوبان منطقة تتالي. من البيانات المذكورة أعلاه ، يمكن أن نستنتج أن نقاء هذا الألومنيوم ، الذي يحدده الفرق مع عشرة شوائب أساسية (Si ، Fe ، Mg ، Mn ، Ti ، Cu ، Cr ، Zn ، Na ، و V) ،\u003e 99.9999٪. يتم تأكيد هذا الاستنتاج بشكل غير مباشر بواسطة القيمة R 293 ك / R 4.2 K، الذي كان في جميع العينات\u003e 30 ּ 10 مارس.
للحصول على المعدن بنقاء 99.9999 ٪ ، وهو ما يكفي لتنفيذ اثنين من سلسلة من ذوبان المنطقة (انظر الجدول 1.5). زيادة أخرى في عدد الشلالات لا تزيد من نقاء الألومنيوم ، على الرغم من أنه يزيد من العائد الإجمالي للمعادن بنقاء 99.9999 ٪.
هناك عملية أخرى ممكنة للحصول على الألمنيوم عالي النقاء وهي تقطيره من خلال subhalides ، وخاصة من خلال subfluoride من الألومنيوم.
إن ضغط البخار المشبع من معدن الألمنيوم ليس عاليًا بما يكفي لتقطيره مباشرة بمعدلات مقبولة عملياً. ومع ذلك ، عند تسخينه في الفراغ (عند 1000-1050 درجة مئوية) باستخدام AlF 3 ، يشكل الألمونيوم فلورايد متقلبة من AlF ، يتم تقطيره إلى منطقة باردة (800 درجة مئوية) ، حيث يتحلل مرة أخرى (غير متناسب) مع إطلاق الألمنيوم النقي:
ترجع إمكانية التنقية العميقة للألمنيوم من الشوائب بشكل أساسي إلى حقيقة أن احتمال تكوين المركبات الفرعية للألمنيوم أعلى بكثير من احتمال تكوين المركبات الفرعية للشوائب.
الجدول 1.5
نتائج التحليل الطيفي الشامل والقياسات R 293 ك / R 4.2 K ألمنيوم كاسكاد نذوب.
| عدد الشلالات | محتوى الشوائب ، × 10-4 ٪ | ||||||
| سي | الحديد | ملغ | مليون | منظمة الشفافية الدولية | المبلغ | ||
| أصل | 18,3 | 0,210 | <0,103 | 0,89 | <0,061 | 0,069 | 1,544 |
| A999 | |||||||
| 2 | 36,5 | <0,062 | <0,103 | 0,006 | <0,061 | 0,017 | 0,460 |
| 2 | 38,0 | <0,062 | <0,103 | 0,006 | <0,061 | 0,017 | 0,460 |
| 2 | 39,5 | 0,073 | <0,103 | 0,045 | <0,061 | 0,07 | 0,563 |
| 3 | 32,0 | 0,204 | <0,103 | 0,006 | <0,061 | 0,017 | 0,502 |
| 3 | 30,0 | 0,073 | 0,100 | 0,006 | 0,020 | 0,07 | 0,480 |
| 3 | 32,0 | 0,052 | 0,100 | 0,006 | 0,061 | 0,07 | 0,500 |
| 4 | 40,0 | <0,021 | <0,103 | 0,006 | 0,061 | 0,07 | 0,472 |
| 4 | 30,5 | 0,031 | 0,100 | 0,006 | 0,061 | 0,07 | 0,479 |
| 5 | 34,0 | 0,104 | <0,060 | 0,006 | 0,061 | 0,017 | 0,459 |
| ملاحظات: 1. يتم إعطاء مجموع الشوائب مع مراعاة الشوائب الأخرى ، التي كان محتواها في جميع العينات ، × 10–4 ٪:<0,071 Cu; <0,038 Cr; 0,048 Zn; 0,017 Na; 0,037 V. 2. При подсчете суммы примесей принимали их максимальное значение, равное пределу чувствительности анализа, например <0,061 считали как 0,061. | |||||||
يرتبط محتوى الشوائب في الألومنيوم المقطر من خلال الفلورايد عكسيا بكتلة سبائك تم الحصول عليها. وسبائك تزن 1،5-1،7 كجم المحتوى الكلي من الشوائب (سي، الحديد، النحاس، والمغنيسيوم) هي 11 -4 ּ 10٪، ومحتوى الغاز من 0.007 سم 3/100 ز محددة المقاومة المتبقية (ρ ○) في درجة حرارة الهيليوم السائل لهذا المعدن هو (1،7 ÷ 2،0) ּ ּ 10 -10 أوم سم. يحتوي تقطير الألومنيوم من خلال الفلورايد على العديد من العيوب (إنتاجية صغيرة نسبيًا ، وتنقية عميقة غير كافية من المغنيسيوم ، إلخ) ، وبالتالي ، فإن الطريقة لم تتلق تنمية صناعية.
كما تم تطوير طرق لإنتاج الألمنيوم عالي النقاء عن طريق التحليل الكهربائي لمركبات الألومنيوم العضوي المعقدة ، والتي تختلف في تكوين المنحل بالكهرباء. على سبيل المثال ، في ألمانيا ، يتم استخدام طريقة التحليل الكهربائي لمحلول 50٪ من NaF-2 Al (C 2 H 5) 3 في التولوين. تتم عملية التكرير عند 100 درجة مئوية ، والجهد على الخلية 1.0-1.5 فولت والكثافة الحالية 0.3-0.5 A / DM 2 باستخدام أقطاب الألومنيوم. الناتج الحالي الكاثود 99 ٪. يعمل التكرير الكهروكيميائي في إلكتروليتات الألمنيوم العضوي على تقليل محتوى المنجنيز وال سكانديوم بشكل كبير ، والتي لا تتم إزالتها عملياً أثناء تنظيف المنطقة. عيوب هذه الطريقة هي إنتاجيتها المنخفضة ومخاطر الحرائق العالية.
للحصول على تنقية أعمق للألمنيوم وللحصول على معدن بنقاوة 99.99999٪ أو أكثر ، يمكن استخدام مزيج من الطرق المذكورة أعلاه: التحليل الكهربائي لمركبات الألومنيوم العضوي أو التسامي بواسطة subfluoride متبوعًا بصهر المنطقة للألمنيوم الذي تم الحصول عليه. على سبيل المثال ، من خلال تنقية منطقة متعددة من الألومنيوم التي تم الحصول عليها عن طريق التحليل الكهربائي لمركبات الألمنيوم العضوي ، يمكن الحصول على معدن عالي النقاء بمحتوى شوائب يبلغ 10-9 ٪: Fe 50 ؛ سي<500; Cu 10; Mg 30; Mn5; Ti <500; Cr 20; Zn <50; Co <1; Ag <5; Sb <1 и Se 3.
تطبيق
مزيج من الخصائص الفيزيائية والميكانيكية والكيميائية للألمنيوم يحدد استخدامه على نطاق واسع في جميع مجالات التكنولوجيا تقريبا ، وخاصة في شكل سبائك مع المعادن الأخرى. في الهندسة الكهربائية ، يستبدل الألومنيوم بنجاح النحاس ، وخاصة في إنتاج الموصلات الصلبة ، على سبيل المثال ، في الخطوط العلوية ، الكابلات ذات الجهد العالي ، حافلات المفاتيح ، المحولات (تصل الموصلية الكهربائية للألمنيوم إلى 65.5٪ من الموصلية الكهربائية للنحاس ، وهي أخف بثلاث مرات من النحاس ؛ مع مقطع عرضي يوفر نفس الموصلية ، فإن كتلة أسلاك الألمنيوم هي نصف كتلة النحاس). يستخدم الألومنيوم فائق النقاء في تصنيع المكثفات والمقومات الكهربائية ، والتي يعتمد تأثيرها على قدرة فيلم أكسيد الألومنيوم على نقل التيار الكهربائي في اتجاه واحد فقط. يستخدم الألومنيوم فائقة النقاء ، المنقى بواسطة ذوبان المنطقة ، لتركيب مركبات أشباه الموصلات من النوع A III B V المستخدمة في تصنيع أجهزة أشباه الموصلات. يستخدم الألمنيوم النقي في تصنيع أنواع مختلفة من المرايا العاكسة. يستخدم الألمنيوم عالي النقاء لحماية الأسطح المعدنية من التآكل في الغلاف الجوي (الكسوة ، طلاء الألمنيوم). مع مقطع عرضي منخفض نسبياً لامتصاص النيوترونات ، يستخدم الألومنيوم كمادة هيكلية في المفاعلات النووية.
في صهاريج الألومنيوم ذات السعة الكبيرة ، يتم تخزين الغازات السائلة (الميثان ، الأكسجين ، الهيدروجين ، إلخ) ، أحماض النيتريك والأسيتيك ، الماء النقي ، بيروكسيد الهيدروجين والزيوت الصالحة للأكل. يستخدم الألومنيوم على نطاق واسع في معدات وأجهزة صناعة الأغذية ، لتغليف المنتجات الغذائية (في شكل رقائق معدنية) ، لإنتاج أنواع مختلفة من المنتجات المنزلية. زاد استهلاك الألومنيوم بشكل كبير في زخرفة المباني والمباني المعمارية والنقل والرياضة.
في صناعة المعادن ، يعد الألومنيوم (بالإضافة إلى السبائك التي تعتمد عليه) واحدًا من المضافات الأكثر شيوعًا في صناعة السبائك القائمة على Cu و Mg و Ti و Ni و Zn و Fe. يستخدم الألومنيوم أيضًا لإزالة الأكسدة من الفولاذ قبل صبها في القالب ، وكذلك في عمليات إنتاج معادن معينة بواسطة طريقة الألمنيوم. استنادًا إلى الألومنيوم ، تم إنشاء SAP (مسحوق الألمنيوم الملبد) بواسطة مسحوق المعادن ، والذي يتميز بمقاومة عالية للحرارة عند درجات حرارة تزيد عن 300 درجة مئوية.
يستخدم الألومنيوم في صناعة المتفجرات (أمونيال ، ألومينوتول). تستخدم مركبات الألومنيوم المختلفة على نطاق واسع.
يتزايد إنتاج واستهلاك الألومنيوم باستمرار ، وهو ما يفوق بشكل كبير إنتاج الفولاذ والنحاس والرصاص والزنك.
DIN (DeutschIndustrienorm) - المعيار الصناعي لألمانيا.
تشمل العملية التكنولوجية لإنتاج الألمنيوم ثلاث مراحل رئيسية:
1. إنشاء الألومينا من خامات الألومنيوم ؛
2. إنشاء الألومنيوم من الألومينا.
3. عملية تكرير الألومنيوم.
وفي الوقت نفسه ، فإن استخدام هذه المعدات ضروري:
معدات لنظام توزيع الألومينا المركزي ؛
كهربي.
بسبار الكاثود
محطات معالجة الغاز الجاف.
التجمع ، والرافعات التكنولوجية ومسبك.
وحدات الشفط
معدات المسابك
معدات ورشة التجميع الأنود.
الهياكل المعدنية للمباني الإنتاج.
إنشاء الألومينا من الخامات - مرحلة إنتاج الألمنيوم
يمكن الحصول على الألومينا بثلاث طرق: الحمض ، القلوية والكهارل. الأكثر شعبية هي الطريقة القلوية. جوهر هذه الطريقة هو أن حلول الألومنيوم تبدأ في التحلل بسرعة كبيرة مع إدخال هيدروكسيد الألومنيوم ، والحل الذي يبقى من التحلل بعد التبخر مع التقليب الشديد عند درجة حرارة 170 درجة مئوية يمكن أن يحل الألومينا الموجودة في البوكسيت مرة أخرى. تحتوي هذه الطريقة على المراحل الرئيسية التالية:
1. إعداد البوكسيت ، والذي ينطوي على سحق وطحن في مصانع خاصة. يتم إرسال القلويات الكاوية والبوكسيت وبعض الجير إلى الطواحين. يتم إرسال اللب ، الذي ظهر ، للتسرب.
2. غسل البوكسيت يعني تحللها الكيميائي من مركب بمحلول مائي من القلويات. في هذه الحالة ، تمر هيدرات أكسيد الألومنيوم ، عند دمجها مع القلويات ، إلى المحلول في شكل ألومينات الصوديوم ، وتنتقل السيليكا الموجودة في البوكسيت ، مع القلويات ، إلى المحلول في صورة سيليكات الصوديوم. في محلول ، هذه المركبات: ألومينات الصوديوم وسيليكات الصوديوم تشكل ألومينات سيليكات الصوديوم غير القابلة للذوبان. تمر أكاسيد الحديد والتيتانيوم في هذه البقايا ، والتي تعطي البقايا صبغة حمراء. هذه البقايا طينية حمراء. عند اكتمال إذابة ألومينات الصوديوم التي تم الحصول عليها ، يتم تخفيفه بمحلول مائي من القلويات مع خفض درجة الحرارة إلى 100 درجة مئوية.
3. الفصل بين الطين الأحمر ومحلول الألومينات عن بعضهما البعض يرجع إلى الغسيل في المثخنات. ثم يستقر الوحل الأحمر ، ويتم تصفية محلول الألومينات المتبقي.
4. تحلل ألومينات الحل. يتم ترشيحها وإرسالها إلى حاويات كبيرة مع خلاطات. من هذا الحل ، يؤدي التبريد إلى 60 درجة مئوية مع التحريك المستمر إلى إطلاق هيدروكسيد الألومنيوم. نظرًا لحقيقة أن العملية غير متكافئة وبطيئة للغاية ، ونمو بلورات هيدروكسيد الألومنيوم مهم جدًا في المعالجة الإضافية ، لا يزال المحللون يضيفون الكثير من هيدروكسيد الصلب إلى هذه الحاويات مع الخلاطات.
5. يتم إنتاج هيدروكسيد الألومنيوم في فلاتر فراغ و hydrocyclones. يتم إرجاع معظم هيدروكسيد كمادة البذور إلى إجراء التحلل. بعد غسل الماء ، يتم إرسال البقايا للتكلس. ويعود المرشح أيضًا إلى العملية.
6. تجفيف هيدروكسيد الألومنيوم - المرحلة النهائية لإنتاج الألومينا. يحدث في أفران أنبوبي ، تدور باستمرار. هيدروكسيد الألومنيوم الخام ، عندما يمر عبر الفرن ، يتم تجفيفه وتجفيفه بالكامل.
يتم إنتاج الألومنيوم من الألومينا في الإنتاج أيضًا على عدة مراحل.
1. يحدث التحليل الكهربائي لأكسيد الألومنيوم عند درجة حرارة الخلية - 970 درجة مئوية. تحتوي الخلية على حمام مبطن بكتل كربونية ، يتصل به تيار كهربائي. يتم تجميع الألمنيوم السائل المنطلق على قاعدة الفحم ، ومن هناك يتم ضخه بانتظام. يتم غمر أنودات الكربون في المنحل بالكهرباء من أعلى ، حيث يتم حرقها في جو من الأكسجين ينطلق من الألومينا ، ويتم إطلاق أول أكسيد الكربون أو ثاني أكسيد الكربون.
2. يتم إجراء التحليل الكهربائي لكلوريد الألومنيوم عن طريق تحويل أكسيد الألومنيوم في وعاء التفاعل إلى كلوريد الألومنيوم. ثم في الحمام المعزول هو التحليل الكهربائي لكلوريد الألومنيوم. يتم امتصاص الكلور ، الذي يتم إطلاقه في هذه الحالة ، وإرساله لإعادة التدوير. والألمنيوم يترسب في الكاثود.
3. الحد من كلوريد الألومنيوم المنغنيز ، في حين يتم إطلاق الألومنيوم. بسبب التكثيف المتحكم به ، يتم إطلاق الملوثات المرتبطة بالكلور من تدفق كلوريد المنجنيز. عندما يتم إطلاق الكلور ، يتم تحويل كلوريد المنجنيز إلى أكسيد المنغنيز ، والذي يتم بعد ذلك اختزاله إلى حالة من المنجنيز التي يمكن إعادة تدويرها.
عملية تكرير الألومنيوم في إنتاج الألمنيوم
تكرير التحليل الكهربائي مع تحلل المحاليل الملحية للألمنيوم غير ممكن. نظرًا لأن درجة تنقية الألومنيوم الصناعي ، والتي يتم الحصول عليها عن طريق التحليل الكهربائي لمصهور كريوليت-ألومينا ، لن تكون كافية لبعض الأغراض ، فإن الألمنيوم يكون أنقى من نفايات الألومنيوم المعدنية والصناعية بسبب التكرير. طريقة التكرير الأكثر شيوعًا هي التحليل الكهربائي ثلاثي الطبقات.
يستخدم الألومنيوم في صناعة المتفجرات (الألوموتول ، الأموني). يتم استخدام مجموعة واسعة من مركبات الألومنيوم. يتزايد إنتاج واستهلاك الألومنيوم بشكل مستمر وأسرع بكثير من إنتاج النحاس والصلب والزنك والرصاص.
للحصول على النحاس ، يتم استخدام خامات النحاس وكذلك فضلات النحاس وسبائكه. تحتوي الخامات على 1 - 6 ٪ من النحاس. خام لا يحتوي على أقل من 0.5٪ من النحاس الخام لا تتم معالجته ، حيث أنه مع المستوى الحالي للتكنولوجيا ، فإن استخراج النحاس منه غير مربح.
في الخامات ، يكون النحاس على شكل مركبات كبريتية (CuFeS 2 - chalcopyrite ، Cu 2 S - chalcosine ، CuS - covelin) ، أكاسيد (CuO ، CuO) وبيكربونات
يتكون خام الجانج من البايرايت (FeS 2) والكوارتز (SiO 2) ومركبات مختلفة تحتوي على Al 2 O 3 و MgO و CaO وأكسيدات الحديد.
تحتوي الخامات أحيانًا على كميات كبيرة من المعادن الأخرى (الزنك والذهب والفضة وغيرها).
هناك طريقتان لإنتاج النحاس من الخامات:
- المائية.
- المعدنية الحرارية.
لم تجد المعادن الهيدرولوجية تطبيقها الواسع بسبب عدم القدرة على استخراج المعادن الثمينة إلى جانب النحاس.
طريقة المعالجة الحرارية المعدنية مناسبة لمعالجة جميع الخامات وتشمل العمليات التالية:
- تحضير الخامات للصهر ؛
- ماتي ذوبان.
- تحويل غير لامع
- تكرير النحاس.
تحضير الخامات للصهر
يتكون إعداد الخامات في التخصيب والتحميص. يتم تخصيب خامات النحاس بالتعويم. والنتيجة هي تركيز النحاس الذي يحتوي على ما يصل إلى 35 ٪ من النحاس وما يصل إلى 50 ٪ من الكبريت. يتم إطلاق المركزات عادة في أفران الأسرة المميعة من أجل تقليل محتوى الكبريت إلى القيم المثلى. أثناء إطلاق النار ، تتأكسد الكبريت عند درجة حرارة 750 - 800 درجة مئوية ، تتم إزالة جزء من الكبريت مع الغازات. والنتيجة هي منتج يسمى cinder.
صهر لامع
يتم صهر Matte في أفران عاكسة أو كهربائية عند درجة حرارة 1250 - 1300 درجة مئوية. تدخل مركزات صهر خامات النحاس في عملية الصهر ، أثناء التسخين ، حيث تتواصل تفاعلات خفض أكسيد النحاس وأكسيد الحديد العالي
6CuO + FeS \u003d 3Cu 2 O + FeO + SO 2
FeS + 3Fe 3 O 4 + 5SiO 2 \u003d 5 (2FeO · SiO 2) + SO 2
نتيجة لتفاعل Cu 2 O مع FeS ، يتكون Cu 2 S بواسطة التفاعل:
Cu 2 O + FeS \u003d Cu 2 S + FeO
كبريتات النحاس والحديد ، تنصهر معا ، وتشكل سليكات الحديد المنصهر ، إذابة أكاسيد أخرى ، تشكل الخبث. ماتي يحتوي على 15 - 55 ٪ من النحاس ؛ 15 إلى 50 ٪ 20-30 ٪ S. Slag يتكون أساسا من SiO 2 ، FeO ، CaO ، Al 2 O 3.
يتم إصدار ماتي والخبث لأنها تتراكم من خلال فتحات خاصة.
ماتي التحويل
يتم تحويل اللامع في مصاهر نحاسية (الشكل 44) عن طريق نفخه بالهواء من أجل أكسدة الحديد الكبريتي ، ونقل الحديد إلى الخبث وعزل النحاس البثر.
يبلغ طول المحولات من 6 إلى 10 أمتار وقطرها الخارجي من 3 إلى 4 أمتار ، ويتم سكب المواد المنصهرة ، ويتم تصريف منتجات الصهر وإزالة الغازات من خلال رقبة موجودة في منتصف صندوق المحول. لتطهير اللون غير اللامع ، يتم توفير الهواء المضغوط من خلال سحابات موجودة على طول المصفوفة العامة للمحول. توجد فتحة في أحد الجدران الطرفية للمحول يتم من خلالها التحميل الهوائي لتدفق الكوارتز ، وهو أمر ضروري لإزالة الحديد في الخبث.
تتم عملية التطهير في فترتين. في الفترة الأولى ، يتم صب المواد غير اللامعة في المحول ويتم توفير تدفق الكوارتز. في هذه الفترة ، تحدث تفاعلات أكسدة الكبريتيد.
يتفاعل أكسيد الحديد الناتج مع تدفق الكوارتز ويتم إزالته للخبث.
مع تراكم الخبث ، يتم تصريفه جزئيًا ويتم صب جزء جديد من اللامع الأولي في المحول ، مع الحفاظ على مستوى معين من اللامع في المحول. في الفترة الثانية ، يتفاعل أكسيد النحاس مع كبريتيد النحاس لتشكيل النحاس المعدني
وبالتالي ، نتيجة للتطهير ، يتم الحصول على نحاس نفطة يحتوي على 98.4 - 99.4 ٪ من النحاس. يتم سكب النحاس الناتج في قوالب مسطحة على آلة صب الشريط.
تكنولوجيا إنتاج المغنيسيوم
الطريقة الرئيسية لإنتاج المغنيسيوم هي كهربائيا. إن إنتاج الإلكتروليت للمغنيسيوم من المحاليل المائية أمر مستحيل ، لأن الإمكانات الكهروكيميائية للمغنيسيوم هي أكثر سلبية من احتمال تصريف أيونات الهيدروجين في الكاثود. لذلك ، يتم إجراء التحليل الكهربائي للمغنيسيوم من أملاحه المنصهرة.
المكون الرئيسي للكهارل هو كلوريد المغنيسيوم MgCl2 ، ويتم إدخال NaCl ، CaCl2 ، KCl وكميات صغيرة من NaF و CaF2 فيه لخفض درجة حرارة انصهار المنحل بالكهرباء وزيادة التوصيل الكهربائي.
المواد الخام الرئيسية لإنتاج المغنيسيوم هي كارناليت (MgCl2 KCl 6H2O) ، المغنسيت (MgCO3) ، الدولوميت (CaCO3 MgCO3) ، البيشوفيت (MgCl2 6H2O). يتم الحصول على أكبر كمية من المغنيسيوم من كارناليت.
المراحل الرئيسية لإنتاج المغنيسيوم:
1. كارناليت
2. إثراء الكرناليت.
3. الجفاف من الكرناليت.
4. إنتاج كهربائيا من المغنيسيوم.
5. تكرير المغنيسيوم.
6. المغنيسيوم.
إثراء الكرنليت هو المرحلة الأولى من معالجته. جوهر عملية التخصيب هو فصل الشوائب KCl وغير القابلة للذوبان عن طريق تحويل MgCl2 و KCl إلى محلول مائي. عندما يتم تبريد المحلول الناتج في بلورات تفريغ الهواء ، فإن رواسب بلورات الكرناليت الاصطناعي MgCl2 KCl 6H2O ، والتي يتم فصلها بواسطة الترشيح.
كارناليت هو الجفاف على مرحلتين. يتم تنفيذ المرحلة الأولى في الأفران الأنبوبية أو أفران الطبقة المميعة في 550-600 درجة مئوية. تحت تأثير حرارة الغازات الساخنة ، يتم تجفيف الكارنيت وبعد هذا العلاج يحتوي على رطوبة 3-4 ٪.
يتم تنفيذ المرحلة الثانية من الجفاف إما عن طريق ذوبان الكارنيت الذي تم الحصول عليه بعد المرحلة الأولى في الأفران الكهربائية ، تليها ترسيب أكسيد المغنيسيوم ، أو عن طريق الكلورة في الكارنيت في الحالة المنصهرة.
إنتاج كهربائيا من المغنيسيوم. لهذا الغرض ، يتم استخدام أداة التحليل الكهربائي ، والتي تصطف داخلياً بالطوب الناري. الأنودات عبارة عن ألواح غرافيتية ، والكاثودات عبارة عن صفائح فولاذية تقع على جانبي الأنود.
للتحلل الكهربائي لكلوريد المغنيسيوم ، يتم تمرير تيار من 2.7-2.8 فولت من خلال المنحل بالكهرباء.
نتيجة للتحلل الكهربائي لكلوريد المغنيسيوم ، تتشكل أيونات الكلور ، التي تنتقل إلى الأنود ، وبعد التفريغ ، تخلق فقاعات الكلور الخارجة من المنحل بالكهرباء. تنتقل أيونات المغنيسيوم إلى الكاثود ، وبعد إطلاقها ، يتم إطلاقها على السطح ، لتكوين قطرات من المغنيسيوم السائل. المغنيسيوم لديه كثافة أقل من المنحل بالكهرباء ، لذلك يطفو على سطحه في الفضاء الكاثود ، من حيث يتم إزالتها بشكل دوري باستخدام دلو فراغ.
أثناء التحليل الكهربائي ، يزداد تركيز الكلوريدات الأخرى في المنحل بالكهرباء بسبب استهلاك MgCl2. لذلك ، بشكل دوري ، تتم إزالة جزء من المنحل بالكهرباء المستهلكة من الحمام ، وبدلاً من ذلك ، يتم سكب MgCl2 أو ذوبان الكارنلايت. نتيجة للتحلل الجزئي للشوائب ، تتشكل الحمأة في قاع الحمام ، والتي يتم إزالتها بانتظام من الحمام.
تكرير المغنيسيوم. في حمامات التحليل الكهربائي ، يتم الحصول على المغنيسيوم الخام ، والذي يحتوي على 5 ٪ من الشوائب: الشوائب المعدنية (Fe ، Na ، K ، Al ، Ca) والشوائب غير المعدنية (MgCl2 ، KCl ، NaCl ، CaCl2 ، MgO). يتم تكرير المغنيسيوم (تكريره) عن طريق إعادة الصهر مع التدفقات.


