21.07.2019
تفاعل القلويات مع الأحماض. هيدروكسيد الصوديوم
صوديوم يشير إلى المعادن القلوية ويتم توزيعه في المجموعة الفرعية الرئيسية للمجموعة الأولى من PSE عليها. DI مندليف. على مستوى الطاقة الخارجية لذرة على مسافة كبيرة نسبيا من النواة هو إلكترون واحد ، والذرات المعادن القلوية أنها تتخلى بسهولة تامة ، وتتحول إلى كاتيونات مفردة الشحن ؛ وهذا ما يفسر النشاط الكيميائي العالي للغاية للمعادن القلوية.
تتمثل الطريقة الشائعة لإنتاج القلوية في التحليل الكهربائي لأملاحها المنصهرة (عادة كلوريد).
يتميز الصوديوم ، كمعدن قلوي ، بصلابة منخفضة وكثافة منخفضة ونقاط انصهار منخفضة.
الصوديوم ، الذي يتفاعل مع الأكسجين ، يشكل أساسا بيروكسيد الصوديوم
2 Na + O2 Na2O2
يمكن أن يؤدي تقليل البيروكسيدات والبيروبوكسيدات الزائدة عن المعادن القلوية إلى إنتاج أكسيد:
Na2O2 + 2 Na 2 Na2O
تتفاعل أكاسيد الصوديوم مع الماء لتكوين هيدروكسيد: Na2O + H2O → 2 NaOH.
تتحلل البيروكسيدات بالكامل بواسطة الماء مع تكوين القلويات: Na2O2 + 2 HOH → 2 NaOH + H2O2
مثل كل المعادن القلوية ، الصوديوم عامل اختزال قوي ويتفاعل بنشاط مع العديد من المعادن غير المعدنية (باستثناء النيتروجين واليود والكربون والغازات النبيلة):
يتفاعل بشكل سيء للغاية مع النيتروجين في تصريف توهج ، مكونًا مادة نيتريد الصوديوم غير المستقرة للغاية
يتفاعل مع الأحماض المخففة مثل المعدن العادي:
مع الأحماض المؤكسدة المركزة ، يتم إطلاق منتجات الاختزال:
هيدروكسيد الصوديوم NaOH (القلوية الكاوية) هي قاعدة كيميائية قوية. في الصناعة ، يتم الحصول على هيدروكسيد الصوديوم بالطرق الكيميائية والكهربائية.
طرق الإنتاج الكيميائي:
الجير ، والذي يتكون من تفاعل محلول الصودا مع حليب الجير عند درجة حرارة حوالي 80 درجة مئوية. وتسمى هذه العملية التذويب ؛ يمر عبر رد الفعل:
Na 2 CO 3 + Ca (OH) 2 → 2NaOH + CaCO 3
الحديدي ، والذي يتضمن مرحلتين:
Na 2 CO 3 + Fe 2 O 3 → 2NaFeО 2 + CO 2
2NaFeО 2 + xH 2 О \u003d 2NaOH + Fe 2 O 3 * xH 2 О
كهربائيا ، يتم الحصول على هيدروكسيد الصوديوم عن طريق التحليل الكهربائي لمحاليل الهاليت (وهو معدن يتكون أساسا من كلوريد الصوديوم كلوريد الصوديوم) مع الإنتاج المتزامن للهيدروجين والكلور. يمكن تمثيل هذه العملية بالمعادلة الكلية:
2NaCl + 2H 2 O ± 2- → H 2 + Cl 2 + 2NaOH
يتفاعل هيدروكسيد الصوديوم:
1) تحييد:
NaOH + HCl → NaCl + H 2 O
2) تبادل مع الأملاح في الحل:
2NoOH + CuSO 4 → Cu (OH) 2 ↓ + Na 2 SO 4
3) يتفاعل مع غير المعادن
3S + 6NaOH → 2Na 2 S + Na 2 SO 3 + 3H 2 O
4) يتفاعل مع المعادن
2Al + 2NaOH + 6H 2 O → 3H 2 + 2Na
يستخدم هيدروكسيد الصوديوم على نطاق واسع في العديد من الصناعات ، على سبيل المثال ، عند عجينة الطهي ، من أجل تصبغ الدهون في صناعة الصابون ؛ كمحفز للتفاعلات الكيميائية في إنتاج وقود الديزل ، إلخ.
كربونات الصوديوميتم إنتاجه إما في صورة Na 2 CO 3 (رماد الصودا) ، أو في شكل هيدرات بلورية Na 2 CO 3 * 10H 2 O (الصودا البلورية) ، أو في صورة NaHCO 3 بيكربونات (شرب الصودا).
غالبًا ما يتم إنتاج الصودا بواسطة طريقة كلوريد الأمونيا ، بناءً على التفاعل:
NaCl + NH 4 HCO 3 ↔ NaHCO 3 + NH4Cl
تستهلك العديد من الصناعات كربونات الصوديوم: الكيميائية ، والصابون ، ولب الورق والورق ، والمنسوجات ، والغذاء ، إلخ.
الخصائص الفيزيائية
هيدروكسيد الصوديوم
الديناميكا الحرارية للحلول
Δ ح 0 انحلال المحلول المائي المخفف بشكل غير محدود لـ -44.45 kJ / mol.
تبلور أحادي الهيدرات (syngonium المعيني) من المحاليل المائية عند 12.3 - 61.8 درجة مئوية ، نقطة انصهار 65.1 درجة مئوية ؛ الكثافة 1.829 جم / سم مكعب ؛ 0H 0 arr 34734.96 kJ / mol ، في المدى من -28 إلى -24 درجة مئوية - heptahydrate ، من -24 إلى -17.7 درجة مئوية - خماسي الهيدرات ، من -17.7 إلى -5.4 ° С - رباعي هيدرات ( تعديل α) ، من -5.4 إلى 12.3 درجة مئوية. الذوبان في الميثانول هو 23.6 جم / لتر (ر \u003d 28 درجة مئوية) ، في الإيثانول 14.7 جم / لتر (ر \u003d 28 درجة مئوية). NaOH · 3.5H 2 O (نقطة الانصهار 15.5 درجة مئوية) ؛
الخواص الكيميائية
(بشكل عام ، يمكن تمثيل هذا التفاعل بمعادلة أيونية بسيطة ، يبدأ التفاعل بإطلاق الحرارة (تفاعل طارد للحرارة): OH - + H 3 O + → 2H 2 O.)
- مع أكاسيد مذبذبة لها خصائص أساسية وحمضية ، وقدرة على التفاعل مع القلويات ، مثل السبائك الصلبة:
ZnO + 2NaOH → Na 2 ZnO 2 + H 2 O
لذلك مع الحلول:
ZnO + 2NaOH (محلول) + H 2 O → Na 2 (محلول)+ ح 2
(يطلق على الأنيون الناتج أيون رباعي هيدروكسوزينيكاتي ، ويسمى الملح الذي يمكن عزله عن المحلول رباعي هيدروكسوكسينات الصوديوم. يدخل هيدروكسيد الصوديوم في تفاعلات مماثلة مع أكاسيد ميثوترية أخرى.)
- مع أكاسيد حمض - مع تشكيل الأملاح. تستخدم هذه الخاصية لتنظيف الانبعاثات الصناعية من الغازات الحمضية (على سبيل المثال: CO 2 و SO 2 و H 2 S):
2Na + + 2OH - + Cu 2+ + SO 4 2- → Cu (OH) 2 ↓ + Na 2 SO 4
يستخدم هيدروكسيد الصوديوم لترسيب هيدروكسيدات المعادن. على سبيل المثال ، يتم إنتاج هيدروكسيد الألومنيوم الشبيه بالهلام عن طريق العمل بهيدروكسيد الصوديوم على كبريتات الألومنيوم في محلول مائي. يتم استخدامه ، على وجه الخصوص ، لتنقية المياه من المعلقات الدقيقة.
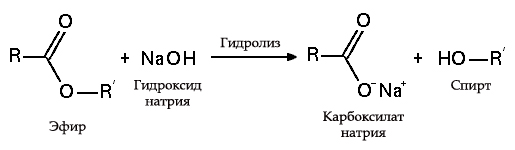
تحلل استرات
- مع الدهون (saponification) ، مثل هذا التفاعل لا رجعة فيه ، لأن الحمض الناتج مع القلويات يشكل الصابون والجلسرين. يتم استخراج الجلسرين في وقت لاحق من منصات الصابون عن طريق التبخر الفراغي وتنقية تقطير إضافية للمنتجات التي تم الحصول عليها. طريقة الحصول على الصابون هذه معروفة في الشرق الأوسط منذ القرن السابع:
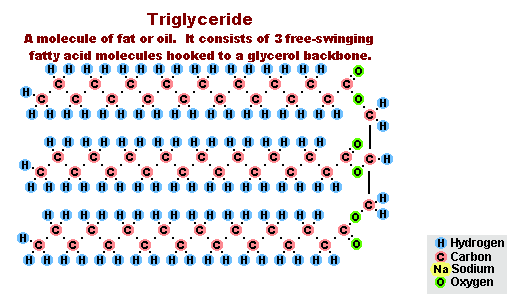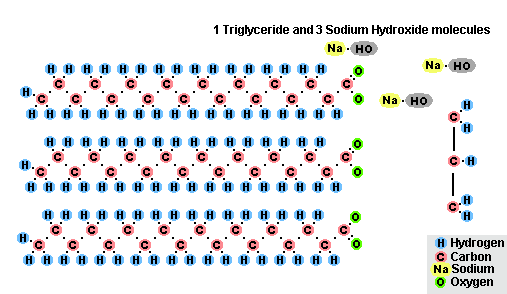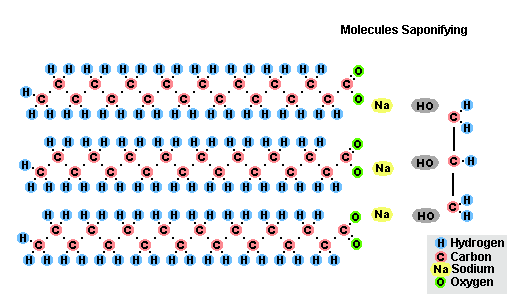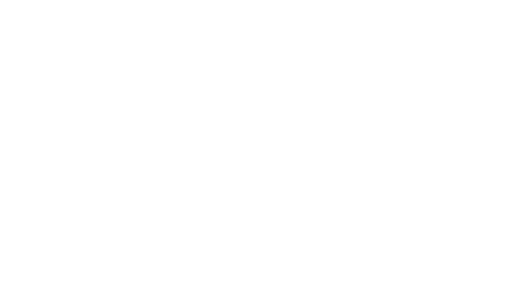
عملية التصاق الدهون
نتيجة لتفاعل الدهون مع هيدروكسيد الصوديوم ، يتم الحصول على صابون صلب (يتم استخدامه لإنتاج صابون بار) ، وهيدروكسيد البوتاسيوم ، إما صابون صلب أو سائل ، اعتمادًا على تكوين الدهون.
HO-CH 2 -CH 2 OH + 2NaOH → NaO-CH 2 -CH 2 -ONa + 2H 2 O
2NaCl + 2H 2 O \u003d H 2 + Cl 2 + 2NaOH ،في الوقت الحاضر ، يتم إنتاج القلويات الكاوية والكلور بواسطة ثلاث طرق كهروكيميائية. اثنان منهم التحليل الكهربائي مع الاسبستوس الصلب أو الكاثود البوليمر (الحجاب الحاجز وأساليب إنتاج الغشاء) ، والثالث هو التحليل الكهربائي مع الكاثود السائل (طريقة إنتاج الزئبق). من بين طرق الإنتاج الكهروكيميائية ، الطريقة الأسهل والأكثر ملاءمة هي التحليل الكهربائي باستخدام كاثود الزئبق ، ولكن هذه الطريقة تسبب أضرارًا كبيرة للبيئة نتيجة التبخر وتسرب الزئبق المعدني. طريقة إنتاج الغشاء هي الطريقة الأكثر فعالية والأقل كثافة في استخدام الطاقة والأكثر صديقة للبيئة ، ولكنها أيضًا الأكثر توجهاً ، على وجه الخصوص ، فهي تتطلب مواد أولية عالية النقاء.
القلوية الكاوية التي يتم الحصول عليها عن طريق التحليل الكهربائي باستخدام كاثود الزئبق السائل هي أنظف كثيرًا من تلك التي يتم الحصول عليها باستخدام طريقة الحجاب الحاجز. بالنسبة لبعض الصناعات ، هذا مهم. لذلك ، في إنتاج الألياف الصناعية ، لا يمكن استخدام سوى مادة كاوية يتم الحصول عليها عن طريق التحليل الكهربائي باستخدام كاثود الزئبق السائل. في الممارسة العالمية ، يتم استخدام الطرق الثلاثة لإنتاج الكلور والكاوية ، مع اتجاه واضح نحو زيادة نسبة التحليل الكهربائي للغشاء. في روسيا ، يتم إنتاج حوالي 35 ٪ من إجمالي المواد الكاوية المنتجة بواسطة التحليل الكهربائي باستخدام كاثود الزئبق و 65 ٪ عن طريق التحليل الكهربائي باستخدام كاثود صلب (طرق الغشاء والغشاء).
تُحسب كفاءة عملية الإنتاج ليس فقط من خلال إنتاجية الصودا الكاوية ، ولكن أيضًا عن طريق إنتاج الكلور والهيدروجين الناتج عن التحليل الكهربائي ، حيث تبلغ نسبة الكلور وهيدروكسيد الصوديوم عند الخرج 100/110 ، يستمر التفاعل في النسب التالية:
1.8 NaCl +0.5 H 2 O + 2.8 MJ \u003d 1.00 Cl 2 + 1.10 NaOH + 0.03 H 2،وترد في الجدول المؤشرات الرئيسية لطرق الإنتاج المختلفة:
| مؤشر 1 طن من هيدروكسيد الصوديوم | طريقة الزئبق | طريقة F- توقف | طريقة الغشاء |
|---|---|---|---|
| الكلور العائد ٪ | 97 | 96 | 98,5 |
| الكهرباء (كيلوواط ساعة) | 3 150 | 3 260 | 2 520 |
| تركيز هيدروكسيد الصوديوم | 50 | 12 | 35 |
| نقاء الكلور | 99,2 | 98 | 99,3 |
| نقاء الهيدروجين | 99,9 | 99,9 | 99,9 |
| جزء من كتلة O 2 في الكلور ، ٪ | 0,1 | 1-2 | 0,3 |
| جزء من كتلة الكلور - في هيدروكسيد الصوديوم ، ٪ | 0,003 | 1-1,2 | 0,005 |
مخطط تدفق عملية الكاثود الصلبة
طريقة F- توقف - ينقسم تجويف المحلل الكهربائي الكاثود الصلب عن طريق الحاجز المسامي - الحجاب الحاجز - إلى حيز الكاثود والأنود ، حيث يوجد الكاثود وأنوار المحلل الكهربائي على التوالي. لذلك ، غالبًا ما يطلق على هذا المحلل الكهربائي الحجاب الحاجز ، وتسمى طريقة الإنتاج بالتحليل الكهربائي للحجاب الحاجز. يدخل تيار anolyte المشبع باستمرار في مساحة الأنود للمحلل الكهربي للحجاب الحاجز. نتيجة للعملية الكهروكيميائية ، يتم إطلاق الكلور في الأنود بسبب تحلل الهاليت ، والهيدروجين عند الكاثود بسبب تحلل الماء. تتم إزالة الكلور والهيدروجين من الخلية بشكل منفصل ، دون خلط:
2Cl - - 2 البريد \u003d Cl 2 0 ، H 2 O - 2 البريد - 1/2 O 2 \u003d H 2.
في هذه الحالة ، يتم إثراء منطقة الكاثود بهيدروكسيد الصوديوم. يتم إزالة المحلول من منطقة الكاثود ، والذي يسمى القلوية الإلكتروليتية ، والذي يحتوي على أنوليت غير متحلل وهيدروكسيد الصوديوم ، بشكل مستمر من المحلل الكهربائي. في المرحلة التالية ، يتم تبخير القلويات الإلكتروليتية ويتم ضبط محتوى هيدروكسيد الصوديوم فيها إلى 42-50٪ وفقًا للمعيار. تترسب الهاليت وكبريتات الصوديوم بزيادة تركيز هيدروكسيد الصوديوم. يتم صب محلول من القلويات الكاوية من المادة المترسبة ونقلها كمنتج نهائي إلى المستودع أو إلى مرحلة التبخر للحصول على منتج صلب ، يتبعه ذوبان أو تحجيم أو تحبيب. يتم إرجاع الهاليت المتبلور (الملح العكسي) إلى التحليل الكهربائي ، وإعداد ما يسمى بالمحلول الملحي العكسي منه. يتم استخراج الكبريتات منه لتجنب تراكم الكبريتات في المحاليل قبل تحضير المحلول الملحي العكسي. يتم تعويض فقدان اللاوليت عن طريق إضافة محلول ملحي طازج ، يتم الحصول عليه عن طريق الرشح تحت الأرض لطبقات الملح أو عن طريق إذابة الهاليت الصلب. يتم تنظيف محلول ملحي طازج قبل مزجه مع محلول ملحي عكسي من المعلقات الميكانيكية وجزء كبير من أيونات الكالسيوم والمغنيسيوم. يتم فصل الكلور الناتج عن بخار الماء ، ويتم ضغطه وتغذيته إما لإنتاج المنتجات المحتوية على الكلور ، أو للتسييل.
طريقة الغشاء - على غرار الحجاب الحاجز ، ولكن يتم فصل الفراغات الأنودية والكاثودية بواسطة غشاء تبادل الموجبة. يوفر التحليل الكهربائي للغشاء أنظف كاوية.
مخطط التكنولوجية التحليل الكهربائي.المرحلة التكنولوجية الرئيسية هي التحليل الكهربائي ، والجهاز الرئيسي هو الحمام الكهربائي ، الذي يتكون من محلل كهربائي ، ومحلل ومضخة زئبقية ، متصلة ببعضها عن طريق الاتصالات. في الحمام الكهربائي ، يدور الزئبق تحت تأثير مضخة الزئبق ، ويمر عبر محلل كهربائي ومحلل. كاثود المحلل الكهربائي هو تيار من الزئبق. الأنودات - الجرافيت أو التآكل المنخفض. جنبا إلى جنب مع الزئبق ، يتدفق تيار anolyte - محلول هاليت - باستمرار من خلال المحلل الكهربائي. نتيجة للتحلل الكهروكيميائي للهاليت ، تتشكل أيونات الكلور على الأنود ويتم إطلاق الكلور:
2 Cl - - 2 البريد \u003d Cl 2 0 ،
الذي يتم تفريغه من المحلل الكهربائي ، وفي كاثود الزئبق ، يتم تشكيل محلول ضعيف من الصوديوم في الزئبق ، يسمى الملغم:
Na + + e \u003d Na 0 nN + + nHg - \u003d Na + Hgيتدفق الملغم باستمرار من الخلية إلى المتحلل. يتم تطهير المياه من الشوائب جيدًا بشكل مستمر أيضًا إلى جهاز التحلل. فيه ، ملغم الصوديوم ، نتيجة لعملية كهروكيميائية عفوية ، يتحلل بالكامل تقريبًا بواسطة الماء بتكوين الزئبق ، وهو محلول من المادة الكاوية والهيدروجينية:
Na + Hg + H 2 0 \u003d NaOH + 1 / 2H 2 + Hgلا يحتوي المحلول الكاوي الذي يتم الحصول عليه بهذه الطريقة ، وهو منتج تجاري ، على شوائب هاليت ضارة في إنتاج الفسكوز. يتم تحرير الزئبق بالكامل تقريبًا من ملغم الصوديوم ويعاد إلى الزنزانة. يتم تصريف الهيدروجين للعلاج. يتم إشباع الحليلة الخارجة من المحلول الكهربائي بالهروليت الطازج ، ويتم إزالة الشوائب التي يتم إدخالها به ، وكذلك غسلها من الأنودات والمواد الإنشائية ، وإعادتها إلى التحليل الكهربائي. قبل التشبع ، يتم استخراج الكلور المذاب فيه من المخدر في عملية من خطوتين أو ثلاث خطوات.
طرق الحصول على المختبر
في المختبر ، يتم الحصول على هيدروكسيد الصوديوم بطرق كيميائية تاريخية أكثر من كونها عملية.
الطريقة الجيرية الحصول على هيدروكسيد الصوديوم هو تفاعل محلول الصودا مع حليب الجير عند درجة حرارة حوالي 80 درجة مئوية. وتسمى هذه العملية التذويب ؛ يوصف بواسطة رد الفعل:
Na 2 C0 3 + Ca (OH) 2 \u003d 2NaOH + CaC0 3نتيجة للتفاعل ، يتم تشكيل محلول من هيدروكسيد الصوديوم وراسب من كربونات الكالسيوم. يتم فصل كربونات الكالسيوم عن المحلول الذي يتبخر للحصول على منتج منصهر يحتوي على حوالي 92٪ هيدروكسيد الصوديوم. يتم صب NaOH المنصهر في براميل حديدية ، حيث يصلب.
طريقة الحديدي وصفها اثنين من ردود الفعل:
Na 2 C0 3 + Fe 2 - 3 \u003d Na 2 - Fe 2 - 3 + C0 2 (1) Na 2 - Fe 2 - 3 -f H 2 0 \u003d 2 NaOH + Fe 2 O 3 (2)(1) - عملية التلبيد من رماد الصودا مع أكسيد الحديد عند درجة حرارة 1100-1200 درجة مئوية. في هذه الحالة ، يتم تشكيل فريت مواصفات الصوديوم وإطلاق ثاني أكسيد الكربون. بعد ذلك ، يتم معاملة الكعكة (ترشح) بالماء وفقًا لرد الفعل (2) ؛ يتم الحصول على محلول من هيدروكسيد الصوديوم وراسب Fe 2 O 3 ، والذي يعود بعد فصله عن المحلول إلى العملية. يحتوي الحل على حوالي 400 جم / لتر من هيدروكسيد الصوديوم. يتبخر للحصول على منتج يحتوي على حوالي 92 ٪ هيدروكسيد الصوديوم.
الطرق الكيميائية لإنتاج هيدروكسيد الصوديوم لها عيوب كبيرة: يتم استهلاك كمية كبيرة من الوقود ، والصودا الكاوية المنتجة ملوثة بالشوائب ، وصيانة الجهاز شاقة. حاليًا ، يتم استبدال هذه الطرق تقريبًا بالكامل بالطريقة الكهروكيميائية للإنتاج.
سوق الصودا الكاوية
الإنتاج العالمي من الصودا الكاوية ، 2005| الشركة المصنعة | حجم الإنتاج ، مليون طن | حصة في الإنتاج العالمي |
|---|---|---|
| DOW | 6.363 | 11.1 |
| شركة اوكسيدنتال الكيميائية | 2.552 | 4.4 |
| البلاستيك فورموزا | 2.016 | 3.5 |
| PPG | 1.684 | 2.9 |
| باير ل | 1.507 | 2.6 |
| أكزو نوبل | 1.157 | 2.0 |
| TOSOH | 1.110 | 1.9 |
| ARKEMA | 1.049 | 1.8 |
| أولين | 0.970 | 1.7 |
| روسيا | 1.290 | 2.24 |
| الصين | 9.138 | 15.88 |
| آخر | 27.559 | 47,87 |
| المجموع: | 57,541 | 100 |
TP - الزئبق الصلب (قشاري) ؛
TD - الحجاب الحاجز الصلب (تنصهر) ؛
PP - محلول الزئبق ؛
محلول كيميائي
RD - حل الحجاب الحاجز.
| اسم المؤشر | TR OKP 21 3211 0400 | TD OKP 21 3212 0200 | RR OKP 21 3211 0100 | PX 1 الصف OKP 21 3221 0530 | PX 2 درجة OKP 21 3221 0540 | RD أعلى درجة OKP 21 3212 0320 | RD الصف الأول OKP 21 3212 0330 |
|---|---|---|---|---|---|---|---|
| مظهر | كتلة بيضاء متقشرة. التلوين طفيف المسموح بها | الكتلة المنصهرة بيضاء. التلوين طفيف المسموح بها | سائل عديم اللون واضح | سائل عديم اللون أو ملون. ترسيب متبل يسمح | سائل عديم اللون أو ملون. ترسيب متبل يسمح | سائل عديم اللون أو ملون. ترسيب متبل يسمح | |
| جزء من كتلة هيدروكسيد الصوديوم ، ٪ ، وليس أقل | 98,5 | 94,0 | 42,0 | 45,5 | 43,0 | 46,0 | 44,0 |
| اسم المؤسسة | 2005 الف طن | 2006 الف طن | حصة في 2005 ٪ | حصة في 2006 ٪ |
|---|---|---|---|---|
| OJSC الكاوية Sterlitamak | 239 | 249 | 20 | 20 |
| OJSC "الكاوية" ، فولغوغراد | 210 | 216 | 18 | 18 |
| Sayanskkhimplast OJSC | 129 | 111 | 11 | 9 |
| LLC Usoliekhimprom | 84 | 99 | 7 | 8 |
| سيبور-نفتخيم | 87 | 92 | 7 | 8 |
| OJSC "كيمبروم" ، تشيبوكساري | 82 | 92 | 7 | 8 |
| VOAO خيمبروم ، فولغوغراد | 87 | 90 | 7 | 7 |
| CJSC Ilimkhimprom | 70 | 84 | 6 | 7 |
| KCHKhK OJSC | 81 | 79 | 7 | 6 |
| NAC "النتروجين" | 73 | 61 | 6 | 5 |
| كيمبروم OJSC ، كيميروفو | 42 | 44 | 4 | 4 |
| المجموع: | 1184 | 1217 | 100 | 100 |
| اسم المؤسسة | 2005 طن | 2006 طن | حصة في 2005 ٪ | حصة في 2006 ٪ |
|---|---|---|---|---|
| OJSC "الكاوية" ، فولغوغراد | 67504 | 63510 | 62 | 60 |
| OJSC الكاوية Sterlitamak | 34105 | 34761 | 31 | 33 |
| سيبور-نفتخيم | 1279 | 833 | 1 | 1 |
| VOAO خيمبروم ، فولغوغراد | 5768 | 7115 | 5 | 7 |
| المجموع: | 108565 | 106219 | 100 | 100 |
تطبيق
وقود الديزل الحيوي

سمك القد Lutefisk في الاحتفال بيوم الدستور في النرويج

الخبز الألماني
الصودا الكاوية يتم استخدامه في مجموعة واسعة من الصناعات وللاحتياجات المحلية:
- يستخدم الكاوية في صناعة اللب والورق لإزالة التشوه (Kraft Reaction) من السليلوز ، في إنتاج الورق والكرتون والألياف الصناعية والألواح الليفية ،
- ل saponification من الدهون مع إنتاج الصابون والشامبو والمنظفات الأخرى. في العصور القديمة ، تم إضافة الرماد إلى الماء أثناء الغسيل ، وعلى ما يبدو ، لاحظت ربات البيوت أنه إذا كان الرماد يحتوي على الدهون التي دخلت الموقد أثناء الطهي ، يتم غسل الأطباق جيدًا. تم ذكر مهنة صانع الصابون (saponarius) لأول مرة حوالي عام 385 م. ه. ثيودور بريشيانوس. كان العرب يصنعون الصابون من الزيوت والصودا منذ القرن السابع ؛ واليوم ، يتم إنتاج الصابون بالطريقة نفسها التي كانت تنتج منذ 10 قرون.
- ال الصناعات الكيماوية - لتحييد الأحماض وأكاسيد الحمض ، كبدلات كاشف أو فينيل أو مطاطي.
MAC من هيدروكسيد الصوديوم في الهواء 0.5 مجم / متر مكعب.
أدب
- التكنولوجيا الكيميائية العامة. إد. آي. موكلينوفا. كتاب مدرسي للتخصصات الكيميائية والتكنولوجية للجامعات. - م: المدرسة الثانوية.
- أساسيات الكيمياء العامة ، المجلد 3 ، B.V. Nekrasov. - م: الكيمياء ، 1970.
- التكنولوجيا الكيميائية العامة. فورمر آي ، زايتسيف في.ن.م.: المدرسة العليا ، 1978.
- قرار من وزارة الصحة بالاتحاد الروسي بتاريخ 28 مارس 2003 N 126 "بناءً على قائمة عوامل الإنتاج الضارة التي يوصى باستخدام الحليب أو غيرها من المنتجات الغذائية المكافئة لأغراض وقائية".
- قرار كبير أطباء الصحة بالاتحاد الروسي المؤرخ 4 أبريل 2003 N 32 "بشأن سن القواعد الصحية لتنظيم نقل البضائع بالسكك الحديدية. SP 2.5.1250-03 ".
- القانون الاتحادي المؤرخ 21 يوليو 1997 N 116-ФЗ "بشأن السلامة الصناعية لمرافق الإنتاج الخطرة" (بصيغته المعدلة في 18 ديسمبر 2006).
- قرار من وزارة الموارد الطبيعية بالاتحاد الروسي مؤرخ في 2 ديسمبر 2002 رقم 786 "بشأن الموافقة على كتالوج التصنيف الفيدرالي للنفايات" (بصيغته المعدلة والمكملة في 30 يوليو 2003).
- مرسوم لجنة الدولة لاتحاد الجمهوريات الاشتراكية السوفياتية المؤرخة 10.25.1974 N 298 / P-22 "بشأن الموافقة على قائمة الصناعات والمتاجر والمهن والمناصب ذات ظروف العمل الضارة ، العمل الذي يمنح الحق في إجازة إضافية وساعات العمل المختصرة" (بصيغته المعدلة في 29 مايو 1991 ).
- مرسوم وزارة العمل الروسية المؤرخ 22 يوليو 1999 N 26 "بشأن الموافقة على معايير الصناعة القياسية للإصدار المجاني للملابس الخاصة والأحذية الخاصة وغيرها من معدات الوقاية الشخصية للعاملين في الصناعات الكيميائية".
- قرار كبير أطباء الصحة في الاتحاد الروسي بتاريخ 05.30.2003 N 116 بشأن سن GN 2.1.6.1339-03 "مستويات التعرض الآمنة الإرشادية (SEC) للملوثات في الهواء الجوي للمناطق المأهولة بالسكان." (بصيغته المعدلة في 3 نوفمبر 2005). قاموس موسوعي مصور
هيدروكسيد الصوديوم - (الصودا الكاوية ، الصودا الكاوية ، الكاوية) هيدروكسيد الصوديوم مادة بلورية صلبة عديمة اللون ، الكثافة 2130 كجم م ؛ ر \u003d 320 درجة مئوية ؛ عندما يذوب في الماء ، يتم إطلاق كمية كبيرة من الحرارة ؛ تأثير مدمر على الجلد ، الأنسجة ، الورق ، خطير ... ... موسوعة الفنون التطبيقية الكبيرة
- (الصودا الكاوية ، الصودا الكاوية) ، هيدروكسيد الصوديوم ، قاعدة قوية (القلوية). بلورات عديمة اللون (تقنية المنتج كتلة بيضاء مبهمة). استرطابي ، قابل للذوبان في الماء ، والإفراج عن كمية كبيرة من الحرارة. تلقي عن طريق التحليل الكهربائي للحل ... القاموس الموسوعي
هيدروكسيد الصوديوم - natrio hidroksidas statusas T sritis chemija formulė NaOH atitikmenys: angl. الصودا الكاوية. هيدروكسيد الصوديوم روس. الحارقات. الصودا الكاوية. هيدروكسيد الصوديوم ryšiai هيدروكسيد الصوديوم: sinonimas - natrio šarmas sinonimas - kaustinė soda ... Chemijos terminų aiškinamasis žodynas
- (الصودا الكاوية ، الصودا الكاوية) ، هيدروكسيد الصوديوم ، قاعدة قوية (القلوية). Bestsv. بلورات (التكنولوجيا. المنتج كتلة بيضاء مبهمة). استرطابي ، قابل للذوبان في الماء ، والإفراج عن كمية كبيرة من الحرارة. تلقي عن طريق التحليل الكهربائي من محلول كلوريد الصوديوم ... التاريخ الطبيعي. القاموس الموسوعي
- (الصودا الكاوية) هيدروكسيد الصوديوم ، عديم اللون. بلورات. يصل إلى 299 درجة مئوية المعينية مستقرة. تعديل (أ \u003d 0.33994 نانومتر ، ج \u003d 1.1377 نانومتر) ، أعلى من 299 س أحادي الميل ؛ DH0 الانتقال متعدد الأشكال 5.85 كيلو جول / مول ؛ ر. 323 درجة مئوية ، ر. 1403 درجة مئوية ؛ ضيق. 2.02 جم / سم 3 ؛ ... الموسوعة الكيميائية
الصودا الكاوية ، الكاوية ، هيدروكسيد الصوديوم عديم اللون البلورية. كتلة، بإحكام. 2130 كجم / م 3 ، رر 320 درجة مئوية ، الذوبان في الماء 52.2 ٪ (عند 20 درجة مئوية). قاعدة قوية ، والأضرار التي لحقت الأنسجة الحيوانية. من الخطر بشكل خاص وضع قطرات N. في العيون ... ... قاموس الموسوعي الكبير للفنون التطبيقية
قلوي قوي ، يستخدم على نطاق واسع كعامل تطهير. عندما يدخل هيدروكسيد الصوديوم سطح الجلد ، فإنه يسبب حروقًا كيميائية شديدة ؛ في هذه الحالة ، اغسل المنطقة المصابة فورًا بعدد كبير من الجلد ... ... المصطلحات الطبية
هيدروكسيد الصوديوم ، الصودا الكاوية - (صودا كاوية) قلوية قوية ، تستخدم على نطاق واسع كعامل تنظيف. عندما يدخل هيدروكسيد الصوديوم سطح الجلد ، فإنه يسبب حروقًا كيميائية شديدة ؛ في هذه الحالة ، اغسل فوراً المنطقة المصابة من الجلد ... ... قاموس توضيحي للطب
كل من هيدروكسيد الصوديوم والقلويات الأخرى ، يرجع اسم "القلويات الكاوية" إلى القدرة على تآكل الجلد والورق والزجاج والتسبب في حروق شديدة. حتى القرن السابع عشر ، القلوي (الاب. فلز قلوي) كانت تسمى أيضا كربونات الصوديوم والبوتاسيوم. بالفرنسية ، ميز العالم أ. ل. دوهاميل دو مونسو أولاً بين هذه المواد: أصبح هيدروكسيد الصوديوم معروفًا باسم الصودا الكاوية ، وكربونات الصوديوم مثل رماد الصودا (من نبات سالسولا الصودا ، الذي استخرج منه) ، وكربونات البوتاسيوم. حاليا ، تسمى الصودا أملاح الصوديوم من حمض الكربونيك. في الإنجليزية والفرنسية ، تعني كلمة الصوديوم الصوديوم والبوتاسيوم - البوتاسيوم.
الخصائص الفيزيائية
هيدروكسيد الصوديوم
الديناميكا الحرارية للحلول
Δ ح 0 انحلال المحلول المائي المخفف بشكل غير محدود لـ -44.45 kJ / mol.
تبلور أحادي الهيدرات (syngonium المعيني) من المحاليل المائية عند 12.3 - 61.8 درجة مئوية ، نقطة انصهار 65.1 درجة مئوية ؛ الكثافة 1.829 جم / سم مكعب ؛ 0H 0 arr 34734.96 kJ / mol ، في المدى من -28 إلى -24 درجة مئوية - heptahydrate ، من -24 إلى -17.7 درجة مئوية - خماسي الهيدرات ، من -17.7 إلى -5.4 ° С - رباعي هيدرات ( تعديل α) ، من -5.4 إلى 12.3 درجة مئوية. الذوبان في الميثانول هو 23.6 جم / لتر (ر \u003d 28 درجة مئوية) ، في الإيثانول 14.7 جم / لتر (ر \u003d 28 درجة مئوية). NaOH · 3.5H 2 O (نقطة الانصهار 15.5 درجة مئوية) ؛
الخواص الكيميائية
(بشكل عام ، يمكن تمثيل هذا التفاعل بمعادلة أيونية بسيطة ، يبدأ التفاعل بإطلاق الحرارة (تفاعل طارد للحرارة): OH - + H 3 O + → 2H 2 O.)
- مع أكاسيد مذبذبة لها خصائص أساسية وحمضية ، وقدرة على التفاعل مع القلويات ، مثل السبائك الصلبة:
ZnO + 2NaOH → Na 2 ZnO 2 + H 2 O
لذلك مع الحلول:
ZnO + 2NaOH (محلول) + H 2 O → Na 2 (محلول)+ ح 2
(يطلق على الأنيون الناتج أيون رباعي هيدروكسوزينيكاتي ، ويسمى الملح الذي يمكن عزله عن المحلول رباعي هيدروكسوكسينات الصوديوم. يدخل هيدروكسيد الصوديوم في تفاعلات مماثلة مع أكاسيد ميثوترية أخرى.)
- مع أكاسيد حمض - مع تشكيل الأملاح. تستخدم هذه الخاصية لتنظيف الانبعاثات الصناعية من الغازات الحمضية (على سبيل المثال: CO 2 و SO 2 و H 2 S):
2Na + + 2OH - + Cu 2+ + SO 4 2- → Cu (OH) 2 ↓ + Na 2 SO 4
يستخدم هيدروكسيد الصوديوم لترسيب هيدروكسيدات المعادن. على سبيل المثال ، يتم إنتاج هيدروكسيد الألومنيوم الشبيه بالهلام عن طريق العمل بهيدروكسيد الصوديوم على كبريتات الألومنيوم في محلول مائي. يتم استخدامه ، على وجه الخصوص ، لتنقية المياه من المعلقات الدقيقة.

تحلل استرات
- مع الدهون (saponification) ، مثل هذا التفاعل لا رجعة فيه ، لأن الحمض الناتج مع القلويات يشكل الصابون والجلسرين. يتم استخراج الجلسرين في وقت لاحق من منصات الصابون عن طريق التبخر الفراغي وتنقية تقطير إضافية للمنتجات التي تم الحصول عليها. طريقة الحصول على الصابون هذه معروفة في الشرق الأوسط منذ القرن السابع:

عملية التصاق الدهون
نتيجة لتفاعل الدهون مع هيدروكسيد الصوديوم ، يتم الحصول على صابون صلب (يتم استخدامه لإنتاج صابون بار) ، وهيدروكسيد البوتاسيوم ، إما صابون صلب أو سائل ، اعتمادًا على تكوين الدهون.
HO-CH 2 -CH 2 OH + 2NaOH → NaO-CH 2 -CH 2 -ONa + 2H 2 O
2NaCl + 2H 2 O \u003d H 2 + Cl 2 + 2NaOH ،في الوقت الحاضر ، يتم إنتاج القلويات الكاوية والكلور بواسطة ثلاث طرق كهروكيميائية. اثنان منهم التحليل الكهربائي مع الاسبستوس الصلب أو الكاثود البوليمر (الحجاب الحاجز وأساليب إنتاج الغشاء) ، والثالث هو التحليل الكهربائي مع الكاثود السائل (طريقة إنتاج الزئبق). من بين طرق الإنتاج الكهروكيميائية ، الطريقة الأسهل والأكثر ملاءمة هي التحليل الكهربائي باستخدام كاثود الزئبق ، ولكن هذه الطريقة تسبب أضرارًا كبيرة للبيئة نتيجة التبخر وتسرب الزئبق المعدني. طريقة إنتاج الغشاء هي الطريقة الأكثر فعالية والأقل كثافة في استخدام الطاقة والأكثر صديقة للبيئة ، ولكنها أيضًا الأكثر توجهاً ، على وجه الخصوص ، فهي تتطلب مواد أولية عالية النقاء.
القلوية الكاوية التي يتم الحصول عليها عن طريق التحليل الكهربائي باستخدام كاثود الزئبق السائل هي أنظف كثيرًا من تلك التي يتم الحصول عليها باستخدام طريقة الحجاب الحاجز. بالنسبة لبعض الصناعات ، هذا مهم. لذلك ، في إنتاج الألياف الصناعية ، لا يمكن استخدام سوى مادة كاوية يتم الحصول عليها عن طريق التحليل الكهربائي باستخدام كاثود الزئبق السائل. في الممارسة العالمية ، يتم استخدام الطرق الثلاثة لإنتاج الكلور والكاوية ، مع اتجاه واضح نحو زيادة نسبة التحليل الكهربائي للغشاء. في روسيا ، يتم إنتاج حوالي 35 ٪ من إجمالي المواد الكاوية المنتجة بواسطة التحليل الكهربائي باستخدام كاثود الزئبق و 65 ٪ عن طريق التحليل الكهربائي باستخدام كاثود صلب (طرق الغشاء والغشاء).
تُحسب كفاءة عملية الإنتاج ليس فقط من خلال إنتاجية الصودا الكاوية ، ولكن أيضًا عن طريق إنتاج الكلور والهيدروجين الناتج عن التحليل الكهربائي ، حيث تبلغ نسبة الكلور وهيدروكسيد الصوديوم عند الخرج 100/110 ، يستمر التفاعل في النسب التالية:
1.8 NaCl +0.5 H 2 O + 2.8 MJ \u003d 1.00 Cl 2 + 1.10 NaOH + 0.03 H 2،وترد في الجدول المؤشرات الرئيسية لطرق الإنتاج المختلفة:
| مؤشر 1 طن من هيدروكسيد الصوديوم | طريقة الزئبق | طريقة F- توقف | طريقة الغشاء |
|---|---|---|---|
| الكلور العائد ٪ | 97 | 96 | 98,5 |
| الكهرباء (كيلوواط ساعة) | 3 150 | 3 260 | 2 520 |
| تركيز هيدروكسيد الصوديوم | 50 | 12 | 35 |
| نقاء الكلور | 99,2 | 98 | 99,3 |
| نقاء الهيدروجين | 99,9 | 99,9 | 99,9 |
| جزء من كتلة O 2 في الكلور ، ٪ | 0,1 | 1-2 | 0,3 |
| جزء من كتلة الكلور - في هيدروكسيد الصوديوم ، ٪ | 0,003 | 1-1,2 | 0,005 |
مخطط تدفق عملية الكاثود الصلبة
طريقة F- توقف - ينقسم تجويف المحلل الكهربائي الكاثود الصلب عن طريق الحاجز المسامي - الحجاب الحاجز - إلى حيز الكاثود والأنود ، حيث يوجد الكاثود وأنوار المحلل الكهربائي على التوالي. لذلك ، غالبًا ما يطلق على هذا المحلل الكهربائي الحجاب الحاجز ، وتسمى طريقة الإنتاج بالتحليل الكهربائي للحجاب الحاجز. يدخل تيار anolyte المشبع باستمرار في مساحة الأنود للمحلل الكهربي للحجاب الحاجز. نتيجة للعملية الكهروكيميائية ، يتم إطلاق الكلور في الأنود بسبب تحلل الهاليت ، والهيدروجين عند الكاثود بسبب تحلل الماء. تتم إزالة الكلور والهيدروجين من الخلية بشكل منفصل ، دون خلط:
2Cl - - 2 البريد \u003d Cl 2 0 ، H 2 O - 2 البريد - 1/2 O 2 \u003d H 2.
في هذه الحالة ، يتم إثراء منطقة الكاثود بهيدروكسيد الصوديوم. يتم إزالة المحلول من منطقة الكاثود ، والذي يسمى القلوية الإلكتروليتية ، والذي يحتوي على أنوليت غير متحلل وهيدروكسيد الصوديوم ، بشكل مستمر من المحلل الكهربائي. في المرحلة التالية ، يتم تبخير القلويات الإلكتروليتية ويتم ضبط محتوى هيدروكسيد الصوديوم فيها إلى 42-50٪ وفقًا للمعيار. تترسب الهاليت وكبريتات الصوديوم بزيادة تركيز هيدروكسيد الصوديوم. يتم صب محلول من القلويات الكاوية من المادة المترسبة ونقلها كمنتج نهائي إلى المستودع أو إلى مرحلة التبخر للحصول على منتج صلب ، يتبعه ذوبان أو تحجيم أو تحبيب. يتم إرجاع الهاليت المتبلور (الملح العكسي) إلى التحليل الكهربائي ، وإعداد ما يسمى بالمحلول الملحي العكسي منه. يتم استخراج الكبريتات منه لتجنب تراكم الكبريتات في المحاليل قبل تحضير المحلول الملحي العكسي. يتم تعويض فقدان اللاوليت عن طريق إضافة محلول ملحي طازج ، يتم الحصول عليه عن طريق الرشح تحت الأرض لطبقات الملح أو عن طريق إذابة الهاليت الصلب. يتم تنظيف محلول ملحي طازج قبل مزجه مع محلول ملحي عكسي من المعلقات الميكانيكية وجزء كبير من أيونات الكالسيوم والمغنيسيوم. يتم فصل الكلور الناتج عن بخار الماء ، ويتم ضغطه وتغذيته إما لإنتاج المنتجات المحتوية على الكلور ، أو للتسييل.
طريقة الغشاء - على غرار الحجاب الحاجز ، ولكن يتم فصل الفراغات الأنودية والكاثودية بواسطة غشاء تبادل الموجبة. يوفر التحليل الكهربائي للغشاء أنظف كاوية.
مخطط التكنولوجية التحليل الكهربائي.المرحلة التكنولوجية الرئيسية هي التحليل الكهربائي ، والجهاز الرئيسي هو الحمام الكهربائي ، الذي يتكون من محلل كهربائي ، ومحلل ومضخة زئبقية ، متصلة ببعضها عن طريق الاتصالات. في الحمام الكهربائي ، يدور الزئبق تحت تأثير مضخة الزئبق ، ويمر عبر محلل كهربائي ومحلل. كاثود المحلل الكهربائي هو تيار من الزئبق. الأنودات - الجرافيت أو التآكل المنخفض. جنبا إلى جنب مع الزئبق ، يتدفق تيار anolyte - محلول هاليت - باستمرار من خلال المحلل الكهربائي. نتيجة للتحلل الكهروكيميائي للهاليت ، تتشكل أيونات الكلور على الأنود ويتم إطلاق الكلور:
2 Cl - - 2 البريد \u003d Cl 2 0 ،
الذي يتم تفريغه من المحلل الكهربائي ، وفي كاثود الزئبق ، يتم تشكيل محلول ضعيف من الصوديوم في الزئبق ، يسمى الملغم:
Na + + e \u003d Na 0 nN + + nHg - \u003d Na + Hgيتدفق الملغم باستمرار من الخلية إلى المتحلل. يتم تطهير المياه من الشوائب جيدًا بشكل مستمر أيضًا إلى جهاز التحلل. فيه ، ملغم الصوديوم ، نتيجة لعملية كهروكيميائية عفوية ، يتحلل بالكامل تقريبًا بواسطة الماء بتكوين الزئبق ، وهو محلول من المادة الكاوية والهيدروجينية:
Na + Hg + H 2 0 \u003d NaOH + 1 / 2H 2 + Hgلا يحتوي المحلول الكاوي الذي يتم الحصول عليه بهذه الطريقة ، وهو منتج تجاري ، على شوائب هاليت ضارة في إنتاج الفسكوز. يتم تحرير الزئبق بالكامل تقريبًا من ملغم الصوديوم ويعاد إلى الزنزانة. يتم تصريف الهيدروجين للعلاج. يتم إشباع الحليلة الخارجة من المحلول الكهربائي بالهروليت الطازج ، ويتم إزالة الشوائب التي يتم إدخالها به ، وكذلك غسلها من الأنودات والمواد الإنشائية ، وإعادتها إلى التحليل الكهربائي. قبل التشبع ، يتم استخراج الكلور المذاب فيه من المخدر في عملية من خطوتين أو ثلاث خطوات.
طرق الحصول على المختبر
في المختبر ، يتم الحصول على هيدروكسيد الصوديوم بطرق كيميائية تاريخية أكثر من كونها عملية.
الطريقة الجيرية الحصول على هيدروكسيد الصوديوم هو تفاعل محلول الصودا مع حليب الجير عند درجة حرارة حوالي 80 درجة مئوية. وتسمى هذه العملية التذويب ؛ يوصف بواسطة رد الفعل:
Na 2 C0 3 + Ca (OH) 2 \u003d 2NaOH + CaC0 3نتيجة للتفاعل ، يتم تشكيل محلول من هيدروكسيد الصوديوم وراسب من كربونات الكالسيوم. يتم فصل كربونات الكالسيوم عن المحلول الذي يتبخر للحصول على منتج منصهر يحتوي على حوالي 92٪ هيدروكسيد الصوديوم. يتم صب NaOH المنصهر في براميل حديدية ، حيث يصلب.
طريقة الحديدي وصفها اثنين من ردود الفعل:
Na 2 C0 3 + Fe 2 - 3 \u003d Na 2 - Fe 2 - 3 + C0 2 (1) Na 2 - Fe 2 - 3 -f H 2 0 \u003d 2 NaOH + Fe 2 O 3 (2)(1) - عملية التلبيد من رماد الصودا مع أكسيد الحديد عند درجة حرارة 1100-1200 درجة مئوية. في هذه الحالة ، يتم تشكيل فريت مواصفات الصوديوم وإطلاق ثاني أكسيد الكربون. بعد ذلك ، يتم معاملة الكعكة (ترشح) بالماء وفقًا لرد الفعل (2) ؛ يتم الحصول على محلول من هيدروكسيد الصوديوم وراسب Fe 2 O 3 ، والذي يعود بعد فصله عن المحلول إلى العملية. يحتوي الحل على حوالي 400 جم / لتر من هيدروكسيد الصوديوم. يتبخر للحصول على منتج يحتوي على حوالي 92 ٪ هيدروكسيد الصوديوم.
الطرق الكيميائية لإنتاج هيدروكسيد الصوديوم لها عيوب كبيرة: يتم استهلاك كمية كبيرة من الوقود ، والصودا الكاوية المنتجة ملوثة بالشوائب ، وصيانة الجهاز شاقة. حاليًا ، يتم استبدال هذه الطرق تقريبًا بالكامل بالطريقة الكهروكيميائية للإنتاج.
سوق الصودا الكاوية
الإنتاج العالمي من الصودا الكاوية ، 2005| الشركة المصنعة | حجم الإنتاج ، مليون طن | حصة في الإنتاج العالمي |
|---|---|---|
| DOW | 6.363 | 11.1 |
| شركة اوكسيدنتال الكيميائية | 2.552 | 4.4 |
| البلاستيك فورموزا | 2.016 | 3.5 |
| PPG | 1.684 | 2.9 |
| باير ل | 1.507 | 2.6 |
| أكزو نوبل | 1.157 | 2.0 |
| TOSOH | 1.110 | 1.9 |
| ARKEMA | 1.049 | 1.8 |
| أولين | 0.970 | 1.7 |
| روسيا | 1.290 | 2.24 |
| الصين | 9.138 | 15.88 |
| آخر | 27.559 | 47,87 |
| المجموع: | 57,541 | 100 |
TP - الزئبق الصلب (قشاري) ؛
TD - الحجاب الحاجز الصلب (تنصهر) ؛
PP - محلول الزئبق ؛
محلول كيميائي
RD - حل الحجاب الحاجز.
| اسم المؤشر | TR OKP 21 3211 0400 | TD OKP 21 3212 0200 | RR OKP 21 3211 0100 | PX 1 الصف OKP 21 3221 0530 | PX 2 درجة OKP 21 3221 0540 | RD أعلى درجة OKP 21 3212 0320 | RD الصف الأول OKP 21 3212 0330 |
|---|---|---|---|---|---|---|---|
| مظهر | كتلة بيضاء متقشرة. التلوين طفيف المسموح بها | الكتلة المنصهرة بيضاء. التلوين طفيف المسموح بها | سائل عديم اللون واضح | سائل عديم اللون أو ملون. ترسيب متبل يسمح | سائل عديم اللون أو ملون. ترسيب متبل يسمح | سائل عديم اللون أو ملون. ترسيب متبل يسمح | |
| جزء من كتلة هيدروكسيد الصوديوم ، ٪ ، وليس أقل | 98,5 | 94,0 | 42,0 | 45,5 | 43,0 | 46,0 | 44,0 |
| اسم المؤسسة | 2005 الف طن | 2006 الف طن | حصة في 2005 ٪ | حصة في 2006 ٪ |
|---|---|---|---|---|
| OJSC الكاوية Sterlitamak | 239 | 249 | 20 | 20 |
| OJSC "الكاوية" ، فولغوغراد | 210 | 216 | 18 | 18 |
| Sayanskkhimplast OJSC | 129 | 111 | 11 | 9 |
| LLC Usoliekhimprom | 84 | 99 | 7 | 8 |
| سيبور-نفتخيم | 87 | 92 | 7 | 8 |
| OJSC "كيمبروم" ، تشيبوكساري | 82 | 92 | 7 | 8 |
| VOAO خيمبروم ، فولغوغراد | 87 | 90 | 7 | 7 |
| CJSC Ilimkhimprom | 70 | 84 | 6 | 7 |
| KCHKhK OJSC | 81 | 79 | 7 | 6 |
| NAC "النتروجين" | 73 | 61 | 6 | 5 |
| كيمبروم OJSC ، كيميروفو | 42 | 44 | 4 | 4 |
| المجموع: | 1184 | 1217 | 100 | 100 |
| اسم المؤسسة | 2005 طن | 2006 طن | حصة في 2005 ٪ | حصة في 2006 ٪ |
|---|---|---|---|---|
| OJSC "الكاوية" ، فولغوغراد | 67504 | 63510 | 62 | 60 |
| OJSC الكاوية Sterlitamak | 34105 | 34761 | 31 | 33 |
| سيبور-نفتخيم | 1279 | 833 | 1 | 1 |
| VOAO خيمبروم ، فولغوغراد | 5768 | 7115 | 5 | 7 |
| المجموع: | 108565 | 106219 | 100 | 100 |
تطبيق
وقود الديزل الحيوي

سمك القد Lutefisk في الاحتفال بيوم الدستور في النرويج


