27.07.2019
1 المعادن القلوية. انت تعرف كيف
ملخص لدرس الكيمياء في الصف التاسع حول هذا الموضوع:
"المركبات المعدنية القلوية واستخدامها."
أهداف: لتعميم وتنظيم المعرفة حول المعادن القلوية ومركباتها ؛ تعرف على استخدام هذه المركبات في الحياة اليومية والإنتاج ، وأهميتها في حياة الكائنات الحية
أهداف الدرس:
1. التأكد خلال الدرس من استيعاب الخواص الكيميائية للمركبات المعدنية القلوية ، واستخدامها في الحياة اليومية والإنتاج ، وأهميتها في حياة الكائنات الحية.
الاستمرار في تطوير مهارات الكواشف التعليمية والكيميائية العامة.
2. تكوين الأفكار الفلسفية الأساسية للعلاقات بين السبب والنتيجة بين الظواهر ، وهيكل ذرة فلزية قلوية - خواص مادة بسيطة - خواص مركبات الفلزات القلوية وتطبيقها على أساس الخواص.
3. قم بتطوير القدرة على مقارنة الحقائق المدروسة وتلخيصها والتعبير عن أفكارك بطريقة منطقية عند الإجابة. لتطوير الاهتمام المعرفي لأطفال المدارس ، وذلك باستخدام بيانات عن تطبيق الظواهر المدروسة في الحياة.
نوع الدرس: مجتمعة - دراسة مواد جديدة باستخدام تكنولوجيا المعلومات والاتصالات.
معدات: كتاب مدرسي ، طباشير ، سبورة ، كمبيوتر ، جهاز عرض وسائط ، شاشة ، عرض موضوع الدرس ، مخططات تدفق الدرس للطلاب ، المواد الكيميائية (الحلول: هيدروكسيد الصوديوم ، حمض الهيدروكلوريك ، سلفات النحاس ، هيدروكسيد الزنك ، الفينول فثالين) والأواني الزجاجية للمختبر (رف أنبوب اختبار).
إجراءات
أنا لحظة التنظيمية.
II . تعلم مواد جديدة.
1. التحقق من المواد التي سبق دراستها حول موضوع "المعادن القلوية".
تخمين الألغاز:
1. عادة ما يخزنون في الكيروسين ، وهو يعمل على الماء ،
في الطبيعة ، تذكر الآن ،
مجاني غير موجود في أي مكان
من الممكن فتحه في الأملاح
تتحول النيران إلى اللون الأصفر منه
ويمكنك الحصول عليها من الملح
كيف حصلت ديفي عليه.
ما العنصر الذي نتحدث عنه؟ (نا)
2. إنه يجبر بقوة على الخروج
من الرطوبة - الهيدروجين النقي ،
يحل محله
ويحوك بحزم الأكسجين.
هذا العنصر في النباتات مخفي
بواسطة اللون البنفسجي
قد يكون مفتوحا في الأملاح.
ما العنصر الذي نتحدث عنه؟ (K).
1. ما المعادن التي التقينا بها في الدرس الأخير؟
2. لماذا يسمون ذلك؟
3. ما هي السمة المشتركة في تركيب ذرات جميع الفلزات القلوية؟
اختبار ذات الصلة: المعادن القلوية.
1. لا ينطبق على المعادن القلوية: أ) الروبيديوم ؛ ج) البوتاسيوم ب) السيزيوم ؛ د) النحاس.
2. الصيغة الإلكترونية) 2) 8) 8) 1 يتوافق مع العنصر: أ) الليثيوم. ج) البوتاسيوم ب) الصوديوم
3. نصف القطر الذري لعناصر المجموعة الأولى من المجموعة الفرعية الرئيسية مع زيادة الشحنة النووية:
أ) التغييرات بشكل دوري ؛ ج) لا يتغير ب) الزيادات ؛
4. المعادن القلوية قوية جدا:
أ) خصائص مؤكسدة ؛ ج) تخفيض الخصائص ؛ ب) خصائص مذبذب ؛
5. .. الخواص الفيزيائية للمعادن القلوية لا تنطبق:
أ) الفضة البيضاء. ب) لينة وخفيفة. د) الحرارية.
6. في تفاعل عناصر المجموعة الأولى من المجموعة الفرعية الرئيسية مع الماء ، يتم تشكيل ما يلي:
حمض) ؛ ب) يتم إطلاق القلويات والهيدروجين ؛ د) الملح.
7. يتم تخزين الصوديوم والبوتاسيوم في الكيروسين لأنها:
أ) لها رائحة نفاذة ؛ ب) تتأكسد بسهولة في الهواء ؛
ضبط النفس: لا توجد أخطاء - "5" ، 1.2 أخطاء - "4" ، 3 أخطاء - "3" ، أكثر - "2"
الإجابات: 1 - 2 - في 3 - 4 - في 5 - 6 - 6 7 - ب.
ضبط النفس: لا توجد أخطاء - "5" ، 1.2 أخطاء - "4" ، 3.4 أخطاء - "3" ، أكثر - "2"
2. تفعيل المعرفة.
هل من الممكن تلبية المعادن القلوية بشكل حر في الطبيعة؟ لماذا؟
لنفترض ، في شكل المركبات التي يمكن العثور عليها في الطبيعة؟
في الطبيعة ، توجد الفلزات القلوية فقط في شكل مركبات.
تحدث Na و K بشكل طبيعي في شكل كلوريد ، كبريتات ، سيليكات ، إلخ.
Li ، Rb ، Cs هي جزء من المعادن المختلفة.
تم العثور على Fr في الخامات المشعة Ac و U.
على الطاولة: الأشياء التي تحتوي على مركبات من الفلزات القلوية (الصودا والملح وبطاريات الأصابع والصابون) وتطرح سؤالاً.
انظر إلى هذه الأشياء. ما رأيك يوحدهم؟
1 ما هو الرابط الجيني؟
2. اصنع سلسلة وراثية من الصوديوم.
Na → Na 2 O → 2NaOH → Na 2 CO 3
3. ما هي فئات المركبات التي تشكل المعادن القلوية؟ النظر في خصائصها.
في سياق شرح المادة وعرض الشرائح ، يحتفظ الطلاب بالملاحظات وفقًا للخطة ، ويكشفون عن الخصائص والتطبيقات.
أكاسيد فلزية قلوية
الثابت ، أبيض ، قابل للذوبان بسهولة.
ب) الخواص الكيميائية ؛ يكتب الطلاب في دفتر ملاحظات: أكاسيد فلزية قلوية أكاسيد أساسية نموذجية. مثل كل الأكاسيد الأساسية ، تتفاعل أكاسيد الفلزات القلوية مع الماء ، مع أكاسيد الحمض ، مع الأحماض.
يكتب الرجال على السبورة وفي دفتر الملاحظات معادلات التفاعلات الكيميائية باستخدام أكسيد الصوديوم كمثال:
Na 2 O + H 2 O → 2NaOH؛
Na 2 O + CO 2 → Na 2 CO 3؛
Na 2 O + H 2 CO 3 → Na 2 CO 3 + H 2 O
هيدروكسيدات المعادن القلوية
.
أ) الخصائص الفيزيائية ؛ يكتب الطلاب في خصائص دفتر الملاحظات: صلبة ، بيضاء ، قابلة للذوبان بشكل جيد ، مستقرة حرارياً ، تآكل الأقمشة والورق.
ب) الخواص الكيميائية
تدريب السلامة عند القيام بعمل المختبر.
الخواص الكيميائية لهيدروكسيد الصوديوم.
الغرض: إثبات الخصائص الكيميائية للمعادن القلوية تجريبياً باستخدام هيدروكسيد كمثال الصوديوم.
دليل التعليمات
صب هيدروكسيد الصوديوم في أنبوب نظيف ، أضف بضع قطرات من الفينول فثالين. ماذا تراقب؟
أضف محلول حمض الهيدروكلوريك إلى نفس الأنبوب. ماذا تراقب؟ اكتب معادلة التفاعل.
NaOH + HCl → NaCl + H 2 O يقوم الأشخاص الموجودون على السبورة وفي دفتر الملاحظات بكتابة معادلات التفاعل الكيميائي في شكل أيوني.
صب هيدروكسيد الصوديوم في أنبوب نظيف وأضف محلول سلفات النحاس. ماذا تراقب؟ اكتب معادلة التفاعل.
2NaOH + CuSO 4 → Na 2 SO 4 + Cu (OH) 2 قام الأشخاص الموجودون على السبورة وفي دفتر الملاحظات بكتابة معادلات التفاعل الكيميائي في شكل أيوني.
استنتج الخواص الكيميائية لهيدروكسيدات الفلزات القلوية.
تتفاعل هيدروكسيدات الفلزات القلوية مع الأحماض والأملاح - التطبيق - الشريحة رقم 5.
هيدروكسيد الصوديوم - هيدروكسيد الصوديوم - الصودا الكاوية ، الصودا الكاوية ، الكاوية.
هيدروكسيد البوتاسيوم - KOH - هيدروكسيد البوتاسيوم.
هيدروكسيد الصوديوم و KOH - القلوية الكاوية ، تآكل الأقمشة والورق. سجل الطلاب:التطبيق: للحرير الصناعي في إنتاج الصابون والرسائل النصية القصيرة ، مستحضرات التجميل ، الأدوية ، إلخ.
أملاح القلوي
.
الخصائص الفيزيائية. يكتب الطلاب الخصائص في دفتر ملاحظات المواد البلورية الصلبة ، كلها تقريبا قابلة للذوبان في الماء.
العمل المستقل مع نص الكتاب المدرسي.
التطبيق: ملء الجدول من الشريحة رقم 5. العمل على الكتاب المدرسي ص 56 - 57
صيغة الملح
الاسم
تطبيق
NaHCO 3
K 2 CO 3
كلوريد الصوديوم
Na 2 SO 4 ∙ 10 H 2 O
Na 2 CO 3 ∙ 10 H 2 O
أهمية في حياة الكائنات - الشريحة رقم 6.
رسالة الطالب حول الموضوع: "قيمة المركبات المعدنية القلوية في حياة الكائنات الحية."
تلعب أيونات الصوديوم والبوتاسيوم دورًا بيولوجيًا كبيرًا: Na + هو أيون خارج الخلية الرئيسي الموجود في الدم والليمفاوية ، و K + هو الأيون الرئيسي داخل الخلايا. "العمل" معا. تنظم نسبة تركيز هذه الأيونات ضغط الدم في الكائن الحي وتضمن حركة المحاليل الملحية من الجذور إلى أوراق النبات. أيونات البوتاسيوم - دعم عمل عضلة القلب ، والمساعدة في الروماتيزم ، وتحسين وظيفة الأمعاء. مركبات البوتاسيوم - القضاء على التورم.
V. تحديد
VI. ملخص الدرس. الدرجات.
ملخص الدرس:
ما هي الخصائص الفيزيائية والكيميائية المميزة للأكسيدات وهيدروكسيدات الفلزات القلوية؟
أين يتم استخدام هيدروكسيدات وأملاح القلويات المعدنية؟
مواد إضافية. هذا مثير للاهتمام.
المهمة: لماذا في اليونان القديمة ، قبل الرحلات الطويلة في الطقس الحار ، أوصى الجنود بتناول قطعة من الخبز والمملح وغسلها بالماء؟
يتم ترطيب أيونات الإلكتروليت بسهولة ، لذلك يحبس كلوريد الصوديوم الماء في الجسم.
الهدف: لماذا يأكل الإسكيموس القليل من الملح؟
وفقًا لأحد النظريات العلمية ، فإن جميع الحيوانات التي تعيش على الأرض ، بما في ذلك البشر ، هي نسل كائنات حية ظهرت وعاشت في البحر. كان سائل الجسم من هذه المخلوقات مياه البحر في التكوين. بعد أن انتقلوا إلى الأرض ، أنقذوا مياه البحر كمائع لجسمهم. لكن الطبيعة ليست قادرة على تزويد الكائنات الحية بكمية كافية من الملح في شكلها الطبيعي. نظرًا لأن الملح يذوب في الماء ، يتم غسل جزء كبير منه من التربة بواسطة مياه الأمطار إلى الأنهار والبحار والمحيطات. نتيجة لذلك ، لا تحتوي النباتات التي تنمو على الأرض على ما يكفي من الملح. لهذا السبب تحتاج الحيوانات التي تتغذى على النباتات إلى الملح. كل يوم ، يفقد الجسم كمية معينة من السوائل التي تحتوي على الملح ، والأطعمة النباتية لا تعوض عن ذلك. الحيوانات التي تتغذى على الحيوانات الأخرى لا تحتاج إلى ملح إضافي. يحصلون على الملح الذي يحتاجونه من الكائنات الحية لضحاياهم. يأكل الأسكيمو اللحوم بشكل أساسي ، لذا فإن حاجتهم إلى الملح صغيرة جدًا.
المهمة: لماذا في إنجلترا في العقود الأخيرة كان هناك انخفاض في الوفيات الناجمة عن أمراض الأوعية الدموية؟
ويرجع ذلك إلى زيادة استهلاك الفواكه والخضروات الطازجة. تحتوي الخضراوات والفواكه الطازجة دائمًا على الكثير من البوتاسيوم والصوديوم قليلًا. يحتفظ الصوديوم بالماء في الجسم ، مما يزيد من ضغط الدم ، وعلى العكس من ذلك ، فإن البوتاسيوم يساعد على تقليله. هذا هو السبب في أن زيادة استهلاك الخضروات والفواكه ، وخاصة التفاح ، يمكن اعتبارها تدبيرا أساسيا للوقاية من الأمراض الوعائية الدماغية.
أين يوجد في حب الناس للأملاح .
يستخدم الملح للحفاظ على الطعام من التلف والانحلال. لتوفير الغذاء (عندما لا توجد ثلاجات ومجمدات) ، تم استخدام الملح. بعد أن جربوا الخضروات من محلول ملحي ، بدأ الناس في الملح والخميرة ومياه الخضروات الطازجة. اعتاد الشخص على الملح كل شيء حتى أنه على استعداد لمواجهة بعض الأمراض ، وليس فقط للتبديل إلى نظام غذائي خال من الملح. تدريجيا ، تم تطوير عادة لملح جميع المواد الغذائية دون حتى محاولة ذلك.
الكثير من الملح - البوتاسيوم الصغير ، البوتاسيوم الصغير - الكثير من الأمراض
مسألة الملح هي مسألة توازن البوتاسيوم والصوديوم. من المهم للغاية في الجسم. يتجادل البوتاسيوم والصوديوم باستمرار حول وجودهما في الخلايا. لا يوجد بوتاسيوم في كلوريد الصوديوم ، إنه صوديوم بالكامل. جسمنا في حاجة ماسة للبوتاسيوم ، والذي يجب أن يكون أكثر من 4 مرات من الصوديوم. يجمع الجسم البوتاسيوم في كل مكان ، لكن الاستخدام المفرط لملح المائدة يبطل كل جهوده. لذلك ، مع وجود كمية زائدة من الملح ، يحدث نقص البوتاسيوم ، والذي يؤدي بمرور الوقت إلى عدد من الأمراض: التعب الجسدي والعقلي ، وضعف النوم ، التشنجات ، آلام المفاصل.
فائض الصوديوم (الملح) يفرط في القلب. هل تريد معرفة ما إذا كنت تأكل الكثير من الملح؟ انتقل إلى المرآة: تشير الدائرة البيضاء حول القزحية إلى الإفراط في تناول الملح.
هيدروكسيد البوتاسيوم
يستخدم البوتاسيوم الكاوية في إنتاج الأسمدة والمطاط الصناعي والكهارل للبطاريات والكواشف ، ويستخدم في صناعة الأدوية والقطاعات الأخرى من الاقتصاد.
يتم نقل البوتاسيوم الكاوية عن طريق السكك الحديدية ، عن طريق البر وفقا لقواعد نقل البضائع المعمول بها في هذا النوع من النقل.
يتم تخزين البوتاسيوم الكاوية في حاوية مغلقة بإحكام ، كما "ينتشر" في الهواء ، ويمتص الرطوبة منه.
يعكس اسمها التقليدي "البوتاسيوم الكاوي" التأثير المدمر لهذه المادة على الأنسجة الحية. إذا كان البوتاسيوم الكاوية يصيب الجلد ، فمن الممكن حدوث حروق كيميائية.
يتم الحصول على الصابون الخفيف عن طريق تصبن الزيوت والدهون مع البوتاسيوم الكاوية. كل هذه الصابون لها قوام كريمي ناعم.
الصودا الكاوية.
القلوية الأكثر شيوعا. يتم إنتاج واستهلاك أكثر من 57 مليون طن من القلويات الكاوية في العالم سنويًا.
تستخدم الصودا الكاوية في مجموعة واسعة من الصناعات وللاستخدام المنزلي:
في صناعة اللب والورق في إنتاج الورق والكرتون والألياف الصناعية ولوحات الألياف الخشبية.
لتسمن الدهون في صناعة الصابون والشامبو والمنظفات الأخرى.
في الصناعات الكيميائية - لتحييد الأحماض وأكاسيد الحمض ، ككاشف أو محفز في التفاعلات الكيميائية ، إلخ.
الصوديوم الكاوية (هيدروكسيد الصوديوم) هو مادة كاوية ومسببة للتآكل. إنه يشير إلى مواد من فئة الخطر الثانية. لذلك ، عند العمل معها ، يجب توخي الحذر.
في حالة ملامسة الجلد والأغشية المخاطية والعينين ، تتشكل حروق كيميائية خطيرة. في حالة ملامسة الأسطح المخاطية للقلويات الكاوية ، فمن الضروري غسل المنطقة المصابة بتيار من الماء ، وإذا ملامستها بمحلول ضعيف من حامض الخليك.
على الليثيوم - إلى النجوم
إن مصنعي الهواتف المحمولة وأجهزة الجيب وأجهزة الكمبيوتر المحمولة في حاجة ماسة إلى هذا المعدن. تستهلك الطاقة النووية كميات كبيرة من الليثيوم (Li) ؛ ووفقًا لحسابات المنظرين ، فإن هذا المعدن القلوي هو الذي يمكن أن يوفر مفتاح الطاقة النووية الحرارية. نظرًا لكونه مؤثرًا عقلانيًا قويًا ، يُستخدم Li في الطب النفسي العسكري والتطبيقي (وطبيعة تأثير Li على النفس البشرية غير مفهومة تمامًا). يستخدم ديوتيريد الليثيوم في قنبلة هيدروجينية كمواد عاملة وكمنظم طاقة متفجرة.
هناك حاجة أيضًا إلى هذا المعدن لاستكشاف الفضاء السحيق.
سير العمل للطلاب للدرس
الموضوع: المركبات المعدنية القلوية.
اختبار
هدريدات. أكثر هيدريد الليثيوم ثباتًا ، والذي يمكن الحصول عليه بسهولة عن طريق تمرير الهيدروجين على الليثيوم المسخن. LiH عبارة عن مسحوق بلوري أبيض تبلغ درجة انصهاره 680 درجة مئوية. في درجات الحرارة العالية ، يكون LiH شديد التفاعل. تتحلل بقوة عن طريق المياه:
LiH + H 2 O \u003d LiOH + H 2
أكاسيد. الأكثر ثباتًا هو Li 2 O. وأكاسيد الليثيوم والصوديوم بيضاء ، والباقي أصفر. علاوة على ذلك ، تزداد كثافة اللون مع زيادة الرقم التسلسلي للعنصر.
البيروكسيد. يتم الحصول عليها عن طريق حرق المعادن في الأكسجين الزائد. يمكن اعتبار بيروكسيدات الفلزات القلوية مشتقات من بيروكسيد الهيدروجين منذ ذلك الحين تتفاعل مع الأحماض والماء لتشكيل بيروكسيد الهيدروجين:
M 2 O 2 + H 2 SO 4 \u003d M 2 SO 4 + H 2 O 2
M 2 O 2 + 2H 2 O \u003d 2MOH + H 2 O 2
الأكثر أهمية هو بيروكسيد الصوديوم ، والذي يستخدم لإنتاج الأكسجين في الأماكن المغلقة (على سبيل المثال ، غواصة):
2Na 2 O 2 + 2CO 2 \u003d 2Na 2 CO 3 + 2O 2
هيدروكسيدات. وتسمى هذه التقنية القلوية الكاوية ، (هيدروكسيد الصوديوم - الصودا الكاوية ، KOH - البوتاسيوم الكاوية). هذه مواد عديمة اللون ، قابلة للانصهار. في الحالة المنصهرة تتفاعل مع الزجاج والخزف والبلاتين. لذلك ، يتم ذوبان القلويات في البوتقات الفضية أو الحديدية ، والتي لا تتفاعل معها. هيدروكسيدات قابلة للذوبان في الماء بسهولة مع توليد حرارة عالية.
يتم تحضير هيدروكسيدات بالطرق التالية:
أ) تفاعل المعادن أو الأكاسيد مع الماء:
Li 2 O + H 2 O \u003d 2LiOH
يستخدم هذا التفاعل فقط لإنتاج هيدروكسيدات نقية للغاية.
ب) رد فعل الكاوية هو أقدم طريقة معروفة لإنتاج الصودا الكاوية. تتكون هذه الطريقة في معالجة محلول من الصودا مع هيدروكسيد الكالسيوم (الجير المطفأ) أثناء الغليان. يتم ترشيح كربونات الكالسيوم غير القابلة للذوبان الناتجة أو يوضع سائل صاف منه:
Na 2 CO 3 + Ca (OH) 2 \u003d 2NaOH + CaCO 3
تم تركيز محلول هيدروكسيد الصوديوم الناتج عن طريق التبخر في الفراغ. تم إذابة هيدروكسيد الصوديوم الصلب عند 500 درجة مئوية لإزالة الماء تمامًا وتم الحصول على هيدروكسيد الصوديوم المحتوي على 3-4٪ Na 2 CO 3. تم الحصول عليها بهذه الطريقة تسمى هيدروكسيد الصوديوم "الصودا الكاوية".
ج) يعتبر التحليل الكهربائي لكلوريد الفلزات القلوية في محلول مائي طريقة صناعية حديثة لإنتاج هيدروكسيد الصوديوم و KOH في وقت واحد مع الكلور. عندما يتعرض محلول كلوريد الصوديوم للتحليل الكهربائي مع أقطاب خاملة (البلاتين ، الجرافيت) ، يتم إطلاق الكلور في الأنود والهيدروجين في الكاثود. تتراكم أيونات Na + و OH - في مساحة الكاثود ، والتي تشكل NaOH.
د) انصهار كربونات المعادن القلوية مع أكاسيد والمعالجة اللاحقة للسبائك بخار الماء:
Fe 2 O 3 + Na 2 CO 3 \u003d 2NaFeO 2 + CO 2
2NaFeO 2 + H 2 O \u003d 2NaOH + Fe 2 O 3
تعتبر القلويات أهم المواد الخام في الصناعة الكيميائية للأصباغ والنظارات والصابون والورق والألياف الصناعية والأدوية.
الملح. تم العثور على كلوريد الصوديوم و KCl بكميات كبيرة في الطبيعة. يوجد كلوريد الصوديوم (ملح الطعام) في مياه البحر (بمعدل 2.7٪) وفي شكل ملح صخري في رواسب بسعة تصل إلى عدة كيلومترات. يتم الحصول على كلوريد الصوديوم النقي و KCl من الكلوريد الطبيعي عن طريق التبلور. يتم الحصول على أملاح الليثيوم من كربونات الليثيوم الطبيعية. الحصول على أملاح الروبيديوم والسيزيوم يرتبط مع الصعوبات ، لأنه قابلية ذوبانها قريبة جدًا من قابلية أملاح أملاح البوتاسيوم. عادةً ما تتم إعادة بلورة الخمور الأم المتبقية بعد كارناليت ويتم عزل الشب الروبيديوم والسيزيوم عنهم ، والتي يتم تنقيتها عن طريق إعادة التبلور. يتم فصل الروبيديوم عن السيزيوم باستخدام ذوبان مختلف للكربونات في الكحول.
من النترات ، NaNO 3 و KNO 3 لهما أهمية عملية. الأسماء الفنية هي نترات الصوديوم ونترات البوتاسيوم. يتم استخدام كلا الأملاح كأسمدة معدنية. يستخدم KNO 3 أيضًا لإنتاج المسحوق الأسود (NaNO 3 لا يستخدم بسبب استرطابه).
يعطي حامض الكربونيك H 2 CO 3 صفين من كربونات الفلزات القلوية ، الحمضية (MHCO 3) والمتوسطة (M 2 CO 3) .كربونات حمض (هيدروكربونات ، بيكربونات) معروفة لجميع الفلزات القلوية باستثناء الليثيوم. باستثناء كربونات الليثيوم ، جميع الكربونات المحايدة قابلة للذوبان في الماء بدرجة كبيرة. Na 2 CO 3 - صودا ، توجد أحيانًا في الطبيعة في مياه بعض البحيرات وفي الينابيع المعدنية. الحصول على طريقة الأمونيا الصودا: مشبعة محلول كلوريد الصوديوم مع الأمونيا وثاني أكسيد الكربون. في هذه الحالة ، يترسب NaHCO 3 ، لأن الصودا أسوأ للذوبان من NH 4 Cl:
NaCl + H 2 O + CO 2 + NH 3 \u003d NaHCO 3 ¯ + NH 4 Cl
2NaHCO 3 → Na 2 CO 3 + CO 2 + H 2 O
K 2 CO 3 - البوتاس ، مسحوق أبيض رطب ، قابل للذوبان بشدة في الماء. تلقي بواسطة كربنة هيدروكسيد البوتاسيوم:
2KOH + CO 2 \u003d K 2 CO 3 + H 2 O
يستخدم البوتاس في صناعات الصابون والزجاج ، لصباغة وتبييض الصوف ، في إنتاج سيانيد البوتاسيوم ، في التخليق العضوي.
حامض الكبريتيك يعطي صفين من كبريتات الفلزات القلوية - الحمضية والمتوسطة.
يتم الحصول على Na 2 SO 4 كمنتج ثانوي في إنتاج حمض الهيدروكلوريك من كلوريد الصوديوم وحمض الكبريتيك. من المحاليل المائية ، تتبلور كبريتات الصوديوم كـ Na 2 SO 4. 10H 2 O ، في هذا الفن يسمى هيدرات البلورية بملح Glauber. تستخدم لصباغة الأقمشة القطنية ، في الطب.
· · ·§ 96. القلوية
تتضمن مجموعة المعادن القلوية سلسلة المعادن التالية ؛ Li، Na، K، Rb، Cs، Fr. هم في المجموعة الفرعية الأولى من مجموعة النظام الدوري.
كل هذه متشابهة من حيث أنها تحتوي على إلكترون واحد على طبقة الإلكترون الخارجي (الجدول 18) /.
القلوية هي عناصر s. إلكترون طبقة الإلكترون الخارجي لذرة فلزية قلوية ، مقارنة بعناصر أخرى في نفس الفترة ، هو الأكثر بعدًا عن النواة ، أي أن نصف قطر ذرة الفلز القلوي هو الأكبر مقارنةً بنصف قطر ذرات العناصر الأخرى في نفس الفترة. في اتصال
|
تهمة الأساسية |
عدد الإلكترونات في مستويات الطاقة |
ذرة نصف قطرها |
|||||||
مع هذا ، فإن الإلكترون التكافؤ للطبقة الخارجية من ذرات الفلزات القلوية ينكسر بسهولة ، ويحولها إلى أيونات موجبة الشحنة. ويرجع ذلك إلى حقيقة أن مركبات المعادن القلوية مع عناصر أخرى يتم بناؤها وفقًا لنوع الرابطة الأيونية.
في تفاعلات الأكسدة والاختزال ، تتصرف كعوامل اختزال قوية ، وهذه القدرة تزداد من المعدن إلى المعدن مع زيادة شحنة النواة الذرية.
§ 97. الصوديوم
التكوين الإلكتروني لذرة الصوديوم ls 2 2s 2 2p 6 3s 1. هيكل الطبقة الخارجية:
تم العثور على الصوديوم في الطبيعة فقط في شكل أملاح. ملح الصوديوم الأكثر شيوعًا هو كلوريد الصوديوم NaCl ، بالإضافة إلى سيلفينيت KC · · NaCl المعدني وبعض أملاح الكبريتات ، على سبيل المثال ، ملح Glauber Na2SO4 · 10H2O ، الموجود بكميات كبيرة في بحر قزوين كارا-بوغاز-جول.
يتم الحصول على فلز الصوديوم من كلوريد الصوديوم عن طريق التحليل الكهربائي للذوبان من هذا الملح. يظهر التثبيت للتحليل الكهربائي في الشكل. 76. يتم خفض الأقطاب الكهربائية في الملح المنصهر. يتم فصل مسافات الأنود والكاثود عن طريق الحجاب الحاجز ، والذي يعزل الصوديوم المتكون بحيث لا يحدث تفاعل عكسي. يتلقى أيونات الصوديوم الإيجابية إلكترونًا من الكاثود ويتحول إلى ذرة صوديوم محايدة. يتم جمع ذرات الصوديوم المحايدة في الكاثود في شكل معدن مصهور. يمكن تمثيل العملية التي تحدث في الكاثود بالنظام التالي:
نا + + نا 0.
بما أن اعتماد الإلكترونات يحدث في الكاثود ، وأي قبول للإلكترونات بواسطة ذرة أو أيون هو انخفاض ، يتم تقليل أيونات الصوديوم في الكاثود. عند الأنود ، تتبرع أيونات الكلور بالإلكترونات ، أي عملية الأكسدة والإفراج الحر
غاز الكلور ، والذي يمكن تمثيله بالمخطط التالي:
Cl - - البريد - → Cl 0
الصوديوم المعدني الناتج له لون فضي-أبيض ويمكن قطعه بسهولة بسكين. إذا كانت هناك شريحة في الصوديوم ، إذا تم فحصها مباشرة بعد القطع ، فإنها تحتوي على لمعان معدني ساطع ، ولكنها تتلاشى بسرعة بسبب التأكسد السريع للغاية للمعادن.
![]()
التين. 76. رسم تخطيطي للتحليل الكهربائي من كلوريد الصوديوم المنصهر.
1 - حلقة الكاثود ؛ 2 - الجرس لإزالة الكلور الغازي من الأنود الفضاء
إذا تم أكسدة الصوديوم في كمية صغيرة من الأكسجين عند درجة حرارة حوالي 180 درجة ، يتم الحصول على أكسيد الصوديوم:
4Na + O2 \u003d 2Na2O.
عند الاحتراق بالأكسجين ، يتم الحصول على بيروكسيد الصوديوم:
2Na + O2 \u003d Na2O2.
في هذه الحالة ، يحترق الصوديوم بلهب أصفر مذهل.
نظرًا للأكسدة السهلة والسريعة للصوديوم ، يتم تخزينه تحت طبقة من الكيروسين أو البارافين ، ويفضل ، نظرًا لأن كمية معينة من الهواء يذوب في الكيروسين وأكسدة الصوديوم ، على الرغم من ببطء ، لا يزال يحدث.
يمكن أن يعطي الصوديوم مركبًا بهيدروجين - هيدروكسيد الصوديوم ، والذي يظهر به حالة أكسدة قدرها 1. هذا مركب يشبه الملح والذي يختلف عن هيدريدات المواد المتطايرة لعناصر المجموعات الفرعية الرئيسية للمجموعات IV-VII في طبيعة الرابطة الكيميائية ودرجة الأكسدة.
يمكن أن يتفاعل معدن الصوديوم ليس فقط مع الأكسجين والهيدروجين ، ولكن أيضًا مع العديد من المواد البسيطة والمعقدة. على سبيل المثال ، عند الطحن في هاون بالكبريت ، يتفاعل الصوديوم بعنف معه ، مكونًا:
2Na + S \u003d Na2S
يكون رد الفعل مصحوبًا بحدوث تفشي ، لذلك يجب أن تبقى الملاط بعيدًا عن العينين وأن تُلف منشفة حول يدك. يجب أن تؤخذ قطع صغيرة من الصوديوم للتفاعل.
يحترق الصوديوم بشدة في الكلور ليشكل كلوريد الصوديوم ، وهو أمر جيد بشكل خاص لملاحظةه في أنبوب الكلور - الكالسيوم ، حيث يتم تمرير تيار الكلور عبر الصوديوم المنصهر والتسخين بقوة:
2Na + Cl2 \u003d 2NaCl
لا يتفاعل الصوديوم مع المواد البسيطة فحسب ، بل يتفاعل أيضًا مع المواد المعقدة ، على سبيل المثال مع الماء ، الذي ينحرف عنه ، لأنه معدن نشط للغاية ، في سلسلة من الضغوط ، يكون على يسار الهيدروجين ويزيل الأخير بسهولة من الماء:
2Na + 2H2O \u003d 2NaOH + H2
يجب عدم إخماد حرق المعادن القلوية بالماء. من الأفضل أن تملأ بمسحوق رماد الصودا. في وجود الصوديوم ، فإن لهب عديم اللون من الموقد الغازي يتحول إلى اللون الأصفر.
يمكن استخدام فلز الصوديوم كعامل مساعد في التخليق العضوي ، على سبيل المثال ، في إنتاج المطاط الصناعي من البيوتاديين. إنه بمثابة مادة البدء لإعداد مركبات الصوديوم الأخرى ، على سبيل المثال بيروكسيد الصوديوم.
■ 27. أثبت باستخدام معادلات التفاعلات الواردة في نص ردود الفعل التي تنطوي على الصوديوم المعدني الذي يتصرف كعامل مختزل.
28. لماذا لا يمكن تخزين الصوديوم في الهواء؟
29. قام الطالب بغمس قطعة من الصوديوم في محلول كبريتات النحاس ، على أمل إزاحة المعادن من الملح. بدلاً من المعدن الأحمر ، ظهر راسب أزرق جيلاتيني. صف التفاعلات التي حدثت واكتب معادلاتها في الأشكال الجزيئية والأيونية. كيف يجب تغيير ظروف التفاعل بحيث يؤدي التفاعل إلى النتيجة المرجوة؟ اكتب المعادلات في الأشكال الأيونية الجزيئية والكاملة والمختصرة.
30. وضعت 2.3 غرام من معدن الصوديوم في وعاء مع 45 مل من الماء. ما تشكلت الصودا الكاوية في نهاية رد الفعل.
31. ما هي العوامل التي يمكن استخدامها لإطفاء الصوديوم المحترق؟ إعطاء إجابة مسبب.
§ 98. مركبات الأكسجين من الصوديوم. الصودا الكاوية
مركبات الأكسجين من الصوديوم ، كما ذكرنا سابقًا ، هي أكسيد الصوديوم Na2O وبيروكسيد الصوديوم Na2O2.
أكسيد الصوديوم Na2O ليس ذو أهمية خاصة. يتفاعل بقوة مع الماء ، ويشكل الصودا الكاوية:
Na2O + H2O \u003d 2NaOH
بيروكسيد الصوديوم Na202 هو مسحوق مصفر. يمكن اعتباره نوعًا من ملح بيروكسيد الهيدروجين ، لأن تركيبته هي نفسها في H2O2. مثل بيروكسيد الصوديوم هو عامل مؤكسد قوي. تحت تأثير الماء ، فإنه يشكل قلوي و:
Na2O2 + H2O \u003d H2O2 + 2NaOH
يتكون من عمل الأحماض المخففة على بيروكسيد الصوديوم:
Na2O2 + H2SO4 \u003d H2O2 + Na2SO4
جميع الخصائص المذكورة أعلاه من بيروكسيد الصوديوم تسمح باستخدامه لتبييض جميع المواد الممكنة.
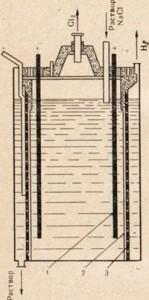
التين. 77. رسم تخطيطي للتحليل الكهربائي لمحلول كلوريد الصوديوم.
1 - الأنود ؛ 2 - الحجاب الحاجز الذي يفصل بين الأنود ومساحة الكاثود. 3 الكاثود
مركب الصوديوم المهم جدا هو هيدروكسيد الصوديوم ، أو الصودا الكاوية ، هيدروكسيد الصوديوم. ويسمى أيضا الصودا الكاوية ، أو ببساطة الكاوية.
للحصول على الصودا الكاوية ، يتم استخدام كلوريد الصوديوم - وهو أرخص مركب صوديوم طبيعي ، يقوم بتحليله كهربائيًا ، ولكن في هذه الحالة ، لا يتم إذابة ، ولكن يتم استخدام محلول ملح (الشكل 77). للحصول على وصف للتحليل الكهربائي لمحلول كلوريد الصوديوم ، انظر الفقرة 33. في الشكل. 77 يوضح أن مساحة الأنود والكاثود مفصولة بغشاء. تم ذلك لمنع المنتجات المكونة من التفاعل مع بعضها البعض ، على سبيل المثال ، Сl2 + 2NaOH \u003d NaClO + NaCl + Н2O.
الصودا الكاوية - مادة بلورية صلبة من اللون الأبيض ، قابلة للذوبان تماما في الماء. عندما يتم إذابة هيدروكسيد الصوديوم في الماء ، يتم إطلاق كمية كبيرة من الحرارة ويكون المحلول ساخنًا للغاية. يجب تخزين الصودا الكاوية في أوعية محكمة الإغلاق لمنعها من اختراق بخار الماء ، الذي يكون تحت تأثيره مبللاً للغاية ، وكذلك ثاني أكسيد الكربون ، تحت تأثير الصودا الكاوية التي يمكن أن تتحول تدريجياً إلى كربونات الصوديوم:
2NaOH + CO2 \u003d Na2CO3 + H2O.
الصودا الكاوية هي قلوية نموذجية ، لذا فإن احتياطات العمل معها هي نفسها عند العمل مع أي قلويات أخرى.
تستخدم الصودا الكاوية في العديد من الصناعات ، على سبيل المثال ، لتكرير المنتجات البترولية ، وإنتاج الصابون من الدهون ، في صناعة الورق ، وفي إنتاج الألياف والأصباغ الاصطناعية ، وفي إنتاج الأدوية ، إلخ (الشكل 78).
اكتب في دفتر الملاحظات مجالات تطبيق الصودا الكاوية.
من أملاح الصوديوم ، أولاً وقبل كل شيء ، كلوريد الصوديوم ، NaCl ، والذي يعد بمثابة المادة الخام الرئيسية لهيدروكسيد الصوديوم والصوديوم المعدني (للحصول على تفاصيل حول هذا الملح ، انظر صفحة 164) ، Na2CO3 الصودا (انظر الصفحة 278) ، Na2SO4 (انظر الصفحة 224) ، NaNO3 (انظر الصفحة 250) ، إلخ.
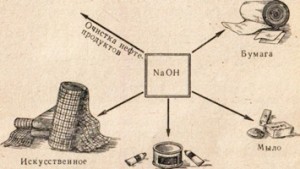
التين. 78. استخدام الصودا الكاوية
32. صف طريقة إنتاج الصودا الكاوية عن طريق التحليل الكهربائي لكلوريد الصوديوم.
33. يمكن الحصول على الصودا الكاوية من خلال العمل على كربونات الصوديوم مع الجير المطفأ. اصنع شكلاً جزيئيًا وأيونيًا من المعادلة الخاصة بهذا التفاعل ، واحسب أيضًا كمية الصودا المحتوية على 95٪ كربونات مطلوبة للحصول على 40 كجم من الصودا الكاوية.
34. لماذا ، عند تخزين محلول من الصودا الكاوية في زجاجات مع سدادات الأرض ، هي "عالقة" المقابس ولا يمكن إزالتها؟ إذا كانت الزجاجة معلقة رأسًا على عقب في الماء لفترة زمنية معينة ، يمكن إزالة الفلين بحرية. اشرح ، في ضوء معادلات التفاعل ، أي نوع من العمليات يحدث في هذه الحالة.
35. اكتب معادلات التفاعلات في الأشكال الجزيئية والأيونية التي تميز خصائص الصودا الكاوية باعتبارها قلوية نموذجية.
36. ما هي الاحتياطات التي يجب مراعاتها عند العمل مع الصودا الكاوية؟ ما هي تدابير الإسعافات الأولية التي ينبغي توفيرها للحروق باستخدام الصودا الكاوية؟
§ 99. البوتاسيوم
يعتبر البوتاسيوم K أيضًا معدنًا قلويًا شائعًا إلى حد ما ، والذي يختلف عن الصوديوم بنصف قطره الذري (الفترة الرابعة) وبالتالي يكون له نشاط كيميائي أكبر من الصوديوم. التكوين الإلكتروني لذرة البوتاسيوم هو 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1.
هيكل الطبقة الإلكترونية الخارجية
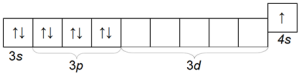
البوتاسيوم هو معدن ناعم مقطوع جيدًا بسكين. لتجنب الأكسدة ، يتم تخزينه ، مثل الصوديوم ، تحت طبقة من الكيروسين.
يتفاعل البوتاسيوم مع الماء أكثر من الصوديوم ، مع تكوين القلويات وإطلاق الهيدروجين ، الذي يشعل:
2K + 2H2O \u003d 2KOH + H2.
عند الاحتراق في الأكسجين (يُنصح بأخذ قطع معدنية أصغر لحرقها مقارنة بحرق الصوديوم) ، مثل الصوديوم ، فإنه يحترق بقوة مع تكوين بيروكسيد البوتاسيوم.
تجدر الإشارة إلى أن البوتاسيوم أكثر خطورة في الدورة الدموية من الصوديوم. يمكن أن يحدث انفجار قوي حتى عند قطع البوتاسيوم ، لذلك تحتاج إلى التعامل معه بعناية أكبر.
هيدروكسيد البوتاسيوم أو هيدروكسيد البوتاسيوم KOH هو مادة بلورية بيضاء. البوتاسيوم الكاوية يشبه في كل الأحوال الصودا الكاوية. تستخدم على نطاق واسع في صناعة الصابون ، ولكن إنتاجها أغلى ثمناً ، لذا لا تجد تطبيقًا مثل NaOH.
وتجدر الإشارة إلى أملاح البوتاسيوم خاصة ، حيث أن بعضها يستخدم على نطاق واسع كأسمدة. هذه هي كلوريد البوتاسيوم KCl ، نترات البوتاسيوم KNO3 ، وهو أيضا الأسمدة النيتروجينية.
37. كيف يمكن أن نفسر حقيقة أن البوتاس الكاوي أكثر نشاطًا من الناحية الكيميائية من الصودا الكاوية؟
38. تم خفض قطعة من البوتاسيوم في القالب بالماء. بعد انتهاء التفاعل ، تم وضع القليل من الزنك في صورة ترسبات جيلاتينية بيضاء. اختفى الراسب ، وعند اختبار المحلول باستخدام الفينول فثالين ، تحول الأخير إلى لون قرمزي. ما هي العمليات الكيميائية التي حدثت هنا؟
التي هي في الحل؟ إعطاء إجابة مسبب.
39. لماذا البوتاسيوم ، مثل جميع المعادن القلوية ، هو عضو في عائلة عنصر s؟
تتفاعل المعادن القلوية بسهولة مع غير المعادن:
2K + I 2 \u003d 2KI
2Na + H 2 \u003d 2NaH
6Li + N 2 \u003d 2Li 3 N (التفاعل موجود بالفعل في درجة حرارة الغرفة)
2Na + S \u003d Na 2 S
2Na + 2C \u003d Na 2 C 2
في تفاعلات الأكسجين ، يُظهر كل فلز قلوي تفرده: عندما يحترق الهواء ، يتشكل الليثيوم أكسيد ، بيروكسيد الصوديوم ، بيروكسيد البوتاسيوم.
4Li + O 2 \u003d 2Li 2 O
2Na + O 2 \u003d Na 2 O 2
K + O 2 \u003d KO 2
الحصول على أكسيد الصوديوم:
10Na + 2NaNO 3 \u003d 6Na 2 O + N 2
2Na + Na 2 O 2 \u003d 2Na 2 O
2Na + 2NaON \u003d 2Na 2 O + H 2
التفاعل مع الماء يؤدي إلى تكوين القلويات والهيدروجين.
2Na + 2H 2 O \u003d 2NaOH + H 2
التفاعل مع الأحماض:
2Na + 2HCl \u003d 2NaCl + H 2
8Na + 5H 2 SO 4 (conc.) \u003d 4Na 2 SO 4 + H 2 S + 4H 2 O
2Li + 3H 2 SO 4 (conc.) \u003d 2LiHSO 4 + SO 2 + 2H 2 O
8Na + 10HNO 3 \u003d 8NaNO 3 + NH 4 NO 3 + 3H 2 O
عند التفاعل مع الأمونيا ، تتشكل الأميدات والهيدروجين:
2Li + 2NH 3 \u003d 2LiNH 2 + H 2
التفاعل مع المركبات العضوية:
H ─ C ≡ C ─ H + 2Na → Na ─ C≡C ─ Na + H 2
2CH 3 Cl + 2Na → C 2 H 6 + 2NaCl
2C 6 H 5 OH + 2Na → 2C 6 H 5 ONa + H 2
2CH 3 OH + 2Na → 2 CH 3 ONa + H 2
2CH 3 COOH + 2Na → 2CH 3 COOONa + H 2
رد الفعل النوعي للمعادن القلوية هو تلوين الشعلة مع الكاتيونات الخاصة بهم. لي + أيون تلوين لهب القرمزي الأحمر ، نا + أيون أصفر ، K + بنفسجي
مركبات القلويات المعدنية
أكاسيد.
أكاسيد الفلزات القلوية هي أكاسيد أساسية نموذجية. تتفاعل مع حمض وأكاسيد مذبذب ، والأحماض ، والمياه.
3Na 2 O + P 2 O 5 \u003d 2Na 3 PO 4
Na 2 O + Al 2 O 3 \u003d 2NaAlO 2
Na 2 O + 2HCl \u003d 2NaCl + H 2 O
Na 2 O + 2H + \u003d 2Na + + H 2 O
Na 2 O + H 2 O \u003d 2NaOH
البيروكسيد.
2Na 2 O 2 + CO 2 \u003d 2Na 2 CO 3 + O 2
Na 2 O 2 + CO \u003d Na 2 CO 3
Na 2 O 2 + SO 2 \u003d Na 2 SO 4
2Na 2 O + O 2 \u003d 2Na 2 O 2
Na 2 O + NO + NO 2 \u003d 2NaNO 2
2Na 2 O 2 \u003d 2Na 2 O + O 2
Na 2 O 2 + 2H 2 O (بارد) \u003d 2NaOH + H 2 O 2
2Na 2 O 2 + 2H 2 O (أفقي) \u003d 4NaOH + O 2
Na 2 O 2 + 2HCl \u003d 2NaCl + H 2 O 2
2Na 2 O 2 + 2H 2 SO 4 (decomp. Horizontal) \u003d 2Na 2 SO 4 + 2H 2 O + O 2
2Na 2 O 2 + S \u003d Na 2 SO 3 + Na 2 O
5Na 2 O 2 + 8H 2 SO 4 + 2KMnO 4 \u003d 5O 2 + 2MnSO 4 + 8H 2 O + 5Na 2 SO 4 + K 2 SO 4
Na 2 O 2 + 2H 2 SO 4 + 2NaI \u003d I 2 + 2Na 2 SO 4 + 2H 2 O
Na 2 O 2 + 2H 2 SO 4 + 2 FeSO 4 \u003d Fe 2 (SO 4) 3 + Na 2 SO 4 + 2H 2 O
3Na 2 O 2 + 2Na 3 \u003d 2Na 2 CrO 4 + 8NaOH + 2H 2 O
قاعدة (القلوي).
2NaOH (فائض) + CO 2 \u003d Na 2 CO 3 + H 2 O
NaOH + CO 2 (فائض) \u003d NaHCO 3
SO 2 + 2NaOH (فائض) \u003d Na 2 SO 3 + H 2 O
SiO 2 + 2NaOH Na 2 SiO 3 + H 2 O
2NoOH + Al 2 O 3 2NaAlO 2 + H 2 O
2NaOH + Al 2 O 3 + 3H 2 O \u003d 2Na
NaOH + Al (OH) 3 \u003d Na
2NaOH + 2Al + 6H 2 O \u003d 2Na + 3H 2
2KOH + 2NO 2 + O 2 \u003d 2KNO 3 + H 2 O
KOH + KHCO 3 \u003d K 2 CO 3 + H 2 O
2NoOH + Si + H 2 O \u003d Na 2 SiO 3 + H 2
3KOH + P 4 + 3H 2 O \u003d 3KH 2 PO 2 + PH 3
2KOH (بارد) + Cl 2 \u003d KClO + KCl + H 2 O
6KOH (ساخن) + 3Cl 2 \u003d KClO 3 + 5KCl + 3H 2 O
6NaOH + 3S \u003d 2Na 2 S + Na 2 SO 3 + 3H 2 O
2NaNO 3 2NaNO 2 + O 2
NaHCO 3 + HNO 3 \u003d NaNO 3 + CO 2 + H 2 O
NaI → Na + + I -
في الكاثود: 2Н 2 О + 2e → H 2 + 2OH - 1
على الأنود: 2I - - 2e → I 2 1
2H 2 O + 2I - ![]() H 2 + 2OH - + I 2
H 2 + 2OH - + I 2
2H 2 O + 2NaI ![]() H 2 + 2NaOH + I 2
H 2 + 2NaOH + I 2
2NaCl ![]() 2Na + Cl 2
2Na + Cl 2
في الكاثود في الأنود
2Na 2 HPO 4 Na 4 P 2 O 7 + H 2 O
KNO 3 + 4Mg + 6H 2 O \u003d NH 3 + 4Mg (OH) 2 + KOH
4KClO 3 KCl + 3KClO 4
2KClO 3 ![]() 2KCl + 3O 2
2KCl + 3O 2
KClO 3 + 6HCl \u003d KCl + 3Cl 2 + 3H 2 O
Na 2 SO 3 + S \u003d Na 2 S 2 O 3
Na 2 S 2 O 3 + H 2 SO 4 \u003d Na 2 SO 4 + S ↓ + SO 2 + H 2 O
2NaI + Br 2 \u003d 2NaBr + I 2
2NaBr + Cl 2 \u003d 2NaCl + Br 2
أنا مجموعة.
1. تم تمرير التصريفات الكهربائية على سطح محلول الصودا الكاوية المصبوبة في القارورة ، والهواء في القارورة كان لونه بني ، والذي يختفي بعد فترة من الوقت. تم تبخير المحلول الناتج بعناية ووجد أن البقايا الصلبة كانت عبارة عن مزيج من أملحين. عندما يتم تسخين هذا الخليط ، يتم إطلاق الغاز وتبقى المادة الوحيدة. اكتب معادلات ردود الفعل الموصوفة.
2. المادة المحررة في الكاثود أثناء التحليل الكهربائي لمذاب كلوريد الصوديوم تم حرقها في الأكسجين. تم وضع المنتج الناتج في عداد غاز مملوء بثاني أكسيد الكربون. تمت إضافة المادة الناتجة إلى محلول كلوريد الأمونيوم وتم تسخين المحلول. اكتب معادلات ردود الفعل الموصوفة.
3) تم تحييد حمض النيتريك مع صودا الخبز ، وتم تبخير المحلول المحايد بعناية وتم تحميص البقايا. تم إدخال المادة الناتجة في محلول برمنجنات البوتاسيوم المحمض بحمض الكبريتيك ، وتم تغيير لون المحلول. تم وضع منتج التفاعل المحتوي على النيتروجين في محلول هيدروكسيد الصوديوم وأضيف الغبار من الزنك ، وتم إطلاق غاز ذي رائحة نفاذة. اكتب معادلات ردود الفعل الموصوفة.
4) تم إدخال المادة التي تم الحصول عليها عند الأنود أثناء التحليل الكهربائي لمحلول يوديد الصوديوم مع أقطاب خاملة في التفاعل مع البوتاسيوم. تم تسخين منتج التفاعل بحمض الكبريتيك المركز ، وتم تمرير الغاز المتطور عبر محلول ساخن من كرومات البوتاسيوم. اكتب معادلات ردود الفعل الموصوفة
5) تم حرق المادة التي تم الحصول عليها عند الكاثود أثناء التحليل الكهربائي لمذاب كلوريد الصوديوم في الأكسجين. تم معالجة المنتج الناتج بعد ذلك بثاني أكسيد الكبريت ومحلول من هيدروكسيد الباريوم. اكتب معادلات ردود الفعل الموصوفة
6) يذوب الفوسفور الأبيض في محلول من البوتاسيوم الكاوية مع تطور غاز ذي رائحة ثوم تشتعل تلقائيًا في الهواء. تفاعل المنتج الصلب لتفاعل الاحتراق مع هيدروكسيد الصوديوم بحيث تحتوي المادة البيضاء الناتجة على ذرة هيدروجين واحدة ؛ عندما يتم تحميص الأخير ، تتشكل بيروفوسفات الصوديوم. اكتب معادلات ردود الفعل الموصوفة
7) معدن غير معروف حرق في الأكسجين. يتفاعل منتج التفاعل ، مع ثاني أكسيد الكربون ، في مادتين: مادة صلبة ، تتفاعل مع محلول حمض الهيدروكلوريك مع إطلاق ثاني أكسيد الكربون ، ومادة غازية بسيطة تدعم الاحتراق. اكتب معادلات ردود الفعل الموصوفة.
8) تم تمرير الغاز البني عبر فائض من محلول هيدروكسيد البوتاسيوم في وجود فائض كبير من الهواء. تمت إضافة حلاقة المغنيسيوم إلى المحلول الناتج وتسخينه ، وتم معادلة حمض النتريك بالغاز المنطلق. تم تبخير المحلول الناتج بعناية ، وتم تحميص منتج التفاعل الصلب. اكتب معادلات ردود الفعل الموصوفة.
9) أثناء التحلل الحراري للملح A في وجود ثاني أكسيد المنجنيز ، يتم تكوين الملح الثنائي B والغاز الذي يدعم الاحتراق ويشكلان جزءًا من الهواء ؛ عندما يتم تسخين هذا الملح دون وجود محفز ، يتم تشكيل الملح B وملح حامض يحتوي على نسبة عالية من الأكسجين. أثناء تفاعل الملح A مع حمض الهيدروكلوريك ، يتم إطلاق غاز أصفر - أخضر (مادة بسيطة) ويتكون الملح B. يعمل الملح B على تحويل اللهب إلى اللون الأرجواني ، عندما يتفاعل مع محلول من نترات الفضة ، وهو شكل رواسب بيضاء. اكتب معادلات ردود الفعل الموصوفة.
10) تمت إضافة نجارة النحاس إلى حامض الكبريتيك المركز الساخن وتم تمرير الغاز المتطور عبر محلول من الصودا الكاوية (الزائدة). تم عزل ناتج التفاعل ، ذوبانه في الماء وتسخينه بالكبريت ، والذوبان نتيجة للتفاعل. تمت إضافة حمض الكبريتيك المخفف إلى المحلول الناتج. اكتب معادلات ردود الفعل الموصوفة.
11) تم معالجة الملح بحمض الكبريتيك المركز. تم معالجة الملح الناتج بهيدروكسيد الصوديوم. تم تكليس المنتج الناتج بالفحم الزائد. تفاعل الغاز المنطلق في هذه الحالة في وجود محفز الكلور. اكتب معادلات ردود الفعل الموصوفة.
12) تفاعل الصوديوم مع الهيدروجين. تم إذابة منتج التفاعل في الماء ، وتم تكوين غاز يتفاعل مع الكلور ، وتفاعل المحلول الناتج مع الكلور عند تسخينه لتشكيل خليط من أملحين. اكتب معادلات ردود الفعل الموصوفة.
13) تم حرق الصوديوم بالأكسجين الزائد ، وتم وضع المادة البلورية الناتجة في أنبوب زجاجي وتم تمرير ثاني أكسيد الكربون من خلاله. تم جمع الغاز الخارج من الأنبوب وحرق الفوسفور في غلافه الجوي. تم تحييد المادة الناتجة مع وجود فائض من محلول هيدروكسيد الصوديوم. اكتب معادلات ردود الفعل الموصوفة.
14) تمت إضافة محلول حمض الهيدروكلوريك إلى المحصل الناتج عن تفاعل بيروكسيد الصوديوم مع الماء عند تسخينه حتى اكتمال التفاعل. تم تحليل محلول الملح المتكون مع أقطاب خاملة. تم تمرير الغاز الناتج عن التحليل الكهربائي في الأنود من خلال تعليق هيدروكسيد الكالسيوم. اكتب معادلات ردود الفعل الموصوفة.
15) تم تمرير غاز الكبريت من خلال محلول هيدروكسيد الصوديوم لتشكيل ملح وسط. تمت إضافة محلول مائي من برمنجنات البوتاسيوم إلى المحلول الناتج. تم فصل الراسب الناتج وعمله على ذلك مع حمض الهيدروكلوريك. تم تمرير الغاز المنبعث من خلال محلول بارد من هيدروكسيد البوتاسيوم. اكتب معادلات ردود الفعل الموصوفة.
16) تم تحميص خليط من السيليكا (IV) ومعدن الماغنسيوم. تمت معالجة المادة البسيطة الناتجة بمحلول هيدروكسيد الصوديوم المركز. تم تمرير الغاز المنبعث على الصوديوم الساخن. وضعت المادة الناتجة في الماء. اكتب معادلات ردود الفعل الموصوفة.
17) تم معالجة ناتج تفاعل الليثيوم مع النيتروجين بالماء. تم تمرير الغاز الناتج من خلال محلول حمض الكبريتيك حتى إنهاء التفاعلات الكيميائية. تمت معالجة المحلول الناتج بمحلول كلوريد الباريوم. تم ترشيح المحلول ، وتم خلط المرشح بمحلول من نترات الصوديوم وتسخينه. اكتب معادلات ردود الفعل الموصوفة.
18) تم تسخين الصوديوم في جو من الهيدروجين. عندما تمت إضافة الماء إلى المادة التي تم الحصول عليها ، لوحظ تطور الغاز وتشكيل محلول واضح. تم تمرير الغاز البني من خلال هذا المحلول ، والذي تم الحصول عليه نتيجة تفاعل النحاس مع محلول مركّز من حمض النتريك. اكتب معادلات ردود الفعل الموصوفة.
19) تم تحميص بيكربونات الصوديوم. يذوب الملح الناتج في الماء ويخلط بمحلول ألومنيوم ، ونتيجة لذلك تتشكل مادة مترسبة ويتم إطلاق غاز عديم اللون. تمت معالجة المادة المترسبة بكمية زائدة من محلول حمض النتريك ، وتم تمرير الغاز من خلال محلول سيليكات البوتاسيوم. اكتب معادلات ردود الفعل الموصوفة.
20) تم تنصهر الصوديوم بالكبريت. تمت معالجة المركب الناتج بحمض الهيدروكلوريك ، تفاعل الغاز المتطور بالكامل مع ثاني أكسيد الكبريت. تمت معالجة المادة الناتجة بحمض النيتريك المركز. اكتب معادلات ردود الفعل الموصوفة.
21) حرق الصوديوم في الأكسجين الزائد. تم معالجة المادة الناتجة بالماء. يغلي الخليط الناتج ، وبعد ذلك يضاف الكلور إلى المحلول الساخن. اكتب معادلات ردود الفعل الموصوفة.
22) تم تسخين البوتاسيوم في جو من النيتروجين. تمت معالجة المادة الناتجة مع زيادة حمض الهيدروكلوريك ، وبعد ذلك تمت إضافة تعليق من هيدروكسيد الكالسيوم إلى الخليط الناتج من الأملاح وتسخينه. تم تمرير الغاز الناتج بأكسيد النحاس المشع السعيد (II) ، اكتب معادلات التفاعلات الموصوفة.
23) تم حرق البوتاسيوم في جو من الكلور ، وتم معالجة الملح الناتج بكمية زائدة من محلول مائي من نترات الفضة. تمت ترشيح المادة المترسبة ، وتم تبخير المرشح وتم تسخين الخليط بعناية. تم معالجة الملح الناتج بمحلول بروم مائي. اكتب معادلات ردود الفعل الموصوفة.
24) الليثيوم يتفاعل مع الهيدروجين. تم إذابة منتج التفاعل في الماء ، وتم تشكيل غاز تفاعل مع البروم ، وتفاعل المحلول الناتج مع الكلور عند تسخينه لتشكيل خليط من أملحين. اكتب معادلات ردود الفعل الموصوفة.
25) حرق الصوديوم في الهواء. المواد الصلبة الناتجة تمتص ثاني أكسيد الكربون مع إطلاق الأكسجين والملح. تم إذابة الملح الأخير في حمض الهيدروكلوريك ، وأضيف محلول نترات الفضة إلى المحلول الناتج. راسب أبيض سقط. اكتب معادلات ردود الفعل الموصوفة.
26) تعرض الأكسجين لتفريغ كهربائي في المعالج بالأوزون. تم تمرير الغاز الناتج من خلال محلول مائي من يوديد البوتاسيوم ، في حين تم إطلاق غاز جديد بدون لون ورائحة ، مما يدعم الاحتراق والتنفس. تم حرق الصوديوم في جو آخر غاز ، وكانت المادة الصلبة التي تم الحصول عليها باستخدام هذا تتفاعل مع ثاني أكسيد الكربون. اكتب معادلات ردود الفعل الموصوفة.
أنا مجموعة.
1. ن 2 + س 2 ![]() 2NO
2NO
2NO + O 2 \u003d 2NO 2
2NO 2 + 2NaOH \u003d NaNO 3 + NaNO 2 + H 2 O
2NaNO 3 2NaNO 2 + O 2
2. 2NaCl ![]() 2Na + Cl 2
2Na + Cl 2
في الكاثود في الأنود
2Na + O 2 \u003d Na 2 O 2
2Na 2 O 2 + 2CO 2 \u003d 2Na 2 CO 3 + O 2
Na 2 CO 3 + 2NH 4 Cl \u003d 2NaCl + CO 2 + 2NH 3 + H 2 O
3. NaHCO 3 + HNO 3 \u003d NaNO 3 + CO 2 + H 2 O
2NaNO 3 2NaNO 2 + O 2
5NaNO 2 + 2KMnO 4 + 3H 2 SO 4 \u003d 5NaNO 3 + 2MnSO 4 + K 2 SO 4 + 3H 2 O
NaNO 3 + 4Zn + 7NaOH + 6H 2 O \u003d 4Na 2 + NH 3
4.2H 2 O + 2 NaI ![]() H 2 + 2NaOH + I 2
H 2 + 2NaOH + I 2
2K + I 2 \u003d 2KI
8KI + 5H 2 SO 4 (conc.) \u003d 4K 2 SO 4 + H 2 S + 4I 2 + 4H 2 O
3H 2 S + 2K 2 CrO 4 + 2H 2 O \u003d 2Cr (OH) 3 ↓ + 3S ↓ + 4KOH
5. 2NaCl ![]() 2Na + Cl 2
2Na + Cl 2
في الكاثود في الأنود
2Na + O 2 \u003d Na 2 O 2
Na 2 O 2 + SO 2 \u003d Na 2 SO 4
Na 2 SO 4 + Ba (OH) 2 \u003d BaSO 4 ↓ + 2NaOH
6. P 4 + 3KOH + 3H 2 O \u003d 3KH 2 PO 2 + PH 3
2PH 3 + 4O 2 \u003d P 2 O 5 + 3H 2 O
P 2 O 5 + 4NaOH \u003d 2Na 2 HPO 4 + H 2 O


