14.08.2019
Якими загальними властивостями мають хімічні елементи метали. Метали як хімічні елементи
З раннього дитинства ми стикаємося з фразою, що такий предмет зроблений з металу. Що таке метал?
Метали - це певна група хімічних елементів (а також їх сплавів), які мають загальні для всієї групи властивості, такі як підвищена міцність, хороша тепло-і електропровідність, ковкість, пластичність, металевий блиск.
До металів відноситься майже 80% всіх відомих хімічних елементів (96 із 118).
Фізичні властивості металів
Усі метали, крім ртуті, у звичайних умовах перебувають у твердому стані. За ступенем твердості м'який метал - це цезій (0,2 бала за 10-бальною шкалою Моосу). Найтвердіший – це вольфрам. Його твердість дорівнює 6 балам. Твердість заліза – 4 бали.
Температури плавлення (переходу в рідкий стан) у металів різняться: від - 39 º у ртуті до 3 410 º у вольфраму. Низькі температури плавлення мають усі лужні метали, та якщо з звичайних - олово і свинець. Їх можна розплавити навіть у домашніх умовах на газовому пальнику. Більшість металів плавиться у спеціальних печах із високими температурами.
Завдяки наявності в кристалічних ґратах металів вільних рухомих електронів, всі вони дуже добре проводять електрику та тепло. Найкращі провідники електрики з металів – це срібло, мідь та алюміній. Невипадково саме з двох останніх металів роблять електропроводку.
З чудовою теплопровідністю металів ми також часто стикаємося у побуті. Щоб закип'ятити воду, ми наливаємо її в металеву каструлю та ставимо на плиту. Тен нагріває метал, а метал передає майже всю теплову енергію воді.
Хімічні властивості металів
У ході хімічних реакцій усі метали легко віддають свої електрони та виступають у ролі відновників.
Багато металів окислюються киснем. Лужні метали (літій, кальцій) вступають у взаємодію Космосу з киснем за нормальних умов. Для окиснення киснем інших металів потрібна підвищена температура. Наприклад, якщо нагріти мідний дріт на вогні, мідь вступить у взаємодію з киснем з повітря і покриється чорною плівкою (оксидом міді):
- 2Сu +O 2 → 2CuO
З киснем не реагують золото та платина.
З інших окислювачів із металами реагують хлор, сірка. Якщо змішати залізну тирсу і порошок сірки і нагріти суміш, то на наших очах вийде сульфід заліза:
- Fe + S → FeS
Відновлювальна активність у різних металів різна. За своєю активністю метали розподіляються так:
- Li - K - Ba - Sr - Ca - Na - Mg - Al - Mn - Zn - Cr - Fe - Ca - Co - Ni - Sn - Pb - (H2) - Cu - Hg - Ag - Pt - Au.
Чим ліворуч у цьому ряду знаходиться метал, тим він активніший. Попередній елемент може витіснити метал, що знаходиться правіше. Наприклад, якщо в пробірку з розчином сульфату міді помістити шматочок заліза, він покриється бурим нальотом (плівкою з міді):
- Fe + CuSO4 → FeSO4 + Cu
Метали, що знаходяться ліворуч від водню (H2), можуть витіснити його з соляної кислоти. Якщо в соляну кислоту опустити шматочок цинку, почне виділятися водень:
- HCl + Zn → ZnCl2 + H2
Лужні метали легко вступають у реакцію із водою. Якщо в ємність з водою помістити шматочок натрію, то активно виділятиметься водень і утвориться луг:
- 2Na + 2H2O → 2NaOH + H2
Застосування металів
Завдяки своїм корисним властивостямметали міцно увійшли у життя людини. Людина використовує міцність металів, роблячи з них каркаси будівель (від маленьких павільйонів до величезних хмарочосів), корпус машин (автомобілів, вагонів, кораблів, верстатів), а також робочі деталі різних інструментів.
Визначення
Знаходження у природі
Властивості металів
Характерні властивості металів
Фізичні властивості металів
Хімічні властивості металів
Мікроскопічна будова
Лужні метали
Загальна характеристика лужних металів
Хімічні властивості лужних металів
Одержання лужних металів
Гідроксиди
Карбонати
Рубідій
Лужноземельні метали
Кальцій
Стронцій
Перехідні метали
Загальна характеристика перехідних елементів
Застосування металів
Конструкційні матеріали
Електротехнічні матеріали
Інструментальні матеріали
Історія
Добувна металургія
Мета́л це(Назва походить від лат. Metallum - Шахта) - група елементів, що володіє характерними металевими властивостями, такими як висока тепло-і електропровідність, позитивний температурний коефіцієнт опору, висока пластичність та ін. До металів відносяться приблизно 70% всіх хімічних елементів.
Метал (Metal) – це











![]()





















![]()


![]()





Знаходження у природі
Більшість металів є у природі як руд і сполук. Вони утворюють оксиди, сульфіди, карбонати та інші хімічні сполуки. Для отримання чистих металів та подальшого їх застосування необхідно виділити їх із руд та провести очищення. При необхідності проводять легування та іншу обробку металів. Вивченням цього займається наука металургія. Металургія розрізняє руди чорних металів (з урахуванням заліза) та кольорових (до їх складу не входить залізовсього близько 70 елементів). , і платина відносяться також до дорогоцінних металів. Крім того, в малих кількостях вони присутні в морській воді, рослини, живі організми (граючи при цьому важливу роль).
Відомо, що організм людини на 3% складається із металів. Найбільше в наших клітинах кальцію та натрію, сконцентрованого в лімфатичних системах. Магній накопичується в м'язах і нервової системи, мідь— у печінці, — у крові.
Властивості металів
Метал (Metal) – це
Характерні властивості металів
Металевий блиск (крім йоду та вуглецю у вигляді графіту. Незважаючи на свій металевий блиск, кристалічний йод і графіт відносяться до неметалів.)
Хороша електропровідність (крім вуглецю.)
Можливість легкої механічної обробки.
Висока щільність (зазвичай метали важчі за неметалів.)
Висока температура плавлення (виключення: ртуть, галій та лужні метали.)
Велика теплопровідність
У реакціях є відновниками.
Фізичні властивості металів
Усі метали (крім ртуті і, умовно, ) за нормальних умов перебувають у твердому стані, проте вони мають різну твердість. Так, лужні метали легко ріжуться кухонним ножем, а такі метали, як ванадій, вольфрам і хром легко дряпають тверду і скло. Нижче наводиться твердість деяких металів за Моосовою шкалою.
Температури плавлення лежать у діапазоні від -39 ° C (ртуть) до 3410 ° C (вольфрам). Температура плавлення більшості металів (за винятком лужних) висока, проте деякі «нормальні» метали, наприклад оловоі свинець, можна розплавити на звичайній електричній або газовій плиті.
Залежно від густини метали ділять на легкі (щільність 0,53 год 5 г/смі) і важкі (5 год 22,5 г/смі). Найлегшим металом є літій (щільність 0.53 г/смі). Найважчий метал нині назвати неможливо, оскільки щільності осмію та іридію — двох найважчих металів — майже рівні (близько 22.6 г/смі — рівно вдвічі вищі за щільність свинцю), а обчислити їх точну щільність вкрай складно: для цього потрібно повністю очистити метали, адже будь-які домішки знижують їхню щільність.
Більшість металів пластичні, тобто металевий дріт можна зігнути, і він не зламається. Це відбувається через усунення шарів атомів металів без розриву зв'язку між ними. Найбільш пластичними є золото, сріблоі мідь. З золотаможна виготовити фольгу завтовшки 0.003 мм, яку використовують для золочення предметів торгівлі. Проте чи всі метали пластичні. Дріт з цинкуабо оловахрумтить при згинанні; марганець та вісмут при деформації взагалі майже не згинаються, а одразу ламаються. Пластичність залежить і від чистоти металу; так, дуже чистий хром дуже пластичний, але, забруднений навіть незначними домішками, стає тендітним і твердішим.
Усі метали добре проводять електричний струм; це обумовлено наявністю в їх кристалічних ґратах рухомих електронів, що переміщуються під дією електричного поля. Срібло, мідь та алюмініймають найбільшу електропровідність; з цієї причини останні два метали найчастіше використовують як матеріал для проводів. Дуже високу електропровідність має також натрій, в експериментальній апаратурі відомі спроби застосування натрієвих струмопроводів у формі тонкостінних труб. нержавіючої сталі, заповнені натрієм. Завдяки малій питомій вазі натрію, при рівному опорі натрієві «проводи» виходять значно легшими за мідні і навіть дещо легшими за алюмінієві.
Висока теплопровідність металів залежить також від рухливості вільних електронів. Тому ряд теплопровідностей схожий ряд електропровідностей і кращим провідником тепла, як і електроенергії, є . Натрій також знаходить застосування як добрий провідник тепла; широко відомо, наприклад, застосування натрію в клапанах автомобільних двигунів для поліпшення їхнього охолодження.
Гладка поверхня металів відбиває великий світла - це явище називається металевим блиском. Однак у порошкоподібному стані більшість металів втрачають свій блиск; алюмінійі магній, тим не менш, зберігають свій блиск і в порошку. Найбільш добре відображають світло, срібло і - з цих металів виготовляють дзеркала. Для виготовлення дзеркал іноді застосовується і родій, незважаючи на його виключно високу ціну: завдяки значно більшій, ніж у срібла або навіть паладію, твердості та хімічній стійкості, родовий шар може бути значно тоншим, ніж срібний.
Колір у більшості металів приблизно однаковий - світло-сірий з блакитним відтінком. , мідь та цезій відповідно жовтого, червоного та світло-жовтого кольору.
Хімічні властивості металів
Метал (Metal) – це
На зовнішньому електронному шарі у більшості металів невелика кількість електронів (1-3), тому вони здебільшого реакцій виступають як відновники (тобто «віддають» свої електрони)
1. Реакції із простими речовинами
З киснем реагують усі метали, окрім золота, платини. Реакція зі сріблом відбувається при високих температурах, але оксид срібла(II) практично не утворюється, оскільки він термічно нестійкий. Залежно від металу на виході можуть бути оксиди, пероксиди, надпероксиди:
4Li + O2 = 2Li2O оксид літію
2Na + O2 = Na2O2 пероксид натрію
K + O2 = KO2 надпероксид калію
Щоб одержати з пероксиду оксид, пероксид відновлюють металом:
Na2O2 + 2Na = 2Na2O
З середніми та малоактивними металами реакція відбувається при нагріванні:
3Fe + 2O2 = Fe3O4
З азотом реагують лише найактивніші метали, при кімнатній температурі взаємодіє лише літій, утворюючи нітриди:
6Li + N2 = 2Li3N
При нагріванні:
3Ca + N2 = Ca3N2
З сіркою реагують усі метали, крім золота та платини:
Залізо взаємодіє з сіроїпри нагріванні, утворюючи сульфід:
З воднем реагують лише найактивніші метали, тобто метали IA та IIA груп крім Be. Реакції здійснюються при нагріванні, утворюються при цьому гідриди. У реакціях метал виступає як відновник, ступінь окислення водню −1:
З вуглецем реагують лише найактивніші метали. При цьому утворюються ацетиленіди або метаніди. Ацетиленіди при взаємодії з водою дають ацетилен, метаніди метан.
2Na + 2C = Na2C2
Na2C2 + 2H2O = 2NaOH + C2H2
Легування - це введення в розплав додаткових елементів, що модифікують механічні, фізичні та Хімічні властивостіосновного матеріалу
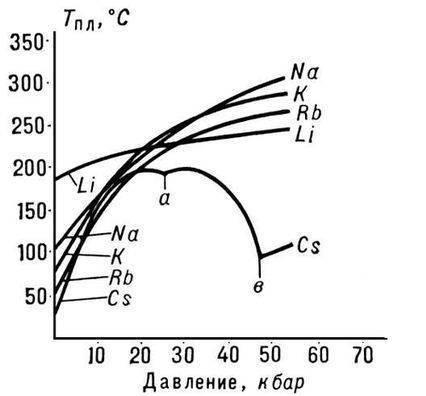
Мікроскопічна будова
Характерні властивості металів можна зрозуміти, виходячи з них внутрішньої будови. Всі вони мають слабкий зв'язок електронів зовнішнього енергетичного рівня (тобто валентних електронів) з ядром. Завдяки цьому створена різниця потенціалів у провіднику призводить до лавиноподібного руху електронів (званих електронами провідності) у кристалічній решітці. Сукупність таких електронів часто називають електронним газом. Внесок у теплопровідність, крім електронів, дають фонони (коливання ґрат). Пластичність обумовлена малим енергетичним бар'єром для руху дислокацій та зсуву кристалографічних площин. Твердість можна пояснити великою кількістю структурних дефектів (міжвузельні атоми та ін.).
Через легку віддачу електронів можливе окислення металів, що може призводити до корозії та подальшої деградації властивостей. Здатність до окислення можна дізнатися за стандартним рядом активності металів. Цей факт підтверджує необхідність використання металів у комбінації з іншими елементами (сплав, найважливішим з яких є сталь), їх легування та застосування різних покриттів.
Для коректнішого опису електронних властивостей металів необхідно використовувати квантову механіку. У всіх твердих тілах з достатньою симетрією рівні енергії електронів окремих атомів перекриваються і утворюють дозволені зони, причому зона, утворена валентними електронами, називається валентною зоною. Слабкий зв'язок валентних електронів у металах призводить до того, що валентна зона в металах виходить дуже широким, і всіх валентних електронів не вистачає для її повного заповнення.
Принципова особливість такої частково заповненої зони полягає в тому, що навіть при мінімальній доданій напрузі у зразку починається перебудова валентних електронів, тобто тече електричний струм.
Та ж висока рухливість електронів призводить і до високої теплопровідності, а також здатності дзеркально відбивати електромагнітне випромінювання (що і надає металам характерний блиск).
Лужні метали
Метал (Metal) – це
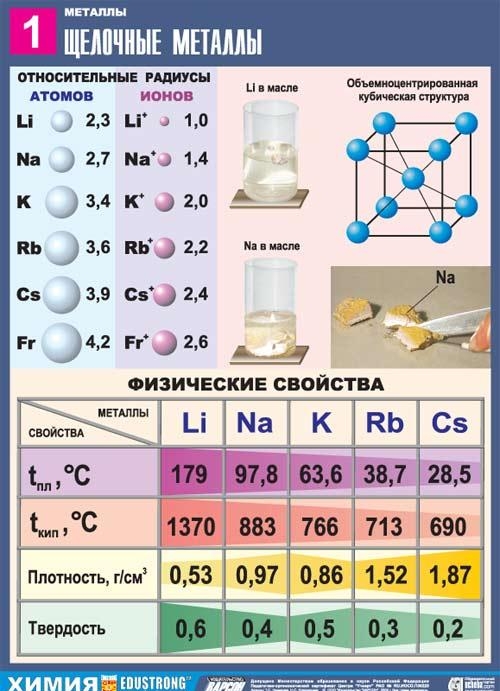
Лужні метали - елементи головної підгрупи I групи Періодичної системи хімічних елементів Д. І. Дмитра Івановича Менделєєва: літій Li, натрій Na, калій K, рубідій Rb, цезій Cs і францій Fr. Ці метали отримали назву лужних, тому що більшість їх сполук розчинно у воді. По-слов'янськи «вилуговувати» означає «розчиняти», це й визначило назву цієї групи металів. При розчиненні лужних металів у воді утворюються розчинні гідроксиди, які називаються лугами.
Загальна характеристика лужних металів
У Періодичній системі вони йдуть одразу за інертними газами, тому особливість будови атомів лужних металів полягає в тому, що вони містять один електрон на новому енергетичному рівні: їхня електронна конфігурація ns1. Очевидно, що валентні електрони лужних металів можуть бути легко видалені, тому що енергетично вигідно віддати електрон і придбати конфігурацію інертного газу. Тому всім лужних металів характерні відновлювальні властивості. Це підтверджують низькі значення їх потенціалів іонізації (потенціал іонізації атома цезію — один із найнижчих) та електронегативності (ЕО).
Усі метали цієї підгрупи мають сріблясто-білий колір (крім сріблясто-жовтого цезію), вони дуже м'які, їх можна різати скальпелем. Літій, натрій і калій легші за воду і плавають на її поверхні, реагуючи з нею.
Лужні метали зустрічаються в природі у формі сполук, що містять однозарядні катіони. Багато мінералів містять у своєму складі метали головної підгрупи І групи. Наприклад, ортоклаз, або польовий шпат, складається з алюмюсилікату калію K2, аналогічний мінерал, Що містить натрій - альбіт - має склад Na2 У морській воді міститься хлорид натрію NaCl, а в ґрунті — солі калію — сильвін KCl, сильвініт NaCl. KCl, карналіт KCl. MgCl2. 6H2O, полігаліт K2SO4 . MgSO4. CaSO4. 2H2O.
Хімічні властивості лужних металів
Метал (Metal) – це
Через високу хімічну активність лужних металів по відношенню до води, кисню, азоту їх зберігають під шаром гасу. Щоб провести реакцію із лужним металом, шматочок потрібного розміру акуратно відрізають скальпелем під шаром. гасу, в атмосфері аргону ретельно очищають поверхню металу від продуктів його взаємодії з повітрям і тільки потім поміщають зразок реакційний посудину.
1. Взаємодія із водою. Важлива властивість лужних металів - їхня висока активність по відношенню до води. Найбільш спокійно (без вибуху) реагує із водою літій.
При проведенні аналогічної реакції натрій горить жовтим полум'ям і невеликий вибух. Калій ще активніший: у цьому випадку вибух набагато сильніший, а полум'я пофарбоване у фіолетовий колір.
2. Взаємодія із киснем. Продукти горіння лужних металів повітря мають різний склад залежно від активності металу.
Тільки літій згоряє повітря з утворенням оксиду стехиометрического складу.
При горінні натрію переважно утворюється пероксид Na2O2 з невеликою домішкою надпероксиду NaO2.
У продуктах горіння калію, рубідії та цезію містяться в основному надпероксиди.
Для отримання оксидів натрію і калію нагрівають суміші гідроксиду, пероксиду або надпероксиду з надлишком металу без кисню.
Для кисневих сполук лужних металів характерна наступна закономірність: у міру збільшення радіусу катіону лужного металу зростає стійкість кисневих сполук, що містять пероксид-іон О22 і надпероксид-іон O2-.
Для важких лужних металів характерне утворення досить стійких озонів складу ЕО3. Всі кисневі сполуки мають різне забарвлення, інтенсивність якого заглиблюється в ряді від Li до Cs.
Оксиди лужних металів мають всі властивості, властиві основним оксидам: вони реагують з водою, кислотними оксидами і кислотами.
Пероксиди та надпероксиди виявляють властивості сильних окислювачів.
Пероксиди та надпероксиди інтенсивно взаємодіють з водою, утворюючи гідроксиди.
3. Взаємодія коїться з іншими речовинами. Лужні метали реагують з багатьма неметалами. При нагріванні вони з'єднуються з воднем з утворенням гідридів, галогенами, сірої, азотом, фосфором, вуглецем і кремнієм з утворенням, відповідно, галогенідів, сульфідів, нітридів, фосфідів, карбідів та силіцидів.
При нагріванні лужні метали здатні реагувати коїться з іншими металами, утворюючи інтерметаліди. Активно (з вибухом) реагують лужні метали із кислотами.
Лужні метали розчиняються в рідкому аміаку та його похідних – амінах та амідах.
При розчиненні у рідкому аміаку лужний металвтрачає електрон, який сольватується молекулами аміаку та надає розчину блакитного кольору. Аміди, що утворюються, легко розкладаються водою з утворенням луги і аміаку.
Лужні метали взаємодіють із органічними речовинами спиртами (з утворенням алкоголятів) та карбоновими кислотами (з утворенням солей).
4. Якісне визначення лужних металів. Оскільки потенціали іонізації лужних металів невеликі, то при нагріванні металу або його сполук у полум'ї атом іонізується, забарвлюючи полум'я у певний колір.
Одержання лужних металів
1. Для отримання лужних металів використовують переважно електроліз розплавів їх галогенідів, найчастіше — хлоридів, що утворюють природні мінерали:
катод: Li+ + e → Li
анод: 2Cl- - 2e → Cl2
2. Іноді для отримання лужних металів проводять електроліз розплавів їх гідроксидів:
катод: Na+ + e → Na
анод: 4OH- - 4e → 2H2O + O2
Оскільки лужні метали в електрохімічному ряді напруг знаходяться лівіше водню, то електролітичне отримання їх із розчинів солей неможливе; у цьому випадку утворюються відповідні луги та водень.
Гідроксиди
Для отримання гідроксидів лужних металів переважно використовують електролітичні методи. Найбільш великотоннажним є виробництво гідроксиду натрію електролізом концентрованого водного розчину кухонної солі.
Насамперед луг отримували реакцією обміну.
Луж, що виходить таким способом, була сильно забруднена содою Na2CO3.
Гідроксиди лужних металів – білі гігроскопічні речовини, водні розчини яких є сильними основами. Вони беруть участь у всіх реакціях, характерних для основ — реагують із кислотами, кислотними та амфотерними оксидами, амфотерними гідроксидами.
Гідроксиди лужних металів при нагріванні виганяються без розкладання, за винятком гідроксиду літію, який так само, як гідроксиди металів головної підгрупи II групи, при прожарюванні розкладається на оксид та воду.
Гідроксид натрію використовується виготовлення мила, синтетичних миючих засобів, штучного волокна, органічних сполук, наприклад фенолу.
Карбонати
Важливим продуктом, що містить лужний метал, є сода Na2CO3. Основну кількість соди у всьому світі виробляють за методом Сольве, запропонованим ще на початку XX ст. Суть методу полягає в наступному: водний розчин NaCl, до якого додано аміак, насичують вуглекислим газом за температури 26 - 30 °C. При цьому утворюється малорозчинний гідрокарбонат натрію, який називається питною содою.
Аміак додають для нейтралізації кислотного середовища, що виникає при пропусканні вуглекислого газу розчин, і отримання гідрокарбонат-іону HCO3-, необхідного для осадження гідрокарбонату натрію. Після відділення питної соди розчин, що містить амонію хлорид, нагрівають з вапном і виділяють аміак, який повертають в реакційну зону.
Таким чином, при аміачному способі отримання соди єдиним відходом є хлорид кальцію, що залишається в розчині і має обмежене застосування.
При прожарюванні гідрокарбонату натрію виходить кальцинована або пральна сода Na2CO3 і діоксид вуглецю, що використовується в процесі отримання гідрокарбонату натрію.
Основний набувач соди - скляна.
На відміну від малорозчинної кислої солі NaHCO3, гідрокарбонат калію KHCO3 добре розчинний у воді, тому карбонат калію або поташ K2CO3 отримують дією вуглекислого газу на розчин гідроксиду калію.
Поташ використовують у виробництві скла та рідкого мила.
Літій - єдиний лужний метал, для якого не отримано гідрокарбонату. Причина цього явища в дуже маленькому радіусі іону літію, який дозволяє йому утримувати досить великий іон HCO3-.
Літій
Метал (Metal) – це
Літій - елемент головної підгрупи першої групи, другого періоду періодичної системи хімічних елементів Д.І. Менделєєва Дмитра Івановича, з атомним номером 3. Позначається символом Li (лат. Lithium). Проста речовина літій (CAS-номер: 7439-93-2) – м'який лужний метал сріблясто-білого кольору.
Літій був відкритий в 1817 році шведським хіміком і мінералогом А. Арфведсон спочатку в мінералі петаліті (Li,Na), а потім в спогадені LiAl і в лепідоліті KLi1.5Al1.5(F,OH)2. Металевий літій вперше отримав Хамфрі Деві у 1825 році.
Свою назву літій отримав через те, що був виявлений у «камінні» (грец. λίθος — камінь). Спочатку називався «літіон», сучасну назву було запропоновано Берцеліусом.
Літій — сріблясто-білий метал, м'який і пластичний, твердіший за натрій, але м'якший за свинець. Його можна обробляти пресуванням та прокаткою.
При кімнатній температурі металевий літій має кубічну об'ємноцентровану решітку (координаційне число 8), яка при холодній обробці переходить у кубічну щільноупаковану решітку, де кожен атом, що має подвійну кубооктаедричну координацію, оточений 12 іншими. Нижче 78 До стійкої кристалічної формою є гексагональна щільноупакована структура, в якій кожен атом літію має 12 найближчих сусідів, розташованих у вершинах кубооктаедра.
З усіх лужних металів літій характеризується найвищими температурами плавлення та кипіння (180,54 і 1340 °C, відповідно), у нього найнижча щільність при кімнатній температурі серед усіх металів (0,533 г/смі, майже вдвічі менша за щільність води).
Невеликі розміри атома літію призводять до появи особливих якостей металу. Наприклад, він змішується з натрієм тільки при температурі нижче 380° С і не змішується з розплавленими калієм, рубідієм і цезієм, тоді як інші пари лужних металів змішуються один з одним у будь-яких співвідношеннях.
Лужний метал нестійкий на повітрі. Літій є найменш активним лужним металом, із сухим повітрям (і навіть із сухим киснем) при кімнатній температурі практично не реагує.
У вологому повітрі повільно окислюється, перетворюючись на нітрид Li3N, гідроксид LiOH та карбонат Li2CO3. У кисні при нагріванні горить, перетворюючись на оксид Li2O. Є цікава особливість, що в інтервалі температур від 100 до 300 °С літій покривається щільною оксидною плівкою, і надалі не окислюється.
У 1818 році німецький хімік Леопольд Гмелін встановив, що літій та його солі забарвлюють полум'я в карміново-червоний колір, це є якісною ознакою для визначення літію. Температура спалаху знаходиться близько 300 °С. Продукти горіння подразнюють слизову оболонку носоглотки.
Спокійно, без вибуху та займання, реагує з водою, утворюючи LiOH та H2. Реагує також з етиловим спиртом, утворюючи алкоголят, з аміаком та галогенами (з йодом — тільки при нагріванні).
Літій зберігають у петролейному ефірі, парафіні, газоліні та/або мінеральному маслі в герметично закритих жерстяних коробках. Металевий літій викликає опіки при попаданні на шкіру, слизові оболонки та очі.
У чорній та кольоровій металургії літій використовується для розкислення та підвищення пластичності та міцності сплавів. Літій іноді застосовується для відновлення методами металотермії рідкісних металів.
Карбонат літію є найважливішою допоміжною речовиною (додається в електроліт) при виплавці алюмінію та його споживання зростає з кожним роком пропорційно до обсягу світового видобутку алюмінію (витрата карбонату літію 2,5-3,5 кг на тонну алюмінію, що виплавляється).
Сплави літію зі сріблом та золотом, а також купрумом є дуже ефективними припоями. Сплави літію з магнієм, скандією, купрумом, кадмієм та алюмінієм — нові перспективні матеріали в авіації та космонавтиці. На основі алюмінату та силікату літію створена кераміка, що твердне при кімнатній температурі та використовується у військовій техніці, металургії, та, в перспективі, у термоядерній енергетиці. Величезною міцністю має скло на основі літій-алюміній-силікату, що зміцнюється волокнами карбіду кремнію. Літій дуже ефективно зміцнює сплави свинцю та надає їм пластичності та стійкості проти корозії.
Солі літію мають психотропну дію і використовуються в медицині при профілактиці та лікуванні низки психічних захворювань. Найбільш поширений у цій якості карбонат літію. застосовується в психіатрії для стабілізації настрою людей, які страждають на біполярні розлади та часті перепади настрою. Він ефективний у запобіганні манії депресії і зменшує суїцид. Пояснюють цей ефект подвійно. З одного боку, встановлено, що літій здатний регулювати активність деяких ферментів, що беруть участь у перенесенні з міжклітинної рідини до клітин мозку іонів натрію і калію. З іншого боку, відмічено, що іони літію безпосередньо впливають на іонний баланс клітини. А від балансу натрію і калію залежить значною мірою стан хворого: надлишок натрію в клітинах характерний для депресивних пацієнтів, недолік - для тих, хто страждає маніями. Вирівнюючи натрій калієвий баланс, солі літію позитивно впливають і на тих, і на інших.
Натрій
Метал (Metal) – це
Натрій - елемент головної підгрупи першої групи, третьої періодуперіодичної системи хімічних елементів Д.І. Дмитра Івановича Менделєєва, з атомним номером 11. Позначається символом Na (лат. Natrium). Проста речовина натрій (CAS-номер: 7440-23-5) – м'який лужний метал сріблясто-білого кольору.
У воді натрій поводиться майже так, як літій: реакція йде з бурхливим виділенням водню, в розчині утворюється гідроксид натрію.
Натрій (а точніше, його сполуки) використовувався з давніх-давен. Наприклад, сода (натрон), що зустрічається у природі у водах натронних озер у Єгипті. Природну соду стародавні єгиптяни використовували для бальзамування, відбілювання полотна, при варінні їжі, виготовленні фарб та глазурів. Пліній Старший пише, що у дельті Нілу соду (у ній була достатня частка домішок) виділяли із річкової води. Вона надходила у продаж у вигляді великих шматків, через домішки вугілля, пофарбованих у сірий або навіть чорний колір.
Натрій вперше був отриманий англійським хіміком Хемфрі Деві в 1807 електролізом твердого NaOH.
Назва «натрій» (natrium) походить від арабського натрун (грецькою — nitron) і спочатку він ставився до природної соди. Сам елемент раніше називався содієм (лат. Sodium).

Натрій - сріблясто-білий метал, у тонких шарах з фіолетовим відтінком, пластичний, навіть м'який (легко ріжеться ножем), свіжий зріз натрію блищить. Величини електропровідності та теплопровідності натрію досить високі, щільність дорівнює 0,96842 г/смі (при 19,7 ° С), температура плавлення 97,86 ° С, температура кипіння 883,15 ° С.
Лужний метал на повітрі легко окислюється. Для захисту від кисню повітря металевий натрій зберігають під шаром гасу. Натрій менш активний, ніж літій, тому з азотом реагує тільки при нагріванні:
При великому надлишку кисню утворюється пероксид натрію.
2Na + O2 = Na2O2
Металевий натрій широко використовується в препаративній хімії та промисловостіяк сильний відновник, у тому числі у металургії. Натрій використовується у виробництві енергоємних натрієво-сірчаних акумуляторів. Його також застосовують у випускних клапанах вантажівок як тепловідведення. Зрідка металевий натрій застосовується як матеріал для електричних проводів, призначених для дуже великих струмів.
У сплаві з калієм, а також з рубідієм та цезієм використовується як високоефективний теплоносій. Зокрема, сплав складу натрій 12 %, калій 47 %, цезій 41 % має рекордно низьку температуру плавлення −78 °C та був запропонований як робоче тіло іонних ракетних двигунів та теплоносія для атомних енергоустановок.
Натрій також використовується в газорозрядних лампах високого та низького тиску(НЛВС та НЛНД). Лампи НЛВС типу ДНаТ (Дугова Натрієва Трубчаста) дуже широко застосовуються у вуличному освітленні. Вони дають яскраво-жовте світло. Термін служби ламп ДНаТ становить 12-24 тисячі годин. Тому газорозрядні лампи типу ДНаТ є незамінними для міського, архітектурного та промислового освітлення. Також існують лампи ДНаС, ДНаМТ (Дугова Натрієва Матова), ДНаЗ (Дугова Натрієва Дзеркальна) та ДНаТБР (Дугова Натрієва Трубчаста Без Ртуті).
Металевий натрій застосовується у якісному аналізі органічної речовини. Сплав натрію та досліджуваної речовини нейтралізують етанолом, додають кілька мілілітрів дистильованої води та ділять на 3 частини, Ж. Лассеня (1843), спрямована на визначення азоту, сірки та галогенів ( пробаБейльштейна)
Хлорид натрію (кухонна сіль) - найдавніше застосовуваний смаковий і консервуючий засіб.
Азид натрію (Na3N) застосовується як азотуючий засіб у металургії та при отриманні азиду свинцю.
Ціанід натрію (NaCN) застосовується при гідрометалургійному способі вилуговування золота з гірських порід, а також при нітроцементації сталі та в гальванотехніці (срібло, золочення).
Хлорат натрію (NaClO3) застосовується для знищення небажаної рослинності на залізничному полотні.
Калій
Калій - елемент головної підгрупи першої групи, четвертого періодуперіодичної системи хімічних елементів Д. І. Менделєєва Дмитра Івановича з атомним номером 19. Позначається символом K (лат. Kalium). Проста речовина калій (CAS-номер: 7440-09-7) – м'який лужний метал сріблясто-білого кольору.
У природі калій зустрічається лише у з'єднаннях з іншими елементами, наприклад, у морській воді, а також у багатьох мінералах. Він дуже швидко окислюється на повітрі і дуже легко входить у хімічні реакції, особливо з водою, утворюючи луг. У багатьох відношеннях хімічні властивості калію дуже близькі до натрію, але з погляду біологічної функціїі використання їх клітинами живих організмів вони все ж таки відрізняються.
Калій (точніше, його сполуки) використовувався з давніх-давен. Так, виробництво поташу (який застосовувався як миючий засіб) існувало вже у XI столітті. Попелю, що утворюється при спалюванні соломи або деревини, обробляли водою, а отриманий розчин (луг) після фільтрування випарювали. Сухий залишок, крім карбонату калію, містив сульфат калію K2SO4, соду та хлорид калію KCl.
У 1807 р. англійський хімік Деві електролізом твердого їдкого калі (KOH) виділив калій і назвав його «потасій» (лат. potassium; ця назва досі вживається в англійській, французькій, іспанській, португальській та польській мовах). В 1809 Л. В. Гільберт запропонував назву «калій» (лат. kalium, від араб. аль-калі - поташ). Ця назва увійшла до німецька мова, звідти більшість мов Північної і Східної Європи (зокрема російський) і «перемогло» під час виборів символу цього елемента — K.
Калій - срібляста речовина з характерним блиском на свіжоствореній поверхні. Дуже легкий та легкоплавкий. Відносно добре розчиняється у ртуті, утворюючи амальгами. Будучи внесеним у полум'я пальника калій (а також його сполуки) забарвлює полум'я у характерний рожево-фіолетовий колір.
Калій, як і інші лужні метали, виявляє типові металеві властивості та дуже хімічно активний, легко віддає електрони.
Є сильним відновником. Він настільки активно поєднується з киснем, що утворюється не оксид, а супероксид калію KO2 (або K2O4). При нагріванні атмосфері водню утворюється гідрид калію KH. Добре взаємодіє з усіма неметалами, утворюючи галогеніди, сульфіди, нітриди, фосфіди і т. д., а також зі складними речовинами, такими як вода (реакція проходить з вибухом), різні оксиди та солі. І тут вони відновлюють інші метали до вільного стану.
Калій зберігають під шаром гасу.
Рідкий при кімнатній температурі сплав калію та натрію використовується як теплоносій у замкнутих системах, наприклад, в атомних силових установках на швидких нейтронах. Крім того, широко застосовуються його рідкі сплави з рубідієм та цезієм. Сплав складу натрій 12 %, калій 47 %, цезій 41 % має рекордно низьку температуру плавлення −78 °C.
Сполуки калію - найважливіший біогенний елемент і тому застосовуються як добрива.
Солі калію широко використовуються в гальванотехніці, оскільки, незважаючи на відносно високу вартість, вони часто розчинніші, ніж відповідні солі натрію, і тому забезпечують інтенсивну роботу електролітів при підвищеній щільності струму.
Калій - найважливіший біогенний елемент, особливо у рослинному світі. При нестачі калію в грунті рослини розвиваються дуже погано, зменшується, тому близько 90% солей калію, що добувають, використовують як добрива.
Калій поряд з азотом та фосфором відносяться до головних елементів живлення рослин. Функція калію в рослинах, як та інших необхідних їм елементів, суворо специфічна. У рослинах калій знаходиться у іонній формі. Калій міститься в основному в цитоплазмі та вакуолях клітин. Близько 80% калію знаходиться у клітинному соку.
Функції калію дуже різноманітні. Встановлено, що стимулює нормальний перебіг фотосинтезу, посилює відтік вуглеводів від пластинок листа в інші органи, а також синтез цукрів.
Калій посилює накопичення моноцукорів у плодових та овочевих культурах, підвищує вміст цукрів у коренеплодах, крохмалю в картоплі, потовщує стінки клітин соломини злакових культур та підвищує стійкість хлібів до вилягання, а у льону та конопель покращує якість волокна.
Сприяючи накопиченню вуглеводів у клітинах рослин, калій збільшує осмотичний тиск клітинного соку і тим самим підвищує холодостійкість та морозостійкість рослин.
Калій поглинається рослинами у вигляді катіонів і, очевидно, у такій формі залишається у клітинах, активізуючи найважливіші біохімічні процесиу клітинах рослини, калій підвищує їх стійкість до різним захворюванням, Як протягом вегетації, так і в післязбиральний, значно покращує лежкість плодів та овочів.
Нестача калію викликає безліч порушень обміну речовин у рослин, послаблюється діяльність ряду ферментів, порушується вуглеводний та білковий обмін, підвищується витративуглеводів на дихання. У результаті продуктивність рослин падає, якість продукції знижується.



Рубідій
Рубідій є елементом головної підгрупи першої групи, п'ятого періоду періодичної системи хімічних елементів Д. І. Дмитра Івановича Менделєєва, з атомним номером 37. Позначається символом Rb (лат. Rubidium). Проста речовина рубідій (CAS-номер: 7440-17-7) – м'який лужний метал сріблясто-білого кольору.
У 1861 році німецькі вчені Роберт Вільгельм Бунзен та Густав Роберт Кірхгоф, вивчаючи за допомогою спектрального аналізу природні алюмосилікати, виявили в них новий елемент, згодом названий рубідієм за кольором найсильніших ліній спектру.
Рубідій утворює сріблясто-білі м'які кристали, що мають на свіжому зрізі металевий блиск. Твердість по Брінеллю 0,2 Мн/мІ (0,02 кгс/ммІ). Кристалічні грати Рубідія об'ємно-центровані кубічні, а=5,71 Е (при кімнатній температурі). Атомний радіус 2,48 Е, радіус іона Rb+ 1,49 Е. Щільність 1,525 г/смі (0 °C), tпл 38,9 °C, tкіп 703 °C. Питома теплоємність 335,2 дж/(кг·К), термічний коефіцієнт лінійного розширення 9,0·10-5 град-1 (0-38 °С), модуль пружності 2,4 Гн/мІ (240 кгс/ммІ), питомий об'ємний електричний опір 11,29 · 10-6 ом · см (20 ° C); рубідій парамагнітний.
Лужний метал вкрай нестійкий на повітрі (реагує з повітрям у присутності слідів води із запаленням). Утворює всі види солей — переважно легкорозчинні (хлорати та перхлорати малорозчинні). Гідроксид рубідія дуже агресивна речовина до скла та інших конструкційних та контейнерних матеріалів, а розплавлений руйнує більшість металів (навіть і платину).
Застосування рубідія різноманітне і, незважаючи на те, що по ряду своїх областей застосування він поступається своїми найважливішими фізичними характеристиками цезію, проте цей рідкісний лужний метал відіграє важливу роль у сучасних технологіях. Можна відзначити такі сфери застосування рубідія: каталіз, електронна промисловість, спеціальна оптика, атомна, медицина.
Рубідій використовується у чистому вигляді, а й у вигляді низки сплавів і хімічних сполук. Важливо відзначити, що рубідій має дуже хорошу і сприятливу сировинну базу, але при цьому становище з забезпеченістю ресурсами набагато сприятливіше, ніж у випадку з цезієм і рубідій здатний зайняти ще більш важливу роль, наприклад, в каталізі (де успішно себе зарекомендував).
Ізотоп рубідій-86 широко використовується в гамма-дефектоскопії, вимірювальній техніці, а також при стерилізації ряду важливих ліків і харчових продуктів. Рубідій і його сплави з цезієм - це дуже перспективний теплоносій і робоче середовище для високотемпературних турбоагрегатів (у зв'язку з цим рубідій і цезій в останні роки набули важливого значення, і надзвичайна дорожнеча металів йде на другий план по відношенню до можливостей різко збільшити ККД турбоагрегатів, а значить та знизити витратипалива та забруднення навколишнього середовища). Застосовувані найбільш широко як теплоносії системи на основі рубідія - це потрійні сплави: натрій-калій-рубідій, і натрій-рубідій-цезій.
У каталізі рубідій використовується як в органічному, так і неорганічному синтезі. Каталітична активність рубідія використовується в основному для нафтопереробки на низку важливих продуктів. Ацетат рубідія, наприклад, використовується для синтезу метанолу та цілого ряду вищих спиртів з водяного газу, що у свою чергу надзвичайно актуально у зв'язку з підземною газифікацією вугілля та виробництві штучного рідкого палива для автомобілів та реактивного палива. Ряд сплавів рубідія з телуром мають більш високу чутливість в ультрафіолетовій області спектру, ніж сполуки цезію, і у зв'язку з цим він здатний у цьому випадку скласти конкуренцію цезію-133 як матеріал для фотоперетворювачів. У складі спеціальних мастильних композицій (сплавів), рубідій застосовується як високоефективне мастило у вакуумі (ракетна та космічна техніка).
Гідроксид рубідія застосовується для приготування електроліту для низькотемпературних ХІТ, а також як добавка до розчину гідроксиду калію для поліпшення його працездатності низьких температурахта підвищення електропровідності електроліту. У гідридних паливних елементах знаходить застосування металевий рубідій.
Хлорид рубідія у сплаві з хлоридом купруму знаходить застосування для вимірювання високих температур (до 400 ° C).
Плазма рубідія знаходить застосування збудження лазерного випромінювання.
Хлорид рубідія застосовується в паливних елементах як електроліт, те ж можна сказати і про гідроксид рубідія, який дуже ефективний як електроліт у паливних елементах, що використовують пряме окислення вугілля.
Цезій
Цезій — елемент головної підгрупи першої групи, шостого періоду періодичної системи хімічних елементів Д. І. Менделєєва Дмитра Івановича з атомним номером 55. Позначається символом Cs (лат. Caesium). Проста речовина цезій (CAS-номер: 7440-46-2) – м'який лужний метал сріблясто-жовтого кольору. Свою назву цезій отримав за наявність двох яскравих синіх ліній в емісійному спектрі (від лат. Caesius – небесно-блакитний).
Цезій було відкрито 1860 року німецькими вченими Р. У. Бунзеном і Р. Р. Кірхгофом у водах Дюрхгеймського мінерального джерела Республіки Німеччини методом оптичної спектроскопії, цим, ставши першим елементом, відкритим з допомогою спектрального аналізу. У чистому вигляді цезій вперше було виділено 1882 року шведським хіміком К. Сеттербергом при електролізі розплаву суміші ціаніду цезію (CsCN) і барію.
Основними цезієвими мінералами є поллуцит і дуже рідкісний вагадрит (K, Cs). Крім того, у вигляді домішок цезій входить до ряду алюмосилікатів: лепідоліт, флогопіт, біотит, амазоніт, петаліт, берил, циннвальдіт, лейцит, карналіт. Як промислову сировину використовуються півлуцит і лепідоліт.
При промисловому отриманні цезій як сполук вилучається з мінералу поллуцита. Це робиться хлоридним або сульфатним розтином. Перше включає обробку вихідного мінералу підігрітою соляною кислотою, додавання хлориду сурми SbCl3 для осадження сполуки Cs3 та промивання гарячою водою або розчином аміаку з утворенням цезію хлориду CsCl. При другому обробляється підігрітою сірчаною кислотою з утворенням алюмоцезієвих галунів CsAl(SO4)2 · 12H2O.
У Російської Федераціїпісля розпаду СРСР промисловий видобуток півлуцита не велася, хоча у Вороньій тундрі під Мурманськом ще за радянських часів було виявлено колосальні запаси мінералу. На той час, коли російська промисловість змогла стати на ноги, з'ясувалося, що ліцензію на розробку цього родовища купила Канадська. В даний час переробка та вилучення солей цезію з півлуцита ведеться в Новосибірську на ЗАТ «Завод рідкісних металів».
Існує декілька лабораторних методівотримання цезію. Він може бути отриманий:
нагріванням у вакуумі суміші хромату або дихромату цезію з цирконієм;
розкладанням азиду цезію у вакуумі;
нагріванням суміші хлориду цезію та спеціально підготовленого кальцію.
Усі методи є трудомісткими. Другий дозволяє отримати високочистий метал, проте є вибухонебезпечним та вимагає на реалізацію кілька діб.
Цезій знайшов застосування лише на початку XX століття, коли було виявлено його мінерали та розроблено технологію отримання в чистому вигляді. В даний час цезій та його сполуки використовуються в електроніці, радіо-, електро-, рентгенотехніці, хімічній промисловості, оптиці, медицині, ядерній енергетиці. В основному застосовується стабільний природний цезій-133, і обмежено його радіоактивний ізотоп цезій-137, що виділяється з суми осколків поділу урану, плутонію, торію в реакторах атомних електростанцій.
Лужноземельні метали
Лужноземельні метали хімічні елементи: кальцій Ca, стронцій Sr, барій Ba, радій Ra (іноді до лужноземельних металів помилково відносять також берилій Be та магній Mg). Названо так тому, що їхні оксиди – «землі» (за термінологією алхіміків) – повідомляють воді лужну реакцію. Солі лужноземельних металів, крім радію, широко поширені у природі у вигляді мінералів.
Кальцій
Кальцій - елемент головної підгрупи другої групи, четвертого періоду періодичної системи хімічних елементів Д. І. Дмитра Івановича Менделєєва, з атомним номером 20. Позначається символом Ca (лат. Calcium). Проста речовина кальцій (CAS-номер: 7440-70-2) – м'який, хімічно активний лужноземельний металсріблясто-білого кольору.
Метал кальцій існує у двох алотропних модифікаціях. До 443 °C стійкий α-Ca з кубічною гранецентрованою решіткою (параметр а = 0,558 нм), вище стійкий β-Ca з кубічною об'ємно-центрованою решіткою типу α-Fe (параметр a = 0,448 нм). Стандартна ентальпія ΔH0 переходу α → β становить 0,93 кДж/моль.
Кальцій – типовий лужноземельний метал. Хімічна активність кальцію висока, але нижче, ніж решти лужноземельних металів. Він легко взаємодіє з киснем, вуглекислим газом і вологою повітря, через що поверхня металевого кальцію зазвичай тьмяно сіра, тому в лабораторії кальцій зазвичай зберігають, як і інші лужноземельні метали, у щільно закритій банці під шаром гасу або рідкого парафіну.
У ряді стандартних потенціалів кальцій розташований ліворуч від водню. Стандартний електродний потенціал пари Ca2+/Ca0 −2,84, так що кальцій активно реагує з водою, але без запалення:
Ca + 2Н2О = Ca(ОН)2 + Н2 + Q.
З активними неметалами (киснем, хлором, бромом) кальцій реагує за звичайних умов:
2Са + О2 = 2СаО, Са + Br2 = CaBr2.
При нагріванні на повітрі чи кисні кальцій запалюється. З менш активними неметалами (воднем, бором, вуглецем, кремнієм, азотом, фосфором та іншими) кальцій вступає у взаємодію при нагріванні, наприклад:
Са + Н2 = СаН2, Ca + 6B = CaB6,
3Ca + N2 = Ca3N2, Са + 2С = СаС2,
3Са + 2Р = Са3Р2 (фосфід кальцію), відомі також фосфіди кальцію складів СаР та СаР5;
2Ca + Si = Ca2Si (силіцид кальцію), відомі також силіциди кальцію складів CaSi, Ca3Si4 та CaSi2.
Перебіг зазначених вище реакцій, як правило, супроводжується виділенням великої кількостітеплоти (тобто ці реакції – екзотермічні). У всіх з'єднаннях з неметалами ступінь окиснення кальцію +2. Більшість сполук кальцію з неметалами легко розкладається водою, наприклад:
СаН2 + 2Н2О = Са(ОН)2 + 2Н2,
Ca3N2 + 3Н2О = 3Са(ОН)2 + 2NH3.
Іон Ca2+ безбарвний. При внесенні в полум'я розчинних солей кальцію полум'я забарвлюється цегляно-червоний колір.
Такі солі кальцію, як хлорид CaCl2, бромід CaBr2, йодид CaI2 і нітрат Ca(NO3)2, добре розчиняються у воді. Нерозчинні у воді фторид CaF2, карбонат CaCO3, сульфат CaSO4, ортофосфат Ca3(PO4)2, оксалат СаС2О4 та деякі інші.
Важливе значення має та обставина, що, на відміну від карбонату кальцію СаСО3, кислий карбонат кальцію (гідрокарбонат) Са(НСО3)2 у воді розчинний. У природі це призводить до таких процесів. Коли холодна дощова або річкова вода, насичена вуглекислим газом, проникає під землю та потрапляє на вапняки, то спостерігається їх розчинення:
СаСО3 + СО2 + Н2О = Са(НСО3)2.
У тих же місцях, де вода, насичена гідрокарбонатом кальцію, виходить на поверхню землі та нагрівається сонячним промінням, протікає зворотна реакція:
Са(НСО3)2 = СаСО3 + СО2 + Н2О.
Так у природі відбувається перенесення великих мас речовин. У результаті під землею можуть утворитися величезні провали, а в печерах утворюються гарні кам'яні бурульки - сталактити та сталагміти.
Наявність у воді розчиненого гідрокарбонату кальцію багато в чому визначає тимчасову твердість води. Тимчасової її називають тому, що при кип'ятінні води гідрокарбонат розкладається, і осад випадає СаСО3. Це явище призводить, наприклад, до того, що в чайнику з часом утворюється накип.
Стронцій
Стро́нцій — елемент головної підгрупи другої групи, п'ятого періоду періодичної системи хімічних елементів Д. І. Менделєєва Дмитра Івановича з атомним номером 38. Позначається символом Sr (лат. Strontium). Проста речовина стронцій (CAS-номер: 7440-24-6) - м'який, ковкий та пластичний лужноземельний метал сріблясто-білого кольору. Має високу хімічну активність, на повітрі швидко реагує з вологою і киснем, покриваючись жовтою оксидною плівкою.
Новий елемент виявили в мінералі стронціаніті, знайденому в 1764 році в свинцевому руднику поблизу шотландського села Строншіан, що згодом дала назву новому елементу. Присутність у цьому мінералі оксиду нового металу була встановлена майже через 30 років Вільямом Крюйкшенком та Адером Кроуфордом. Виділено у чистому вигляді сером Хемфрі Деві у 1808 році.
Стронцій - м'який сріблясто-білий метал, має ковкість і пластичність, легко ріжеться ножем.
Поліморфен - відомі три його модифікації. До 215оС стійка кубічна гранецентрована модифікація (α-Sr), між 215 і 605оС - гексагональна (β-Sr), вище 605оС - кубічна об'ємно-центрована модифікація (γ-Sr).
Температура плавлення – 768оС, Температура кипіння – 1390оС.
Стронцій у своїх сполуках завжди виявляє валентність +2. За властивостями стронцій близький до кальцію та барію, займаючи проміжне положення між ними.
У електрохімічному ряду напруг стронцій знаходиться серед найбільш активних металів(його нормальний електродний потенціал дорівнює −2,89 В. Енергійно реагує з водою, утворюючи гідроксид:
Sr + 2H2O = Sr(OH)2 + H2
Взаємодіє з кислотами, витісняє важкі метали зі своїх солей. З концентрованими кислотами (H2SO4, HNO3) слабо реагує.
Металевий стронцій швидко окислюється на повітрі, утворюючи жовту плівку, в якій крім оксиду SrO завжди присутні пероксид SrO2 і нітрид Sr3N2. При нагріванні на повітрі спалахує, порошкоподібний стронцій на повітрі схильний до самозаймання.
Енергійно реагує з неметалами - сіркою, фосфором, галогенами. Взаємодіє з воднем (понад 200оС), азотом (вище 400оС). Практично не реагує із лугами.
При високих температурах реагує з CO2, утворюючи карбід:
5Sr + 2CO2 = SrC2 + 4SrO
Легкорозчинні солі стронцію з аніонами Cl-, I-, NO3-. Солі з аніонами F-, SO42-, CO32-, PO43-малорозчинні.
Стронцій застосовується для легування купруму та деяких її сплавів, для введення в акумуляторні свинцеві сплави, для знесірювання чавуну, купруму та сталей.
Барій
Барій - елемент головної підгрупи другої групи, шостого періоду періодичної системи хімічних елементів Д. І. Дмитра Івановича Менделєєва, з атомним номером 56. Позначається символом Ba (лат. Barium). Проста речовина барій (CAS-номер: 7440-39-3) - м'який, ковкий лужноземельний метал сріблясто-білого кольору. Має високу хімічну активність.
Барій було відкрито як оксиду BaO в 1774 р. Карлом Шееле. У 1808 році англійський хімік Гемфрі Деві електролізом вологого гідроксиду барію з ртутним катодом отримав амальгамубарію; після випаровування ртуті під час нагрівання він виділив металевий барій.
Барій - сріблясто-білий ковкий метал. При різкому ударі розколюється. Існують дві алотропні модифікації барію: до 375 °C стійкий α-Ba з кубічними об'ємно-центрованими гратами (параметр а = 0,501 нм), вище стійкий β-Ba.
Твердість за мінералогічною шкалою 1,25; за шкалою Моосу 2.
Зберігають металевий барій у гасі або під шаром парафіну.
Барій - лужноземельний метал. Інтенсивно окислюється на повітрі, утворюючи оксид барію BaO і нітрид барію Ba3N2, а при незначному нагріванні спалахує. Енергійно реагує з водою, утворюючи гідроксид барію Ba(OH)2:
Ba + 2Н2О = Ba(ОН)2 + Н2
Активно взаємодіє із розведеними кислотами. Багато солі барію нерозчинні або малорозчинні у воді: сульфат барію BaSO4, сульфіт барію BaSO3, карбонат барію BaCO3, фосфат барію Ba3(PO4)2. Сульфід барію BaS, на відміну від сульфіду кальцію CaS, добре розчинний у воді.
Легко входить у реакцію з галогенами, утворюючи галогеніди.
При нагріванні з воднем утворює гідрид барію BaH2, який у свою чергу з гідридом літію LiH дає комплекс Li.
Реагує при нагріванні з аміаком:
6Ba + 2NH3 = 3BaH2 + Ba3N2
Нітрид барію Ba3N2 при нагріванні взаємодіє з CO, утворюючи ціанід:
Ba3N2 + 2CO = Ba(CN)2 + 2BaO
З рідким аміаком дає темно-синій розчин, з якого можна виділити аміакат, що має золотистий блиск і легко розкладається з відщепленням NH3. У присутності платинового каталізатора аміакат розкладається з утворенням аміду барію:
Ba(NH2)2 + 4NH3 + Н2
Карбід барію BaC2 може бути отриманий при нагріванні в печі дугової BaO з вугіллям.
З фосфором утворює фосфід Ba3P2.
Барій відновлює оксиди, галогеніди та сульфіди багатьох металів до відповідного металу.
Металевий барій, часто в сплаві з алюмінієм використовується як газопоглинач (геттер) у високовакуумних електронних приладах, а також додається спільно з цирконієм в рідкометалеві теплоносії (сплави натрію, калію, рубідія, літію, цезію) для зменшення агресивності до трубопровід. металургії.
Перехідні метали
Перехідні метали (перехідні елементи) - елементи побічних підгруп Періодичної системи хімічних елементів Д. І. Менделєєва Дмитра Івановича, в атомах яких з'являються електрони на d-і f-орбіталях. У загальному виглядіЕлектронна будова перехідних елементів можна наступним чином: . На ns-орбіталі міститься один або два електрони, інші валентні електрони знаходяться на -орбіталі. Оскільки число валентних електронів помітно менше від числа орбіталей, то прості речовини, утворені перехідними елементами, є металами.
Загальна характеристика перехідних елементів
Усі перехідні елементи мають такі загальні характеристики:
Невеликі значення електронегативності.
Змінні ступені окислення. Майже для всіх d-елементів, в атомах яких на зовнішньому ns-підрівні знаходяться 2 валентні електрони, відомий ступінь окислення +2.
Починаючи з d-елементів ІІІ групи Періодичної системи хімічних елементів Д. І. Дмитра Івановича Менделєєва, елементи в нижчому ступені окислення утворюють сполуки, які виявляють основні властивості, у вищій — кислотні, у проміжній — амфотерні.
Залізо
Залізо — елемент побічної підгрупи восьмої групи четвертого періоду періодичної системи хімічних елементів Д. І. Менделєєва Дмитра Івановича, атомний номер 26. Позначається символом Fe (лат. Ferrum). Один із найпоширеніших у земній корі металів (друге місце після алюмінію).
Проста речовина залізо (CAS-номер: 7439-89-6) - ковкий метал сріблясто-білого кольору з високою хімічною реакційною здатністю: залізо швидко корродує при високих температурах або за високої вологості на повітрі. У чистому кисні залізо горить, а в дрібнодисперсному стані самозаймається і на повітрі.
Насправді залізом зазвичай називають його сплави з малим вмістом домішок (до 0,8%), які зберігають м'якість та пластичність чистого металу. Але на практиці частіше застосовуються сплави заліза з вуглецем: (до 2% вуглецю) і (більше 2% вуглецю), а також нержавіюча (легована) сталь з добавками легуючих металів (хром, марганець, Ni та ін.). Сукупність специфічних властивостейзаліза та його сплавів роблять його «металом № 1» за важливістю для людини.
У природі залізо рідко зустрічається у чистому вигляді, найчастіше воно зустрічається у складі залізо-нікелевих метеоритів. Поширеність заліза в земній корі - 4,65% (4-е місце після O, Si, Al). Вважається також, що залізо становить більшу частину земного ядра.




Залізо – типовий метал, у вільному стані – сріблясто-білого кольору з сіруватим відтінком. Чистий метал пластичний, різні домішки (зокрема вуглець) підвищують його твердість і крихкість. Має яскраво виражені магнітні властивості. Часто виділяють так звану "тріаду заліза" - групу трьох металів (залізо Fe, кобальт Co, Ni Ni), що мають схожі фізичні властивості, атомні радіуси і значення електронегативності.
Для заліза характерний поліморфізм, він має чотири кристалічні модифікації:
до 769 °C існує α-Fe (ферит) з об'ємноцентрованими кубічними гратами та властивостями феромагнетика (769 °C ≈ 1043 K — точка Кюрі для заліза)
у температурному інтервалі 769—917 °C існує β-Fe, який відрізняється від α-Fe лише параметрами об'ємноцентрованої кубічної ґрати та магнітними властивостями парамагнетика.
у температурному інтервалі 917—1394 °C існує γ-Fe (аустеніт) з гранецентрованими кубічними гратами
вище 1394 °C стійкий δ-Fe з об'ємоцентрованими кубічними гратами
Металознавство не виділяє β-Fe як окрему фазу і розглядає її як різновид α-Fe. При нагріванні заліза або сталі вище точки Кюрі (769 °C ≈ 1043 K) тепловий рух іонів засмучує орієнтацію спінових магнітних моментів електронів, феромагнетик стає парамагнетиком - відбувається фазовий перехід другого роду, але фазового переходу першого роду зі зміною основних фізичних параметрів кристалів не відбувається.
Для чистого заліза за нормального тиску, з погляду металознавства, існують такі стійкі модифікації:
Від абсолютного нуля до 910 єC стійка α-модифікація з об'ємноцентрованими кубічними (ОЦК) кристалічними гратами. Твердий розчин вуглецю в -залізі називається феритом.
Від 910 до 1400 єC стійка γ-модифікація з гранецентрованою кубічною (ГЦК) кристалічною решіткою. Твердий розчин вуглецю в γ-залізі називається аустенітом.
Від 910 до 1539 є C стійка δ-модифікація з об'ємноцентрованим кубічною (ОЦК) кристалічною решіткою. Твердий розчин вуглецю в δ-залізі (так само, як і в α-залізі) називається феритом. Іноді розрізняють високотемпературний -ферит і низькотемпературний -ферит (або просто ферит), хоча їх атомні структури однакові.
Наявність у сталі вуглецю та легуючих елементів істотно змінює температури фазових переходів.
В області високих тисків(понад 104 МПа, 100 тис. атм.) виникає модифікація ε-заліза з гексагональним щільноупакованим (ГПУ) ґратами.
Явище поліморфізму надзвичайно важливе для металургії сталі. Саме завдяки α-γ переходам кристалічних ґрат відбувається термообробка сталі. Без цього явища залізо, як основа стали не набуло б такого широкого застосування.
Залізо тугоплавке, відноситься до металів середньої активності. Температура плавлення заліза 1539 ° C, температура кипіння - близько 3200 ° C.
Залізо — один із найбільш застосовуваних металів, на нього припадає до 95 % світового металургійного виробництва.
Залізо є основним компонентом сталей та чавунів – найважливіших конструкційних матеріалів.
Залізо може входити до складу сплавів на основі інших металів, наприклад, нікелевих.
Магнітний окис заліза (магнетит) - важливий матеріал у виробництві пристроїв довгострокової комп'ютерної пам'яті: жорстких дисків, дискет тощо.
Ультрадисперсний порошок магнетиту використовується в чорно-білих лазерних принтерах як тонер.
Унікальні феромагнітні властивості ряду сплавів на основі заліза сприяють їх широкому застосуванню в електротехніці для магнітопроводів трансформаторів та електродвигунів.
Хлорид заліза (III) (хлорне залізо) використовується в радіоаматорській практиці для травлення друкованих плат.
Семиводний сульфат заліза (залізний купорос) у суміші з мідним купоросом використовується для боротьби зі шкідливими грибками у садівництві та будівництві.
Залізо застосовується як анод в залізо-нікелевих акумуляторах, залізо-повітряних акумуляторах.
Мідь
Мідь - елемент побічної підгрупи першої групи, четвертого періоду періодичної системи хімічних елементів Д. І. Дмитра Івановича Менделєєва з атомним номером 29. Позначається символом Cu (лат. Cuprum). Проста речовина мідь (CAS-номер: 7440-50-8) – це пластичний перехідний метал золотисто-рожевого кольору (рожевого кольору за відсутності оксидної плівки). З давніх-давен широко застосовується людиною.



Мідь - золотисто-рожевий пластичний метал, на повітрі швидко покривається оксидною плівкою, яка надає їй характерного інтенсивного жовтувато-червоного відтінку. Мідь має високу тепло- та електропровідність (займає друге місце по електропровідності після срібла). Має два стабільні ізотопи - 63Cu і 65Cu, і кілька радіоактивних ізотопів. Найбільш довгоживучий з них, 64Cu, має період напіврозпаду 12,7 год і два варіанти розпаду з різними продуктами.
Щільність - 8,94 * 10і кг/мі
Питома теплоємність при 20 °C – 390 Дж/кг*К
Питомий електричний опір при 20-100 ° С - 1,78 · 10-8 Ом · м
Температура плавлення - 1083 °C
Температура кипіння - 2600 °C
Існує ряд сплавів купруму: латунь - сплав купруму з цинком, - сплав купруму з оловом, мельхіор - сплав купруму та нікелю, та деякі інші.
Цинк
Цинк — елемент побічної підгрупи другої групи, четвертого періоду періодичної системи хімічних елементів Д. І. Менделєєва Дмитра Івановича з атомним номером 30. Позначається символом Zn (лат. Zinkum). Проста речовина (CAS-номер: 7440-66-6) за нормальних умов — крихкий перехідний метал блакитно-білого кольору (тьмяніє на повітрі, покриваючись тонким шаром оксиду цинку).
У чистому вигляді досить пластичний сріблясто-білий метал. Має гексагональні грати з параметрами а = 0,26649 нм, с = 0,49468 нм. При кімнатній температурі крихкий, при згинанні платівки чути тріск від тертя кристалітів (зазвичай сильніше, ніж крик олова). При 100-150 ° C цинк пластичний. Домішки, навіть незначні, різко збільшують крихкість цинку.
Типовий амфотерний метал. Стандартний електродний потенціал -0,76 В, у ряді стандартних потенціалів розташований до заліза.
На повітрі цинк покривається тонкою плівкою оксиду ZnO. При сильному нагріванні згоряє з утворенням білого амфотерного оксиду ZnO:
2Zn + O2 = 2ZnO.
Оксид цинку реагує як з розчинами кислот:
ZnO + 2HNO3 = Zn(NO3)2 + H2O
так і лугами:
ZnO + 2NaOH = Na2ZnO2 + Н2О,
Цинк звичайної чистоти активно реагує з розчинами кислот:
Zn + 2HCl = ZnCl2 + H2,
Zn + H2SO4 (розб.) = ZnSO4 + H2
та розчинами лугів:
Zn + 2NaOH + 2H2O = Na2 + H2,
утворюючи гідроксоцінкати. З розчинами кислот та лугів дуже чистий цинк не реагує. Взаємодія починається при додаванні кількох крапель розчину сульфату купруму CuSO4.
При нагріванні цинк реагує з галогенами з утворенням галогенідів ZnHal2. З фосфором цинк утворює фосфіди Zn3P2 та ZnP2. З сіркою та її аналогами - селеном і телуром - різні халькогеніди, ZnS, ZnSe, ZnSe2 та ZnTe.
З воднем, азотом, вуглецем, кремнієм та бором цинк безпосередньо не реагує. Нітрид Zn3N2 одержують реакцією цинку з аміаком при 550-600°C.
У водних розчинахіони цинку Zn2+ утворюють аквакомплекси 2+ та 2+.
Чистий металевий цинк використовується для відновлення шляхетних металів, що видобувають підземне вилуговування (золото, срібло). Крім того, цинк використовується для вилучення срібла, золота (та інших металів) з чорнового свинцю у вигляді інтерметалідів цинку зі сріблом і золотом (так званої «сріблястої піни»), які потім обробляють звичайними методами афінажу.
Застосовується для захисту сталі від корозії (оцинкування поверхонь, що не схильні до механічних впливів, або металізація — для мостів, ємностей, металоконструкцій). Також використовується як матеріал для негативного електрода в хімічних джерелах струму, тобто в батарейках і акумуляторах, наприклад: марганцево-цинковий елемент, срібно-цинковий акумулятор (ЕРС 1,85 В, 150 Вт·ч/кг, 650 Вт·ч/ дмі, малий опір та колосальні розрядні струми, ртутно-цинковий елемент (ЕРС 1,35 В, 135 Вт·ч/кг, 550-650 Вт·ч/дмі), діоксисульфатно-ртутний елемент, йодатно-цинковий елемент, мідно-окисний гальванічний елемент (ЕРС 0,7-1,6 Вольт, 84-127 Вт·ч/кг, 410-570 Вт·ч/дмі), хром-цинковий елемент, цинк-хлоросрібний елемент, нікель-цинковий акумулятор (ЕРС 1, 82 Вольт, 95-118 Вт·ч/кг, 230-295 Вт·ч/дмі), свинцево-цинковий елемент, цинк-хлорний акумулятор, цинк-бромний акумулятор та ін). Дуже важлива роль цинку в цинк-повітряних акумуляторах, останніми роками інтенсивно розробляються на основі системи цинк-повітря — акумулятори для комп'ютерів (ноутбуки) і в цій галузі досягнуто значного успіху (більші, ніж у літієвих батарей, ємність і ресурс, менша за 3 рази вартість), так само ця система дуже перспективна для пуску двигунів (свинцевий акумулятор - 55 Вт · год / кг, цинк-повітря - 220-300 Вт · год / кг) і для електромобілів (пробіг до 900 км). Входить до складу багатьох твердих припоїв зниження їх температури плавлення. Цинк – важливий компонент латуні. Окис цинку широко використовується в медицині як антисептичний та протизапальний засіб. Також оксид цинку використовується для виробництва фарби – цинкових білил.
Хлорид цинку - важливий флюс для паяння металів та компонентів при виробництві фібри.
Телурид, селенід, фосфід, сульфід цинку - напівпровідники, що широко застосовуються.
Селенід цинку використовується для виготовлення оптичного скла з дуже низьким коефіцієнтом поглинання в середньому інфрачервоному діапазоні, наприклад, вуглекислотних лазерах.
Ртуть
Ртуть — елемент побічної підгрупи другої групи, шостого періоду періодичної системи хімічних елементів Д. І. Дмитра Івановича Менделєєва з атомним номером 80. Позначається символом Hg (лат. Hydrargyrum). Проста речовина ртуть (CAS-номер: 7439-97-6) — перехідний метал, при кімнатній температурі є важкою сріблясто-білою помітно летючою рідиною, пари якої надзвичайно отруйні. Ртуть — один із двох хімічних елементів (і єдиний метал), прості речовини яких за нормальних умов перебувають у рідкому агрегатному стані (другий елемент — бром). У природі перебуває як у самородному вигляді, і утворює ряд мінералів. Найчастіше ртуть отримують шляхом відновлення з найпоширенішого мінералу — кіноварі. Застосовується для виготовлення вимірювальних приладів, вакуумних насосів, джерел світла та інших галузях науки і техніки.
Ртуть – єдиний метал, рідкий за кімнатної температури. Має властивості діамагнетика. Утворює з багатьма металами рідкі сплави. амальгами. Не амальгамуються лише залізо, марганець та Ni.
Ртуть – малоактивний метал.
При нагріванні до 300 °C ртуть набуває реакції з киснем: 2Hg + O2 → 2HgO Утворюється оксид ртуті(II) червоного кольору. Ця реакція є оборотною: при нагріванні вище 340 °C оксид розкладається до простих речовин. Реакція розкладання оксиду ртуті історично одна із перших способів отримання кисню.
При нагріванні ртуті із сіркою утворюється сульфід ртуті(II).
Ртуть не розчиняється в розчинах кислот, які не мають окисними властивостями, але розчиняється в царській горілці та азотної кислотиутворюючи солі двовалентної ртуті. При розчиненні надлишку ртуті азотної кислоти на холоді утворюється нітрат Hg2(NO3)2.
З елементів IIБ групи саме у ртуті з'являється можливість руйнування дуже стійкої 6d10 - електронної оболонки, що призводить до існування сполук ртуті (+4). Так, крім малорозчинного Hg2F2 і HgF2, що розкладається водою, існує і HgF4, одержуваний при взаємодії атомів ртуті і суміші неону і фтору при температурі 4К.
Ртуть застосовується у виготовленні термометрів, парами ртуті наповнюються ртутно-кварцові та люмінесцентні лампи. Ртутні контакти є датчиками положення. Крім того, металева ртуть застосовується для одержання цілого ряду найважливіших сплавів.
Раніше різні амальгами металів, особливо амальгами золота та срібла, широко використовувалися у ювелірній справі, у виробництві дзеркал та зубних пломб. У техніці ртуть широко застосовувалася для барометрів та манометрів. З'єднання ртуті використовувалися як антисептик (сулема), проносне (каломель), у капелюшному виробництві і т.д., але у зв'язку з її високою токсичністю до кінця XX століття були практично витіснені з цих сфер (заміна амальгамування на напилення та електроосадження металів, полімерні пломби у стоматології).
Сплав ртуті із талієм використовується для низькотемпературних термометрів.
Металева ртуть служить катодом для електролітичного отримання ряду активних металів, хлору та лугів, у деяких хімічних джерелах струму (наприклад, ртутно-цинкових тип РЦ), в еталонних джерелах напруги (Вестона елемент). Ртутно-цинковий елемент (ЕДС 1,35 Вольт) має дуже високу енергію за об'ємом і масою (130 Вт/год/кг, 550 Вт/год/дм).
Ртуть використовується для переробки вторинного алюмінію та видобутку золота (див. амальгамна).
Ртуть також іноді застосовується як робоче тіло у важконавантажених гідродинамічних підшипниках.
Ртуть входить до складу деяких біоцидних фарб для запобігання обростання корпусу суден у морській воді.
Ртуть-203 (T1/2 = 53 с) використовується в радіофармакології.
Також використовуються і солі ртуті:
Йодид ртуті використовується як детектор напівпровідниковий радіоактивного випромінювання.
Фульмінат ртуті («Грумуча ртуть») здавна застосовується як ініціює ВР (Детонатори).
Бромід ртуті застосовується при термохімічному розкладанні води на водень та кисень (атомно-воднева енергетика).
Деякі сполуки ртуті застосовуються як ліки (наприклад, мертіолят для консервації вакцин), але в основному через токсичність ртуть була витіснена з медицини (сулема, оксиціанід ртуті – антисептики, каломель – проносне та ін.) у середині-кінці XX століття.

Алюміній
Алюміній - елемент головної підгрупи третьої групи третього періоду періодичної системи хімічних елементів Д. І. Менделєєва Дмитра Івановича, атомний номер 13. Позначається символом Al (лат. Aluminium). Належить до групи легких металів. Найбільш поширений Метал і третій за поширеністю (після кисню та кремнію) хімічний елемент у земній корі.
Проста речовина Алюміній (CAS-номер: 7429-90-5) - легкий, немагнітний Метал сріблясто-білого кольору, що легко піддається формуванню, литтю, механічній обробці. Алюміній має високу тепло- та електропровідність, стійкість до корозії за рахунок швидкого утворення міцних оксидних плівок, що захищають поверхню від подальшої взаємодії.
За деякими біологічними дослідженнями надходження Алюмінію в організм людини було вважати фактором у розвитку хвороби Альцгеймера, але ці дослідження були пізніше розкритиковані і висновок про зв'язок одного з іншим спростовувався.
Метал сріблясто-білого кольору, легкий, щільність 2,7 г/смі, температура плавлення у технічного 658 °C, Алюмінію високої чистоти 660 °C, температура кипіння 2500 °C, тимчасовий опір литого 10-12 кг/ммІ, деформованого 18 -25 кг/мм2, сплавів 38-42 кг/ммІ.
Твердість по Брінеллю 24-32 кгс/ммІ, висока пластичність: у технічного 35%, у чистого 50%, прокочується у тонкий аркуш і навіть фольгу.
Алюміній має високу електропровідність і теплопровідність, 65 % від електропровідності Купруму, має високу світловідбивну здатність.
Алюміній утворює сплави майже з усіма металами.
За нормальних умов Алюміній покритий тонкою та міцною оксидною плівкою і тому не реагує з класичними окислювачами: з H2O (t°); O2, HNO3 (без нагрівання). Завдяки цьому Алюміній практично не схильний до корозії і тому широко затребуваний сучасною індустрією. Однак, при руйнуванні оксидної плівки (наприклад, при контакті з розчинами амонію солей NH4+, гарячими лугами або в результаті амальгамування), Алюміній виступає як активний метал-відновник.
Легко реагує із простими речовинами:
з киснем:
4Al + 3O2 = 2Al2O3
з галогенами:
2Al + 3Br2 = 2AlBr3
з іншими неметалами реагує при нагріванні:
з Сіркою, утворюючи сульфід Алюмінію:
2Al + 3S = Al2S3
з азотом, утворюючи нітрид Алюмінію:
з вуглецем, утворюючи карбід Алюмінію:
4Al + 3С = Al4С3
Сульфід та карбід Алюмінію повністю гідролізують:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
Al4C3 + 12H2O = 4Al(OH)3+ 3CH4
Зі складними речовинами:
з водою (після видалення захисної оксидної плівки, наприклад, амальгамуванням або розчинами гарячої луги):
2Al + 6H2O = 2Al(OH)3 + 3H2
з лугами (з утворенням тетрагідроксоалюмінатів та інших алюмінатів):
2Al + 2NaOH + 6H2O = 2Na + 3H2
2(NaOH.H2O) + 2Al = 2NaAlO2 + 3H2
Легко розчиняється в соляній та розведеній сірчаній кислотах:
2Al + 6HCl = 2AlCl3 + 3H2
2Al + 3H2SO4(розб) = Al2(SO4)3 + 3H2
При нагріванні розчиняється в кислотах - окислювачах, що утворюють розчинні солі алюмінію:
2Al + 6H2SO4(кінець) = Al2(SO4)3 + 3SO2 + 6H2O
Al + 6HNO3(кінець) = Al(NO3)3 + 3NO2 + 3H2O
відновлює метали з їх оксидів (алюмінотермія):
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
2Al + Cr2O3 = Al2O3 + 2Cr
Широко застосовується як конструкційний матеріал. Основні переваги Алюмінію в цій якості - легкість, податливість штампування, корозійна стійкість (на повітрі Алюміній миттєво покривається міцною плівкою Al2O3, яка перешкоджає його подальшому окисленню), висока теплопровідність, неотруйність його сполук. Зокрема, ці властивості зробили алюміній надзвичайно популярним при виробництві кухонного посуду, алюмінієвої фольги в харчовій промисловості та для упаковки.
Основний недолік алюмінію як конструкційного матеріалу - мала міцність, тому його зазвичай сплавляють з невеликою кількістю купруму і магнію (сплав називається дюралюміній).
Електропровідність алюмінію всього в 1,7 раза менша, ніж у Купрума, при цьому алюміній приблизно в 2 рази дешевше. Тому він широко застосовується в електротехніці для виготовлення дротів, їх екранування і навіть мікроелектроніці при виготовленні провідників у чіпах. Найменшу електропровідність Алюмінію (37 1/ом) порівняно з Купрумом (63 1/ом) компенсують збільшенням перерізу алюмінієвих провідників. Недоліком Алюмінію як електротехнічного матеріалу є міцна оксидна плівка, що ускладнює спаювання.
Завдяки комплексу властивостей широко поширений у тепловому обладнанні.
Алюміній та його сплави зберігають міцність при наднизьких температурах. Завдяки цьому він широко використовується у кріогенній техніці.
Високий коефіцієнт відображення у поєднанні з дешевизною та легкістю напилення робить алюміній ідеальним матеріалом для виготовлення дзеркал.
У виробництві будівельних матеріалів як газоутворюючий агент.
Алітуванням надають корозійну та окалиностійкість сталевим та іншим сплавам, наприклад клапанам поршневих ДВС, лопаткам турбін, Вишкам нафтовидобутку, теплообмінній апаратурі, а також замінюють цинкування.
Сульфід Алюмінію використовується для виробництва сірководню.
Йдуть дослідження з розробки пінистого алюмінію як особливо міцного та легкого матеріалу.
Коли алюміній був дуже дорогий, з нього робили різноманітні ювелірні вироби. Мода на них одразу пройшла, коли з'явилися нові технології (розробки) його одержання, що у багато разів знизили . Нині Алюміній іноді використовують у виробництві біжутерії.


Інші Метали
Свинець
Свинець — елемент головної підгрупи четвертої групи, шостого періоду періодичної системи хімічних елементів Д. І. Дмитра Івановича Менделєєва, з атомним номером 82. Позначається символом Pb (лат. Plumbum). Проста речовина Свинець (CAS-номер: 7439-92-1) - ковка, порівняно легкоплавка Метал сірого кольору.
Свинець має досить низьку теплопровідність, вона становить 35,1 Вт/(м·К) при температурі 0 °C. Метал м'який, легко ріже ножем. На поверхні він зазвичай покритий більш менш товстою плівкою оксидів, при розрізанні відкривається блискуча поверхня, яка на повітрі з часом тьмяніє.
Температура плавлення: 327,4 °C
Температура кипіння: 1740 °C
Нітрат Свинцю застосовується для потужних сумішевих вибухових речовин. Азид Свинцю застосовується як найбільш широко вживаний детонатор (що ініціює вибухову речовину). Перхлорат Свинцю використовується для приготування важкої рідини (щільність 2,6 г/смі), що використовується у флотаційному збагаченні руд, він іноді застосовується у потужних сумішових вибухових речовин як окислювач. Фторид Свинцю самостійно, а також спільно з фторидом вісмуту, Купрума, Срібла застосовується як катодний матеріал у хімічних джерелах струму. Вісмутат Свинцю, сульфід Свинцю PbS, іодид Свинцю застосовують як катодний матеріал в літієвих акумуляторних батареях. Хлорид Свинцю PbCl2 як катодний матеріал у резервних джерелах струму. Телурид Свинцю PbTe широко застосовується як термоелектричний матеріал (термо-е.д.с 350 мкВ/К), найширший матеріал у виробництві термоелектрогенераторів і термоелектричних холодильників. Двоокис свинцю PbO2 широко застосовується не тільки в свинцевому акумуляторі, але так само на її основі виробляються багато резервних хімічних джерел струму, наприклад - свинцево-хлорний елемент, свинцево-плавиковий елемент та ін.
Свинцеві білила, основний карбонат Pb(OH)2.PbCO3, щільний білий порошок, - виходить із Свинцю на повітрі під дією вуглекислого газу та оцтової кислоти. Використання свинцевих білил як барвника пігменту тепер не так поширене, як раніше, через їх розкладання під дією сірководню H2S. Свинцеві білила застосовують також для виробництва шпаклівки, технології цементу і свинцевокарбонатного паперу.
Арсенат та арсеніт Свинцю застосовують у технології інсектицидів для знищення комах — шкідників сільського господарства (непарного шовкопряда та бавовняного довгоносика). Борат Свинцю Pb(BO2)2·H2O, нерозчинний білий порошок, використовують для сушіння картин і лаків, а разом з іншими Металами - як покриття скла і фарфору. Хлорид Свинцю PbCl2, білий кристалічний порошок, розчинний у гарячій воді, розчинах інших хлоридів і особливо хлориду амонію NH4Cl Його застосовують для приготування мазей для обробки пухлин.
Хромат свинцю PbCrO4 відомий як хромовий жовтий барвник, є важливим пігментом для приготування фарб, для забарвлення порцеляни та тканин. У промисловості хромат застосовують в основному у виробництві жовтих пігментів. Нітрат Свинцю Pb(NO3)2 — біла кристалічна речовина, що добре розчиняється у воді. Це в'яжуче обмежене застосування. У Промисловості його використовують у сірниковому виробництві, фарбуванні та набиванні текстилю, фарбуванні рогів та гравіювання. Сульфат Свинцю Pb(SO4)2, нерозчинний у воді білий порошок, застосовують як пігмент в акумуляторах, літографії, технології набивних тканин.
Сульфід свинцю PbS, чорний нерозчинний у воді порошок, використовують при випаленні глиняного посуду і для виявлення іонів свинцю.
Оскільки Свинець добре поглинає γ-випромінювання, він використовується для радіаційного захисту в рентгенівських установках та ядерних реакторах. Крім того, Свинець розглядається як теплоносій у проектах перспективних ядерних реакторів на швидких нейтронах.
Значне застосування знаходять сплави Свинцю. П'ютер (сплав Олова зі свинцем), що містить 85-90% Tin metal і 15-10% Pb, формується, недорогий і використовується у виробництві домашнього начиння. Припій, що містить 67% Pb та 33% Tin metal, застосовують в електротехніці. Сплави Свинцю з сурмою використовують у виробництві куль та друкарського шрифту, а сплави Свинцю, сурми та Олова – для фігурного лиття та підшипників. Сплави Свинцю із сурмою зазвичай застосовують для оболонок кабелів та пластин електричних акумуляторів. Сполуки Свинцю використовуються у виробництві барвників, фарб, інсектицидів, скляних Предметів торгівліі як добавки до Бензину у вигляді тетраетилсвинцю (C2H5)4Pb (помірно летюча рідина, пари якої в малих концентраціях мають солодкуватий фруктовий запах, у великих-неприємний запах; Тпл = 130 ° C, Ткіп = 80 ° С/13 мм рт .ст., щільність 1,650 г/смі;nD2v = 1,5198;не розчиняється у воді, змішується з органічними розчинниками; кг (щури, перорально)) підвищення октанового числа.

Олово
Олово — елемент головної підгрупи четвертої групи, п'ятого періоду періодичної системи хімічних елементів Д. І. Менделєєва Дмитра Івановича, з атомним номером 50. Позначається символом Tin metal (лат. Stannum). За нормальних умов проста речовина — пластичний, ковкий та легкоплавкий блискучий метал сріблясто-білого кольору. Олово утворює кілька алотропних модифікацій: нижче 13,2 °С стійко α-олово (сіре Олово) з кубічними гратами типу алмазу, вище 13,2 °С стійко β-олово (біле Олово) з тетрагональними кристалічними гратами.
Олово використовується в основному як безпечне, нетоксичне, корозійностійке покриття в чистому вигляді або сплавах з іншими Металами. Головні промислові застосування Олова - у білій жерсті (луджене Залізо) для виготовлення тари харчових продуктів, у припоях для електроніки, у будинкових трубопроводах, у підшипникових сплавах та у покриттях з Олова та його сплавів. Найважливіший сплав Олова Бронза(З Купрумом). Інший відомий сплав – п'ютер – використовується для виготовлення посуду. У Останнім часомвідроджується інтерес до використання Металу, оскільки він найбільш «екологічний» серед важких кольорових металів. Використовується для створення надпровідних проводів на основі інтерметалевого з'єднання Nb3Sn.
Цінина металеве Олово у 2006 році склали в середньому 12—18 дол/кг, двоокис Олова високої чистоти близько 25 дол/кг, монокристалічний Олово особливої чистоти близько 210 дол/кг.
Інтерметалеві сполуки Олова та цирконію мають високі температури плавлення (до 2000 °C) та стійкість до окислення при нагріванні на повітрі та мають ряд областей застосування.
Олово є найважливішим компонентом, що легує, при отриманні конструкційних сплавів титану.
Двоокис Олова - дуже ефективний абразивний матеріал, що застосовується при доведенні поверхні оптичного скла.
Суміш солей Олова - "жовта композиція" - раніше використовувалася як барвник для вовни.
Олово застосовується також у хімічних джерелах струму як анодний матеріал, наприклад: марганцево-олов'яний елемент, окисно-ртутно-олов'яний елемент. Перспективне використання Олова у свинцево-олов'яному акумуляторі; так, наприклад, при рівній напрузі зі свинцевим акумулятором свинцево-олов'яний акумулятор має в 2,5 рази більшу ємність і в 5 разів більшу енергощільність на одиницю об'єму, внутрішній опір його значно нижче.
Металеве Олово не токсичне, що дозволяє застосовувати його в харчовій промисловості. Шкідливі домішки, що містяться в Олові у звичайних умовах зберігання та застосування, у тому числі в розплаві при температурі до 600 єС, не виділяються у повітря робочої зони в об'ємах, що перевищують гранично допустиму концентрацію відповідно до ГОСТу. Тривалий (протягом 15-20 років) вплив пилу Олова надає фіброгенну дію на легені і може викликати захворювання працюючих пневмоконіозом.
Застосування металів
Конструкційні матеріали
Метали та їх сплави – одні з головних конструкційних матеріалів сучасної цивілізації. Це визначається насамперед їх високою міцністю, однорідністю та непроникністю для рідин та газів. Крім того, змінюючи рецептуру сплавів, можна змінювати їх властивості у дуже широких межах.
Електротехнічні матеріали
Метали використовуються як хороші провідники Електроенергії(Медь, Алюміній), так і як матеріали з підвищеним опором для резисторів та електронагрівальних елементів (ніхром тощо).
Інструментальні матеріали
Метали та їх сплави широко застосовуються виготовлення інструментів (їх робочої частини). В основному це інструментальні сталі та тверді сплави. Як інструментальні матеріали застосовуються також алмаз, нітрид бору, кераміка.
Металургія
Металургія або металургія - область матеріалознавства, що вивчає фізичну та хімічну поведінку Металів, інтерметалідів та сплавів. До Металургії відноситься і практичне застосування наявних знань про Метали - від видобутку сировини до Грошової емісії готової продукції.
Вивчення будови та фізико-хімічних властивостей металевих та оксидних розплавів та твердих розчинів, розробка теорії конденсованого стану речовини;
Вивчення термодинаміки, кінетики та механізму металургійних реакцій;
Розробка наукових та техніко-економічних основ комплексного використання поліметалічної мінеральної сировини та техногенних відходів з вирішенням екологічних проблем;
Розробка теорії основ пірометаллургічних, електротермічних, гідрометалургійних та газофазних процесіввиробництва Металів, сплавів, металевих порошків та композиційних матеріалів та покриттів.
До чорних металів відносять залізо, марганець, хром, ванадій. Решта — кольорові. За фізичними властивостями та призначенням кольорові Метали умовно поділяють на важкі (Медь, Свинець, Цинк, Олово, Ni) та легені (Алюміній, магній).
В основному Технологічний процеспідрозділяється на пірометаллургію (плавка) і гідрометалургію (витяг металів у хімічних розчинах). Різновидом пірометалургії є плазмова металургія.
Плазмова Металургія - витяг з руд, виплавка та обробка Металів та сплавів під впливом плазми.
Переробка руд (окислів та ін.) здійснюється шляхом їхнього термічного розкладання в плазмі. Для запобігання зворотним реакціям застосовують відновник (вуглець, водень, метан та ін), або різке охолодження потоку плазми, що порушує термодинамічний рівновагу.
Плазмова Металургія дозволяє проводити пряме відновлення Металу з руди, значно прискорювати металургійні процеси, отримати чисті матеріали, знизити витрати палива (відновника). Недоліком плазмової металургії є високе споживання електроенергії, що використовується для генерації плазми.

Історія
Перші свідчення того, що людина займалася металургією, належать до 5-6 тисячоліть до н. е. і були знайдені в Майданпеці, Плочнику та інших місцях в Сербії (у тому числі мідна сокира 5500 років до н.е. (). Однак, як це нерідко трапляється з такими давніми явищами, вік не завжди може бути точно визначений.
У культурі ранніх часів присутні Срібло, Мідь, Олово та метеоритне Залізо, що дозволяло вести обмежену металообробку. Так, високо цінувалися "Небесні кинджали" - єгипетська зброя, створена з метеоритного Заліза 3000 років до н. е. Але, навчившись добувати Мідь та Олова з Гірської породиі отримувати сплав, названий бронзою, люди в 3500 до н. е. вступили до Бронзового століття.
Одержання Заліза з руди та виплавка Металу було набагато складніше. Вважається, що технологія була винайдена хетами приблизно 1200 до н. е., що стало початком Залізного віку. Секрет видобутку та виготовлення Заліза став ключовим фактором володарювання филистимлян.
Сліди розвитку чорної металургії можна відстежити у багатьох минулих культурах та цивілізаціях. Сюди входять стародавні та середньовічні королівства та імперії Середнього Сходу та Близького Сходу, стародавній Єгипет та Анатолія (), Карфаген, греки та римляни античної та середньовічної Європи, Китай, і т. д. Потрібно помітити, що багато методів, пристроїв і технологій Металургії спочатку були придумані в Стародавньому Китаї, а потім і європейці освоїли це ремесло (винайдаючи доменні печі, Чавун, Сталь, гідромолоти тощо). Тим не менш, останні дослідження свідчать про те, що технології римлян були набагато просунутішими, ніж передбачалося раніше, особливо в галузі гірничої здобичі та кування.
Добувна металургія
Добувна металургія полягає у вилученні цінних металів з руди та переплавленні вилученої сировини в чистий метал. Для того, щоб перетворити оксид або сульфід металу на чистий метал, руда повинна бути відділена фізичним, хімічним або електролітичним способом.
Металурги працюють із трьома основними складовими: сировиною, концентратом (цінний оксид або сульфід Металу) та відходами. Після видобутку великі шматки руди подрібнюються настільки, коли кожна частка є або цінним концентратом або відходом.
Гірські Роботине обов'язкові, якщо руда та довкілля дозволяють провести вилуговування. Таким шляхом можна розчинити та отримати збагачений Мінералом розчин.
Найчастіше руда містить кілька цінних металів. У такому випадку відходи одного процесу можуть бути використані як сировина для іншого процесу.
Сплав
Сплав - макроскопічно однорідна суміш двох або більшої кількості хімічних елементів з переважанням металевих компонентів. Основною або єдиною фазою сплаву, як правило, є твердий розчин легуючих елементів у металі, що є основою сплаву.
Сплави мають металеві властивості, наприклад: металевий блиск, високі електропровідність та теплопровідність. Іноді компонентами сплаву можуть бути не тільки хімічні елементи, але й хімічні сполуки, що мають металеві властивості. Наприклад, основними компонентами твердих сплавів є карбіди вольфраму чи титану. Макроскопічні властивості сплавів завжди відрізняються від властивостей їх компонентів, а макроскопічна однорідність багатофазних (гетерогенних) сплавів досягається рахунок рівномірного розподілу домішкових фаз в металевій матриці.
Сплави зазвичай одержують за допомогою змішування компонентів у розплавленому стані з подальшим охолодженням. При високих температурах плавлення компонентів сплави проводяться змішуванням порошків Металів з подальшим спіканням (так виходять, наприклад, багато вольфрамових сплавів).
Сплави є одним із основних конструкційних матеріалів. Серед них найбільше значення мають сплави на основі Заліза та Алюмінію. До складу багатьох сплавів можуть вводитися і неметали, такі як вуглець, кремній, бор та ін. У техніці застосовується понад 5 тис. сплавів.
Джерела
http://ua.wikipedia.org/
Енциклопедія інвестора. 2013 .
Синоніми:- - МЕТАЛ, метал чоловік., лат. рушник; а у малому вигляді, у виплавці: королек. У побуті життєвому, цінні, дорогі метали: золото, платина, срібло; прості: залізо, мідь, цинк, олово, свинець; хімія відкрила такі початки майже всіх копалин, що складаються з ... Тлумачний словник Даля
Переважна більшість (93 із 117) відомих на даний час хімічних елементів відноситься до металів.
Атоми різних металів мають багато спільного у будові, а утворювані ними прості і складні речовини мають схожі властивості (фізичні та хімічні).
Положення в періодичній системі та будова атомів металів.
У періодичній системі метали розташовуються ліворуч і нижче від умовної ламаної лінії, що проходить від бору до астату (див. таблицю нижче). До металів відносяться майже всі s-елементи (за винятком Н, Не), приблизно половина р-Елементів, все d- І f-Елементи ( лантанідиі актиніди).
Більшість атомів металів на зовнішньому енергетичному рівні міститься невелике число (до 3) електронів, лише в деяких атомів р-елементів (Sn, Pb, Bi, Ро) їх більше (від чотирьох до шести). Валентні електрони атомів металів слабо (порівняно з атомами неметалів) пов'язані з ядром. Тому атоми металів відносно легко віддають ці електрони іншим атомам, виступаючи в хімічних реакціяхтільки як відновники і перетворюючись при цьому на позитивно заряджені катіони:
Me - пе - = Ме n +.
На відміну від неметалів для атомів металів характерні лише позитивні ступені окислення від +1 до +8.
Легкість, з якою атоми металу віддають свої валентні електрони іншим атомам, характеризує відновлювальну активність металу. Чим легше атом металу віддає свої електрони, тим сильніший відновник. Якщо розташувати в ряд метали в порядку зменшення їх відновлювальної здатності у водних розчинах, ми отримаємо відомий нам витіснювальний ряд металів, який називається також електрохімічним рядом напруг (або поряд активності) металів (див. таблицю нижче).
Поширеність металів у природі.
У першу трійку найпоширеніших у земній корі (це поверхневий шар нашої планети завтовшки приблизно 16 км) металів входять алюміній, залізо та кальцій. Менш поширені натрій, калій, магній. У таблиці нижче наведено масові частки деяких металів у земній корі.
залізо та кальцій. Менш поширені натрій, калій, магній. У таблиці нижче наведено масові частки деяких металів у земній корі.
Поширеність металів у земній корі
| Метал | Метал | Масова частка у земній корі, % | |
|---|---|---|---|
| Al | 8,8 | Cr | 8,3 ∙ 10 -3 |
| Fe | 4,65 | Zn | 8,3 ∙ 10 -3 |
| Ca | 3,38 | Ni | 8 ∙ 10 -3 |
| Na | 2,65 | Cu | 4,7 ∙ 10 -3 |
| K | 2,41 | Pb | 1,6 ∙ 10 -3 |
| Mg | 2,35 | Ag | 7 ∙ 10 -6 |
| Ti | 0,57 | Hg | 1,35 ∙ 10 -6 |
| Mn | 0,10 | Au | 5 ∙ 10 -8 |
Елементи, масова частка яких у земній корі становить менше 0,01%, називаються рідкісними. До рідкісних металів відносяться, наприклад, всі лантаніди. Якщо елемент не здатний концентруватися в земній корі, тобто не утворює власних руд, а зустрічається як домішка з іншими елементами, його відносять до розсіянимелементів. Розсіяними, наприклад, є такі метали: Sc, Ga, In, Tl, Hf.
У 40-х роках XX ст. німецькі вчені Вальтер та Іда Нолла висловили думку про те. що у кожному камені на бруківці присутні всі хімічні елементи періодичної системи. Спочатку ці слова зустріли їхні колеги далеко не з одностайним схваленням. Однак у міру появи дедалі точніших методів аналізу вчені дедалі більше переконуються у справедливості цих слів.
Оскільки всі живі організми перебувають у тісному контакті з довкіллям, то і в кожному з них повинні утримуватися якщо не всі, то більшість хімічних елементів періодичної системи. Наприклад, в організмі дорослої людини масова частка неорганічних речовинстановить 6%. З металів у цих сполуках присутні Mg, Са, Na, К. У складі багатьох ферментів та інших біологічно активних органічних сполук у нашому організмі містяться V, Mn, Fe, Cu, Zn, Co, Ni, Mo, Сг та деякі інші метали.
В організмі дорослої людини міститься в середньому близько 140 г іонів калію та близько 100 г іонів натрію. З їжею ми щодня споживаємо від 1,5 г до 7 г іонів калію та від 2 г до 15 г іонів натрію. Потреба в іонах натрію така велика, що їх потрібно спеціально додавати в їжу. Значна втрата іонів натрію (як NaCl із сечею і потім) несприятливо позначається здоров'я людини. Тому в спеку лікарі рекомендують пити мінеральну воду. Однак і надлишковий вміст солі в їжі негативно позначається на роботі наших внутрішніх органів(Насамперед, серця та нирок).
Вам необхідно ввімкнути JavaScript, щоб проголосуватита інші хімічні сполуки. Для отримання чистих металів та подальшого їх застосування необхідно виділити їх із руд та провести очищення. При необхідності проводять легуваннята іншу обробку металів. Вивченням цього займається наука металургія. Металургія розрізняє руди чорних металів (з урахуванням заліза) і кольорових (до складу не входить залізо, всього близько 70 елементів). Золото, срібло та платинавідносяться також до дорогоцінним (шляхетним) металам . Крім того, у малих кількостях вони присутні у морській воді, рослинах, живих організмах (граючи при цьому важливу роль).
Відомо, що організм людини на 3% складається з металів. Найбільше у наших клітинах кальціюі натрію, сконцентрованого в лімфатичних системах. Магнійнакопичується в м'язахі нервової системи , мідь- у печінки , залізо- у крові.
Видобуток
Метали часто витягують із землі засобами гірничої промисловості, результат - здобуті руди - служать щодо багатим джерелом необхідних елементів. Для з'ясування знаходження руд використовуються спеціальні пошукові методи, що включають розвідку руд та дослідження родовищ. Родовища, як правило, поділяються на кар'єри(розробки руд на поверхні), у яких видобуток ведеться шляхом вилучення ґрунту з використанням важкої техніки, а також - на підземні шахти.
З видобутої руди метали витягуються, зазвичай, з допомогою хімічного чи електролітичного відновлення. У пірометалургіїдля перетворення руди на металеву сировину використовуються високі температури, в гідрометалургіїзастосовують для тих же цілей водну хімію. Методи, що використовуються, залежать від виду металу і типу забруднення.
Коли металева руда є іонним з'єднанням металу та неметалу, для вилучення чистого металу вона зазвичай піддається виплавленню - нагріванню з відновником. Багато поширених металів, таких як залізо, плавлять з використанням як відновник вуглецю(Отриманого зі спалювання вугілля). Деякі метали, такі як алюмінійі натрій, не мають жодного економічно виправданого відновника та витягуються із застосуванням електролізу.
Твердість деяких металів за шкалою Моосу:
| Твердість | Метал |
|---|---|
| 0.2 | Цезій |
| 0.3 | Рубідій |
| 0.4 | Калій |
| 0.5 | Натрій |
| 0.6 | Літій |
| 1.2 | Індій |
| 1.2 | Талій |
| 1.25 | Барій |
| 1.5 | Стронцій |
| 1.5 | Галій |
| 1.5 | Олово |
| 1.5 | Свинець |
| 1.5 | |
| 1.75 | Кальцій |
| 2.0 | Кадмій |
| 2.25 | Вісмут |
| 2.5 | Магній |
| 2.5 | Цинк |
| 2.5 | Лантан |
| 2.5 | Срібло |
| 2.5 | Золото |
| 2.59 | Ітрій |
| 2.75 | Алюміній |
| 3.0 | Мідь |
| 3.0 | Сурма |
| 3.0 | Торій |
| 3.17 | Скандій |
| 3.5 | Платина |
| 3.75 | Кобальт |
| 3.75 | Паладій |
| 3.75 | Цирконій |
| 4.0 | Залізо |
| 4.0 | Нікель |
| 4.0 | Гафній |
| 4.0 | Марганець |
| 4.5 | Ванадій |
| 4.5 | Молібден |
| 4.5 | Родій |
| 4.5 | Титан |
| 4.75 | Ніобій |
| 5.0 | Іридій |
| 5.0 | Рутеній |
| 5.0 | Тантал |
| 5.0 | Технецький |
| 5.0 | Хром |
| 5.5 | Берилій |
| 5.5 | Осмій |
| 5.5 | Реній |
| 6.0 | Вольфрам |
| 6.0 | β-Уран |
Через легку віддачу електронів можливе окислення металів, що може призводити до корозіїта подальшої деградації властивостей. Здатність до окислення можна дізнатися за стандартним рядом активності металів. Цей факт підтверджує необхідність використання металів у комбінації з іншими елементами ( сплав, найважливішим з яких є сталь), їх легування та застосування різних покриттів.
Для коректного опису електронних властивостей металів необхідно використовувати квантову механіку. У всіх твердих тілах з достатньою симетрієюрівні енергії електронів окремих атомів перекриваються і утворюють дозволені зони, причому зона, утворена валентними електронами, називається валентною зоною. Слабкий зв'язок валентних електронів у металах призводить до того, що валентна зона в металах виходить дуже широким, і всіх валентних електронів не вистачає для її повного заповнення.
Принципова особливість такої частково заповненої зони полягає в тому, що навіть при мінімальній доданій напрузі у зразку починається перебудова валентних електронів, тобто тече електричний струм.
Та ж висока рухливість електронів призводить і до високої теплопровідності, а також здатності дзеркально відбивати електромагнітне випромінювання (що і надає металам характерний блиск).
Деякі метали
- Легкі:
- Інші:
Застосування металів
Конструкційні матеріали
Інструментальні матеріали
Історія розвитку уявлень про метали
Знайомство людини з металами почалося з золота , сріблаі міді, тобто з металів, що зустрічаються у вільному стані на земній поверхні; згодом до них приєдналися метали, що значно поширені в природі і легко виділяються з їх сполук: олово , свинець , залізота . Ці сім металів були знайомі людству в давнину. Серед давньоєгипетських артефактів зустрічаються золоті та мідні вироби, які, за деякими даними, належать до епохи, віддаленої на 3000-4000 років від н. е.
До семи відомих металів вже тільки в середньовіччядодалися цинк , вісмут , сурмата на початку XVIII століття миш'як. З середини XVIII століття число відкритих металів швидко зростає і на початку XX століття сягає 65, а початку XXI століття - до 96.
Жодне з хімічних виробництв не сприяло стільки розвитку хімічних знань, як процеси, пов'язані з отриманням та обробкою металів; з історією їх пов'язані найважливіші моменти історії хімії. Властивості металів такі характерні, що вже в ранню епоху золото, срібло, мідь, свинець, олово, залізо і ртуть становили одну природну групу однорідних речовин, і поняття про «метал» відноситься до найдавніших хімічних понять. Однак погляди на їхню натуру в більш-менш певній форміз'являються тільки в середні віки у алхіміків. Щоправда, ідеї Арістотеляпро природу: утворенні всього існуючого з чотирьох елементів (вогню, землі, води та повітря) вже тим самим вказували на складність металів; але ці ідеї були надто туманні та абстрактні. У алхіміків поняття про складність металів і, як результат цього, віра в можливість перетворювати одні метали на інші, створювати їх штучно, є основним поняттям їхнього світогляду. Це є природний висновок з тієї маси фактів, що належать до хімічних перетворень металів, які накопичилися на той час. Насправді, перетворення металу на зовсім несхожий на них окис простим прожарюванням на повітрі і зворотне одержання металу з окису, виділення одних металів з інших, утворення сплавів, що володіють іншими властивостями, ніж спочатку взяті метали, та інше - все це начебто мало вказувати на складність їхньої натури.
Що стосується власне до перетворення металів на золото, то віра у можливість цього була заснована на багатьох видимих фактах. Спочатку створення сплавів, кольором схожих на золото, наприклад з міді і цинку, в очах алхіміків вже було перетворенням їх на золото. Їм здавалося, що потрібно змінити лише колір, і властивості металу стануть іншими. Особливо багато сприяли цій вірі погано поставлені досліди, коли перетворення неблагородного металу в золото бралися речовини, що містили домішка цього золота. Наприклад, вже наприкінці XVIII століття один копенгагенський аптекар запевняв, що хімічно чисте срібло при сплавленні з миш'яком частково перетворюється на золото. Цей факт було підтверджено відомим хіміком Гітоном де Морвоі наробив багато галасу. Невдовзі потім було показано, що миш'як, який служив для досвіду, містив сліди срібла із золотом.
Так як із семи відомих тоді металів одні легше зазнавали хімічних перетворень, інші важче, то алхіміки ділили їх на шляхетні - досконалі, і неблагородні - недосконалі. До перших належали золото та срібло, до других мідь, олово, свинець, залізо та ртуть. Остання, володіючи властивостями шляхетних металів, але водночас різко відрізняючись від усіх металів своїм рідким станом і летючістю, надзвичайно займала тодішніх учених, і деякі виділяли їх у особливу групу; увага, що залучалася їй, була така велика, що ртуть стали вважати в числі елементів, з яких утворені власне метали, і в ній саме бачили носія металевих властивостей. Приймаючи існування в природі переходу одних металів в інші, недосконалих у досконалі, алхіміки припускали, що в звичайних умовах це перетворення йде надзвичайно повільно, цілими століттями, і, можливо, не без таємничої участі небесних світил, яким тоді приписували таку велику роль і у долі людини. За збігом, відомих тоді металів було сім, як і відомих тоді планет, а це ще більше вказувало на таємничий зв'язок між ними. У алхіміків метали часто звуться планет; золото називається Сонцем, срібло - Місяцем, мідь - Венерою, олово - Юпітером, свинець - Сатурном, залізо - Марсомі ртуть - Меркурієм. Коли були відкриті цинк, вісмут, сурма і миш'як, тіла, у всіх відношеннях схожі з металами, але у яких одна з найхарактерніших властивостей металу, ковкість, розвинена слабко, то вони були виділені в особливу групу - напівметалів. Розподіл металів на власне метали та напівметали існував ще в середині XVIII століття.
Визначення складу металу спочатку було суто умоглядним. Спочатку алхіміки приймали, що вони утворені з двох елементів - і сірки. Походження цієї думки невідомо, вона є вже у VIII столітті. за Геберудоказом присутності ртуті в металах служить те, що вона їх розчиняє, і в цих розчинах індивідуальність їх зникає, поглинається ртуттю, чого б не сталося, якби в них не було одного спільного з ртуттю початку. Крім того, ртуть зі свинцем давала щось схоже на олово. Що стосується сірки, то, можливо, вона взята тому, що були відомі сірчисті сполуки, зовнішньому вигляду схожі на метали. Надалі ці прості уявлення, мабуть, внаслідок безуспішних спроб отримання металів штучно, вкрай ускладнюються, заплутуються. У поняттях алхіміків, наприклад Х-XIII століть, ртуть і сірка, у тому числі утворені метали, були тими ртуттю і сіркою, які мали руках алхіміки. Це було тільки щось схоже з ними, що має особливі властивості; щось таке, яке у звичайній сірці і ртуті існувало реально, було виражено у них більшою мірою, ніж у інших тілах. Під ртуттю, що входить до складу металів, представляли щось, що зумовлює їх незмінність, металевий блиск, тягучість, одним словом, носія металевого вигляду; під сіркою мали на увазі носія змінності, розкладності, горючості металів. Ці два елементи знаходилися в металах у різному співвідношенні і, як тоді говорили, по-різному фіксовані; крім того, вони могли бути різного ступеня чистоти. За Гебером, наприклад, золото складалося з великої кількості ртуті та невеликої кількості сірки найвищою мірою чистоти та найбільш фіксованих; в олові, навпаки, передбачали багато сірки та мало ртуті, які були не чисті, погано фіксовані та інше. Всім цим, звичайно, хотіли висловити різне ставлення металів до єдиного тодішнього могутнього хімічного агента - вогню. При подальшому розвитку цих поглядів двох елементів – ртуті та сірки – для пояснення складу металів алхімікам здалося недостатньо; до них приєднали сіль, а деякі миш'як. Цим хотіли зазначити, що за всіх перетвореннях металів залишається щось не летюче, постійне. Якщо у природі «перетворення неблагородних металів на благородні відбувається століттями», то алхіміки прагнули створити такі умови, у яких цей процес вдосконалення, дозрівання йшов швидко і легко. Внаслідок тісного зв'язку хімії з тодішньою медициною і тодішньої біологією, ідея про перетворення металів природно ототожнювалася з ідеєю про зростання і розвиток організованих тіл: перехід, наприклад, свинцю в золото, утворення рослини з зерна, кинутого в землю і ніби розклалося, Лікування хворого органу в людини - це були приватні явища одного загального таємничого життєвого процесу, вдосконалення, і викликалися одними стимулами. Звідси зрозуміло, що таємниче початок, що дає можливість отримати золото, мало зцілювати хвороби, перетворювати старе людське тіло на молоде та інше. Так склалося поняття про чудове філософське каміння.
Що стосується ролі філософського каменюу перетворенні неблагородних металів на благородні, то найбільше існує вказівок щодо переходу їх у золото, про отримання срібла йдеться мало. За одними авторами, той самий філософський камінь перетворює метали на срібло і золото; за іншими - існують два роду цієї речовини: одна досконала, інша менш досконала, і це останнє і служить для отримання срібла. Щодо кількості філософського каменю, який потрібний для перетворення, вказівки теж різні. За одними, 1 частина його здатна перетворити на золото 10000000 частин металу, за іншими - 100 частин і навіть лише 2 частини. Для отримання золота плавили якийсь неблагородний метал чи брали ртуть і кидали туди філософський камінь; одні запевняли, що перетворення відбувається миттєво, інші ж помалу. Ці погляди на природу металів і на здатність їх до перетворень тримаються загалом протягом багатьох століть до XVII століття, коли починають різко заперечувати все це, тим більше, що ці погляди викликали появу багатьох шарлатанів, котрі експлуатували надію легковірних отримати золото. З ідеями алхіміків особливо боровся Бойль: «Я б хотів знати, - каже він в одному місці, - як можна розкласти золото на ртуть, сірку та сіль; я готовий сплатити витрати з цього досвіду; що стосується мене, то я ніколи не міг цього досягти».
Після вікових безплідних спроб штучного одержання металів і при тій кількості фактів, що накопичилися до XVII століття, наприклад про роль повітря при горінні, збільшення ваги металу при окисленні, що, втім, знав ще Геберу VIII столітті, питання елементарності складу металу, здавалося, був дуже близький до закінчення; Однак у хімії виникла нова течія, результатом якого стала флогістонна теорія, і вирішення цього питання було відстрочено на тривалий час.
Тодішніх учених сильно займали явища горіння. Виходячи з основної ідеї тогочасної філософії, що подібність у властивостях тіл повинна походити від однакової початків, елементів, що входять до їх складу, приймали, що горючі тіла укладають загальний елемент. Акт горіння вважався актом розкладання, розпаду на елементи; при цьому елемент горючості виділявся у вигляді полум'я, інші залишалися. Визнаючи погляд алхіміків на утворення металів з трьох елементів, ртуті, сірки та солі, і приймаючи їх реальне існування в металі, пальним початком у них треба було визнати сірку. Тоді іншою складовою металу треба було, очевидно, визнати залишок від прожарювання металу - «землю», як тоді говорили; отже, ртуть тут ні до чого. З іншого боку, сірка згоряє в сірчану кислоту, яку багато хто, в силу сказаного, вважали більш простим тілом, ніж сірка, і включили до елементарних тіл. Виходила плутанина та протиріччя. БехерЩоб узгодити старі поняття з новими, приймав існування у металі землі трьох сортів: власне «землю», «землю пальну» та «землю ртутну». У цих умовах Штальзапропонував свою теорію. На його думку, початком горючості служить не сірка і якась інша відома речовина, а щось невідоме, назване ним флогістоном. Метали, начебто, утворені з флогістону та землі; прожарювання металу на повітрі супроводжується виділенням флогістону; зворотне одержання металів з його землі за допомогою вугілля - речовини, багатої на флогістон - є акт з'єднання флогістону з землею. Хоча металів було кілька і кожен із них при прожарюванні давав свою землю, остання, як елемент, була одна, так що і ця складова металу була такого ж гіпотетичного характеру, як і флогістон; втім, послідовники Шталя іноді брали стільки «елементарних земель», скільки було металів. Коли Кавендішпри розчиненні металів у кислотах отримав воденьі досліджував його властивості (нездатність підтримувати горіння, його вибуховість у суміші з повітрям та ін.), він визнав у ньому флогістон Шталя; метали, за його поняттями, складаються з водню та «землі». Цей погляд приймався багатьма послідовниками флогістонної теорії.
Незважаючи на видиму стрункість теорії флогістону, існували великі факти, які не можна було пов'язати з нею. Ще Гебер було відомо, що метали при випалюванні збільшуються у вазі; тим часом, за Шталем, вони повинні втрачати флогістон: при зворотному приєднанні флогістону до «землі» вага отриманого металу менша за вагу «землі». Таким чином виходило, що флогістон повинен мати якусь особливу властивість - негативне тяжіння. Незважаючи на всі дотепні гіпотези, висловлені для пояснення цього явища, воно було незрозумілим і викликало здивування.
Коли Лавуазьєз'ясував роль повітря при горінні і показав, що прибуток у вазі металів при випалюванні походить від приєднання до металів кисню з повітря, і таким чином встановив, що акт горіння металів не є розпадом на елементи, а, навпаки, акт з'єднання, питання про складність металів було вирішено негативно. Метали були віднесені до простих хімічних елементів, в силу основної ідеї Лавуазьє, що прості тіла суть ті, з яких не вдалося виділити інших тіл. Зі створенням періодичної системи хімічних елементів Менделєєвимелементи металів зайняли у ній своє законне місце.
Див. також
Примітки
Посилання
- С. П. Вуколов: // Енциклопедичний словник Брокгауза та Єфрона: У 86 томах (82 т. та 4 дод.). - СПб. , 1890-1907.(Історична частина)
| Періодична таблиця | |
|---|---|
| Дмитро Іванович Менделєєв · Періодичний закон · Групи елементів | |
| Формати | Коротка· За блоками · Розширена· Збільшена · Електронні конфігурації · Електронегативність · Альтернативна · Ізотопи елементів |
| Списки елементівпо | Назвою ·
Етимології(на честь місць, на честь відкривачів) · Часу відкриття Ступені окислення · Поширеності (у людині) · Стабільності ізотопів · |


