07.03.2019
Химические свойства щелочных металлов. Знаешь как
Щелочные металлы легко реагируют с неметаллами:
2K + I 2 = 2KI
2Na + H 2 = 2NaH
6Li + N 2 = 2Li 3 N (реакция идет уже при комнатной температуре)
2Na + S = Na 2 S
2Na + 2C = Na 2 C 2
В реакциях с кислородом каждый щелочной металл проявляет свою индивидуальность: при горении на воздухе литий образует оксид, натрий – пероксид, калий – надпероксид.
4Li + O 2 = 2Li 2 O
2Na + O 2 = Na 2 O 2
K + O 2 = KO 2
Получение оксида натрия:
10Na + 2NaNO 3 = 6Na 2 O + N 2
2Na + Na 2 O 2 = 2Na 2 O
2Na + 2NaOН = 2Na 2 O + Н 2
Взаимодействие с водой приводит к образованию щелочи и водорода.
2Na + 2H 2 O = 2NaOH + H 2
Взаимодействие с кислотами:
2Na + 2HCl = 2NaCl + H 2
8Na + 5H 2 SO 4(конц.) = 4Na 2 SO 4 + H 2 S + 4H 2 O
2Li + 3H 2 SO 4(конц.) = 2LiHSO 4 + SO 2 + 2H 2 O
8Na + 10HNO 3 = 8NaNO 3 + NH 4 NO 3 + 3H 2 O
При взаимодействии с аммиаком образуются амиды и водород:
2Li + 2NH 3 = 2LiNH 2 + H 2
Взаимодействие с органическими соединениями:
Н ─ C ≡ С ─ Н + 2Na → Na ─ C≡C ─ Na + H 2
2CH 3 Cl + 2Na → C 2 H 6 + 2NaCl
2C 6 H 5 OH + 2Na → 2C 6 H 5 ONa + H 2
2СН 3 ОН + 2Na → 2 CH 3 ONa + H 2
2СH 3 COOH + 2Na → 2CH 3 COOONa + H 2
Качественной реакцией на щелочные металлы является окрашивание пламени их катионами. Ион Li + окрашивает пламя в кармино-красный цвет, ион Na + – в желтый, К + – в фиолетовый
Соединения щелочных металлов
Оксиды.
Оксиды щелочных металлов типичные основные оксиды. Вступают в реакции с кислотными и амфотерными оксидами, кислотами, водой.
3Na 2 O + P 2 O 5 = 2Na 3 PO 4
Na 2 O + Al 2 O 3 = 2NaAlO 2
Na 2 O + 2HCl = 2NaCl + H 2 O
Na 2 O + 2H + = 2Na + + H 2 O
Na 2 O + H 2 O = 2NaOH
Пероксиды .
2Na 2 O 2 + CO 2 = 2Na 2 CO 3 + O 2
Na 2 O 2 + CO = Na 2 CO 3
Na 2 O 2 + SO 2 = Na 2 SO 4
2Na 2 O + O 2 = 2Na 2 O 2
Na 2 O + NO + NO 2 = 2NaNO 2
2Na 2 O 2 = 2Na 2 O + O 2
Na 2 O 2 + 2H 2 O (хол.) = 2NaOH + H 2 O 2
2Na 2 O 2 + 2H 2 O (гор.) = 4NaOH + O 2
Na 2 O 2 + 2HCl = 2NaCl + H 2 O 2
2Na 2 O 2 + 2H 2 SO 4 (разб. гор.) = 2Na 2 SO 4 + 2H 2 O + O 2
2Na 2 O 2 + S = Na 2 SO 3 + Na 2 O
5Na 2 O 2 + 8H 2 SO 4 + 2KMnO 4 = 5O 2 + 2MnSO 4 + 8H 2 O + 5Na 2 SO 4 + K 2 SO 4
Na 2 O 2 + 2H 2 SO 4 + 2NaI = I 2 + 2Na 2 SO 4 + 2H 2 O
Na 2 O 2 + 2H 2 SO 4 + 2FeSO 4 = Fe 2 (SO 4) 3 + Na 2 SO 4 + 2H 2 O
3Na 2 O 2 + 2Na 3 = 2Na 2 CrO 4 + 8NaOH + 2H 2 O
Основания (щелочи).
2NaOH (избыток) + CO 2 = Na 2 CO 3 + H 2 O
NaOH + CO 2 (избыток) = NaHCO 3
SO 2 + 2NaOH (избыток) = Na 2 SO 3 + H 2 O
SiO 2 + 2NaOH Na 2 SiO 3 + H 2 O
2NaOH + Al 2 O 3 2NaAlO 2 + H 2 O
2NaOH + Al 2 O 3 + 3H 2 O = 2Na
NaOH + Al(OH) 3 = Na
2NaOH + 2Al + 6Н 2 О = 2Na + 3Н 2
2KOH + 2NO 2 + O 2 = 2KNO 3 + H 2 O
KOH + KHCO 3 = K 2 CO 3 + H 2 O
2NaOH + Si + H 2 O = Na 2 SiO 3 + H 2
3KOH + P 4 + 3H 2 O = 3KH 2 PO 2 + PH 3
2KOH (холодный) + Cl 2 = KClO + KCl + H 2 O
6KOH (горячий) + 3Cl 2 = KClO 3 + 5KCl + 3H 2 O
6NaOH + 3S = 2Na 2 S + Na 2 SO 3 + 3H 2 O
2NaNO 3 2NaNO 2 + O 2
NaHCO 3 + HNO 3 = NaNO 3 + CO 2 + H 2 O
NaI → Na + + I –
на катоде: 2Н 2 О + 2e → H 2 + 2OH – 1
на аноде: 2I – – 2e → I 2 1
2Н 2 О
+ 2I –![]() H 2
+ 2OH –
+ I 2
H 2
+ 2OH –
+ I 2
2H 2 O
+ 2NaI![]() H 2
+ 2NaOH + I 2
H 2
+ 2NaOH + I 2
2NaCl![]() 2Na
+ Cl 2
2Na
+ Cl 2
на катоде на аноде
2Na 2 HPO 4 Na 4 P 2 O 7 + H 2 O
KNO 3 + 4Mg + 6H 2 O = NH 3 + 4Mg(OH) 2 + KOH
4KClO 3 KCl + 3KClO 4
2KClO 3![]() 2KCl + 3O 2
2KCl + 3O 2
KClO 3 + 6HCl = KCl + 3Cl 2 + 3H 2 O
Na 2 SO 3 + S = Na 2 S 2 O 3
Na 2 S 2 O 3 + H 2 SO 4 = Na 2 SO 4 + S↓ + SO 2 + H 2 O
2NaI + Br 2 = 2NaBr + I 2
2NaBr + Cl 2 = 2NaCl + Br 2
I A группа.
1. Над поверхностью налитого в колбу раствора едкого натра пропускали электрические разряды, при этом воздух в колбе окрашивался в бурый цвет, который исчезает через некоторое время. Полученный раствор осторожно выпарили и установили, что твердый остаток представляет собой смесь двух солей. При нагревании этой смеси выделяется газ и остается единственное вещество. Напишите уравнения описанных реакций.
2. Вещество, выделяющееся на катоде при электролизе расплава хлорида натрия, сожгли в кислороде. Полученный продукт поместили в газометр, наполненный углекислым газом. Образовавшееся вещество добавили в раствор хлорида аммония и раствор нагрели. Напишите уравнения описанных реакций.
3) Азотную кислоту нейтрализовали пищевой содой, нейтральный раствор осторожно выпарили и остаток прокалили. Образовавшееся вещество внесли в подкисленный серной кислотой раствор перманганата калия, при этом раствор обесцветился. Азотсодержащий продукт реакции поместили в раствор едкого натра и добавили цинковую пыль, при этом выделился газ с резким запахом. Напишите уравнения описанных реакций.
4) Вещество, полученное на аноде при электролизе раствора иодида натрия с инертными электродами, внесли в реакцию с калием. Продукт реакции нагрели с концентрированной серной кислотой, и выделившийся газ пропустили через горячий раствор хромата калия. Напишите уравнения описанных реакций
5) Вещество, полученное на катоде при электролизе расплава хлорида натрия, сожгли в кислороде. Поученный продукт последовательно обработали сернистым газом и раствором гидроксида бария. Напишите уравнения описанных реакций
6) Белый фосфор растворяется в растворе едкого кали с выделением газа с чесночным запахом, который самовоспламеняется на воздухе. Твердый продукт реакции горения прореагировал с едким натром в таком соотношении, что в образовавшемся веществе белого цвета содержится один атом водорода; при прокаливании последнего вещества образуется пирофосфат натрия. Напишите уравнения описанных реакций
7) Неизвестный металл сожгли в кислороде. Продукт реакции, взаимодействует с углекислым газом, образует два вещества: твердое, которое взаимодействует с раствором соляной кислоты с выделением углекислого газа, и газообразное простое вещество, поддерживающее горение. Напишите уравнения описанных реакций.
8) Через избыток раствора едкого кали пропустили бурый газ в присутствии большого избытка воздуха. В образовавшийся раствор добавили магниевую стружку и нагрели, выделившимся газом нейтрализовали азотную кислоту. Полученный раствор осторожно выпарили, твердый продукт реакции прокалили. Напишите уравнения описанных реакций.
9) При термическом разложении соли А в присутствии диоксида марганца образовались бинарная соль Б и газ, поддерживающий горение и входящий в состав воздуха; при нагревании этой соли без катализатора образуются соль Б и соль высшей кислородсодержащей кислоты. При взаимодействии соли А с соляной кислотой выделяется желто-зеленый газ (простое вещество) и образуется соль Б. Соль Б окрашивает пламя в фиолетовый цвет, при ее взаимодействии с раствором нитрата серебра выпадает осадок белого цвета. Напишите уравнения описанных реакций.
10) К нагретой концентрированной серной кислотой добавили медную стружку и выделившийся газ пропустили через раствор едкого натра (избыток). Продукт реакции выделили, растворили в воде и нагрели с серой, которая в результате проведения реакции растворилась. В полученный раствор добавили разбавленную серную кислоту. Напишите уравнения описанных реакций.
11) Поваренную соль обработали концентрированной серной кислотой. Полученную соль обработали гидроксидом натрия. Полученный продукт прокалили с избытком угля. Выделившийся при этом газ прореагировал в присутствии катализатора с хлором. Напишите уравнения описанных реакций.
12) Натрий прореагировал с водородом. Продукт реакции растворили в воде, при этом образовался газ, реагирующий с хлором, а полученный раствор при нагревании прореагировал с хлором с образованием смеси двух солей. Напишите уравнения описанных реакций.
13) Натрий сожгли в избытке кислорода, полученное кристаллическое вещество поместили в стеклянную трубку и пропустили через неё углекислый газ. Газ, выходящий из трубки, собрали и сожгли в его атмосфере фосфор. Полученное вещество нейтрализовали избытком раствора гидроксида натрия. Напишите уравнения описанных реакций.
14) К раствору, полученному в результате взаимодействия пероксида натрия с водой при нагревании, добавили раствор соляной кислоты до окончания реакции. Раствор образовавшейся соли подвергли электролизу с инертными электродами. Газ, образовавшийся в результате электролиза на аноде, пропустили через суспензию гидроксида кальция. Напишите уравнения описанных реакций.
15) Через раствор гидроксида натрия пропустили сернистый газ до образования средней соли. К полученному раствору прилили водный раствор перманганата калия. Образовавшийся осадок отделили и подействовали на него соляной кислотой. Выделившийся газ пропустили через холодный раствор гидроксида калия. Напишите уравнения описанных реакций.
16) Смесь оксида кремния (IV) и металлического магния прокалили. Полученное в результате реакции простое вещество обработали концентрированным раствором гидроксида натрия. Выделившийся газ пропустили над нагретым натрием. Образовавшееся вещество поместили в воду. Напишите уравнения описанных реакций.
17) Продукт взаимодействия лития с азотом обработали водой. Полученный газ пропустили через раствор серной кислоты до прекращения химических реакций. Полученный раствор обработали раствором хлорида бария. Раствор профильтровали, а фильтрат смешали с раствором нитрата натрия и нагрели. Напишите уравнения описанных реакций.
18) Натрий нагрели в атмосфере водорода. При добавлении к полученному веществу воды наблюдали выделение газа и образование прозрачного раствора. Через этот раствор пропустили бурый газ, который был получен в результате взаимодействия меди с концентрированным раствором азотной кислоты. Напишите уравнения описанных реакций.
19) Гидрокарбонат натрия прокалили. Полученную соль растворили в воде и смешали с раствором алюминия, в результате образовался осадок и выделился бесцветный газ. Осадок обработали избытком раствора азотной кислоты, а газ пропустили через раствор силиката калия. Напишите уравнения описанных реакций.
20) Натрий сплавили с серой. Образовавшееся соединение обработали соляной кислотой, выделившийся газ нацело прореагировал с оксидом серы (IV). Образовавшееся вещество обработали концентрированной азотной кислотой. Напишите уравнения описанных реакций.
21) Натрий сожгли в избытке кислорода. Образовавшееся вещество обработали водой. Полученную смесь прокипятили, после чего в горячий раствор добавили хлор. Напишите уравнения описанных реакций.
22) Калий нагрели в атмосфере азота. Полученное вещество обработали избытком соляной кислоты, после чего к образовавшейся смеси солей добавили суспензию гидроксида кальция и нагрели. Полученный газ пропустили рад раскаленным оксидом меди (II).Напишите уравнения описанных реакций.
23) Калий сожгли в атмосфере хлора, образовавшуюся соль обработали избытком водного раствора нитрата серебра. Выпавший осадок отфильтровали, фильтрат выпарили т осторожно нагрели. Образовавшуюся соль обработали водным раствором брома. Напишите уравнения описанных реакций.
24) Литий прореагировал с водородом. Продукт реакции растворили в воде, при этом образовался газ, реагирующий с бромом, а полученный раствор при нагревании прореагировал с хлором с образованием смеси двух солей. Напишите уравнения описанных реакций.
25) Натрий сожгли на воздухе. Образовавшееся при этом твердое вещество поглощает углекислый газ с выделением кислорода и соли. Последнюю соль растворили в соляной кислоте, а к полученному при этом раствору добавили раствор нитрата серебра. При этом выпал белый осадок. Напишите уравнения описанных реакций.
26) Кислород подвергли воздействию электроразряда в озонаторе. Полученный газ пропустили через водный раствор йодида калия, при этом выделился новый газ без цвета и запаха, поддерживающий горение и дыхание. В атмосфере последнего газа сожгли натрий, а полученное при этом твердое вещество прореагировало с углекислым газом. Напишите уравнения описанных реакций.
I A группа.
1.
N 2
+ O 2
![]() 2NO
2NO
2NO + O 2 = 2NO 2
2NO 2 + 2NaOH = NaNO 3 + NaNO 2 + H 2 O
2NaNO 3 2NaNO 2 + O 2
2.
2NaCl![]() 2Na + Cl 2
2Na + Cl 2
на катоде на аноде
2Na + O 2 = Na 2 O 2
2Na 2 O 2 + 2CO 2 = 2Na 2 CO 3 + O 2
Na 2 CO 3 + 2NH 4 Cl = 2NaCl + CO 2 + 2NH 3 + Н 2 О
3. NaHCO 3 + HNO 3 = NaNO 3 + CO 2 + H 2 O
2NaNO 3 2NaNO 2 + O 2
5NaNO 2 + 2KMnO 4 + 3H 2 SO 4 = 5NaNO 3 + 2MnSO 4 + K 2 SO 4 + 3H 2 O
NaNO 3 + 4Zn + 7NaOH + 6H 2 O = 4Na 2 + NH 3
4.
2H 2 O
+ 2NaI![]() H 2
+ 2NaOH + I 2
H 2
+ 2NaOH + I 2
2K + I 2 = 2KI
8KI + 5H 2 SO 4(конц.) = 4K 2 SO 4 + H 2 S + 4I 2 + 4H 2 O
3H 2 S + 2K 2 CrO 4 + 2H 2 O = 2Cr(OH) 3 ↓ + 3S↓ + 4KOH
5.
2NaCl![]() 2Na
+ Cl 2
2Na
+ Cl 2
на катоде на аноде
2Na + O 2 = Na 2 O 2
Na 2 O 2 + SO 2 = Na 2 SO 4
Na 2 SO 4 + Ba(OH) 2 = BaSO 4 ↓ + 2NaOH
6. P 4 + 3KOH + 3H 2 O = 3KH 2 PO 2 + PH 3
2PH 3 + 4O 2 = P 2 O 5 + 3H 2 O
P 2 O 5 + 4NaOH = 2Na 2 HPO 4 + H 2 O
· · ·§ 96. Щелочные
В группу щелочных металлов входит следующий ряд металлов; Li, Na, К, Rb, Cs, Fr. Они находятся в главной подгруппе I группы периодической системы.
Все эти сходны в том отношении, что на внешнем электронном слое их имеется один электрон (табл. 18)/.
Щелочные относятся к числу s-элементов. Электрон внешнего электронного слоя атома щелочного металла по сравнению с другими элементами того же периода наиболее удален от ядра, т. е. радиус атома щелочного металла наибольший по сравнению с радиусами атомов других элементов того же периода. В связи
|
Заряд ядра |
Число электронов на энергетических уровнях |
Радиус атома |
|||||||
с этим валентный электрон внешнего слоя атомов щелочных металлов легко отрывается, превращая их в положительные однозарядные ионы. Этим обусловлено , что соединения щелочных металлов с другими элементами построены по типу ионной связи.
В окислительно-восстановительных реакциях ведут себя как сильные восстановители, и эта способность возрастает от металла к металлу с увеличением заряда ядра атома.
§ 97. Натрий
Электронная конфигурация атома натрия ls 2 2s 2 2p 6 3s 1 . Структура его внешнего слоя:
Натрий встречается в природе только в виде солей. Наиболее распространенной солью натрия является поваренная соль NaCl, а также минерал сильвинит КCl · NaCl и некоторые сернокислые соли, например глауберова соль Na2SO4 · 10H2O, встречающаяся в больших количествах в заливе Каспийского моря Кара-Богаз-Гол.
Из поваренной соли NaCl металлический натрий получают путем электролиза расплава этой соли. Установка для электролиза изображена на рис. 76. В расплавленную соль опускают электроды. Анодное и катодное пространство разделено диафрагмой, которая изолирует образующийся от натрия, чтобы не произошло обратной реакции. Положительный ион натрия принимает с катода электрон и превращается в нейтральный атом натрия. Нейтральные атомы натрия собираются на катоде в виде расплавленного металла. Происходящий на катоде процесс можно изобразить следующей схемой:
Na + + Na 0 .
Поскольку на катоде происходит принятие электронов, а всякое принятие электронов атомом или ионом является восстановлением, ионы натрия на катоде восстанавливаются. На аноде ионы хлора отдают электроны, т. е. происходит процесс окисления и выделение свободного
газообразного хлора, что можно изобразить следующей схемой:
Cl — — е — → Cl 0
Полученный металлический натрий имеет серебристо-белый цвет, легко режется ножом. Срез у натрия, если его рассмотреть сразу после разреза, имеет яркий металлический блеск, но быстро тускнеет вследствие крайне быстрого окисления металла.
![]()
Рис. 76. Схема установки для электролиза расплава поваренной соли.
1 - кольцевой катод; 2 - колокол для выведения газообразного хлора из анодного пространства
Если натрий окислять в небольшом количестве кислорода при температуре около 180°, получается окись натрия:
4Na + О2 = 2Na2O.
При горении в кислороде получается перекись натрия:
2Na + O2 = Na2O2.
При этом натрий сгорает ослепительно желтым пламенем.
В связи с легкой и быстрой окисляемостью натрия его хранят под слоем керосина или парафина, причем предпочтительнее, так как в керосине все же растворяется некоторое количество воздуха и окисление натрия хотя и медленно, но все же происходит.
Натрий может давать соединение с водородом - гидрид NaH, в котором проявляет степень окисления - 1. Это солеподобное соединение, которое по характеру химической связи и величине степени окисления отличается от летучих гидридов элементов главных подгрупп IV-VII группы.
Металлический натрий может реагировать не только с кислородом и водородом, но и с многими простыми и сложными веществами. Например, при растирании в ступке с серой натрий бурно реагирует с ней, образуя :
2Na + S = Na2S
Реакция сопровождается вспышками, поэтому ступку нужно держать подальше от глаз и обернуть руку полотенцем. Для реакции следует брать небольшие кусочки натрия.
Натрий энергично сгорает в хлоре с образованием хлорида натрия, что особенно хорошо наблюдать в хлор-кальциевой трубке, в которой через расплавленный и сильно разогретый натрий пропускают ток хлора:
2Na + Сl2 = 2NaCl
Натрий реагирует не только с простыми, но и со сложными веществами, например с водой, вытесняя из нее , так как является весьма активным металлом, в ряду напряжений стоит намного левее водорода и легко вытесняет последний из воды:
2Na + 2Н2O = 2NaOH + H2
Загоревшийся щелочной металл нельзя тушить водой. Лучше всего засыпать его порошком кальцинированной соды. В присутствии натрия бесцветное пламя газовой горелки окрашивается в желтый цвет.
Металлический натрий можно использовать как катализатор в органическом синтезе, например при производстве синтетического каучука из бутадиена. Он служит исходным веществом для получения других соединений натрия, например перекиси натрия.
■ 27. Докажите с помощью приведенных в тексте уравнений реакций с участием металлического натрия, что он ведет себя как восстановитель.
28. Почему натрий нельзя хранить на воздухе?
29. Ученик опустил в раствор сульфата меди кусочек натрия, надеясь вытеснить из соли металлическую . Вместо металла красного цвета получился студенистый голубой осадок. Опишите происшедшие реакции и напишите их уравнения в молекулярной и ионной формах. Как следовало изменить условия реакции, чтобы реакция привела к желаемому результату? Уравнения напишите в молекулярной, полной и сокращенной ионной формах.
30. В сосуд с 45 мл воды поместили 2,3 г металлического натрия. Какова едкого натра, образовавшегося по окончании реакции.
31. Какие средства можно применять при тушении загоревшегося натрия? Дайте обоснованный ответ.
§ 98. Кислородные соединения натрия. Едкий натр
Кислородными соединениями натрия, как уже было сказано, являются окись натрия Na2O и перекись натрия Na2O2.
Окись натрия Na2O особого значения не имеет. Она энергично реагирует с водой, образуя едкий натр:
Na2O + Н2O = 2NaOH
Перекись натрия Na202 - желтоватый порошок. Ее можно рассматривать как своеобразную соль перекиси водорода, ибо структура ее такая же, как у Н2O2. Как и , перекись натрия является сильнейшим окислителем. При действии воды она образует щелочь и :
Na2O2 + Н2O = Н2O2 + 2NaOH
образуется и при действии разбавленных кислот на перекись натрия:
Na2O2 + H2SO4 = Н2O2 + Na2SO4
Все указанные выше свойства перекиси натрия позволяют использовать ее для отбелки все возможных материалов.
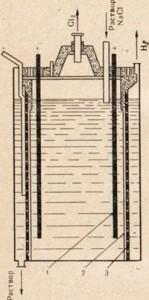
Рис. 77. Схема установки для электролиза раствора поваренной соли.
1 - анод; 2 - диафрагма, разделяющее анодное и катодное пространство; 3 -катод
Очень важным соединением натрия является гидроокись натрия, или едкий натр, NaOH. Его называют также каустической содой, или просто каустиком.
Для получения едкого натра используют поваренную соль - наиболее дешевое природное соединение натрия, подвергая ее электролизу, но в этом случае применяют не расплав, а раствор соли (рис. 77). Описание процесса электролиза раствора поваренной соли см. § 33. На рис. 77 показано, что анодное и катодное пространство разделено диафрагмой. Это сделано с той целью, чтобы образующиеся продукты не вступали между собой во взаимодействие, например Сl2 + 2NaOH = NaClO + NaCl + Н2O.
Едкий натр - твердое кристаллическое вещество белого цвета, прекрасно растворимое в воде. При растворении едкого натра в воде выделяется большое количество тепла и раствор сильно разогревается. Едкий натр необходимо хранить в хорошо закупоренных сосудах, чтобы предохранить его от проникновения водяных паров, под действием которых он может сильно увлажниться, а также двуокиси углерода, под действием которой едкий натр может постепенно превратиться в карбонат натрия:
2NaOH + СO2 = Na2CO3+ Н2O.
Едкий натр-типичная щелочь, поэтому меры предосторожности при работе с ним такие же, как и при работе с любыми другими щелочами.
Едкий натр применяется во многих отраслях промышленности, например для очистки нефтепродуктов, производства мыла из жиров, в бумажной промышленности, в производстве искусственного волокна и красителей, производстве медикаментов и др. (рис. 78).
Запишите в тетрадь области применения едкого натра.
Из солей натрия следует отметить в первую очередь поваренную соль NaCl, которая служит основным сырьем для получения едкого натра и металлического натрия (подробно об этой соли см. стр. 164), соду Na2CO3 (см. стр. 278), Na2SO4 (см. стр. 224), NaNO3 (см. стр. 250) и др.
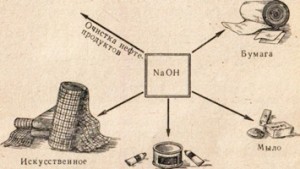
Рис. 78. Применение едкого натра
■ 32. Опишите способ получения едкого натра электролизом поваренной соли.
33. Едкий натр можно получить действием на карбонат натрия гашеной известью. Составьте молекулярную и ионные формы уравнения этой реакции, а также рассчитайте, сколько соды, содержащей 95% карбоната, потребуется для получения 40 кг едкого натра.
34. Почему при хранении раствора едкого натра в склянках с притертыми пробками пробки «заедают» и их нельзя вынуть? Если же в течение некоторого срока подержать склянку опрокинутой в воду, то пробка свободно вынимается. Объясните, приведя уравнения реакций, что за процессы имеют место в данном случае.
35. Напишите уравнения реакций в молекулярной и ионных формах, характеризующих свойства едкого натра как типичной щелочи.
36. Какие меры предосторожности следует соблюдать при работе с едким натром? Какие меры первой помощи следует оказать при ожогах едким натром?
§ 99. Калий
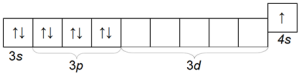
Калий К - также довольно распространенный щелочной металл, отличающийся от натрия величиной атомного радиуса (четвертый период) и потому обладающий большей химической активностью, чем натрий. Электронная конфигурация атома калия 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 .
Структура его внешнего электронного слоя
Калий - мягкий металл, который хорошо режется ножом. Во избежание окисления его, как и натрий, хранят под слоем керосина.
С водой калий реагирует еще более бурно, чем натрий, с образованием щелочи и с выделением водорода, который загорается:
2К + 2Н2O = 2КОН + Н2.
При сжигании в кислороде (при этом для сжигания рекомендуется брать еще более мелкие кусочки металла, чем для сжигания натрия) он, подобно натрию, сгорает очень энергично с образованием перекиси калия.
Следует отметить, что в обращении калий гораздо опаснее натрия. Сильный взрыв может произойти даже при разрезании калия, поэтому обращаться с ним нужно еще осторожнее.
Гидроокись калия, или едкое кали КОН - белое кристаллическое вещество. Едкое кали во всех отношениях сходно с едким натром. Они широко применяются в мыловаренной промышленности, но его получение обходится несколько дороже, поэтому такого применения, как NaOH, оно не находит.
Соли калия следует отметить особо, так как некоторые из них широко используются в качестве удобрения. Таковы хлорид калия КСl, нитрат калия KNO3, который является также азотным удобрением.
■ 37. Чем объяснить то, что едкое кали химически активнее едкого натра?
38. В кристаллизатор с водой опустили кусочек калия. После того как реакция закончилась, туда же поместили немного цинка в виде белого студенистого осадка. Осадок исчез, а при испытании раствора фенолфталеином последний окрасился в малиновый цвет. Какие химические процессы здесь произошли?
Какие находятся в растворе? Дайте обоснованный ответ.
39. Почему калий, как и все щелочные металлы, относят к семейству s-элементов?
Гидриды. Наиболее устойчив гидрид лития, который легко получается при пропускании водорода над нагретым литием. LiH – белый кристаллический порошок с температурой плавления 680 о С. При высокой температуре LiH чрезвычайно реакционноспособен. Энергично разлагается водой:
LiH + H 2 O = LiOH + H 2
Оксиды. Наиболее устойчив Li 2 O. Оксиды лития и натрия белого цвета, остальные - желтого. Причем, интенсивность окраски увеличивается с увеличением порядкового номера элемента.
Пероксиды. Получаются при горении металлов в избытке кислорода. Пероксиды щелочных металлов можно считать производными пероксида водорода т.к. они взаимодействуя с кислотами и водой образуют пероксид водорода:
M 2 O 2 + H 2 SO 4 = M 2 SO 4 + H 2 O 2
M 2 O 2 + 2H 2 O = 2MOH + H 2 O 2
Наибольшее значение имеет пероксид натрия, который используется для получения кислорода в закрытых помещениях (например, подводная лодка):
2Na 2 O 2 + 2CO 2 = 2Na 2 CO 3 + 2O 2
Гидроксиды. В технике носят название едкие щелочи, (NaOH - едкий натр, KOH - едкое кали). Это бесцветные, легкоплавкие вещества. В расплавленном состоянии взаимодействуют со стеклом, фарфором, платиной. Поэтому плавление щелочей осуществляют в серебрянных или железных тиглях, с которыми они не взаимодействуют. Гидроксиды хорошо растворимы в воде с большим выделением тепла.
Получают гидроксиды следующими способами:
а) Взаимодействием металлов или оксидов с водой:
Li 2 O + H 2 O = 2LiOH
Эта реакция используется только для получения очень чистых гидроксидов.
б) Реакция каустификации – самый старый из известных методов получения едкого натра. Этот метод состоит в обработке раствора соды гидроксидом кальция (гашеная известь) при кипячении. Образующийся нерастворимый карбонат кальция отфильтровывается или с него декантируют прозрачную жидкость:
Na 2 CO 3 + Ca(OH) 2 = 2NaOH + CaCO 3
Полученный раствор едкого натра концентрируют путем упаривания в вакууме. Твердый едкий натр плавят при 500 о С для полного удаления воды и получают NaOH, содержащий 3-4% Na 2 CO 3 . Полученный этим способом NaOH носит название "каустическая сода".
в) Электролиз хлоридов щелочных металлов в водном растворе представляет собой современный промышленный метод получения NaOH и KOH одновременно с хлором. Когда раствор NaCl подвергают электролизу с инертными электродами (платина, графит), на аноде выделяется хлор, а на катоде водород. В прикатодном пространстве накапливаются ионы Na + и ионы OH - , которые образуют NaOH.
г) Сплавлением карбонатов щелочных металлов с оксидами и последующей обработкой сплава водяным паром:
Fe 2 O 3 + Na 2 CO 3 = 2NaFeO 2 + CO 2
2NaFeO 2 + H 2 O = 2NaOH + Fe 2 O 3
Щелочи являются важнейшим сырьем в химической промышленности для получения красителей, стекол, мыла, бумаги, искусственных волокон, лекарственных средств.
Соли. NaCl и KCl встречаются в больших количествах в природе. NaCl (поваренная соль) содержится в морской воде (в среднем 2,7%) и в виде каменной соли в залежах мощностью до нескольких километров. В чистом виде NaCl и KCl получают из природных хлоридов перекристаллизацией. Соли лития получают из природного карбоната лития. Получение солей рубидия и цезия связано с трудностями, т.к. их растворимость очень близка к растворимости солей калия. Обычно исходят из маточных растворов, остающихся после перекристаллизации карналлита и выделяют из них квасцы рубидия и цезия, которые очищают перекристаллизацией. Отделения рубидия от цезия производят, используя различную растворимость их карбонатов в спирте.
Из нитратов практическое значение имеют NaNO 3 и KNO 3 . Технические названия – натриевая селитра и калийная селитра. Обе соли используются в качестве минеральных удобрений. KNO 3 идет также на производство черного пороха (NaNO 3 не применяется из-за своей гигроскопичности).
Угольная кислота H 2 CO 3 дает два ряда карбонатов щелочных металлов кислые (MHCO 3) и средние (M 2 CO 3).Кислые карбонаты (гидрокарбонаты, бикарбонаты) известны для всех щелочных металлов кроме лития. За исключением карбоната лития все нейтральные карбонаты хорошо растворимы в воде. Na 2 CO 3 – сода, иногда встречается в природе в водах некоторых озер и в минеральных источниках. Получают соду аммиачным способом: раствор поваренной соли насыщают аммиаком и диоксидом углерода. При этом NaHCO 3 выпадает в осадок, т.к. сода хуже растворима, чем NH 4 Cl:
NaCl + H 2 O + CO 2 + NH 3 = NaHCO 3 ¯ + NH 4 Cl
2NaHCO 3 → Na 2 CO 3 + CO 2 + H 2 O
K 2 CO 3 – поташ, гигроскопичный белый порошок, хорошо растворимый в воде. Получают карбонизацией едкого кали:
2KOH + CO 2 = K 2 CO 3 + H 2 O
Поташ применяется в мыловаренной, стекольной промышленностях, при крашении и отбеливании шерсти, в производстве цианида калия, в органическом синтезе.
Серная кислота дает два ряда сульфатов щелочных металлов - кислых и средних.
Na 2 SO 4 получают как побочный продукт при производстве соляной кислоты из хлорида натрия и серной кислоты. Из водных растворов сульфат натрия кристаллизуется в виде Na 2 SO 4 . 10H 2 O, в технике этот кристаллогидрат называется глауберовой солью. Используется при крашении хлопчатобумажных тканей, в медицине.
Конспект урока химии в 9 классе по теме:
« Соединения щелочных металлов и их применение».
Цели : Обобщить и систематизировать знания о щелочных металлах и их соединениях; познакомиться с применением этих соединений в быту и производстве, значением их в жизнедеятельности организмов
Задачи урока :
1.Обеспечить в ходе урока усвоение химических свойств соединений щелочных металлов, их применение в быту и производстве, значение в жизнедеятельности организмов.
Продолжить формирование общеучебных умений и навыков работы с химическими реактивами.
2. Формирование основных мировоззренческих идей причинно-следственных связей между явлениями строение атома щелочного металла – свойства простого вещества – свойства соединений щелочных металлов и их применением на основе свойств.
3.Развивать умение сравнивать, обобщать изучаемые факты, логически излагать свои мысли при ответе. Развивать познавательный интерес школьников, используя данные о применении изучаемых явлений в окружающей жизни.
Тип урока : комбинированный - изучение нового материала с использованием ИКТ.
Оборудование : учебник, мел, доска, компьютер, медиапроектор, экран, презентация темы урока, технологические карты урока для учащихся, химические реактивы (растворы: гидроксид натрия, соляная кислота, сульфат меди гидроксид цинка, фенолфталеин) и лабораторная посуда (штатив с пробирками).
Ход урока
I .Организационный момент .
II . Изучение нового материала.
1.Проверка ранее изученного материала по теме «Щелочные металлы».
Отгадайте загадки:
1. Хранят обычно в керосине, и бегает он по воде,
В природе, помните, отныне,
Свободным нет его нигде,
В солях открыть его возможно
Желтеет пламя от него
И получить из соли можно
Как Дэви получил его.
О каком элементе идет речь? (Na)
2. Он энергично вытесняет
Из влаги - чистый водород,
Его при этом заменяет
И вяжет прочно кислород.
Тот элемент в растеньях скрыт
По фиолетовому цвету
Он может быть в солях открыт.
О каком элементе идет речь? (К).
1.С какими металлами мы с вами познакомились на прошлом уроке?
2.Почему они так называются?
3. Назовите общую особенность в строении атомов всех щелочных металлов?
Тест по теме: Щелочные металлы .
1.К щелочным металлам не относится: а) рубидий; в) калий; б) цезий; г) медь.
2.Электронная формула) 2) 8) 8) 1 соответствует элементу: а) литию; в) калию; б) натрию;
3.Радиус атома у элементов I группы главной подгруппы с увеличением заряда ядра:
а) изменяется периодически; в) не изменяется; б) увеличивается;
4.Щелочные металлы проявляют очень сильные:
а) окислительные свойства; в) восстановительные свойства; б) амфотерные свойства;
5..К физическим свойствам щелочных металлов не относится:
а) серебристо-белые; б) мягкие и легки; г) тугоплавкие.
6.При взаимодействии элементов I группы главной подгруппы с водой образуется:
а) кислота; б) щелочь и выделяется водород; г) соль.
7.Натрий и калий хранят в керосине, потому что они:
а) имеют резкий запах; б) легко окисляются на воздухе;
Самоконтроль: нет ошибок – «5», 1,2 ошибки – «4», 3 ошибки – «3», более – «2»
Ответы: 1- г 2 - в 3 - б 4 - в 5 - г 6 – б 7 - б.
Самоконтроль: нет ошибок – «5», 1,2 ошибки – «4», 3,4 ошибки – «3», более – «2»
2.Актуализация знаний .
А можно ли встреть щелочные металлы в свободном виде в природе? Почему?
Предположите, в виде каких соединений они могут находится в природе?
В природе щелочные металлы встречаются только в виде соединений.
Na и К в природе встречаются в виде хлоридов, сульфатов, силикатов и т.д.
Li, Rb, Cs входят в состав различных минералов.
Fr встречается в радиоактивных рудах Ас и U .
На столе: объекты, содержащие соединения щелочных металлов (сода, соль, пальчиковые батарейки, мыло) и задает вопрос.
Посмотрите на эти объекты. Как вы думаете, что их объединяет?
1Что такое генетическая связь?
2.Составим генетический ряд натрия.
Na → Na 2 O → 2NaOH →Na 2 CO 3
3. Какие классы соединений образуют щелочные металлы? Рассмотрим их свойства.
По ходу объяснения материала и просмотров слайдов учащиеся ведут записи по плану, раскрывая свойства и применение.
Оксиды щелочных металлов
твердые, белые, легкорастворимые.
б) химические свойства; Учащиеся записывают в тетрадь: оксиды щелочных металлов – это типичные основные оксиды. Как все основные оксиды, оксиды щелочных металлов реагируют с водой, с кислотными оксидами, с кислотами.
Ребята на доске и в тетради записывают уравнения химических реакций на примере оксида натрия:
Na
2 O
+ H
2 O
→ 2NaOH
;
Na 2 O + CO 2 → Na 2 CO 3 ;
Na 2 O + H 2 CO 3 → Na 2 CO 3 + H 2 O
Гидроксиды щелочных металлов
.
а) физические свойства; Учащиеся записывают в тетрадь свойства: твердые, белые, хорошо растворимые, термически устойчивые, разъедают ткани и бумагу.
б) химические свойства
Инструктаж по техника безопасности
при выполнении лабораторной работы.
Химические свойства гидроксида натрия.
Цель: экспериментально доказать химические свойства щелочных металлов на примере гидроксида
Инструкция
Налейте в чистую пробирку гидроксид натрия, добавьте несколько капель фенолфталеина. Что наблюдаете?
Добавьте в эту же пробирку раствор соляной кислоты. Что наблюдаете? Запишите уравнение реакции.
NaOH
+ HCl
→ NaCl
+ H
2 O
Ребята на доске и в тетради записывают уравнения химической реакции в ионном виде.
Налейте в чистую пробирку гидроксид натрия и добавьте раствор сульфата меди. Что наблюдаете? Запишите уравнение реакции.
2NaOH
+CuSO
4 → Na
2 SO
4 + Cu
(OH
) 2 Ребята на доске и в тетради записывают уравнения химической реакции в ионном виде.
Сделайте вывод о химических свойствах гидроксидов щелочных металлов.
Гидроксиды щелочных металлов реагируют с кислотами, солямив) применение – слайд № 5.
Гидроксид натрия – NaOH – едкий натр, каустическая сода, каустик.
Гидроксид калия – КОН – едкое кали.
NaOH
и КОН – едкие щелочи, разъедают ткани и бумагу. Учащиеся записывают: Применение: для получения искусственного шелка , в производстве мыла и СМС, косметики, лекарств и т.д.Соли щелочных металлов
.
Физические свойства
. Учащиеся записывают в тетрадь свойства твердые кристаллические вещества, почти все растворимые в воде.
Самостоятельная работа с текстом учебника.
Применение: заполнение таблицы с слайда № 5. Работа по учебнику стр. 56 – 57
Формула соли
название
применение
NaHCO 3
K 2 CO 3
NaCl
Na 2 SO 4 ∙ 10 H 2 O
Na 2 CO 3 ∙ 10 H 2 O
Значение в жизнедеятельности организмов - слайд № 6.
Сообщение ученика по теме: «Значение соединений щелочных металлов в жизнедеятельности организмов».
Ионы натрия и калия играют большую биологическую роль: Na
+ - главный внеклеточный ион, содержится в крови и лимфе, а К + - основной внутриклеточный ион. «Работают» вместе. Соотношение концентрации этих ионов регулирует давление крови в живом организме и обеспечивает перемещение растворов солей из корней в листья растений. Ионы калия - поддерживают работу сердечной мышцы, помогают при ревматизме, улучшают работу кишечника. Соединения калия – устраняют отеки.
V . Закрепление
VI
. Итог урока. Выставление отметок.
Итог урока:
Какие физические и химические свойства характерны для оксидов, гидроксидов щелочных металлов?
Где применяются гидроксиды и соли щелочных металлов?
Дополнительный материал. Это интересно.
Задача: Почему в Древней Греции перед длительными походами в жаркую погоду воинам рекомендовали съесть кусочек хлеба, круто посоленный, и запить водой?
Ионы электролитов легко гидратируются, поэтому поваренная соль задерживает воду в организме.
Задача: Почему эскимосы употребляют в пищу очень мало соли?
Согласно одной из научных теорий, все животные, обитающие на земле, включая человека, – потомки организмов, которые появились и жили в море. Жидкость тела этих созданий по составу была морской водой. Переселившись на сушу, они сохранили морскую воду в качестве жидкости своего тела. Но природа не в состоянии обеспечить живые организмы достаточным количеством соли в натуральном виде. Поскольку соль растворяется в воде, значительная ее часть вымывается из почвы дождевой водой в реки, моря и океаны. В результате произрастающие на земле растения содержат недостаточно соли. Вот почему животные, питающиеся растениями, нуждаются в соли. Организм каждый день теряет определенное количество жидкости, содержащей соль, и растительная пища не восполняет ее. Животным, питающимся другими животными, дополнительная соль не нужна. Они получают необходимую им соль из организмов своих жертв. Эскимосы питаются преимущественно мясом, поэтому потребность в соли у них очень мала.
Задача: Почему в Англии в последние десятилетия наблюдается снижение смертности от болезней сосудов головного мозга?
Это связано с увеличением потребления свежих фруктов и овощей. В свежих овощах и фруктах всегда много калия и мало натрия. Натрий задерживает воду в организме, повышая артериальное давление, а калий, напротив, способствует его снижению. Вот почему увеличение потребления овощей, фруктов, в частности яблок, можно рассматривать как существенную меру предупреждения болезней сосудов головного мозга.
ОТКУДА В ЛЮДЯХ ЛЮБОВЬ К СОЛЕНОМУ .
Соль служит для сохранения продуктов от порчи и гниения. Чтобы сохранить продукты (когда еще не было холодильников и морозильников), применяли соль. Попробовав овощей из рассола, люди стали солить, квасить и мочить свежие овощи. Человек так привык все солить, что готов даже смириться с некоторыми болезнями, только бы не переходить на бессолевую диету. Постепенно вырабатывалась привычка солить всякую пищу, даже не пробуя ее.
МНОГО СОЛИ - МАЛО КАЛИЯ, МАЛО КАЛИЯ - МНОГО БОЛЕЗНЕЙ
Вопрос о соли - это вопрос калиево-натриевого равновесия. Оно чрезвычайно важно в организме. Калий и натрий постоянно спорят за свое присутствие в клетках. В поваренной соли нет калия, это полностью натрий. Наш же организм остро нуждается в калии, которого должно быть в 4 раза больше, чем натрия. Организм собирает калий всюду, но избыточное применение поваренной соли сводит на нет все его усилия. Поэтому при избытке потребления соли возникает недостаток калия, что со временем ведет к ряду недомоганий: физическое и умственное утомление, плохой сон, судороги, боли в суставах.
Избыток натрия (соли) перегружает работу сердца. Хотите узнать, не много ли вы употребляете соли? Подойдите к зеркалу: белый круг вокруг радужной оболочки глаза указывает на избыточное потребление соли.
Едкий калий
Едкий калий применяется для производства удобрений, синтетического каучука, электролитов для аккумуляторов, реактивов, используется в фармацевтической промышленности и других отраслях народного хозяйства.
Едкий калий транспортируют железнодорожным, автомобильным транспортом в соответствии с правилами перевозки грузов, действующими на данном виде транспорта.
Едкий калий хранят в герметично закрытой таре, т.к. он "расплывается" на воздухе, поглощая из него влагу.
Его традиционное название "едкое кали" отражает разъедающее действие этого вещества на живые ткани. При попадании едкого калия на кожу возможны химические ожоги.
Мягкие мыла получаются при омыливании масел и жиров едким кали. Все эти мыла обладают мягкой кремообразной консистенцией.
Едкий натр.
Самая распространенная щёлочь. В год в мире производится и потребляется более 57 миллионов тонн едкой щёлочи.
Едкий натр применяется в огромном множестве отраслей промышленности и для бытовых нужд:
В целлюлозно-бумажной промышленности в производстве бумаги, картона, искусственных волокон, древесно-волоконных плит.
Для омыления жиров при производстве мыла, шампуня и других моющих средств.
В химических отраслях промышленности - для нейтрализации кислот и кислотных окислов, как реагент или катализатор в химических реакциях и др.
Натр едкий (Гидроксид натрия) - едкое и коррозионноактивное вещество. Оно относится к веществам 2-го класса опасности. Поэтому при работе с ним требуется соблюдать осторожность.
При попадании на кожу, слизистые оболочки и в глаза образуются серьезные химические ожоги. При контакте слизистых поверхностей с едкой щелочью необходимо промыть пораженный участок струей воды, а при попадании на кожу слабым раствором уксусной кислоты.
На литии – к звездам
В этом металле остро нуждаются производители мобилок, карманных гаджетов и ноутбуков. В больших количествах литий (Li) потребляет ядерная энергетика, по расчетам теоретикам именно этот щелочной металл может дать ключ к термоядерной энергии. Будучи мощнейшим психотропным веществом, Li используется в военной и прикладной психиатрии (причем природа воздействия Li на психику человека до конце не понятна). Дейтерид лития используется в водородной бомбе в качестве рабочего вещества и регулятора мощности взрыва.
Нужен этот металл и для освоения дальнего космоса.
Технологическая карта для учащихся к уроку
Тема: Соединения щелочных металлов.
Тест


