14.08.2019
โลหะธาตุเคมีมีคุณสมบัติทั่วไปอะไรบ้าง? โลหะเป็นองค์ประกอบทางเคมี
ตั้งแต่วัยเด็กเราต้องเผชิญกับวลีที่ว่าวัตถุดังกล่าวทำจากโลหะ โลหะคืออะไร?
โลหะคือองค์ประกอบทางเคมีกลุ่มหนึ่ง (เช่นเดียวกับโลหะผสม) ที่มีคุณสมบัติเหมือนกันกับทั้งกลุ่ม เช่น ความแข็งแรงที่เพิ่มขึ้น การนำความร้อนและไฟฟ้าที่ดี ความอ่อนตัว ความเหนียว และความแวววาวของโลหะ
เกือบ 80% ขององค์ประกอบทางเคมีที่รู้จักทั้งหมด (96 จาก 118) เป็นของโลหะ
คุณสมบัติทางกายภาพของโลหะ
โลหะทุกชนิด ยกเว้นปรอท จะอยู่ในสถานะของแข็งภายใต้สภาวะปกติ ในแง่ของความแข็ง โลหะที่อ่อนที่สุดคือซีเซียม (0.2 คะแนนในระดับ Mohs 10 จุด) ที่ยากที่สุดคือทังสเตน ความแข็งของมันคือ 6 คะแนน ความแข็งของเหล็ก - 4 คะแนน
จุดหลอมเหลว (การเปลี่ยนสถานะเป็นของเหลว) ของโลหะจะแตกต่างกันไป: ตั้งแต่ - 39° สำหรับปรอท จนถึง 3,410° สำหรับทังสเตน โลหะอัลคาไลทั้งหมดมีจุดหลอมเหลวต่ำ และโลหะทั่วไปได้แก่ ดีบุกและตะกั่ว สามารถละลายได้แม้ใช้เตาแก๊สที่บ้าน โลหะส่วนใหญ่ละลายในเตาหลอมพิเศษที่อุณหภูมิสูง
เนื่องจากมีอิเล็กตรอนเคลื่อนที่อิสระอยู่ในโครงผลึกของโลหะ พวกมันจึงนำไฟฟ้าและความร้อนได้ดีมาก โลหะตัวนำไฟฟ้าที่ดีที่สุดคือ เงิน ทองแดง และอลูมิเนียม ไม่ใช่เรื่องบังเอิญที่การเดินสายไฟฟ้าทำจากโลหะสองชนิดสุดท้าย
เรามักจะพบกับการนำความร้อนที่ดีเยี่ยมของโลหะในชีวิตประจำวัน ในการต้มน้ำให้เทลงในกระทะโลหะแล้ววางบนเตา องค์ประกอบความร้อนจะทำให้โลหะร้อนขึ้น และโลหะจะถ่ายเทพลังงานความร้อนเกือบทั้งหมดไปยังน้ำ
คุณสมบัติทางเคมีของโลหะ
ในระหว่างปฏิกิริยาเคมี โลหะทุกชนิดจะปล่อยอิเล็กตรอนได้ง่ายและทำหน้าที่เป็นตัวรีดิวซ์
โลหะเกือบทั้งหมดถูกออกซิไดซ์ด้วยออกซิเจน โลหะอัลคาไล (ลิเธียม แคลเซียม) ทำปฏิกิริยากับออกซิเจนภายใต้สภาวะปกติ ออกซิเดชันของโลหะอื่นด้วยออกซิเจนต้องใช้อุณหภูมิที่สูงขึ้น ตัวอย่างเช่น หากคุณให้ความร้อนลวดทองแดงเหนือไฟ ทองแดงจะทำปฏิกิริยากับออกซิเจนจากอากาศและถูกปกคลุมไปด้วยฟิล์มสีดำ (ทองแดงออกไซด์):
- 2Сu +O 2 → 2CuO
ทองคำและแพลทินัมไม่ทำปฏิกิริยากับออกซิเจน
สารออกซิไดซ์อื่นๆ ได้แก่ คลอรีนและซัลเฟอร์ที่ทำปฏิกิริยากับโลหะ หากคุณผสมตะไบเหล็กและผงซัลเฟอร์แล้วให้ความร้อนกับส่วนผสมคุณจะได้เหล็กซัลไฟด์ต่อหน้าต่อตาเรา:
- เฟ +S → เฟS
กิจกรรมรีดิวซ์ของโลหะชนิดต่างๆ จะแตกต่างกัน ตามกิจกรรมของพวกเขา โลหะมีการกระจายดังนี้:
- Li - K - Ba - Sr - Ca - Na - Mg - อัล - Mn - Zn - Cr - Fe - Ca - Co - Ni - Sn - Pb - (H2) - Cu - Hg - Ag - Pt - Au
ยิ่งโลหะอยู่ทางซ้ายมากเท่าไรก็ยิ่งมีความกระตือรือร้นมากขึ้นเท่านั้น องค์ประกอบก่อนหน้าสามารถแทนที่โลหะที่อยู่ทางด้านขวาได้ ตัวอย่างเช่น หากใส่เหล็กชิ้นหนึ่งในหลอดทดลองที่มีสารละลายคอปเปอร์ซัลเฟต เหล็กจะถูกเคลือบด้วยสีน้ำตาล (ฟิล์มทองแดง):
- เฟ + CuSO4 → FeSO4 + Cu
โลหะที่อยู่ด้านซ้ายของไฮโดรเจน (H2) สามารถแทนที่มันจากกรดไฮโดรคลอริกได้ หากคุณหย่อนสังกะสีลงในกรดไฮโดรคลอริก ไฮโดรเจนจะเริ่มปล่อยออกมา:
- HCl + Zn → ZnCl2 + H2
โลหะอัลคาไลทำปฏิกิริยากับน้ำได้ง่าย หากคุณใส่โซเดียมลงในภาชนะบรรจุน้ำ ไฮโดรเจนจะเริ่มพัฒนาอย่างรวดเร็วและเกิดเป็นด่าง:
- 2Na + 2H2O → 2NaOH + H2
การประยุกต์ใช้โลหะ
ขอบคุณคุณ คุณสมบัติที่เป็นประโยชน์โลหะได้เข้ามาในชีวิตมนุษย์อย่างมั่นคง มนุษย์ใช้ความแข็งแกร่งของโลหะ โดยสร้างโครงต่างๆ (ตั้งแต่ศาลาเล็กๆ ไปจนถึงตึกระฟ้าขนาดใหญ่) ตัวถัง (รถยนต์ รถม้า เรือ เครื่องมือกล) รวมถึงชิ้นส่วนการทำงานของเครื่องมือต่างๆ
คำนิยาม
อยู่ในธรรมชาติ
คุณสมบัติของโลหะ
คุณสมบัติลักษณะ โลหะ
คุณสมบัติทางกายภาพ โลหะ
คุณสมบัติทางเคมีของโลหะ
โครงสร้างกล้องจุลทรรศน์
โลหะอัลคาไล
ลักษณะทั่วไปของโลหะอัลคาไล
คุณสมบัติทางเคมีของโลหะอัลคาไล
การเตรียมโลหะอัลคาไล
ไฮดรอกไซด์
คาร์บอเนต
รูบิเดียม
โลหะอัลคาไลน์เอิร์ธ
แคลเซียม
ธาตุโลหะชนิดหนึ่ง
โลหะทรานซิชัน
ลักษณะทั่วไปขององค์ประกอบการเปลี่ยนแปลง
การประยุกต์ใช้โลหะ
วัสดุก่อสร้าง
วัสดุไฟฟ้า
วัสดุเครื่องมือ
เรื่องราว
การทำเหมืองแร่ โลหะวิทยา
โลหะเป็น(ชื่อมาจากภาษาละติน metallum - เหมือง) - กลุ่มขององค์ประกอบที่มีคุณสมบัติเป็นโลหะเช่นการนำความร้อนและไฟฟ้าสูง ค่าสัมประสิทธิ์อุณหภูมิเชิงบวกของความต้านทาน ความเหนียวสูง ฯลฯ ประมาณ 70% ขององค์ประกอบทางเคมีทั้งหมดเป็นของโลหะ .
โลหะเป็น











![]()





















![]()


![]()





อยู่ในธรรมชาติ
โลหะส่วนใหญ่มีอยู่ในธรรมชาติในรูปของแร่และสารประกอบ พวกมันก่อตัวเป็นออกไซด์ ซัลไฟด์ คาร์บอเนต และสารประกอบเคมีอื่นๆ เพื่อให้ได้โลหะบริสุทธิ์และการใช้งานต่อไป จำเป็นต้องแยกโลหะออกจากแร่และดำเนินการทำให้บริสุทธิ์ หากจำเป็น จะดำเนินการผสมและแปรรูปโลหะอื่น ๆ วิทยาศาสตร์กำลังศึกษาสิ่งนี้ โลหะวิทยา. โลหะวิทยาแยกแยะแร่ของโลหะเหล็ก (ขึ้นอยู่กับ ต่อม) และใส่สี (ไม่รวม เหล็กรวมประมาณ 70 องค์ประกอบ) และแพลทินัมก็เป็นโลหะมีค่าเช่นกัน นอกจากนี้ยังมีอยู่ในปริมาณเล็กน้อยด้วย น้ำทะเล, พืช, สิ่งมีชีวิต (มีบทบาทสำคัญ).
เป็นที่ทราบกันว่าร่างกายมนุษย์ประกอบด้วยโลหะ 3% เซลล์ของเราส่วนใหญ่ประกอบด้วยแคลเซียมและโซเดียมเข้มข้น ระบบน้ำเหลือง. แมกนีเซียมสะสมอยู่ในกล้ามเนื้อและ ระบบประสาท, ทองแดง- ในตับ - ในเลือด
คุณสมบัติของโลหะ
โลหะเป็น
คุณสมบัติเฉพาะของโลหะ
ความแวววาวของโลหะ (ยกเว้นไอโอดีนและคาร์บอนในรูปของกราไฟท์ แม้จะมีความแวววาวของโลหะ แต่ไอโอดีนและกราไฟต์ของผลึกกลับไม่ใช่โลหะ)
การนำไฟฟ้าได้ดี (ยกเว้นคาร์บอน)
ความเป็นไปได้ของการตัดเฉือนง่าย
ความหนาแน่นสูง (โดยปกติแล้วโลหะจะหนักกว่าอโลหะ)
จุดหลอมเหลวสูง (ยกเว้น: ปรอท, แกลเลียม และโลหะอัลคาไล)
การนำความร้อนที่ดีเยี่ยม
พวกมันจะรีดิวซ์สารในปฏิกิริยาอยู่เสมอ
คุณสมบัติทางกายภาพของโลหะ
โลหะทุกชนิด (ยกเว้นปรอทและตามเงื่อนไข) ภายใต้สภาวะปกติจะอยู่ในสถานะของแข็ง แต่มีความแข็งต่างกัน ดังนั้นโลหะอัลคาไลจึงถูกตัดได้ง่ายด้วยมีดทำครัว และโลหะเช่นวานาเดียม ทังสเตน และโครเมียม ทำให้เกิดรอยขีดข่วนกับกระจกที่แข็งที่สุดได้ง่าย ด้านล่างคือความแข็งของโลหะบางชนิดในระดับ Mohs
จุดหลอมเหลวมีตั้งแต่ −39 °C (ปรอท) ถึง 3410 °C (ทังสเตน) จุดหลอมเหลวของโลหะส่วนใหญ่ (ยกเว้นด่าง) จะสูง แต่โลหะ "ปกติ" บางชนิด เช่น ดีบุกและ ตะกั่ว,สามารถละลายได้บนเตาไฟฟ้าหรือเตาแก๊สธรรมดา
โลหะจะถูกแบ่งออกเป็นแสง (ความหนาแน่น 0.53 ชม. 5 ก./ซม.) และหนัก (5 ชม. 22.5 ก./ซม.) ขึ้นอยู่กับความหนาแน่น โลหะที่เบาที่สุดคือลิเธียม (ความหนาแน่น 0.53 g/cm³) ปัจจุบันนี้เป็นไปไม่ได้ที่จะตั้งชื่อโลหะที่หนักที่สุด เนื่องจากความหนาแน่นของออสเมียมและอิริเดียม ซึ่งเป็นโลหะที่หนักที่สุดทั้งสองชนิด เกือบจะเท่ากัน (ประมาณ 22.6 กรัม/ลูกบาศก์เซนติเมตร - สองเท่าของความหนาแน่นพอดี ตะกั่ว) และการคำนวณความหนาแน่นที่แน่นอนนั้นเป็นเรื่องยากมาก: ในการทำเช่นนี้ โลหะจะต้องบริสุทธิ์อย่างสมบูรณ์ เนื่องจากสิ่งเจือปนใด ๆ จะลดความหนาแน่นลง
โลหะส่วนใหญ่มีความเหนียว ซึ่งหมายความว่าลวดโลหะสามารถโค้งงอได้โดยไม่แตกหัก สิ่งนี้เกิดขึ้นเนื่องจากการกระจัดของชั้นอะตอมโลหะโดยไม่ทำลายพันธะระหว่างพวกมัน ที่มีความยืดหยุ่นมากที่สุดคือ ทอง, เงินและ ทองแดง. จาก ทองสามารถผลิตฟอยล์หนา 0.003 มม. ซึ่งใช้สำหรับปิดทองสินค้าเชิงพาณิชย์ อย่างไรก็ตาม ไม่ใช่ว่าโลหะทุกชนิดจะมีความเหนียว สายจาก สังกะสีหรือ ดีบุกกระทืบเมื่องอ; เมื่อเปลี่ยนรูปแมงกานีสและบิสมัทแทบจะไม่โค้งงอเลย แต่จะแตกหักทันที ความเป็นพลาสติกยังขึ้นอยู่กับความบริสุทธิ์ของโลหะด้วย ดังนั้น โครเมียมที่บริสุทธิ์มากจึงมีความเหนียวมาก แต่เมื่อปนเปื้อนด้วยสิ่งสกปรกแม้แต่น้อย โครเมียมจะเปราะและแข็งขึ้น
โลหะทุกชนิดนำไฟฟ้าได้ดี นี่เป็นเพราะการมีอิเล็กตรอนเคลื่อนที่อยู่ในโครงผลึกคริสตัลซึ่งเคลื่อนที่ภายใต้อิทธิพลของสนามไฟฟ้า เงิน, ทองแดง และ อลูมิเนียมมีค่าการนำไฟฟ้าสูงสุด ด้วยเหตุนี้โลหะสองชนิดหลังจึงมักถูกใช้เป็นวัสดุลวด โซเดียมยังมีค่าการนำไฟฟ้าสูงมาก ในอุปกรณ์ทดลอง เป็นที่รู้กันว่ามีการใช้ตัวนำโซเดียมในรูปแบบของท่อผนังบางที่ทำจาก ของสแตนเลสเต็มไปด้วยโซเดียม เนื่องจากความถ่วงจำเพาะของโซเดียมต่ำและมีความต้านทานเท่ากัน “สายไฟ” ของโซเดียมจึงเบากว่าทองแดงมากและเบากว่าอลูมิเนียมด้วยซ้ำ
ค่าการนำความร้อนสูงของโลหะยังขึ้นอยู่กับการเคลื่อนที่ของอิเล็กตรอนอิสระด้วย ดังนั้นซีรีย์ของการนำความร้อนจึงคล้ายกับซีรีย์ของการนำไฟฟ้าและเป็นตัวนำความร้อนที่ดีที่สุดเช่นเดียวกับไฟฟ้าก็คือ โซเดียมยังพบว่าใช้เป็นตัวนำความร้อนได้ดี เป็นที่ทราบกันอย่างกว้างขวางว่าโซเดียมถูกใช้ในวาล์วของเครื่องยนต์รถยนต์เพื่อปรับปรุงการระบายความร้อน
พื้นผิวเรียบของโลหะสะท้อนแสงได้มาก ปรากฏการณ์นี้เรียกว่าความแวววาวของโลหะ อย่างไรก็ตาม เมื่ออยู่ในรูปผง โลหะส่วนใหญ่จะสูญเสียความมันวาว อลูมิเนียมและแมกนีเซียมยังคงความแวววาวไว้ได้แม้จะเป็นผงก็ตาม เงินและเงินสะท้อนแสงได้ดีที่สุด - กระจกทำจากโลหะเหล่านี้ โรเดียมบางครั้งใช้ทำกระจก แม้จะมีราคาที่สูงมากก็ตาม เนื่องจากมีความแข็งและทนทานต่อสารเคมีมากกว่าเงินหรือแม้แต่แพลเลเดียมมาก ชั้นโรเดียมจึงบางกว่าชั้นเงินได้มาก
สีของโลหะส่วนใหญ่จะใกล้เคียงกัน - สีเทาอ่อนและมีโทนสีน้ำเงิน ทองแดงและซีเซียมมีสีเหลือง สีแดง และสีเหลืองอ่อนตามลำดับ
คุณสมบัติทางเคมีของโลหะ
โลหะเป็น
โลหะส่วนใหญ่มีอิเล็กตรอนจำนวนเล็กน้อย (1-3) บนชั้นอิเล็กตรอนด้านนอก ดังนั้นในปฏิกิริยาส่วนใหญ่ โลหะเหล่านี้จะทำหน้าที่เป็นตัวรีดิวซ์ (กล่าวคือ พวกมัน "บริจาค" อิเล็กตรอนของพวกมัน)
1. ปฏิกิริยากับสารเชิงเดี่ยว
โลหะทุกชนิดยกเว้นทองคำและแพลทินัมทำปฏิกิริยากับออกซิเจน ปฏิกิริยากับเงินเกิดขึ้นที่อุณหภูมิสูง แต่ในทางปฏิบัติแล้วซิลเวอร์ (II) ออกไซด์จะไม่เกิดขึ้น เนื่องจากมันไม่เสถียรทางความร้อน ผลลัพธ์ที่ได้อาจรวมถึงออกไซด์ เปอร์ออกไซด์ และซูเปอร์ออกไซด์ ทั้งนี้ขึ้นอยู่กับโลหะ:
4Li + O2 = 2Li2O ลิเธียมออกไซด์
2Na + O2 = Na2O2 โซเดียมเปอร์ออกไซด์
K + O2 = KO2 โพแทสเซียมเปอร์ออกไซด์
เพื่อให้ได้ออกไซด์จากเปอร์ออกไซด์ เปอร์ออกไซด์จะถูกรีดิวซ์ด้วยโลหะ:
นา2O2 + 2นา = 2Na2O
สำหรับโลหะที่มีฤทธิ์ปานกลางและต่ำ ปฏิกิริยาจะเกิดขึ้นเมื่อถูกความร้อน:
3เฟ + 2O2 = เฟ3O4
เฉพาะโลหะที่มีฤทธิ์มากที่สุดเท่านั้นที่ทำปฏิกิริยากับไนโตรเจน ที่อุณหภูมิห้อง ลิเธียมเท่านั้นที่ทำปฏิกิริยา ก่อให้เกิดไนไตรด์:
6Li + N2 = 2Li3N
เมื่อถูกความร้อน:
3Ca + N2 = Ca3N2
โลหะทุกชนิดทำปฏิกิริยากับซัลเฟอร์ ยกเว้นทองคำและ แพลทินัม:
เหล็กมีปฏิสัมพันธ์กับ สีเทาเมื่อได้รับความร้อนจะเกิดซัลไฟด์:
เฉพาะโลหะที่มีความว่องไวที่สุด ได้แก่ โลหะของกลุ่ม IA และ IIA ยกเว้น Be เท่านั้นที่ทำปฏิกิริยากับไฮโดรเจน ปฏิกิริยาเกิดขึ้นเมื่อถูกความร้อนและเกิดไฮไดรด์ ในปฏิกิริยาโลหะจะทำหน้าที่เป็นตัวรีดิวซ์ สถานะออกซิเดชันของไฮโดรเจนคือ −1:
เฉพาะโลหะที่มีฤทธิ์มากที่สุดเท่านั้นที่ทำปฏิกิริยากับคาร์บอน ในกรณีนี้จะเกิดอะเซทิลีนไนด์หรือเมทาไนด์ เมื่อทำปฏิกิริยากับน้ำ อะเซทิไลด์จะให้อะเซทิลีน เมทาไนด์จะให้มีเทน
2Na + 2C = Na2C2
Na2C2 + 2H2O = 2NaOH + C2H2
การผสมคือการใส่องค์ประกอบเพิ่มเติมเข้าไปในการหลอมซึ่งจะปรับเปลี่ยนกลไก ทางกายภาพ และ คุณสมบัติทางเคมีวัสดุหลัก
โครงสร้างกล้องจุลทรรศน์
คุณสมบัติเฉพาะของโลหะสามารถเข้าใจได้จากคุณสมบัติเหล่านี้ โครงสร้างภายใน. พวกมันทั้งหมดมีการเชื่อมต่ออิเล็กตรอนในระดับพลังงานภายนอกที่อ่อนแอ (กล่าวอีกนัยหนึ่งคือเวเลนซ์อิเล็กตรอน) กับนิวเคลียส ด้วยเหตุนี้ ความต่างศักย์ที่สร้างขึ้นในตัวนำจึงทำให้เกิดการเคลื่อนที่ของอิเล็กตรอนคล้ายหิมะถล่ม (เรียกว่าการนำอิเล็กตรอน) ในโครงตาข่ายคริสตัล การรวมตัวกันของอิเล็กตรอนดังกล่าวมักเรียกว่าก๊าซอิเล็กตรอน นอกจากอิเล็กตรอนแล้ว โฟนอน (การสั่นสะเทือนของโครงตาข่าย) ยังมีส่วนช่วยในการนำความร้อนอีกด้วย ความเป็นพลาสติกเกิดจากการกั้นพลังงานต่ำต่อการเคลื่อนที่ของการเคลื่อนที่และแรงเฉือนของระนาบผลึกศาสตร์ ความแข็งสามารถอธิบายได้ด้วยข้อบกพร่องทางโครงสร้างจำนวนมาก (อะตอมคั่นกลาง ฯลฯ )
เนื่องจากการปล่อยอิเล็กตรอนได้ง่าย จึงอาจเกิดปฏิกิริยาออกซิเดชันของโลหะได้ ซึ่งอาจนำไปสู่การกัดกร่อนและการเสื่อมสภาพของคุณสมบัติเพิ่มเติม ความสามารถในการออกซิไดซ์สามารถรับรู้ได้จากชุดกิจกรรมมาตรฐานของโลหะ ข้อเท็จจริงนี้ยืนยันถึงความจำเป็นในการใช้โลหะร่วมกับองค์ประกอบอื่น ๆ (โลหะผสมซึ่งที่สำคัญที่สุดคือ เหล็ก) การผสมและการใช้สารเคลือบต่างๆ
เพื่อให้คำอธิบายคุณสมบัติทางอิเล็กทรอนิกส์ของโลหะถูกต้องยิ่งขึ้น จำเป็นต้องใช้กลศาสตร์ควอนตัม ในของแข็งทุกชนิดที่มีความสมมาตรเพียงพอ ระดับพลังงานของอิเล็กตรอนของแต่ละอะตอมจะทับซ้อนกันและก่อตัวเป็นแถบที่อนุญาต และแถบที่เกิดจากเวเลนซ์อิเล็กตรอนเรียกว่าแถบเวเลนซ์ การเชื่อมต่อที่อ่อนแอของเวเลนซ์อิเล็กตรอนในโลหะนำไปสู่ความจริงที่ว่าแถบเวเลนซ์ในโลหะนั้นกว้างมากและอิเล็กตรอนทั้งหมดไม่เพียงพอที่จะเติมให้เต็ม
คุณลักษณะพื้นฐานของโซนที่มีการเติมบางส่วนคือแม้ใช้แรงดันไฟฟ้าขั้นต่ำ การจัดเรียงเวเลนซ์อิเล็กตรอนใหม่จะเริ่มขึ้นในตัวอย่าง กล่าวคือ กระแสไฟฟ้าจะไหล
ความคล่องตัวสูงของอิเล็กตรอนทำให้มีการนำความร้อนสูง เช่นเดียวกับความสามารถในการสะท้อนรังสีแม่เหล็กไฟฟ้าด้วยแสง (ซึ่งทำให้โลหะมีความเงางามเป็นพิเศษ)
โลหะอัลคาไล
โลหะเป็น
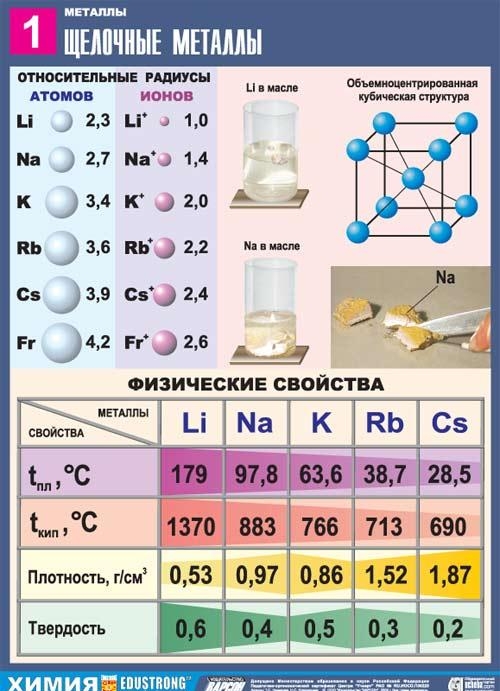
โลหะอัลคาไลเป็นองค์ประกอบของกลุ่มย่อยหลักของกลุ่ม I ของตารางธาตุขององค์ประกอบทางเคมีของ D.I. Dmitry Ivanovich Mendeleev: ลิเธียม Li, โซเดียม Na, โพแทสเซียม K, รูบิเดียม Rb, ซีเซียม Cs และแฟรนเซียม Fr. โลหะเหล่านี้เรียกว่าโลหะอัลคาไลน์เนื่องจากสารประกอบส่วนใหญ่ละลายในน้ำได้ ในภาษาสลาฟ "ชะล้าง" หมายถึง "ละลาย" ซึ่งเป็นตัวกำหนดชื่อของโลหะกลุ่มนี้ เมื่อโลหะอัลคาไลละลายในน้ำ จะเกิดไฮดรอกไซด์ที่ละลายน้ำได้เรียกว่าอัลคาลิส
ลักษณะทั่วไปของโลหะอัลคาไล
ในตารางธาตุพวกมันจะติดตามแก๊สมีตระกูลทันที ดังนั้นลักษณะเฉพาะของโครงสร้างของอะตอมของโลหะอัลคาไลก็คือพวกมันมีอิเล็กตรอนหนึ่งตัวที่ระดับพลังงานใหม่ นั่นคือ การจัดเรียงอิเล็กตรอนของพวกมัน ns1 แน่นอนว่าเวเลนซ์อิเล็กตรอนของโลหะอัลคาไลสามารถกำจัดออกได้อย่างง่ายดาย เนื่องจากอะตอมจะยอมให้อิเล็กตรอนและรับการกำหนดค่าก๊าซเฉื่อยในทางพลังงาน ดังนั้นโลหะอัลคาไลทั้งหมดจึงมีคุณสมบัติลดลง สิ่งนี้ได้รับการยืนยันโดยค่าต่ำของศักยภาพไอออไนเซชัน (ศักยภาพไอออไนเซชันของอะตอมซีเซียมเป็นหนึ่งในค่าต่ำสุด) และอิเล็กโตรเนกาติวีตี้ (EO)
โลหะทั้งหมดในกลุ่มย่อยนี้มีสีขาวเงิน (ยกเว้นซีเซียมสีเงินเหลือง) มีความอ่อนมาก และสามารถตัดได้ด้วยมีดผ่าตัด ลิเธียม โซเดียม และโพแทสเซียมมีน้ำหนักเบากว่าน้ำและลอยอยู่บนพื้นผิวเพื่อทำปฏิกิริยากับมัน
โลหะอัลคาไลเกิดขึ้นในธรรมชาติในรูปของสารประกอบที่มีไอออนบวกที่มีประจุเพียงตัวเดียว แร่ธาตุหลายชนิดประกอบด้วยโลหะของกลุ่มย่อยหลักของกลุ่ม I ตัวอย่างเช่น ออร์โธเคลสหรือเฟลด์สปาร์ประกอบด้วยโพแทสเซียมอะลูมิโนซิลิเกต K2 ที่คล้ายกัน แร่ที่มีโซเดียม - อัลไบต์ - มีองค์ประกอบ Na2 น้ำทะเลมีโซเดียมคลอไรด์ NaCl และดินมีเกลือโพแทสเซียม - sylvin KCl, sylvinite NaCl KCl, คาร์นัลไลท์ KCl. MgCl2. 6H2O, พอลิเฮไลต์ K2SO4 MgSO4 CaSO4. 2H2O
คุณสมบัติทางเคมีของโลหะอัลคาไล
โลหะเป็น
เนื่องจากโลหะอัลคาไลมีฤทธิ์ทางเคมีสูงเมื่อเทียบกับน้ำ ออกซิเจน และไนโตรเจน จึงถูกเก็บไว้ใต้ชั้นน้ำมันก๊าด ในการทำปฏิกิริยากับโลหะอัลคาไลให้ตัดชิ้นส่วนที่มีขนาดที่ต้องการออกอย่างระมัดระวังด้วยมีดผ่าตัดใต้ชั้น น้ำมันก๊าดในบรรยากาศอาร์กอน พื้นผิวของโลหะจะถูกทำความสะอาดอย่างทั่วถึงจากผลิตภัณฑ์ที่มีปฏิกิริยากับอากาศ จากนั้นจึงใส่ตัวอย่างลงในถังปฏิกิริยาเท่านั้น
1. ปฏิกิริยากับน้ำ คุณสมบัติที่สำคัญของโลหะอัลคาไลคือมีฤทธิ์ต่อน้ำสูง ลิเธียมทำปฏิกิริยากับน้ำอย่างสงบที่สุด (ไม่มีการระเบิด)
เมื่อเกิดปฏิกิริยาที่คล้ายกัน โซเดียมจะไหม้เป็นเปลวไฟสีเหลืองและเกิดการระเบิดเล็กน้อย โพแทสเซียมมีความกระฉับกระเฉงมากขึ้น ในกรณีนี้ การระเบิดจะรุนแรงขึ้นมากและเปลวไฟจะเป็นสีม่วง
2. ปฏิกิริยากับออกซิเจน ผลิตภัณฑ์การเผาไหม้ของโลหะอัลคาไลในอากาศมีองค์ประกอบที่แตกต่างกันขึ้นอยู่กับกิจกรรมของโลหะ
มีเพียงลิเธียมเท่านั้นที่เผาไหม้ในอากาศเพื่อสร้างออกไซด์ขององค์ประกอบปริมาณสัมพันธ์
เมื่อโซเดียมไหม้ Na2O2 เปอร์ออกไซด์ส่วนใหญ่จะก่อตัวขึ้นด้วยส่วนผสมเล็กน้อยของ NaO2 ซูเปอร์ออกไซด์
ผลิตภัณฑ์จากการเผาไหม้ของโพแทสเซียม รูบิเดียม และซีเซียม มีซูเปอร์ออกไซด์เป็นส่วนใหญ่
เพื่อให้ได้โซเดียมและโพแทสเซียมออกไซด์ ส่วนผสมของไฮดรอกไซด์ เปอร์ออกไซด์ หรือซูเปอร์ออกไซด์ที่มีโลหะส่วนเกินจะถูกให้ความร้อนในกรณีที่ไม่มีออกซิเจน
รูปแบบต่อไปนี้เป็นคุณลักษณะของสารประกอบออกซิเจนของโลหะอัลคาไล: เมื่อรัศมีของไอออนบวกของโลหะอัลคาไลเพิ่มขึ้น ความเสถียรของสารประกอบออกซิเจนที่มีเปอร์ออกไซด์ไอออน O22 และซูเปอร์ออกไซด์ไอออน O2- จะเพิ่มขึ้น
โลหะอัลคาไลหนักมีลักษณะเฉพาะคือการก่อตัวของโอโซนที่มีความเสถียรพอสมควรโดยมีองค์ประกอบเป็น EO3 สารประกอบออกซิเจนทั้งหมดมีสีที่แตกต่างกัน โดยความเข้มจะเข้มขึ้นตามลำดับตั้งแต่ Li ถึง Cs
ออกไซด์ของโลหะอัลคาไลมีคุณสมบัติทั้งหมดของออกไซด์พื้นฐาน: พวกมันทำปฏิกิริยากับน้ำ ออกไซด์ที่เป็นกรด และกรด
เปอร์ออกไซด์และซูเปอร์ออกไซด์แสดงคุณสมบัติของสารออกซิไดซ์ที่แรง
เปอร์ออกไซด์และซูเปอร์ออกไซด์ทำปฏิกิริยากับน้ำอย่างเข้มข้นทำให้เกิดไฮดรอกไซด์
3. ปฏิกิริยากับสารอื่นๆ โลหะอัลคาไลทำปฏิกิริยากับอโลหะหลายชนิด เมื่อถูกความร้อน จะรวมตัวกับไฮโดรเจน เกิดเป็นไฮไดรด์ ฮาโลเจน สีเทา, ไนโตรเจน, ฟอสฟอรัส, คาร์บอนและซิลิคอน เพื่อสร้างเฮไลด์, ซัลไฟด์, ไนไตรด์, ฟอสไฟด์, คาร์ไบด์ และซิลิไซด์ตามลำดับ
เมื่อถูกความร้อน โลหะอัลคาไลสามารถทำปฏิกิริยากับโลหะอื่น ๆ ก่อตัวเป็นสารประกอบระหว่างโลหะ โลหะอัลคาไลทำปฏิกิริยาอย่างแข็งขัน (ระเบิด) กับกรด
โลหะอัลคาไลละลายในแอมโมเนียเหลวและอนุพันธ์ของมัน - เอมีนและเอไมด์
เมื่อละลายในแอมโมเนียเหลว โลหะอัลคาไลสูญเสียอิเล็กตรอนซึ่งถูกละลายโดยโมเลกุลแอมโมเนียและทำให้สารละลายมีสีฟ้า เอไมด์ที่ได้จะถูกย่อยสลายได้ง่ายด้วยน้ำเพื่อสร้างเป็นด่างและแอมโมเนีย
โลหะอัลคาไลทำปฏิกิริยากับสารอินทรีย์ แอลกอฮอล์ (เพื่อสร้างแอลกอฮอล์) และกรดคาร์บอกซิลิก (เพื่อสร้างเกลือ)
4. การกำหนดคุณภาพของโลหะอัลคาไล เนื่องจากศักยภาพในการแตกตัวเป็นไอออนของโลหะอัลคาไลมีน้อย เมื่อโลหะหรือสารประกอบของมันถูกให้ความร้อนในเปลวไฟ อะตอมจึงถูกแตกตัวเป็นไอออน ทำให้เปลวไฟมีสีที่ต้องการ
การเตรียมโลหะอัลคาไล
1. เพื่อให้ได้โลหะอัลคาไล พวกเขาส่วนใหญ่ใช้อิเล็กโทรไลซิสของการละลายของเฮไลด์ ซึ่งส่วนใหญ่มักจะเป็นคลอไรด์ซึ่งก่อตัวตามธรรมชาติ แร่ธาตุ:
แคโทด: Li+ + e → Li
ขั้วบวก: 2Cl- — 2e → Cl2
2. บางครั้งเพื่อให้ได้โลหะอัลคาไลอิเล็กโทรไลซิสของไฮดรอกไซด์ที่ละลายจะดำเนินการ:
แคโทด: Na+ + e → Na
ขั้วบวก: 4OH- – 4e → 2H2O + O2
เนื่องจากโลหะอัลคาไลตั้งอยู่ทางด้านซ้ายของไฮโดรเจนในชุดแรงดันไฟฟ้าเคมีไฟฟ้า การเตรียมอิเล็กโทรไลต์จากสารละลายเกลือจึงเป็นไปไม่ได้ ในกรณีนี้จะเกิดอัลคาไลและไฮโดรเจนที่สอดคล้องกัน
ไฮดรอกไซด์
เพื่อให้ได้ไฮดรอกไซด์ของโลหะอัลคาไล ส่วนใหญ่จะใช้วิธีการอิเล็กโทรไลต์ การผลิตขนาดใหญ่ที่สุดคือการผลิตโซเดียมไฮดรอกไซด์โดยอิเล็กโทรไลซิสของสารละลายเกลือแกงเข้มข้น
ก่อนหน้านี้ได้อัลคาไลมาจากปฏิกิริยาการแลกเปลี่ยน
อัลคาไลที่ได้รับในลักษณะนี้มีการปนเปื้อนอย่างมากกับโซดา Na2CO3
ไฮดรอกไซด์ของโลหะอัลคาไลเป็นสารดูดความชื้นสีขาวซึ่งเป็นสารละลายที่เป็นเบสแก่ พวกมันมีส่วนร่วมในลักษณะปฏิกิริยาทั้งหมดของเบส - พวกมันทำปฏิกิริยากับกรด, ออกไซด์ที่เป็นกรดและแอมโฟเทอริก และไฮดรอกไซด์ของแอมโฟเทอริก
เมื่อถูกความร้อน ไฮดรอกไซด์ของโลหะอัลคาไลจะระเหิดโดยไม่สลายตัว ยกเว้นลิเธียมไฮดรอกไซด์ซึ่งเช่นเดียวกับไฮดรอกไซด์ของโลหะของกลุ่มย่อยหลักของกลุ่ม II จะสลายตัวเป็นออกไซด์และน้ำเมื่อเผา
โซเดียมไฮดรอกไซด์ใช้ทำสบู่ ผงซักฟอกสังเคราะห์ เส้นใยสังเคราะห์ และสารประกอบอินทรีย์ เช่น ฟีนอล
คาร์บอเนต
ผลิตภัณฑ์ที่สำคัญที่มีโลหะอัลคาไลคือโซดา Na2CO3 โซดาจำนวนมากทั่วโลกผลิตโดยใช้วิธี Solvay ซึ่งเสนอเมื่อต้นศตวรรษที่ 20 สาระสำคัญของวิธีการมีดังนี้: สารละลาย NaCl ที่เป็นน้ำซึ่งเติมแอมโมเนียเข้าไปจะอิ่มตัวด้วยคาร์บอนไดออกไซด์ที่อุณหภูมิ 26 - 30 °C สิ่งนี้จะผลิตโซเดียมไบคาร์บอเนตที่ละลายน้ำได้เล็กน้อยเรียกว่าเบกกิ้งโซดา
แอมโมเนียจะถูกเติมเพื่อทำให้สภาพแวดล้อมที่เป็นกรดเป็นกลางซึ่งเกิดขึ้นเมื่อก๊าซคาร์บอนไดออกไซด์ถูกส่งผ่านเข้าไปในสารละลาย และเพื่อสร้างไบคาร์บอเนตไอออน HCO3 ซึ่งจำเป็นสำหรับการตกตะกอนของโซเดียมไบคาร์บอเนต หลังจากแยกเบกกิ้งโซดาแล้ว สารละลายที่มีแอมโมเนียมคลอไรด์จะถูกให้ความร้อนด้วยปูนขาว และแอมโมเนียจะถูกปล่อยออกมา ซึ่งจะถูกส่งกลับไปยังโซนปฏิกิริยา
ดังนั้น ด้วยวิธีแอมโมเนียในการผลิตโซดา ของเสียเพียงอย่างเดียวคือแคลเซียมคลอไรด์ ซึ่งยังคงอยู่ในสารละลายและมีการใช้งานอย่างจำกัด
เมื่อโซเดียมไบคาร์บอเนตถูกเผาจะทำให้เกิดโซดาแอชหรือโซดาซักผ้า Na2CO3 และคาร์บอนไดออกไซด์ซึ่งใช้ในกระบวนการผลิตโซเดียมไบคาร์บอเนต
ผู้ซื้อโซดาหลักคือแก้ว
แตกต่างจากเกลือกรด NaHCO3 ที่ละลายได้น้อย โพแทสเซียมไบคาร์บอเนต KHCO3 สามารถละลายได้สูงในน้ำ ดังนั้นโพแทสเซียมคาร์บอเนตหรือโปแตช K2CO3 ได้มาโดยการกระทำของคาร์บอนไดออกไซด์บนสารละลายโพแทสเซียมไฮดรอกไซด์
โปแตชใช้ในการผลิตแก้วและสบู่เหลว
ลิเธียมเป็นโลหะอัลคาไลชนิดเดียวที่ไม่ได้รับไบคาร์บอเนต สาเหตุของปรากฏการณ์นี้ก็คือลิเธียมไอออนมีรัศมีน้อยมาก ซึ่งไม่สามารถกักเก็บ HCO3- ไอออนที่ค่อนข้างใหญ่ได้
ลิเธียม
โลหะเป็น
ลิเธียมเป็นองค์ประกอบของกลุ่มย่อยหลักของกลุ่มแรกช่วงที่สองของตารางธาตุขององค์ประกอบทางเคมี D.I. เมนเดเลเยฟ มิทรี อิวาโนวิชโดยมีเลขอะตอม 3 เขียนแทนด้วยสัญลักษณ์ Li (lat. Lithium) สารที่เป็นธาตุลิเธียม (หมายเลข CAS: 7439-93-2) เป็นโลหะอัลคาไลอ่อนที่มีสีเงินขาว
ลิเธียมถูกค้นพบในปี 1817 โดยนักเคมีและนักแร่วิทยาชาวสวีเดน เอ. อาร์ฟเวดสัน ค้นพบครั้งแรกในแร่เพตาไลต์ (Li,Na) และจากนั้นในสปอดูมีน LiAl และในเลปิโดไลต์ KLi1.5Al1.5(F,OH)2 โลหะลิเธียมถูกค้นพบครั้งแรกโดย Humphry Davy ในปี 1825
ลิเธียมได้ชื่อมาจากข้อเท็จจริงที่มันถูกค้นพบใน "หิน" (กรีก ladίθος - หิน) เดิมเรียกว่า "ลิเธียม" ชื่อสมัยใหม่เสนอโดย Berzelius
ลิเธียมเป็นโลหะสีขาวเงิน อ่อนนุ่มและเหนียว แข็งกว่าโซเดียม แต่นิ่มกว่าตะกั่ว สามารถดำเนินการได้โดยการกดและกลิ้ง
ที่อุณหภูมิห้อง โลหะลิเธียมจะมีลูกบาศก์ที่มีศูนย์กลางอยู่ที่ตัวถัง (หมายเลขประสานงาน 8) ซึ่งเมื่อผ่านกระบวนการเย็นจะเปลี่ยนเป็นโครงตาข่ายที่อัดแน่นเป็นลูกบาศก์ โดยที่อะตอมแต่ละอะตอมมีรูปทรงลูกบาศก์คู่ประสานกันจะถูกล้อมรอบด้วยอะตอมอีก 12 อะตอม รูปแบบผลึกที่เสถียรต่ำกว่า 78 K เป็นโครงสร้างอัดแน่นหกเหลี่ยม โดยอะตอมลิเธียมแต่ละอะตอมมีเพื่อนบ้านที่ใกล้ที่สุด 12 ตัว ซึ่งอยู่ที่จุดยอดของทรงลูกบาศก์
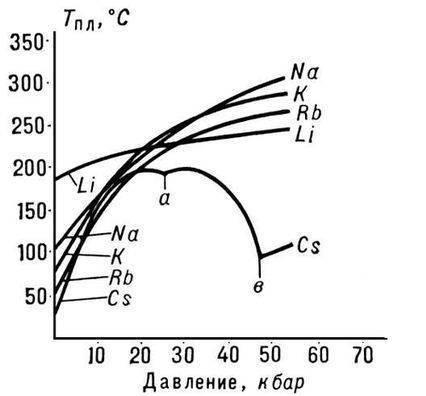
ในบรรดาโลหะอัลคาไลทั้งหมด ลิเธียมมีจุดหลอมเหลวและจุดเดือดสูงสุด (180.54 และ 1340 °C ตามลำดับ) และมีความหนาแน่นต่ำสุดที่อุณหภูมิห้องของโลหะทั้งหมด (0.533 g/cm3 เกือบครึ่งหนึ่งของความหนาแน่นของน้ำ)
อะตอมลิเธียมที่มีขนาดเล็กทำให้เกิดคุณสมบัติพิเศษของโลหะ ตัวอย่างเช่น ผสมกับโซเดียมที่อุณหภูมิต่ำกว่า 380 ° C เท่านั้น และไม่ผสมกับโพแทสเซียมหลอมเหลว รูบิเดียม และซีเซียม ในขณะที่คู่โลหะอัลคาไลอื่น ๆ จะผสมกันในอัตราส่วนเท่าใดก็ได้
โลหะอัลคาไล ไม่เสถียรในอากาศ ลิเธียมเป็นโลหะอัลคาไลที่มีฤทธิ์น้อยที่สุด ในทางปฏิบัติแล้วจะไม่ทำปฏิกิริยากับอากาศแห้ง (และแม้แต่ออกซิเจนแห้ง) ที่อุณหภูมิห้อง
ในอากาศชื้น มันจะออกซิไดซ์อย่างช้าๆ กลายเป็น Li3N ไนไตรด์, LiOH ไฮดรอกไซด์ และ Li2CO3 คาร์บอเนต เมื่อได้รับความร้อนจากออกซิเจน จะเผาไหม้กลายเป็นออกไซด์ Li2O มีคุณสมบัติที่น่าสนใจคือในช่วงอุณหภูมิตั้งแต่ 100 °C ถึง 300 °C ลิเธียมถูกปกคลุมไปด้วยฟิล์มออกไซด์ที่มีความหนาแน่นและไม่เกิดออกซิไดซ์เพิ่มเติม
ในปี ค.ศ. 1818 นักเคมีชาวเยอรมัน Leopold Gmelin ได้กำหนดว่าลิเธียมและเกลือของลิเธียมทำให้เปลวไฟสีแดงเป็นสีแดง ซึ่งเป็นสัญญาณเชิงคุณภาพในการกำหนดปริมาณลิเธียม อุณหภูมิการเผาไหม้ประมาณ 300 °C ผลิตภัณฑ์ที่เผาไหม้จะทำให้เยื่อเมือกของช่องจมูกระคายเคือง
ทำปฏิกิริยาอย่างสงบโดยไม่มีการระเบิดหรือไฟ กับน้ำ ทำให้เกิด LiOH และ H2 นอกจากนี้ยังทำปฏิกิริยากับเอทิลแอลกอฮอล์ เกิดเป็นแอลกอฮอล์ กับแอมโมเนียและฮาโลเจน (กับไอโอดีน - เมื่อถูกความร้อนเท่านั้น)
ลิเธียมถูกเก็บไว้ในปิโตรเลียมอีเทอร์ พาราฟิน น้ำมันเบนซิน และ/หรือน้ำมันแร่ในกล่องดีบุกที่ปิดสนิท โลหะลิเธียมทำให้เกิดแผลไหม้หากสัมผัสกับผิวหนัง เยื่อเมือก และดวงตา
ในโลหะวิทยาที่เป็นเหล็กและอโลหะ ลิเธียมใช้ในการกำจัดออกซิไดซ์และเพิ่มความเหนียวและความแข็งแรงของโลหะผสม บางครั้งลิเธียมใช้ในการนำโลหะหายากกลับมาใช้ใหม่โดยใช้วิธีโลหะวิทยา
ลิเธียมคาร์บอเนตเป็นสารเสริมที่สำคัญที่สุด (เติมลงในอิเล็กโทรไลต์) ในการถลุงอะลูมิเนียม และมีการบริโภคเพิ่มขึ้นทุกปีตามสัดส่วนของปริมาณการผลิตอะลูมิเนียมทั่วโลก (ปริมาณการใช้ลิเธียมคาร์บอเนตอยู่ที่ 2.5-3.5 กิโลกรัมต่อตันของอะลูมิเนียมที่ถลุง)
โลหะผสมลิเธียมที่มีเงินและทอง รวมถึงคิวรัมเป็นสารบัดกรีที่มีประสิทธิภาพมาก โลหะผสมลิเธียมที่มีแมกนีเซียม สแกนเดียม คิวรัม แคดเมียม และอะลูมิเนียม เป็นวัสดุใหม่ที่มีแนวโน้มในด้านการบินและอวกาศ เซรามิกถูกสร้างขึ้นโดยใช้ลิเธียมอะลูมิเนตและซิลิเกตซึ่งจะแข็งตัวที่อุณหภูมิห้องและนำไปใช้ในเทคโนโลยีทางทหาร โลหะวิทยา และในอนาคตในพลังงานแสนสาหัส แก้วที่ทำจากลิเธียมอะลูมิเนียมซิลิเกตเสริมความแข็งแรงด้วยเส้นใยซิลิกอนคาร์ไบด์มีความแข็งแรงมหาศาล ลิเธียมมีประสิทธิภาพมากในการเสริมความแข็งแกร่งให้กับโลหะผสมตะกั่ว และให้ความเหนียวและทนทานต่อการกัดกร่อน
เกลือลิเธียมมีฤทธิ์ออกฤทธิ์ต่อจิตประสาทและใช้ในการแพทย์เพื่อป้องกันและรักษาโรคทางจิตหลายชนิด วัสดุประเภทนี้ที่พบมากที่สุดคือลิเธียมคาร์บอเนต ใช้ในจิตเวชเพื่อรักษาอารมณ์ของผู้ที่เป็นโรคไบโพลาร์และอารมณ์แปรปรวนบ่อยครั้ง มีประสิทธิภาพในการป้องกันภาวะซึมเศร้าและลดการฆ่าตัวตาย แพทย์สังเกตซ้ำ ๆ ว่าสารประกอบลิเธียมบางชนิด (ในปริมาณที่เหมาะสม) มีผลดีต่อผู้ป่วยที่เป็นโรคซึมเศร้า ผลกระทบนี้สามารถอธิบายได้สองวิธี ในด้านหนึ่ง มีการพิสูจน์แล้วว่าลิเธียมสามารถควบคุมการทำงานของเอนไซม์บางชนิดที่เกี่ยวข้องกับการถ่ายโอนไอออนโซเดียมและโพแทสเซียมจากของเหลวระหว่างเซลล์ไปยังเซลล์สมอง ในทางกลับกัน มีข้อสังเกตว่าลิเธียมไอออนส่งผลโดยตรงต่อความสมดุลของไอออนิกของเซลล์ และสภาพของผู้ป่วยส่วนใหญ่ขึ้นอยู่กับความสมดุลของโซเดียมและโพแทสเซียม: โซเดียมส่วนเกินในเซลล์เป็นเรื่องปกติสำหรับผู้ป่วยซึมเศร้า การขาด - สำหรับผู้ที่ทุกข์ทรมานจากอาการบ้าคลั่ง เกลือลิเธียมจะมีผลเชิงบวกต่อทั้งสองอย่างโดยการปรับสมดุลโซเดียม-โพแทสเซียม
โซเดียม
โลหะเป็น
โซเดียมเป็นองค์ประกอบของกลุ่มย่อยหลักของกลุ่มแรกกลุ่มที่สาม ระยะเวลาตารางธาตุองค์ประกอบทางเคมี D.I. มิทรี อิวาโนวิช เมนเดเลเยฟโดยมีเลขอะตอม 11 เขียนแทนด้วยสัญลักษณ์ Na (lat. Natrium) โซเดียมสารอย่างง่าย (หมายเลข CAS: 7440-23-5) เป็นโลหะอัลคาไลอ่อนที่มีสีเงินขาว
ในน้ำโซเดียมมีพฤติกรรมเกือบจะเหมือนกับลิเธียม: ปฏิกิริยาจะเกิดขึ้นเมื่อมีการปล่อยไฮโดรเจนอย่างรวดเร็วและโซเดียมไฮดรอกไซด์จะเกิดขึ้นในสารละลาย
โซเดียม (หรือสารประกอบของมัน) ถูกนำมาใช้มาตั้งแต่สมัยโบราณ ตัวอย่างเช่น โซดา (นาตรอน) ที่พบตามธรรมชาติในน้ำทะเลสาบโซดาในอียิปต์ ชาวอียิปต์โบราณใช้โซดาธรรมชาติในการดอง ฟอกผ้าใบ ปรุงอาหาร และทำสีและเคลือบ ผู้เฒ่าพลินีเขียนว่าในสามเหลี่ยมปากแม่น้ำไนล์ โซดา (มีสัดส่วนของสิ่งเจือปนเพียงพอ) ถูกแยกออกจากน้ำในแม่น้ำ มีจำหน่ายเป็นชิ้นใหญ่ มีสีเทาหรือสีดำเนื่องจากมีส่วนผสมของถ่านหิน
โซเดียมได้รับครั้งแรกโดยนักเคมีชาวอังกฤษ ฮัมฟรีย์ เดวี ในปี 1807 โดยอิเล็กโทรไลซิสของ NaOH ที่เป็นของแข็ง
ชื่อ "โซเดียม" (natrium) มาจากภาษาอาหรับ natrun (ในภาษากรีก - ไนตรอน) และเดิมเรียกว่าโซดาธรรมชาติ ก่อนหน้านี้ธาตุนี้เรียกว่าโซดา (lat. Sodium)

โซเดียมเป็นโลหะสีขาวเงินในชั้นบาง ๆ ที่มีโทนสีม่วง พลาสติกแม้จะอ่อนนุ่ม (ตัดด้วยมีดได้ง่าย) โซเดียมที่ตัดใหม่ก็มีความแวววาว ค่าการนำไฟฟ้าและค่าการนำความร้อนของโซเดียมค่อนข้างสูง ความหนาแน่น 0.96842 g/cm3 (ที่ 19.7 ° C) จุดหลอมเหลว 97.86 ° C จุดเดือด 883.15 ° C
โลหะอัลคาไลที่ออกซิไดซ์ได้ง่ายในอากาศ เพื่อป้องกันออกซิเจนในชั้นบรรยากาศ โซเดียมของโลหะจะถูกเก็บไว้ใต้ชั้นหนึ่ง น้ำมันก๊าด. โซเดียมมีฤทธิ์น้อยกว่าลิเธียม ดังนั้นจึงทำปฏิกิริยากับไนโตรเจนเมื่อถูกความร้อนเท่านั้น:
เมื่อมีออกซิเจนมากเกินไป จะเกิดโซเดียมเปอร์ออกไซด์ขึ้น
2นา + O2 = นา2O2
โลหะโซเดียมถูกนำมาใช้กันอย่างแพร่หลายในเคมีเตรียมการและ อุตสาหกรรมเป็นตัวรีดิวซ์ที่แข็งแกร่งรวมถึงในโลหะวิทยาด้วย โซเดียมใช้ในการผลิตแบตเตอรี่โซเดียมซัลเฟอร์ที่ใช้พลังงานสูง นอกจากนี้ยังใช้ในวาล์วไอเสียของรถบรรทุกเป็นตัวระบายความร้อน ในบางครั้ง โลหะโซเดียมจะถูกใช้เป็นวัสดุสำหรับสายไฟที่มีจุดประสงค์เพื่อส่งกระแสไฟฟ้าที่สูงมาก
ในโลหะผสมที่มีโพแทสเซียม เช่นเดียวกับรูบิเดียมและซีเซียม มันถูกใช้เป็นสารหล่อเย็นที่มีประสิทธิภาพสูง โดยเฉพาะอย่างยิ่ง โลหะผสมของส่วนประกอบโซเดียม 12% โพแทสเซียม 47% ซีเซียม 41% มีจุดหลอมเหลวต่ำเป็นประวัติการณ์ที่ −78 °C และถูกเสนอให้เป็นของเหลวทำงานสำหรับเครื่องยนต์จรวดไอออนและเป็นสารหล่อเย็นสำหรับโรงไฟฟ้านิวเคลียร์
โซเดียมยังใช้ในหลอดปล่อยก๊าซสูงและก๊าซสูงอีกด้วย ความดันต่ำ(NLVD และ NLND) หลอดไฟ NLVD ประเภท DNaT (Arc Sodium Tubular) มีการใช้กันอย่างแพร่หลายในระบบไฟถนน พวกมันเปล่งแสงสีเหลืองสดใส อายุการใช้งานของหลอด HPS คือ 12-24,000 ชั่วโมง ดังนั้นหลอดปล่อยก๊าซประเภท HPS จึงขาดไม่ได้สำหรับระบบแสงสว่างในเมือง สถาปัตยกรรม และอุตสาหกรรม นอกจากนี้ยังมีหลอดไฟ DNaS, DNaMT (Arc Sodium Matte), DNaZ (Arc Sodium Mirror) และ DNaTBR (Arc Sodium Tubular Without Mercury)
โลหะโซเดียมใช้ในการวิเคราะห์เชิงคุณภาพ อินทรียฺวัตถุ. โลหะผสมของโซเดียมและสารทดสอบถูกทำให้เป็นกลางด้วยเอทานอล โดยเติมน้ำกลั่นสองสามมิลลิลิตรแล้วแบ่งออกเป็น 3 ส่วนคือ J. Lassenya (1843) มีวัตถุประสงค์เพื่อตรวจวัดไนโตรเจน ซัลเฟอร์ และฮาโลเจน ( พยายามไบล์สไตน์)
โซเดียมคลอไรด์ (เกลือแกง) เป็นสารปรุงแต่งรสและสารกันบูดที่ใช้ที่เก่าแก่ที่สุด
โซเดียมอะไซด์ (Na3N) ถูกใช้เป็นสารไนไตรด์ในโลหะวิทยาและในการผลิตตะกั่วอะไซด์
โซเดียมไซยาไนด์ (NaCN) ใช้ในวิธีการไฮโดรเมทัลลิกวิทยาในการชะทองออกจากหิน เช่นเดียวกับในกระบวนการไนโตรคาร์บูไรเซชันของเหล็ก และการชุบด้วยไฟฟ้า (การทำเงิน การปิดทอง)
โซเดียมคลอเรต (NaClO3) ใช้เพื่อทำลายพืชพรรณที่ไม่ต้องการบนรางรถไฟ
โพแทสเซียม
โพแทสเซียมเป็นองค์ประกอบของกลุ่มย่อยหลักของกลุ่มแรกกลุ่มที่สี่ ระยะเวลาระบบองค์ประกอบทางเคมีเป็นระยะโดย D.I. Mendeleev Dmitry Ivanovich มีเลขอะตอม 19 แสดงด้วยสัญลักษณ์ K (lat. Kalium) โพแทสเซียมสารเชิงเดี่ยว (หมายเลข CAS: 7440-09-7) เป็นโลหะอัลคาไลอ่อนที่มีสีเงินขาว
ในธรรมชาติ โพแทสเซียมจะพบได้เฉพาะเมื่อรวมกับธาตุอื่นๆ เท่านั้น เช่น ในน้ำทะเล และในแร่ธาตุหลายชนิดด้วย มันออกซิไดซ์อย่างรวดเร็วในอากาศและเข้าสู่ปฏิกิริยาเคมีได้ง่ายมาก โดยเฉพาะอย่างยิ่งกับน้ำทำให้เกิดเป็นด่าง คุณสมบัติทางเคมีของโพแทสเซียมในหลาย ๆ ด้านนั้นคล้ายคลึงกับโซเดียมมาก แต่ในแง่ของ ฟังก์ชั่นทางชีวภาพและวิธีที่เซลล์ของสิ่งมีชีวิตนำไปใช้ยังคงแตกต่างกัน
โพแทสเซียม (หรือสารประกอบของมัน) ถูกนำมาใช้มาตั้งแต่สมัยโบราณ ดังนั้นการผลิตโปแตช (ซึ่งใช้เป็นผงซักฟอก) จึงมีอยู่แล้วในศตวรรษที่ 11 เถ้าที่เกิดจากการเผาฟางหรือไม้ถูกบำบัดด้วยน้ำและสารละลายที่เกิดขึ้น (น้ำด่าง) จะถูกระเหยหลังจากการกรอง สารตกค้างแห้ง นอกเหนือจากโพแทสเซียมคาร์บอเนตแล้ว ยังมีโพแทสเซียมซัลเฟต K2SO4, โซดาและโพแทสเซียมคลอไรด์ KCl
ในปี 1807 เดวี นักเคมีชาวอังกฤษ แยกโพแทสเซียมด้วยกระแสไฟฟ้าของของแข็งโพแทสเซียมไฮดรอกไซด์ (KOH) และตั้งชื่อมันว่า "โพแทสเซียม" (โพแทสเซียมละติน ชื่อนี้ยังคงใช้ในภาษาอังกฤษ ฝรั่งเศส สเปน โปรตุเกส และโปแลนด์) ในปี ค.ศ. 1809 L. V. Gilbert เสนอชื่อ "โพแทสเซียม" (ภาษาละติน kalium จากภาษาอาหรับ al-kali - โปแตช) ชื่อนี้รวมอยู่ใน เยอรมันจากที่นั่นไปยังภาษาส่วนใหญ่ของยุโรปเหนือและตะวันออก (รวมถึงรัสเซีย) และ "ชนะ" เมื่อเลือกสัญลักษณ์สำหรับองค์ประกอบนี้ - K.
โพแทสเซียมเป็นสารสีเงินที่มีความแวววาวเป็นพิเศษบนพื้นผิวที่เกิดขึ้นใหม่ เบามากและหลอมละลายได้ มันละลายได้ค่อนข้างดีในปรอททำให้เกิดเป็นอะมัลกัม เมื่อเติมโพแทสเซียม (รวมทั้งสารประกอบของมัน) ลงในเปลวไฟของเตา จะทำให้เปลวไฟมีสีม่วงอมชมพูที่มีลักษณะเฉพาะ
โพแทสเซียมก็เหมือนกับโลหะอัลคาไลอื่นๆ ที่มีคุณสมบัติเป็นโลหะโดยทั่วไปและมีปฏิกิริยาทางเคมีสูง สามารถให้อิเล็กตรอนได้ง่าย
เป็นตัวรีดิวซ์ที่รุนแรง มันรวมตัวกับออกซิเจนอย่างแข็งขันโดยไม่เกิดออกไซด์ แต่เป็นโพแทสเซียมซูเปอร์ออกไซด์ KO2 (หรือ K2O4) เมื่อถูกความร้อนในบรรยากาศไฮโดรเจน จะเกิดโพแทสเซียมไฮไดรด์ KH มันมีปฏิกิริยาที่ดีกับอโลหะทั้งหมด สร้างเฮไลด์ ซัลไฟด์ ไนไตรด์ ฟอสไฟด์ ฯลฯ รวมถึงกับสารที่ซับซ้อนเช่นน้ำ (ปฏิกิริยาเกิดการระเบิด) ออกไซด์และเกลือต่างๆ ในกรณีนี้จะลดโลหะอื่น ๆ ให้อยู่ในสถานะอิสระ
โพแทสเซียมจะถูกเก็บไว้ใต้ชั้นน้ำมันก๊าด
โลหะผสมของโพแทสเซียมและโซเดียม ซึ่งเป็นของเหลวที่อุณหภูมิห้อง ถูกใช้เป็นสารหล่อเย็นในระบบปิด เช่น ในโรงไฟฟ้านิวเคลียร์นิวตรอนเร็ว นอกจากนี้โลหะผสมของเหลวกับรูบิเดียมและซีเซียมยังใช้กันอย่างแพร่หลาย โลหะผสมขององค์ประกอบโซเดียม 12%, โพแทสเซียม 47%, ซีเซียม 41% มีจุดหลอมเหลวต่ำเป็นประวัติการณ์ที่ −78 °C
สารประกอบโพแทสเซียมเป็นองค์ประกอบทางชีวภาพที่สำคัญที่สุดจึงถูกนำมาใช้เป็นปุ๋ย
เกลือโพแทสเซียมถูกนำมาใช้กันอย่างแพร่หลายในการชุบด้วยไฟฟ้า เนื่องจากถึงแม้จะมีราคาค่อนข้างสูง แต่ก็มักจะละลายได้ดีกว่าเกลือโซเดียมที่เกี่ยวข้อง ดังนั้นจึงให้การทำงานของอิเล็กโทรไลต์อย่างเข้มข้นที่ความหนาแน่นกระแสที่เพิ่มขึ้น
โพแทสเซียมเป็นองค์ประกอบทางชีวภาพที่สำคัญที่สุด โดยเฉพาะในโลกของพืช เมื่อขาดโพแทสเซียมในดิน พืชจะพัฒนาได้แย่มากและลดลง ซึ่งเป็นเหตุผลว่าทำไมเกลือโพแทสเซียมที่ขุดได้ประมาณ 90% จึงถูกนำมาใช้เป็นปุ๋ย
โพแทสเซียม ไนโตรเจน และฟอสฟอรัส เป็นสารอาหารหลักของพืช การทำงานของโพแทสเซียมในพืชเช่นเดียวกับองค์ประกอบอื่น ๆ ที่จำเป็นสำหรับพืชนั้นมีความเฉพาะเจาะจงอย่างเคร่งครัด ในพืช โพแทสเซียมอยู่ในรูปไอออนิก โพแทสเซียมพบส่วนใหญ่ในไซโตพลาสซึมและแวคิวโอลของเซลล์ พบโพแทสเซียมประมาณ 80% ในน้ำนมเซลล์
หน้าที่ของโพแทสเซียมมีความหลากหลายมาก เป็นที่ยอมรับแล้วว่าช่วยกระตุ้นการสังเคราะห์ด้วยแสงตามปกติ เพิ่มการไหลเวียนของคาร์โบไฮเดรตจากใบมีดไปยังอวัยวะอื่น ๆ รวมถึงการสังเคราะห์น้ำตาล
โพแทสเซียมช่วยเพิ่มการสะสมของโมโนแซ็กคาไรด์ในพืชผักและผลไม้ เพิ่มปริมาณน้ำตาลในผักราก แป้งในมันฝรั่ง ทำให้ผนังเซลล์ของฟางของพืชธัญพืชหนาขึ้น และเพิ่มความต้านทานของขนมปังต่อการกักตัว และปรับปรุงคุณภาพของเส้นใยใน ผ้าลินินและป่าน
โดยการส่งเสริมการสะสมของคาร์โบไฮเดรตในเซลล์พืช โพแทสเซียมจะเพิ่มความดันออสโมติกของน้ำนมในเซลล์ และด้วยเหตุนี้จึงเพิ่มความต้านทานต่อความเย็นและความต้านทานต่อน้ำค้างแข็งของพืช
โพแทสเซียมถูกดูดซับโดยพืชในรูปของแคตไอออนและเห็นได้ชัดว่ายังคงอยู่ในรูปแบบนี้ในเซลล์ กระตุ้นการทำงานของชีวเคมีที่สำคัญที่สุด กระบวนการในเซลล์พืชโพแทสเซียมจะเพิ่มความต้านทานต่อ โรคต่างๆทั้งในช่วงฤดูปลูกและหลังการเก็บเกี่ยว ช่วยปรับปรุงคุณภาพการเก็บรักษาผักและผลไม้ได้อย่างมาก
การขาดโพแทสเซียมทำให้เกิดความผิดปกติของการเผาผลาญในพืช กิจกรรมของเอนไซม์จำนวนหนึ่งลดลง เมแทบอลิซึมของคาร์โบไฮเดรตและโปรตีนหยุดชะงัก และ ค่าใช้จ่ายคาร์โบไฮเดรตสำหรับการหายใจ ส่งผลให้ผลผลิตของพืชลดลงและคุณภาพของผลิตภัณฑ์ลดลง



รูบิเดียม
รูบิเดียมเป็นองค์ประกอบของกลุ่มย่อยหลักของกลุ่มแรกช่วงที่ห้าของตารางธาตุขององค์ประกอบทางเคมีของ D.I. Dmitry Ivanovich Mendeleev โดยมีเลขอะตอม 37 ถูกกำหนดโดยสัญลักษณ์ Rb (lat. Rubidium) รูบิเดียมสสารอย่างง่าย (หมายเลข CAS: 7440-17-7) เป็นโลหะอัลคาไลอ่อนที่มีสีเงินขาว
ในปี ค.ศ. 1861 นักวิทยาศาสตร์ชาวเยอรมัน Robert Wilhelm Bunsen และ Gustav Robert Kirchhoff ศึกษาอะลูมิโนซิลิเกตตามธรรมชาติโดยใช้การวิเคราะห์สเปกตรัม ค้นพบองค์ประกอบใหม่ในพวกมัน ซึ่งต่อมาได้ตั้งชื่อว่ารูบิเดียมตามสีของเส้นที่แข็งแกร่งที่สุดในสเปกตรัม
รูบิเดียมก่อตัวเป็นผลึกอ่อนสีขาวเงินซึ่งมีความแวววาวของโลหะเมื่อตัดใหม่ ความแข็งของบริเนล 0.2 MN/mI (0.02 kgf/mmI) โครงผลึกของรูบิเดียมมีลูกบาศก์เป็นศูนย์กลาง โดยมี a = 5.71 E (ที่อุณหภูมิห้อง) รัศมีอะตอม 2.48 E, Rb+ รัศมีไอออน 1.49 E. ความหนาแน่น 1.525 g/cm (0 °C), จุดหลอมเหลว 38.9 °C, จุดเดือด 703 °C ความจุความร้อนจำเพาะ 335.2 J/(kg · K) ค่าสัมประสิทธิ์ความร้อนของการขยายตัวเชิงเส้น 9.0·10-5 deg-1 (0-38 °C) โมดูลัสยืดหยุ่น 2.4 H/mІ (240 kgf/mmI) ปริมาตรความต้านทานไฟฟ้าจำเพาะ 11.29 ·10-6 โอห์ม·ซม. (20 °C); รูบิเดียมเป็นพาราแมกเนติก
โลหะอัลคาไล ไม่เสถียรอย่างยิ่งในอากาศ (ทำปฏิกิริยากับอากาศเมื่อมีร่องรอยของน้ำด้วยการจุดไฟ) สร้างเกลือทุกประเภท - ส่วนใหญ่ละลายได้ง่าย (คลอเรตและเปอร์คลอเรตละลายได้เล็กน้อย) รูบิเดียมไฮดรอกไซด์เป็นสารที่มีฤทธิ์รุนแรงมากต่อแก้ว วัสดุโครงสร้างและภาชนะอื่นๆ และเมื่อหลอมละลายจะทำลายโลหะส่วนใหญ่ (แม้แต่แพลตตินัม)
การใช้รูบิเดียมมีความหลากหลายและแม้ว่าในหลายพื้นที่การใช้งานจะด้อยกว่าในลักษณะทางกายภาพที่สำคัญที่สุดของซีเซียม แต่โลหะอัลคาไลที่หายากนี้มีบทบาทสำคัญใน เทคโนโลยีที่ทันสมัย. สามารถสังเกตการใช้รูบิเดียมในด้านต่อไปนี้: การเร่งปฏิกิริยา, อิเล็กทรอนิกส์ อุตสาหกรรม, เลนส์พิเศษ, นิวเคลียร์, การแพทย์
รูบิเดียมใช้ไม่เพียงแต่ในรูปแบบบริสุทธิ์เท่านั้น แต่ยังใช้ในรูปของโลหะผสมและสารประกอบทางเคมีอีกจำนวนหนึ่งด้วย สิ่งสำคัญคือต้องทราบว่ารูบิเดียมมีฐานวัตถุดิบที่ดีและเป็นที่น่าพอใจ แต่ในขณะเดียวกันสถานการณ์ที่มีทรัพยากรก็เป็นที่นิยมมากกว่าในกรณีของซีเซียมและรูบิเดียมสามารถมีบทบาทที่สำคัญยิ่งกว่าได้เช่น ในการเร่งปฏิกิริยา (ซึ่งได้พิสูจน์ตัวเองแล้ว)
ไอโซโทปรูบิเดียม-86 ถูกนำมาใช้กันอย่างแพร่หลายในการตรวจจับข้อบกพร่องของแกมมา เทคโนโลยีการวัด ตลอดจนในการฆ่าเชื้อยาที่สำคัญจำนวนหนึ่งและ ผลิตภัณฑ์อาหาร. รูบิเดียมและโลหะผสมกับซีเซียมเป็นสารหล่อเย็นที่มีแนวโน้มสูงและเป็นตัวกลางทำงานสำหรับหน่วยกังหันที่มีอุณหภูมิสูง (ในเรื่องนี้ รูบิเดียมและซีเซียมมีความสำคัญในช่วงไม่กี่ปีที่ผ่านมา และโลหะที่มีราคาสูงมากกำลังเป็นเบาะหลังของความเป็นไปได้ ของการเพิ่มประสิทธิภาพของหน่วยกังหันอย่างมากและลดลง ค่าใช้จ่ายเชื้อเพลิงและมลภาวะต่อสิ่งแวดล้อม) ระบบที่ใช้รูบิเดียมเป็นสารหล่อเย็นที่ใช้กันอย่างแพร่หลายที่สุดคือโลหะผสมแบบไตรภาค: โซเดียม-โพแทสเซียม-รูบิเดียม และโซเดียม-รูบิเดียม-ซีเซียม
ในการเร่งปฏิกิริยา รูบิเดียมใช้ทั้งในการสังเคราะห์สารอินทรีย์และอนินทรีย์ กิจกรรมการเร่งปฏิกิริยาของรูบิเดียมใช้เป็นหลักในการกลั่นปิโตรเลียมให้เป็นผลิตภัณฑ์ที่สำคัญจำนวนหนึ่ง ตัวอย่างเช่น รูบิเดียมอะซิเตตใช้สำหรับการสังเคราะห์เมทานอลและแอลกอฮอล์ที่สูงขึ้นจำนวนหนึ่งจากก๊าซน้ำ ซึ่งมีความสำคัญอย่างยิ่งในการเกี่ยวข้องกับการแปรสภาพเป็นแก๊สใต้ดินของถ่านหินและการผลิตเชื้อเพลิงเหลวเทียมสำหรับรถยนต์และเชื้อเพลิงเครื่องบิน โลหะผสมของรูบิเดียมกับเทลลูเรียมจำนวนหนึ่งมีความไวในบริเวณอัลตราไวโอเลตของสเปกตรัมสูงกว่าสารประกอบซีเซียม ดังนั้นในกรณีนี้ จึงสามารถแข่งขันกับซีเซียม-133 เป็นวัสดุสำหรับโฟโตคอนเวอร์เตอร์ได้ รูบิเดียมถูกใช้เป็นสารหล่อลื่นที่มีประสิทธิภาพสูงในสุญญากาศ (เทคโนโลยีจรวดและอวกาศ) ซึ่งเป็นส่วนหนึ่งขององค์ประกอบการหล่อลื่นพิเศษ (โลหะผสม)
รูบิเดียมไฮดรอกไซด์ใช้ในการเตรียมอิเล็กโทรไลต์สำหรับเครื่องปฏิกรณ์เคมีที่อุณหภูมิต่ำ และยังเป็นสารเติมแต่งในสารละลายโพแทสเซียมไฮดรอกไซด์เพื่อปรับปรุงประสิทธิภาพที่ อุณหภูมิต่ำและเพิ่มการนำไฟฟ้าของอิเล็กโทรไลต์ โลหะรูบิเดียมใช้ในเซลล์เชื้อเพลิงไฮไดรด์
รูบิเดียมคลอไรด์ที่ผสมกับคิวรัมคลอไรด์ใช้สำหรับวัดอุณหภูมิสูง (สูงถึง 400 °C)
พลาสมารูบิเดียมใช้เพื่อกระตุ้นการแผ่รังสีเลเซอร์
รูบิเดียมคลอไรด์ใช้ในเซลล์เชื้อเพลิงเป็นอิเล็กโทรไลต์ และอาจกล่าวได้เช่นเดียวกันกับรูบิเดียมไฮดรอกไซด์ ซึ่งมีประสิทธิภาพมากในฐานะอิเล็กโทรไลต์ในเซลล์เชื้อเพลิงโดยใช้ปฏิกิริยาออกซิเดชันโดยตรงของถ่านหิน
ซีเซียม
ซีเซียมเป็นองค์ประกอบของกลุ่มย่อยหลักของกลุ่มแรกช่วงที่หกของระบบธาตุเคมีโดย D.I. Mendeleev Dmitry Ivanovich มีเลขอะตอม 55 แสดงด้วยสัญลักษณ์ Cs (lat. Caesium) สารซีเซียมอย่างง่าย (หมายเลข CAS: 7440-46-2) เป็นโลหะอัลคาไลอ่อนที่มีสีเงินเหลือง ซีเซียมได้ชื่อมาจากการมีเส้นสีน้ำเงินสดใสสองเส้นในสเปกตรัมการแผ่รังสี (จากภาษาละติน caesius - สีฟ้า)
ซีเซียมถูกค้นพบในปี 1860 โดยนักวิทยาศาสตร์ชาวเยอรมัน R.W. Bunsen และ G.R. Kirchhoff ในน่านน้ำของบ่อน้ำแร่ Durchheim ในสาธารณรัฐเยอรมนีโดยใช้สเปกโทรสโกปีแบบออพติคอล จึงกลายเป็นองค์ประกอบแรกที่ค้นพบโดยใช้การวิเคราะห์สเปกตรัม ซีเซียมถูกแยกออกครั้งแรกในรูปแบบบริสุทธิ์ในปี พ.ศ. 2425 โดยนักเคมีชาวสวีเดน เค. เซตเตอร์เบิร์ก ระหว่างกระบวนการอิเล็กโทรลิซิสของส่วนผสมที่หลอมละลายของซีเซียมไซยาไนด์ (CsCN) และแบเรียม
แร่ธาตุซีเซียมหลักคือแร่พอลลูไซต์และอะโวกาไดรต์ (K,Cs) ที่หายากมาก นอกจากนี้ในรูปแบบของสิ่งสกปรกซีเซียมยังรวมอยู่ในอะลูมิโนซิลิเกตจำนวนหนึ่ง: lepidolite, phlogopite, biotite, amazonite, Petalite, beryl, zinnwaldite, leucite, carnallite Pollucite และ lepidolite ใช้เป็นวัตถุดิบทางอุตสาหกรรม
ในการผลิตทางอุตสาหกรรม ซีเซียมในรูปของสารประกอบจะถูกสกัดจากแร่พอลลูไซต์ ทำได้โดยการเปิดคลอไรด์หรือซัลเฟต ประการแรกเกี่ยวข้องกับการบำบัดแร่ธาตุต้นทางด้วยกรดไฮโดรคลอริกที่ให้ความร้อน เติมพลวงคลอไรด์ SbCl3 เพื่อตกตะกอนสารประกอบ Cs3 และล้างด้วยน้ำร้อนหรือสารละลายแอมโมเนียเพื่อสร้าง CsCl ของซีเซียมคลอไรด์ ในกรณีที่สอง จะได้รับการบำบัดด้วยกรดซัลฟิวริกที่ให้ความร้อนเพื่อสร้างซีเซียมสารส้ม CsAl(SO4)2 · 12H2O
ใน สหพันธรัฐรัสเซียหลังจากการล่มสลายของสหภาพโซเวียต การขุดแร่พอลลูไซต์ทางอุตสาหกรรมไม่ได้เกิดขึ้น แม้ว่าจะมีการค้นพบแร่ปริมาณมหาศาลในทุ่งทุนดรา Voronya ใกล้กับเมือง Murmansk ในสมัยโซเวียตก็ตาม เมื่อถึงเวลาที่อุตสาหกรรมรัสเซียสามารถกลับมาฟื้นตัวได้ ปรากฎว่าบริษัทของแคนาดาได้ซื้อใบอนุญาตในการพัฒนาสาขานี้แล้ว ปัจจุบัน การแปรรูปและการสกัดเกลือซีเซียมจากพอลลูไซต์ดำเนินการในโนโวซีบีร์สค์ ที่โรงงาน ZAO Rare Metals
มีหลายอย่าง วิธีการทางห้องปฏิบัติการการได้รับซีเซียม สามารถรับได้:
การทำความร้อนในสุญญากาศเป็นส่วนผสมของซีเซียมโครเมตหรือไดโครเมตกับเซอร์โคเนียม
การสลายตัวของซีเซียมอะไซด์ในสุญญากาศ
ให้ความร้อนส่วนผสมของซีเซียมคลอไรด์และแคลเซียมที่เตรียมไว้เป็นพิเศษ
วิธีการทั้งหมดใช้แรงงานเข้มข้น อย่างที่สองช่วยให้คุณได้โลหะที่มีความบริสุทธิ์สูง แต่จะระเบิดได้และต้องใช้เวลาหลายวันจึงจะสำเร็จ
ซีเซียมพบการใช้งานเฉพาะเมื่อต้นศตวรรษที่ 20 เท่านั้น เมื่อมีการค้นพบแร่ธาตุของซีเซียม และเทคโนโลยีในการได้มาซึ่งซีเซียมในรูปแบบบริสุทธิ์ได้รับการพัฒนา ปัจจุบัน ซีเซียมและสารประกอบของซีเซียมถูกนำมาใช้ในอุปกรณ์อิเล็กทรอนิกส์ วิทยุ ไฟฟ้า วิศวกรรมเอ็กซ์เรย์ อุตสาหกรรมเคมี เลนส์ การแพทย์ และพลังงานนิวเคลียร์ โดยส่วนใหญ่จะใช้ซีเซียม-133 ตามธรรมชาติที่เสถียร และไอโซโทปกัมมันตภาพรังสีซีเซียม-137 ของไอโซโทปซีเซียม-137 จะถูกแยกออกจากผลรวมของชิ้นส่วนฟิชชันของยูเรเนียม พลูโทเนียม และทอเรียมในเครื่องปฏิกรณ์ของโรงไฟฟ้านิวเคลียร์
โลหะอัลคาไลน์เอิร์ธ
โลหะอัลคาไลน์เอิร์ธ - องค์ประกอบทางเคมี: แคลเซียม Ca, สตรอนเซียม Sr, แบเรียม Ba, เรเดียม Ra (บางครั้งเบริลเลียม Be และแมกนีเซียม Mg ก็ถูกจัดประเภทอย่างผิดพลาดว่าเป็นโลหะอัลคาไลน์เอิร์ท) พวกมันถูกตั้งชื่อเช่นนั้นเพราะออกไซด์ของพวกมัน - "ดิน" (ตามศัพท์เฉพาะของนักเล่นแร่แปรธาตุ) - ให้ปฏิกิริยาอัลคาไลน์กับน้ำ เกลือของโลหะอัลคาไลน์เอิร์ท ยกเว้นเรเดียม มีการกระจายอย่างกว้างขวางในธรรมชาติในรูปของแร่ธาตุ
แคลเซียม
แคลเซียมเป็นองค์ประกอบของกลุ่มย่อยหลักของกลุ่มที่สองช่วงที่สี่ของระบบธาตุเคมีโดย D.I. Dmitry Ivanovich Mendeleev โดยมีเลขอะตอม 20 ถูกกำหนดโดยสัญลักษณ์ Ca (lat. แคลเซียม) สารแคลเซียมอย่างง่าย (หมายเลข CAS: 7440-70-2) - อ่อน มีฤทธิ์ทางเคมี โลหะอัลคาไลน์เอิร์ธสีเงินสีขาว
โลหะแคลเซียมมีอยู่ในการดัดแปลงแบบ allotropic สองแบบ สูงถึง 443 °C, α-Ca ที่มีโครงตาข่ายวางตรงกลางลูกบาศก์ (พารามิเตอร์ a = 0.558 nm) มีความเสถียร; β-Ca ที่มีโครงตาข่ายที่มีโครงลูกบาศก์อยู่ตรงกลางลำตัวของประเภท α-Fe (พารามิเตอร์ a = 0.448 nm) คือ มีเสถียรภาพมากขึ้น เอนทาลปีมาตรฐาน ΔH0 ของการเปลี่ยน α → β คือ 0.93 กิโลจูล/โมล
แคลเซียมเป็นโลหะอัลคาไลน์เอิร์ธทั่วไป แคลเซียมมีฤทธิ์ทางเคมีสูง แต่ต่ำกว่าโลหะอัลคาไลน์เอิร์ธอื่นๆ ทั้งหมด มันทำปฏิกิริยากับออกซิเจน คาร์บอนไดออกไซด์ และความชื้นในอากาศได้ง่าย ซึ่งเป็นเหตุผลว่าทำไมพื้นผิวของโลหะแคลเซียมจึงมักเป็นสีเทาหม่น ดังนั้นในห้องปฏิบัติการจึงมักจะเก็บแคลเซียมไว้ในขวดที่ปิดสนิทไว้ใต้ชั้น เช่นเดียวกับโลหะอัลคาไลน์เอิร์ทอื่นๆ น้ำมันก๊าดหรือพาราฟินเหลว
ในชุดค่าศักย์ไฟฟ้ามาตรฐาน แคลเซียมจะอยู่ทางด้านซ้ายของไฮโดรเจน ศักย์ไฟฟ้ามาตรฐานของคู่ Ca2+/Ca0 คือ −2.84 V ดังนั้นแคลเซียมจึงทำปฏิกิริยาอย่างแข็งขันกับน้ำ แต่ไม่มีการจุดระเบิด:
Ca + 2H2O = Ca(OH)2 + H2 + Q
แคลเซียมทำปฏิกิริยากับสารออกฤทธิ์ที่ไม่ใช่โลหะ (ออกซิเจน คลอรีน โบรมีน) ภายใต้สภาวะปกติ:
2Ca + O2 = 2CaO, Ca + Br2 = CaBr2
เมื่อได้รับความร้อนในอากาศหรือออกซิเจน แคลเซียมจะจุดติดไฟ แคลเซียมทำปฏิกิริยากับอโลหะที่มีฤทธิ์น้อยกว่า (ไฮโดรเจน โบรอน คาร์บอน ซิลิคอน ไนโตรเจน ฟอสฟอรัส และอื่นๆ) เมื่อถูกความร้อน เช่น:
Ca + H2 = CaH2, Ca + 6B = CaB6,
3Ca + N2 = Ca3N2, Ca + 2C = CaC2,
3Ca + 2P = Ca3P2 (แคลเซียมฟอสไฟด์) แคลเซียมฟอสไฟด์ขององค์ประกอบ CaP และ CaP5 เป็นที่รู้จักเช่นกัน
2Ca + Si = Ca2Si (แคลเซียมซิลิไซด์) รู้จักแคลเซียมซิลิไซด์ขององค์ประกอบ CaSi, Ca3Si4 และ CaSi2
การเกิดปฏิกิริยาข้างต้นมักจะมาพร้อมกับการปล่อยสาร ปริมาณมากความร้อน (นั่นคือปฏิกิริยาเหล่านี้เป็นปฏิกิริยาคายความร้อน) ในสารประกอบทั้งหมดที่ไม่ใช่โลหะ สถานะออกซิเดชันของแคลเซียมคือ +2 สารประกอบแคลเซียมที่มีอโลหะส่วนใหญ่สามารถย่อยสลายได้ง่ายด้วยน้ำ ตัวอย่างเช่น
CaH2 + 2H2O = Ca(OH)2 + 2H2,
Ca3N2 + 3H2O = 3Ca(OH)2 + 2NH3
ไอออน Ca2+ ไม่มีสี เมื่อเติมเกลือแคลเซียมที่ละลายน้ำได้ลงในเปลวไฟ เปลวไฟจะเปลี่ยนเป็นสีแดงอิฐ
เกลือแคลเซียม เช่น CaCl2 คลอไรด์, CaBr2 โบรไมด์, CaI2 ไอโอไดด์ และ Ca(NO3)2 ไนเตรต ละลายได้ดีในน้ำ ที่ไม่ละลายในน้ำ ได้แก่ ฟลูออไรด์ CaF2, คาร์บอเนต CaCO3, ซัลเฟต CaSO4, ออร์โธฟอสเฟต Ca3(PO4)2, ออกซาเลต CaC2O4 และอื่นๆ อีกมากมาย
สิ่งสำคัญคือแคลเซียมคาร์บอเนตที่เป็นกรด (ไบคาร์บอเนต) Ca(HCO3)2 ไม่เหมือนกับแคลเซียมคาร์บอเนต CaCO3 ที่สามารถละลายได้ในน้ำ โดยธรรมชาติแล้วสิ่งนี้นำไปสู่กระบวนการดังต่อไปนี้ เมื่อฝนตกเย็นหรือน้ำในแม่น้ำซึ่งอิ่มตัวด้วยคาร์บอนไดออกไซด์แทรกซึมใต้ดินและตกลงบนหินปูนจะสังเกตเห็นการละลายของพวกมัน:
CaCO3 + CO2 + H2O = Ca(HCO3)2
ในสถานที่เดียวกับที่น้ำที่อิ่มตัวด้วยแคลเซียมไบคาร์บอเนตมาถึงพื้นผิวโลกและได้รับความร้อนจากรังสีดวงอาทิตย์จะเกิดปฏิกิริยาย้อนกลับ:
Ca(HCO3)2 = CaCO3 + CO2 + H2O
นี่คือปริมาณสารจำนวนมากที่ถูกถ่ายโอนในธรรมชาติ เป็นผลให้ช่องว่างขนาดใหญ่สามารถก่อตัวใต้ดินและ "น้ำแข็ง" หินที่สวยงาม - หินย้อยและหินงอก - ก่อตัวในถ้ำ
การมีอยู่ของแคลเซียมไบคาร์บอเนตที่ละลายในน้ำส่วนใหญ่จะเป็นตัวกำหนดความกระด้างชั่วคราวของน้ำ เรียกว่าชั่วคราว เพราะเมื่อน้ำเดือด ไบคาร์บอเนตจะสลายตัว และ CaCO3 จะตกตะกอน ปรากฏการณ์นี้นำไปสู่ความจริงที่ว่าตะกรันก่อตัวในกาต้มน้ำเมื่อเวลาผ่านไป
ธาตุโลหะชนิดหนึ่ง
สตรอนเทียมเป็นองค์ประกอบของกลุ่มย่อยหลักของกลุ่มที่สองช่วงที่ห้าของระบบธาตุเคมีโดย D.I. Mendeleev Dmitry Ivanovich โดยมีเลขอะตอม 38 ถูกกำหนดโดยสัญลักษณ์ Sr (lat. Strontium) สารสตรอนเซียมอย่างง่าย (หมายเลข CAS: 7440-24-6) เป็นโลหะอัลคาไลน์เอิร์ธที่อ่อนนุ่ม อ่อนตัวได้ และเหนียวได้ โดยมีสีขาวเงิน มีฤทธิ์ทางเคมีสูง ในอากาศจะทำปฏิกิริยากับความชื้นและออกซิเจนอย่างรวดเร็วจนกลายเป็นฟิล์มออกไซด์สีเหลือง
ธาตุใหม่นี้ถูกค้นพบในแร่สตรอนเทียนไนต์ ซึ่งพบในปี 1764 ในเหมืองตะกั่วใกล้กับหมู่บ้านสตรอนเชียนในสกอตแลนด์ ซึ่งต่อมาได้ตั้งชื่อให้กับธาตุใหม่นี้ การมีอยู่ของโลหะออกไซด์ใหม่ในแร่นี้ถูกค้นพบเกือบ 30 ปีต่อมาโดย William Cruickshank และ Ader Crawford ถูกแยกออกมาในรูปแบบบริสุทธิ์โดยเซอร์ ฮัมฟรีย์ เดวี ในปี 1808
สตรอนเซียมเป็นโลหะเนื้ออ่อนสีขาวเงินที่อ่อนตัวและเหนียวได้ และสามารถตัดด้วยมีดได้ง่าย
Polymorphic - ทราบการปรับเปลี่ยนสามแบบ ที่อุณหภูมิสูงถึง 215°C การดัดแปลงโดยให้ลูกบาศก์หันหน้าเข้าหาศูนย์กลาง (α-Sr) จะมีความเสถียร ระหว่าง 215 ถึง 605°C การดัดแปลงแบบหกเหลี่ยม (β-Sr) จะเสถียร และสูงกว่า 605°C การดัดแปลงโดยให้ลำตัวเป็นลูกบาศก์ (γ- Sr) มีเสถียรภาพ
จุดหลอมเหลว - 768oC จุดเดือด - 1390oC
ธาตุโลหะชนิดหนึ่งในสารประกอบจะมีความจุอยู่ที่ +2 เสมอ คุณสมบัติของสตรอนเซียมนั้นใกล้เคียงกับแคลเซียมและแบเรียมซึ่งมีตำแหน่งตรงกลางระหว่างกัน
ในซีรีย์แรงดันไฟฟ้าเคมีไฟฟ้า สตรอนเซียมเป็นหนึ่งในมากที่สุด โลหะที่ใช้งานอยู่(ศักย์ไฟฟ้าของอิเล็กโทรดปกติคือ −2.89 V ทำปฏิกิริยาอย่างแรงกับน้ำ ทำให้เกิดไฮดรอกไซด์:
ซีอาร์ + 2H2O = ซีอาร์(OH)2 + H2
ทำปฏิกิริยากับกรด แทนที่โลหะหนักจากเกลือ ทำปฏิกิริยาอย่างอ่อนกับกรดเข้มข้น (H2SO4, HNO3)
โลหะสตรอนเซียมออกซิไดซ์อย่างรวดเร็วในอากาศก่อตัวเป็นฟิล์มสีเหลืองซึ่งมีอยู่นอกเหนือจาก SrO ออกไซด์แล้ว SrO2 เปอร์ออกไซด์และไนไตรด์ Sr3N2 ก็มีอยู่เสมอ เมื่อถูกความร้อนในอากาศจะติดไฟ สตรอนเซียมที่เป็นผงในอากาศมีแนวโน้มที่จะติดไฟได้เอง
ทำปฏิกิริยาอย่างรุนแรงกับอโลหะ - ซัลเฟอร์, ฟอสฟอรัส, ฮาโลเจน ทำปฏิกิริยากับไฮโดรเจน (สูงกว่า 200°C), ไนโตรเจน (สูงกว่า 400°C) ในทางปฏิบัติแล้วไม่ทำปฏิกิริยากับด่าง
ที่อุณหภูมิสูงจะทำปฏิกิริยากับ CO2 ให้เกิดเป็นคาร์ไบด์:
5Sr + 2CO2 = SrC2 + 4SrO
เกลือสตรอนเทียมที่ละลายได้ง่ายด้วยแอนไอออน Cl-, I-, NO3- เกลือที่มีแอนไอออน F-, SO42-, CO32-, PO43- ละลายได้เล็กน้อย
สตรอนเทียมใช้สำหรับการผสมคิวรัมและโลหะผสมบางชนิด เพื่อแนะนำเป็นโลหะผสมตะกั่วของแบตเตอรี่ สำหรับการกำจัดซัลเฟอร์ไดออกไซด์ของเหล็กหล่อ คิวรัม และ เหล็ก.
แบเรียม
แบเรียมเป็นองค์ประกอบของกลุ่มย่อยหลักของกลุ่มที่สองช่วงที่หกของระบบธาตุเคมีโดย D.I. Dmitry Ivanovich Mendeleev มีเลขอะตอม 56 ถูกกำหนดโดยสัญลักษณ์ Ba (lat. แบเรียม) แบเรียมที่เป็นสารเชิงเดี่ยว (หมายเลข CAS: 7440-39-3) เป็นโลหะอัลคาไลน์เอิร์ธที่อ่อนนุ่มและมีสีขาวเงิน มีฤทธิ์ทางเคมีสูง
แบเรียมถูกค้นพบว่าเป็นออกไซด์ BaO ในปี พ.ศ. 2317 โดยคาร์ล ชีเลอ ในปี ค.ศ. 1808 นักเคมีชาวอังกฤษ ฮัมฟรีย์ เดวี ได้รับโดยกระแสไฟฟ้าของแบเรียมไฮดรอกไซด์เปียกกับแคโทดปรอท มัลกัมแบเรียม; หลังจากที่ปรอทระเหยเมื่อถูกความร้อนจะปล่อยโลหะแบเรียมออกมา
แบเรียมเป็นโลหะอ่อนสีเงินสีขาว ถ้ากระแทกแรงๆก็แตก มีการปรับเปลี่ยนแบเรียมแบบ allotropic สองแบบ: α-Ba ที่มีโครงตาข่ายที่มีศูนย์กลางเป็นลูกบาศก์ (พารามิเตอร์ a = 0.501 นาโนเมตร) มีความเสถียรสูงถึง 375 °C; β-Ba มีความเสถียรเหนือมัน
ความแข็งในระดับแร่วิทยา 1.25; โมห์สสเกล 2
เก็บโลหะแบเรียมไว้ในน้ำมันก๊าดหรือใต้ชั้นพาราฟิน
แบเรียมเป็นโลหะอัลคาไลน์เอิร์ธ มันจะออกซิไดซ์อย่างเข้มข้นในอากาศ เกิดเป็นแบเรียมออกไซด์ BaO และแบเรียมไนไตรด์ Ba3N2 และติดไฟได้โดยใช้ความร้อนเล็กน้อย ทำปฏิกิริยาอย่างแรงกับน้ำ เกิดแบเรียมไฮดรอกไซด์ Ba(OH)2:
บา + 2H2O = บา(OH)2 + H2
ทำปฏิกิริยากับกรดเจือจางอย่างแข็งขัน เกลือแบเรียมหลายชนิดไม่ละลายน้ำหรือละลายได้เล็กน้อยในน้ำ: แบเรียมซัลเฟต BaSO4, แบเรียมซัลไฟต์ BaSO3, แบเรียมคาร์บอเนต BaCO3, แบเรียมฟอสเฟต Ba3(PO4)2 แบเรียมซัลไฟด์ BaS แตกต่างจากแคลเซียมซัลไฟด์ CaS ตรงที่สามารถละลายน้ำได้สูง
ทำปฏิกิริยากับฮาโลเจนได้ง่ายจนเกิดเป็นเฮไลด์
เมื่อถูกความร้อนด้วยไฮโดรเจน จะเกิดแบเรียมไฮไดรด์ BaH2 ซึ่งในทางกลับกันด้วยลิเธียมไฮไดรด์ LiH จะให้ Li เชิงซ้อน
ทำปฏิกิริยาเมื่อถูกความร้อนด้วยแอมโมเนีย:
6Ba + 2NH3 = 3BaH2 + Ba3N2
เมื่อถูกความร้อนแบเรียมไนไตรด์ Ba3N2 จะทำปฏิกิริยากับ CO ทำให้เกิดไซยาไนด์:
Ba3N2 + 2CO = บา(CN)2 + 2BaO
ด้วยแอมโมเนียเหลว จะได้สารละลายสีน้ำเงินเข้ม ซึ่งสามารถแยกแอมโมเนียออกมาได้ ซึ่งมีสีทองเป็นมันเงา และสลายตัวได้ง่ายเมื่อกำจัด NH3 ออก เมื่อมีตัวเร่งปฏิกิริยาแพลตตินัม แอมโมเนียจะสลายตัวเป็นแบเรียมเอไมด์:
บา(NH2)2 + 4NH3 + H2
แบเรียมคาร์ไบด์ BaC2 สามารถรับได้จากการให้ความร้อน BaO ด้วยถ่านหินในเตาอาร์ค
ด้วยฟอสฟอรัสจะเกิดฟอสไฟด์ Ba3P2
แบเรียมจะลดออกไซด์ เฮไลด์ และซัลไฟด์ของโลหะหลายชนิดให้เป็นโลหะที่สอดคล้องกัน
แบเรียมโลหะซึ่งมักเป็นโลหะผสมกับอะลูมิเนียม ถูกใช้เป็นตัวดูดซับก๊าซ (ตัวดูดซับ) ในอุปกรณ์อิเล็กทรอนิกส์ที่มีสุญญากาศสูงและยังถูกเติมร่วมกับเซอร์โคเนียมไปจนถึงสารหล่อเย็นโลหะเหลว (โลหะผสมของโซเดียม โพแทสเซียม รูบิเดียม ลิเธียม ซีเซียม) เพื่อลดความก้าวร้าวต่อท่อและในด้านโลหะวิทยา
โลหะทรานซิชัน
โลหะทรานซิชัน (องค์ประกอบการเปลี่ยนผ่าน) เป็นองค์ประกอบของกลุ่มย่อยรองของตารางธาตุขององค์ประกอบทางเคมีของ D. I. Mendeleev Dmitry Ivanovich ในอะตอมที่อิเล็กตรอนปรากฏใน d- และ f-orbitals ใน ปริทัศน์โครงสร้างทางอิเล็กทรอนิกส์ขององค์ประกอบการเปลี่ยนแปลงสามารถแสดงได้ดังนี้: ns orbital มีอิเล็กตรอนหนึ่งหรือสองตัว ส่วนเวเลนซ์อิเล็กตรอนที่เหลือจะอยู่ใน -orbital เนื่องจากจำนวนเวเลนซ์อิเล็กตรอนน้อยกว่าจำนวนออร์บิทัลอย่างเห็นได้ชัด สารอย่างง่ายที่เกิดจากองค์ประกอบทรานซิชันจึงเป็นโลหะ
ลักษณะทั่วไปขององค์ประกอบการเปลี่ยนแปลง
องค์ประกอบการเปลี่ยนแปลงทั้งหมดมีคุณสมบัติทั่วไปดังต่อไปนี้:
ค่าอิเลคโตรเนกาติวีตี้เล็กน้อย
สถานะออกซิเดชันที่แปรผันได้ สำหรับองค์ประกอบ d เกือบทั้งหมด ซึ่งมีอะตอมที่มีเวเลนซ์อิเล็กตรอน 2 ตัวอยู่ในระดับย่อย ns ภายนอก จะทราบสถานะออกซิเดชัน +2
เริ่มต้นด้วยองค์ประกอบ d ของกลุ่ม III ของตารางธาตุขององค์ประกอบทางเคมีโดย D.I. Dmitry Ivanovich Mendeleev องค์ประกอบในสถานะออกซิเดชันต่ำสุดก่อตัวเป็นสารประกอบที่แสดงคุณสมบัติพื้นฐานในระดับสูงสุด - เป็นกรดในระดับกลาง - แอมโฟเทอริก
เหล็ก
เหล็กเป็นองค์ประกอบของกลุ่มย่อยด้านข้างของกลุ่มที่แปดของคาบที่สี่ของระบบธาตุเคมีโดย D.I. Mendeleev Dmitry Ivanovich เลขอะตอม 26 ถูกกำหนดโดยสัญลักษณ์ Fe (lat. Ferrum) โลหะชนิดหนึ่งที่พบมากที่สุดในเปลือกโลก (อันดับที่สองรองจากอะลูมิเนียม)
เหล็กสารเดี่ยว (หมายเลข CAS: 7439-89-6) เป็นโลหะสีขาวเงินอ่อนได้ซึ่งมีปฏิกิริยาทางเคมีสูง เหล็กจะกัดกร่อนอย่างรวดเร็วที่อุณหภูมิสูงหรือมีความชื้นในอากาศสูง เหล็กเผาไหม้ในออกซิเจนบริสุทธิ์ และในสถานะที่กระจายตัวอย่างประณีต มันจะติดไฟในอากาศได้เอง
ในความเป็นจริง เหล็กมักเรียกว่าโลหะผสมซึ่งมีปริมาณสิ่งเจือปนต่ำ (มากถึง 0.8%) ซึ่งยังคงความอ่อนตัวและความเหนียวของโลหะบริสุทธิ์ แต่ในทางปฏิบัติมักใช้โลหะผสมของเหล็กกับคาร์บอน: (คาร์บอนมากถึง 2%) และ (คาร์บอนมากกว่า 2%) เช่นเดียวกับเหล็กสเตนเลส (อัลลอยด์) ที่เติมโลหะผสม (โครเมียม, แมงกานีส, Ni, ฯลฯ) จำนวนทั้งสิ้น คุณสมบัติเฉพาะเหล็กและโลหะผสมทำให้เป็น "โลหะอันดับ 1" ที่มีความสำคัญสำหรับมนุษย์
ในธรรมชาติ เหล็กมักไม่ค่อยพบในรูปแบบบริสุทธิ์ ส่วนใหญ่มักพบในอุกกาบาตเหล็ก-นิกเกิล ความอุดมสมบูรณ์ของธาตุเหล็กในเปลือกโลกอยู่ที่ 4.65% (อันดับที่ 4 รองจาก O, Si, Al) เชื่อกันว่าเหล็กประกอบเป็นแกนกลางของโลกเป็นส่วนใหญ่




เหล็กเป็นโลหะทั่วไป ในสถานะอิสระ จะมีสีขาวเงินและมีโทนสีเทา โลหะบริสุทธิ์มีความเหนียว สิ่งเจือปนต่างๆ (โดยเฉพาะคาร์บอน) จะเพิ่มความแข็งและความเปราะบาง มันมีคุณสมบัติทางแม่เหล็กที่เด่นชัด สิ่งที่เรียกว่า "กลุ่มเหล็กสาม" มักจะมีความโดดเด่น - กลุ่มของโลหะสามชนิด (เหล็ก Fe, โคบอลต์ Co, นิ Ni) มีคุณสมบัติทางกายภาพ รัศมีอะตอม และค่าอิเลคโตรเนกาติวีตี้คล้ายคลึงกัน
เหล็กมีลักษณะเฉพาะโดยความหลากหลาย มีการดัดแปลงผลึกสี่แบบ:
สูงถึง 769 °C จะมี α-Fe (เฟอร์ไรต์) ที่มีคุณสมบัติตาข่ายลูกบาศก์เป็นศูนย์กลางและคุณสมบัติเฟอร์โรแมกเนติก (769 °C กลับไปยัง 1,043 K - จุดกูรีสำหรับเหล็ก)
ในช่วงอุณหภูมิ 769–917 °C มี β-Fe ซึ่งแตกต่างจาก α-Fe เฉพาะในพารามิเตอร์ของโครงตาข่ายลูกบาศก์ที่มีศูนย์กลางร่างกายและคุณสมบัติทางแม่เหล็กของพาราแมกเนติก
ในช่วงอุณหภูมิ 917–1394 °C จะมี γ-Fe (ออสเทนไนต์) โดยมีตาข่ายลูกบาศก์อยู่ตรงกลางใบหน้า
สูงกว่า 1,394 °C δ-Fe โดยมีโครงตาข่ายลูกบาศก์เป็นศูนย์กลางมีความเสถียร
โลหะวิทยาไม่ได้แยกความแตกต่าง β-Fe เป็นเฟสที่แยกจากกัน และพิจารณาว่าเป็น α-Fe ที่หลากหลาย เมื่อเหล็กหรือเหล็กกล้าถูกให้ความร้อนเหนือจุดกูรี (769 °C พรีเมี่ยม 1,043 K) การเคลื่อนที่ด้วยความร้อนของไอออนจะทำให้ทิศทางของโมเมนต์แม่เหล็กหมุนของอิเล็กตรอนพลิกผัน เฟอร์โรแมกเนติกจะกลายเป็นพาราแมกเนติก - การเปลี่ยนเฟสลำดับที่สองเกิดขึ้น แต่ การเปลี่ยนเฟสลำดับที่หนึ่งโดยการเปลี่ยนแปลงพารามิเตอร์ทางกายภาพพื้นฐานของคริสตัลจะไม่เกิดขึ้น
สำหรับเหล็กบริสุทธิ์ที่ความดันปกติ จากมุมมองของโลหะวิทยา มีการดัดแปลงที่เสถียรดังต่อไปนี้:
จากศูนย์สัมบูรณ์ถึง 910 µC การปรับเปลี่ยน α ด้วยโครงผลึกลูกบาศก์ที่มีศูนย์กลางร่างกาย (bcc) มีความเสถียร สารละลายคาร์บอนที่เป็นของแข็งในเหล็กαเรียกว่าเฟอร์ไรต์
ตั้งแต่ 910 ถึง 1,400 µC การปรับเปลี่ยน γ ด้วยโครงตาข่ายคริสตัลลูกบาศก์ตรงกลางใบหน้า (fcc) มีความเสถียร สารละลายคาร์บอนที่เป็นของแข็งในเหล็ก γ เรียกว่า ออสเทนไนต์
จาก 910 ถึง 1539 µC การปรับเปลี่ยน δ ด้วยโครงผลึกลูกบาศก์ที่มีศูนย์กลางร่างกาย (bcc) มีความเสถียร สารละลายคาร์บอนที่เป็นของแข็งใน δ-เหล็ก (เช่นเดียวกับใน α-เหล็ก) เรียกว่าเฟอร์ไรต์ บางครั้งมีการแยกแยะความแตกต่างระหว่าง δ-เฟอร์ไรต์ที่มีอุณหภูมิสูง และ α-เฟอร์ไรต์ที่มีอุณหภูมิต่ำ (หรือเพียงแค่เฟอร์ไรต์) แม้ว่าโครงสร้างอะตอมของพวกมันจะเหมือนกันก็ตาม
การมีอยู่ของคาร์บอนและองค์ประกอบอัลลอยด์ในเหล็กทำให้อุณหภูมิของการเปลี่ยนเฟสเปลี่ยนแปลงไปอย่างมาก
ในพื้นที่ แรงกดดันสูง(มากกว่า 104 MPa, 100,000 atm) การดัดแปลงของε-เหล็กที่มีโครงตาข่ายบรรจุปิดหกเหลี่ยม (hcp) ปรากฏขึ้น
ปรากฏการณ์ของความหลากหลายมีความสำคัญอย่างยิ่งต่อโลหะวิทยาเหล็ก ต้องขอบคุณการเปลี่ยน α-γ ของโครงตาข่ายคริสตัลที่ทำให้การรักษาความร้อนของเหล็กเกิดขึ้น หากไม่มีปรากฏการณ์นี้ เหล็กซึ่งเป็นพื้นฐานของเหล็กคงไม่ได้รับการใช้อย่างแพร่หลายเช่นนี้
เหล็กเป็นวัสดุทนไฟและเป็นของโลหะที่มีฤทธิ์ปานกลาง จุดหลอมเหลวของเหล็กคือ 1539 °C จุดเดือดประมาณ 3200 °C
เหล็กเป็นโลหะชนิดหนึ่งที่มีการใช้มากที่สุด โดยคิดเป็นสัดส่วนถึง 95% ของการผลิตโลหะวิทยาทั่วโลก
เหล็กเป็นส่วนประกอบหลักของเหล็กและเหล็กหล่อซึ่งเป็นวัสดุโครงสร้างที่สำคัญที่สุด
เหล็กสามารถเป็นส่วนหนึ่งของโลหะผสมที่มีโลหะอื่นเป็นหลัก เช่น นิกเกิล
เหล็กออกไซด์แม่เหล็ก (แม่เหล็ก) เป็นวัสดุสำคัญในการผลิตอุปกรณ์หน่วยความจำคอมพิวเตอร์ระยะยาว เช่น ฮาร์ดไดรฟ์ ฟลอปปีดิสก์ ฯลฯ
ผงแมกนีไทต์ Ultrafine ใช้ในเครื่องพิมพ์เลเซอร์ขาวดำเป็นผงหมึก
คุณสมบัติทางแม่เหล็กไฟฟ้าที่เป็นเอกลักษณ์ของโลหะผสมที่มีเหล็กจำนวนหนึ่งมีส่วนช่วยในการใช้อย่างแพร่หลายในงานวิศวกรรมไฟฟ้าสำหรับแกนแม่เหล็กของหม้อแปลงไฟฟ้าและมอเตอร์ไฟฟ้า
เหล็ก (III) คลอไรด์ (เฟอร์ริกคลอไรด์) ใช้ในการฝึกวิทยุสมัครเล่นสำหรับการแกะสลักแผงวงจรพิมพ์
Ferrous sulfate heptate (ferrous sulfate) ผสมกับคอปเปอร์ซัลเฟตใช้เพื่อต่อสู้กับเชื้อราที่เป็นอันตรายในการทำสวนและการก่อสร้าง
เหล็กถูกใช้เป็นขั้วบวกในแบตเตอรี่เหล็ก-นิกเกิลและแบตเตอรี่เหล็ก-อากาศ
ทองแดง
ทองแดงเป็นองค์ประกอบของกลุ่มย่อยด้านข้างของกลุ่มแรกช่วงที่สี่ของตารางธาตุขององค์ประกอบทางเคมีของ D.I. Dmitry Ivanovich Mendeleev โดยมีเลขอะตอม 29 ถูกกำหนดโดยสัญลักษณ์ Cu (lat. Cuprum) ธาตุทองแดง (หมายเลข CAS: 7440-50-8) เป็นโลหะทรานซิชันแบบเหนียวที่มีสีชมพูทอง (สีชมพูในกรณีที่ไม่มีฟิล์มออกไซด์) มีคนใช้กันอย่างแพร่หลายมาเป็นเวลานาน



ทองแดงเป็นโลหะดัดสีชมพูทอง เมื่ออยู่ในอากาศ จะถูกเคลือบด้วยฟิล์มออกไซด์อย่างรวดเร็ว ซึ่งทำให้มีลักษณะเป็นสีเหลืองแดงเข้มข้น ทองแดงมีค่าการนำความร้อนและไฟฟ้าสูง (เป็นอันดับสองในด้านการนำไฟฟ้ารองจากเงิน) มีไอโซโทปเสถียรสองตัวคือ 63Cu และ 65Cu และไอโซโทปกัมมันตภาพรังสีหลายตัว 64Cu ที่มีอายุยาวนานที่สุดมีครึ่งชีวิต 12.7 ชั่วโมงและมีโหมดการสลายตัวสองโหมดด้วยผลิตภัณฑ์ที่แตกต่างกัน
ความหนาแน่น - 8.94*10i กก./ม
ความจุความร้อนจำเพาะที่ 20 °C - 390 J/kg*K
ความต้านทานไฟฟ้าที่ 20-100 °C - 1.78·10−8 Ohm m
จุดหลอมเหลว - 1,083 °C
จุดเดือด - 2,600 °C
โลหะผสมของคิวรัมมีอยู่หลายชนิด: ทองเหลือง - โลหะผสมของคิวรัมกับสังกะสี, โลหะผสมของคิวรัมและดีบุก, คิวโปรนิกเกิล - โลหะผสมของคิวรัมและนิกเกิล และอื่นๆ อีกมากมาย
สังกะสี
สังกะสีเป็นองค์ประกอบของกลุ่มย่อยรองของกลุ่มที่สองช่วงที่สี่ของระบบธาตุเคมีโดย D.I. Mendeleev Dmitry Ivanovich มีเลขอะตอม 30 ถูกกำหนดโดยสัญลักษณ์ Zn (lat. Zinkum) สารเชิงเดี่ยว (หมายเลข CAS: 7440-66-6) ภายใต้สภาวะปกติคือโลหะทรานซิชันที่เปราะซึ่งมีสีขาวอมฟ้า (ทำให้มัวหมองในอากาศ และถูกเคลือบด้วยชั้นบางๆ ของซิงค์ออกไซด์)
ในรูปแบบบริสุทธิ์ มันเป็นโลหะสีเงินอมขาวที่ค่อนข้างเหนียว มีโครงตาข่ายหกเหลี่ยมพร้อมพารามิเตอร์ a = 0.26649 nm, c = 0.49468 nm ที่อุณหภูมิห้องจะเปราะบาง เมื่อแผ่นถูกงอ จะได้ยินเสียงแตกร้าวจากการเสียดสีของผลึก (โดยปกติจะแรงกว่า "เสียงร้องของดีบุก") ที่อุณหภูมิ 100-150°C สังกะสีจะเป็นพลาสติก สิ่งเจือปนแม้แต่สิ่งเล็กน้อยก็เพิ่มความเปราะบางของสังกะสีได้อย่างมาก
โลหะแอมโฟเทอริกทั่วไป ศักย์ไฟฟ้ามาตรฐานคือ −0.76 V โดยในชุดของศักย์ไฟฟ้ามาตรฐานจะอยู่ที่ระดับเหล็ก
ในอากาศ สังกะสีจะถูกเคลือบด้วยฟิล์มบางของ ZnO ออกไซด์ เมื่อได้รับความร้อนสูง จะเผาไหม้เกิดเป็นแอมโฟเทอริก ไวท์ออกไซด์ ZnO:
2Zn + O2 = 2ZnO
ซิงค์ออกไซด์ทำปฏิกิริยากับสารละลายกรด:
ZnO + 2HNO3 = สังกะสี(NO3)2 + H2O
และด้วยด่าง:
ZnO + 2NaOH = Na2ZnO2 + H2O
สังกะสีที่มีความบริสุทธิ์ธรรมดาจะทำปฏิกิริยาอย่างแข็งขันกับสารละลายกรด:
สังกะสี + 2HCl = ZnCl2 + H2
สังกะสี + H2SO4(ดิล.) = ZnSO4 + H2
และสารละลายอัลคาไล:
สังกะสี + 2NaOH + 2H2O = Na2 + H2
ก่อตัวเป็นไฮดรอกซิเนต สังกะสีที่บริสุทธิ์มากไม่ทำปฏิกิริยากับสารละลายกรดและด่าง ปฏิกิริยาเริ่มต้นเมื่อเติมสารละลายคิวรัมซัลเฟต CuSO4 ลงไปสองสามหยด
เมื่อถูกความร้อน สังกะสีจะทำปฏิกิริยากับฮาโลเจนเพื่อสร้างเฮไลด์ ZnHal2 ด้วยฟอสฟอรัส สังกะสีจะเกิดฟอสไฟด์ Zn3P2 และ ZnP2 ด้วยกำมะถันและอะนาลอกของมัน - ซีลีเนียมและเทลลูเรียม - chalcogenides ต่างๆ, ZnS, ZnSe, ZnSe2 และ ZnTe
สังกะสีไม่ทำปฏิกิริยาโดยตรงกับไฮโดรเจน ไนโตรเจน คาร์บอน ซิลิคอน และโบรอน Zn3N2 ไนไตรด์ได้มาจากการทำปฏิกิริยาสังกะสีกับแอมโมเนียที่อุณหภูมิ 550-600°C
ใน สารละลายที่เป็นน้ำไอออนของสังกะสี Zn2+ ก่อให้เกิดสารประกอบเชิงซ้อนของน้ำ 2+ และ 2+
โลหะสังกะสีบริสุทธิ์ใช้เพื่อนำโลหะมีค่าที่ขุดโดยการชะล้างใต้ดิน (ทอง เงิน) นอกจากนี้ สังกะสียังใช้ในการแยกเงิน ทองคำ (และโลหะอื่นๆ) จากตะกั่วดิบในรูปของสารประกอบระหว่างโลหะระหว่างสังกะสี-เงิน-ทอง (เรียกว่า "โฟมเงิน") ซึ่งจากนั้นจึงนำไปแปรรูปโดยวิธีการกลั่นแบบดั้งเดิม
ใช้เพื่อปกป้องเหล็กจากการกัดกร่อน (การชุบสังกะสีของพื้นผิวที่ไม่อยู่ภายใต้ความเครียดทางกลหรือการทำให้เป็นโลหะ - สำหรับสะพาน ถัง โครงสร้างโลหะ) นอกจากนี้ยังใช้เป็นวัสดุสำหรับอิเล็กโทรดลบในแหล่งจ่ายกระแสไฟฟ้าทางเคมี กล่าวคือ ในแบตเตอรี่และตัวสะสม ตัวอย่างเช่น: เซลล์แมงกานีส-สังกะสี, แบตเตอรี่สังกะสีเงิน (EMF 1.85 V, 150 Wh/kg, 650 Wh/ dmі, ต่ำ ความต้านทานและกระแสคายประจุขนาดมหึมา, องค์ประกอบปรอท-สังกะสี (EMF 1.35 V, 135 Wh/kg, 550-650 Wh/dmі), องค์ประกอบไดออกซีซัลเฟต-ปรอท, องค์ประกอบสังกะสีไอโอเดต, เซลล์กัลวานิกคอปเปอร์ออกไซด์ (EMF 0.7-1.6 โวลต์, 84- 127 Wh/กก., 410-570 Wh/dmI), เซลล์โครเมียม-สังกะสี, เซลล์ซิงค์-ซิลเวอร์คลอไรด์, แบตเตอรี่นิกเกิล-สังกะสี (EMF 1, 82 โวลต์, 95-118 Wh/กก., 230-295 Wh/dmI), เซลล์ตะกั่วสังกะสี, แบตเตอรี่ซิงค์คลอรีน, แบตเตอรี่สังกะสีโบรมีน ฯลฯ) บทบาทของสังกะสีในแบตเตอรี่สังกะสี-อากาศมีความสำคัญมาก ในช่วงไม่กี่ปีที่ผ่านมา แบตเตอรี่สำหรับคอมพิวเตอร์ (แล็ปท็อป) ที่ใช้ระบบสังกะสี-อากาศได้รับการพัฒนาอย่างเข้มข้นและประสบความสำเร็จอย่างมากในด้านนี้ (ใหญ่กว่าแบตเตอรี่ลิเธียม ความจุ และทรัพยากรน้อยกว่าต้นทุน 3 เท่า) ระบบนี้ยังมีแนวโน้มมากสำหรับการสตาร์ทเครื่องยนต์ (แบตเตอรี่ตะกั่ว - 55 Wh/kg, สังกะสี-อากาศ - 220-300 Wh/kg) และสำหรับรถยนต์ไฟฟ้า (ระยะสูงสุด 900 กม. ). รวมอยู่ในสารบัดกรีแข็งหลายชนิดเพื่อลดจุดหลอมเหลว สังกะสีเป็นส่วนประกอบสำคัญของทองเหลือง ซิงค์ออกไซด์ถูกนำมาใช้กันอย่างแพร่หลายในทางการแพทย์เป็นสารฆ่าเชื้อและต้านการอักเสบ ซิงค์ออกไซด์ยังใช้ในการผลิตสี - สังกะสีสีขาว
ซิงค์คลอไรด์เป็นฟลักซ์ที่สำคัญสำหรับการบัดกรีโลหะและเป็นส่วนประกอบในการผลิตเส้นใย
ซิงค์เทลลูไรด์ เซเลไนด์ ฟอสไฟด์ และซัลไฟด์เป็นสารกึ่งตัวนำที่ใช้กันอย่างแพร่หลาย
สังกะสี เซเลไนด์ใช้ในการผลิตแว่นสายตาที่มีค่าสัมประสิทธิ์การดูดกลืนแสงต่ำมากในบริเวณอินฟราเรดตอนกลาง เช่น ในเลเซอร์คาร์บอนไดออกไซด์
ปรอท
ปรอทเป็นองค์ประกอบของกลุ่มย่อยรองของกลุ่มที่สองช่วงที่หกของตารางธาตุขององค์ประกอบทางเคมีของ D.I. Dmitry Ivanovich Mendeleev โดยมีเลขอะตอม 80 ถูกกำหนดโดยสัญลักษณ์ Hg (lat. Hydrargyrum) สารปรอทอย่างง่าย (หมายเลข CAS: 7439-97-6) เป็นโลหะทรานซิชัน ที่อุณหภูมิห้องจะเป็นของเหลวสีขาวเงินหนัก ระเหยได้อย่างเห็นได้ชัด ซึ่งเป็นไอระเหยที่มีพิษร้ายแรง ปรอทเป็นหนึ่งในสององค์ประกอบทางเคมี (และเป็นโลหะเพียงชนิดเดียว) ซึ่งเป็นสารธรรมดาที่อยู่ภายใต้สภาวะปกติจะอยู่ในสถานะของเหลวรวมตัว (องค์ประกอบที่สองคือโบรมีน) ในธรรมชาติพบได้ทั้งในรูปแบบพื้นเมืองและในรูปของแร่ธาตุหลายชนิด ปรอทมักได้มาจากการลดลงจากแร่ชาดที่พบมากที่สุด ใช้สำหรับการผลิตเครื่องมือวัด ปั๊มสุญญากาศ แหล่งกำเนิดแสง และในสาขาวิทยาศาสตร์และเทคโนโลยีอื่นๆ
ปรอทเป็นโลหะชนิดเดียวที่เป็นของเหลวที่อุณหภูมิห้อง มันมีคุณสมบัติเป็นแม่เหล็ก ก่อรูปโลหะผสมเหลวกับโลหะหลายชนิด - มัลกัม. มีเพียงเหล็ก แมงกานีส และ นิ.
ปรอทเป็นโลหะที่มีปฏิกิริยาต่ำ
เมื่อถูกความร้อนถึง 300 °C ปรอทจะทำปฏิกิริยากับออกซิเจน: 2Hg + O2 → 2HgO ปรอทแดง (II) ออกไซด์จะเกิดขึ้น ปฏิกิริยานี้สามารถย้อนกลับได้: เมื่อได้รับความร้อนสูงกว่า 340 °C ออกไซด์จะสลายตัวเป็นสารธรรมดา ปฏิกิริยาการสลายตัวของปรอทออกไซด์ถือเป็นวิธีแรกๆ ในการผลิตออกซิเจนในอดีต
เมื่อปรอทถูกให้ความร้อนด้วยซัลเฟอร์ จะเกิดสารปรอท (II) ซัลไฟด์
ปรอทไม่ละลายในสารละลายของกรดที่ไม่มี คุณสมบัติออกซิไดซ์แต่ละลายในน้ำกัดทองและ กรดไนตริก, ก่อรูปเกลือปรอทแบบไดวาเลนต์ เมื่อปรอทส่วนเกินละลายในกรดไนตริกในความเย็น จะเกิดไนเตรต Hg2(NO3)2
ในบรรดาองค์ประกอบของกลุ่ม IIB มันคือปรอทที่มีความเป็นไปได้ที่จะทำลายเปลือกอิเล็กตรอน 6d10 ที่เสถียรมากซึ่งนำไปสู่ความเป็นไปได้ของการมีอยู่ของสารประกอบปรอท (+4) ดังนั้น นอกเหนือจาก Hg2F2 ที่ละลายน้ำได้ไม่ดีและ HgF2 ที่สลายตัวในน้ำแล้ว ยังมี HgF4 อีกด้วย ซึ่งได้จากปฏิกิริยาของอะตอมของปรอทและส่วนผสมของนีออนและฟลูออรีนที่อุณหภูมิ 4K
ปรอทใช้ในการผลิตเทอร์โมมิเตอร์ หลอดปรอท - ควอตซ์และหลอดฟลูออเรสเซนต์เต็มไปด้วยไอปรอท หน้าสัมผัสปรอททำหน้าที่เป็นเซ็นเซอร์ตำแหน่ง นอกจากนี้ ปรอทของโลหะยังใช้ในการผลิตโลหะผสมที่สำคัญจำนวนหนึ่งอีกด้วย
ก่อนหน้านี้ อะมัลกัมโลหะหลายชนิด โดยเฉพาะอะมัลกัมทองคำและเงิน ถูกนำมาใช้กันอย่างแพร่หลายในเครื่องประดับ กระจก และการอุดฟัน ในด้านเทคโนโลยี ปรอทถูกนำมาใช้กันอย่างแพร่หลายสำหรับบารอมิเตอร์และเกจวัดความดัน สารประกอบปรอทถูกใช้เป็นสารฆ่าเชื้อ (ระเหิด) ยาระบาย (คาโลเมล) ในการผลิตหมวก ฯลฯ แต่เนื่องจากมีความเป็นพิษสูง ในตอนท้ายของศตวรรษที่ 20 พวกเขาจึงถูกบังคับให้ออกจากพื้นที่เหล่านี้ (แทนที่การควบรวมกิจการด้วยการสปัตเตอร์) และการวางตำแหน่งด้วยไฟฟ้าของโลหะ การอุดโพลีเมอร์ในทางทันตกรรม)
เทอร์โมมิเตอร์อุณหภูมิต่ำใช้โลหะผสมของปรอทและแทลเลียม
ปรอทที่เป็นโลหะทำหน้าที่เป็นแคโทดสำหรับการผลิตอิเล็กโทรไลต์ของโลหะแอคทีฟ คลอรีน และด่างจำนวนหนึ่งในแหล่งจ่ายกระแสไฟฟ้าทางเคมีบางชนิด (เช่น ปรอท-สังกะสี - ชนิด RC) ในแหล่งจ่ายแรงดันอ้างอิง (องค์ประกอบ Weston) ธาตุปรอท-สังกะสี (แรงเคลื่อนไฟฟ้า 1.35 โวลต์) มีพลังงานในปริมาณและมวลสูงมาก (130 วัตต์/ชั่วโมง/กก. 550 วัตต์/ชั่วโมง/dm)
ปรอทใช้ในการแปรรูปอลูมิเนียมรีไซเคิลและการขุดทอง (ดูอะมัลกัม)
บางครั้งปรอทยังใช้เป็นสารทำงานในตลับลูกปืนอุทกไดนามิกที่รับภาระหนักอีกด้วย
สารปรอทรวมอยู่ในสีฆ่าเชื้อไวรัสบางชนิดเพื่อป้องกันการเปรอะเปื้อนของตัวเรือในน้ำทะเล
Mercury-203 (T1/2 = 53 วินาที) ใช้ในเภสัชวิทยารังสี
เกลือของปรอทยังใช้:
ปรอทไอโอไดด์ถูกใช้เป็นเครื่องตรวจจับรังสีเซมิคอนดักเตอร์
ปรอทจุดสิ้นสุด (“Mercury fulminate”) ถูกใช้เป็นวัตถุระเบิด (ตัวจุดชนวน) มานานแล้ว
ปรอทโบรไมด์ใช้ในการย่อยสลายทางความร้อนเคมีของน้ำให้เป็นไฮโดรเจนและออกซิเจน (พลังงานอะตอมไฮโดรเจน)
สารประกอบปรอทบางชนิดใช้เป็นยา (เช่น เมอร์ไธโอเลตสำหรับถนอมวัคซีน) แต่สาเหตุหลักมาจากความเป็นพิษทำให้ปรอทต้องเลิกใช้ยา (ระเหิด, เมอร์คิวริกออกซีไซยาไนด์ - ยาฆ่าเชื้อ, คาโลเมล - ยาระบาย ฯลฯ) ในช่วงกลางถึงปลายศตวรรษที่ 20 ศตวรรษ.

อลูมิเนียม
อลูมิเนียมเป็นองค์ประกอบของกลุ่มย่อยหลักของกลุ่มที่สามของช่วงที่สามของระบบธาตุเคมีโดย D. I. Mendeleev Dmitry Ivanovich เลขอะตอม 13 แสดงด้วยสัญลักษณ์ Al (lat. Aluminium) อยู่ในกลุ่มโลหะเบา โลหะที่พบมากที่สุดและเป็นองค์ประกอบทางเคมีที่มีมากเป็นอันดับสาม (รองจากออกซิเจนและซิลิคอน) ในเปลือกโลก
อะลูมิเนียมสสารธรรมดา (หมายเลข CAS: 7429-90-5) เป็นโลหะสีเงิน-ขาวน้ำหนักเบาที่ไม่เป็นแม่เหล็ก ซึ่งสามารถขึ้นรูป หล่อ และกลึงได้ง่าย อลูมิเนียมมีค่าการนำความร้อนและไฟฟ้าสูงและทนต่อการกัดกร่อนเนื่องจากการก่อตัวอย่างรวดเร็วของฟิล์มออกไซด์ที่แข็งแกร่งซึ่งช่วยปกป้องพื้นผิวจากการมีปฏิสัมพันธ์เพิ่มเติม
จากการศึกษาทางชีววิทยาบางกรณี การบริโภคอะลูมิเนียมเข้าสู่ร่างกายมนุษย์ถือเป็นปัจจัยในการพัฒนาโรคอัลไซเมอร์ แต่การศึกษาเหล่านี้ถูกวิพากษ์วิจารณ์ในภายหลังและข้อสรุปเกี่ยวกับความสัมพันธ์ระหว่างสิ่งหนึ่งกับอีกสิ่งหนึ่งถูกข้องแวะ
โลหะมีสีขาวเงิน น้ำหนักเบา ความหนาแน่น 2.7 g/cm³ จุดหลอมเหลวทางเทคนิค 658 °C อลูมิเนียมความบริสุทธิ์สูง 660 °C จุดเดือด 2500 °C ความต้านทานแรงดึงของการหล่อ 10-12 กก./มม.² เปลี่ยนรูปได้ 18 -25 กก./ตร.มม., โลหะผสม 38-42 กก./ตร.มม.
ความแข็งของบริเนลอยู่ที่ 24-32 กก./มม.² มีความเหนียวสูง: เทคนิค 35%, บริสุทธิ์ 50%, รีดเป็นแผ่นบางและแม้แต่ฟอยล์
อลูมิเนียมมีค่าการนำไฟฟ้าและความร้อนสูง คิดเป็น 65% ของค่าการนำไฟฟ้าของคิวรัม และมีการสะท้อนแสงสูง
อลูมิเนียมเป็นโลหะผสมกับโลหะเกือบทั้งหมด
ภายใต้สภาวะปกติ อลูมิเนียมจะถูกเคลือบด้วยฟิล์มออกไซด์ที่บางและทนทาน ดังนั้นจึงไม่ทำปฏิกิริยากับสารออกซิไดซ์แบบดั้งเดิม: กับ H2O (t°); O2, HNO3 (โดยไม่ต้องให้ความร้อน) ด้วยเหตุนี้อะลูมิเนียมจึงไม่ถูกกัดกร่อนและเป็นที่ต้องการอย่างกว้างขวางในอุตสาหกรรมสมัยใหม่ อย่างไรก็ตาม เมื่อฟิล์มออกไซด์ถูกทำลาย (ตัวอย่างเช่น เมื่อสัมผัสกับสารละลายของเกลือแอมโมเนียม NH4+, อัลคาไลร้อน หรือเป็นผลมาจากการควบรวมกิจการ) อะลูมิเนียมจะทำหน้าที่เป็นโลหะรีดิวซ์ที่แอคทีฟ
ทำปฏิกิริยาได้ง่ายกับสารธรรมดา:
ด้วยออกซิเจน:
4อัล + 3O2 = 2Al2O3
ด้วยฮาโลเจน:
2Al + 3Br2 = 2AlBr3
ทำปฏิกิริยากับอโลหะอื่น ๆ เมื่อถูกความร้อน:
ด้วยซัลเฟอร์ทำให้เกิดอะลูมิเนียมซัลไฟด์:
2อัล + 3S = อัล2S3
ด้วยไนโตรเจนทำให้เกิดอะลูมิเนียมไนไตรด์:
ด้วยคาร์บอนทำให้เกิดอะลูมิเนียมคาร์ไบด์:
4อัล + 3C = อัล4C3
อลูมิเนียมซัลไฟด์และคาร์ไบด์ถูกไฮโดรไลซ์อย่างสมบูรณ์:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
Al4C3 + 12H2O = 4Al(OH)3+ 3CH4
ด้วยสารที่ซับซ้อน:
กับน้ำ (หลังจากลอกฟิล์มป้องกันออกไซด์ เช่น การควบรวมหรือสารละลายด่างร้อน):
2Al + 6H2O = 2Al(OH)3 + 3H2
ด้วยด่าง (ด้วยการก่อตัวของเตตระไฮดรอกซีโซอะลูมิเนตและอะลูมิเนตอื่น ๆ ):
2Al + 2NaOH + 6H2O = 2Na + 3H2
2(NaOH.H2O) + 2Al = 2NaAlO2 + 3H2
ละลายได้ง่ายในกรดไฮโดรคลอริกและกรดซัลฟิวริกเจือจาง:
2Al + 6HCl = 2AlCl3 + 3H2
2Al + 3H2SO4(ดิล) = Al2(SO4)3 + 3H2
เมื่อถูกความร้อนจะละลายในกรด - ตัวออกซิไดซ์ที่สร้างเกลืออลูมิเนียมที่ละลายน้ำได้:
2Al + 6H2SO4(คอนซี) = Al2(SO4)3 + 3SO2 + 6H2O
อัล + 6HNO3(คอนซี) = อัล(NO3)3 + 3NO2 + 3H2O
ฟื้นฟูโลหะจากออกไซด์ (อะลูมิเนียมอลูมินัม):
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
2Al + Cr2O3 = Al2O3 + 2Cr
นิยมใช้เป็นวัสดุก่อสร้าง ข้อได้เปรียบหลักของอะลูมิเนียมในด้านคุณภาพนี้คือ ความเบา ความอ่อนตัวในการปั๊ม ความต้านทานการกัดกร่อน (ในอากาศ อลูมิเนียมจะถูกเคลือบด้วยฟิล์ม Al2O3 ที่ทนทานทันที ซึ่งป้องกันการเกิดออกซิเดชันเพิ่มเติม) การนำความร้อนสูง และไม่เป็นพิษของสารประกอบ โดยเฉพาะอย่างยิ่งคุณสมบัติเหล่านี้ทำให้อะลูมิเนียมได้รับความนิยมอย่างมากในการผลิตเครื่องครัว อลูมิเนียมฟอยล์ในอุตสาหกรรมอาหารและบรรจุภัณฑ์
ข้อเสียเปรียบหลักของอลูมิเนียมในฐานะวัสดุโครงสร้างคือมีความแข็งแรงต่ำ ดังนั้นจึงมักจะผสมกับคิวรัมและแมกนีเซียมในปริมาณเล็กน้อย (โลหะผสมเรียกว่าดูราลูมิน)
ค่าการนำไฟฟ้าของอะลูมิเนียมมีค่าการนำไฟฟ้าน้อยกว่าคิวรัมเพียง 1.7 เท่า ในขณะที่อะลูมิเนียมมีราคาถูกกว่าประมาณ 2 เท่า ดังนั้นจึงมีการใช้กันอย่างแพร่หลายในวิศวกรรมไฟฟ้าสำหรับการผลิตสายไฟ การป้องกัน และแม้แต่ในไมโครอิเล็กทรอนิกส์สำหรับการผลิตตัวนำในชิป ค่าการนำไฟฟ้าที่ต่ำกว่าของอะลูมิเนียม (37 1/โอห์ม) เมื่อเทียบกับคิวรัม (63 1/โอห์ม) ได้รับการชดเชยด้วยการเพิ่มขึ้นของหน้าตัดของตัวนำอะลูมิเนียม ข้อเสียของอลูมิเนียมในฐานะวัสดุไฟฟ้าคือฟิล์มออกไซด์ที่เข้มข้น ซึ่งทำให้การบัดกรีทำได้ยาก
เนื่องจากคุณสมบัติที่ซับซ้อนจึงใช้กันอย่างแพร่หลายในอุปกรณ์ทำความร้อน
อลูมิเนียมและโลหะผสมจะคงความแข็งแรงไว้ที่อุณหภูมิต่ำมาก ด้วยเหตุนี้จึงมีการใช้กันอย่างแพร่หลายในเทคโนโลยีการแช่แข็ง
การสะท้อนแสงสูง รวมกับต้นทุนที่ต่ำและความง่ายในการสะสม ทำให้อลูมิเนียมเป็นวัสดุที่เหมาะสำหรับการทำกระจก
ในการผลิตวัสดุก่อสร้างที่เป็นตัวแทนการขึ้นรูปก๊าซ
อะลูมิไนซ์ช่วยให้เหล็กและโลหะผสมอื่นๆ มีการกัดกร่อนและตะกรันได้ เช่น วาล์วของเครื่องยนต์สันดาปภายในแบบลูกสูบ ใบพัดกังหัน แท่นขุดเจาะน้ำมัน อุปกรณ์แลกเปลี่ยนความร้อน และยังใช้แทนการชุบสังกะสีอีกด้วย
อลูมิเนียมซัลไฟด์ใช้ในการผลิตไฮโดรเจนซัลไฟด์
การวิจัยอยู่ระหว่างการพัฒนาอะลูมิเนียมโฟมให้เป็นวัสดุที่แข็งแรงและน้ำหนักเบาเป็นพิเศษ
เมื่ออะลูมิเนียมมีราคาแพงมาก จึงมีการผลิตเครื่องประดับหลากหลายชนิด แฟชั่นสำหรับพวกเขาผ่านไปทันทีเมื่อมีเทคโนโลยีใหม่ (การพัฒนา) สำหรับการผลิตปรากฏขึ้นและลดจำนวนลงหลายครั้ง ปัจจุบันอลูมิเนียมบางครั้งถูกนำมาใช้ในการผลิตเครื่องประดับเครื่องแต่งกาย


โลหะอื่นๆ
ตะกั่ว
ตะกั่วเป็นองค์ประกอบของกลุ่มย่อยหลักของกลุ่มที่สี่ช่วงที่หกของระบบธาตุขององค์ประกอบทางเคมีของ D.I. Dmitry Ivanovich Mendeleev โดยมีเลขอะตอม 82 ถูกกำหนดโดยสัญลักษณ์ Pb (ละติน: Plumbum) สารตะกั่วอย่างง่าย (หมายเลข CAS: 7439-92-1) เป็นโลหะสีเทาที่อ่อนตัวได้และค่อนข้างหลอมละลายได้
ตะกั่วมีค่าการนำความร้อนค่อนข้างต่ำ อยู่ที่ 35.1 W/(m K) ที่อุณหภูมิ 0 °C โลหะมีความอ่อนและสามารถตัดด้วยมีดได้ง่าย บนพื้นผิวมักถูกปกคลุมด้วยฟิล์มออกไซด์ที่มีความหนาไม่มากก็น้อย เมื่อตัด จะเผยให้เห็นพื้นผิวมันวาวซึ่งจะจางหายไปตามกาลเวลาในอากาศ
จุดหลอมเหลว: 327.4 °C
จุดเดือด: 1740 °C
ตะกั่วไนเตรตใช้ในการผลิตวัตถุระเบิดผสมที่ทรงพลัง ตะกั่วอะไซด์ถูกใช้เป็นตัวจุดชนวนที่ใช้กันอย่างแพร่หลาย ลีดเปอร์คลอเรตใช้ในการเตรียมของเหลวหนัก (ความหนาแน่น 2.6 ก./ซม.3) ที่ใช้ในการเสริมประโยชน์จากการลอยตัวของแร่ บางครั้งใช้ในวัตถุระเบิดผสมที่ทรงพลังเป็นสารออกซิไดซ์ ตะกั่วฟลูออไรด์เพียงอย่างเดียว เช่นเดียวกับบิสมัท คิวรัม และซิลเวอร์ฟลูออไรด์ ถูกใช้เป็นวัสดุแคโทดในแหล่งกระแสไฟฟ้าทางเคมี ตะกั่วบิสมัทเทต, ตะกั่วซัลไฟด์ PbS, ตะกั่วไอโอไดด์ถูกใช้เป็นวัสดุแคโทดในแบตเตอรี่ลิเธียม ตะกั่วคลอไรด์ PbCl2 เป็นวัสดุแคโทดในแหล่งกระแสไฟสำรอง ตะกั่วเทลลูไรด์ PbTe ถูกนำมาใช้กันอย่างแพร่หลายเป็นวัสดุเทอร์โมอิเล็กทริก (เทอร์โมอิเล็กทริกแรงเคลื่อนไฟฟ้าที่ 350 μV/K) ซึ่งเป็นวัสดุที่ใช้กันอย่างแพร่หลายที่สุดในการผลิตเครื่องกำเนิดไฟฟ้าเทอร์โมอิเล็กทริกและตู้เย็นเทอร์โมอิเล็กทริก ตะกั่วไดออกไซด์ PbO2 ถูกนำมาใช้กันอย่างแพร่หลายไม่เพียงแต่ในแบตเตอรี่ตะกั่วเท่านั้น แต่ยังบนพื้นฐานของแหล่งกำเนิดสารเคมีสำรองจำนวนมากที่เกิดขึ้นในปัจจุบัน เช่น เซลล์ตะกั่ว-คลอรีน เซลล์ตะกั่ว-ฟลูออเรสเซนต์ เป็นต้น
ตะกั่วสีขาว คาร์บอเนตพื้นฐาน Pb(OH)2.PbCO3 ซึ่งเป็นผงสีขาวหนาแน่นได้มาจากตะกั่วในอากาศภายใต้อิทธิพลของคาร์บอนไดออกไซด์และกรดอะซิติก การใช้ตะกั่วสีขาวเป็นเม็ดสีจะไม่ธรรมดาอีกต่อไปเนื่องจากครั้งหนึ่งเกิดจากการสลายตัวของไฮโดรเจนซัลไฟด์ H2S ตะกั่วขาวยังใช้สำหรับการผลิตผงสำหรับอุดรูในเทคโนโลยีซีเมนต์และกระดาษตะกั่วคาร์บอเนต
สารหนูตะกั่วและสารหนูถูกนำมาใช้ในเทคโนโลยียาฆ่าแมลงเพื่อฆ่าแมลงศัตรูพืชทางการเกษตร (มอดยิปซีและมอดฝ้าย) ตะกั่วบอเรต Pb(BO2)2·H2O เป็นผงสีขาวที่ไม่ละลายน้ำ ใช้สำหรับอบแห้งภาพวาดและเคลือบเงา และใช้ร่วมกับโลหะอื่นๆ เพื่อใช้เคลือบแก้วและพอร์ซเลน Lead Chloride PbCl2 ผงผลึกสีขาว ละลายได้ใน น้ำร้อนสารละลายของคลอไรด์อื่นๆ และโดยเฉพาะแอมโมเนียมคลอไรด์ NH4Cl ใช้สำหรับเตรียมขี้ผึ้งสำหรับรักษาเนื้องอก
Lead Chromate PbCrO4 รู้จักกันในชื่อสีย้อมสีเหลืองโครเมียม และเป็นเม็ดสีที่สำคัญสำหรับทำสี สำหรับการย้อมเครื่องลายครามและผ้า ในอุตสาหกรรม โครเมตใช้เป็นหลักในการผลิตเม็ดสีเหลือง Lead Nitrate Pb(NO3)2 เป็นสารผลึกสีขาว ละลายได้ดีในน้ำ นี่เป็นเครื่องผูกที่มีการใช้งานอย่างจำกัด ในอุตสาหกรรม ใช้ในการผลิตไม้ขีด การย้อมและการพิมพ์สิ่งทอ การย้อมแตรและการแกะสลัก ตะกั่วซัลเฟต Pb(SO4)2 ซึ่งเป็นผงสีขาวที่ไม่ละลายน้ำ ถูกใช้เป็นเม็ดสีในแบตเตอรี่ การพิมพ์หิน และเทคโนโลยีผ้าพิมพ์
ตะกั่วซัลไฟด์ PbS เป็นผงสีดำที่ไม่ละลายน้ำ ใช้ในการเผาเครื่องปั้นดินเผาและตรวจจับไอออนตะกั่ว
เนื่องจากตะกั่วดูดซับรังสี γ ได้ดี จึงใช้สำหรับการป้องกันรังสีในโรงงานเอ็กซเรย์และในเครื่องปฏิกรณ์นิวเคลียร์ นอกจากนี้ ตะกั่วยังถือเป็นสารหล่อเย็นในโครงการเครื่องปฏิกรณ์นิวเคลียร์นิวตรอนเร็วขั้นสูงอีกด้วย
โลหะผสมตะกั่วถูกนำมาใช้กันอย่างแพร่หลาย พิวเตอร์ (โลหะผสมของดีบุกและตะกั่ว) ที่ประกอบด้วยโลหะดีบุก 85-90% และ Pb 15-10% สามารถขึ้นรูปได้ มีราคาไม่แพง และใช้ในการผลิตเครื่องใช้ในครัวเรือน โลหะบัดกรีที่มี Pb 67% และโลหะดีบุก 33% ใช้ในงานวิศวกรรมไฟฟ้า โลหะผสมของตะกั่วกับพลวงใช้ในการผลิตกระสุนและฟอนต์ตัวอักษร ส่วนโลหะผสมของตะกั่ว พลวง และดีบุกใช้สำหรับการหล่อขึ้นรูปและตลับลูกปืน โลหะผสมตะกั่วและพลวงมักใช้สำหรับปลอกสายเคเบิลและแผ่นแบตเตอรี่ไฟฟ้า สารประกอบตะกั่วใช้ในการผลิตสีย้อม สี ยาฆ่าแมลง แก้ว รายการค้าและเป็นสารเติมแต่งให้กับน้ำมันเบนซินในรูปของเตตระเอทิลตะกั่ว (C2H5)4Pb (ของเหลวที่ระเหยได้ปานกลาง ไอระเหยที่มีความเข้มข้นน้อยจะมีกลิ่นผลไม้ที่หอมหวาน ในความเข้มข้นสูงจะมีกลิ่นอันไม่พึงประสงค์ จุดหลอมเหลว = 130 °C จุดเดือด = 80°C/13 mm Hg .st.; ความหนาแน่น 1.650 g/cm; nD2v = 1.5198; ไม่ละลายในน้ำ ผสมรวมกับตัวทำละลายอินทรีย์ได้ เป็นพิษสูง แทรกซึมเข้าสู่ผิวหนังได้ง่าย MPC = 0.005 mg/m; LD50 = 12.7 mg /กก.(หนูปากเปล่า)) เพื่อเพิ่มค่าออกเทน

ดีบุก
ดีบุกเป็นองค์ประกอบของกลุ่มย่อยหลักของกลุ่มที่สี่ช่วงที่ห้าของระบบธาตุเคมีโดย D.I. Mendeleev Dmitry Ivanovich มีเลขอะตอม 50 ถูกกำหนดโดยสัญลักษณ์โลหะดีบุก (ละติน Stannum) ภายใต้สภาวะปกติ สารธรรมดาคือพลาสติก โลหะมันเงาที่อ่อนตัวได้และหลอมได้ซึ่งมีสีเงินขาว ดีบุกมีการดัดแปลงแบบ allotropic หลายอย่าง: ต่ำกว่า 13.2 °C, α-tin (ดีบุกสีเทา) ที่มีโครงตาข่ายชนิดเพชรลูกบาศก์มีความเสถียร; ที่สูงกว่า 13.2 °C, β-tin (ดีบุกสีขาว) ที่มีโครงตาข่ายคริสตัล tetragonal มีความเสถียร
ดีบุกถูกใช้เป็นหลักเป็นสารเคลือบที่ปลอดภัย ปลอดสารพิษ และทนต่อการกัดกร่อนทั้งในรูปแบบบริสุทธิ์หรือในโลหะผสมกับโลหะอื่นๆ การใช้ดีบุกในอุตสาหกรรมหลักได้แก่ แผ่นเหล็กเคลือบดีบุก (เหล็กเคลือบดีบุก) สำหรับภาชนะบรรจุอาหาร ในการบัดกรีสำหรับอุปกรณ์อิเล็กทรอนิกส์ ในท่อในครัวเรือน ในโลหะผสมของแบริ่ง และในการเคลือบดีบุกและโลหะผสมของมัน โลหะผสมที่สำคัญที่สุดของดีบุกคือ สีบรอนซ์(กับคิวรัม) พิวเตอร์เป็นโลหะผสมที่รู้จักกันดีอีกชนิดหนึ่งที่ใช้ทำเครื่องใช้บนโต๊ะอาหาร ใน เมื่อเร็วๆ นี้ความสนใจในการใช้โลหะกำลังฟื้นขึ้นมา เนื่องจากเป็นโลหะที่ "เป็นมิตรต่อสิ่งแวดล้อม" มากที่สุดในบรรดาโลหะหนักที่ไม่ใช่เหล็ก ใช้เพื่อสร้างสายไฟตัวนำยิ่งยวดโดยใช้สารประกอบระหว่างโลหะ Nb3Sn
ราคาสำหรับดีบุกโลหะในปี 2549 เฉลี่ยอยู่ที่ 12-18 ดอลลาร์/กก. ดีบุกไดออกไซด์ที่มีความบริสุทธิ์สูงประมาณ 25 ดอลลาร์/กก. ดีบุกที่มีความบริสุทธิ์สูงผลึกเดี่ยวประมาณ 210 ดอลลาร์/กก.
สารประกอบระหว่างโลหะของดีบุกและเซอร์โคเนียมมีจุดหลอมเหลวสูง (สูงถึง 2000 °C) และต้านทานต่อการเกิดออกซิเดชันเมื่อถูกความร้อนในอากาศและมีการใช้งานหลายอย่าง
ดีบุกเป็นส่วนประกอบโลหะผสมที่สำคัญที่สุดในการผลิตโลหะผสมไทเทเนียมที่มีโครงสร้าง
ดีบุกไดออกไซด์เป็นวัสดุขัดถูที่มีประสิทธิภาพมากซึ่งใช้ในการ "ตกแต่ง" พื้นผิวของแก้วแสง
ส่วนผสมของเกลือดีบุก - "องค์ประกอบสีเหลือง" - ก่อนหน้านี้ใช้เป็นสีย้อมสำหรับขนสัตว์
ดีบุกยังใช้ในแหล่งกระแสไฟฟ้าทางเคมีเป็นวัสดุแอโนด เช่น ธาตุแมงกานีส-ดีบุก ธาตุปรอท-ดีบุกออกไซด์ การใช้ดีบุกในแบตเตอรี่ตะกั่ว-ดีบุกมีแนวโน้มที่ดี ตัวอย่างเช่น ที่แรงดันไฟฟ้าเท่ากับแบตเตอรี่ตะกั่ว แบตเตอรี่ตะกั่ว-ดีบุกมีความจุมากกว่า 2.5 เท่าและมีความหนาแน่นของพลังงานมากกว่า 5 เท่าต่อหน่วยปริมาตร ความต้านทานภายในของแบตเตอรี่จึงต่ำกว่ามาก
โลหะดีบุกไม่เป็นพิษ จึงสามารถนำไปใช้ในอุตสาหกรรมอาหารได้ สิ่งเจือปนที่เป็นอันตรายซึ่งบรรจุอยู่ในดีบุกภายใต้สภาวะการจัดเก็บและการใช้งานปกติ รวมถึงการหลอมที่อุณหภูมิสูงถึง 600 °C จะไม่ถูกปล่อยออกสู่อากาศในพื้นที่ทำงานในปริมาณที่เกินความเข้มข้นสูงสุดที่อนุญาตตาม GOST การสัมผัสกับฝุ่นดีบุกในระยะยาว (15-20 ปี) มีผลกระทบต่อปอดและอาจทำให้เกิดโรคปอดบวมในคนงานได้
การใช้โลหะ
วัสดุก่อสร้าง
โลหะและโลหะผสมเป็นหนึ่งในวัสดุโครงสร้างหลักของอารยธรรมสมัยใหม่ สิ่งนี้ถูกกำหนดโดยความแข็งแกร่ง ความสม่ำเสมอ และการซึมผ่านของของเหลวและก๊าซเป็นหลัก นอกจากนี้ การเปลี่ยนสูตรโลหะผสมยังทำให้คุณสมบัติต่างๆ เปลี่ยนแปลงไปในวงกว้างได้อีกด้วย
วัสดุไฟฟ้า
โลหะถูกใช้เป็นตัวนำไฟฟ้าที่ดี ไฟฟ้า(ทองแดง อลูมิเนียม) และเป็นวัสดุที่มีความต้านทานเพิ่มขึ้นสำหรับตัวต้านทานและองค์ประกอบความร้อนไฟฟ้า (นิกโครม ฯลฯ)
วัสดุเครื่องมือ
โลหะและโลหะผสมถูกนำมาใช้กันอย่างแพร่หลายในการผลิตเครื่องมือ (ชิ้นส่วนที่ใช้งาน) ส่วนใหญ่เป็นเหล็กกล้าเครื่องมือและโลหะผสมแข็ง เพชร โบรอนไนไตรด์ และเซรามิกยังใช้เป็นวัสดุเครื่องมืออีกด้วย
โลหะวิทยา
โลหะวิทยาหรือโลหะวิทยาเป็นสาขาวิชาวัสดุศาสตร์ที่ศึกษาพฤติกรรมทางกายภาพและเคมีของโลหะ สารประกอบระหว่างโลหะ และโลหะผสม โลหะวิทยายังรวมถึงการประยุกต์ใช้ความรู้ที่มีอยู่เกี่ยวกับโลหะในทางปฏิบัติตั้งแต่การสกัดวัตถุดิบไปจนถึงประเด็นทางการเงินของผลิตภัณฑ์สำเร็จรูป
ศึกษาโครงสร้างและคุณสมบัติทางเคมีฟิสิกส์ของโลหะและออกไซด์ที่หลอมละลายและสารละลายของแข็ง การพัฒนาทฤษฎีสถานะควบแน่นของสสาร
การศึกษาอุณหพลศาสตร์ จลนศาสตร์ และกลไกของปฏิกิริยาโลหะวิทยา
การพัฒนารากฐานทางวิทยาศาสตร์ เทคนิค และเศรษฐศาสตร์สำหรับการใช้วัตถุดิบแร่โพลีเมทัลลิกและของเสียทางเทคโนโลยีแบบบูรณาการกับการแก้ปัญหาสิ่งแวดล้อม
การพัฒนาทฤษฎีพื้นฐานของเฟสไพโรเมทัลโลจิคัล ความร้อนไฟฟ้า ไฮโดรเมทัลโลจิคัล และเฟสก๊าซ กระบวนการการผลิตโลหะ โลหะผสม ผงโลหะ วัสดุคอมโพสิตและสารเคลือบ
โลหะกลุ่มเหล็ก ได้แก่ เหล็ก แมงกานีส โครเมียม วานาเดียม ที่เหลือทั้งหมดเป็นสี ตามคุณสมบัติทางกายภาพและวัตถุประสงค์ โลหะที่ไม่ใช่เหล็กจะถูกแบ่งออกเป็นโลหะหนัก (ทองแดง ตะกั่ว สังกะสี ดีบุก นิ) และโลหะเบา (อลูมิเนียม แมกนีเซียม) ตามคุณสมบัติและวัตถุประสงค์
ตามหลัก กระบวนการทางเทคโนโลยีแบ่งออกเป็น ไพโรเมทัลโลหการ (การถลุง) และโลหวิทยาไฮโดรเมทัลโลหการ (การสกัดโลหะในสารละลายเคมี) ประเภทของไพโรเมทัลวิทยาคือโลหะวิทยาแบบพลาสมา
โลหะวิทยาพลาสม่า - การสกัดแร่ การถลุง และการแปรรูปโลหะและโลหะผสมภายใต้อิทธิพลของพลาสมา
การแปรรูปแร่ (ออกไซด์ ฯลฯ) ดำเนินการโดยการสลายตัวด้วยความร้อนในพลาสมา เพื่อป้องกันปฏิกิริยาย้อนกลับ มีการใช้สารรีดิวซ์ (คาร์บอน ไฮโดรเจน มีเทน ฯลฯ) หรือการระบายความร้อนอย่างรวดเร็วของการไหลของพลาสมา ซึ่งจะรบกวนสมดุลทางอุณหพลศาสตร์
โลหะวิทยาพลาสม่าช่วยให้สามารถลดโลหะจากแร่ได้โดยตรง ช่วยเร่งกระบวนการทางโลหะวิทยา การได้วัสดุบริสุทธิ์ และลดต้นทุนเชื้อเพลิง (ตัวรีดิวซ์) ข้อเสียของโลหะวิทยาพลาสม่าคือการสิ้นเปลืองไฟฟ้าที่ใช้ในการผลิตพลาสมาสูง

เรื่องราว
หลักฐานแรกที่แสดงว่ามนุษย์เกี่ยวข้องกับโลหะวิทยามีอายุย้อนกลับไปในสหัสวรรษที่ 5-6 ก่อนคริสต์ศักราช จ. และถูกพบใน Majdanpek, Pločnik และสถานที่อื่นๆ ในเซอร์เบีย (รวมถึงขวานทองแดงจาก 5,500 ปีก่อนคริสตกาล ซึ่งเป็นของวัฒนธรรม Vinca), บัลแกเรีย (5,000 ปีก่อนคริสตกาล), Palmela (), สเปน, สโตนเฮนจ์ () อย่างไรก็ตาม ดังที่มักเกิดขึ้นกับปรากฏการณ์โบราณเช่นนี้ จึงไม่สามารถระบุอายุได้อย่างแม่นยำเสมอไป
วัฒนธรรมในยุคแรกประกอบด้วยเงิน ทองแดง ดีบุก และเหล็กอุกกาบาต ซึ่งอนุญาตให้มีงานโลหะอย่างจำกัด ดังนั้น "มีดสั้นสวรรค์" จึงมีมูลค่าสูง - อาวุธของอียิปต์ที่สร้างขึ้นจากเหล็กอุกกาบาตเมื่อ 3,000 ปีก่อนคริสตกาล จ. แต่เมื่อได้เรียนรู้ที่จะสกัดทองแดงและดีบุกออกมาแล้ว หินและผู้คนผลิตโลหะผสมที่เรียกว่าบรอนซ์ใน 3,500 ปีก่อนคริสตกาล จ. เข้าสู่ยุคสำริด
การได้รับเหล็กจากแร่และการถลุงโลหะนั้นยากกว่ามาก เชื่อกันว่าเทคโนโลยีนี้ถูกประดิษฐ์ขึ้นโดยชาวฮิตไทต์เมื่อประมาณ 1,200 ปีก่อนคริสตกาล e. ซึ่งเป็นจุดเริ่มต้นของยุคเหล็ก ความลับของการขุดและการผลิตเหล็กกลายเป็นปัจจัยสำคัญในการปกครองของชาวฟิลิสเตีย
ร่องรอยของการพัฒนาโลหะวิทยาเหล็กสามารถสืบย้อนได้จากวัฒนธรรมและอารยธรรมในอดีตมากมาย ซึ่งรวมถึงอาณาจักรและอาณาจักรโบราณและยุคกลางของตะวันออกกลางและตะวันออกใกล้ อียิปต์โบราณและอนาโตเลีย () คาร์เธจ ชาวกรีกและโรมันในสมัยโบราณและยุคกลาง ยุโรปจีน ฯลฯ ควรสังเกตว่าวิธีการอุปกรณ์และเทคโนโลยีของโลหะวิทยาหลายอย่างนั้นถูกประดิษฐ์ขึ้นครั้งแรกในจีนโบราณและจากนั้นชาวยุโรปก็เชี่ยวชาญงานฝีมือนี้ (โดยคิดค้นเตาถลุงเหล็ก เหล็กหล่อ,เหล็ก,ค้อนไฮดรอลิก ฯลฯ) อย่างไรก็ตาม การวิจัยเมื่อเร็วๆ นี้ชี้ให้เห็นว่าเทคโนโลยีของโรมันก้าวหน้าไปมากกว่าที่คิดไว้มาก โดยเฉพาะอย่างยิ่งในด้านการขุดและการหลอมโลหะ
การทำเหมืองแร่โลหะวิทยา
โลหะผสมเชิงสกัดเกี่ยวข้องกับการสกัดโลหะอันมีค่าจากแร่และการถลุงวัตถุดิบที่สกัดได้ให้เป็นโลหะบริสุทธิ์ ในการแปลงโลหะออกไซด์หรือซัลไฟด์ให้เป็นโลหะบริสุทธิ์ แร่จะต้องถูกแยกออกด้วยวิธีทางกายภาพ เคมี หรืออิเล็กโทรไลต์
นักโลหะวิทยาทำงานร่วมกับองค์ประกอบหลักสามประการ ได้แก่ วัตถุดิบ สารเข้มข้น (ออกไซด์หรือซัลไฟด์ที่มีคุณค่าของโลหะ) และของเสีย เมื่อขุดได้แล้ว แร่ก้อนใหญ่จะถูกบดขยี้จนถึงจุดที่แต่ละอนุภาคเป็นสารเข้มข้นหรือของเสียที่มีคุณค่า
ภูเขา ได้ผลไม่จำเป็นหากแร่และสิ่งแวดล้อมเอื้ออำนวยต่อการชะล้าง ด้วยวิธีนี้ คุณสามารถละลายและรับสารละลายที่อุดมด้วยแร่ธาตุได้
แร่มักมีโลหะมีค่าหลายชนิด ในกรณีเช่นนี้ ของเสียจากกระบวนการหนึ่งสามารถใช้เป็นวัตถุดิบสำหรับอีกกระบวนการหนึ่งได้
อัลลอย
โลหะผสมคือส่วนผสมที่เป็นเนื้อเดียวกันในระดับมหภาคขององค์ประกอบทางเคมีตั้งแต่สององค์ประกอบขึ้นไปโดยมีส่วนประกอบเป็นโลหะมากกว่า ตามกฎแล้วเฟสหลักหรือเฟสเดียวของโลหะผสมคือสารละลายของแข็งขององค์ประกอบอัลลอยด์ในโลหะซึ่งเป็นพื้นฐานของโลหะผสม
โลหะผสมมีคุณสมบัติเป็นโลหะ เช่น ความมันวาวของโลหะ ค่าการนำไฟฟ้าสูง และค่าการนำความร้อน บางครั้งส่วนประกอบของโลหะผสมอาจไม่ใช่แค่องค์ประกอบทางเคมีเท่านั้น แต่ยังรวมถึงสารประกอบทางเคมีที่มีคุณสมบัติเป็นโลหะด้วย ตัวอย่างเช่น ส่วนประกอบหลักของโลหะผสมแข็งคือทังสเตนหรือไทเทเนียมคาร์ไบด์ คุณสมบัติมหภาคของโลหะผสมมักจะแตกต่างจากคุณสมบัติของส่วนประกอบของมันเสมอ และความสม่ำเสมอในระดับมหภาคของโลหะผสมหลายเฟส (ต่างกัน) เกิดขึ้นได้เนื่องจากการกระจายเฟสสิ่งเจือปนสม่ำเสมอในเมทริกซ์โลหะ
โลหะผสมมักผลิตโดยการผสมส่วนประกอบในสถานะหลอมเหลวแล้วจึงทำให้เย็นลง ที่อุณหภูมิหลอมเหลวสูงของส่วนประกอบ โลหะผสมจะถูกผลิตขึ้นโดยการผสมผงโลหะตามด้วยการเผาผนึก (ตัวอย่างเช่น จะได้โลหะผสมทังสเตนจำนวนมาก)
โลหะผสมเป็นหนึ่งในวัสดุโครงสร้างหลัก โลหะผสมที่มีส่วนประกอบของเหล็กและอะลูมิเนียมมีความสำคัญมากที่สุด อโลหะ เช่น คาร์บอน ซิลิคอน โบรอน ฯลฯ สามารถนำมาใช้เป็นองค์ประกอบของโลหะผสมหลายชนิดได้ เทคโนโลยีมีการใช้โลหะผสมมากกว่า 5,000 ชนิด
แหล่งที่มา
http://ru.wikipedia.org/
สารานุกรมนักลงทุน. 2013 .
คำพ้องความหมาย:- - METAL ตัวผู้โลหะ lat. ครูเชค; และในรูปแบบเล็ก ๆ ในการถลุง: kinglet ในชีวิตประจำวัน โลหะมีค่าและมีราคาแพง: ทองคำ แพลทินัม เงิน; ง่าย: เหล็ก, ทองแดง, สังกะสี, ดีบุก, ตะกั่ว; เคมีได้ค้นพบหลักการดังกล่าวสำหรับฟอสซิลเกือบทั้งหมดประกอบด้วย... ... พจนานุกรมอธิบายของดาห์ล
องค์ประกอบทางเคมีส่วนใหญ่ (93 จาก 117) ที่รู้จักในปัจจุบันคือโลหะ
อะตอมของโลหะหลายชนิดมีโครงสร้างที่เหมือนกันมาก และสารเชิงเดี่ยวและเชิงซ้อนที่พวกมันก่อตัวขึ้นก็มีคุณสมบัติคล้ายกัน (ทางกายภาพและเคมี)
ตำแหน่งในตารางธาตุและโครงสร้างของอะตอมของโลหะ
ในตารางธาตุ โลหะจะอยู่ทางด้านซ้ายและใต้เส้นหักทั่วไปที่ลากจากโบรอนถึงแอสทาทีน (ดูตารางด้านล่าง) องค์ประกอบ s เกือบทั้งหมด (ยกเว้น H, He) เป็นโลหะ ประมาณครึ่งหนึ่ง ร-องค์ประกอบทั้งหมด ง- และ ฉ-องค์ประกอบ ( แลนทาไนด์และ แอกติไนด์).
อะตอมของโลหะส่วนใหญ่มีอิเล็กตรอนจำนวนน้อย (มากถึง 3) ในระดับพลังงานภายนอก มีเพียงอะตอมขององค์ประกอบ p (Sn, Pb, Bi, Po) เพียงบางส่วนเท่านั้นที่มีมากกว่า (จากสี่ถึงหก) เวเลนซ์อิเล็กตรอนของอะตอมโลหะมีความอ่อน (เมื่อเทียบกับอะตอมที่ไม่ใช่โลหะ) จับกับนิวเคลียส ดังนั้นอะตอมของโลหะจึงค่อนข้างง่ายที่จะมอบอิเล็กตรอนเหล่านี้ให้กับอะตอมอื่นโดยทำหน้าที่เป็น ปฏิกริยาเคมีเป็นเพียงสารรีดิวซ์และในขณะเดียวกันก็กลายเป็นแคตไอออนที่มีประจุบวก:
ฉัน - เน่ – = ฉัน n+
อะตอมของโลหะต่างจากอโลหะตรงที่มีสถานะออกซิเดชันที่เป็นบวกเท่านั้นตั้งแต่ +1 ถึง +8
ความง่ายในการที่อะตอมของโลหะจะปล่อยเวเลนซ์อิเล็กตรอนให้กับอะตอมอื่น ๆ นั้นเป็นลักษณะเฉพาะของกิจกรรมรีดิวซ์ของโลหะนั้น ยิ่งอะตอมของโลหะปล่อยอิเล็กตรอนได้ง่ายกว่า ตัวรีดิวซ์ก็จะยิ่งแข็งแกร่งขึ้นเท่านั้น หากเราจัดเรียงโลหะเรียงกันเพื่อลดกำลังรีดิวซ์ในสารละลายที่เป็นน้ำ เราก็จะรู้จักโลหะนั้น ชุดการกระจัดของโลหะซึ่งเรียกอีกอย่างว่าอนุกรมแรงดันไฟฟ้าเคมีไฟฟ้า (หรือ กิจกรรมใกล้เคียง) โลหะ (ดูตารางด้านล่าง)
ความชุก มโลหะในธรรมชาติ.
โลหะที่พบมากที่สุดสามอันดับแรกในเปลือกโลก (นี่คือชั้นพื้นผิวของโลกของเรา ซึ่งมีความหนาประมาณ 16 กม.) ได้แก่ อะลูมิเนียม เหล็ก และแคลเซียม พบได้น้อยคือโซเดียม โพแทสเซียม และแมกนีเซียม ตารางด้านล่างแสดงเศษส่วนมวลของโลหะบางชนิดในเปลือกโลก
เหล็กและแคลเซียม พบได้น้อยคือโซเดียม โพแทสเซียม และแมกนีเซียม ตารางด้านล่างแสดงเศษส่วนมวลของโลหะบางชนิดในเปลือกโลก
การเกิดขึ้นของโลหะในเปลือกโลก
| โลหะ | โลหะ | เศษส่วนมวลในเปลือกโลก, % | |
|---|---|---|---|
| อัล | 8,8 | Cr | 8,3 ∙ 10 -3 |
| เฟ | 4,65 | สังกะสี | 8,3 ∙ 10 -3 |
| แคลิฟอร์เนีย | 3,38 | นิ | 8 ∙ 10 -3 |
| นา | 2,65 | ลูกบาศ์ก | 4,7 ∙ 10 -3 |
| เค | 2,41 | ป.ล | 1,6 ∙ 10 -3 |
| มก | 2,35 | อจ | 7 ∙ 10 -6 |
| Ti | 0,57 | ปรอท | 1,35 ∙ 10 -6 |
| มน | 0,10 | ออสเตรเลีย | 5 ∙ 10 -8 |
เรียกว่าธาตุที่มีสัดส่วนมวลในเปลือกโลกน้อยกว่า 0.01% หายาก. โลหะหายากได้แก่ แลนทาไนด์ทั้งหมด เป็นต้น ถ้าธาตุใดไม่สามารถรวมตัวอยู่ในเปลือกโลกได้ กล่าวคือ ธาตุนั้นไม่ได้ก่อตัวเป็นแร่ในตัวเอง แต่พบว่ามีสิ่งเจือปนร่วมกับธาตุอื่น ๆ ก็จัดเป็น เหม่อลอยองค์ประกอบ ตัวอย่างเช่น โลหะต่อไปนี้จะกระจายตัว: Sc, Ga, In, Tl, Hf
ในช่วงทศวรรษที่ 40 ของศตวรรษที่ XX นักวิทยาศาสตร์ชาวเยอรมัน Walter และ Ida Nolla ได้แสดงความคิดนี้ หินกรวดทุกก้อนบนทางเท้ามีองค์ประกอบทางเคมีทั้งหมดของตารางธาตุ ในตอนแรก คำเหล่านี้ไม่ได้รับความเห็นชอบจากเพื่อนร่วมงานอย่างเป็นเอกฉันท์ อย่างไรก็ตาม เมื่อมีวิธีการวิเคราะห์ที่แม่นยำมากขึ้นเรื่อย ๆ นักวิทยาศาสตร์ก็เริ่มมั่นใจมากขึ้นในความจริงของคำเหล่านี้
เนื่องจากสิ่งมีชีวิตทุกชนิดสัมผัสกันอย่างใกล้ชิด สิ่งแวดล้อมจากนั้นแต่ละรายการควรมีองค์ประกอบทางเคมีส่วนใหญ่ของตารางธาตุหากไม่ใช่ทั้งหมด ตัวอย่างเช่น ในร่างกายมนุษย์ที่เป็นผู้ใหญ่ เศษส่วนมวล สารอนินทรีย์คือ 6% ในบรรดาโลหะ สารประกอบเหล่านี้ประกอบด้วย Mg, Ca, Na, K เอนไซม์หลายชนิดและสารประกอบอินทรีย์ออกฤทธิ์ทางชีวภาพอื่นๆ ในร่างกายของเราประกอบด้วย V, Mn, Fe, Cu, Zn, Co, Ni, Mo, Cr และโลหะอื่นๆ บางชนิด
ร่างกายของผู้ใหญ่ประกอบด้วยโพแทสเซียมไอออนโดยเฉลี่ยประมาณ 140 กรัม และโซเดียมไอออนประมาณ 100 กรัม สำหรับอาหาร เราบริโภคโพแทสเซียมไอออนทุกวันตั้งแต่ 1.5 กรัมถึง 7 กรัม และโซเดียมไอออนตั้งแต่ 2 กรัมถึง 15 กรัม ความต้องการโซเดียมไอออนมีมากจนต้องเติมลงในอาหารเป็นพิเศษ การสูญเสียโซเดียมไอออนอย่างมีนัยสำคัญ (ในรูปของ NaCl ในปัสสาวะและเหงื่อ) ส่งผลเสียต่อสุขภาพของมนุษย์ ดังนั้นในช่วงอากาศร้อนแพทย์แนะนำให้ดื่ม น้ำแร่. อย่างไรก็ตาม ปริมาณเกลือที่มากเกินไปในอาหารก็ส่งผลเสียต่อการทำงานของร่างกายเช่นกัน อวัยวะภายใน(โดยหลักคือหัวใจและไต)
คุณต้องเปิดใช้งาน JavaScript เพื่อลงคะแนนและสารประกอบเคมีอื่นๆ เพื่อให้ได้โลหะบริสุทธิ์และการใช้งานต่อไป จำเป็นต้องแยกโลหะออกจากแร่และดำเนินการทำให้บริสุทธิ์ หากจำเป็นให้ดำเนินการ ยาสลบและการแปรรูปโลหะอื่นๆ วิทยาศาสตร์กำลังศึกษาสิ่งนี้ โลหะวิทยา. โลหะวิทยาแยกแยะแร่ของโลหะเหล็ก (ขึ้นอยู่กับ ต่อม) และอโลหะ (ไม่มีธาตุเหล็ก มีธาตุเพียงประมาณ 70 ธาตุเท่านั้น) ทอง เงิน และ แพลทินัมยังนำไปใช้กับ โลหะมีค่า (มีเกียรติ) . นอกจากนี้ยังมีอยู่ในปริมาณเล็กน้อยในน้ำทะเล พืช และสิ่งมีชีวิต (มีบทบาทสำคัญใน)
เป็นที่รู้กันว่าร่างกายมนุษย์ประกอบด้วย 3% โลหะ. ที่สุดในของเรา เซลล์ แคลเซียมและ โซเดียม, เข้มข้นใน ระบบน้ำเหลือง. แมกนีเซียมสะสมอยู่ใน กล้ามเนื้อและ ระบบประสาท , ทองแดง- วี ตับ , เหล็ก- วี เลือด.
การผลิต
โลหะมักถูกสกัดจากพื้นดินโดยการขุด และแร่ที่ได้นั้นให้แหล่งธาตุที่จำเป็นค่อนข้างมาก เพื่อระบุตำแหน่งของแร่ จะใช้วิธีการค้นหาพิเศษ รวมถึงการสำรวจแร่และการวิจัยแหล่งสะสม เงินฝากมักจะแบ่งออกเป็น อาชีพ(การขุดแร่บนผิวดิน) โดยการขุดจะดำเนินการโดยการขุดดินโดยใช้เครื่องมือหนักรวมทั้งการขุดใต้ดิน เหมือง.
โลหะมักจะถูกสกัดจากแร่ที่ขุดได้โดยใช้สารเคมีหรืออิเล็กโทรไลต์รีดิวซ์ ใน ไพโรเมทัลวิทยาใช้ในการแปลงแร่เป็นวัตถุดิบโลหะ อุณหภูมิสูง, วี วิทยาโลหะวิทยาเคมีในน้ำใช้เพื่อจุดประสงค์เดียวกัน วิธีการที่ใช้จะขึ้นอยู่กับชนิดของโลหะและชนิดของการปนเปื้อน
เมื่อแร่โลหะเป็นสารประกอบไอออนิกของโลหะและไม่ใช่โลหะ แร่โลหะมักจะถูกนำไปถลุง - ให้ความร้อนด้วยตัวรีดิวซ์ - เพื่อสกัดโลหะบริสุทธิ์ โลหะทั่วไปหลายชนิดเช่น เหล็กละลายโดยใช้เป็นตัวรีดิวซ์ คาร์บอน(ได้มาจากการเผาไหม้ถ่านหิน) โลหะบางชนิดเช่น อลูมิเนียมและ โซเดียมไม่มีสารรีดิวซ์ที่เหมาะสมทางเศรษฐกิจเพียงตัวเดียวและสกัดโดยใช้ กระแสไฟฟ้า.
ความแข็งของโลหะบางชนิดในระดับ Mohs:
| ความแข็ง | โลหะ |
|---|---|
| 0.2 | ซีเซียม |
| 0.3 | รูบิเดียม |
| 0.4 | โพแทสเซียม |
| 0.5 | โซเดียม |
| 0.6 | ลิเธียม |
| 1.2 | อินเดียม |
| 1.2 | แทลเลียม |
| 1.25 | แบเรียม |
| 1.5 | ธาตุโลหะชนิดหนึ่ง |
| 1.5 | แกลเลียม |
| 1.5 | ดีบุก |
| 1.5 | ตะกั่ว |
| 1.5 | |
| 1.75 | แคลเซียม |
| 2.0 | แคดเมียม |
| 2.25 | บิสมัท |
| 2.5 | แมกนีเซียม |
| 2.5 | สังกะสี |
| 2.5 | แลนทานัม |
| 2.5 | เงิน |
| 2.5 | ทอง |
| 2.59 | อิตเทรียม |
| 2.75 | อลูมิเนียม |
| 3.0 | ทองแดง |
| 3.0 | พลวง |
| 3.0 | ทอเรียม |
| 3.17 | สแกนเดียม |
| 3.5 | แพลตตินัม |
| 3.75 | โคบอลต์ |
| 3.75 | แพลเลเดียม |
| 3.75 | เซอร์โคเนียม |
| 4.0 | เหล็ก |
| 4.0 | นิกเกิล |
| 4.0 | ฮาฟเนียม |
| 4.0 | แมงกานีส |
| 4.5 | วาเนเดียม |
| 4.5 | โมลิบดีนัม |
| 4.5 | โรเดียม |
| 4.5 | ไทเทเนียม |
| 4.75 | ไนโอเบียม |
| 5.0 | อิริเดียม |
| 5.0 | รูทีเนียม |
| 5.0 | แทนทาลัม |
| 5.0 | เทคนีเชียม |
| 5.0 | โครเมียม |
| 5.5 | เบริลเลียม |
| 5.5 | ออสเมียม |
| 5.5 | รีเนียม |
| 6.0 | ทังสเตน |
| 6.0 | β-ยูเรเนียม |
เนื่องจากการสูญเสียอิเล็กตรอนได้ง่ายจึงอาจเกิดปฏิกิริยาออกซิเดชันของโลหะซึ่งอาจนำไปสู่ การกัดกร่อนและคุณสมบัติเสื่อมโทรมลงไปอีก ความสามารถในการออกซิไดซ์สามารถรับรู้ได้จากชุดกิจกรรมมาตรฐานของโลหะ ข้อเท็จจริงนี้ยืนยันถึงความจำเป็นในการใช้โลหะร่วมกับองค์ประกอบอื่น ๆ ( โลหะผสมที่สำคัญที่สุดคือ เหล็ก) การผสมและการใช้สารเคลือบต่างๆ
จำเป็นต้องใช้คำอธิบายคุณสมบัติทางอิเล็กทรอนิกส์ของโลหะที่ถูกต้องยิ่งขึ้น กลศาสตร์ควอนตัม. ในของแข็งทั้งหมดได้อย่างเพียงพอ สมมาตรระดับพลังงานของอิเล็กตรอนของแต่ละอะตอมทับซ้อนกันและก่อตัวเป็นแถบที่อนุญาต และแถบที่เกิดจากเวเลนซ์อิเล็กตรอนเรียกว่า วงวาเลนซ์. การเชื่อมต่อที่อ่อนแอของเวเลนซ์อิเล็กตรอนในโลหะนำไปสู่ความจริงที่ว่าแถบเวเลนซ์ในโลหะนั้นกว้างมากและอิเล็กตรอนทั้งหมดไม่เพียงพอที่จะเติมให้เต็ม
คุณลักษณะพื้นฐานของโซนที่มีการเติมบางส่วนคือแม้จะใช้แรงดันไฟฟ้าขั้นต่ำ การจัดเรียงเวเลนซ์อิเล็กตรอนใหม่ก็เริ่มต้นขึ้นในตัวอย่าง เช่น การไหล ไฟฟ้า.
ความคล่องตัวสูงของอิเล็กตรอนทำให้มีการนำความร้อนสูง เช่นเดียวกับความสามารถในการสะท้อนรังสีแม่เหล็กไฟฟ้าด้วยแสง (ซึ่งทำให้โลหะมีความเงางามเป็นพิเศษ)
โลหะบางชนิด
- ปอด:
- อื่น:
การประยุกต์ใช้โลหะ
วัสดุก่อสร้าง
วัสดุเครื่องมือ
ประวัติความเป็นมาของการพัฒนาแนวคิดเกี่ยวกับโลหะ
ความใกล้ชิดของมนุษย์กับโลหะเริ่มต้นด้วย ทอง , เงินและ ทองแดงนั่นคือจากโลหะที่พบในสถานะอิสระบนพื้นผิวโลก ต่อมาก็เชื่อมเข้าด้วยกันด้วยโลหะที่มีการกระจายอย่างกว้างขวางในธรรมชาติและแยกออกจากสารประกอบได้ง่าย: ดีบุก , ตะกั่ว , เหล็กและ . โลหะทั้งเจ็ดนี้คุ้นเคยกับมนุษยชาติในสมัยโบราณ ในบรรดาสิ่งประดิษฐ์ของอียิปต์โบราณมีสิ่งของที่เป็นทองคำและทองแดงซึ่งตามข้อมูลบางส่วนมีอายุย้อนกลับไปถึงยุค 3,000-4,000 ปีที่แยกออกจากยุคปัจจุบัน จ.
โลหะทั้งเจ็ดที่รู้จักมีอยู่แล้วเท่านั้น วัยกลางคนเพิ่มขึ้น สังกะสี , บิสมัท , พลวงและเมื่อต้นศตวรรษที่ 18 สารหนู. ตั้งแต่กลางศตวรรษที่ 18 จำนวนโลหะที่ค้นพบเพิ่มขึ้นอย่างรวดเร็วและเมื่อต้นศตวรรษที่ 20 ก็มีจำนวนถึง 65 และเมื่อต้นศตวรรษที่ 21 - สูงถึง 96
ไม่มีอุตสาหกรรมเคมีใดมีส่วนช่วยในการพัฒนาความรู้ทางเคมีมากเท่ากับกระบวนการที่เกี่ยวข้องกับการผลิตและการแปรรูปโลหะ ช่วงเวลาที่สำคัญที่สุดในประวัติศาสตร์เคมีเชื่อมโยงกับประวัติศาสตร์ของพวกเขา คุณสมบัติของโลหะมีลักษณะเฉพาะที่ในยุคแรกสุด ทองคำ เงิน ทองแดง ตะกั่ว ดีบุก เหล็ก และปรอท ประกอบไปด้วยกลุ่มสารที่เป็นเนื้อเดียวกันตามธรรมชาติกลุ่มหนึ่ง และแนวคิดของ "โลหะ" หมายถึงแนวคิดทางเคมีที่เก่าแก่ที่สุด อย่างไรก็ตาม มุมมองเกี่ยวกับธรรมชาติของพวกเขามีไม่มากก็น้อย แบบฟอร์มบางอย่างปรากฏเฉพาะในยุคกลางเท่านั้น นักเล่นแร่แปรธาตุ. ความจริงความคิด อริสโตเติลเกี่ยวกับธรรมชาติ: การก่อตัวของทุกสิ่งที่มีอยู่จากธาตุทั้งสี่ (ไฟ ดิน น้ำ และอากาศ) จึงบ่งบอกถึงความซับซ้อนของโลหะอยู่แล้ว แต่แนวคิดเหล่านี้คลุมเครือและเป็นนามธรรมเกินไป สำหรับนักเล่นแร่แปรธาตุ แนวคิดเรื่องความซับซ้อนของโลหะและด้วยเหตุนี้ ความเชื่อในความสามารถในการเปลี่ยนโลหะบางชนิดให้เป็นโลหะอื่น เพื่อสร้างโลหะเทียมขึ้นมา ถือเป็นแนวคิดหลักของโลกทัศน์ของพวกเขา แนวคิดนี้เป็นข้อสรุปโดยธรรมชาติจากข้อเท็จจริงจำนวนมากที่เกี่ยวข้องกับการเปลี่ยนแปลงทางเคมีของโลหะที่สะสมในช่วงเวลานั้น ในความเป็นจริง การเปลี่ยนโลหะให้เป็นออกไซด์แตกต่างอย่างสิ้นเชิงจากการเผาอย่างง่ายในอากาศและการคืนโลหะจากออกไซด์ การแยกโลหะบางชนิดออกจากโลหะอื่น การก่อตัวของโลหะผสมที่มีคุณสมบัติแตกต่างจากโลหะที่นำมาแต่แรก และอื่น ๆ - ทั้งหมดนี้ดูเหมือนจะต้องชี้ให้เห็นถึงความซับซ้อนของธรรมชาติของพวกเขา
สำหรับการเปลี่ยนโลหะให้เป็นทองคำอย่างแท้จริง ความเชื่อในความเป็นไปได้นั้นขึ้นอยู่กับข้อเท็จจริงที่มองเห็นได้หลายประการ ในตอนแรก การก่อตัวของโลหะผสมที่มีสีคล้ายกับทอง เช่น จากทองแดงและสังกะสี ในสายตาของนักเล่นแร่แปรธาตุนั้นได้เปลี่ยนเป็นทองคำแล้ว สำหรับพวกเขาดูเหมือนว่าจำเป็นต้องเปลี่ยนสีเท่านั้น และคุณสมบัติของโลหะก็จะแตกต่างออกไปด้วย โดยเฉพาะอย่างยิ่ง การทดลองที่ดำเนินการไม่ดี เมื่อมีการใช้สารที่มีส่วนผสมของทองคำนี้เพื่อเปลี่ยนโลหะฐานให้เป็นทองคำ มีส่วนอย่างมากต่อความเชื่อนี้ ตัว อย่าง เช่น เมื่อ ปลาย ศตวรรษ ที่ 18 เภสัชกร ชาว โคเปนเฮเกน คน หนึ่ง รับรอง ว่า เงิน บริสุทธิ์ ทาง เคมี เมื่อ ผสมกับ สารหนู จะ กลาย เป็น ทอง ได้ บางส่วน. ข้อเท็จจริงนี้ได้รับการยืนยันจากนักเคมีชื่อดัง กีตอง เดอ มอร์โวและทำเสียงดังมาก ในไม่ช้าก็พบว่าสารหนูที่ใช้ในการทดลองมีร่องรอยของเงินและทอง
เนื่องจากโลหะเจ็ดชนิดที่รู้จักในเวลานั้นสามารถผ่านการเปลี่ยนแปลงทางเคมีได้ง่ายกว่า โลหะอื่นๆ ที่ยากกว่า นักเล่นแร่แปรธาตุจึงแบ่งโลหะเหล่านั้นออกเป็นโลหะที่มีเกียรติ - สมบูรณ์แบบ และที่ไม่มีเกียรติ - ไม่สมบูรณ์ ยุคแรกประกอบด้วยทองคำและเงิน ยุคหลังประกอบด้วยทองแดง ดีบุก ตะกั่ว เหล็ก และปรอท หลังซึ่งมีคุณสมบัติของโลหะมีตระกูล แต่ในขณะเดียวกันก็แตกต่างอย่างมากจากโลหะทั้งหมดในสถานะของเหลวและความผันผวนเป็นสิ่งที่น่าสนใจอย่างยิ่งสำหรับนักวิทยาศาสตร์ในยุคนั้นและบางคนก็แยกมันออกมาในกลุ่มพิเศษ ความสนใจที่ดึงดูดได้มากจนปรอทเริ่มถูกมองว่าเป็นหนึ่งในองค์ประกอบที่โลหะก่อตัวขึ้น และถูกมองว่าเป็นผู้ที่มีคุณสมบัติของโลหะ นักเล่นแร่แปรธาตุยอมรับการดำรงอยู่โดยธรรมชาติของการเปลี่ยนโลหะบางชนิดไปสู่โลหะอื่นๆ ไม่สมบูรณ์จนสมบูรณ์แบบ นักเล่นแร่แปรธาตุสันนิษฐานว่าภายใต้สภาวะปกติ การเปลี่ยนแปลงนี้ดำเนินไปอย่างช้าๆ เป็นเวลาหลายศตวรรษ และบางทีอาจไม่ใช่โดยปราศจากการมีส่วนร่วมอย่างลึกลับของเทห์ฟากฟ้า ซึ่งเช่นนั้น มีบทบาทสำคัญในชะตากรรมของมนุษย์ในเวลานั้น บังเอิญมีโลหะเจ็ดชนิดที่รู้จักในเวลานั้น เช่นเดียวกับดาวเคราะห์เจ็ดดวงที่รู้จัก และนี่ยังบ่งบอกถึงความเชื่อมโยงลึกลับระหว่างทั้งสองอีกด้วย ในบรรดานักเล่นแร่แปรธาตุ โลหะมักถูกเรียกว่าดาวเคราะห์ มันเรียกว่าทองคำ ดวงอาทิตย์, เงิน - ดวงจันทร์, ทองแดง - ดาวศุกร์, ดีบุก - ดาวพฤหัสบดี, ตะกั่ว - ดาวเสาร์, เหล็ก - ดาวอังคารและปรอท - ปรอท. เมื่อค้นพบสังกะสี บิสมัท พลวง และสารหนู วัตถุมีความคล้ายคลึงกับโลหะทุกประการ แต่ในคุณสมบัติที่เป็นลักษณะเฉพาะที่สุดของโลหะ ความอ่อนตัวได้นั้นได้รับการพัฒนาได้ไม่ดี พวกมันจึงถูกจัดสรรให้กับกลุ่มพิเศษ - กึ่งโลหะ. การแบ่งโลหะออกเป็นโลหะที่เหมาะสมและกึ่งโลหะมีมาตั้งแต่กลางศตวรรษที่ 18
การกำหนดองค์ประกอบของโลหะในตอนแรกนั้นเป็นเพียงการเก็งกำไรเท่านั้น ในตอนแรกนักเล่นแร่แปรธาตุยอมรับว่าพวกมันถูกสร้างขึ้นจากสององค์ประกอบ - และ กำมะถัน. ไม่ทราบที่มาของมุมมองนี้ มีอยู่แล้วในศตวรรษที่ 8 โดย เกเบอร์ข้อพิสูจน์ว่ามีปรอทอยู่ในโลหะก็คือว่ามันละลาย และในสารละลายเหล่านี้ ความเป็นตัวตนของพวกมันก็หายไป และถูกดูดซับโดยปรอท ซึ่งจะไม่เกิดขึ้นหากไม่มีหลักการทั่วไปเกี่ยวกับปรอท นอกจากนี้ปรอทและตะกั่วยังผลิตสิ่งที่คล้ายกับดีบุกอีกด้วย สำหรับกำมะถันนั้นบางทีอาจถูกนำมาใช้เพราะรู้จักสารประกอบกำมะถัน รูปร่าง คล้ายกับโลหะ ในอนาคต แนวคิดง่ายๆ เหล่านี้อาจเนื่องมาจากความพยายามในการรับโลหะเทียมไม่สำเร็จ กลายเป็นเรื่องซับซ้อนและสับสนอย่างมาก ตัวอย่างเช่นในแนวคิดของนักเล่นแร่แปรธาตุในศตวรรษที่ X-XIII ปรอทและกำมะถันที่ใช้สร้างโลหะนั้นไม่ใช่ปรอทและกำมะถันแบบเดียวกับที่นักเล่นแร่แปรธาตุมีอยู่ในมือ มันเป็นเพียงสิ่งที่คล้ายกับพวกเขาซึ่งมีคุณสมบัติพิเศษ สิ่งที่มีอยู่จริงในกำมะถันและปรอทธรรมดานั้นแสดงออกมาในพวกมันมากกว่าในร่างกายอื่น ๆ ภายใต้ปรอทซึ่งเป็นส่วนหนึ่งขององค์ประกอบของโลหะ พวกมันเป็นตัวแทนของบางสิ่งบางอย่างที่กำหนดความไม่เปลี่ยนรูป ความแวววาวของโลหะ ความเหนียว กล่าวอีกนัยหนึ่งว่าเป็นพาหะของรูปลักษณ์โลหะ ซัลเฟอร์หมายถึงการเป็นพาหะของความแปรปรวน การสลายตัว และการติดไฟของโลหะ องค์ประกอบทั้งสองนี้พบได้ในโลหะในสัดส่วนที่ต่างกัน และดังที่พวกเขากล่าวไปแล้ว ได้รับการแก้ไขด้วยวิธีที่ต่างกัน นอกจากนี้อาจมีความบริสุทธิ์ที่แตกต่างกันไป ตัวอย่างเช่นตาม Geber ทองคำประกอบด้วยปรอทจำนวนมากและกำมะถันจำนวนเล็กน้อยซึ่งมีความบริสุทธิ์สูงสุดและคงที่มากที่สุด ในทางกลับกันในดีบุกกลับมีกำมะถันและปรอทจำนวนมากซึ่งไม่บริสุทธิ์คงสภาพไม่ดี ฯลฯ แน่นอนว่าพวกเขาต้องการแสดงทัศนคติที่แตกต่างกันของโลหะต่อสารเคมีที่ทรงพลังเพียงชนิดเดียวในเวลานั้นนั่นคือไฟ ด้วยการพัฒนามุมมองเหล่านี้ต่อไป องค์ประกอบสองประการ - ปรอทและกำมะถัน - ดูเหมือนจะไม่เพียงพอสำหรับนักเล่นแร่แปรธาตุที่จะอธิบายองค์ประกอบของโลหะ เติมเกลือลงไปและมีสารหนูอยู่บ้าง ด้วยเหตุนี้ พวกเขาต้องการชี้ให้เห็นว่าในระหว่างการเปลี่ยนแปลงของโลหะทั้งหมด บางสิ่งที่ไม่ระเหยและถาวรจะยังคงอยู่ หากโดยธรรมชาติแล้ว “การเปลี่ยนแปลงของโลหะฐานให้เป็นโลหะมีตระกูลใช้เวลาหลายศตวรรษ” นักเล่นแร่แปรธาตุก็พยายามสร้างเงื่อนไขที่กระบวนการปรับปรุงและการสุกจะดำเนินไปอย่างรวดเร็วและง่ายดาย เนื่องจากความสัมพันธ์ที่ใกล้ชิดระหว่างเคมีกับการแพทย์และชีววิทยาในเวลานั้น แนวคิดเรื่องการเปลี่ยนแปลงของโลหะจึงถูกระบุโดยธรรมชาติกับแนวคิดเรื่องการเติบโตและการพัฒนาของร่างกายที่มีการจัดระเบียบ: การเปลี่ยนแปลง สำหรับ ตัวอย่างตะกั่วเป็นทองคำการก่อตัวของพืชจากเมล็ดพืชที่ถูกโยนลงดินและในขณะที่มันสลายตัวการหมักการรักษาอวัยวะที่เป็นโรคในบุคคล - ทั้งหมดนี้เป็นปรากฏการณ์ส่วนตัวของกระบวนการชีวิตลึกลับทั่วไปหนึ่งกระบวนการการปรับปรุง และเกิดจากสิ่งเร้าเดียวกัน จากที่นี่เป็นที่ประจักษ์ชัดในตัวเองว่าหลักการลึกลับซึ่งทำให้สามารถรับทองคำได้นั้นควรจะรักษาโรค เปลี่ยนร่างกายมนุษย์เก่าให้เป็นเด็ก และอื่นๆ นี่คือที่มาของแนวคิดเกี่ยวกับศิลาปราชญ์ผู้วิเศษ
เกี่ยวกับบทบาท ศิลาอาถรรพ์ในการเปลี่ยนโลหะฐานให้เป็นโลหะมีเกียรติ ที่สำคัญที่สุดคือคำแนะนำเกี่ยวกับการเปลี่ยนเป็นทองคำ ไม่ค่อยมีใครพูดถึงการผลิตเงิน ตามที่ผู้เขียนบางคนกล่าวว่าศิลาอาถรรพ์คนเดียวกันเปลี่ยนโลหะเป็นเงินและทอง ตามที่กล่าวไว้ สารนี้มีสองประเภท: ประเภทหนึ่งสมบูรณ์แบบ อีกประเภทหนึ่งสมบูรณ์แบบน้อยกว่า และประเภทหลังทำหน้าที่ผลิตเงิน เกี่ยวกับปริมาณศิลาอาถรรพ์ที่จำเป็นสำหรับการเปลี่ยนแปลง คำแนะนำก็แตกต่างกันเช่นกัน ตามที่กล่าวไว้บางส่วน 1 ส่วนหนึ่งของสามารถเปลี่ยนโลหะได้ 10,000,000 ชิ้นส่วนให้เป็นทองคำตามที่ส่วนอื่น ๆ - 100 ส่วนและมีเพียง 2 ส่วนเท่านั้น เพื่อให้ได้ทองคำพวกเขาละลายโลหะพื้นฐานหรือเอาปรอทแล้วโยนศิลาของปราชญ์ไปที่นั่น บางคนมั่นใจว่าการเปลี่ยนแปลงจะเกิดขึ้นทันที ในขณะที่บางคนมั่นใจว่าการเปลี่ยนแปลงจะเกิดขึ้นทีละน้อย มุมมองเหล่านี้เกี่ยวกับธรรมชาติของโลหะและความสามารถในการเปลี่ยนรูปโดยทั่วไปมีมานานหลายศตวรรษจนถึงศตวรรษที่ 17 เมื่อพวกเขาเริ่มปฏิเสธทั้งหมดนี้อย่างรุนแรง โดยเฉพาะอย่างยิ่งเมื่อมุมมองเหล่านี้ก่อให้เกิดการเกิดขึ้นของผู้หลอกลวงจำนวนมากที่แสวงประโยชน์จากความหวังของ ใจง่ายที่จะได้ทอง ฉันมีปัญหากับความคิดของนักเล่นแร่แปรธาตุเป็นพิเศษ บอยล์“ฉันอยากจะรู้” เขากล่าวในที่เดียว “ทองคำสามารถแตกตัวเป็นปรอท กำมะถัน และเกลือได้อย่างไร ฉันพร้อมที่จะจ่ายค่าประสบการณ์นี้แล้ว สำหรับฉันฉันไม่สามารถบรรลุเป้าหมายนี้ได้”
หลังจากหลายศตวรรษของความพยายามที่ไร้ผลเพื่อให้ได้โลหะเทียมและด้วยจำนวนข้อเท็จจริงที่สะสมในศตวรรษที่ 17 เช่นเกี่ยวกับบทบาทของอากาศในการเผาไหม้การเพิ่มขึ้นของน้ำหนักของโลหะในระหว่างการออกซิเดชั่นซึ่งยังคงอยู่ เป็นที่รู้จัก เกเบอร์ในศตวรรษที่ 8 คำถามเกี่ยวกับองค์ประกอบองค์ประกอบของโลหะดูเหมือนจะใกล้จะจบลงแล้ว แต่กระแสใหม่ปรากฏในวิชาเคมีซึ่งเป็นผลมาจากทฤษฎีโฟลจิสตันและการแก้ปัญหานี้ก็ล่าช้าออกไปอีกเป็นเวลานาน
นักวิทยาศาสตร์ในยุคนั้นสนใจปรากฏการณ์การเผาไหม้เป็นอย่างมาก ตามแนวคิดพื้นฐานของปรัชญาในเวลานั้นว่าความคล้ายคลึงกันในคุณสมบัติของวัตถุควรมาจากความเหมือนกันของหลักการและองค์ประกอบที่รวมอยู่ในองค์ประกอบของพวกเขา เป็นที่ยอมรับกันว่าวัตถุที่ติดไฟได้นั้นมีองค์ประกอบร่วมกัน การเผาไหม้ถือเป็นการกระทำของการสลายตัวการแตกตัวเป็นองค์ประกอบ ในกรณีนี้องค์ประกอบการติดไฟถูกปล่อยออกมาในรูปของเปลวไฟในขณะที่ส่วนที่เหลือยังคงอยู่ ด้วยการยอมรับมุมมองของนักเล่นแร่แปรธาตุเกี่ยวกับการก่อตัวของโลหะจากธาตุทั้งสาม ได้แก่ ปรอท ซัลเฟอร์ และเกลือ และการยอมรับการมีอยู่จริงของพวกมันในโลหะ ซัลเฟอร์จึงต้องได้รับการยอมรับว่าเป็นหลักการที่ติดไฟได้ จากนั้นส่วนประกอบอื่นของโลหะจะต้องได้รับการยอมรับอย่างชัดเจนว่าเป็นสารตกค้างจากการเผาโลหะ - "ดิน" ตามที่พวกเขากล่าวไว้ ดังนั้นปรอทจึงไม่เกี่ยวอะไรกับมัน ในทางกลับกัน กำมะถันจะเผาไหม้เข้าไป กรดซัลฟูริกซึ่งหลายคนพิจารณาจากสิ่งที่กล่าวมาข้างต้นว่าเป็นวัตถุที่เรียบง่ายกว่ากำมะถันและรวมไว้ในวัตถุเบื้องต้น เกิดความสับสนและขัดแย้งกัน เบเชอร์เพื่อที่จะประสานแนวคิดเก่ากับแนวคิดใหม่ จึงยอมรับการมีอยู่ของดินสามประเภทในโลหะ: “ดิน” เอง “ดินไวไฟ” และ “ดินปรอท” ภายใต้เงื่อนไขเหล่านี้ สตาห์ลเสนอทฤษฎีของเขา ในความเห็นของเขา แหล่งที่มาของความไวไฟไม่ใช่กำมะถันหรือสารอื่นใดที่รู้จัก แต่เป็นสิ่งที่ไม่ทราบซึ่งเขาเรียกว่า โฟลจิสตัน. โลหะน่าจะเกิดจากโฟลจิสตันและดิน การเผาโลหะในอากาศจะมาพร้อมกับการปล่อย phlogiston; การกลับมาของโลหะจากโลกของเขาด้วยความช่วยเหลือของถ่านหินซึ่งเป็นสารที่อุดมไปด้วยโฟลจิสตัน - เป็นการรวมโฟลจิสตันเข้ากับโลก แม้ว่าจะมีโลหะหลายชนิดและแต่ละชนิดก็ให้โลกของตัวเองเมื่อจุดติดไฟ แต่โลหะชนิดหลังนั้นเป็นองค์ประกอบเดียว ดังนั้นส่วนประกอบของโลหะนี้จึงมีลักษณะสมมุติฐานเหมือนกับโฟลจิสตัน อย่างไรก็ตาม บางครั้งสาวกของสตาห์ลก็ยอมรับ "ดินพื้นฐาน" มากพอๆ กับโลหะ เมื่อไร คาเวนดิชเมื่อละลายโลหะในกรดที่ได้รับ ไฮโดรเจนและตรวจสอบคุณสมบัติของมัน (ไม่สามารถรองรับการเผาไหม้ การระเบิดของมันเมื่อผสมกับอากาศ ฯลฯ) เขาจำได้ว่ามันเป็น phlogiston ของ Stahl; โลหะตามแนวคิดของเขาประกอบด้วยไฮโดรเจนและ "โลก" มุมมองนี้ได้รับการยอมรับจากผู้ติดตามทฤษฎีโฟลจิสตันจำนวนมาก
แม้จะมีความสอดคล้องกันอย่างชัดเจนของทฤษฎีโฟลจิสตัน แต่ก็มีข้อเท็จจริงสำคัญที่ไม่สามารถเชื่อมโยงกับทฤษฎีนี้ได้ Geber รู้ด้วยว่าโลหะจะมีน้ำหนักเพิ่มขึ้นเมื่อถูกยิง ในขณะเดียวกัน ตามข้อมูลของ Stahl พวกเขาจะต้องสูญเสีย phlogiston: เมื่อ phlogiston ถูกแนบกลับเข้ากับ "โลก" น้ำหนักของโลหะที่ได้จะน้อยกว่าน้ำหนักของ "โลก" ปรากฎว่าโฟลจิสตันต้องมีคุณสมบัติพิเศษบางอย่าง - แรงโน้มถ่วงเชิงลบ แม้จะมีสมมติฐานที่แยบยลทั้งหมดที่ถูกหยิบยกมาเพื่ออธิบายปรากฏการณ์นี้ แต่ก็ไม่สามารถเข้าใจได้และน่าสับสน
เมื่อไร ลาวัวซิเยร์ชี้แจงบทบาทของอากาศในระหว่างการเผาไหม้และแสดงให้เห็นว่าการเพิ่มน้ำหนักของโลหะในระหว่างการเผานั้นมาจากการเติมออกซิเจนจากอากาศไปยังโลหะ และด้วยเหตุนี้จึงเป็นที่ยอมรับว่าการกระทำของการเผาไหม้โลหะไม่ใช่การสลายองค์ประกอบ แต่ ในทางตรงกันข้าม การเชื่อมโยงกัน คำถามเกี่ยวกับความซับซ้อนของโลหะถูกตัดสินในเชิงลบ โลหะถูกจัดประเภทเป็นองค์ประกอบทางเคมีอย่างง่าย เนื่องจากแนวคิดพื้นฐานของลาวัวซิเยร์ที่ว่าวัตถุธรรมดาคือธาตุที่ไม่สามารถแยกวัตถุอื่นออกจากกันได้ ด้วยการสร้างสรรค์ ตารางธาตุขององค์ประกอบทางเคมี เมนเดเลเยฟองค์ประกอบโลหะเข้ามาแทนที่อย่างถูกต้อง
ดูสิ่งนี้ด้วย
หมายเหตุ
ลิงค์
- เอส.พี. วูโคลอฟ: // พจนานุกรมสารานุกรมของ Brockhaus และ Efron: จำนวน 86 เล่ม (82 เล่ม และ พิเศษ 4 เล่ม) - เซนต์ปีเตอร์สเบิร์ก. , พ.ศ. 2433-2450.(ส่วนประวัติศาสตร์)
| ตารางธาตุ | |
|---|---|
| ดมิตรี อิวาโนวิช เมนเดเลเยฟ · กฎหมายเป็นระยะ · กลุ่มขององค์ประกอบ | |
| รูปแบบ | สั้น· โดยบล็อก · ขยาย· ขยายใหญ่ขึ้น · การกำหนดค่าทางอิเล็กทรอนิกส์ · อิเล็กโทรเนกาติวีตี้ · ทางเลือก · ไอโซโทปของธาตุ |
| รายการองค์ประกอบโดย | ชื่อ ·
นิรุกติศาสตร์(เพื่อเป็นเกียรติแก่สถานที่เพื่อเป็นเกียรติแก่ผู้ค้นพบ) · เวลาเปิดทำการ สถานะออกซิเดชัน · ความชุก (ในมนุษย์) ความเสถียรของไอโซโทป |


