27.07.2019
1 โลหะอัลคาไล คุณรู้ไหมว่าทำอย่างไร
สรุปบทเรียนเคมีชั้นประถมศึกษาปีที่ 9 ในหัวข้อ:
« การเชื่อมต่อ โลหะอัลคาไลและการประยุกต์ใช้ของพวกเขา"
เป้าหมาย: สรุปและจัดระบบความรู้เกี่ยวกับโลหะอัลคาไลและสารประกอบ ทำความคุ้นเคยกับการใช้สารประกอบเหล่านี้ในชีวิตประจำวันและการผลิตซึ่งมีความสำคัญต่อชีวิตของสิ่งมีชีวิต
วัตถุประสงค์ของบทเรียน:
1. ในระหว่างบทเรียน ต้องแน่ใจว่าการดูดซึมคุณสมบัติทางเคมีของสารประกอบโลหะอัลคาไล การใช้ในชีวิตประจำวันและการผลิต และความสำคัญในชีวิตของสิ่งมีชีวิต
พัฒนาทักษะการศึกษาทั่วไปและทักษะในการทำงานกับสารเคมีต่อไป
2. การก่อตัวของแนวคิดเชิงอุดมการณ์พื้นฐานของความสัมพันธ์ระหว่างเหตุและผลระหว่างปรากฏการณ์โครงสร้างของอะตอมของโลหะอัลคาไล - คุณสมบัติของสารอย่างง่าย - คุณสมบัติของสารประกอบโลหะอัลคาไลและการประยุกต์ตามคุณสมบัติ
3.พัฒนาความสามารถในการเปรียบเทียบ สรุปข้อเท็จจริงที่กำลังศึกษา และแสดงความคิดเห็นอย่างมีเหตุผลเมื่อตอบคำถาม เพื่อพัฒนาความสนใจทางปัญญาของเด็กนักเรียนโดยใช้ข้อมูลเกี่ยวกับการประยุกต์ใช้ปรากฏการณ์ที่กำลังศึกษาในชีวิตรอบตัวพวกเขา
ประเภทบทเรียน: รวม - การเรียนรู้เนื้อหาใหม่โดยใช้ ICT
อุปกรณ์: หนังสือเรียน ชอล์ก กระดานดำ คอมพิวเตอร์ เครื่องฉายสื่อ หน้าจอ การนำเสนอหัวข้อบทเรียน การ์ดเทคโนโลยีบทเรียนสำหรับนักเรียน สารเคมี (สารละลาย: โซเดียมไฮดรอกไซด์ กรดไฮโดรคลอริก คอปเปอร์ซัลเฟต ซิงค์ไฮดรอกไซด์ ฟีนอล์ฟทาลีน) และเครื่องแก้วในห้องปฏิบัติการ (ชั้นวาง ด้วยหลอดทดลอง)
ในระหว่างเรียน
ฉัน .เวลาจัดงาน.
ครั้งที่สอง . การเรียนรู้เนื้อหาใหม่
1.ตรวจสอบวัสดุที่ศึกษาก่อนหน้านี้ในหัวข้อ “โลหะอัลคาไล”
เดาปริศนา:
1. โดยปกติจะเก็บไว้ในน้ำมันก๊าดและไหลผ่านน้ำ
ในธรรมชาติจงจำไว้ว่าต่อจากนี้ไป
เขาไม่อยู่ที่ไหนเลยฟรี
สามารถเปิดเป็นเกลือได้
เปลวไฟเปลี่ยนเป็นสีเหลืองจากมัน
และคุณสามารถรับมันได้จากเกลือ
เดวี่ได้มันมาได้ยังไง
เรากำลังพูดถึงองค์ประกอบอะไร? (นา)
2. เขาอดกลั้นอย่างแรง
จากความชื้น - ไฮโดรเจนบริสุทธิ์
มันถูกแทนที่ด้วย
และจับออกซิเจนอย่างแน่นหนา
องค์ประกอบนั้นซ่อนอยู่ในพืช
โดยสีม่วง
มันอาจจะเปิดในเกลือ
เรากำลังพูดถึงองค์ประกอบอะไร? (ถึง).
1.เราคุ้นเคยกับโลหะอะไรบ้างในบทเรียนที่แล้ว?
2.ทำไมถึงเรียกอย่างนั้น?
3. คุณสมบัติทั่วไปในโครงสร้างของอะตอมของโลหะอัลคาไลทั้งหมดคืออะไร?
ทดสอบในหัวข้อ: โลหะอัลคาไล.
1. ข้อมูลต่อไปนี้ใช้ไม่ได้กับโลหะอัลคาไล: ก) รูบิเดียม; ค) โพแทสเซียม; ข) ซีเซียม; ง) ทองแดง
2.สูตรอิเล็กทรอนิกส์) 2) 8) 8) 1 สอดคล้องกับองค์ประกอบ: ก) ลิเธียม; ค) โพแทสเซียม; ข) โซเดียม;
3. รัศมีอะตอมสำหรับองค์ประกอบของกลุ่ม I ของกลุ่มย่อยหลักที่มีประจุนิวเคลียร์เพิ่มขึ้น:
ก) การเปลี่ยนแปลงเป็นระยะ c) ไม่เปลี่ยนแปลง; ข) เพิ่มขึ้น;
4. โลหะอัลคาไลมีความแข็งแรงมาก:
ก) คุณสมบัติออกซิไดซ์; c) คุณสมบัติการบูรณะ; b) คุณสมบัติแอมโฟเทอริก;
5..คุณสมบัติทางกายภาพของโลหะอัลคาไลไม่รวม:
ก) สีเงินขาว; b) นุ่มนวลและเบา; d) วัสดุทนไฟ
6. เมื่อองค์ประกอบของกลุ่ม I ของกลุ่มย่อยหลักมีปฏิกิริยากับน้ำ จะเกิดสิ่งต่อไปนี้:
ก) กรด; b) ปล่อยอัลคาไลและไฮโดรเจนออกมา ง) เกลือ
7. โซเดียมและโพแทสเซียมถูกเก็บไว้ในน้ำมันก๊าดเนื่องจาก:
ก) มีกลิ่นฉุน; b) ถูกออกซิไดซ์ในอากาศได้ง่าย
การควบคุมตนเอง: ไม่มีข้อผิดพลาด – “5”, ข้อผิดพลาด 1.2 – “4”, ข้อผิดพลาด 3 รายการ – “3”, มากกว่า – “2”
คำตอบ: 1- วัน 2 - ค 3 - ข 4 - ค 5 - วัน 6 – ข 7 - ข
การควบคุมตนเอง: ไม่มีข้อผิดพลาด – “5”, ข้อผิดพลาด 1.2 – “4”, ข้อผิดพลาด 3.4 – “3”, มากกว่า – “2”
2.การอัพเดตความรู้.
เป็นไปได้ไหมที่จะพบโลหะอัลคาไลในรูปแบบอิสระในธรรมชาติ? ทำไม
คุณเดาได้ไหมว่าสารประกอบเหล่านี้สามารถพบได้ในธรรมชาติในรูปแบบใด?
ในธรรมชาติโลหะอัลคาไลจะพบได้เฉพาะในรูปของสารประกอบเท่านั้น
Na และ K เกิดขึ้นในธรรมชาติในรูปของคลอไรด์ ซัลเฟต ซิลิเกต ฯลฯ
Li, Rb, Cs พบได้ในแร่ธาตุต่างๆ
Fr เกิดขึ้นในแร่กัมมันตภาพรังสี Ac และ U
บนโต๊ะ: วัตถุที่มีสารประกอบโลหะอัลคาไล (โซดา เกลือ แบตเตอรี่ AA สบู่) และถามคำถาม
ดูวัตถุเหล่านี้ คุณคิดว่าพวกเขามีอะไรเหมือนกัน?
1 ความเชื่อมโยงทางพันธุกรรมคืออะไร?
2. มาสร้างลำดับพันธุกรรมของโซเดียมกันดีกว่า
นา → นา 2 O → 2NaOH → นา 2 CO 3
3. สารประกอบประเภทใดที่ก่อให้เกิดโลหะอัลคาไล? พิจารณาคุณสมบัติของพวกเขา
ขณะที่นักเรียนอธิบายเนื้อหาและดูสไลด์ นักเรียนจะจดบันทึกตามแผน โดยเปิดเผยคุณสมบัติและการใช้งาน
ออกไซด์ของโลหะอัลคาไล
แข็ง ขาว ละลายง่าย
ข) คุณสมบัติทางเคมี; นักเรียนเขียนลงในสมุดบันทึกว่า: ออกไซด์ของโลหะอัลคาไลเป็นออกไซด์พื้นฐานทั่วไป เช่นเดียวกับออกไซด์พื้นฐานทั้งหมด ออกไซด์ของโลหะอัลคาไลทำปฏิกิริยากับน้ำ กับออกไซด์ที่เป็นกรดกับกรด
พวกเขาเขียนสมการปฏิกิริยาเคมีโดยใช้โซเดียมออกไซด์เป็นตัวอย่างบนกระดานและในสมุดบันทึก:
นา 2 O + H 2 O → 2NaOH;
นา 2 O + CO 2 → นา 2 CO 3 ;
นา 2 O + H 2 CO 3 → นา 2 CO 3 + H 2 O
ไฮดรอกไซด์ของโลหะอัลคาไล
.
ก) คุณสมบัติทางกายภาพ นักเรียนจดคุณสมบัติต่อไปนี้ลงในสมุดบันทึก: แข็ง สีขาว ละลายน้ำได้สูง ทนความร้อน กัดกร่อนผ้าและกระดาษ
ข) คุณสมบัติทางเคมี
การบรรยายสรุปด้านความปลอดภัยเมื่อปฏิบัติงานในห้องปฏิบัติการ
คุณสมบัติทางเคมีของโซเดียมไฮดรอกไซด์
วัตถุประสงค์: ทดลองพิสูจน์คุณสมบัติทางเคมีของโลหะอัลคาไลโดยใช้ตัวอย่างของไฮดรอกไซด์โซเดียม
คำแนะนำ
เทโซเดียมไฮดรอกไซด์ลงในหลอดทดลองที่สะอาด และเติมฟีนอล์ฟทาลีนลงไป 2-3 หยด คุณกำลังสังเกตอะไรอยู่?
เพิ่มสารละลายลงในหลอดทดลองเดียวกัน ของกรดไฮโดรคลอริก. คุณกำลังสังเกตอะไรอยู่? เขียนสมการปฏิกิริยา
NaOH + HCl → NaCl + H 2 O พวกเขาเขียนสมการของปฏิกิริยาเคมีในรูปแบบไอออนิกบนกระดานและในสมุดบันทึก
เทโซเดียมไฮดรอกไซด์ลงในหลอดทดลองที่สะอาด และเติมสารละลายคอปเปอร์ซัลเฟต คุณกำลังสังเกตอะไรอยู่? เขียนสมการปฏิกิริยา
2NaOH + CuSO 4 → Na 2 SO 4 + Cu (OH) 2 พวกมันเขียนสมการของปฏิกิริยาเคมีในรูปแบบไอออนิกบนกระดานและในสมุดบันทึก
สรุปเกี่ยวกับคุณสมบัติทางเคมีของไฮดรอกไซด์ของโลหะอัลคาไล
การใช้ไฮดรอกไซด์ของโลหะอัลคาไลทำปฏิกิริยากับกรด, เกลือ) - สไลด์หมายเลข 5
โซเดียมไฮดรอกไซด์ - NaOH - โซดาไฟ, โซดาไฟ, โซดาไฟ
โพแทสเซียมไฮดรอกไซด์ - KOH - โปแตชกัดกร่อน
NaOHและ KOH เป็นด่างกัดกร่อนที่กัดกร่อนผ้าและกระดาษ นักเรียนเขียนลงไปว่า:ศักยภาพการใช้งาน: สำหรับผลิตผ้าไหมเทียม , วี การผลิตสบู่และ SMS เครื่องสำอาง ยารักษาโรค ฯลฯ
เกลือของโลหะอัลคาไล
.
คุณสมบัติทางกายภาพ
. นักเรียนเขียนคุณสมบัติลงในสมุดบันทึก ของแข็งที่เป็นผลึก เกือบทั้งหมดละลายได้ในน้ำ
งานอิสระกับข้อความในตำราเรียน
การสมัคร: กรอกตารางจากสไลด์หมายเลข 5 งานจากตำราเรียนหน้า 56 – 57
สูตรเกลือ
ชื่อ
แอปพลิเคชัน
NaHCO3
K2CO3
โซเดียมคลอไรด์
นา 2 SO 4 ∙ 10 H 2 O
นา 2 CO 3 ∙ 10 H 2 O
ความสำคัญในกิจกรรมชีวิตของสิ่งมีชีวิต - สไลด์หมายเลข 6
สารจากนักเรียนในหัวข้อ: “ความสำคัญของสารประกอบโลหะอัลคาไลในชีวิตของสิ่งมีชีวิต”
โซเดียมและโพแทสเซียมไอออนมีบทบาททางชีววิทยาที่สำคัญ โดย Na + เป็นไอออนภายนอกเซลล์หลักที่พบในเลือดและน้ำเหลือง และ K + เป็นไอออนหลักในเซลล์ "ทำงานด้วยกัน. อัตราส่วนของความเข้มข้นของไอออนเหล่านี้จะควบคุมความดันโลหิตในสิ่งมีชีวิตและรับประกันการเคลื่อนที่ของสารละลายเกลือจากรากไปยังใบพืช โพแทสเซียมไอออน - สนับสนุนการทำงานของกล้ามเนื้อหัวใจ ช่วยรักษาโรคไขข้ออักเสบ และปรับปรุงการทำงานของลำไส้ สารประกอบโพแทสเซียม – ขจัดอาการบวม
วี. การรวมบัญชี
วี. สรุปบทเรียน การทำเครื่องหมาย
สรุปบทเรียน:
คุณสมบัติทางกายภาพและเคมีใดที่เป็นลักษณะของออกไซด์และไฮดรอกไซด์ของโลหะอัลคาไล
โลหะอัลคาไลไฮดรอกไซด์และเกลือใช้ที่ไหน?
วัสดุเพิ่มเติม นี่เป็นสิ่งที่น่าสนใจ
งาน: ทำไมต้องเข้า กรีกโบราณก่อนการสู้รบอันยาวนานท่ามกลางอากาศร้อน มีการแนะนำให้ทหารกินขนมปังเค็มหนักและดื่มน้ำหรือไม่?
ไอออนของอิเล็กโทรไลต์จะชุ่มชื้นได้ง่าย ดังนั้นเกลือแกงจะกักเก็บน้ำไว้ในร่างกาย
ปัญหา: ทำไมเอสกิโมถึงกินเกลือน้อยมาก?
ตามทฤษฎีทางวิทยาศาสตร์ข้อหนึ่ง สัตว์ทุกตัวที่อาศัยอยู่บนโลก รวมทั้งมนุษย์ ล้วนสืบเชื้อสายมาจากสิ่งมีชีวิตที่ปรากฏตัวและอาศัยอยู่ในทะเล ของเหลวในร่างกายของสิ่งมีชีวิตเหล่านี้เป็นส่วนประกอบของน้ำทะเล เมื่อย้ายขึ้นบกแล้ว พวกเขากักเก็บน้ำทะเลไว้เป็นของเหลวในร่างกาย แต่ธรรมชาติไม่สามารถให้เกลือในรูปแบบธรรมชาติแก่สิ่งมีชีวิตในปริมาณที่เพียงพอ เนื่องจากเกลือละลายในน้ำ เกลือส่วนใหญ่จึงถูกชะล้างออกจากดินด้วยน้ำฝนลงสู่แม่น้ำ ทะเล และมหาสมุทร ส่งผลให้พืชที่ปลูกบนพื้นดินมีเกลือไม่เพียงพอ นี่คือสาเหตุที่สัตว์กินพืชต้องการเกลือ ร่างกายสูญเสียของเหลวที่มีเกลือจำนวนหนึ่งทุกวัน และอาหารจากพืชไม่สามารถเติมเต็มได้ สัตว์ที่กินสัตว์อื่นไม่ต้องการเกลือเพิ่มเติม พวกเขาได้รับเกลือที่ต้องการจากร่างของเหยื่อ ชาวเอสกิโมกินเนื้อสัตว์เป็นหลัก ดังนั้นความต้องการเกลือจึงมีน้อยมาก
วัตถุประสงค์: เหตุใดอัตราการเสียชีวิตจากโรคหลอดเลือดสมองในอังกฤษจึงลดลงในช่วงไม่กี่ทศวรรษที่ผ่านมา
เนื่องจากการบริโภคผักและผลไม้สดเพิ่มขึ้น ผักและผลไม้สดมักมีโพแทสเซียมสูงและมีโซเดียมต่ำ โซเดียมกักเก็บน้ำในร่างกายเพิ่มมากขึ้น ความดันเลือดแดงและในทางกลับกันโพแทสเซียมกลับช่วยลดความมันได้ นั่นคือเหตุผลว่าทำไมการเพิ่มการบริโภคผักและผลไม้ โดยเฉพาะแอปเปิ้ล จึงถือเป็นมาตรการสำคัญในการป้องกันโรคหลอดเลือดสมอง
ความรักของผู้คนต่อเกลือมาจากไหน? .
เกลือทำหน้าที่รักษาอาหารไม่ให้เน่าเสียและเน่าเปื่อย เพื่อใช้ถนอมอาหาร (เมื่อยังไม่มีตู้เย็นและตู้แช่แข็ง) ให้ใช้เกลือ หลังจากชิมผักจากน้ำเกลือแล้ว ผู้คนก็เริ่มดอง หมัก และแช่ผักสด คน ๆ หนึ่งคุ้นเคยกับการเกลือทุกอย่างจนพร้อมที่จะทนกับโรคบางอย่างเพียงไม่เปลี่ยนมาทานอาหารที่ไม่มีเกลือ ฉันค่อยๆ พัฒนานิสัยการใส่เกลือในอาหารทุกประเภทโดยไม่ได้ลองเลย
เกลือมาก - โพแทสเซียมน้อย โพแทสเซียมน้อย - โรคมากมาย
คำถามเรื่องเกลือคือคำถามเรื่องความสมดุลของโพแทสเซียม-โซเดียม มีความสำคัญอย่างยิ่งต่อร่างกาย โพแทสเซียมและโซเดียมแข่งขันกันอย่างต่อเนื่องเพื่อให้มีอยู่ในเซลล์ เกลือแกงไม่มีโพแทสเซียม แต่เป็นโซเดียมทั้งหมด ร่างกายของเราต้องการโพแทสเซียมอย่างเร่งด่วนซึ่งควรมากกว่าโซเดียมถึง 4 เท่า ร่างกายสะสมโพแทสเซียมทุกที่ แต่การใช้เกลือแกงมากเกินไปจะทำให้ความพยายามทั้งหมดเป็นโมฆะ ดังนั้นการบริโภคเกลือมากเกินไปจะเกิดการขาดโพแทสเซียมซึ่งเมื่อเวลาผ่านไปนำไปสู่โรคภัยไข้เจ็บต่างๆ: ความเหนื่อยล้าทางร่างกายและจิตใจ การนอนหลับไม่ดี ตะคริว ปวดข้อ
โซเดียม (เกลือ) ส่วนเกินจะทำให้หัวใจทำงานหนักเกินไป ต้องการทราบว่าคุณบริโภคเกลือมากเกินไปหรือไม่? ไปที่กระจก: วงกลมสีขาวรอบๆ ม่านตาบ่งบอกถึงปริมาณเกลือที่มากเกินไป
โพแทสเซียมกัดกร่อน
โพแทสเซียมโซดาไฟใช้สำหรับการผลิตปุ๋ย ยางสังเคราะห์ อิเล็กโทรไลต์สำหรับแบตเตอรี่ รีเอเจนต์ และใช้ในอุตสาหกรรมยาและภาคส่วนอื่นๆ ของเศรษฐกิจของประเทศ
โพแทสเซียมโซดาไฟถูกขนส่งโดยทางรถไฟและทางถนนตามกฎสำหรับการขนส่งสินค้าที่บังคับใช้สำหรับการขนส่งประเภทนี้
โพแทสเซียมโซดาไฟจะถูกเก็บไว้ในภาชนะที่ปิดสนิทเพราะฉะนั้น มัน "กระจาย" ในอากาศเพื่อดูดซับความชื้นจากมัน
ชื่อดั้งเดิมของมันคือ "โพแทสเซียมกัดกร่อน" สะท้อนถึงฤทธิ์กัดกร่อนของสารนี้ต่อเนื้อเยื่อของสิ่งมีชีวิต หากโพแทสเซียมที่มีฤทธิ์กัดกร่อนสัมผัสกับผิวหนัง อาจเกิดการไหม้จากสารเคมีได้
สบู่อ่อนได้จากการสะพอนิฟายน้ำมันและไขมันด้วยโพแทสเซียมที่มีฤทธิ์กัดกร่อน สบู่ทั้งหมดนี้มีความนุ่มและเนื้อครีมสม่ำเสมอ
โซเดียมไฮดรอกไซด์.
อัลคาไลที่พบมากที่สุด ทั่วโลกมีการผลิตและบริโภคด่างกัดกร่อนมากกว่า 57 ล้านตันต่อปี
โซดาไฟใช้ในอุตสาหกรรมหลากหลายประเภทและสำหรับความต้องการภายในประเทศ:
ในอุตสาหกรรมเยื่อและกระดาษในการผลิตกระดาษ กระดาษแข็ง เส้นใยเทียม แผ่นใยไม้
สำหรับซาพอนิฟิเคชันของไขมันในการผลิตสบู่ แชมพู และผงซักฟอกอื่นๆ
ในอุตสาหกรรมเคมี - เพื่อทำให้กรดและกรดออกไซด์เป็นกลาง เป็นตัวทำปฏิกิริยาหรือตัวเร่งปฏิกิริยา ปฏิกริยาเคมีและอื่น ๆ.
โซดาไฟ (โซเดียมไฮดรอกไซด์) เป็นสารกัดกร่อนและมีฤทธิ์กัดกร่อน จัดอยู่ในกลุ่มสารอันตรายประเภทที่ 2 ดังนั้นจึงต้องระมัดระวังเมื่อทำงานกับมัน
เมื่อสัมผัสกับผิวหนัง เยื่อเมือก และดวงตา จะเกิดการเผาไหม้ของสารเคมีอย่างรุนแรง หากพื้นผิวเมือกสัมผัสกับด่างกัดกร่อนจำเป็นต้องล้างบริเวณที่ได้รับผลกระทบด้วยกระแสน้ำและในกรณีที่สัมผัสกับผิวหนังให้ใช้สารละลายกรดอะซิติกอ่อน ๆ
บนลิเธียม - สู่ดวงดาว
ผู้ผลิตโทรศัพท์มือถือ อุปกรณ์พกพา และแล็ปท็อป ต่างต้องการโลหะชนิดนี้อย่างมาก พลังงานนิวเคลียร์ใช้ลิเธียม (Li) ในปริมาณมาก ตามที่นักทฤษฎีกล่าวไว้ โลหะอัลคาไลนี้สามารถเป็นกุญแจสำคัญในการสร้างพลังงานแสนสาหัสได้ เป็นผู้มีอำนาจสูงสุด สารออกฤทธิ์ต่อจิตประสาท, หลี่ใช้ในการทหารและจิตเวชประยุกต์ (และธรรมชาติของผลกระทบของหลี่ต่อจิตใจมนุษย์ยังไม่เป็นที่เข้าใจอย่างสมบูรณ์) ลิเธียมดิวเทอไรด์ถูกใช้ในระเบิดไฮโดรเจนเป็นสารทำงานและเป็นตัวควบคุมกำลังการระเบิด
โลหะนี้ยังจำเป็นสำหรับการสำรวจอวกาศลึกด้วย
การกำหนดเส้นทางสำหรับนักเรียนสำหรับบทเรียน
หัวข้อ: สารประกอบของโลหะอัลคาไล
ทดสอบ
ไฮไดรด์ความเสถียรที่สุดคือลิเธียมไฮไดรด์ ซึ่งหาได้ง่ายโดยการส่งไฮโดรเจนไปบนลิเธียมที่ให้ความร้อน LiH เป็นผงผลึกสีขาวที่มีจุดหลอมเหลว 680 o C เมื่อใด อุณหภูมิสูง LiH มีปฏิกิริยาอย่างมาก สลายตัวอย่างรุนแรงด้วยน้ำ:
LiH + H 2 O = LiOH + H 2
ออกไซด์เสถียรที่สุดคือ Li 2 O ลิเธียมและโซเดียมออกไซด์เป็นสีขาว ส่วนที่เหลือเป็นสีเหลือง นอกจากนี้ความเข้มของสีจะเพิ่มขึ้นตามเลขอะตอมขององค์ประกอบที่เพิ่มขึ้น
เปอร์ออกไซด์เกิดจากการเผาโลหะด้วยออกซิเจนส่วนเกิน โลหะอัลคาไลเปอร์ออกไซด์ถือได้ว่าเป็นอนุพันธ์ของไฮโดรเจนเปอร์ออกไซด์เพราะว่า พวกมันทำปฏิกิริยากับกรดและน้ำเพื่อสร้างไฮโดรเจนเปอร์ออกไซด์:
ม 2 โอ 2 + เอช 2 ดังนั้น 4 = ม 2 ดังนั้น 4 + เอช 2 โอ 2
ม 2 โอ 2 + 2H 2 O = 2MOH + H 2 O 2
ที่สำคัญที่สุดคือโซเดียมเปอร์ออกไซด์ซึ่งใช้ในการผลิตออกซิเจนในพื้นที่ปิด (เช่น เรือดำน้ำ):
2นา 2 O 2 + 2CO 2 = 2Na 2 CO 3 + 2O 2
ไฮดรอกไซด์ในเทคโนโลยีเรียกว่าด่างกัดกร่อน (NaOH - โซดาไฟ, KOH - โพแทสเซียมกัดกร่อน) เหล่านี้เป็นสารไม่มีสีและหลอมละลายได้ ในสถานะหลอมเหลว พวกมันจะทำปฏิกิริยากับแก้ว เครื่องเคลือบ และแพลตตินัม ดังนั้นการละลายของอัลคาไลจึงดำเนินการในถ้วยใส่ตัวอย่างเงินหรือเหล็กซึ่งพวกมันจะไม่ทำปฏิกิริยากัน ไฮดรอกไซด์ละลายได้ดีในน้ำโดยมีการคายความร้อนสูง
ไฮดรอกไซด์จัดทำขึ้นด้วยวิธีต่อไปนี้:
ก) ปฏิกิริยาระหว่างโลหะหรือออกไซด์กับน้ำ:
Li 2 O + H 2 O = 2LiOH
ปฏิกิริยานี้ใช้เพื่อผลิตไฮดรอกไซด์ที่บริสุทธิ์มากเท่านั้น
b) ปฏิกิริยากัดกร่อนเป็นวิธีการผลิตโซดาไฟที่เก่าแก่ที่สุดที่รู้จักกันดี วิธีนี้ประกอบด้วยการบำบัดสารละลายโซดาด้วยแคลเซียมไฮดรอกไซด์ (ปูนขาว) ขณะเดือด แคลเซียมคาร์บอเนตที่ไม่ละลายน้ำที่เกิดขึ้นจะถูกกรองออกหรือแยกของเหลวใสออก:
นา 2 CO 3 + Ca(OH) 2 = 2NaOH + CaCO 3
สารละลายโซเดียมไฮดรอกไซด์ที่เกิดขึ้นจะถูกทำให้เข้มข้นโดยการระเหยในสุญญากาศ โซดาไฟแข็งจะถูกละลายที่อุณหภูมิ 500 o C เพื่อกำจัดน้ำออกจนหมด และจะได้ NaOH ที่มี Na 2 CO 3 3-4% NaOH ที่ได้รับในลักษณะนี้เรียกว่า "โซดาไฟ"
ค) อิเล็กโทรไลซิสของโลหะอัลคาไลคลอไรด์ในสารละลายที่เป็นน้ำเป็นวิธีการทางอุตสาหกรรมสมัยใหม่ในการผลิต NaOH และ KOH พร้อมๆ กับคลอรีน เมื่อสารละลาย NaCl ถูกอิเล็กโทรลิซิสด้วยอิเล็กโทรดเฉื่อย (แพลตตินัม กราไฟต์) คลอรีนจะถูกปล่อยออกมาที่ขั้วบวกและไฮโดรเจนที่ขั้วลบ Na + ไอออนและ OH - ไอออนสะสมในพื้นที่แคโทดซึ่งก่อตัวเป็น NaOH
d) โดยการหลอมรวมของคาร์บอเนตโลหะอัลคาไลกับออกไซด์และการบำบัดโลหะผสมด้วยไอน้ำในเวลาต่อมา:
เฟ 2 O 3 + นา 2 CO 3 = 2NaFeO 2 + CO 2
2NaFeO 2 + H 2 O = 2NaOH + เฟ 2 O 3
อัลคาไลเป็นวัตถุดิบที่สำคัญที่สุดใน อุตสาหกรรมเคมีสำหรับการผลิตสีย้อม แก้ว สบู่ กระดาษ เส้นใยเทียม ยารักษาโรค
เกลือ. NaCl และ KCl เกิดขึ้นในปริมาณมากในธรรมชาติ NaCl (เกลือแกง) พบได้ใน น้ำทะเล(โดยเฉลี่ย 2.7%) และอยู่ในรูปของเกลือหินที่มีความหนาหลายกิโลเมตร ในรูปแบบบริสุทธิ์ NaCl และ KCl ได้มาจากคลอไรด์ธรรมชาติโดยการตกผลึกใหม่ เกลือลิเธียมได้มาจากลิเธียมคาร์บอเนตธรรมชาติ การได้รับเกลือของรูบิเดียมและซีเซียมนั้นสัมพันธ์กับความยากลำบากเพราะว่า ความสามารถในการละลายนั้นใกล้เคียงกับเกลือโพแทสเซียมมาก โดยปกติแล้วจะเริ่มต้นจากสุราแม่ที่เหลืออยู่หลังจากการตกผลึกใหม่ของคาร์นัลไลท์ และแยกรูบิเดียมและสารส้มซีเซียมออกจากพวกมัน ซึ่งได้รับการทำให้บริสุทธิ์โดยการตกผลึกซ้ำ รูบิเดียมถูกแยกออกจากซีเซียมโดยใช้คาร์บอเนตในแอลกอฮอล์ที่มีความสามารถในการละลายต่างกัน
ในบรรดาไนเตรต NaNO 3 และ KNO 3 มีความสำคัญในทางปฏิบัติ ชื่อทางเทคนิคคือโซเดียมไนเตรตและโพแทสเซียมไนเตรต เกลือทั้งสองชนิดถูกใช้เป็นปุ๋ยแร่ธาตุ KNO 3 ยังใช้สำหรับการผลิตผงสีดำ (ไม่ได้ใช้ NaNO 3 เนื่องจากการดูดความชื้น)
กรดคาร์บอนิก H 2 CO 3 ให้คาร์บอเนตโลหะอัลคาไลสองชุดคือกรด (MHCO 3) และตัวกลาง (M 2 CO 3) กรดคาร์บอเนต (ไฮโดรคาร์บอเนต, ไบคาร์บอเนต) เป็นที่รู้จักสำหรับโลหะอัลคาไลทั้งหมดยกเว้นลิเธียม คาร์บอเนตที่เป็นกลางทั้งหมดสามารถละลายในน้ำได้สูง ยกเว้นลิเธียมคาร์บอเนต นา 2 CO 3 – โซดา บางครั้งพบได้ตามธรรมชาติในน้ำของทะเลสาบและบ่อน้ำแร่บางแห่ง ได้รับโซดาโดยใช้วิธีแอมโมเนีย: สารละลายเกลือแกงอิ่มตัวด้วยแอมโมเนียและคาร์บอนไดออกไซด์ ในกรณีนี้ NaHCO 3 จะตกตะกอนเพราะว่า โซดาละลายได้น้อยกว่า NH 4 Cl:
โซเดียมคลอไรด์ + H 2 O + CO 2 + NH 3 = NaHCO 3 yl + NH 4 Cl
2NaHCO 3 → นา 2 CO 3 + CO 2 + H 2 O
K 2 CO 3 – โปแตช ผงสีขาวดูดความชื้น ละลายน้ำได้สูง เตรียมโดยคาร์บอนไดออกไซด์ของโพแทสเซียมไฮดรอกไซด์:
2KOH + CO 2 = K 2 CO 3 + H 2 O
โปแตชใช้ในอุตสาหกรรมสบู่และแก้ว ในการย้อมและฟอกขนสัตว์ ในการผลิตโพแทสเซียมไซยาไนด์ และการสังเคราะห์สารอินทรีย์
กรดซัลฟูริกให้ซัลเฟตโลหะอัลคาไลสองชุด - เป็นกรดและปานกลาง
ได้รับ Na 2 SO 4 เป็นผลพลอยได้ในการผลิตกรดไฮโดรคลอริกจากโซเดียมคลอไรด์และกรดซัลฟิวริก จากสารละลายในน้ำโซเดียมซัลเฟตจะตกผลึกในรูปของ Na 2 SO 4 10H 2 O ในเทคโนโลยีไฮเดรตที่เป็นผลึกนี้เรียกว่าเกลือของ Glauber ใช้ในการย้อมผ้าฝ้ายและในทางการแพทย์
· · ·§ 96. อัลคาไลน์
กลุ่มของโลหะอัลคาไลประกอบด้วยโลหะประเภทต่างๆ ดังต่อไปนี้ Li, Na, K, Rb, Cs, Fr. พวกมันอยู่ในกลุ่มย่อยหลักของกลุ่ม I ของตารางธาตุ
ทั้งหมดนี้คล้ายกันตรงที่มีอิเล็กตรอนหนึ่งตัวอยู่บนชั้นอิเล็กทรอนิกส์ด้านนอก (ตารางที่ 18)/
องค์ประกอบอัลคาไลน์เป็นหนึ่งในองค์ประกอบ s อิเล็กตรอนของชั้นอิเล็กตรอนชั้นนอกของอะตอมโลหะอัลคาไลจะอยู่ห่างจากนิวเคลียสมากที่สุดเมื่อเปรียบเทียบกับองค์ประกอบอื่นในช่วงเวลาเดียวกัน กล่าวคือ รัศมีของอะตอมของโลหะอัลคาไลนั้นใหญ่ที่สุดเมื่อเทียบกับรัศมีของอะตอมขององค์ประกอบอื่น ๆ ของ ช่วงเวลาเดียวกัน เนื่องจาก
|
ค่าใช้จ่ายหลัก |
จำนวนอิเล็กตรอนในระดับพลังงาน |
รัศมีอะตอม |
|||||||
ด้วยเหตุนี้ วาเลนซ์อิเล็กตรอนของชั้นนอกของอะตอมโลหะอัลคาไลจึงถูกดึงออกอย่างง่ายดาย ทำให้พวกมันกลายเป็นไอออนที่มีประจุบวกเพียงตัวเดียว นี่เป็นเพราะความจริงที่ว่าสารประกอบของโลหะอัลคาไลกับองค์ประกอบอื่นถูกสร้างขึ้นตามประเภทของพันธะไอออนิก
ในปฏิกิริยารีดอกซ์ พวกมันทำหน้าที่เป็นตัวรีดิวซ์อย่างแรง และความสามารถนี้จะเพิ่มขึ้นจากโลหะหนึ่งไปอีกโลหะหนึ่งโดยการเพิ่มประจุของนิวเคลียสของอะตอม
§ 97. โซเดียม
การกำหนดค่าทางอิเล็กทรอนิกส์ของอะตอมโซเดียมคือ ls 2 2s 2 2p 6 3s 1 โครงสร้างของชั้นนอก:
โซเดียมเกิดขึ้นในธรรมชาติในรูปของเกลือเท่านั้น เกลือโซเดียมที่พบมากที่สุดคือเกลือแกง NaCl เช่นเดียวกับแร่ซิลวิไนต์ KCl · NaCl และเกลือของกรดซัลฟิวริกบางชนิด เช่น เกลือของ Glauber Na2SO4 · 10H2O ซึ่งพบได้ในปริมาณมากในอ่าวคารา-โบกาซ-โกลของทะเลแคสเปียน
จากเกลือแกง NaCl จะได้โลหะโซเดียมโดยอิเล็กโทรไลซิสของเกลือหลอมเหลว การติดตั้งอิเล็กโทรไลซิสแสดงไว้ในรูปที่ 1 76. อิเล็กโทรดจุ่มลงในเกลือหลอมเหลว ช่องว่างของขั้วบวกและแคโทดจะถูกคั่นด้วยไดอะแฟรม ซึ่งจะแยกโซเดียมที่เกิดขึ้นเพื่อไม่ให้เกิดปฏิกิริยาย้อนกลับ โซเดียมไอออนบวกจะรับอิเล็กตรอนจากแคโทดและกลายเป็นอะตอมโซเดียมที่เป็นกลาง อะตอมของโซเดียมที่เป็นกลางจะรวมตัวกันที่แคโทดในรูปของโลหะหลอมเหลว กระบวนการที่เกิดขึ้นที่แคโทดสามารถแสดงได้ด้วยแผนภาพต่อไปนี้:
นา + + นา 0 .
เนื่องจากการรับอิเล็กตรอนเกิดขึ้นที่แคโทด และการรับอิเล็กตรอนโดยอะตอมหรือไอออนทั้งหมดเป็นการรีดักชัน โซเดียมไอออนที่แคโทดจึงลดลง ที่ขั้วบวก คลอรีนไอออนจะปล่อยอิเล็กตรอนออกมา กล่าวคือ กระบวนการออกซิเดชันและการปลดปล่อยอิสระ
ก๊าซคลอรีน ซึ่งสามารถแสดงได้ด้วยแผนภาพต่อไปนี้:
ซีแอล — — จ— → เคลียร์ 0
โลหะโซเดียมที่ได้จะมีสีขาวเงินและสามารถตัดด้วยมีดได้ง่าย หากตรวจสอบทันทีหลังจากการเจียระไน ส่วนโซเดียมจะมีความแวววาวของโลหะ แต่จะจางลงอย่างรวดเร็วเนื่องจากโลหะออกซิเดชันอย่างรวดเร็วมาก
![]()
ข้าว. 76. แผนภาพการติดตั้งสำหรับอิเล็กโทรไลซิสของเกลือหลอมเหลว
1 - แคโทดวงแหวน; 2 - ระฆังสำหรับกำจัดก๊าซคลอรีนออกจากช่องขั้วบวก
หากโซเดียมถูกออกซิไดซ์ในออกซิเจนจำนวนเล็กน้อยที่อุณหภูมิประมาณ 180° จะได้โซเดียมออกไซด์:
4Na + O2 = 2Na2O
เมื่อเผาด้วยออกซิเจนจะเกิดโซเดียมเปอร์ออกไซด์:
2นา + O2 = นา2O2
ในกรณีนี้ โซเดียมจะไหม้พร้อมกับเปลวไฟสีเหลืองพราว
เนื่องจากโซเดียมออกซิเดชันได้ง่ายและรวดเร็ว จึงถูกเก็บไว้ใต้ชั้นของน้ำมันก๊าดหรือพาราฟิน ซึ่งเป็นวิธีที่ดีกว่า เนื่องจากอากาศจำนวนหนึ่งยังคงละลายในน้ำมันก๊าดและออกซิเดชันของโซเดียม แม้ว่าจะยังคงเกิดขึ้นอย่างช้าๆ ก็ตาม
โซเดียมสามารถรวมกับไฮโดรเจนได้ - ไฮไดรด์ NaHซึ่งแสดงสถานะออกซิเดชันที่ 1 นี่คือสารประกอบคล้ายเกลือซึ่งโดยธรรมชาติของพันธะเคมีและขนาดของสถานะออกซิเดชันนั้นแตกต่างจากไฮไดรด์ที่ระเหยได้ขององค์ประกอบของกลุ่มย่อยหลักของกลุ่ม IV -VII
โลหะโซเดียมสามารถทำปฏิกิริยาได้ไม่เพียงแต่กับออกซิเจนและไฮโดรเจนเท่านั้น แต่ยังทำปฏิกิริยากับสารที่เรียบง่ายและซับซ้อนหลายชนิดอีกด้วย ตัวอย่างเช่น เมื่อบดในปูนที่มีกำมะถัน โซเดียมจะทำปฏิกิริยาอย่างรุนแรงกับมัน โดยก่อตัวเป็น:
2นา + ส = นา2S
ปฏิกิริยาจะมาพร้อมกับการระบาด ดังนั้นคุณควรเก็บปูนให้ห่างจากดวงตาและพันมือด้วยผ้าเช็ดตัว สำหรับปฏิกิริยานี้คุณควรรับประทานโซเดียมชิ้นเล็กๆ
โซเดียมจะเผาไหม้อย่างรุนแรงในคลอรีนเพื่อสร้างโซเดียมคลอไรด์ ซึ่งเป็นสิ่งที่ดีอย่างยิ่งเมื่อสังเกตในหลอดแคลเซียมคลอไรด์ซึ่งมีกระแสคลอรีนไหลผ่านโซเดียมหลอมเหลวและให้ความร้อนสูง:
2Na + Cl2 = 2NaCl
โซเดียมไม่เพียงทำปฏิกิริยากับสารธรรมดาเท่านั้น แต่ยังรวมถึงสารที่ซับซ้อนเช่นน้ำด้วย โดยแทนที่มันเนื่องจากมีปฏิกิริยามาก โลหะที่ใช้งานอยู่ในอนุกรมแรงดันไฟฟ้าจะอยู่ทางด้านซ้ายของไฮโดรเจนมากและไล่ไฮโดรเจนออกจากน้ำได้ง่าย:
2Na + 2H2O = 2NaOH + H2
ไฟโลหะอัลคาไลไม่สามารถดับได้ด้วยน้ำ ทางที่ดีควรเติมผงโซดาแอชลงไป เมื่อมีโซเดียม เปลวไฟไม่มีสีของเตาแก๊สจะเปลี่ยนเป็นสีเหลือง
โลหะโซเดียมสามารถใช้เป็นตัวเร่งปฏิกิริยาในการสังเคราะห์สารอินทรีย์ได้ เช่น ในการผลิตยางสังเคราะห์จากบิวทาไดอีน ทำหน้าที่เป็นวัสดุเริ่มต้นสำหรับการผลิตสารประกอบโซเดียมอื่นๆ เช่น โซเดียมเปอร์ออกไซด์
■ 27. การใช้สมการสำหรับปฏิกิริยาที่เกี่ยวข้องกับโซเดียมของโลหะที่ให้ไว้ในข้อความ พิสูจน์ว่ามันทำหน้าที่เป็นตัวรีดิวซ์
28. เหตุใดโซเดียมจึงไม่สามารถกักเก็บในอากาศได้?
29. นักเรียนคนหนึ่งจุ่มโซเดียมลงในสารละลายคอปเปอร์ซัลเฟต โดยหวังว่าจะแทนที่เกลือโลหะออกจากเกลือ แทนที่จะเป็นโลหะสีแดง ผลที่ได้คือตะกอนสีน้ำเงินที่เป็นวุ้น อธิบายปฏิกิริยาที่เกิดขึ้นและเขียนสมการในรูปแบบโมเลกุลและไอออนิก สภาวะของปฏิกิริยาควรเปลี่ยนแปลงอย่างไรเพื่อให้ปฏิกิริยานำไปสู่ผลลัพธ์ที่ต้องการ? เขียนสมการในรูปแบบไอออนิกระดับโมเลกุล รูปแบบเต็ม และแบบย่อ
30. ใส่โลหะโซเดียม 2.3 กรัมลงในภาชนะที่มีน้ำ 45 มิลลิลิตร ปริมาณโซเดียมไฮดรอกไซด์ที่เกิดขึ้นเมื่อสิ้นสุดปฏิกิริยาคือเท่าใด
31. สามารถใช้วิธีใดในการดับไฟโซเดียมได้? ให้คำตอบที่มีเหตุผล
§ 98. สารประกอบออกซิเจนของโซเดียม โซเดียมไฮดรอกไซด์
สารประกอบออกซิเจนของโซเดียมดังที่ได้กล่าวไปแล้วคือโซเดียมออกไซด์ Na2O และโซเดียมเปอร์ออกไซด์ Na2O2
โซเดียมออกไซด์ Na2O ไม่สำคัญอย่างยิ่ง ทำปฏิกิริยากับน้ำอย่างรุนแรงทำให้เกิดโซดาไฟ:
นา2O + H2O = 2NaOH
โซเดียมเปอร์ออกไซด์ Na202 เป็นผงสีเหลือง ถือได้ว่าเป็นเกลือชนิดหนึ่งของไฮโดรเจนเปอร์ออกไซด์เนื่องจากมีโครงสร้างเหมือนกับของ H2O2 เช่นเดียวกับโซเดียมเปอร์ออกไซด์ มันเป็นตัวออกซิไดซ์ที่แรง เมื่อสัมผัสกับน้ำจะเกิดเป็นด่างและ:
นา2O2 + H2O = H2O2 + 2NaOH
ยังเกิดขึ้นจากการกระทำของกรดเจือจางต่อโซเดียมเปอร์ออกไซด์:
Na2O2 + H2SO4 = H2O2 + Na2SO4
คุณสมบัติข้างต้นทั้งหมดของโซเดียมเปอร์ออกไซด์ทำให้สามารถนำไปใช้ในการฟอกสีวัสดุที่เป็นไปได้ทั้งหมด
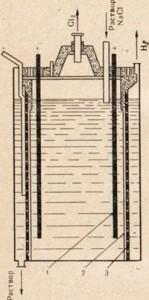
ข้าว. 77. แผนผังการติดตั้งสำหรับอิเล็กโทรไลซิสของสารละลายเกลือแกง
1 - ขั้วบวก; 2 - ไดอะแฟรมแยกช่องว่างแอโนดและแคโทด 3-แคโทด
สารประกอบโซเดียมที่สำคัญมากคือโซเดียมไฮดรอกไซด์หรือโซเดียมไฮดรอกไซด์ NaOH เรียกอีกอย่างว่าโซดาไฟหรือเรียกง่ายๆว่าโซดาไฟ
เพื่อให้ได้โซดาไฟ เกลือแกงซึ่งเป็นสารประกอบโซเดียมธรรมชาติที่ถูกที่สุดจะถูกใช้โดยการอิเล็กโทรไลซิส แต่ในกรณีนี้ ไม่ใช่การละลาย แต่ใช้สารละลายเกลือ (รูปที่ 77) สำหรับคำอธิบายกระบวนการอิเล็กโทรไลซิสของสารละลายเกลือแกงดู§ 33 ในรูป 77 แสดงว่าช่องว่างของขั้วบวกและแคโทดถูกคั่นด้วยไดอะแฟรม ทำเช่นนี้เพื่อให้ผลิตภัณฑ์ผลลัพธ์ไม่โต้ตอบกัน เช่น Cl2 + 2NaOH = NaClO + NaCl + H2O
โซดาไฟเป็นของแข็งผลึกสีขาว ละลายได้ดีในน้ำ เมื่อโซดาไฟละลายในน้ำจะปล่อยออกมา จำนวนมากความร้อนและสารละลายจะร้อนมาก โซดาไฟจะต้องเก็บไว้ในภาชนะที่ปิดสนิทเพื่อป้องกันไม่ให้ไอน้ำซึมเข้าไปภายใต้อิทธิพลของสิ่งที่ทำให้มีความชุ่มชื้นมากเช่นเดียวกับคาร์บอนไดออกไซด์ภายใต้อิทธิพลของโซดาไฟที่ค่อยๆ กลายเป็นโซเดียมคาร์บอเนต : :
2NaOH + CO2 = Na2CO3+ H2O
โซดาไฟเป็นด่างทั่วไป ดังนั้นข้อควรระวังเมื่อใช้งานจึงเหมือนกับเมื่อใช้งานกับด่างอื่นๆ
โซดาไฟถูกนำมาใช้ในหลายอุตสาหกรรม เช่น สำหรับการทำให้ผลิตภัณฑ์ปิโตรเลียมบริสุทธิ์ การผลิตสบู่จากไขมัน ในอุตสาหกรรมกระดาษ ในการผลิตเส้นใยและสีเทียม ในการผลิตยา เป็นต้น (รูปที่. 78)
จดบริเวณที่ใช้โซดาไฟลงในสมุดบันทึกของคุณ
ในบรรดาเกลือโซเดียมควรสังเกตเกลือ NaCl ก่อนซึ่งทำหน้าที่เป็นวัตถุดิบหลักในการผลิตโซดาไฟและโซเดียมโลหะ (สำหรับข้อมูลเพิ่มเติมเกี่ยวกับเกลือนี้ดูหน้า 164) โซดา Na2CO3 (ดูหน้า 278), Na2SO4 (ดูหน้า 224), NaNO3 (ดูหน้า 250) เป็นต้น
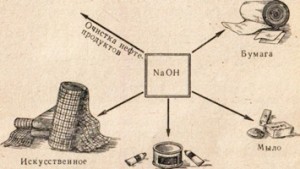
ข้าว. 78. การใช้โซดาไฟ
■ 32. อธิบายวิธีการผลิตโซเดียมไฮดรอกไซด์โดยอิเล็กโทรลิซิสของเกลือแกง
33. โซดาไฟสามารถเตรียมได้โดยการบำบัดโซเดียมคาร์บอเนตด้วยปูนขาว เขียนสมการรูปแบบโมเลกุลและไอออนิกสำหรับปฏิกิริยานี้ และคำนวณด้วยว่าต้องใช้โซดาที่มีคาร์บอเนต 95% เท่าใดในการผลิตโซเดียมไฮดรอกไซด์ 40 กิโลกรัม
34. ทำไมเมื่อเก็บสารละลายโซดาไฟในขวดที่มีจุกแบบกราวด์ จุกปิดจึง “ติด” และไม่สามารถถอดออกได้ หากคุณคว่ำขวดไว้ในน้ำเป็นระยะเวลาหนึ่ง ก็สามารถถอดจุกปิดออกได้อย่างง่ายดาย อธิบายโดยให้สมการปฏิกิริยาว่ากระบวนการประเภทใดที่เกิดขึ้นในกรณีนี้
35. เขียนสมการปฏิกิริยาในรูปแบบโมเลกุลและไอออนิกที่แสดงคุณสมบัติของโซดาไฟเป็นด่างทั่วไป
36. ควรใช้ข้อควรระวังอะไรบ้างเมื่อทำงานกับโซดาไฟ? ควรมีมาตรการปฐมพยาบาลอะไรบ้างสำหรับการเผาไหม้ของโซดาไฟ?
§ 99. โพแทสเซียม
โพแทสเซียม K ยังเป็นโลหะอัลคาไลที่พบได้ทั่วไป แตกต่างจากโซเดียมในขนาดของรัศมีอะตอม (ช่วงที่สี่) ดังนั้นจึงมีฤทธิ์ทางเคมีมากกว่าโซเดียม การกำหนดค่าทางอิเล็กทรอนิกส์ของอะตอมโพแทสเซียมคือ 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1
โครงสร้างของชั้นอิเล็กทรอนิกส์ภายนอก
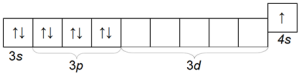
โพแทสเซียมเป็นโลหะอ่อนที่สามารถตัดได้ดีด้วยมีด เพื่อหลีกเลี่ยงการเกิดออกซิเดชัน มันจะถูกเก็บไว้ใต้ชั้นน้ำมันก๊าดเช่นเดียวกับโซเดียม
โพแทสเซียมทำปฏิกิริยากับน้ำได้รุนแรงกว่าโซเดียม ทำให้เกิดเป็นด่างและปล่อยไฮโดรเจนออกมา ซึ่งจุดติดไฟ:
2K + 2H2O = 2KOH + H2
เมื่อเผาด้วยออกซิเจน (และแนะนำให้ใช้โลหะชิ้นเล็ก ๆ ในการเผาไหม้มากกว่าการเผาโซเดียม) มันก็จะเผาไหม้อย่างแรงเช่นเดียวกับโซเดียมเพื่อสร้างโพแทสเซียมเปอร์ออกไซด์
ควรสังเกตว่าโพแทสเซียมมีอันตรายมากกว่าโซเดียมในการไหลเวียน การระเบิดอย่างรุนแรงสามารถเกิดขึ้นได้แม้ในขณะที่ตัดโพแทสเซียม ดังนั้นคุณจึงต้องจัดการมันอย่างระมัดระวังยิ่งขึ้น
โพแทสเซียมไฮดรอกไซด์หรือโพแทสเซียมไฮดรอกไซด์ KOH เป็นสารผลึกสีขาว โพแทสเซียมโซดาไฟมีความคล้ายคลึงกับโซดาไฟทุกประการ มีการใช้กันอย่างแพร่หลายในอุตสาหกรรมสบู่ แต่การผลิตค่อนข้างแพงกว่าดังนั้นจึงไม่ได้ใช้ในลักษณะเดียวกับ NaOH
ควรสังเกตเกลือโพแทสเซียมเป็นพิเศษเนื่องจากเกลือบางชนิดใช้เป็นปุ๋ยกันอย่างแพร่หลาย เหล่านี้คือโพแทสเซียมคลอไรด์ KCl, โพแทสเซียมไนเตรต KNO3 ซึ่งเป็นปุ๋ยไนโตรเจนด้วย
■ 37. เราจะอธิบายข้อเท็จจริงที่ว่าโพแทสเซียมโซดาไฟมีฤทธิ์ทางเคมีมากกว่าโซดาไฟได้อย่างไร?
38. โพแทสเซียมชิ้นหนึ่งถูกหย่อนลงในเครื่องตกผลึกด้วยน้ำ หลังจากปฏิกิริยาเสร็จสิ้น ก็ใส่สังกะสีเล็กน้อยในรูปของตะกอนเจลาตินัสสีขาว ตะกอนหายไปและเมื่อทดสอบสารละลายด้วยฟีนอล์ฟทาลีน ตะกอนจะกลายเป็นสีแดงเข้ม กระบวนการทางเคมีใดเกิดขึ้นที่นี่?
อันไหนอยู่ในสารละลาย? ให้คำตอบที่มีเหตุผล
39. เหตุใดโพแทสเซียมจึงถูกจัดอยู่ในกลุ่มธาตุ S เช่นเดียวกับโลหะอัลคาไลอื่นๆ
โลหะอัลคาไลทำปฏิกิริยากับอโลหะได้ง่าย:
2K + ฉัน 2 = 2KI
2Na + H 2 = 2NaH
6Li + N 2 = 2Li 3 N (ปฏิกิริยาเกิดขึ้นที่อุณหภูมิห้อง)
2Na + S = นา 2 ส
2นา + 2C = นา 2 ค 2
ในการทำปฏิกิริยากับออกซิเจน โลหะอัลคาไลแต่ละชนิดจะมีลักษณะเฉพาะของตัวเอง: เมื่อถูกเผาในอากาศ ลิเธียมจะเกิดออกไซด์ โซเดียม - เปอร์ออกไซด์ โพแทสเซียม - ซูเปอร์ออกไซด์
4Li + O 2 = 2Li 2 O
2นา + โอ 2 = นา 2 โอ 2
K + O 2 = เกาะ 2
การเตรียมโซเดียมออกไซด์:
10Na + 2NaNO 3 = 6Na 2 O + N 2
2นา + นา 2 O 2 = 2นา 2 โอ
2Na + 2NaON = 2Na 2 O + H 2
ปฏิกิริยากับน้ำทำให้เกิดอัลคาไลและไฮโดรเจน
2Na + 2H 2 O = 2NaOH + H 2
ปฏิกิริยากับกรด:
2Na + 2HCl = 2NaCl + H2
8Na + 5H 2 SO 4 (เข้มข้น) = 4Na 2 SO 4 + H 2 S + 4H 2 O
2Li + 3H 2 SO 4 (เข้มข้น) = 2LiHSO 4 + SO 2 + 2H 2 O
8Na + 10HNO 3 = 8NaNO 3 + NH 4 NO 3 + 3H 2 O
เมื่อทำปฏิกิริยากับแอมโมเนียจะเกิดเอไมด์และไฮโดรเจน:
2Li + 2NH 3 = 2LiNH 2 + H 2
ปฏิกิริยากับสารประกอบอินทรีย์:
H ─ C ≡ C ─ H + 2Na → นา ─ C≡C ─ นา + H 2
2CH 3 Cl + 2Na → C 2 H 6 + 2NaCl
2C 6 H 5 OH + 2Na → 2C 6 H 5 ONa + H 2
2CH 3 โอ้ + 2Na → 2 CH 3 ONa + H 2
2CH 3 COOH + 2Na → 2CH 3 COOOONa + H 2
ปฏิกิริยาเชิงคุณภาพต่อโลหะอัลคาไลคือการทำให้เปลวไฟมีสีของแคตไอออน Li + ไอออนทำให้เปลวไฟเป็นสีแดงเลือดนก, Na + ไอออน – สีเหลือง, K + – สีม่วง
สารประกอบโลหะอัลคาไล
ออกไซด์
ออกไซด์ของโลหะอัลคาไลเป็นออกไซด์พื้นฐานทั่วไป พวกมันทำปฏิกิริยากับออกไซด์ที่เป็นกรดและแอมโฟเทอริก กรดและน้ำ
3นา 2 โอ + พี 2 โอ 5 = 2นา 3 PO 4
นา 2 O + อัล 2 O 3 = 2NaAlO 2
นา 2 O + 2HCl = 2NaCl + H 2 O
นา 2 O + 2H + = 2Na + + H 2 O
นา 2 O + H 2 O = 2NaOH
เปอร์ออกไซด์.
2Na 2 O 2 + CO 2 = 2Na 2 CO 3 + O 2
นา 2 O 2 + CO = นา 2 CO 3
นา 2 O 2 + SO 2 = นา 2 SO 4
2นา 2 โอ + โอ 2 = 2นา 2 โอ 2
นา 2 O + NO + NO 2 = 2NaNO 2
2นา 2 โอ 2 = 2นา 2 โอ + โอ 2
นา 2 O 2 + 2H 2 O (เย็น) = 2NaOH + H 2 O 2
2Na 2 O 2 + 2H 2 O (ฮอ.) = 4NaOH + O 2
นา 2 O 2 + 2HCl = 2NaCl + H 2 O 2
2Na 2 O 2 + 2H 2 SO 4 (แบ่งขอบฟ้า) = 2Na 2 SO 4 + 2H 2 O + O 2
2นา 2 O 2 + S = นา 2 SO 3 + นา 2 O
5Na 2 O 2 + 8H 2 SO 4 + 2KMnO 4 = 5O 2 + 2MnSO 4 + 8H 2 O + 5Na 2 SO 4 + K 2 SO 4
นา 2 O 2 + 2H 2 SO 4 + 2NaI = ฉัน 2 + 2Na 2 SO 4 + 2H 2 O
นา 2 O 2 + 2H 2 SO 4 + 2FeSO 4 = เฟ 2 (SO 4) 3 + นา 2 SO 4 + 2H 2 O
3Na 2 O 2 + 2Na 3 = 2Na 2 CrO 4 + 8NaOH + 2H 2 O
เบส (ด่าง)
2NaOH (ส่วนเกิน) + CO 2 = นา 2 CO 3 + H 2 O
NaOH + CO 2 (ส่วนเกิน) = NaHCO 3
SO 2 + 2NaOH (ส่วนเกิน) = นา 2 SO 3 + H 2 O
SiO 2 + 2NaOH นา 2 SiO 3 + H 2 O
2NaOH + อัล 2 O 3 2NaAlO 2 + H 2 O
2NaOH + อัล 2 O 3 + 3H 2 O = 2Na
NaOH + อัล(OH) 3 = นา
2NaOH + 2Al + 6H 2 O = 2Na + 3H 2
2KOH + 2NO2 + O2 = 2KNO3 + H2O
KOH + KHCO 3 = K 2 CO 3 + H 2 O
2NaOH + Si + H 2 O = นา 2 SiO 3 + H 2
3KOH + P 4 + 3H 2 O = 3KH 2 PO 2 + PH 3
2KOH (เย็น) + Cl 2 = KClO + KCl + H 2 O
6KOH (ร้อน) + 3Cl 2 = KClO 3 + 5KCl + 3H 2 O
6NaOH + 3S = 2Na2S + Na2SO3 + 3H2O
2นาโน 3 2 นาโน 2 + O 2
NaHCO 3 + HNO 3 = นาโน 3 + CO 2 + H 2 O
นาย → นา + + ฉัน –
ที่แคโทด: 2H 2 O + 2e → H 2 + 2OH – 1
ที่ขั้วบวก: 2I – – 2e → I 2 1
2H 2 O + 2I – ![]() เอช 2 + 2OH – + ฉัน 2
เอช 2 + 2OH – + ฉัน 2
2H2O + 2NaI ![]() เอช 2 + 2NaOH + ฉัน 2
เอช 2 + 2NaOH + ฉัน 2
2โซเดียมคลอไรด์ ![]() 2Na + Cl2
2Na + Cl2
ที่แคโทดที่ขั้วบวก
2Na 2 HPO 4 Na 4 P 2 O 7 + H 2 O
KNO 3 + 4Mg + 6H 2 O = NH 3 + 4Mg(OH) 2 + KOH
4KClO 3 KCl + 3KClO 4
2KClO3 ![]() 2KCl + 3O 2
2KCl + 3O 2
KClO 3 + 6HCl = KCl + 3Cl 2 + 3H 2 O
นา 2 SO 3 + S = นา 2 ส 2 O 3
นา 2 S 2 O 3 + H 2 SO 4 = นา 2 SO 4 + S↓ + SO 2 + H 2 O
2NaI + Br 2 = 2NaBr + ฉัน 2
2NaBr + Cl 2 = 2NaCl + Br 2
ฉันกลุ่มเอ.
1. การปล่อยประจุไฟฟ้าถูกส่งผ่านบนพื้นผิวของสารละลายโซดาไฟที่เทลงในขวด และอากาศในขวดเปลี่ยนเป็นสีน้ำตาล ซึ่งหายไปหลังจากนั้นครู่หนึ่ง สารละลายที่เป็นผลลัพธ์ถูกระเหยอย่างระมัดระวังและถูกกำหนดว่าเรซิดิวที่เป็นของแข็งเป็นของผสมของเกลือสองชนิด เมื่อส่วนผสมนี้ได้รับความร้อน ก๊าซจะถูกปล่อยออกมาและเหลือเพียงสารเดียวเท่านั้น เขียนสมการของปฏิกิริยาที่อธิบายไว้
2. สารที่ปล่อยออกมาที่แคโทดระหว่างอิเล็กโทรไลซิสของโซเดียมคลอไรด์หลอมเหลวถูกเผาในออกซิเจน ผลลัพธ์ที่ได้จะถูกนำไปวางในเครื่องวัดก๊าซที่เต็มไปด้วยคาร์บอนไดออกไซด์ สารที่ได้จะถูกเติมลงในสารละลายแอมโมเนียมคลอไรด์ และสารละลายได้รับความร้อน เขียนสมการของปฏิกิริยาที่อธิบายไว้
3) กรดไนตริกถูกทำให้เป็นกลางด้วยเบกกิ้งโซดา สารละลายที่เป็นกลางจะถูกระเหยอย่างระมัดระวัง และสารตกค้างถูกเผา สารที่ได้จะถูกเติมลงในสารละลายโพแทสเซียมเปอร์แมงกาเนตที่เป็นกรดด้วยกรดซัลฟิวริกและสารละลายไม่มีสี วางผลิตภัณฑ์ปฏิกิริยาที่ประกอบด้วยไนโตรเจนในสารละลายโซเดียมไฮดรอกไซด์และฝุ่นสังกะสีที่ถูกเติม และปล่อยก๊าซที่มีกลิ่นฉุนออกมา เขียนสมการของปฏิกิริยาที่อธิบายไว้
4) สารที่ได้รับที่ขั้วบวกระหว่างอิเล็กโทรไลซิสของสารละลายโซเดียมไอโอไดด์กับอิเล็กโทรดเฉื่อยถูกทำปฏิกิริยากับโพแทสเซียม ผลิตภัณฑ์ที่ทำปฏิกิริยาถูกให้ความร้อนด้วยกรดซัลฟิวริกเข้มข้น และก๊าซที่ปล่อยออกมาถูกส่งผ่านสารละลายร้อนของโพแทสเซียมโครเมต เขียนสมการของปฏิกิริยาที่อธิบายไว้
5) สารที่ได้รับที่แคโทดระหว่างอิเล็กโทรไลซิสของโซเดียมคลอไรด์หลอมเหลวถูกเผาในออกซิเจน ผลลัพธ์ที่ได้จะถูกบำบัดด้วยซัลเฟอร์ไดออกไซด์และสารละลายแบเรียมไฮดรอกไซด์อย่างต่อเนื่อง เขียนสมการของปฏิกิริยาที่อธิบายไว้
6) ฟอสฟอรัสขาวละลายในสารละลายโพแทสเซียมไฮดรอกไซด์ ปล่อยก๊าซที่มีกลิ่นคล้ายกระเทียม ซึ่งจะติดไฟในอากาศได้เอง ผลิตภัณฑ์ที่เป็นของแข็งของปฏิกิริยาการเผาไหม้ทำปฏิกิริยากับโซดาไฟในอัตราส่วนที่สารสีขาวที่ได้จะมีอะตอมไฮโดรเจนหนึ่งอะตอม เมื่อสารหลังถูกเผาจะเกิดโซเดียมไพโรฟอสเฟต เขียนสมการของปฏิกิริยาที่อธิบายไว้
7) โลหะที่ไม่รู้จักถูกเผาด้วยออกซิเจน ผลิตภัณฑ์ที่ทำปฏิกิริยาจะทำปฏิกิริยากับคาร์บอนไดออกไซด์เพื่อสร้างสารสองชนิด: ของแข็งที่ทำปฏิกิริยากับสารละลายของกรดไฮโดรคลอริกเพื่อปล่อยก๊าซคาร์บอนไดออกไซด์ และสารเชิงเดี่ยวที่เป็นก๊าซที่รองรับการเผาไหม้ เขียนสมการของปฏิกิริยาที่อธิบายไว้
8) ก๊าซสีน้ำตาลถูกส่งผ่านสารละลายโพแทสเซียมที่มีฤทธิ์กัดกร่อนส่วนเกินต่อหน้าอากาศส่วนเกินจำนวนมาก เศษแมกนีเซียมถูกเติมลงในสารละลายที่ได้และให้ความร้อน และก๊าซที่เกิดขึ้นจะทำให้กรดไนตริกเป็นกลาง สารละลายที่เป็นผลลัพธ์ถูกระเหยอย่างระมัดระวัง และผลิตภัณฑ์ปฏิกิริยาของแข็งถูกเผา เขียนสมการของปฏิกิริยาที่อธิบายไว้
9) เมื่อใด การสลายตัวด้วยความร้อนเกลือ A เมื่อมีแมงกานีสไดออกไซด์ก่อตัวเป็นเกลือไบนารี B และก๊าซที่รองรับการเผาไหม้และเป็นส่วนหนึ่งของอากาศ เมื่อเกลือนี้ถูกให้ความร้อนโดยไม่มีตัวเร่งปฏิกิริยา จะเกิดเกลือ B และเกลือของกรดที่มีออกซิเจนสูงกว่า เมื่อเกลือ A ทำปฏิกิริยากับกรดไฮโดรคลอริกจะปล่อยก๊าซสีเหลืองเขียว (สารธรรมดา) และเกลือ B เกิดขึ้น เกลือ B จะเปลี่ยนเปลวไฟเป็นสีม่วงและเมื่อมันทำปฏิกิริยากับสารละลายของซิลเวอร์ไนเตรตจะเกิดตะกอนสีขาว เขียนสมการของปฏิกิริยาที่อธิบายไว้
10) เศษทองแดงถูกเติมลงในกรดซัลฟิวริกเข้มข้นที่ได้รับความร้อน และก๊าซที่ปล่อยออกมาจะถูกส่งผ่านสารละลายโซดาไฟ (ส่วนเกิน) ผลิตภัณฑ์ปฏิกิริยาถูกแยกออก ละลายในน้ำและให้ความร้อนด้วยซัลเฟอร์ ซึ่งละลายตามผลของปฏิกิริยา กรดซัลฟิวริกเจือจางถูกเติมลงในสารละลายที่เป็นผลลัพธ์ เขียนสมการของปฏิกิริยาที่อธิบายไว้
11) เกลือแกงได้รับการบำบัดด้วยกรดซัลฟิวริกเข้มข้น เกลือที่เป็นผลลัพธ์ถูกบำบัดด้วยโซเดียมไฮดรอกไซด์ ผลลัพธ์ที่ได้คือเผาด้วยถ่านหินส่วนเกิน ก๊าซที่ปล่อยออกมาจะทำปฏิกิริยาเมื่อมีตัวเร่งปฏิกิริยากับคลอรีน เขียนสมการของปฏิกิริยาที่อธิบายไว้
12) โซเดียมทำปฏิกิริยากับไฮโดรเจน ผลิตภัณฑ์ปฏิกิริยาถูกละลายในน้ำ ซึ่งก่อตัวเป็นก๊าซที่ทำปฏิกิริยากับคลอรีน และสารละลายที่เป็นผลลัพธ์เมื่อถูกความร้อน จะทำปฏิกิริยากับคลอรีนเพื่อสร้างส่วนผสมของเกลือสองชนิด เขียนสมการของปฏิกิริยาที่อธิบายไว้
13) โซเดียมถูกเผาในออกซิเจนส่วนเกิน สารที่เป็นผลึกจะถูกใส่ลงในหลอดแก้ว และก๊าซคาร์บอนไดออกไซด์ถูกส่งผ่านเข้าไป ก๊าซที่ออกมาจากท่อถูกรวบรวมและเผาฟอสฟอรัสในบรรยากาศ สารที่ได้จะถูกทำให้เป็นกลางด้วยสารละลายโซเดียมไฮดรอกไซด์ที่มากเกินไป เขียนสมการของปฏิกิริยาที่อธิบายไว้
14) เติมสารละลายกรดไฮโดรคลอริกลงในสารละลายที่ได้จากการทำปฏิกิริยาโซเดียมเปอร์ออกไซด์กับน้ำเมื่อถูกความร้อนจนกระทั่งปฏิกิริยาเสร็จสิ้น สารละลายของเกลือที่ได้จะถูกนำไปผ่านกระบวนการอิเล็กโทรไลซิสด้วยอิเล็กโทรดเฉื่อย ก๊าซที่เกิดขึ้นจากอิเล็กโทรไลซิสที่ขั้วบวกถูกส่งผ่านสารแขวนลอยของแคลเซียมไฮดรอกไซด์ เขียนสมการของปฏิกิริยาที่อธิบายไว้
15) ซัลเฟอร์ไดออกไซด์ถูกส่งผ่านสารละลายโซเดียมไฮดรอกไซด์จนกระทั่งเกิดเกลือปานกลาง สารละลายที่เป็นน้ำของโพแทสเซียมเปอร์แมงกาเนตถูกเติมลงในสารละลายที่ได้ ตะกอนที่เป็นผลลัพธ์ถูกแยกและบำบัดด้วยกรดไฮโดรคลอริก ก๊าซที่ปล่อยออกมาจะถูกส่งผ่านสารละลายโพแทสเซียมไฮดรอกไซด์เย็น เขียนสมการของปฏิกิริยาที่อธิบายไว้
16) เผาส่วนผสมของซิลิคอน (IV) ออกไซด์และโลหะแมกนีเซียม สารอย่างง่ายที่ได้รับจากปฏิกิริยาได้รับการบำบัดด้วยสารละลายเข้มข้นของโซเดียมไฮดรอกไซด์ ก๊าซที่ปล่อยออกมาจะถูกส่งผ่านไปยังโซเดียมที่ให้ความร้อน สารที่ได้จึงถูกใส่ลงไปในน้ำ เขียนสมการของปฏิกิริยาที่อธิบายไว้
17) ผลิตภัณฑ์จากปฏิกิริยาของลิเธียมกับไนโตรเจนได้รับการบำบัดด้วยน้ำ ก๊าซที่เกิดขึ้นจะถูกส่งผ่านสารละลายกรดซัลฟิวริกจนกระทั่งปฏิกิริยาเคมีหยุดลง สารละลายที่เป็นผลลัพธ์ถูกบำบัดด้วยสารละลายแบเรียมคลอไรด์ สารละลายถูกกรอง และของกรองถูกผสมกับสารละลายโซเดียมไนเตรตและให้ความร้อน เขียนสมการของปฏิกิริยาที่อธิบายไว้
18) โซเดียมถูกให้ความร้อนในบรรยากาศไฮโดรเจน เมื่อเติมน้ำลงในสารที่เกิดขึ้น จะสังเกตวิวัฒนาการของก๊าซและการเกิดสารละลายใส ก๊าซสีน้ำตาลถูกส่งผ่านสารละลายนี้ซึ่งได้มาจากปฏิกิริยาของทองแดงกับสารละลายเข้มข้น กรดไนตริก. เขียนสมการของปฏิกิริยาที่อธิบายไว้
19) เผาโซเดียมไบคาร์บอเนต เกลือที่ได้จะถูกละลายในน้ำและผสมกับสารละลายอะลูมิเนียม ทำให้เกิดตะกอนและปล่อยก๊าซไม่มีสี ตกตะกอนได้รับการบำบัดด้วยสารละลายกรดไนตริกส่วนเกิน และก๊าซถูกส่งผ่านสารละลายโพแทสเซียมซิลิเกต เขียนสมการของปฏิกิริยาที่อธิบายไว้
20) โซเดียมถูกหลอมรวมกับซัลเฟอร์ สารประกอบที่ได้จะถูกบำบัดด้วยกรดไฮโดรคลอริก ก๊าซที่ปล่อยออกมาจะทำปฏิกิริยากับซัลเฟอร์ (IV) ออกไซด์อย่างสมบูรณ์ สารที่ได้จะถูกบำบัดด้วยกรดไนตริกเข้มข้น เขียนสมการของปฏิกิริยาที่อธิบายไว้
21) โซเดียมถูกเผาเมื่อมีออกซิเจนส่วนเกิน สารที่ได้จะถูกบำบัดด้วยน้ำ ส่วนผสมที่ได้จะถูกต้มหลังจากนั้นจึงเติมคลอรีนลงในสารละลายร้อน เขียนสมการของปฏิกิริยาที่อธิบายไว้
22) โพแทสเซียมถูกให้ความร้อนในบรรยากาศไนโตรเจน สารที่ได้จะได้รับการบำบัดด้วยกรดไฮโดรคลอริกส่วนเกินหลังจากนั้นจึงเติมแคลเซียมไฮดรอกไซด์แขวนลอยลงในส่วนผสมของเกลือที่เกิดขึ้นและให้ความร้อน ก๊าซที่ได้จะถูกส่งผ่านคอปเปอร์ออกไซด์ร้อน (II) เขียนสมการสำหรับปฏิกิริยาที่อธิบายไว้
23) โพแทสเซียมถูกเผาในบรรยากาศของคลอรีน เกลือที่ได้จะถูกบำบัดด้วยสารละลายซิลเวอร์ไนเตรตที่มากเกินไป ตะกอนที่ก่อตัวจะถูกกรองออก สารกรองจะถูกระเหยและให้ความร้อนอย่างระมัดระวัง เกลือที่ได้นั้นได้รับการประมวลผล สารละลายที่เป็นน้ำโบรมีน เขียนสมการของปฏิกิริยาที่อธิบายไว้
24) ลิเธียมทำปฏิกิริยากับไฮโดรเจน ผลิตภัณฑ์ปฏิกิริยาถูกละลายในน้ำ ซึ่งก่อตัวเป็นก๊าซที่ทำปฏิกิริยากับโบรมีน และสารละลายที่เป็นผลลัพธ์เมื่อถูกความร้อน จะทำปฏิกิริยากับคลอรีนเพื่อสร้างส่วนผสมของเกลือสองชนิด เขียนสมการของปฏิกิริยาที่อธิบายไว้
25) โซเดียมถูกเผาในอากาศ ของแข็งที่เกิดขึ้นจะดูดซับคาร์บอนไดออกไซด์และปล่อยออกซิเจนและเกลือออกมา เกลือสุดท้ายถูกละลายในกรดไฮโดรคลอริกและเติมสารละลายซิลเวอร์ไนเตรตลงในสารละลายที่ได้ เกิดการตกตะกอนสีขาว เขียนสมการของปฏิกิริยาที่อธิบายไว้
26) ออกซิเจนถูกปล่อยประจุไฟฟ้าในเครื่องโอโซน ก๊าซที่ได้จะถูกส่งผ่านสารละลายโพแทสเซียมไอโอไดด์ที่เป็นน้ำ และก๊าซใหม่ที่ไม่มีสีและไม่มีกลิ่นถูกปล่อยออกมา เพื่อรองรับการเผาไหม้และการหายใจ ในบรรยากาศของก๊าซประเภทหลัง โซเดียมถูกเผา และของแข็งที่เกิดปฏิกิริยากับคาร์บอนไดออกไซด์ เขียนสมการของปฏิกิริยาที่อธิบายไว้
ฉันกลุ่มเอ.
1. น 2 + โอ 2 ![]() 2NO
2NO
2NO + O 2 = 2NO 2
2NO 2 + 2NaOH = นาโน 3 + นาโน 2 + H 2 O
2นาโน 3 2 นาโน 2 + O 2
2.2NaCl ![]() 2Na + Cl2
2Na + Cl2
ที่แคโทดที่ขั้วบวก
2นา + โอ 2 = นา 2 โอ 2
2นา 2 O 2 + 2CO 2 = 2Na 2 CO 3 + O 2
นา 2 CO 3 + 2NH 4 Cl = 2NaCl + CO 2 + 2NH 3 + H 2 O
3. NaHCO 3 + HNO 3 = นาโน 3 + CO 2 + H 2 O
2นาโน 3 2 นาโน 2 + O 2
5NaNO 2 + 2KMnO 4 + 3H 2 SO 4 = 5NaNO 3 + 2MnSO 4 + K 2 SO 4 + 3H 2 O
นาโน 3 + 4Zn + 7NaOH + 6H 2 O = 4Na 2 + NH 3
4. 2H2O + 2NaI ![]() เอช 2 + 2NaOH + ฉัน 2
เอช 2 + 2NaOH + ฉัน 2
2K + ฉัน 2 = 2KI
8KI + 5H 2 SO 4 (สรุป) = 4K 2 SO 4 + H 2 S + 4I 2 + 4H 2 O
3H 2 S + 2K 2 CrO 4 + 2H 2 O = 2Cr(OH) 3 ↓ + 3S↓ + 4KOH
5.2NaCl ![]() 2Na + Cl2
2Na + Cl2
ที่แคโทดที่ขั้วบวก
2นา + โอ 2 = นา 2 โอ 2
นา 2 O 2 + SO 2 = นา 2 SO 4
นา 2 SO 4 + บา(OH) 2 = BaSO 4 ↓ + 2NaOH
6. พี 4 + 3เกาะ + 3H 2 O = 3KH 2 PO 2 + PH 3
2PH 3 + 4O 2 = P 2 O 5 + 3H 2 O
P 2 O 5 + 4NaOH = 2Na 2 HPO 4 + H 2 O


