14.08.2019
रासायनिक घटक धातूंमध्ये कोणते सामान्य गुणधर्म असतात? रासायनिक घटक म्हणून धातू
लहानपणापासूनच आपल्याला या वाक्प्रचाराचा सामना करावा लागतो की अशी आणि अशी वस्तू धातूची बनलेली असते. धातू म्हणजे काय?
धातू हा रासायनिक घटकांचा (तसेच त्यांचे मिश्रधातू) एक विशिष्ट गट आहे ज्यात संपूर्ण गटासाठी समान गुणधर्म आहेत, जसे की वाढलेली ताकद, चांगली थर्मल आणि विद्युत चालकता, लवचिकता, लवचिकता आणि धातूची चमक.
सर्व ज्ञात रासायनिक घटकांपैकी जवळजवळ 80% (118 पैकी 96) धातूंचे आहेत.
धातूंचे भौतिक गुणधर्म
पारा वगळता सर्व धातू सामान्य स्थितीत घन अवस्थेत असतात. कडकपणाच्या बाबतीत, सर्वात मऊ धातू सीझियम आहे (10-बिंदू मोहस स्केलवर 0.2 गुण). सर्वात कठीण टंगस्टन आहे. त्याची कडकपणा 6 गुण आहे. लोह कडकपणा - 4 गुण.
धातूंचे वितळण्याचे बिंदू (द्रव अवस्थेकडे संक्रमण) बदलतात: पारासाठी - 39º ते टंगस्टनसाठी 3,410º पर्यंत. सर्व अल्कली धातूंचे वितळण्याचे बिंदू कमी असतात आणि सामान्य धातूंमध्ये कथील आणि शिसे यांचा समावेश होतो. ते गॅस बर्नरवर घरी देखील वितळले जाऊ शकतात. बहुतेक धातू उच्च तापमानात विशेष भट्टीत वितळतात.
धातूंच्या क्रिस्टल जाळींमध्ये मुक्त मोबाइल इलेक्ट्रॉन्सच्या उपस्थितीमुळे, ते सर्व वीज आणि उष्णता चांगल्या प्रकारे चालवतात. विजेचे सर्वोत्तम धातू कंडक्टर म्हणजे चांदी, तांबे आणि ॲल्युमिनियम. शेवटच्या दोन धातूंपासून इलेक्ट्रिकल वायरिंग बनवले जाते हा योगायोग नाही.
दैनंदिन जीवनात धातूंच्या उत्कृष्ट थर्मल चालकतेचाही सामना करावा लागतो. पाणी उकळण्यासाठी, आम्ही ते धातूच्या पॅनमध्ये ओततो आणि स्टोव्हवर ठेवतो. हीटिंग एलिमेंट धातूला गरम करते आणि धातू जवळजवळ सर्व थर्मल ऊर्जा पाण्यात हस्तांतरित करते.
धातूंचे रासायनिक गुणधर्म
रासायनिक अभिक्रिया दरम्यान, सर्व धातू सहजपणे त्यांचे इलेक्ट्रॉन सोडतात आणि कमी करणारे एजंट म्हणून कार्य करतात.
जवळजवळ सर्व धातू ऑक्सिजनद्वारे ऑक्सिडाइझ केल्या जातात. अल्कली धातू (लिथियम, कॅल्शियम) सामान्य परिस्थितीत ऑक्सिजनशी संवाद साधतात. ऑक्सिजनद्वारे इतर धातूंचे ऑक्सीकरण करण्यासाठी उच्च तापमानाची आवश्यकता असते. उदाहरणार्थ, जर तुम्ही तांब्याची तार आगीवर गरम केली तर, तांबे हवेतील ऑक्सिजनवर प्रतिक्रिया देईल आणि काळ्या फिल्मने झाकले जाईल (कॉपर ऑक्साईड):
- 2Сu +O 2 → 2CuO
सोने आणि प्लॅटिनम ऑक्सिजनवर प्रतिक्रिया देत नाहीत.
इतर ऑक्सिडायझिंग एजंट्समध्ये क्लोरीन आणि सल्फर यांचा समावेश होतो जे धातूंवर प्रतिक्रिया देतात. जर तुम्ही आयर्न फिलिंग्ज आणि सल्फर पावडर मिसळले आणि मिश्रण गरम केले तर आमच्या डोळ्यांसमोर तुम्हाला लोह सल्फाइड मिळेल:
- Fe +S → FeS
वेगवेगळ्या धातूंची घटणारी क्रिया वेगळी असते. त्यांच्या क्रियाकलापांनुसार, धातू खालीलप्रमाणे वितरीत केले जातात:
- Li - K - Ba - Sr - Ca - Na - Mg - Al - Mn - Zn - Cr - Fe - Ca - Co - Ni - Sn - Pb - (H2) - Cu - Hg - Ag - Pt - Au.
या पंक्तीमध्ये धातू जितकी डावीकडे असेल तितकी ती अधिक सक्रिय असेल. मागील घटक उजवीकडे स्थित धातू विस्थापित करू शकता. उदाहरणार्थ, तांबे सल्फेटच्या द्रावणासह चाचणी ट्यूबमध्ये लोखंडाचा तुकडा ठेवल्यास, ते तपकिरी कोटिंग (तांबे फिल्म) ने झाकले जाईल:
- Fe + CuSO4 → FeSO4 + Cu
हायड्रोजन (H2) च्या डावीकडे स्थित धातू ते हायड्रोक्लोरिक ऍसिडपासून विस्थापित करू शकतात. जर तुम्ही झिंकचा तुकडा हायड्रोक्लोरिक ऍसिडमध्ये टाकला तर हायड्रोजन सोडण्यास सुरुवात होईल:
- HCl + Zn → ZnCl2 + H2
अल्कली धातू पाण्यावर सहज प्रतिक्रिया देतात. जर तुम्ही सोडियमचा तुकडा पाण्याच्या कंटेनरमध्ये ठेवला तर हायड्रोजन सक्रियपणे विकसित होण्यास सुरवात होईल आणि अल्कली तयार होईल:
- 2Na + 2H2O → 2NaOH + H2
धातू अर्ज
तुमचे आभार फायदेशीर गुणधर्मधातूंनी मानवी जीवनात घट्टपणे प्रवेश केला आहे. मनुष्य धातूंच्या ताकदीचा वापर करतो, त्यांच्यापासून फ्रेम्स (लहान मंडपांपासून ते मोठ्या गगनचुंबी इमारतींपर्यंत), मशीन बॉडी (कार, कॅरेज, जहाजे, मशीन टूल्स), तसेच विविध साधनांचे कार्यरत भाग बनवतो.
व्याख्या
निसर्गात असणे
धातूंचे गुणधर्म
वैशिष्ट्यपूर्ण गुणधर्म धातू
भौतिक गुणधर्म धातू
धातूंचे रासायनिक गुणधर्म
सूक्ष्म रचना
अल्कली धातू
अल्कली धातूंची सामान्य वैशिष्ट्ये
अल्कली धातूंचे रासायनिक गुणधर्म
अल्कली धातू तयार करणे
हायड्रॉक्साइड
कार्बोनेट
रुबिडियम
क्षारीय पृथ्वी धातू
कॅल्शियम
स्ट्रॉन्टियम
संक्रमण धातू
संक्रमण घटकांची सामान्य वैशिष्ट्ये
धातू अर्ज
बांधकामाचे सामान
इलेक्ट्रिकल साहित्य
साधन साहित्य
कथा
खाणकाम धातू शास्त्र
धातू आहे(हे नाव लॅटिन धातूपासून आले आहे - माइन) - वैशिष्ट्यपूर्ण धातू गुणधर्म असलेल्या घटकांचा समूह, जसे की उच्च थर्मल आणि विद्युत चालकता, सकारात्मक तापमान गुणांक प्रतिरोधकता, उच्च लवचिकता इ. सर्व रासायनिक घटकांपैकी अंदाजे 70% धातूंचे असतात. .
धातू आहे











![]()





















![]()


![]()





निसर्गात असणे
बहुतेक धातू धातू आणि संयुगेच्या स्वरूपात निसर्गात असतात. ते ऑक्साइड, सल्फाइड, कार्बोनेट आणि इतर रासायनिक संयुगे तयार करतात. शुद्ध धातू मिळविण्यासाठी आणि त्यांचा पुढील वापर करण्यासाठी, त्यांना धातूपासून वेगळे करणे आणि शुद्धीकरण करणे आवश्यक आहे. आवश्यक असल्यास, धातूंचे मिश्रण आणि इतर प्रक्रिया केली जाते. विज्ञान याचा अभ्यास करत आहे धातू शास्त्र. धातूशास्त्र फेरस धातूंच्या धातूंमध्ये फरक करते (आधारीत ग्रंथी) आणि रंगीत (त्यांना समाविष्ट नाही लोखंड, एकूण सुमारे 70 घटक). , आणि प्लॅटिनम देखील मौल्यवान धातू आहेत. याव्यतिरिक्त, ते लहान प्रमाणात उपस्थित आहेत समुद्राचे पाणी, वनस्पती, जिवंत प्राणी (महत्त्वाची भूमिका बजावत).
हे ज्ञात आहे की मानवी शरीरात 3% धातू असतात. आपल्या बहुतेक पेशींमध्ये कॅल्शियम आणि सोडियम असतात, ज्यामध्ये केंद्रित असते लिम्फॅटिक प्रणाली. मॅग्नेशियम स्नायूंमध्ये जमा होते आणि मज्जासंस्था, तांबे- यकृत मध्ये, - रक्त मध्ये.
धातूंचे गुणधर्म
धातू आहे
धातूंचे वैशिष्ट्यपूर्ण गुणधर्म
धातूची चमक (ग्रेफाइटच्या स्वरूपात आयोडीन आणि कार्बन वगळता. धातूची चमक असूनही, क्रिस्टलीय आयोडीन आणि ग्रेफाइट नॉन-मेटल आहेत.)
चांगली विद्युत चालकता (कार्बन वगळता.)
सुलभ मशीनिंगची शक्यता.
उच्च घनता (सामान्यतः धातू नॉन-मेटलपेक्षा जड असतात.)
उच्च वितळण्याचे बिंदू (अपवाद: पारा, गॅलियम आणि अल्कली धातू.)
महान थर्मल चालकता
ते नेहमी प्रतिक्रियांमध्ये एजंट कमी करतात.
धातूंचे भौतिक गुणधर्म
सर्व धातू (पारा वगळता आणि, सशर्त,) सामान्य परिस्थितीत घन स्थितीत असतात, परंतु त्यांची कठोरता भिन्न असते. अशा प्रकारे, अल्कली धातू स्वयंपाकघरातील चाकूने सहजपणे कापल्या जातात आणि व्हॅनेडियम, टंगस्टन आणि क्रोमियम सारख्या धातू सर्वात कठीण काचेवर सहजपणे स्क्रॅच करतात. खाली मोह्स स्केलवर काही धातूंची कठोरता आहे.
वितळण्याचे बिंदू −39 °C (पारा) ते 3410 °C (टंगस्टन) पर्यंत असतात. बहुतेक धातूंचा (अल्कली वगळता) वितळण्याचा बिंदू जास्त असतो, परंतु काही "सामान्य" धातू, उदा. कथीलआणि आघाडी, नियमित इलेक्ट्रिक किंवा गॅस स्टोव्हवर वितळले जाऊ शकते.
त्यांच्या घनतेनुसार, धातू प्रकाश (घनता 0.53 h 5 g/cm³) आणि जड (5 h 22.5 g/cm³) मध्ये विभागली जातात. सर्वात हलका धातू लिथियम आहे (घनता 0.53 g/cm³). सर्वात जड धातूचे नाव देणे सध्या अशक्य आहे, कारण ऑस्मियम आणि इरिडियमची घनता - दोन सर्वात जड धातू - जवळजवळ समान आहेत (सुमारे 22.6 g/cm3 - घनतेच्या दुप्पट आघाडी), आणि त्यांच्या अचूक घनतेची गणना करणे अत्यंत कठीण आहे: हे करण्यासाठी, धातू पूर्णपणे शुद्ध करणे आवश्यक आहे, कारण कोणतीही अशुद्धता त्यांची घनता कमी करते.
बहुतेक धातू लवचिक असतात, म्हणजे धातूची तार तुटल्याशिवाय वाकली जाऊ शकते. हे धातूच्या अणूंच्या थरांच्या विस्थापनामुळे त्यांच्यातील बंध न तोडता येते. सर्वात लवचिक आहेत सोने, चांदीआणि तांबे. पासून सोने 0.003 मिमी जाडीचे फॉइल तयार करणे शक्य आहे, ज्याचा वापर व्यावसायिक वस्तूंच्या गिल्डिंगसाठी केला जातो. तथापि, सर्व धातू लवचिक नसतात. पासून वायर जस्तकिंवा कथीलवाकल्यावर crunches; विकृत झाल्यावर, मँगनीज आणि बिस्मथ क्वचितच वाकतात, परंतु लगेच तुटतात. प्लॅस्टिकिटी देखील धातूच्या शुद्धतेवर अवलंबून असते; अशाप्रकारे, अतिशय शुद्ध क्रोमियम अतिशय लवचिक आहे, परंतु, अगदी किरकोळ अशुद्धतेने दूषित झाल्याने ते ठिसूळ आणि कडक होते.
सर्व धातू चांगल्या प्रकारे वीज चालवतात; हे विद्युत क्षेत्राच्या प्रभावाखाली फिरत असलेल्या मोबाईल इलेक्ट्रॉनच्या क्रिस्टल जाळीमध्ये उपस्थितीमुळे आहे. चांदी, तांबे आणि ॲल्युमिनियमउच्चतम विद्युत चालकता आहे; या कारणास्तव, नंतरचे दोन धातू बहुतेकदा वायर साहित्य म्हणून वापरले जातात. सोडियमची विद्युत चालकता देखील खूप जास्त आहे; प्रायोगिक उपकरणांमध्ये, पातळ-भिंतींच्या पाईप्सच्या स्वरूपात सोडियम कंडक्टर वापरण्याचे प्रयत्न ज्ञात आहेत. स्टेनलेस स्टीलचेसोडियमने भरलेले. सोडियमच्या कमी विशिष्ट गुरुत्वाकर्षणामुळे, समान प्रतिकारासह, सोडियम "तार" तांब्यापेक्षा खूप हलके आणि ॲल्युमिनियमपेक्षा काहीसे हलके असतात.
धातूंची उच्च थर्मल चालकता देखील मुक्त इलेक्ट्रॉनच्या गतिशीलतेवर अवलंबून असते. त्यामुळे, थर्मल चालकता मालिका विद्युत चालकता मालिका समान आहे आणि उष्णता सर्वोत्तम वाहक, तसेच वीज, आहे. सोडियमचा उपयोग उष्णतेचा चांगला वाहक म्हणूनही होतो; हे मोठ्या प्रमाणावर ज्ञात आहे, उदाहरणार्थ, सोडियमचा वापर ऑटोमोबाईल इंजिनच्या व्हॉल्व्हमध्ये त्यांचे कूलिंग सुधारण्यासाठी केला जातो.
धातूंची गुळगुळीत पृष्ठभाग भरपूर प्रकाश प्रतिबिंबित करते - या घटनेला धातूची चमक म्हणतात. तथापि, पावडरच्या स्वरूपात, बहुतेक धातू त्यांची चमक गमावतात; ॲल्युमिनियमआणि मॅग्नेशियम मात्र पावडरमध्येही त्यांची चमक टिकवून ठेवतात. चांदी आणि चांदी प्रकाश सर्वात चांगले प्रतिबिंबित करतात - या धातूपासून आरसे बनवले जातात. ऱ्होडियमचा वापर कधीकधी आरसा बनवण्यासाठी केला जातो, त्याची किंमत खूप जास्त असूनही: चांदी किंवा पॅलेडियमपेक्षा जास्त कडकपणा आणि रासायनिक प्रतिरोधकतेमुळे, रोडियमचा थर चांदीपेक्षा खूपच पातळ असू शकतो.
बहुतेक धातूंचा रंग अंदाजे समान असतो - निळसर रंगाची छटा असलेला हलका राखाडी. , तांबे आणि सीझियम अनुक्रमे पिवळे, लाल आणि हलके पिवळे आहेत.
धातूंचे रासायनिक गुणधर्म
धातू आहे
बहुतेक धातूंच्या बाह्य इलेक्ट्रॉन थरावर कमी प्रमाणात इलेक्ट्रॉन (1-3) असतात, म्हणून बहुतेक प्रतिक्रियांमध्ये ते कमी करणारे एजंट म्हणून काम करतात (म्हणजे ते त्यांचे इलेक्ट्रॉन "दान" करतात)
1. साध्या पदार्थांसह प्रतिक्रिया
सोने आणि प्लॅटिनम वगळता सर्व धातू ऑक्सिजनसह प्रतिक्रिया देतात. चांदीची प्रतिक्रिया उच्च तापमानात होते, परंतु चांदी (II) ऑक्साईड व्यावहारिकरित्या तयार होत नाही, कारण ते थर्मलली अस्थिर आहे. धातूवर अवलंबून, आउटपुटमध्ये ऑक्साइड, पेरोक्साइड आणि सुपरऑक्साइड समाविष्ट असू शकतात:
4Li + O2 = 2Li2O लिथियम ऑक्साईड
2Na + O2 = Na2O2 सोडियम पेरोक्साइड
K + O2 = KO2 पोटॅशियम सुपरऑक्साइड
पेरोक्साइडमधून ऑक्साईड मिळविण्यासाठी, पेरोक्साइड धातूने कमी केला जातो:
Na2O2 + 2Na = 2Na2O
मध्यम आणि कमी-सक्रिय धातूसह, जेव्हा गरम होते तेव्हा प्रतिक्रिया येते:
3Fe + 2O2 = Fe3O4
केवळ सर्वात सक्रिय धातू नायट्रोजनसह प्रतिक्रिया देतात; खोलीच्या तपमानावर फक्त लिथियम प्रतिक्रिया देते, नायट्राइड तयार करतात:
6Li + N2 = 2Li3N
गरम झाल्यावर:
3Ca + N2 = Ca3N2
सोने वगळता सर्व धातू सल्फरसह प्रतिक्रिया देतात आणि प्लॅटिनम:
लोह यांच्याशी संवाद साधतो राखाडीगरम झाल्यावर सल्फाइड तयार होतो:
फक्त सर्वात सक्रिय धातू, म्हणजे, बी वगळता IA आणि IIA गटातील धातू, हायड्रोजनवर प्रतिक्रिया देतात. गरम झाल्यावर प्रतिक्रिया होतात आणि हायड्राइड्स तयार होतात. प्रतिक्रियांमध्ये, धातू कमी करणारे एजंट म्हणून कार्य करते, हायड्रोजनची ऑक्सीकरण स्थिती −1 आहे:
केवळ सर्वात सक्रिय धातू कार्बनवर प्रतिक्रिया देतात. या प्रकरणात, ऍसिटिलेनाइड्स किंवा मेथॅनाइड्स तयार होतात. पाण्याशी प्रतिक्रिया करताना, ॲसिटिलायड्स ॲसिटिलीन देतात, मिथेनाइड्स मिथेन देतात.
2Na + 2C = Na2C2
Na2C2 + 2H2O = 2NaOH + C2H2
अलॉयिंग म्हणजे मेल्टमध्ये अतिरिक्त घटकांचा परिचय जो यांत्रिक, भौतिक आणि सुधारित करतो रासायनिक गुणधर्ममुख्य साहित्य.
सूक्ष्म रचना
धातूंचे वैशिष्ट्यपूर्ण गुणधर्म त्यांच्या आधारे समजू शकतात अंतर्गत रचना. त्या सर्वांचे न्यूक्लियससह बाह्य ऊर्जा पातळीच्या इलेक्ट्रॉन्सचे (दुसऱ्या शब्दात, व्हॅलेन्स इलेक्ट्रॉन) कमकुवत कनेक्शन आहे. यामुळे, कंडक्टरमध्ये निर्माण झालेल्या संभाव्य फरकामुळे क्रिस्टल जाळीमध्ये इलेक्ट्रॉनची (ज्याला वहन इलेक्ट्रॉन म्हणतात) हिमस्खलनासारखी हालचाल होते. अशा इलेक्ट्रॉन्सच्या संग्रहाला बहुधा इलेक्ट्रॉन गॅस म्हणतात. इलेक्ट्रॉन्स व्यतिरिक्त, फोनॉन्स (जाळी कंपन) थर्मल चालकतेमध्ये योगदान देतात. प्लॅस्टिकिटी हे विस्थापनांच्या हालचाली आणि क्रिस्टलोग्राफिक विमानांच्या कातरणेमध्ये कमी उर्जा अडथळा असल्यामुळे आहे. कठोरता मोठ्या संख्येने संरचनात्मक दोष (इंटरस्टिशियल अणू इ.) द्वारे स्पष्ट केली जाऊ शकते.
इलेक्ट्रॉन सहज सोडल्यामुळे, धातूंचे ऑक्सिडेशन शक्य आहे, ज्यामुळे गंज आणि गुणधर्मांचे आणखी ऱ्हास होऊ शकतो. ऑक्सिडाइझ करण्याची क्षमता धातूंच्या मानक क्रियाकलाप मालिकेद्वारे ओळखली जाऊ शकते. ही वस्तुस्थिती इतर घटकांच्या संयोजनात धातू वापरण्याची आवश्यकता पुष्टी करते (मिश्रधातू, त्यापैकी सर्वात महत्वाचे आहे स्टील), त्यांचे मिश्र धातु आणि विविध कोटिंग्जचा वापर.
धातूंच्या इलेक्ट्रॉनिक गुणधर्मांच्या अधिक अचूक वर्णनासाठी, क्वांटम मेकॅनिक्स वापरणे आवश्यक आहे. पुरेशी सममिती असलेल्या सर्व घन पदार्थांमध्ये, वैयक्तिक अणूंच्या इलेक्ट्रॉन्सची ऊर्जा पातळी ओव्हरलॅप होऊन अनुमत बँड बनवतात आणि व्हॅलेन्स इलेक्ट्रॉन्सद्वारे तयार झालेल्या बँडला व्हॅलेन्स बँड म्हणतात. धातूंमधील व्हॅलेन्स इलेक्ट्रॉनचे कमकुवत कनेक्शन हे वस्तुस्थितीकडे नेत आहे की धातूंमधील व्हॅलेन्स बँड खूप विस्तृत आहे आणि सर्व व्हॅलेन्स इलेक्ट्रॉन ते पूर्णपणे भरण्यासाठी पुरेसे नाहीत.
अशा अर्धवट भरलेल्या झोनचे मूलभूत वैशिष्ट्य म्हणजे किमान लागू केलेल्या व्होल्टेजवरही, नमुन्यामध्ये व्हॅलेन्स इलेक्ट्रॉनची पुनर्रचना सुरू होते, म्हणजेच विद्युत प्रवाह वाहतो.
इलेक्ट्रॉनच्या समान उच्च गतिशीलतेमुळे उच्च थर्मल चालकता, तसेच इलेक्ट्रोमॅग्नेटिक रेडिएशन (जे धातूंना त्यांची वैशिष्ट्यपूर्ण चमक देते) स्पेक्युलरपणे परावर्तित करण्याची क्षमता देते.
अल्कली धातू
धातू आहे
अल्कली धातू हे D.I. दिमित्री इव्हानोविच मेंडेलीव्हच्या रासायनिक घटकांच्या आवर्त सारणीच्या गट I च्या मुख्य उपसमूहाचे घटक आहेत: लिथियम ली, सोडियम ना, पोटॅशियम के, रुबिडियम आरबी, सीझियम सी आणि फ्रॅन्सियम फ्र. या धातूंना अल्कधर्मी धातू म्हणतात कारण त्यांची बहुतेक संयुगे पाण्यात विरघळणारी असतात. स्लाव्हिकमध्ये, "लीच" म्हणजे "विरघळणे", ज्याने या धातूंच्या गटाचे नाव निश्चित केले. जेव्हा अल्कली धातू पाण्यात विरघळतात तेव्हा अल्कली नावाचे विद्रव्य हायड्रॉक्साइड तयार होतात.
अल्कली धातूंची सामान्य वैशिष्ट्ये
नियतकालिक सारणीमध्ये ते ताबडतोब उदात्त वायूंचे अनुसरण करतात, म्हणून अल्कली धातूच्या अणूंच्या संरचनेचे वैशिष्ठ्य म्हणजे त्यांच्यामध्ये नवीन ऊर्जा स्तरावर एक इलेक्ट्रॉन असतो: त्यांचे इलेक्ट्रॉन कॉन्फिगरेशन ns1. साहजिकच, अल्कली धातूंचे व्हॅलेन्स इलेक्ट्रॉन सहज काढले जाऊ शकतात कारण अणूला इलेक्ट्रॉन सोडणे आणि अक्रिय वायू कॉन्फिगरेशन प्राप्त करणे ऊर्जावानदृष्ट्या अनुकूल आहे. म्हणून, सर्व अल्कली धातू गुणधर्म कमी करून दर्शविले जातात. हे त्यांच्या आयनीकरण क्षमतांच्या कमी मूल्यांद्वारे पुष्टी होते (सीझियम अणूची आयनीकरण क्षमता सर्वात कमी आहे) आणि इलेक्ट्रोनेगेटिव्हिटी (ईओ).
या उपसमूहातील सर्व धातू चांदीच्या-पांढऱ्या रंगाच्या आहेत (चांदी-पिवळे सिझियम वगळता), ते खूप मऊ आहेत आणि स्केलपेलने कापले जाऊ शकतात. लिथियम, सोडियम आणि पोटॅशियम हे पाण्यापेक्षा हलके असतात आणि त्याच्या पृष्ठभागावर तरंगतात आणि त्यावर प्रतिक्रिया देतात.
अल्कली धातू निसर्गात संयुगेच्या स्वरूपात आढळतात ज्यामध्ये एकल चार्ज केलेले केशन असतात. अनेक खनिजांमध्ये गट I च्या मुख्य उपसमूहातील धातू असतात. उदाहरणार्थ, ऑर्थोक्लेझ किंवा फेल्डस्पार, पोटॅशियम ॲल्युमिनोसिलिकेट K2, समान खनिजसोडियम - अल्बाइट - ची रचना Na2 आहे. समुद्राच्या पाण्यात सोडियम क्लोराईड NaCl असते आणि मातीमध्ये पोटॅशियम क्षार असतात - सिल्विन KCl, sylvinite NaCl. KCl, carnallite KCl. MgCl2. 6H2O, polyhalite K2SO4. MgSO4. CaSO4. 2H2O.
अल्कली धातूंचे रासायनिक गुणधर्म
धातू आहे
पाणी, ऑक्सिजन आणि नायट्रोजनच्या संबंधात अल्कली धातूंच्या उच्च रासायनिक क्रियांमुळे, ते रॉकेलच्या थराखाली साठवले जातात. अल्कली धातूसह प्रतिक्रिया करण्यासाठी, इच्छित आकाराचा तुकडा थराखाली स्केलपेलने काळजीपूर्वक कापला जातो. रॉकेल, आर्गॉन वातावरणात, धातूची पृष्ठभाग त्याच्या हवेशी परस्परसंवादाच्या उत्पादनांपासून पूर्णपणे स्वच्छ केली जाते आणि त्यानंतरच नमुना प्रतिक्रिया पात्रात ठेवला जातो.
1. पाण्याशी संवाद. अल्कली धातूंचा एक महत्त्वाचा गुणधर्म म्हणजे त्यांची पाण्याबद्दलची उच्च क्रिया. लिथियम पाण्याशी सर्वात शांतपणे (विस्फोटाशिवाय) प्रतिक्रिया देते.
जेव्हा अशीच प्रतिक्रिया केली जाते तेव्हा सोडियम पिवळ्या ज्वालाने जळतो आणि एक छोटासा स्फोट होतो. पोटॅशियम आणखी सक्रिय आहे: या प्रकरणात, स्फोट जास्त मजबूत आहे, आणि ज्वाला रंगीत जांभळा आहे.
2. ऑक्सिजनसह संवाद. हवेतील अल्कली धातूंच्या ज्वलन उत्पादनांमध्ये धातूच्या क्रियाकलापांवर अवलंबून भिन्न रचना असतात.
फक्त लिथियम हवेत जळत स्टोइचिओमेट्रिक रचनेचा ऑक्साइड तयार करतो.
जेव्हा सोडियम जळतो तेव्हा Na2O2 पेरोक्साइड प्रामुख्याने NaO2 सुपरऑक्साइडच्या लहान मिश्रणाने तयार होतो.
पोटॅशियम, रुबिडियम आणि सीझियमच्या ज्वलन उत्पादनांमध्ये प्रामुख्याने सुपरऑक्साइड असतात.
सोडियम आणि पोटॅशियम ऑक्साईड्स मिळविण्यासाठी, हायड्रॉक्साईड, पेरोक्साइड किंवा सुपरऑक्साइडचे मिश्रण जास्त प्रमाणात धातूसह ऑक्सिजनच्या अनुपस्थितीत गरम केले जाते.
खालील पॅटर्न अल्कली धातूंच्या ऑक्सिजन संयुगांचे वैशिष्ट्य आहे: अल्कली धातूच्या केशनची त्रिज्या जसजशी वाढते तसतसे पेरोक्साइड आयन O22 आणि सुपरऑक्साइड आयन O2- असलेल्या ऑक्सिजन संयुगांची स्थिरता वाढते.
जड अल्कली धातू EO3 रचनेसह बऱ्यापैकी स्थिर ओझोनाइड्सच्या निर्मितीद्वारे वैशिष्ट्यीकृत आहेत. सर्व ऑक्सिजन संयुगे वेगवेगळे रंग आहेत, ज्याची तीव्रता Li ते Cs या मालिकेत खोलवर जाते.
अल्कली मेटल ऑक्साईड्समध्ये मूलभूत ऑक्साईडचे सर्व गुणधर्म असतात: ते पाणी, अम्लीय ऑक्साईड आणि ऍसिडसह प्रतिक्रिया देतात.
पेरोक्साइड आणि सुपरऑक्साइड मजबूत ऑक्सिडायझिंग एजंट्सचे गुणधर्म प्रदर्शित करतात.
पेरोक्साइड आणि सुपरऑक्साइड्स पाण्याशी तीव्रतेने संवाद साधतात, हायड्रॉक्साइड तयार करतात.
3. इतर पदार्थांसह परस्परसंवाद. अल्कली धातू अनेक नॉनमेटल्सवर प्रतिक्रिया देतात. गरम केल्यावर ते हायड्रोजनसह एकत्रित होऊन हायड्राइड्स, हॅलोजन, राखाडी, नायट्रोजन, फॉस्फरस, कार्बन आणि सिलिकॉन, अनुक्रमे हॅलाइड्स, सल्फाइड्स, नायट्राइड्स, फॉस्फाइड्स, कार्बाइड्स आणि सिलिकॉन तयार होतात.
गरम केल्यावर, अल्कली धातू इतर धातूंशी प्रतिक्रिया देण्यास सक्षम असतात, ज्यामुळे इंटरमेटॅलिक संयुगे तयार होतात. अल्कली धातू ऍसिडसह सक्रियपणे (स्फोटकपणे) प्रतिक्रिया देतात.
अल्कली धातू द्रव अमोनिया आणि त्याच्या डेरिव्हेटिव्ह्जमध्ये विरघळतात - अमाइन्स आणि एमाइड्स.
द्रव अमोनिया मध्ये विसर्जित तेव्हा अल्कली धातूएक इलेक्ट्रॉन गमावतो, जो अमोनियाच्या रेणूंद्वारे सोडवला जातो आणि द्रावणाला निळा रंग देतो. परिणामी अमाइड्स पाण्याद्वारे सहजपणे विघटित होऊन अल्कली आणि अमोनिया तयार होतात.
अल्कली धातू सेंद्रिय पदार्थ, अल्कोहोल (अल्कोहोल तयार करण्यासाठी) आणि कार्बोक्झिलिक ऍसिड (क्षार तयार करण्यासाठी) यांच्याशी संवाद साधतात.
4. अल्कली धातूंचे गुणात्मक निर्धारण. अल्कली धातूंचे आयनीकरण क्षमता लहान असल्याने, जेव्हा धातू किंवा त्याची संयुगे ज्वालामध्ये गरम केली जातात, तेव्हा अणू आयनीकृत होते, ज्वाला विशिष्ट रंग देते.
अल्कली धातू तयार करणे
1. अल्कली धातू मिळविण्यासाठी, ते प्रामुख्याने त्यांच्या हॅलाइड्सच्या वितळलेल्या इलेक्ट्रोलिसिसचा वापर करतात, बहुतेकदा क्लोराईड, जे नैसर्गिक बनतात. खनिजे:
कॅथोड: Li+ + e → Li
एनोड: 2Cl- — 2e → Cl2
2. कधीकधी, अल्कली धातू मिळविण्यासाठी, त्यांच्या हायड्रॉक्साईड्सच्या वितळण्याचे इलेक्ट्रोलिसिस केले जाते:
कॅथोड: Na+ + e → Na
एनोड: 4OH- – 4e → 2H2O + O2
इलेक्ट्रोकेमिकल व्होल्टेज मालिकेत अल्कली धातू हायड्रोजनच्या डावीकडे स्थित असल्याने, मीठ द्रावणातून त्यांची इलेक्ट्रोलाइटिक तयारी अशक्य आहे; या प्रकरणात, संबंधित अल्कली आणि हायड्रोजन तयार होतात.
हायड्रॉक्साइड
अल्कली मेटल हायड्रॉक्साईड्स मिळविण्यासाठी, इलेक्ट्रोलाइटिक पद्धती प्रामुख्याने वापरल्या जातात. टेबल सॉल्टच्या एकाग्र जलीय द्रावणाच्या इलेक्ट्रोलिसिसद्वारे सोडियम हायड्रॉक्साईडचे उत्पादन हे सर्वात मोठ्या प्रमाणात उत्पादन आहे.
पूर्वी, अल्कली एक्सचेंज अभिक्रियाद्वारे प्राप्त केली जात होती.
अशा प्रकारे मिळवलेली अल्कली Na2CO3 सोड्याने मोठ्या प्रमाणात दूषित होती.
अल्कली मेटल हायड्रॉक्साइड हे पांढरे हायग्रोस्कोपिक पदार्थ आहेत, ज्याचे जलीय द्रावण मजबूत तळ आहेत. ते बेसच्या वैशिष्ट्यपूर्ण सर्व प्रतिक्रियांमध्ये भाग घेतात - ते ऍसिड, ऍसिडिक आणि ॲम्फोटेरिक ऑक्साईड्स आणि ॲम्फोटेरिक हायड्रॉक्साइडसह प्रतिक्रिया देतात.
गरम केल्यावर, लिथियम हायड्रॉक्साईडचा अपवाद वगळता अल्कली धातूचे हायड्रॉक्साइड विघटन न करता उदात्तीकरण करतात, जे, गट II च्या मुख्य उपसमूहातील धातूंच्या हायड्रॉक्साईड्सप्रमाणे, कॅलक्लाइंड केल्यावर ऑक्साईड आणि पाण्यात विघटित होतात.
सोडियम हायड्रॉक्साईडचा वापर साबण, सिंथेटिक डिटर्जंट्स, कृत्रिम तंतू आणि सेंद्रिय संयुगे जसे की फिनॉल तयार करण्यासाठी केला जातो.
कार्बोनेट
अल्कली धातू असलेले एक महत्त्वाचे उत्पादन म्हणजे सोडा Na2CO3. 20 व्या शतकाच्या सुरूवातीस प्रस्तावित केलेल्या सॉल्वे पद्धतीचा वापर करून जगभरातील मोठ्या प्रमाणात सोडा तयार केला जातो. पद्धतीचे सार खालीलप्रमाणे आहे: NaCl चे जलीय द्रावण, ज्यामध्ये अमोनिया जोडला जातो, 26 - 30 डिग्री सेल्सियस तापमानात कार्बन डायऑक्साइडसह संतृप्त होतो. हे किंचित विरघळणारे सोडियम बायकार्बोनेट तयार करते, ज्याला बेकिंग सोडा म्हणतात.
जेव्हा कार्बन डायऑक्साइड द्रावणात जातो तेव्हा उद्भवणाऱ्या अम्लीय वातावरणाला तटस्थ करण्यासाठी आणि सोडियम बायकार्बोनेटच्या अवक्षेपणासाठी आवश्यक असलेले बायकार्बोनेट आयन HCO3 तयार करण्यासाठी अमोनिया जोडला जातो. बेकिंग सोडा वेगळे केल्यानंतर, अमोनियम क्लोराईड असलेले द्रावण चुनासह गरम केले जाते आणि अमोनिया सोडला जातो, जो प्रतिक्रिया झोनमध्ये परत येतो.
अशा प्रकारे, सोडा तयार करण्याच्या अमोनिया पद्धतीसह, कॅल्शियम क्लोराईड हा एकमेव कचरा आहे, जो द्रावणात राहतो आणि त्याचा मर्यादित वापर आहे.
जेव्हा सोडियम बायकार्बोनेट कॅल्साइन केले जाते तेव्हा ते सोडा ॲश, किंवा वॉशिंग सोडा, Na2CO3 आणि कार्बन डायऑक्साइड तयार करते, जे सोडियम बायकार्बोनेट तयार करण्याच्या प्रक्रियेत वापरले जाते.
सोडाचा मुख्य खरेदीदार काच आहे.
कमी प्रमाणात विरघळणारे आम्ल मीठ NaHCO3 विपरीत, पोटॅशियम बायकार्बोनेट KHCO3 हे पाण्यात अत्यंत विरघळणारे आहे, म्हणून पोटॅशियम कार्बोनेट किंवा पोटॅश, K2CO3 हे पोटॅशियम हायड्रॉक्साईडच्या द्रावणावर कार्बन डायऑक्साइडच्या क्रियेद्वारे प्राप्त होते.
पोटॅशचा वापर काच आणि द्रव साबणाच्या उत्पादनात केला जातो.
लिथियम हा एकमेव अल्कली धातू आहे ज्यासाठी बायकार्बोनेट मिळालेले नाही. या इंद्रियगोचरचे कारण म्हणजे लिथियम आयनची अतिशय लहान त्रिज्या, जी त्यास त्याऐवजी मोठे HCO3- आयन ठेवू देत नाही.
लिथियम
धातू आहे
लिथियम हा पहिल्या गटातील मुख्य उपसमूहाचा एक घटक आहे, रासायनिक घटकांच्या आवर्त सारणीचा दुसरा कालावधी D.I. मेंडेलीव्ह दिमित्री इव्हानोविच, अणुक्रमांक 3 सह. Li (lat. लिथियम) या चिन्हाने दर्शविले जाते. एलिमेंटल पदार्थ लिथियम (CAS क्रमांक: 7439-93-2) हा चांदीसारखा पांढरा रंग असलेला मऊ अल्कली धातू आहे.
लिथियमचा शोध 1817 मध्ये स्वीडिश रसायनशास्त्रज्ञ आणि खनिजशास्त्रज्ञ ए. अर्फवेडसन यांनी प्रथम खनिज पेटालाइट (Li,Na) मध्ये आणि नंतर स्पोड्युमिन LiAl आणि लेपिडोलाइट KLi1.5Al1.5(F,OH)2 मध्ये शोधला. लिथियम धातूचा शोध प्रथम 1825 मध्ये हम्फ्री डेव्हीने लावला होता.
लिथियमला त्याचे नाव मिळाले कारण ते "दगड" (ग्रीक λίθος - दगड) मध्ये सापडले होते. मूलतः "लिथिऑन" असे म्हणतात, आधुनिक नाव बर्झेलियसने सुचवले होते.
लिथियम हा चांदीसारखा पांढरा धातू आहे, मऊ आणि लवचिक आहे, सोडियमपेक्षा कठिण पण शिशापेक्षा मऊ आहे. दाबून आणि रोल करून त्यावर प्रक्रिया केली जाऊ शकते.
खोलीच्या तपमानावर, लिथियम धातूमध्ये शरीर-केंद्रित क्यूबिक जाळी (समन्वय क्रमांक 8) असते, जी थंड प्रक्रिया केल्यावर क्यूबिक क्लोज-पॅक्ड जालीमध्ये रूपांतरित होते, जिथे दुहेरी क्यूबोक्टहेड्रल समन्वय असलेला प्रत्येक अणू 12 इतरांनी वेढलेला असतो. 78 K च्या खाली, स्थिर क्रिस्टल फॉर्म ही एक षटकोनी क्लोज-पॅक केलेली रचना आहे ज्यामध्ये प्रत्येक लिथियम अणूला क्यूबोक्टहेड्रॉनच्या शिरोबिंदूवर 12 जवळचे शेजारी असतात.
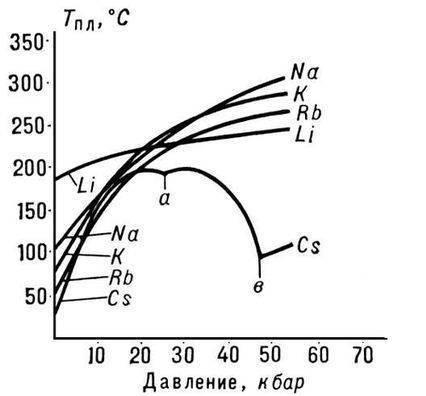
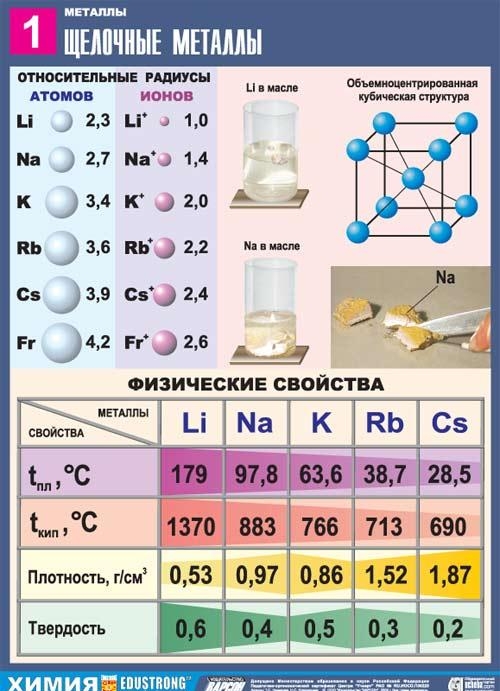
सर्व अल्कली धातूंपैकी, लिथियममध्ये सर्वाधिक वितळणारे आणि उकळण्याचे बिंदू आहेत (अनुक्रमे 180.54 आणि 1340 °C), आणि सर्व धातूंच्या खोलीच्या तपमानावर त्याची घनता सर्वात कमी आहे (0.533 g/cm3, पाण्याच्या घनतेच्या जवळजवळ अर्धा).
लिथियम अणूच्या लहान आकारामुळे धातूचे विशेष गुणधर्म दिसून येतात. उदाहरणार्थ, ते सोडियममध्ये फक्त 380 डिग्री सेल्सियसपेक्षा कमी तापमानात मिसळते आणि वितळलेल्या पोटॅशियम, रुबिडियम आणि सीझियममध्ये मिसळत नाही, तर इतर अल्कली धातूच्या जोड्या कोणत्याही प्रमाणात एकमेकांशी मिसळतात.
अल्कली धातू, हवेत अस्थिर. लिथियम हा सर्वात कमी सक्रिय अल्कली धातू आहे; खोलीच्या तपमानावर ते कोरड्या हवेवर (आणि कोरड्या ऑक्सिजनसह) व्यावहारिकपणे प्रतिक्रिया देत नाही.
दमट हवेत ते हळूहळू ऑक्सिडाइझ होऊन Li3N नायट्राइड, LiOH हायड्रॉक्साइड आणि Li2CO3 कार्बोनेटमध्ये बदलते. ऑक्सिजनमध्ये गरम केल्यावर ते जळते, ऑक्साईड Li2O मध्ये बदलते. एक मनोरंजक वैशिष्ट्य आहे की तापमान श्रेणी 100 °C ते 300 °C पर्यंत, लिथियम दाट ऑक्साईड फिल्मने झाकलेले असते आणि पुढे ऑक्सिडाइझ होत नाही.
1818 मध्ये, जर्मन रसायनशास्त्रज्ञ लिओपोल्ड ग्मेलिन यांनी स्थापित केले की लिथियम आणि त्याचे क्षार ज्वाला कार्माइन लाल रंग देतात, हे लिथियमच्या निर्धारासाठी एक गुणात्मक चिन्ह आहे. ज्वलन तापमान सुमारे 300 डिग्री सेल्सियस आहे. ज्वलन उत्पादने नासोफरीनक्सच्या श्लेष्मल झिल्लीला त्रास देतात.
शांतपणे, स्फोट किंवा आग न लावता, पाण्यासह, LiOH आणि H2 तयार करते. ते इथाइल अल्कोहोलवर देखील प्रतिक्रिया देते, अल्कोहोलेट तयार करते, अमोनियासह आणि हॅलोजनसह (आयोडीनसह - फक्त गरम झाल्यावर).
लिथियम हे पेट्रोलियम इथर, पॅराफिन, गॅसोलीन आणि/किंवा खनिज तेल हर्मेटिकली सीलबंद टिन बॉक्समध्ये साठवले जाते. लिथियम धातू त्वचेच्या, श्लेष्मल झिल्ली आणि डोळ्यांच्या संपर्कात आल्यास जळते.
फेरस आणि नॉन-फेरस मेटलर्जीमध्ये, लिथियमचा वापर डीऑक्सिडाइझ करण्यासाठी आणि मिश्रधातूंची लवचिकता आणि ताकद वाढवण्यासाठी केला जातो. लिथियमचा वापर कधीकधी मेटॅलोथर्मी पद्धती वापरून दुर्मिळ धातू पुनर्प्राप्त करण्यासाठी केला जातो.
एल्युमिनियम स्मेल्टिंगमध्ये लिथियम कार्बोनेट हा सर्वात महत्त्वाचा सहायक पदार्थ (इलेक्ट्रोलाइटमध्ये जोडला जातो) आहे आणि त्याचा वापर दरवर्षी जागतिक ॲल्युमिनियम उत्पादनाच्या प्रमाणात वाढत आहे (लिथियम कार्बोनेटचा वापर 2.5-3.5 किलो प्रति टन ॲल्युमिनियम स्मेल्टेड आहे).
चांदी आणि सोन्याचे लिथियम मिश्र धातु तसेच कपरम हे अतिशय प्रभावी सोल्डर आहेत. मॅग्नेशियम, स्कँडियम, कपरम, कॅडमियम आणि ॲल्युमिनियमसह लिथियम मिश्र हे विमानचालन आणि अंतराळविज्ञानातील नवीन आशादायक सामग्री आहेत. लिथियम ॲल्युमिनेट आणि सिलिकेटवर आधारित, सिरॅमिक्स तयार केले गेले आहेत जे खोलीच्या तपमानावर कठोर होतात आणि लष्करी तंत्रज्ञान, धातू विज्ञान आणि भविष्यात थर्मोन्यूक्लियर उर्जेमध्ये वापरले जातात. लिथियम ॲल्युमिनियम सिलिकेटपासून बनवलेल्या काचेला, सिलिकॉन कार्बाइड तंतूंनी बळकट केले आहे, त्याची ताकद प्रचंड आहे. लिथियम शिशाच्या मिश्रधातूंना बळकट करण्यासाठी आणि त्यांना लवचिकता आणि गंजांना प्रतिकार करण्यासाठी खूप प्रभावी आहे.
लिथियम क्षारांचा सायकोट्रॉपिक प्रभाव असतो आणि ते अनेक मानसिक आजारांच्या प्रतिबंध आणि उपचारांसाठी औषधांमध्ये वापरले जातात. या सामग्रीचा सर्वात सामान्य प्रकार म्हणजे लिथियम कार्बोनेट. बायपोलर डिसऑर्डर आणि वारंवार मूड बदलणाऱ्या लोकांच्या मनःस्थिती स्थिर करण्यासाठी मानसोपचारात वापरले जाते. हे मॅनिक डिप्रेशन रोखण्यासाठी प्रभावी आहे आणि आत्महत्या कमी करते. डॉक्टरांनी वारंवार निरीक्षण केले आहे की काही लिथियम संयुगे (योग्य डोसमध्ये, अर्थातच) मॅनिक डिप्रेशनने ग्रस्त असलेल्या रुग्णांवर सकारात्मक परिणाम करतात. हा परिणाम दोन प्रकारे स्पष्ट केला जाऊ शकतो. एकीकडे, हे स्थापित केले गेले आहे की लिथियम इंटरसेल्युलर द्रवपदार्थातून मेंदूच्या पेशींमध्ये सोडियम आणि पोटॅशियम आयनच्या हस्तांतरणामध्ये गुंतलेल्या काही एन्झाईम्सच्या क्रियाकलापांचे नियमन करण्यास सक्षम आहे. दुसरीकडे, हे लक्षात आले आहे की लिथियम आयन थेट सेलच्या आयनिक संतुलनावर परिणाम करतात. आणि रुग्णाची स्थिती मुख्यत्वे सोडियम आणि पोटॅशियमच्या संतुलनावर अवलंबून असते: पेशींमध्ये जास्त प्रमाणात सोडियम उदासीन रूग्णांसाठी वैशिष्ट्यपूर्ण आहे, एक कमतरता - उन्माद ग्रस्त लोकांसाठी. सोडियम-पोटॅशियम संतुलन समतल करून, लिथियम लवणांचा दोन्हीवर सकारात्मक प्रभाव पडतो.
सोडियम
धातू आहे
सोडियम हा पहिल्या गटातील मुख्य उपसमूहाचा एक घटक आहे, तिसरा कालावधीरासायनिक घटकांचे आवर्त सारणी D.I. दिमित्री इव्हानोविच मेंडेलीव्ह, अणुक्रमांक 11 सह. Na (lat. Natrium) या चिन्हाने दर्शविले जाते. साधा पदार्थ सोडियम (CAS क्रमांक: 7440-23-5) हा चांदीसारखा पांढरा रंग असलेला मऊ अल्कली धातू आहे.
पाण्यात, सोडियम जवळजवळ लिथियमसारखेच वागते: हायड्रोजनच्या जलद प्रकाशनासह प्रतिक्रिया पुढे जाते आणि द्रावणात सोडियम हायड्रॉक्साईड तयार होते.
सोडियम (किंवा त्याऐवजी, त्याची संयुगे) प्राचीन काळापासून वापरली जात आहे. उदाहरणार्थ, सोडा (नॅट्रॉन), इजिप्तमधील सोडा तलावांच्या पाण्यात नैसर्गिकरित्या आढळतो. प्राचीन इजिप्शियन लोक सुशोभित करण्यासाठी, कॅनव्हास ब्लीच करण्यासाठी, अन्न शिजवण्यासाठी आणि पेंट आणि ग्लेझ बनवण्यासाठी नैसर्गिक सोडा वापरत. प्लिनी द एल्डर लिहितात की नाईल डेल्टामध्ये, सोडा (त्यात अशुद्धतेचे पुरेसे प्रमाण होते) नदीच्या पाण्यापासून वेगळे केले गेले. कोळशाच्या मिश्रणामुळे ते मोठ्या तुकड्या, रंगीत राखाडी किंवा अगदी काळ्या स्वरूपात विक्रीसाठी गेले.
सोडियम प्रथम इंग्रजी रसायनशास्त्रज्ञ हम्फ्री डेव्ही यांनी 1807 मध्ये घन NaOH च्या इलेक्ट्रोलिसिसद्वारे मिळवला होता.
"सोडियम" (नॅट्रिअम) हे नाव अरबी नॅट्रून (ग्रीकमध्ये - नायट्रॉन) वरून आले आहे आणि मूलतः त्याचा संदर्भ नैसर्गिक सोडा आहे. या घटकालाच पूर्वी सोडिया (लॅट. सोडियम) म्हटले जात असे.

सोडियम हा एक चांदीचा-पांढरा धातू आहे, जांभळ्या रंगाच्या पातळ थरांमध्ये, प्लास्टिक, अगदी मऊ (चाकूने सहजपणे कापला जातो), सोडियमचा ताजा कट चमकदार असतो. सोडियमची विद्युत चालकता आणि थर्मल चालकता यांचे मूल्य बरेच जास्त आहे, घनता 0.96842 g/cm3 आहे (19.7 ° C वर), वितळण्याचा बिंदू 97.86 ° C आहे, उत्कलन बिंदू 883.15 ° C आहे.
एक अल्कली धातू जो हवेत सहजपणे ऑक्सिडायझ होतो. वातावरणातील ऑक्सिजनपासून संरक्षण करण्यासाठी, धातूचा सोडियम एका थराखाली साठवला जातो रॉकेल. सोडियम लिथियमपेक्षा कमी सक्रिय आहे, म्हणून ते गरम झाल्यावरच नायट्रोजनसह प्रतिक्रिया देते:
जेव्हा ऑक्सिजनचे प्रमाण जास्त असते तेव्हा सोडियम पेरोक्साइड तयार होतो
2Na + O2 = Na2O2
तयारीच्या रसायनशास्त्रात सोडियम धातूचा मोठ्या प्रमाणावर वापर केला जातो उद्योगएक मजबूत कमी करणारे एजंट म्हणून, धातू शास्त्रासह. सोडियमचा वापर उच्च ऊर्जा-केंद्रित सोडियम-सल्फर बॅटरीच्या निर्मितीमध्ये केला जातो. हे ट्रक एक्झॉस्ट व्हॉल्व्हमध्ये उष्णता सिंक म्हणून देखील वापरले जाते. कधीकधी, सोडियम धातूचा वापर विद्युत तारांसाठी सामग्री म्हणून केला जातो ज्याचा हेतू खूप जास्त प्रवाह वाहून नेतो.
पोटॅशियम, तसेच रुबिडियम आणि सीझियमसह मिश्रधातूमध्ये, ते अत्यंत कार्यक्षम शीतलक म्हणून वापरले जाते. विशेषत:, मिश्रधातू सोडियम 12%, पोटॅशियम 47%, सीझियम 41% यांचा विक्रमी कमी वितळण्याचा बिंदू −78 °C आहे आणि ते आयन रॉकेट इंजिनसाठी कार्यरत द्रवपदार्थ आणि अणुऊर्जा प्रकल्पांसाठी शीतलक म्हणून प्रस्तावित होते.
उच्च आणि उच्च-वायू डिस्चार्ज दिवे मध्ये देखील सोडियम वापरले जाते. कमी दाब(NLVD आणि NLND). DNaT (आर्क सोडियम ट्यूबलर) प्रकारचे NLVD दिवे स्ट्रीट लाइटिंगमध्ये मोठ्या प्रमाणावर वापरले जातात. ते एक चमकदार पिवळा प्रकाश देतात. एचपीएस दिव्यांची सेवा आयुष्य 12-24 हजार तास आहे. म्हणून, एचपीएस प्रकारचे गॅस-डिस्चार्ज दिवे शहरी, आर्किटेक्चरल आणि औद्योगिक प्रकाशासाठी अपरिहार्य आहेत. DNaS, DNaMT (आर्क सोडियम मॅट), DNaZ (आर्क सोडियम मिरर) आणि DNaTBR (आर्क सोडियम ट्यूबलर विदाऊट पारा) दिवे देखील आहेत.
गुणात्मक विश्लेषणामध्ये सोडियम धातूचा वापर केला जातो सेंद्रिय पदार्थ. सोडियम आणि चाचणी पदार्थाचे मिश्रधातू इथेनॉलसह तटस्थ केले जाते, काही मिलिलिटर डिस्टिल्ड वॉटर जोडले जाते आणि 3 भागांमध्ये विभागले जाते, जे. लासेन्या (1843), नायट्रोजन, सल्फर आणि हॅलोजन (हॅलोजन) निर्धारित करण्याच्या उद्देशाने प्रयत्नबेलस्टीन)
सोडियम क्लोराईड (टेबल सॉल्ट) हे सर्वात जुने वापरलेले चव आणि संरक्षक आहे.
सोडियम ॲझाइड (Na3N) धातू शास्त्रात आणि लीड ॲझाइडच्या उत्पादनात नायट्राइडिंग एजंट म्हणून वापरला जातो.
सोडियम सायनाइड (NaCN) हा खडकांमधून सोने बाहेर काढण्याच्या हायड्रोमेटालर्जिकल पद्धतीमध्ये, तसेच स्टीलच्या नायट्रोकार्ब्युरायझेशनमध्ये आणि इलेक्ट्रोप्लेटिंग (सिल्व्हरिंग, गिल्डिंग) मध्ये वापरला जातो.
सोडियम क्लोरेट (NaClO3) चा वापर रेल्वे मार्गावरील अवांछित वनस्पती नष्ट करण्यासाठी केला जातो.
पोटॅशियम
पोटॅशियम हा पहिल्या गटातील मुख्य उपसमूहाचा एक घटक आहे, चौथा कालावधीडी.आय. मेंडेलीव्ह दिमित्री इव्हानोविच द्वारे रासायनिक घटकांची नियतकालिक प्रणाली, अणुक्रमांक 19 सह. K (lat. Kalium) द्वारे दर्शविले जाते. पोटॅशियम हा साधा पदार्थ (CAS क्रमांक: 7440-09-7) हा चांदीसारखा पांढरा रंग असलेला मऊ अल्कली धातू आहे.
निसर्गात, पोटॅशियम फक्त इतर घटकांच्या संयोगाने आढळते, उदाहरणार्थ समुद्राच्या पाण्यात आणि अनेक खनिजांमध्ये. हे हवेत खूप लवकर ऑक्सिडायझेशन करते आणि रासायनिक अभिक्रियांमध्ये, विशेषत: पाण्यासह, अल्कली तयार करते. बऱ्याच बाबतीत, पोटॅशियमचे रासायनिक गुणधर्म सोडियमसारखेच आहेत, परंतु दृष्टीने जैविक कार्यआणि ते सजीवांच्या पेशींद्वारे कसे वापरले जातात, तरीही ते भिन्न आहेत.
पोटॅशियम (अधिक तंतोतंत, त्याची संयुगे) प्राचीन काळापासून वापरली जात आहे. अशा प्रकारे, पोटॅशचे उत्पादन (जे डिटर्जंट म्हणून वापरले जात होते) 11 व्या शतकात आधीपासूनच अस्तित्वात होते. पेंढा किंवा लाकूड जाळताना तयार होणारी राख पाण्याने प्रक्रिया केली जाते आणि परिणामी द्रावण (लाय) फिल्टर केल्यानंतर बाष्पीभवन होते. कोरड्या अवशेषांमध्ये, पोटॅशियम कार्बोनेट व्यतिरिक्त, पोटॅशियम सल्फेट K2SO4, सोडा आणि पोटॅशियम क्लोराईड KCl समाविष्ट होते.
1807 मध्ये, इंग्रजी रसायनशास्त्रज्ञ डेव्ही यांनी घन पोटॅशियम हायड्रॉक्साईड (KOH) च्या इलेक्ट्रोलिसिसद्वारे पोटॅशियम वेगळे केले आणि त्याला "पोटॅशियम" (लॅटिन पोटॅशियम; हे नाव अद्याप इंग्रजी, फ्रेंच, स्पॅनिश, पोर्तुगीज आणि पोलिशमध्ये वापरले जाते) असे नाव दिले. 1809 मध्ये, एल.व्ही. गिल्बर्ट यांनी "पोटॅशियम" (लॅटिन कॅलियम, अरबी अल-काली - पोटॅश) हे नाव सुचवले. मध्ये हे नाव समाविष्ट होते जर्मन, तेथून उत्तर आणि पूर्व युरोपच्या बऱ्याच भाषांमध्ये (रशियनसह) आणि या घटकासाठी चिन्ह निवडताना “विजय” - के.
पोटॅशियम हा एक चांदीचा पदार्थ आहे ज्यामध्ये ताज्या पृष्ठभागावर एक वैशिष्ट्यपूर्ण चमक असते. खूप हलके आणि fusible. हे पारामध्ये तुलनेने चांगले विरघळते, मिश्रण तयार करते. जेव्हा पोटॅशियम (तसेच त्याचे संयुगे) बर्नरच्या ज्वालामध्ये जोडले जाते तेव्हा ते वैशिष्ट्यपूर्ण गुलाबी-व्हायलेट रंगात ज्योत रंगवते.
पोटॅशियम, इतर अल्कली धातूंप्रमाणे, विशिष्ट धातूचे गुणधर्म प्रदर्शित करते आणि ते अतिशय रासायनिकदृष्ट्या सक्रिय आहे, सहजपणे इलेक्ट्रॉन दान करते.
एक मजबूत कमी करणारे एजंट आहे. हे ऑक्सिजनसह इतके सक्रियपणे एकत्र होते की ऑक्साईड तयार होत नाही तर पोटॅशियम सुपरऑक्साइड KO2 (किंवा K2O4) तयार होतो. हायड्रोजन वातावरणात गरम केल्यावर पोटॅशियम हायड्राइड KH तयार होतो. हे सर्व नॉन-मेटल्स, हॅलाइड्स, सल्फाइड्स, नायट्राइड्स, फॉस्फाइड्स इत्यादींशी तसेच पाणी (प्रतिक्रिया स्फोटकपणे घडते), विविध ऑक्साईड्स आणि क्षार यासारख्या जटिल पदार्थांशी चांगले संवाद साधते. या प्रकरणात, ते इतर धातूंना मुक्त स्थितीत कमी करतात.
पोटॅशियम रॉकेलच्या थराखाली साठवले जाते.
पोटॅशियम आणि सोडियमचे मिश्रधातू, खोलीच्या तपमानावर द्रव, बंद प्रणालींमध्ये शीतलक म्हणून वापरले जाते, उदाहरणार्थ वेगवान न्यूट्रॉन अणुऊर्जा प्रकल्पांमध्ये. याव्यतिरिक्त, रुबिडियम आणि सीझियमसह त्याचे द्रव मिश्रधातू मोठ्या प्रमाणावर वापरले जातात. सोडियम 12%, पोटॅशियम 47%, सीझियम 41% च्या मिश्रधातूचा विक्रमी कमी वितळण्याचा बिंदू −78 °C आहे.
पोटॅशियम संयुगे हे सर्वात महत्वाचे बायोजेनिक घटक आहेत आणि म्हणून ते खत म्हणून वापरले जातात.
पोटॅशियम क्षारांचा इलेक्ट्रोप्लेटिंगमध्ये मोठ्या प्रमाणावर वापर केला जातो कारण, त्यांची किंमत तुलनेने जास्त असूनही, ते संबंधित सोडियम क्षारांपेक्षा अधिक विरघळणारे असतात आणि त्यामुळे विद्युत् प्रवाहाच्या वाढीव घनतेवर इलेक्ट्रोलाइट्सचे गहन ऑपरेशन प्रदान करतात.
पोटॅशियम हा सर्वात महत्वाचा बायोजेनिक घटक आहे, विशेषतः वनस्पती जगामध्ये. मातीमध्ये पोटॅशियमच्या कमतरतेमुळे, झाडे फारच खराब विकसित होतात आणि कमी होतात, म्हणूनच खनन केलेल्या पोटॅशियम लवणांपैकी सुमारे 90% खते म्हणून वापरली जातात.
नायट्रोजन आणि फॉस्फरससह पोटॅशियम हे वनस्पतींचे मुख्य पोषक घटक आहेत. वनस्पतींमध्ये पोटॅशियमचे कार्य, त्यांच्यासाठी आवश्यक असलेल्या इतर घटकांप्रमाणेच, काटेकोरपणे विशिष्ट आहे. वनस्पतींमध्ये पोटॅशियम आयनिक स्वरूपात असते. पोटॅशियम मुख्यत्वे पेशींच्या सायटोप्लाझम आणि व्हॅक्यूल्समध्ये आढळते. सुमारे 80% पोटॅशियम सेल सॅपमध्ये आढळते.
पोटॅशियमची कार्ये खूप वैविध्यपूर्ण आहेत. हे स्थापित केले गेले आहे की ते प्रकाशसंश्लेषणाच्या सामान्य प्रक्रियेस उत्तेजित करते, पानांच्या ब्लेडपासून इतर अवयवांमध्ये कार्बोहायड्रेट्सचा प्रवाह वाढवते तसेच साखरेचे संश्लेषण देखील करते.
पोटॅशियम फळे आणि भाजीपाला पिकांमध्ये मोनोसॅकेराइड्सचे संचय वाढवते, मूळ भाज्यांमध्ये साखरेचे प्रमाण वाढवते, बटाट्यांमधील स्टार्च, तृणधान्य पिकांच्या पेंढ्याच्या पेशींच्या भिंती जाड करते आणि राहण्यासाठी ब्रेडचा प्रतिकार वाढवते आणि फायबरची गुणवत्ता सुधारते. अंबाडी आणि भांग.
वनस्पतींच्या पेशींमध्ये कर्बोदकांमधे जमा होण्यास प्रोत्साहन देऊन, पोटॅशियम सेल सॅपचा ऑस्मोटिक दाब वाढवते आणि त्यामुळे वनस्पतींचा थंड प्रतिकार आणि दंव प्रतिरोध वाढवते.
पोटॅशियम वनस्पतींद्वारे केशन्सच्या स्वरूपात शोषले जाते आणि स्पष्टपणे, पेशींमध्ये या स्वरूपात राहते, सर्वात महत्वाचे जैवरासायनिक सक्रिय करते. प्रक्रियावनस्पतींच्या पेशींमध्ये, पोटॅशियम त्यांचा प्रतिकार वाढवते विविध रोग, वाढत्या हंगामात आणि काढणीनंतर, फळे आणि भाज्यांच्या ठेवण्याच्या गुणवत्तेत लक्षणीय सुधारणा होते.
पोटॅशियमच्या कमतरतेमुळे वनस्पतींमध्ये अनेक चयापचय विकार होतात, अनेक एंजाइमची क्रिया कमकुवत होते, कार्बोहायड्रेट आणि प्रथिने चयापचय विस्कळीत होते आणि खर्चश्वासोच्छवासासाठी कार्बोहायड्रेट. परिणामी, वनस्पतींची उत्पादकता कमी होते आणि उत्पादनाची गुणवत्ता कमी होते.



रुबिडियम
रुबिडियम हा पहिल्या गटाच्या मुख्य उपसमूहाचा एक घटक आहे, D.I. दिमित्री इव्हानोविच मेंडेलीव्हच्या रासायनिक घटकांच्या नियतकालिक सारणीचा पाचवा कालावधी, अणुक्रमांक 37 सह. हे Rb (lat. Rubidium) या चिन्हाने नियुक्त केले आहे. रुबिडियम हा साधा पदार्थ (CAS क्रमांक: 7440-17-7) हा चांदीसारखा पांढरा रंग असलेला मऊ अल्कली धातू आहे.
1861 मध्ये, जर्मन शास्त्रज्ञ रॉबर्ट विल्हेल्म बनसेन आणि गुस्ताव रॉबर्ट किर्चहॉफ यांनी, वर्णक्रमीय विश्लेषणाचा वापर करून नैसर्गिक ॲल्युमिनोसिलिकेट्सचा अभ्यास करून, त्यांच्यामध्ये एक नवीन घटक शोधला, ज्याला नंतर स्पेक्ट्रममधील सर्वात मजबूत रेषांच्या रंगावर आधारित रुबिडियम असे नाव देण्यात आले.
रुबिडियम चंदेरी-पांढऱ्या मऊ क्रिस्टल्स बनवते ज्यांना ताजे कापल्यावर धातूची चमक असते. ब्रिनेल कडकपणा 0.2 MN/mI (0.02 kgf/mmI). रुबिडियमची क्रिस्टल जाळी घन शरीर-केंद्रित आहे, a = 5.71 E (खोलीच्या तपमानावर). अणु त्रिज्या 2.48 E, Rb+ आयन त्रिज्या 1.49 E. घनता 1.525 g/cm (0 °C), वितळण्याचा बिंदू 38.9 °C, उत्कलन बिंदू 703 °C. विशिष्ट उष्णता क्षमता 335.2 J/(kg K), रेखीय विस्ताराचे थर्मल गुणांक 9.0·10-5 deg-1 (0-38 °C), लवचिक मॉड्यूलस 2.4 H/mІ (240 kgf/mmI), विशिष्ट खंड विद्युत प्रतिरोधकता 11.29 · 10-6 ohm·cm (20 °C); रुबिडियम पॅरामॅग्नेटिक आहे.
अल्कली धातू, हवेत अत्यंत अस्थिर (इग्निशनसह पाण्याच्या ट्रेसच्या उपस्थितीत हवेशी प्रतिक्रिया देते). सर्व प्रकारचे क्षार तयार करतात - मुख्यतः सहजपणे विरघळणारे (क्लोरेट्स आणि परक्लोरेट्स किंचित विद्रव्य असतात). रुबिडियम हायड्रॉक्साईड हा काच आणि इतर स्ट्रक्चरल आणि कंटेनर मटेरियलसाठी अतिशय आक्रमक पदार्थ आहे आणि जेव्हा ते वितळले जाते तेव्हा ते बहुतेक धातू (अगदी प्लॅटिनम देखील) नष्ट करते.
रुबिडियमचा वापर वैविध्यपूर्ण आहे आणि त्याच्या वापराच्या अनेक क्षेत्रांमध्ये ते सीझियमच्या सर्वात महत्वाच्या भौतिक वैशिष्ट्यांमध्ये निकृष्ट आहे हे असूनही, तरीही ही दुर्मिळ अल्कली धातू महत्त्वपूर्ण भूमिका बजावते. आधुनिक तंत्रज्ञान. रुबिडियमच्या वापराचे खालील क्षेत्र लक्षात घेतले जाऊ शकतात: उत्प्रेरक, इलेक्ट्रॉनिक उद्योग, विशेष ऑप्टिक्स, परमाणु, औषध.
रुबिडियमचा वापर केवळ त्याच्या शुद्ध स्वरूपातच नाही तर अनेक मिश्रधातू आणि रासायनिक संयुगेच्या स्वरूपात देखील केला जातो. हे लक्षात घेणे महत्त्वाचे आहे की रुबिडियमला कच्च्या मालाचा खूप चांगला आणि अनुकूल आधार आहे, परंतु त्याच वेळी सीझियम आणि रुबिडियमच्या बाबतीत संसाधनांच्या उपलब्धतेची परिस्थिती खूपच अनुकूल आहे, उदाहरणार्थ, उत्प्रेरक मध्ये (जिथे त्याने स्वतःला यशस्वीरित्या सिद्ध केले आहे).
समस्थानिक रुबिडियम-86 मोठ्या प्रमाणावर गॅमा दोष शोधणे, मापन तंत्रज्ञान, तसेच अनेक महत्त्वाच्या औषधांच्या निर्जंतुकीकरणात वापरले जाते. अन्न उत्पादने. सीझियमसह रुबिडियम आणि त्याचे मिश्र धातु हे उच्च-तापमान टर्बाइन युनिट्ससाठी एक अतिशय आशादायक शीतलक आणि कार्यरत माध्यम आहेत (या संदर्भात, रुबिडियम आणि सीझियम अलिकडच्या वर्षांत महत्त्वपूर्ण बनले आहेत आणि धातूंच्या अत्यंत उच्च किमतीच्या शक्यतांना मागे टाकत आहे. टर्बाइन युनिट्सची कार्यक्षमता नाटकीयरित्या वाढवणे, आणि म्हणून आणि कमी करणे खर्चइंधन आणि पर्यावरणीय प्रदूषण). रुबिडियम-आधारित प्रणाली कूलंट्स म्हणून मोठ्या प्रमाणावर वापरल्या जाणाऱ्या ट्रिनरी मिश्र धातु आहेत: सोडियम-पोटॅशियम-रुबिडियम आणि सोडियम-रुबिडियम-सीझियम.
उत्प्रेरकामध्ये, रुबिडियमचा वापर सेंद्रिय आणि अजैविक संश्लेषणात केला जातो. रुबिडियमची उत्प्रेरक क्रिया प्रामुख्याने अनेक महत्त्वाच्या उत्पादनांमध्ये पेट्रोलियम शुद्धीकरणासाठी वापरली जाते. रुबिडियम एसीटेट, उदाहरणार्थ, पाण्याच्या वायूपासून मिथेनॉल आणि उच्च अल्कोहोलच्या संश्लेषणासाठी वापरला जातो, जो कोळशाच्या भूमिगत गॅसिफिकेशन आणि कार आणि जेट इंधनासाठी कृत्रिम द्रव इंधनाच्या निर्मितीच्या संबंधात अत्यंत महत्त्वपूर्ण आहे. टेल्यूरियमसह रुबिडियमच्या अनेक मिश्रधातूंमध्ये स्पेक्ट्रमच्या अल्ट्राव्हायोलेट प्रदेशात सीझियम संयुगेपेक्षा जास्त संवेदनशीलता असते आणि म्हणूनच, या प्रकरणात, ते फोटोकन्व्हर्टरसाठी सामग्री म्हणून सीझियम -133 शी स्पर्धा करू शकते. विशेष स्नेहन रचनांचा (मिश्रधातू) भाग म्हणून, रुबिडियमचा वापर व्हॅक्यूममध्ये (रॉकेट आणि स्पेस टेक्नॉलॉजी) अत्यंत प्रभावी वंगण म्हणून केला जातो.
रुबिडियम हायड्रॉक्साईडचा वापर कमी-तापमानाच्या रासायनिक अणुभट्ट्यांसाठी इलेक्ट्रोलाइट तयार करण्यासाठी केला जातो आणि पोटॅशियम हायड्रॉक्साईडच्या द्रावणात त्याचे कार्यप्रदर्शन सुधारण्यासाठी एक जोड म्हणून देखील वापरले जाते. कमी तापमानआणि इलेक्ट्रोलाइटची विद्युत चालकता वाढवते. रुबिडियम धातूचा वापर हायड्राइड इंधन पेशींमध्ये केला जातो.
कपरम क्लोराईडसह मिश्रित रुबिडियम क्लोराईडचा वापर उच्च तापमान (400 °C पर्यंत) मोजण्यासाठी केला जातो.
रुबिडियम प्लाझ्मा लेझर रेडिएशन उत्तेजित करण्यासाठी वापरला जातो.
रुबिडियम क्लोराईडचा वापर इंधन पेशींमध्ये इलेक्ट्रोलाइट म्हणून केला जातो आणि रुबिडियम हायड्रॉक्साईडसाठीही असेच म्हटले जाऊ शकते, जे कोळशाचे थेट ऑक्सीकरण वापरून इंधन पेशींमध्ये इलेक्ट्रोलाइट म्हणून खूप प्रभावी आहे.
सिझियम
सीझियम हा पहिल्या गटाच्या मुख्य उपसमूहाचा एक घटक आहे, डी.आय. मेंडेलीव्ह दिमित्री इव्हानोविच यांनी रासायनिक घटकांच्या नियतकालिक प्रणालीचा सहावा कालावधी, अणुक्रमांक 55 सह. Cs (lat. Caesium) या चिन्हाने दर्शविले जाते. सीझियम हा साधा पदार्थ (CAS क्रमांक: 7440-46-2) हा चांदीच्या-पिवळ्या रंगाचा मऊ अल्कली धातू आहे. उत्सर्जन स्पेक्ट्रममध्ये दोन चमकदार निळ्या रेषांच्या उपस्थितीसाठी सीझियमला त्याचे नाव मिळाले (लॅटिन सेसियस - आकाश निळा).
1860 मध्ये जर्मन शास्त्रज्ञ R.W. Bunsen आणि G.R. Kirchhoff यांनी ऑप्टिकल स्पेक्ट्रोस्कोपीचा वापर करून जर्मनीच्या प्रजासत्ताकातील Durchheim मिनरल स्प्रिंगच्या पाण्यात सीझियमचा शोध लावला होता, ज्यामुळे वर्णक्रमीय विश्लेषण वापरून शोधण्यात आलेला पहिला घटक बनला होता. 1882 मध्ये स्वीडिश केमिस्ट के. सेटरबर्ग यांनी सीझियम सायनाइड (CsCN) आणि बेरियमच्या वितळलेल्या मिश्रणाच्या इलेक्ट्रोलिसिस दरम्यान सीझियमला त्याच्या शुद्ध स्वरूपात वेगळे केले.
मुख्य सीझियम खनिजे प्रदूषित आहेत आणि अत्यंत दुर्मिळ ॲव्होगाड्राईट (K,Cs). याव्यतिरिक्त, अशुद्धतेच्या रूपात, सीझियम अनेक ॲल्युमिनोसिलिकेट्समध्ये समाविष्ट आहे: लेपिडोलाइट, फ्लोगोपाइट, बायोटाइट, ॲमेझोनाइट, पेटालाइट, बेरील, झिनवाल्डाइट, ल्युसाइट, कार्नालाइट. औद्योगिक कच्चा माल म्हणून प्रदूषण आणि लेपिडोलाइटचा वापर केला जातो.
औद्योगिक उत्पादनात, संयुगेच्या स्वरूपात सीझियम खनिज प्रदूषणापासून काढले जाते. हे क्लोराईड किंवा सल्फेट ओपनिंगद्वारे केले जाते. प्रथम स्त्रोत खनिजावर गरम केलेल्या हायड्रोक्लोरिक ऍसिडसह उपचार करणे, Cs3 कंपाऊंडचा अवक्षेप करण्यासाठी अँटीमोनी क्लोराईड SbCl3 जोडणे आणि सीझियम क्लोराईड CsCl तयार करण्यासाठी गरम पाण्याने किंवा अमोनियाच्या द्रावणाने धुणे यांचा समावेश होतो. दुस-या प्रकरणात, गरम केलेल्या सल्फ्यूरिक ऍसिडने सीझियम अलम CsAl(SO4)2 · 12H2O तयार करण्यासाठी त्यावर प्रक्रिया केली जाते.
IN रशियाचे संघराज्ययूएसएसआरच्या पतनानंतर, प्रदुषणाचे औद्योगिक खाणकाम केले गेले नाही, जरी सोव्हिएत काळात मुर्मन्स्कजवळील व्होरोनिया टुंड्रामध्ये खनिजांचे प्रचंड साठे सापडले. रशियन उद्योग जोपर्यंत त्याच्या पायावर परत येण्यास सक्षम होता तोपर्यंत असे दिसून आले की कॅनेडियन कंपनीने हे क्षेत्र विकसित करण्याचा परवाना विकत घेतला आहे. सध्या, नोवोसिबिर्स्कमध्ये ZAO दुर्मिळ धातू प्लांटमध्ये प्रदूषणापासून सीझियम क्षारांची प्रक्रिया आणि निष्कर्षण चालते.
अनेक आहेत प्रयोगशाळा पद्धतीसीझियम मिळवणे. ते मिळू शकते:
व्हॅक्यूममध्ये सीझियम क्रोमेट किंवा डायक्रोमेटचे मिश्रण झिरकोनियमसह गरम करणे;
व्हॅक्यूममध्ये सीझियम अझाइडचे विघटन;
सीझियम क्लोराईड आणि खास तयार केलेले कॅल्शियम यांचे मिश्रण गरम करणे.
सर्व पद्धती श्रम-केंद्रित आहेत. दुसरा आपल्याला उच्च-शुद्धता धातू मिळविण्याची परवानगी देतो, परंतु स्फोटक आहे आणि अंमलबजावणीसाठी अनेक दिवस लागतात.
सीझियमचा उपयोग 20 व्या शतकाच्या सुरुवातीलाच झाला, जेव्हा त्यातील खनिजे शोधून काढली गेली आणि ते शुद्ध स्वरूपात मिळवण्याचे तंत्रज्ञान विकसित केले गेले. सध्या, सिझियम आणि त्याची संयुगे इलेक्ट्रॉनिक्स, रेडिओ, इलेक्ट्रिकल, क्ष-किरण अभियांत्रिकी, रासायनिक उद्योग, ऑप्टिक्स, औषध आणि आण्विक ऊर्जा मध्ये वापरली जातात. मुख्यतः स्थिर नैसर्गिक सीझियम-133 वापरला जातो आणि मर्यादित प्रमाणात त्याचा किरणोत्सर्गी समस्थानिक सीझियम-137, अणुऊर्जा प्रकल्पांच्या अणुभट्ट्यांमध्ये युरेनियम, प्लुटोनियम आणि थोरियमच्या विखंडन तुकड्यांच्या बेरीजपासून वेगळे केले जाते.
क्षारीय पृथ्वी धातू
क्षारीय पृथ्वी धातू - रासायनिक घटक: कॅल्शियम Ca, strontium Sr, बेरियम Ba, radium Ra (कधीकधी बेरिलियम बी आणि मॅग्नेशियम एमजी देखील चुकून अल्कधर्मी पृथ्वी धातू म्हणून वर्गीकृत केले जातात). त्यांना असे नाव देण्यात आले आहे कारण त्यांचे ऑक्साइड - "पृथ्वी" (किमयाशास्त्रज्ञांच्या परिभाषेत) - पाण्यावर अल्कधर्मी प्रतिक्रिया देतात. रेडियम वगळता क्षारीय पृथ्वी धातूंचे क्षार, खनिजांच्या स्वरूपात निसर्गात मोठ्या प्रमाणात वितरीत केले जातात.
कॅल्शियम
कॅल्शियम हा दुसऱ्या गटाच्या मुख्य उपसमूहाचा एक घटक आहे, डी.आय. दिमित्री इव्हानोविच मेंडेलीव्ह यांनी रासायनिक घटकांच्या नियतकालिक प्रणालीचा चौथा कालखंड, अणुक्रमांक 20 सह. हे Ca (lat. कॅल्शियम) चिन्हाद्वारे नियुक्त केले आहे. साधे पदार्थ कॅल्शियम (CAS क्रमांक: 7440-70-2) - मऊ, रासायनिकदृष्ट्या सक्रिय अल्कधर्मी पृथ्वी धातूचांदी-पांढरा रंग.
कॅल्शियम धातू दोन ऍलोट्रॉपिक बदलांमध्ये अस्तित्वात आहे. 443 °C पर्यंत, क्यूबिक फेस-केंद्रित जाळीसह α-Ca (पॅरामीटर a = 0.558 nm) स्थिर आहे; α-Fe प्रकाराच्या घन शरीर-केंद्रित जाळीसह β-Ca (पॅरामीटर a = 0.448 nm) आहे अधिक स्थिर. α → β संक्रमणाचे मानक एन्थॅल्पी ΔH0 0.93 kJ/mol आहे.
कॅल्शियम एक विशिष्ट क्षारीय पृथ्वी धातू आहे. कॅल्शियमची रासायनिक क्रिया जास्त असते, परंतु इतर सर्व क्षारीय पृथ्वीच्या धातूंपेक्षा कमी असते. ते ऑक्सिजन, कार्बन डायऑक्साइड आणि हवेतील आर्द्रतेवर सहज प्रतिक्रिया देते, म्हणूनच कॅल्शियम धातूचा पृष्ठभाग सामान्यतः निस्तेज राखाडी असतो, म्हणून प्रयोगशाळेत कॅल्शियम सामान्यतः इतर अल्कधर्मी पृथ्वी धातूंप्रमाणे, एका थराखाली घट्ट बंद भांड्यात साठवले जाते. रॉकेल किंवा द्रव पॅराफिनचे.
मानक क्षमतांच्या मालिकेत, कॅल्शियम हायड्रोजनच्या डावीकडे स्थित आहे. Ca2+/Ca0 जोडीची मानक इलेक्ट्रोड क्षमता −2.84 V आहे, म्हणून कॅल्शियम पाण्यावर सक्रियपणे प्रतिक्रिया देते, परंतु प्रज्वलन न करता:
Ca + 2H2O = Ca(OH)2 + H2 + Q.
कॅल्शियम सामान्य परिस्थितीत सक्रिय नॉन-मेटल्स (ऑक्सिजन, क्लोरीन, ब्रोमिन) सह प्रतिक्रिया देते:
2Ca + O2 = 2CaO, Ca + Br2 = CaBr2.
हवा किंवा ऑक्सिजनमध्ये गरम केल्यावर कॅल्शियम पेटते. कॅल्शियम गरम झाल्यावर कमी सक्रिय नॉन-मेटल्स (हायड्रोजन, बोरॉन, कार्बन, सिलिकॉन, नायट्रोजन, फॉस्फरस आणि इतर) सह प्रतिक्रिया देते, उदाहरणार्थ:
Ca + H2 = CaH2, Ca + 6B = CaB6,
3Ca + N2 = Ca3N2, Ca + 2C = CaC2,
3Ca + 2P = Ca3P2 (कॅल्शियम फॉस्फाइड), CaP आणि CaP5 या रचनांचे कॅल्शियम फॉस्फाइड देखील ओळखले जातात;
2Ca + Si = Ca2Si (कॅल्शियम सिलिसाइड); CaSi, Ca3Si4 आणि CaSi2 या रचनांचे कॅल्शियम सिलिसाइड देखील ओळखले जातात.
वरील प्रतिक्रियांची घटना सहसा रिलीझसह असते मोठ्या प्रमाणातउष्णता (म्हणजे, या प्रतिक्रिया एक्झोथर्मिक आहेत). धातू नसलेल्या सर्व संयुगेमध्ये, कॅल्शियमची ऑक्सीकरण स्थिती +2 असते. नॉन-मेटल्ससह बहुतेक कॅल्शियम संयुगे पाण्याद्वारे सहजपणे विघटित होतात, उदाहरणार्थ:
CaH2 + 2H2O = Ca(OH)2 + 2H2,
Ca3N2 + 3H2O = 3Ca(OH)2 + 2NH3.
Ca2+ आयन रंगहीन आहे. जेव्हा विरघळणारे कॅल्शियम क्षार ज्वालामध्ये जोडले जातात तेव्हा ज्योत विट-लाल होते.
कॅल्शियम क्षार जसे की CaCl2 क्लोराईड, CaBr2 ब्रोमाइड, CaI2 आयोडाइड आणि Ca(NO3)2 नायट्रेट पाण्यात अत्यंत विद्रव्य असतात. पाण्यात विरघळणारे फ्लोराइड CaF2, कार्बोनेट CaCO3, सल्फेट CaSO4, ऑर्थोफॉस्फेट Ca3(PO4)2, oxalate CaC2O4 आणि काही इतर आहेत.
हे महत्त्वाचे आहे की, कॅल्शियम कार्बोनेट CaCO3 विपरीत, आम्लयुक्त कॅल्शियम कार्बोनेट (बायकार्बोनेट) Ca(HCO3)2 पाण्यात विरघळते. निसर्गात, यामुळे पुढील प्रक्रिया होतात. जेव्हा थंड पाऊस किंवा नदीचे पाणी, कार्बन डाय ऑक्साईडने भरलेले, भूगर्भात प्रवेश करते आणि चुनखडीवर पडते तेव्हा त्यांचे विघटन दिसून येते:
CaCO3 + CO2 + H2O = Ca(HCO3)2.
त्याच ठिकाणी जेथे कॅल्शियम बायकार्बोनेटने भरलेले पाणी पृथ्वीच्या पृष्ठभागावर येते आणि सूर्याच्या किरणांनी गरम होते, उलट प्रतिक्रिया येते:
Ca(HCO3)2 = CaCO3 + CO2 + H2O.
अशा प्रकारे निसर्गात मोठ्या प्रमाणात पदार्थांचे हस्तांतरण होते. परिणामी, भूगर्भात प्रचंड दरी तयार होऊ शकतात आणि सुंदर दगड "icicles" - stalactites आणि stalagmites - गुहांमध्ये तयार होतात.
पाण्यात विरघळलेल्या कॅल्शियम बायकार्बोनेटची उपस्थिती मुख्यत्वे पाण्याची तात्पुरती कडकपणा निर्धारित करते. याला तात्पुरते म्हणतात कारण जेव्हा पाणी उकळते तेव्हा बायकार्बोनेटचे विघटन होते आणि CaCO3 अवक्षेपित होते. या घटनेमुळे, उदाहरणार्थ, कालांतराने केटलमध्ये स्केल तयार होतात.
स्ट्रॉन्टियम
स्ट्रॉन्टियम हा दुसऱ्या गटातील मुख्य उपसमूहाचा एक घटक आहे, डी.आय. मेंडेलीव्ह दिमित्री इव्हानोविच यांनी रासायनिक घटकांच्या नियतकालिक प्रणालीचा पाचवा कालखंड, अणुक्रमांक 38 सह. हे चिन्ह Sr (lat. स्ट्रॉन्टियम) ने नियुक्त केले आहे. साधा पदार्थ स्ट्रॉन्टियम (CAS क्रमांक: 7440-24-6) हा चांदीसारखा पांढरा रंगाचा मऊ, निंदनीय आणि लवचिक अल्कधर्मी पृथ्वी धातू आहे. त्यात उच्च रासायनिक क्रिया आहे; हवेत ते त्वरीत आर्द्रता आणि ऑक्सिजनसह प्रतिक्रिया देते, पिवळ्या ऑक्साईड फिल्मने झाकलेले होते.
स्ट्रॉन्शिअन या स्कॉटिश गावाजवळील शिशाच्या खाणीत १७६४ मध्ये सापडलेल्या खनिज स्ट्रॉन्शिअनाइटमध्ये नवीन घटक सापडला, ज्याने नंतर नवीन घटकाला त्याचे नाव दिले. या खनिजामध्ये नवीन धातूच्या ऑक्साईडची उपस्थिती जवळजवळ 30 वर्षांनंतर विल्यम क्रुकशँक आणि एडर क्रॉफर्ड यांनी शोधली. 1808 मध्ये सर हम्फ्री डेव्ही यांनी त्याच्या शुद्ध स्वरूपात वेगळे केले.
स्ट्रॉन्टियम एक मऊ, चांदीसारखा पांढरा धातू आहे जो निंदनीय आणि लवचिक आहे आणि चाकूने सहजपणे कापला जाऊ शकतो.
पॉलिमॉर्फिक - त्यातील तीन बदल ज्ञात आहेत. 215°C पर्यंत क्यूबिक फेस-केंद्रित फेरबदल (α-Sr) स्थिर आहे, 215 आणि 605°C दरम्यान षटकोनी बदल (β-Sr) स्थिर आहे आणि 605°C च्या वर घन शरीर-केंद्रित सुधारणा (γ- Sr) स्थिर आहे.
वितळण्याचा बिंदू - 768oC, उत्कलन बिंदू - 1390oC.
त्याच्या यौगिकांमध्ये स्ट्रॉन्टियम नेहमी +2 ची व्हॅलेन्स दर्शवते. स्ट्रॉन्टियमचे गुणधर्म कॅल्शियम आणि बेरियमच्या जवळ आहेत, त्यांच्या दरम्यान मध्यवर्ती स्थान व्यापतात.
इलेक्ट्रोकेमिकल व्होल्टेज मालिकेत, स्ट्रॉन्टियम सर्वात जास्त आहे सक्रिय धातू(त्याची सामान्य इलेक्ट्रोड क्षमता −2.89 V आहे. पाण्यावर जोरदारपणे प्रतिक्रिया देते, हायड्रॉक्साइड तयार करते:
Sr + 2H2O = Sr(OH)2 + H2
आम्लांशी संवाद साधतो, जड धातू त्यांच्या क्षारांपासून विस्थापित करतो. हे केंद्रित ऍसिड (H2SO4, HNO3) सह कमकुवतपणे प्रतिक्रिया देते.
मेटल स्ट्रॉन्टियम हवेत त्वरीत ऑक्सिडायझेशन करते, एक पिवळसर फिल्म तयार करते, ज्यामध्ये, SrO ऑक्साईड व्यतिरिक्त, SrO2 पेरोक्साइड आणि Sr3N2 नायट्राइड नेहमी उपस्थित असतात. हवेत गरम केल्यावर ते प्रज्वलित होते; हवेतील चूर्ण स्ट्रॉन्टियम स्वयं-इग्निशनसाठी प्रवण असते.
नॉन-मेटल्स - सल्फर, फॉस्फरस, हॅलोजनसह जोरदारपणे प्रतिक्रिया देते. हायड्रोजन (200°C वर), नायट्रोजन (400°C वर) यांच्याशी संवाद साधतो. व्यावहारिकरित्या अल्कलीसह प्रतिक्रिया देत नाही.
उच्च तापमानात ते कार्बाईड तयार करण्यासाठी CO2 सह प्रतिक्रिया देते:
5Sr + 2CO2 = SrC2 + 4SrO
Cl-, I-, NO3- anions सह सहज विरघळणारे स्ट्रॉन्टियम लवण. एफ-, SO42-, CO32-, PO43- सह क्षार किंचित विद्राव्य असतात.
स्ट्रॉन्शिअमचा वापर कपरम आणि त्यातील काही मिश्र धातुंसाठी, बॅटरी शिशाच्या मिश्रधातूंमध्ये प्रवेश करण्यासाठी, कास्ट आयर्न, कप्रम आणि डिसल्फ्युरायझेशनसाठी केला जातो. स्टील्स.
बेरियम
बेरियम हा दुसऱ्या गटातील मुख्य उपसमूहाचा एक घटक आहे, D.I. दिमित्री इव्हानोविच मेंडेलीव्ह यांनी रासायनिक घटकांच्या नियतकालिक प्रणालीचा सहावा कालखंड, अणुक्रमांक 56 सह. हे बा (lat. बेरियम) चिन्हाद्वारे नियुक्त केले आहे. साधा पदार्थ बेरियम (CAS क्रमांक: 7440-39-3) हा चांदीच्या-पांढऱ्या रंगाचा मऊ, निंदनीय अल्कधर्मी पृथ्वी धातू आहे. उच्च रासायनिक क्रियाकलाप आहे.
बेरियमचा शोध 1774 मध्ये ऑक्साईड BaO म्हणून कार्ल शिले यांनी लावला. 1808 मध्ये, इंग्लिश रसायनशास्त्रज्ञ हम्फ्री डेव्हीने पारा कॅथोडसह ओले बेरियम हायड्रॉक्साईडचे इलेक्ट्रोलिसिस करून प्राप्त केले. एकत्रीकरणबेरियम गरम झाल्यावर पाराचे बाष्पीभवन झाल्यानंतर, ते बेरियम धातू सोडते.
बेरियम हा चांदीसारखा पांढरा निंदनीय धातू आहे. जोरात मारले तर तुटते. बेरियमचे दोन ॲलोट्रॉपिक बदल आहेत: α-Ba एक घन शरीर-केंद्रित जाळीसह (पॅरामीटर a = 0.501 nm) 375 °C पर्यंत स्थिर आहे; β-Ba त्याच्या वर स्थिर आहे.
खनिज स्केलवर कडकपणा 1.25; मोह स्केल 2.
बेरियम धातू केरोसीनमध्ये किंवा पॅराफिनच्या थराखाली साठवा.
बेरियम एक अल्कधर्मी पृथ्वी धातू आहे. ते हवेत तीव्रतेने ऑक्सिडायझेशन करते, बेरियम ऑक्साईड BaO आणि बेरियम नायट्राइड Ba3N2 बनवते आणि थोड्या गरमतेने प्रज्वलित होते. बेरियम हायड्रॉक्साईड Ba(OH)2 तयार करून पाण्यावर जोरदार प्रतिक्रिया देते:
Ba + 2H2O = Ba(OH)2 + H2
सौम्य ऍसिडसह सक्रियपणे संवाद साधते. अनेक बेरियम लवण पाण्यात अघुलनशील किंवा किंचित विरघळणारे असतात: बेरियम सल्फेट BaSO4, बेरियम सल्फाइट BaSO3, बेरियम कार्बोनेट BaCO3, बेरियम फॉस्फेट Ba3(PO4)2. कॅल्शियम सल्फाइड CaS विपरीत, बेरियम सल्फाइड BaS, पाण्यात अत्यंत विद्रव्य आहे.
हॅलाइड्स तयार करण्यासाठी हॅलोजनसह सहजपणे प्रतिक्रिया देते.
हायड्रोजनसह गरम केल्यावर, ते बेरियम हायड्राइड BaH2 बनवते, जे लिथियम हायड्राइड LiH सह Li कॉम्प्लेक्स देते.
अमोनियासह गरम झाल्यावर प्रतिक्रिया देते:
6Ba + 2NH3 = 3BaH2 + Ba3N2
गरम केल्यावर, बेरियम नायट्राइड Ba3N2 सीओवर प्रतिक्रिया देते, सायनाइड तयार करते:
Ba3N2 + 2CO = Ba(CN)2 + 2BaO
द्रव अमोनियासह ते गडद निळे द्रावण देते, ज्यामधून अमोनिया वेगळे केले जाऊ शकते, ज्यामध्ये सोनेरी चमक असते आणि NH3 च्या निर्मूलनासह सहजपणे विघटन होते. प्लॅटिनम उत्प्रेरकाच्या उपस्थितीत, अमोनियाचे विघटन होऊन बेरियम अमाइड तयार होतो:
Ba(NH2)2 + 4NH3 + H2
बेरियम कार्बाइड BaC2 चाप भट्टीत कोळशासह BaO गरम करून मिळवता येते.
फॉस्फरससह ते फॉस्फाइड Ba3P2 बनते.
बेरियम अनेक धातूंचे ऑक्साइड, हॅलाइड्स आणि सल्फाइड्स संबंधित धातूमध्ये कमी करते.
मेटल बेरियम, बहुतेकदा ॲल्युमिनियमच्या मिश्रधातूमध्ये, उच्च-व्हॅक्यूम इलेक्ट्रॉनिक उपकरणांमध्ये गॅस शोषक (गेटर) म्हणून वापरला जातो आणि द्रव धातूच्या शीतलकांमध्ये (सोडियम, पोटॅशियम, रुबिडियम, लिथियम, सीझियमचे मिश्र धातु) सोबत झिरकोनियम देखील जोडले जातात. पाइपलाइन आणि धातूशास्त्रातील आक्रमकता कमी करण्यासाठी.
संक्रमण धातू
संक्रमण धातू (संक्रमण घटक) हे D. I. मेंडेलीव्ह दिमित्री इव्हानोविचच्या रासायनिक घटकांच्या आवर्त सारणीच्या दुय्यम उपसमूहांचे घटक आहेत, ज्याच्या अणूंमध्ये d- आणि f-ऑर्बिटल्समध्ये इलेक्ट्रॉन दिसतात. IN सामान्य दृश्यसंक्रमण घटकांची इलेक्ट्रॉनिक रचना खालीलप्रमाणे दर्शविली जाऊ शकते: . एनएस ऑर्बिटलमध्ये एक किंवा दोन इलेक्ट्रॉन असतात, उर्वरित व्हॅलेन्स इलेक्ट्रॉन -ऑर्बिटलमध्ये असतात. व्हॅलेन्स इलेक्ट्रॉनची संख्या ऑर्बिटल्सच्या संख्येपेक्षा लक्षणीयपणे कमी असल्याने, संक्रमण घटकांद्वारे तयार केलेले साधे पदार्थ म्हणजे धातू.
संक्रमण घटकांची सामान्य वैशिष्ट्ये
सर्व संक्रमण घटकांमध्ये खालील सामान्य गुणधर्म आहेत:
लहान इलेक्ट्रोनेगेटिव्हिटी मूल्ये.
परिवर्तनीय ऑक्सिडेशन अवस्था. जवळजवळ सर्व डी-एलिमेंट्ससाठी, ज्या अणूंच्या बाह्य एनएस-सबलेव्हलमध्ये 2 व्हॅलेन्स इलेक्ट्रॉन असतात, ऑक्सिडेशन स्थिती +2 ओळखली जाते.
डी.आय. दिमित्री इव्हानोविच मेंडेलीव्ह यांच्या रासायनिक घटकांच्या नियतकालिक सारणीच्या गट III च्या डी-एलिमेंट्सपासून सुरुवात करून, सर्वात कमी ऑक्सिडेशन अवस्थेतील घटक संयुगे तयार करतात जे मूलभूत गुणधर्म प्रदर्शित करतात, सर्वात जास्त - अम्लीय, मध्यवर्ती - ॲम्फोटेरिक
लोखंड
लोह हा D.I. मेंडेलीव्ह दिमित्री इव्हानोविच, अणुक्रमांक 26 द्वारे रासायनिक घटकांच्या नियतकालिक प्रणालीच्या चौथ्या कालखंडातील आठव्या गटाच्या बाजूच्या उपसमूहाचा एक घटक आहे. तो Fe (lat. Ferrum) या चिन्हाद्वारे नियुक्त केला जातो. पृथ्वीच्या कवचातील सर्वात सामान्य धातूंपैकी एक (ॲल्युमिनियम नंतर दुसरे स्थान).
साधा पदार्थ लोखंड (CAS क्रमांक: 7439-89-6) उच्च रासायनिक अभिक्रियासह एक निंदनीय चांदी-पांढरा धातू आहे: लोह उच्च तापमानात किंवा हवेतील उच्च आर्द्रतेमध्ये त्वरीत खराब होते. लोह शुद्ध ऑक्सिजनमध्ये जळते आणि बारीक विखुरलेल्या अवस्थेत ते हवेत उत्स्फूर्तपणे प्रज्वलित होते.
खरं तर, लोखंडाला सामान्यतः कमी अशुद्धता (0.8% पर्यंत) असलेल्या मिश्रधातू म्हणतात, जे शुद्ध धातूचा मऊपणा आणि लवचिकता टिकवून ठेवतात. परंतु सराव मध्ये, कार्बनसह लोहाचे मिश्र धातु अधिक वेळा वापरले जातात: (2% कार्बन पर्यंत) आणि (2% पेक्षा जास्त कार्बन), तसेच मिश्र धातुंच्या जोडणीसह स्टेनलेस (मिश्रित) स्टील (क्रोम, मँगनीज, नी, इ.). संपूर्णता विशिष्ट गुणधर्मलोह आणि त्याच्या मिश्रधातूंमुळे ते "नंबर 1 धातू" मानवांसाठी महत्त्वाचे आहे.
निसर्गात, लोह त्याच्या शुद्ध स्वरूपात क्वचितच आढळते; बहुतेकदा ते लोह-निकेल उल्कामध्ये आढळते. पृथ्वीच्या कवचामध्ये लोहाचे प्रमाण 4.65% आहे (O, Si, Al नंतर चौथे स्थान). लोखंड हे पृथ्वीच्या गाभ्याचा बहुतेक भाग बनवतो असेही मानले जाते.




लोह हा एक सामान्य धातू आहे; त्याच्या मुक्त अवस्थेत ते करड्या रंगाच्या छटासह चांदी-पांढर्या रंगाचे असते. शुद्ध धातू लवचिक आहे; विविध अशुद्धता (विशेषतः कार्बन) त्याचा कडकपणा आणि ठिसूळपणा वाढवतात. यात चुंबकीय गुणधर्म स्पष्ट आहेत. तथाकथित "लोह ट्रायड" सहसा वेगळे केले जाते - तीन धातूंचा समूह (लोह फे, कोबाल्ट को, नि Ni), समान भौतिक गुणधर्म, अणु त्रिज्या आणि विद्युत ऋणात्मकता मूल्ये.
लोह बहुरूपी द्वारे दर्शविले जाते; त्यात चार स्फटिकासारखे बदल आहेत:
769 °C पर्यंत शरीर-केंद्रित घन जाळी आणि फेरोमॅग्नेटिक गुणधर्मांसह α-Fe (फेराइट) असते (769 °C ≈ 1043 K - लोहासाठी क्युरी पॉइंट)
तापमान श्रेणी 769–917 °C मध्ये β-Fe आहे, जो α-Fe पेक्षा फक्त शरीर-केंद्रित घन जाळीच्या पॅरामीटर्समध्ये आणि पॅरामॅग्नेटच्या चुंबकीय गुणधर्मांमध्ये भिन्न आहे.
तापमान श्रेणी 917–1394 °C मध्ये चेहरा-केंद्रित घन जाळीसह γ-Fe (ऑस्टेनाइट) आहे
शरीर-केंद्रित घन जाळीसह 1394 °C δ-Fe वर स्थिर आहे
धातूविज्ञान β-Fe ला एक वेगळा टप्पा म्हणून वेगळे करत नाही आणि त्याला α-Fe ची विविधता मानते. जेव्हा लोखंड किंवा स्टील क्युरी पॉइंट (769 °C ≈ 1043 K) वर गरम केले जाते, तेव्हा आयनची थर्मल हालचाल इलेक्ट्रॉनच्या स्पिन चुंबकीय क्षणांचे अभिमुखता बिघडवते, फेरोमॅग्नेट पॅरामॅग्नेटिक बनते - एक द्वितीय-क्रम चरण संक्रमण होते, परंतु क्रिस्टल्सच्या मूलभूत भौतिक पॅरामीटर्समध्ये बदलासह प्रथम-ऑर्डर फेज संक्रमण होत नाही.
सामान्य दाबाने शुद्ध लोहासाठी, धातूशास्त्राच्या दृष्टिकोनातून, खालील स्थिर बदल आहेत:
निरपेक्ष शून्य ते 910 єC पर्यंत, शरीर-केंद्रित क्यूबिक (bcc) क्रिस्टल जाळीसह α-बदल स्थिर आहे. α-लोहातील कार्बनच्या घन द्रावणाला फेराइट म्हणतात.
910 ते 1400 єC पर्यंत, फेस-केंद्रित क्यूबिक (fcc) क्रिस्टल जाळीसह γ-बदल स्थिर आहे. γ-लोहातील कार्बनच्या घन द्रावणाला ऑस्टेनाइट म्हणतात.
910 ते 1539 єC पर्यंत, शरीर-केंद्रित क्यूबिक (bcc) क्रिस्टल जाळीसह δ सुधारणा स्थिर आहे. δ-लोह (तसेच α-लोहात) कार्बनच्या घन द्रावणाला फेराइट म्हणतात. उच्च-तापमान δ-फेराइट आणि कमी-तापमान α-फेराइट (किंवा फक्त फेराइट) यांच्यात काही वेळा फरक केला जातो, जरी त्यांची अणू संरचना समान असते.
स्टीलमध्ये कार्बन आणि मिश्रधातूच्या घटकांची उपस्थिती फेज संक्रमणाच्या तापमानात लक्षणीय बदल करते.
परिसरात उच्च दाब(104 MPa पेक्षा जास्त, 100 हजार atm.) हेक्सागोनल क्लोज-पॅक्ड (hcp) जाळीसह ε-लोहाचे बदल दिसून येतात.
पोलाद धातुकर्मासाठी पॉलिमॉर्फिझमची घटना अत्यंत महत्त्वाची आहे. क्रिस्टल जाळीच्या α-γ संक्रमणांमुळे स्टीलची उष्णता उपचार होते. या घटनेशिवाय, स्टीलचा आधार म्हणून लोखंडाचा इतका व्यापक वापर झाला नसता.
लोह दुर्दम्य आहे आणि मध्यम क्रियाकलापांच्या धातूंशी संबंधित आहे. लोहाचा वितळण्याचा बिंदू 1539 °C आहे, उत्कलन बिंदू सुमारे 3200 °C आहे.
लोह हा सर्वात जास्त वापरल्या जाणाऱ्या धातूंपैकी एक आहे, जो जागतिक धातू उत्पादनाच्या 95% पर्यंत आहे.
लोह हा स्टील्स आणि कास्ट इस्त्रीचा मुख्य घटक आहे - सर्वात महत्वाची संरचनात्मक सामग्री.
लोह इतर धातूंवर आधारित मिश्रधातूंचा भाग असू शकतो - उदाहरणार्थ, निकेल.
चुंबकीय लोह ऑक्साईड (मॅग्नेटाइट) दीर्घकालीन संगणक मेमरी उपकरणांच्या निर्मितीमध्ये एक महत्त्वाची सामग्री आहे: हार्ड ड्राइव्हस्, फ्लॉपी डिस्क इ.
अल्ट्राफाइन मॅग्नेटाइट पावडर ब्लॅक अँड व्हाइट लेसर प्रिंटरमध्ये टोनर म्हणून वापरली जाते.
अनेक लोह-आधारित मिश्र धातुंचे अद्वितीय फेरोमॅग्नेटिक गुणधर्म ट्रान्सफॉर्मर्स आणि इलेक्ट्रिक मोटर्सच्या चुंबकीय कोरसाठी इलेक्ट्रिकल अभियांत्रिकीमध्ये त्यांच्या व्यापक वापरासाठी योगदान देतात.
आयर्न(III) क्लोराईड (फेरिक क्लोराईड) चा वापर हौशी रेडिओ प्रॅक्टिसमध्ये मुद्रित सर्किट बोर्डच्या नक्षीसाठी केला जातो.
तांबे सल्फेट मिसळून फेरस सल्फेट हेप्टेट (फेरस सल्फेट) बागकाम आणि बांधकामात हानिकारक बुरशीचा सामना करण्यासाठी वापरला जातो.
आयर्न-निकेल बॅटऱ्या आणि आयर्न-एअर बॅटरियांमध्ये लोखंडाचा वापर एनोड म्हणून केला जातो.
तांबे
तांबे हा पहिल्या गटाच्या बाजूच्या उपसमूहाचा एक घटक आहे, D.I. दिमित्री इव्हानोविच मेंडेलीव्हच्या रासायनिक घटकांच्या नियतकालिक सारणीचा चौथा कालखंड, अणुक्रमांक 29 सह. हे Cu (lat. Cuprum) या चिन्हाने नियुक्त केले आहे. मूलद्रव्य तांबे (CAS क्रमांक: 7440-50-8) हा सोनेरी-गुलाबी रंगाचा (ऑक्साइड फिल्म नसताना गुलाबी) असलेला एक लवचिक संक्रमण धातू आहे. हे बर्याच काळापासून लोकांकडून मोठ्या प्रमाणावर वापरले जात आहे.



तांबे एक सोनेरी-गुलाबी नम्र धातू आहे; हवेत ते त्वरीत ऑक्साईड फिल्मने झाकले जाते, जे त्यास वैशिष्ट्यपूर्ण तीव्र पिवळसर-लाल रंग देते. तांब्याची औष्णिक आणि विद्युत चालकता जास्त असते (चांदीनंतर विद्युत चालकतेमध्ये ते दुसऱ्या क्रमांकावर आहे). यात दोन स्थिर समस्थानिक आहेत - 63Cu आणि 65Cu आणि अनेक किरणोत्सर्गी समस्थानिक. यापैकी सर्वात जास्त काळ टिकणारे, 64Cu, 12.7 तासांचे अर्धे आयुष्य आणि वेगवेगळ्या उत्पादनांसह दोन क्षय मोड आहेत.
घनता - 8.94*10i kg/m
20 °C - 390 J/kg*K वर विशिष्ट उष्णता क्षमता
विद्युत प्रतिरोधकता 20-100 °C - 1.78·10−8 Ohm m
वितळण्याचा बिंदू - 1083 ° से
उकळत्या बिंदू - 2600 ° से
अनेक कप्रम मिश्रधातू आहेत: पितळ - झिंकसह कपरमचे मिश्र धातु, कपरम आणि कथील यांचे मिश्रण, कप्रोनिकेल - कपरम आणि निकेलचे मिश्र धातु आणि काही इतर.
जस्त
झिंक हा दुसऱ्या गटाच्या दुय्यम उपसमूहाचा एक घटक आहे, डी.आय. मेंडेलीव्ह दिमित्री इव्हानोविच यांनी रासायनिक घटकांच्या नियतकालिक प्रणालीचा चौथा कालखंड, अणुक्रमांक 30 सह. हे Zn (lat. Zinkum) चिन्हाद्वारे नियुक्त केले आहे. सामान्य परिस्थितीत साधा पदार्थ (CAS क्रमांक: 7440-66-6) हा निळसर-पांढऱ्या रंगाचा एक ठिसूळ संक्रमण धातू आहे (हवेत कलंकित होतो, झिंक ऑक्साईडच्या पातळ थराने झाकलेला असतो).
त्याच्या शुद्ध स्वरूपात ते एक ऐवजी लवचिक चांदी-पांढर्या धातू आहे. त्यात a = 0.26649 nm, c = 0.49468 nm मापदंडांसह षटकोनी जाळी आहे. खोलीच्या तपमानावर ते नाजूक असते; जेव्हा प्लेट वाकलेली असते, तेव्हा क्रिस्टलाइट्सच्या घर्षणातून क्रॅकिंग आवाज ऐकू येतो (सामान्यतः "टिनच्या रडण्यापेक्षा" मजबूत). 100-150°C वर जस्त प्लास्टिक असते. अशुद्धता, अगदी किरकोळ, झिंकची नाजूकता नाटकीयरित्या वाढवते.
एक नमुनेदार एम्फोटेरिक धातू. मानक इलेक्ट्रोड पोटेंशिअल −0.76 V आहे, मानक पोटेंशिअलच्या मालिकेत ते लोहापर्यंत स्थित आहे.
हवेत, झिंक ZnO ऑक्साईडच्या पातळ फिल्मने लेपित केले जाते. जोरदार गरम केल्यावर, ते जळून एम्फोटेरिक व्हाईट ऑक्साईड ZnO बनते:
2Zn + O2 = 2ZnO.
झिंक ऑक्साईड ऍसिड सोल्यूशनसह दोन्ही प्रतिक्रिया देते:
ZnO + 2HNO3 = Zn(NO3)2 + H2O
आणि अल्कलीसह:
ZnO + 2NaOH = Na2ZnO2 + H2O,
सामान्य शुद्धतेचे झिंक ऍसिड सोल्यूशनसह सक्रियपणे प्रतिक्रिया देते:
Zn + 2HCl = ZnCl2 + H2,
Zn + H2SO4(dil.) = ZnSO4 + H2
आणि अल्कली द्रावण:
Zn + 2NaOH + 2H2O = Na2 + H2,
हायड्रॉक्सिनेट तयार करणे. अतिशय शुद्ध जस्त आम्ल आणि अल्कलीच्या द्रावणांवर प्रतिक्रिया देत नाही. कपरम सल्फेट सोल्यूशन CuSO4 चे काही थेंब जोडले जातात तेव्हा संवाद सुरू होतो.
गरम झाल्यावर, झिंक हॅलोजनसह प्रतिक्रिया देऊन हॅलाइड्स ZnHal2 तयार करते. फॉस्फरससह, जस्त फॉस्फाइड्स Zn3P2 आणि ZnP2 बनवते. सल्फर आणि त्याच्या analogues सह - सेलेनियम आणि टेल्यूरियम - विविध chalcogenides, ZnS, ZnSe, ZnSe2 आणि ZnTe.
झिंक हायड्रोजन, नायट्रोजन, कार्बन, सिलिकॉन आणि बोरॉनवर थेट प्रतिक्रिया देत नाही. Zn3N2 नायट्राइड 550-600°C तापमानावर अमोनियासह झिंकची अभिक्रिया करून प्राप्त होते.
IN जलीय द्रावणझिंक आयन Zn2+ एक्वा कॉम्प्लेक्स 2+ आणि 2+ तयार करतात.
शुद्ध जस्त धातूचा वापर भूमिगत लीचिंग (सोने, चांदी) द्वारे उत्खनन केलेले मौल्यवान धातू पुनर्प्राप्त करण्यासाठी केला जातो. याव्यतिरिक्त, जस्तचा वापर कच्च्या शिशापासून चांदी, सोने (आणि इतर धातू) जस्त-चांदी-सोने इंटरमेटॅलिक संयुगे (तथाकथित "सिल्व्हर फोम") च्या स्वरूपात काढण्यासाठी केला जातो, ज्यावर नंतर पारंपारिक शुद्धीकरण पद्धतींनी प्रक्रिया केली जाते.
याचा वापर स्टीलला गंजपासून संरक्षण करण्यासाठी (यांत्रिक तणावाच्या अधीन नसलेल्या पृष्ठभागांचे गॅल्वनायझेशन, किंवा मेटलायझेशन - पूल, टाक्या, धातूच्या संरचनेसाठी) वापरले जाते. रासायनिक विद्युत् स्त्रोतांमध्ये नकारात्मक इलेक्ट्रोडसाठी सामग्री म्हणून देखील वापरले जाते, म्हणजे, बॅटरी आणि संचयकांमध्ये, उदाहरणार्थ: मँगनीज-जस्त सेल, चांदी-जस्त बॅटरी (EMF 1.85 V, 150 Wh/kg, 650 Wh/ dmі, कमी प्रतिकार आणि प्रचंड डिस्चार्ज करंट, पारा-जस्त घटक (EMF 1.35 V, 135 Wh/kg, 550-650 Wh/dmі), डायऑक्सीसल्फेट-पारा घटक, झिंक आयोडेट घटक, कॉपर ऑक्साईड गॅल्व्हॅनिक सेल (EMF-1.35 V, 135 Wh/dmі), 127 Wh/kg, 410-570 Wh/dmI), क्रोमियम-झिंक सेल, झिंक-सिल्व्हर क्लोराईड सेल, निकेल-झिंक बॅटरी (EMF 1, 82 व्होल्ट, 95-118 Wh/kg, 230-295 Wh/dmI), लीड-झिंक सेल, झिंक-क्लोरीन बॅटरी, झिंक-ब्रोमाइन बॅटरी इ.). झिंक-एअर बॅटरीमध्ये झिंकची भूमिका खूप महत्त्वाची आहे; अलिकडच्या वर्षांत, झिंक-एअर सिस्टमवर आधारित कॉम्प्युटर (लॅपटॉप) साठीच्या बॅटऱ्या सखोलपणे विकसित केल्या गेल्या आहेत आणि या क्षेत्रात लक्षणीय यश मिळाले आहे (लिथियम बॅटरीपेक्षा मोठ्या, क्षमता आणि संसाधन, किमतीच्या 3 पट कमी), ही प्रणाली इंजिन सुरू करण्यासाठी (लीड बॅटरी - 55 Wh/kg, झिंक-एअर - 220-300 Wh/kg) आणि इलेक्ट्रिक वाहनांसाठी (900 किमी पर्यंतची श्रेणी) खूप आशादायक आहे. ). त्यांचा वितळण्याचा बिंदू कमी करण्यासाठी अनेक कठोर सोल्डरमध्ये समाविष्ट केले आहे. पितळातील झिंक हा महत्त्वाचा घटक आहे. झिंक ऑक्साईडचा औषधांमध्ये अँटीसेप्टिक आणि दाहक-विरोधी एजंट म्हणून मोठ्या प्रमाणावर वापर केला जातो. झिंक ऑक्साईडचा वापर पेंट तयार करण्यासाठी देखील केला जातो - जस्त पांढरा.
झिंक क्लोराईड हा धातूच्या सोल्डरिंगसाठी एक महत्त्वाचा प्रवाह आणि फायबर उत्पादनातील एक घटक आहे.
झिंक टेल्युराइड, सेलेनाइड, फॉस्फाइड आणि सल्फाइड हे अर्धसंवाहक मोठ्या प्रमाणावर वापरले जातात.
झिंक सेलेनाइडचा वापर कार्बन डायऑक्साइड लेसरसारख्या मध्य-अवरक्त प्रदेशात अत्यंत कमी शोषण गुणांक असलेले ऑप्टिकल ग्लासेस बनवण्यासाठी केला जातो.
बुध
बुध हा दुसऱ्या गटाच्या दुय्यम उपसमूहाचा एक घटक आहे, D.I. दिमित्री इव्हानोविच मेंडेलीव्हच्या रासायनिक घटकांच्या नियतकालिक सारणीचा सहावा कालखंड, अणुक्रमांक 80 सह. हे Hg (lat. Hydrargyrum) या चिन्हाने नियुक्त केले आहे. साधा पदार्थ पारा (CAS क्रमांक: 7439-97-6) एक संक्रमण धातू आहे, खोलीच्या तपमानावर तो एक जड, चांदीसारखा-पांढरा, दृश्यमानपणे अस्थिर द्रव आहे, ज्यातील वाफ अत्यंत विषारी असतात. बुध हा दोन रासायनिक घटकांपैकी एक (आणि एकमेव धातू) आहे, ज्याचे साधे पदार्थ, सामान्य परिस्थितीत, एकत्रिततेच्या द्रव स्थितीत असतात (दुसरा घटक ब्रोमिन आहे). निसर्गात, ते मूळ स्वरूपात आढळते आणि अनेक खनिजे बनवतात. पारा बहुतेकदा त्याच्या सर्वात सामान्य खनिज, सिनाबारपासून कमी करून मिळवला जातो. हे मोजमाप यंत्रे, व्हॅक्यूम पंप, प्रकाश स्रोत आणि विज्ञान आणि तंत्रज्ञानाच्या इतर क्षेत्रात वापरले जाते.
बुध हा एकमेव धातू आहे जो खोलीच्या तपमानावर द्रव असतो. त्यात डायमॅग्नेटिक गुणधर्म आहेत. अनेक धातूंसह द्रव मिश्रधातू तयार करतात - एकत्रीकरण. फक्त लोह, मँगनीज आणि नि.
बुध हा कमी-प्रतिक्रियाशील धातू आहे.
300 °C पर्यंत गरम केल्यावर, पारा ऑक्सिजनसह प्रतिक्रिया देतो: 2Hg + O2 → 2HgO लाल पारा(II) ऑक्साईड तयार होतो. ही प्रतिक्रिया उलट करता येण्यासारखी आहे: 340 डिग्री सेल्सियसपेक्षा जास्त गरम केल्यावर, ऑक्साइड साध्या पदार्थांमध्ये विघटित होतो. पारा ऑक्साईडची विघटन प्रतिक्रिया ऐतिहासिकदृष्ट्या ऑक्सिजन तयार करण्याच्या पहिल्या मार्गांपैकी एक आहे.
जेव्हा पारा सल्फरसह गरम केला जातो तेव्हा पारा (II) सल्फाइड तयार होतो.
ज्या ऍसिडमध्ये नसतात त्यांच्या द्रावणात पारा विरघळत नाही ऑक्सिडायझिंग गुणधर्म, परंतु एक्वा रेजियामध्ये विरघळते आणि नायट्रिक आम्ल, द्विसंयोजक पारा लवण तयार करणे. जेव्हा थंडीत जास्त पारा नायट्रिक ऍसिडमध्ये विरघळतो तेव्हा नायट्रेट Hg2(NO3)2 तयार होतो.
ग्रुप IIB च्या घटकांपैकी, हा पारा आहे ज्यामध्ये अत्यंत स्थिर 6d10 - इलेक्ट्रॉन शेल नष्ट करण्याची शक्यता आहे, ज्यामुळे पारा संयुगे (+4) च्या अस्तित्वाची शक्यता निर्माण होते. अशा प्रकारे, खराब विरघळणारे Hg2F2 आणि पाण्यात विघटित HgF2 व्यतिरिक्त, HgF4 देखील आहे, जे पारा अणूंच्या परस्परसंवादाद्वारे आणि 4K तापमानात निऑन आणि फ्लोरिनच्या मिश्रणाने प्राप्त होते.
पारा थर्मामीटरच्या निर्मितीमध्ये वापरला जातो; पारा-क्वार्ट्ज आणि फ्लोरोसेंट दिवे पारा वाष्पाने भरलेले असतात. बुध संपर्क पोझिशन सेन्सर म्हणून काम करतात. याशिवाय, अनेक महत्त्वाच्या मिश्रधातूंच्या निर्मितीसाठी धातूचा पारा वापरला जातो.
पूर्वी, विविध धातूंचे मिश्रण, विशेषतः सोने आणि चांदीचे मिश्रण, दागिने, आरसे आणि दंत भरण्यासाठी मोठ्या प्रमाणावर वापरले जात होते. तंत्रज्ञानामध्ये, पारा मोठ्या प्रमाणावर बॅरोमीटर आणि दाब गेजसाठी वापरला जात असे. बुध यौगिकांचा वापर पूतिनाशक (उत्तम), रेचक (कॅलोमेल), टोपी उत्पादनात, इ. म्हणून केला जात होता, परंतु त्याच्या उच्च विषाक्ततेमुळे, 20 व्या शतकाच्या अखेरीस त्यांना व्यावहारिकपणे या भागांमधून बाहेर काढण्यात आले (एकत्रीकरणाच्या जागी थुंकणे. आणि दंतचिकित्सामध्ये धातूंचे इलेक्ट्रोड डिपॉझिशन, पॉलिमर भरणे).
कमी-तापमानाच्या थर्मामीटरसाठी पारा आणि थॅलियमचा मिश्रधातू वापरला जातो.
धातूचा पारा काही रासायनिक वर्तमान स्त्रोतांमध्ये (उदाहरणार्थ, पारा-जस्त - प्रकार आरसी), संदर्भ व्होल्टेज स्त्रोतांमध्ये (वेस्टन घटक) सक्रिय धातू, क्लोरीन आणि अल्कलींच्या इलेक्ट्रोलाइटिक उत्पादनासाठी कॅथोड म्हणून काम करतो. पारा-जस्त घटक (emf 1.35 व्होल्ट) मध्ये आवाज आणि वस्तुमान (130 W/hour/kg, 550 W/hour/dm) खूप जास्त ऊर्जा आहे.
पुनर्नवीनीकरण केलेल्या ॲल्युमिनियम प्रक्रिया आणि सोन्याच्या खाणकामात पारा वापरला जातो (अमलगम पहा).
बऱ्याचदा भारित हायड्रोडायनामिक बियरिंग्जमध्ये पारा एक कार्यरत द्रव म्हणून देखील वापरला जातो.
समुद्राच्या पाण्यात जहाजाच्या पोकळ्यांना दूषित होण्यापासून रोखण्यासाठी काही जैवनाशक पेंट्समध्ये पारा समाविष्ट केला जातो.
पारा-203 (T1/2 = 53 sec) रेडिओफार्माकोलॉजीमध्ये वापरला जातो.
पारा लवण देखील वापरले जातात:
सेमीकंडक्टर रेडिएशन डिटेक्टर म्हणून पारा आयोडाइडचा वापर केला जातो.
मर्क्युरी फुलमिनेट ("मर्क्युरी फुलमिनेट") दीर्घकाळापासून सुरुवात करणारे स्फोटक (डेटोनेटर्स) म्हणून वापरले जात आहे.
मर्क्युरी ब्रोमाइड पाण्याचे थर्मोकेमिकल विघटन करून हायड्रोजन आणि ऑक्सिजन (अणु हायड्रोजन ऊर्जा) मध्ये वापरले जाते.
काही पारा संयुगे औषधे म्हणून वापरली जातात (उदाहरणार्थ, लस टिकवून ठेवण्यासाठी मेर्थिओलेट), परंतु मुख्यतः विषारीपणामुळे, 20 च्या उत्तरार्धात पारा औषधातून काढून टाकण्यात आला (सबलाइमेट, मर्क्युरिक ऑक्सीसायनाइड - अँटीसेप्टिक्स, कॅलोमेल - रेचक इ.) शतक

ॲल्युमिनियम
ॲल्युमिनियम हा D. I. Mendeleev Dmitry Ivanovich द्वारे रासायनिक घटकांच्या नियतकालिक प्रणालीच्या तिसऱ्या कालखंडातील तिसऱ्या गटातील मुख्य उपसमूहाचा एक घटक आहे, अणुक्रमांक 13. Al (lat. ॲल्युमिनियम) या चिन्हाने दर्शविले जाते. हलक्या धातूंच्या गटाशी संबंधित आहे. पृथ्वीच्या कवचातील सर्वात सामान्य धातू आणि तिसरा सर्वात मुबलक (ऑक्सिजन आणि सिलिकॉन नंतर) रासायनिक घटक.
साधा पदार्थ ॲल्युमिनियम (CAS क्रमांक: 7429-90-5) हा हलका, चुंबकीय नसलेला चांदी-पांढरा धातू आहे जो सहजपणे बनवता येतो, कास्ट करता येतो आणि मशीन बनवता येतो. ॲल्युमिनिअममध्ये उच्च औष्णिक आणि विद्युत चालकता आहे आणि मजबूत ऑक्साईड फिल्म्सच्या जलद निर्मितीमुळे गंजण्यास प्रतिकार आहे जे पृष्ठभागास पुढील परस्परसंवादापासून संरक्षण करते.
काही जैविक अभ्यासांनुसार, मानवी शरीरात ॲल्युमिनियमचे सेवन अल्झायमर रोगाच्या विकासासाठी एक घटक मानले गेले होते, परंतु या अभ्यासांवर नंतर टीका करण्यात आली आणि एक आणि दुसर्यामधील संबंधांबद्दलच्या निष्कर्षाचे खंडन करण्यात आले.
धातू चांदी-पांढरा, हलका, घनता 2.7 g/cm³, तांत्रिक साठी वितळण्याचा बिंदू 658 °C, उच्च-शुद्धता ॲल्युमिनियम 660 °C, उकळत्या बिंदू 2500 °C, कास्टची तन्य शक्ती 10-12 kg/mm², विकृत 18 -25 kg/mm2, मिश्र धातु 38-42 kg/mm².
ब्रिनेल कडकपणा 24-32 kgf/mm², उच्च लवचिकता: तांत्रिक 35%, शुद्ध 50%, पातळ पत्रके आणि अगदी फॉइलमध्ये गुंडाळलेली.
ॲल्युमिनिअममध्ये उच्च विद्युत आणि थर्मल चालकता आहे, क्युरमच्या विद्युत चालकतेच्या 65%, आणि उच्च प्रकाश परावर्तकता आहे.
ॲल्युमिनियम जवळजवळ सर्व धातूंसह मिश्र धातु बनवते.
सामान्य परिस्थितीत, ॲल्युमिनियम पातळ आणि टिकाऊ ऑक्साईड फिल्मने झाकलेले असते आणि म्हणून शास्त्रीय ऑक्सिडायझिंग एजंट्सवर प्रतिक्रिया देत नाही: H2O (t°); O2, HNO3 (हीटिंगशिवाय). याबद्दल धन्यवाद, ॲल्युमिनियम व्यावहारिकरित्या गंजच्या अधीन नाही आणि म्हणूनच आधुनिक उद्योगात मोठ्या प्रमाणावर मागणी आहे. तथापि, जेव्हा ऑक्साइड फिल्म नष्ट होते (उदाहरणार्थ, अमोनियम क्षार NH4+, गरम क्षारांच्या द्रावणाच्या संपर्कात आल्यावर किंवा एकत्रीकरणाच्या परिणामी), ॲल्युमिनियम सक्रिय कमी करणारे धातू म्हणून कार्य करते.
साध्या पदार्थांसह सहज प्रतिक्रिया देते:
ऑक्सिजनसह:
4Al + 3O2 = 2Al2O3
हॅलोजनसह:
2Al + 3Br2 = 2AlBr3
गरम झाल्यावर इतर नॉन-मेटल्सवर प्रतिक्रिया देते:
सल्फरसह, ॲल्युमिनियम सल्फाइड तयार करणे:
2Al + 3S = Al2S3
नायट्रोजनसह, ॲल्युमिनियम नायट्राइड तयार करते:
कार्बनसह, ॲल्युमिनियम कार्बाइड तयार करणे:
4Al + 3C = Al4C3
ॲल्युमिनियम सल्फाइड आणि कार्बाइड पूर्णपणे हायड्रोलायझ्ड आहेत:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
Al4C3 + 12H2O = 4Al(OH)3+ 3CH4
जटिल पदार्थांसह:
पाण्याने (संरक्षणात्मक ऑक्साईड फिल्म काढून टाकल्यानंतर, उदाहरणार्थ, एकत्रीकरण किंवा गरम अल्कली द्रावण):
2Al + 6H2O = 2Al(OH)3 + 3H2
अल्कलीसह (टेट्राहायड्रॉक्सोल्युमिनेट आणि इतर अल्युमिनेट्सच्या निर्मितीसह):
2Al + 2NaOH + 6H2O = 2Na + 3H2
2(NaOH.H2O) + 2Al = 2NaAlO2 + 3H2
हायड्रोक्लोरिक आणि पातळ सल्फ्यूरिक ऍसिडमध्ये सहजपणे विरघळते:
2Al + 6HCl = 2AlCl3 + 3H2
2Al + 3H2SO4(dil) = Al2(SO4)3 + 3H2
गरम केल्यावर, ते ऍसिडमध्ये विरघळते - ऑक्सिडायझिंग एजंट जे विद्रव्य ॲल्युमिनियम लवण तयार करतात:
2Al + 6H2SO4(conc) = Al2(SO4)3 + 3SO2 + 6H2O
Al + 6HNO3(conc) = Al(NO3)3 + 3NO2 + 3H2O
धातू त्यांच्या ऑक्साईड्समधून पुनर्संचयित करते (ॲल्युमिनोथर्मी):
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
2Al + Cr2O3 = Al2O3 + 2Cr
बांधकाम साहित्य म्हणून मोठ्या प्रमाणावर वापरले जाते. या गुणवत्तेतील ॲल्युमिनियमचे मुख्य फायदे म्हणजे हलकेपणा, स्टँपिंगसाठी लवचिकता, गंज प्रतिरोधकता (हवेमध्ये, ॲल्युमिनियम त्वरित टिकाऊ Al2O3 फिल्मने झाकलेले असते, जे त्याचे पुढील ऑक्सिडेशन प्रतिबंधित करते), उच्च थर्मल चालकता आणि त्याच्या संयुगांची गैर-विषाक्तता. विशेषतः, या गुणधर्मांमुळे कूकवेअर, अन्न उद्योगात ॲल्युमिनियम फॉइल आणि पॅकेजिंगसाठी ॲल्युमिनियम अत्यंत लोकप्रिय झाले आहे.
स्ट्रक्चरल मटेरिअल म्हणून ॲल्युमिनिअमचा मुख्य तोटा म्हणजे त्याची कमी ताकद आहे, त्यामुळे ते सहसा कप्रम आणि मॅग्नेशियम (मिश्रधातूला ड्युरल्युमिन म्हणतात) सह मिश्रित केले जाते.
ॲल्युमिनियमची विद्युत चालकता कपरमच्या तुलनेत केवळ 1.7 पट कमी आहे, तर ॲल्युमिनियम अंदाजे 2 पट स्वस्त आहे. म्हणून, तारांच्या निर्मितीसाठी, त्यांचे संरक्षण करण्यासाठी आणि चिप्समधील कंडक्टरच्या निर्मितीसाठी मायक्रोइलेक्ट्रॉनिकमध्ये देखील ते इलेक्ट्रिकल अभियांत्रिकीमध्ये मोठ्या प्रमाणावर वापरले जाते. कप्रम (63 1/ohm) च्या तुलनेत ॲल्युमिनियमची कमी विद्युत चालकता (37 1/ohm) ॲल्युमिनियम कंडक्टरच्या क्रॉस-सेक्शनमध्ये वाढ करून भरपाई केली जाते. विद्युत सामग्री म्हणून ॲल्युमिनियमचा तोटा म्हणजे त्याची मजबूत ऑक्साईड फिल्म, ज्यामुळे सोल्डरिंग कठीण होते.
त्याच्या गुणधर्मांच्या जटिलतेमुळे, ते गरम उपकरणांमध्ये मोठ्या प्रमाणावर वापरले जाते.
ॲल्युमिनिअम आणि त्याचे मिश्र धातु अति-कमी तापमानात ताकद टिकवून ठेवतात. यामुळे क्रायोजेनिक तंत्रज्ञानाचा वापर मोठ्या प्रमाणावर केला जातो.
उच्च परावर्तकता, कमी किमतीत आणि ठेवण्याची सुलभता, ॲल्युमिनियमला आरसे बनवण्यासाठी एक आदर्श सामग्री बनवते.
गॅस-फॉर्मिंग एजंट म्हणून बांधकाम साहित्याच्या उत्पादनात.
एल्युमिनाइझिंगमुळे स्टील आणि इतर मिश्रधातूंना गंज आणि प्रमाण प्रतिरोधकता मिळते, उदाहरणार्थ, पिस्टन अंतर्गत ज्वलन इंजिनचे वाल्व, टर्बाइन ब्लेड, तेल उत्पादन रिग, उष्णता विनिमय उपकरणे आणि गॅल्वनाइजिंगची जागा देखील बदलते.
हायड्रोजन सल्फाइड तयार करण्यासाठी ॲल्युमिनियम सल्फाइडचा वापर केला जातो.
फोम केलेले ॲल्युमिनियम विशेषतः मजबूत आणि हलके साहित्य म्हणून विकसित करण्यासाठी संशोधन चालू आहे.
जेव्हा ॲल्युमिनियम खूप महाग होते, तेव्हा त्यातून विविध प्रकारचे दागिने बनवले जायचे. जेव्हा त्यांच्या उत्पादनासाठी नवीन तंत्रज्ञान (विकास) दिसू लागले तेव्हा त्यांच्यासाठी फॅशन लगेचच निघून गेली आणि ती बर्याच वेळा कमी झाली. आजकाल ॲल्युमिनियमचा वापर कधीकधी पोशाख दागिन्यांच्या उत्पादनात केला जातो.


इतर धातू
आघाडी
लीड हा चौथ्या गटातील मुख्य उपसमूहाचा एक घटक आहे, D.I. दिमित्री इव्हानोविच मेंडेलीव्हच्या रासायनिक घटकांच्या नियतकालिक प्रणालीचा सहावा कालावधी, अणुक्रमांक 82 सह. हे Pb (लॅटिन: प्लंबम) या चिन्हाने नियुक्त केले आहे. साधा पदार्थ लीड (CAS क्रमांक: 7439-92-1) एक निंदनीय, तुलनेने फ्यूजिबल राखाडी धातू आहे.
शिशाची थर्मल चालकता कमी असते, ती 0 °C तापमानात 35.1 W/(m K) असते. धातू मऊ आहे आणि चाकूने सहजपणे कापता येते. पृष्ठभागावर ते सहसा ऑक्साईडच्या कमी किंवा कमी जाड फिल्मने झाकलेले असते; कापल्यावर, एक चमकदार पृष्ठभाग दिसून येतो, जो हवेत कालांतराने विरळ होतो.
वितळण्याचा बिंदू: 327.4 °C
उकळत्या बिंदू: 1740 ° से
लीड नायट्रेटचा वापर शक्तिशाली मिश्रित स्फोटके तयार करण्यासाठी केला जातो. लीड ॲझाइडचा वापर सर्वाधिक प्रमाणात वापरला जाणारा डिटोनेटर (इनिशिएटिंग एक्सप्लोसिव्ह) म्हणून केला जातो. लीड परक्लोरेटचा वापर जड द्रव (घनता 2.6 g/cm3) तयार करण्यासाठी वापरला जातो, ज्याचा वापर अयस्कांच्या फ्लोटेशन फायद्यासाठी केला जातो; ते कधीकधी शक्तिशाली मिश्रित स्फोटकांमध्ये ऑक्सिडायझिंग एजंट म्हणून वापरले जाते. एकट्या लीड फ्लोराईडचा, तसेच बिस्मथ, कपरम आणि सिल्व्हर फ्लोराईडसह, रासायनिक वर्तमान स्त्रोतांमध्ये कॅथोड सामग्री म्हणून वापरला जातो. लीड बिस्मुथेट, लीड सल्फाइड PbS, लीड आयोडाइड लिथियम बॅटरीमध्ये कॅथोड सामग्री म्हणून वापरतात. बॅकअप चालू स्त्रोतांमध्ये कॅथोड सामग्री म्हणून लीड क्लोराईड PbCl2. लीड टेल्युराइड PbTe थर्मोइलेक्ट्रिक मटेरियल (350 μV/K सह थर्मो-ईएमएफ) म्हणून मोठ्या प्रमाणावर वापरले जाते, थर्मोइलेक्ट्रिक जनरेटर आणि थर्मोइलेक्ट्रिक रेफ्रिजरेटर्सच्या उत्पादनात सर्वाधिक वापरले जाणारे साहित्य. लीड डायऑक्साइड PbO2 मोठ्या प्रमाणावर केवळ लीड बॅटरीमध्येच वापरला जात नाही, तर त्याच्या आधारावर अनेक राखीव रासायनिक वर्तमान स्रोत देखील तयार केले जातात, उदाहरणार्थ, लीड-क्लोरीन सेल, लीड-फ्लोरोसंट सेल इ.
लीड व्हाईट, बेसिक कार्बोनेट Pb(OH)2.PbCO3, दाट पांढरी पावडर, कार्बन डायऑक्साइड आणि ऍसिटिक ऍसिडच्या प्रभावाखाली हवेतील शिसेपासून मिळते. हायड्रोजन सल्फाइड H2S द्वारे विघटित झाल्यामुळे रंगीत रंगद्रव्य म्हणून पांढऱ्या शिशाचा वापर पूर्वीसारखा सामान्य राहिलेला नाही. पुटीच्या उत्पादनासाठी, सिमेंट आणि लीड कार्बोनेट पेपरच्या तंत्रज्ञानामध्ये शिशाचा पांढरा देखील वापरला जातो.
लीड आर्सेनेट आणि आर्सेनाइटचा वापर कीटकनाशक तंत्रज्ञानामध्ये शेतीतील कीटक (जिप्सी मॉथ आणि कापूस भुंगा) मारण्यासाठी केला जातो. लीड बोरेट Pb(BO2)2·H2O, एक अघुलनशील पांढरी पावडर, पेंटिंग आणि वार्निश सुकविण्यासाठी आणि इतर धातूंसह, काच आणि पोर्सिलेनसाठी कोटिंग म्हणून वापरली जाते. लीड क्लोराईड PbCl2, पांढरा स्फटिक पावडर, विरघळणारे गरम पाणी, इतर क्लोराईड्स आणि विशेषतः अमोनियम क्लोराईड NH4Cl चे द्रावण. हे ट्यूमरच्या उपचारांसाठी मलम तयार करण्यासाठी वापरले जाते.
लीड क्रोमेट PbCrO4 हा क्रोम यलो डाई म्हणून ओळखला जातो आणि पेंट्स बनवण्यासाठी, पोर्सिलेन आणि फॅब्रिक्स रंगवण्यासाठी एक महत्त्वाचा रंगद्रव्य आहे. उद्योगात, क्रोमेटचा वापर प्रामुख्याने पिवळ्या रंगद्रव्यांच्या निर्मितीसाठी केला जातो. लीड नायट्रेट Pb(NO3)2 हा एक पांढरा स्फटिकासारखा पदार्थ आहे, जो पाण्यात अत्यंत विरघळतो. हे मर्यादित वापराचे बाईंडर आहे. उद्योगात, ते मॅच उत्पादन, कापड रंग आणि छपाई, हॉर्न डाईंग आणि खोदकाम मध्ये वापरले जाते. लीड सल्फेट Pb(SO4)2, पाण्यात विरघळणारी पांढरी पावडर, बॅटरी, लिथोग्राफी आणि मुद्रित फॅब्रिक तंत्रज्ञानामध्ये रंगद्रव्य म्हणून वापरली जाते.
लीड सल्फाइड PbS, एक काळा, पाण्यात विरघळणारी पावडर, भांडी फायरिंगमध्ये आणि लीड आयन शोधण्यासाठी वापरली जाते.
शिसे γ-रेडिएशन चांगल्या प्रकारे शोषून घेत असल्याने, त्याचा उपयोग क्ष-किरण सुविधांमध्ये आणि अणुभट्ट्यांमध्ये रेडिएशन संरक्षणासाठी केला जातो. याव्यतिरिक्त, प्रगत वेगवान न्यूट्रॉन अणुभट्ट्यांच्या प्रकल्पांमध्ये लीडला शीतलक मानले जाते.
लीड मिश्रधातूंचा मोठ्या प्रमाणावर वापर केला जातो. 85-90% कथील धातू आणि 15-10% Pb असलेले प्युटर (टिन आणि शिशाचे मिश्र धातु) हे मोल्ड करण्यायोग्य, स्वस्त आणि घरगुती भांडी तयार करण्यासाठी वापरले जाते. विद्युत अभियांत्रिकीमध्ये 67% Pb आणि 33% टिन धातू असलेले सोल्डर वापरले जाते. अँटिमनीसह लीडचे मिश्र धातु बुलेट्स आणि टायपोग्राफिक फॉन्टच्या निर्मितीमध्ये वापरले जातात आणि लीड, अँटिमनी आणि टिनचे मिश्र धातु कास्टिंग आणि बेअरिंगसाठी वापरले जातात. लीड-अँटीमनी मिश्रधातूंचा वापर सामान्यतः केबल शीथ आणि इलेक्ट्रिक बॅटरी प्लेटसाठी केला जातो. शिशाची संयुगे रंग, रंग, कीटकनाशके, काच यांच्या उत्पादनात वापरली जातात व्यापार आयटमआणि tetraethyl शिसे (C2H5)4Pb (मध्यम वाष्पशील द्रव, लहान एकाग्रतेतील बाष्पांना एक गोड फळाचा वास असतो, मोठ्या प्रमाणामध्ये त्यांना अप्रिय गंध असतो; वितळण्याचा बिंदू = 130 °C, उत्कलन बिंदू = 80°C/13 mm Hg .st.; घनता 1.650 g/cm; nD2v = 1.5198; पाण्यात विरघळणारे नाही, सेंद्रिय सॉल्व्हेंट्ससह मिसळणारे; अत्यंत विषारी, त्वचेत सहज प्रवेश करते; MPC = 0.005 mg/m; LD50 = 17g / किलो (उंदीर, तोंडी)) ऑक्टेन संख्या वाढवण्यासाठी.

कथील
टिन हा चौथ्या गटातील मुख्य उपसमूहाचा एक घटक आहे, डी.आय. मेंडेलीव्ह दिमित्री इव्हानोविच यांच्या रासायनिक घटकांच्या नियतकालिक प्रणालीचा पाचवा कालखंड, अणुक्रमांक ५० सह. हे टिन धातू (लॅटिन स्टॅनम) या चिन्हाने नियुक्त केले आहे. सामान्य स्थितीत, एक साधा पदार्थ म्हणजे चांदी-पांढऱ्या रंगाचा प्लास्टिक, निंदनीय आणि फ्यूसिबल चमकदार धातू. टिनमध्ये अनेक ॲलोट्रॉपिक बदल होतात: 13.2 °C च्या खाली, α-tin (राखाडी टिन) घन डायमंड-प्रकारची जाळी स्थिर असते; 13.2 °C वर, β-tin (पांढरा टिन) चौकोनी क्रिस्टल जाळीसह स्थिर असते.
कथील प्रामुख्याने सुरक्षित, बिनविषारी, गंज-प्रतिरोधक कोटिंग म्हणून त्याच्या शुद्ध स्वरूपात किंवा इतर धातूंसह मिश्रधातूंमध्ये वापरला जातो. कथीलचे मुख्य औद्योगिक उपयोग अन्नाच्या डब्यांसाठी टिनप्लेटमध्ये (टिन केलेले लोह), इलेक्ट्रॉनिक्सच्या सोल्डरमध्ये, घरगुती पाइपिंगमध्ये, बेअरिंग मिश्रधातूंमध्ये आणि कथील आणि त्याच्या मिश्र धातुंच्या कोटिंगमध्ये आहेत. कथील सर्वात महत्वाचे मिश्र धातु आहे कांस्य(कप्रम सह). आणखी एक सुप्रसिद्ध मिश्र धातु, pewter, टेबलवेअर बनवण्यासाठी वापरला जातो. IN अलीकडेजड नॉन-फेरस धातूंमध्ये ते सर्वात "पर्यावरणपूरक" असल्याने धातूच्या वापरात रस निर्माण होत आहे. Nb3Sn इंटरमेटेलिक कंपाऊंडवर आधारित सुपरकंडक्टिंग वायर तयार करण्यासाठी वापरला जातो.
किमती 2006 मध्ये मेटॅलिक टिनसाठी सरासरी 12-18 डॉलर/किलो, उच्च-शुद्धता टिन डायऑक्साइड सुमारे 25 डॉलर/किलो, सिंगल-क्रिस्टलाइन उच्च-शुद्धता टिन सुमारे 210 डॉलर/किलो.
कथील आणि झिर्कोनियमच्या इंटरमेटॅलिक संयुगेमध्ये उच्च वितळण्याचे बिंदू (2000 °C पर्यंत) आणि हवेत गरम केल्यावर ऑक्सिडेशनला प्रतिकार असतो आणि त्यात अनेक अनुप्रयोग असतात.
स्ट्रक्चरल टायटॅनियम मिश्र धातुंच्या उत्पादनात टिन हा सर्वात महत्वाचा मिश्रधातू घटक आहे.
टिन डायऑक्साइड ही एक अतिशय प्रभावी अपघर्षक सामग्री आहे जी ऑप्टिकल काचेच्या पृष्ठभागाला “समाप्त” करण्यासाठी वापरली जाते.
कथील क्षारांचे मिश्रण - "पिवळी रचना" - पूर्वी लोकरसाठी रंग म्हणून वापरली जात होती.
टिनचा वापर रासायनिक वर्तमान स्त्रोतांमध्ये एनोड सामग्री म्हणून देखील केला जातो, उदाहरणार्थ: मँगनीज-टिन घटक, पारा-टिन ऑक्साइड घटक. लीड-टिन बॅटरीमध्ये टिनचा वापर आशादायक आहे; उदाहरणार्थ, लीड बॅटरी सारख्या व्होल्टेजवर, लीड-टिन बॅटरीची क्षमता 2.5 पट जास्त असते आणि प्रति युनिट व्हॉल्यूमच्या 5 पट जास्त ऊर्जा घनता असते, तिचा अंतर्गत प्रतिकार खूपच कमी असतो.
कथील धातू गैर-विषारी आहे, ज्यामुळे ते अन्न उद्योगात वापरता येते. 600 डिग्री सेल्सिअस तापमानात वितळण्यासह, स्टोरेज आणि वापरण्याच्या सामान्य परिस्थितीत टिनमध्ये असलेली हानिकारक अशुद्धता, GOST नुसार जास्तीत जास्त परवानगी असलेल्या एकाग्रतेपेक्षा जास्त प्रमाणात कार्यरत क्षेत्राच्या हवेत सोडली जात नाही. टिन धुळीच्या दीर्घकाळापर्यंत (15-20 वर्षे) संपर्काचा फुफ्फुसांवर फायब्रोजेनिक प्रभाव पडतो आणि कामगारांमध्ये न्यूमोकोनिओसिस होऊ शकतो.
धातू अर्ज
बांधकामाचे सामान
धातू आणि त्यांचे मिश्र धातु आधुनिक सभ्यतेच्या मुख्य संरचनात्मक साहित्यांपैकी एक आहेत. हे प्रामुख्याने त्यांच्या उच्च शक्ती, एकसारखेपणा आणि द्रव आणि वायूंच्या अभेद्यतेद्वारे निर्धारित केले जाते. याव्यतिरिक्त, मिश्रधातूच्या फॉर्म्युलेशनमध्ये बदल करून, त्यांचे गुणधर्म खूप विस्तृत श्रेणीमध्ये बदलणे शक्य आहे.
इलेक्ट्रिकल साहित्य
धातू दोन्ही चांगले कंडक्टर म्हणून वापरले जातात वीज(तांबे, ॲल्युमिनियम), आणि प्रतिरोधक आणि इलेक्ट्रिक हीटिंग एलिमेंट्स (निक्रोम इ.) साठी वाढीव प्रतिकार असलेली सामग्री म्हणून.
साधन साहित्य
धातू आणि त्यांचे मिश्रधातू साधनांच्या निर्मितीसाठी (त्यांचे कार्यरत भाग) मोठ्या प्रमाणावर वापरले जातात. हे मुख्यतः टूल स्टील्स आणि हार्ड मिश्र धातु आहेत. डायमंड, बोरॉन नायट्राइड आणि सिरॅमिक्स देखील साधन सामग्री म्हणून वापरले जातात.
धातूशास्त्र
धातूशास्त्र किंवा धातूविज्ञान हे भौतिक विज्ञानाचे एक क्षेत्र आहे जे धातू, आंतरधातू संयुगे आणि मिश्र धातुंच्या भौतिक आणि रासायनिक वर्तनाचा अभ्यास करते. कच्च्या मालाच्या उत्खननापासून ते तयार उत्पादनांच्या आर्थिक समस्येपर्यंत - धातूबद्दलच्या विद्यमान ज्ञानाचा व्यावहारिक उपयोग मेटलर्जीमध्ये देखील समाविष्ट आहे.
धातू आणि ऑक्साईड वितळणे आणि घन सोल्यूशन्सची रचना आणि भौतिक-रासायनिक गुणधर्मांचा अभ्यास, पदार्थाच्या घनरूप अवस्थेच्या सिद्धांताचा विकास;
थर्मोडायनामिक्स, गतिशास्त्र आणि मेटलर्जिकल प्रतिक्रियांची यंत्रणा यांचा अभ्यास;
पर्यावरणीय समस्यांचे निराकरण करण्यासाठी पॉलिमेटेलिक खनिज कच्चा माल आणि टेक्नोजेनिक कचरा यांच्या एकात्मिक वापरासाठी वैज्ञानिक, तांत्रिक आणि आर्थिक पाया विकसित करणे;
पायरोमेटलर्जिकल, इलेक्ट्रोथर्मल, हायड्रोमेटालर्जिकल आणि गॅस-फेजच्या मूलभूत तत्त्वांच्या सिद्धांताचा विकास प्रक्रियाधातू, मिश्रधातू, धातू पावडर आणि संमिश्र साहित्य आणि कोटिंग्जचे उत्पादन.
फेरस धातूंमध्ये लोह, मँगनीज, क्रोमियम, व्हॅनेडियम यांचा समावेश होतो. बाकी सर्व रंगीत आहेत. त्यांच्या भौतिक गुणधर्म आणि उद्देशाच्या आधारावर, नॉन-फेरस धातू पारंपारिकपणे जड (तांबे, शिसे, जस्त, कथील, नि) आणि प्रकाश (ॲल्युमिनियम, मॅग्नेशियम) मध्ये विभागले जातात.
मुख्य नुसार तांत्रिक प्रक्रिया pyrometallurgy (smelting) आणि hydrometalurgy (रासायनिक द्रावणात धातू काढणे) मध्ये विभागलेले आहे. पायरोमेटलर्जीचा एक प्रकार म्हणजे प्लाझ्मा मेटलर्जी.
प्लाझ्मा मेटॅलर्जी - धातूपासून काढणे, प्लाझ्माच्या प्रभावाखाली धातू आणि मिश्र धातुंचे वितळणे आणि प्रक्रिया करणे.
अयस्कांची (ऑक्साइड इ.) प्रक्रिया त्यांच्या प्लाझ्मामधील थर्मल विघटनाद्वारे केली जाते. उलट प्रतिक्रिया टाळण्यासाठी, कमी करणारे एजंट (कार्बन, हायड्रोजन, मिथेन इ.) किंवा प्लाझ्मा प्रवाहाची तीक्ष्ण शीतकरण वापरली जाते, ज्यामुळे थर्मोडायनामिक समतोल बिघडतो.
प्लाझ्मा मेटलर्जीमुळे धातूपासून धातू थेट कमी करणे, धातूच्या प्रक्रियेस लक्षणीय गती देणे, शुद्ध सामग्री मिळवणे आणि इंधन (कमी करणारे एजंट) खर्च कमी करणे शक्य होते. प्लाझ्मा मेटलर्जीचा तोटा म्हणजे प्लाझमा तयार करण्यासाठी वापरल्या जाणाऱ्या विजेचा उच्च वापर.

कथा
मनुष्य धातुशास्त्रात गुंतला होता याचा पहिला पुरावा 5व्या-6व्या सहस्रकापूर्वीचा आहे. e आणि सर्बियामधील माजदानपेक, प्लोनिक आणि इतर ठिकाणी आढळले (5500 बीसी मधील तांब्याच्या कुऱ्हाडीसह, विन्का संस्कृतीशी संबंधित), बल्गेरिया (5000 बीसी), पामेला (), स्पेन, स्टोनहेंज (). तथापि, अशा प्राचीन घटनांसह अनेकदा घडते, वय नेहमीच अचूकपणे निर्धारित केले जाऊ शकत नाही.
सुरुवातीच्या काळातील संस्कृतीत चांदी, तांबे, कथील आणि उल्का लोखंड होते, ज्यामुळे मर्यादित धातूकाम करण्याची परवानगी होती. अशा प्रकारे, "स्वर्गीय खंजीर" अत्यंत मूल्यवान होते - इजिप्शियन शस्त्रे उल्का लोखंडापासून 3000 बीसी तयार केली गेली. e पण, तांबे आणि कथील काढायला शिकलो खडकआणि लोकांनी 3500 बीसी मध्ये कांस्य नावाचा मिश्रधातू तयार केला. e कांस्ययुगात प्रवेश केला.
धातूपासून लोह मिळवणे आणि धातू वितळणे अधिक कठीण होते. सुमारे १२०० ईसापूर्व हित्ती लोकांनी या तंत्रज्ञानाचा शोध लावला असे मानले जाते. ई., जे लोहयुगाची सुरुवात झाली. खाणकाम आणि लोह बनवण्याचे रहस्य हे पलिष्ट्यांच्या अधिपत्याखाली एक महत्त्वाचे घटक बनले.
अनेक भूतकाळातील संस्कृती आणि सभ्यतांमध्ये फेरस धातूविज्ञानाच्या विकासाच्या खुणा शोधल्या जाऊ शकतात. यामध्ये मध्य पूर्व आणि पूर्वेकडील प्राचीन आणि मध्ययुगीन राज्ये आणि साम्राज्ये, प्राचीन इजिप्त आणि अनातोलिया (), कार्थेज, प्राचीन आणि मध्ययुगीन ग्रीक आणि रोमन यांचा समावेश आहे. युरोप, चीन, इ. हे लक्षात घेतले पाहिजे की धातूशास्त्राच्या अनेक पद्धती, उपकरणे आणि तंत्रज्ञानाचा शोध मूळतः प्राचीन चीनमध्ये लागला होता आणि नंतर युरोपियन लोकांनी या हस्तकलेत प्रभुत्व मिळवले (ब्लास्ट फर्नेसचा शोध लावला, ओतीव लोखंड, स्टील, हायड्रॉलिक हॅमर इ.). तथापि, अलीकडील संशोधन असे सूचित करते की रोमन तंत्रज्ञान पूर्वीच्या विचारापेक्षा खूप प्रगत होते, विशेषतः खाणकाम आणि फोर्जिंगच्या क्षेत्रात.
खाण धातूशास्त्र
एक्स्ट्रॅक्टिव्ह मेटलर्जीमध्ये धातूपासून मौल्यवान धातू काढणे आणि काढलेला कच्चा माल शुद्ध धातूमध्ये वितळणे यांचा समावेश होतो. मेटल ऑक्साईड किंवा सल्फाइडचे शुद्ध धातूमध्ये रूपांतर करण्यासाठी, धातूचे भौतिक, रासायनिक किंवा इलेक्ट्रोलाइटिक माध्यमांनी वेगळे करणे आवश्यक आहे.
धातूशास्त्रज्ञ तीन मुख्य घटकांसह कार्य करतात: कच्चा माल, घनता (धातूचे मौल्यवान ऑक्साईड किंवा सल्फाइड) आणि कचरा. एकदा उत्खनन केल्यावर, धातूचे मोठे तुकडे अशा ठिकाणी चिरडले जातात जेथे प्रत्येक कण एकतर मौल्यवान सांद्रता किंवा कचरा असतो.
डोंगर कार्य करतेधातू आणि वातावरण लीचिंगला परवानगी देत असल्यास आवश्यक नाही. अशा प्रकारे, आपण विरघळू शकता आणि खनिजाने समृद्ध केलेले समाधान मिळवू शकता.
अनेकदा धातूमध्ये अनेक मौल्यवान धातू असतात. अशा परिस्थितीत, एका प्रक्रियेतील कचरा दुसऱ्या प्रक्रियेसाठी कच्चा माल म्हणून वापरला जाऊ शकतो.
मिश्रधातू
मिश्रधातू हे धातूच्या घटकांचे प्राबल्य असलेले दोन किंवा अधिक रासायनिक घटकांचे मॅक्रोस्कोपिकदृष्ट्या एकसंध मिश्रण आहे. मिश्रधातूचा मुख्य किंवा एकमेव टप्पा, एक नियम म्हणून, मिश्रधातूचा आधार असलेल्या धातूमधील मिश्रधातूंच्या घटकांचे घन समाधान आहे.
मिश्र धातुंमध्ये धातूचे गुणधर्म असतात, उदाहरणार्थ: धातूची चमक, उच्च विद्युत चालकता आणि थर्मल चालकता. कधीकधी मिश्रधातूचे घटक केवळ रासायनिक घटक नसतात, तर धातूचे गुणधर्म असलेले रासायनिक संयुगे देखील असू शकतात. उदाहरणार्थ, हार्ड मिश्र धातुंचे मुख्य घटक टंगस्टन किंवा टायटॅनियम कार्बाइड आहेत. मिश्रधातूंचे मॅक्रोस्कोपिक गुणधर्म नेहमी त्यांच्या घटकांच्या गुणधर्मांपेक्षा वेगळे असतात आणि धातूच्या मॅट्रिक्समधील अशुद्धता टप्प्यांच्या समान वितरणामुळे मल्टीफेस (विषम) मिश्रधातूंची मॅक्रोस्कोपिक एकसंधता प्राप्त होते.
मिश्रधातू सामान्यत: वितळलेल्या अवस्थेत घटक मिसळून आणि नंतर थंड करून तयार केले जातात. घटकांच्या उच्च वितळलेल्या तापमानात, धातूच्या पावडरचे मिश्रण करून मिश्रधातू तयार केले जातात आणि त्यानंतर सिंटरिंग (अशा प्रकारे, अनेक टंगस्टन मिश्र धातु मिळतात).
मिश्र धातु मुख्य संरचनात्मक सामग्रींपैकी एक आहेत. त्यापैकी, लोह आणि ॲल्युमिनियमवर आधारित मिश्रधातूंना सर्वात जास्त महत्त्व आहे. कार्बन, सिलिकॉन, बोरॉन इत्यादी नसलेल्या धातूंचाही अनेक मिश्रधातूंच्या रचनेत परिचय होऊ शकतो. तंत्रज्ञानामध्ये 5 हजार पेक्षा जास्त मिश्रधातूंचा वापर केला जातो.
स्रोत
http://ru.wikipedia.org/
गुंतवणूकदार विश्वकोश. 2013 .
समानार्थी शब्द:- - मेटल, मेटल नर, lat. क्रुशेक; आणि लहान स्वरूपात, smelting मध्ये: kinglet. दैनंदिन जीवनात, मौल्यवान, महाग धातू: सोने, प्लॅटिनम, चांदी; साधे: लोह, तांबे, जस्त, कथील, शिसे; रसायनशास्त्राने अशी तत्त्वे जवळजवळ सर्व जीवाश्मांसाठी शोधली आहेत ज्यात... ... डहलचा स्पष्टीकरणात्मक शब्दकोश
सध्या ज्ञात असलेल्या रासायनिक घटकांपैकी बहुसंख्य (117 पैकी 93) धातू आहेत.
विविध धातूंच्या अणूंच्या संरचनेत बरेच साम्य असते आणि ते बनवलेल्या साध्या आणि जटिल पदार्थांमध्ये समान गुणधर्म असतात (भौतिक आणि रासायनिक).
नियतकालिक सारणीतील स्थान आणि धातूच्या अणूंची रचना.
नियतकालिक सारणीमध्ये, धातू बोरॉन ते ॲस्टाटिनपर्यंत चालणाऱ्या पारंपरिक तुटलेल्या रेषेच्या डावीकडे आणि खाली स्थित आहेत (खालील तक्ता पहा). जवळजवळ सर्व s-घटक (H, He अपवाद वगळता) धातू आहेत, अंदाजे अर्धे आर- घटक, सर्व d- आणि f-घटक ( lanthanidesआणि ऍक्टिनाइड्स).
बहुतेक धातूच्या अणूंमध्ये त्यांच्या बाह्य उर्जा पातळीमध्ये कमी संख्येने (3 पर्यंत) इलेक्ट्रॉन असतात; फक्त काही p-मूलद्रव्यांच्या (Sn, Pb, Bi, Po) अणूंमध्ये जास्त (चार ते सहा पर्यंत) असतात. धातूच्या अणूंचे व्हॅलेन्स इलेक्ट्रॉन्स न्यूक्लियसला बांधलेले असतात (नॉन-मेटल अणूंच्या तुलनेत). म्हणून, धातूचे अणू तुलनेने सहजपणे हे इलेक्ट्रॉन इतर अणूंना देतात, म्हणून कार्य करतात रासायनिक प्रतिक्रियाकेवळ कमी करणारे एजंट म्हणून आणि त्याच वेळी सकारात्मक चार्ज केलेल्या केशन्समध्ये बदलणे:
मी - ne – = मी n+.
नॉन-मेटल्सच्या विपरीत, धातूचे अणू +1 ते +8 पर्यंत केवळ सकारात्मक ऑक्सिडेशन अवस्थेद्वारे दर्शविले जातात.
धातूचे अणू ज्या सहजतेने त्यांचे व्हॅलेन्स इलेक्ट्रॉन इतर अणूंना देतात ते त्या धातूची क्रियाशीलता कमी करते. धातूचा अणू जितक्या सहजतेने त्याचे इलेक्ट्रॉन सोडतो, तितका तो कमी करणारा घटक अधिक मजबूत असतो. जर आपण धातूंची जलीय द्रावणात त्यांची कमी करणारी शक्ती कमी करण्याच्या क्रमाने एका ओळीत मांडली तर आपल्याला त्याची माहिती मिळते. धातूंची विस्थापन मालिका, ज्याला इलेक्ट्रोकेमिकल व्होल्टेज मालिका देखील म्हणतात (किंवा जवळील क्रियाकलाप) धातू (खालील तक्ता पहा).
प्रसार मनिसर्गातील धातू.
पृथ्वीच्या कवचातील शीर्ष तीन सर्वात सामान्य धातू (हा आपल्या ग्रहाचा पृष्ठभागाचा थर आहे, अंदाजे 16 किमी जाडीचा) ॲल्युमिनियम, लोह आणि कॅल्शियम आहेत. सोडियम, पोटॅशियम आणि मॅग्नेशियम कमी सामान्य आहेत. खालील तक्ता पृथ्वीच्या कवचातील काही धातूंचे वस्तुमान अपूर्णांक दाखवते.
लोह आणि कॅल्शियम. सोडियम, पोटॅशियम आणि मॅग्नेशियम कमी सामान्य आहेत. खालील तक्ता पृथ्वीच्या कवचातील काही धातूंचे वस्तुमान अपूर्णांक दाखवते.
पृथ्वीच्या कवच मध्ये धातू घटना
| धातू | धातू | पृथ्वीच्या कवचातील वस्तुमानाचा अंश, % | |
|---|---|---|---|
| अल | 8,8 | क्र | 8,3 ∙ 10 -3 |
| फे | 4,65 | Zn | 8,3 ∙ 10 -3 |
| सीए | 3,38 | नि | 8 ∙ 10 -3 |
| ना | 2,65 | कु | 4,7 ∙ 10 -3 |
| के | 2,41 | Pb | 1,6 ∙ 10 -3 |
| मिग्रॅ | 2,35 | Ag | 7 ∙ 10 -6 |
| ति | 0,57 | Hg | 1,35 ∙ 10 -6 |
| Mn | 0,10 | Au | 5 ∙ 10 -8 |
पृथ्वीच्या कवचातील वस्तुमानाचा अंश ०.०१% पेक्षा कमी आहे अशा घटकांना म्हणतात दुर्मिळ. दुर्मिळ धातूंमध्ये, उदाहरणार्थ, सर्व लॅन्थॅनाइड्स समाविष्ट आहेत. जर एखादा घटक पृथ्वीच्या कवचामध्ये एकाग्र होऊ शकत नसेल, म्हणजेच तो स्वतःची धातू बनवत नाही, परंतु इतर घटकांसह अशुद्धता म्हणून आढळतो, तर त्याचे वर्गीकरण असे केले जाते. अनुपस्थित मनाचाघटक. उदाहरणार्थ, खालील धातू विखुरलेले आहेत: Sc, Ga, In, Tl, Hf.
XX शतकाच्या 40 च्या दशकात. जर्मन शास्त्रज्ञ वॉल्टर आणि इडा नोला यांनी ही कल्पना व्यक्त केली. की फुटपाथवरील प्रत्येक कोबलस्टोनमध्ये आवर्त सारणीतील सर्व रासायनिक घटक असतात. सुरुवातीला, या शब्दांना त्यांच्या सहकाऱ्यांनी एकमताने मान्यता दिली नाही. तथापि, विश्लेषणाच्या अधिकाधिक अचूक पद्धती दिसू लागल्यावर, शास्त्रज्ञांना या शब्दांच्या सत्याबद्दल अधिकाधिक खात्री पटली आहे.
सर्व सजीवांच्या जवळच्या संपर्कात असल्याने वातावरण, नंतर त्या प्रत्येकामध्ये नियतकालिक सारणीतील बहुतेक रासायनिक घटक असले पाहिजेत. उदाहरणार्थ, प्रौढ मानवी शरीरात वस्तुमानाचा अंश अजैविक पदार्थ 6% आहे. धातूंमध्ये, या संयुगांमध्ये Mg, Ca, Na, K असतात. आपल्या शरीरातील अनेक एन्झाइम्स आणि इतर जैविक दृष्ट्या सक्रिय सेंद्रिय संयुगेमध्ये V, Mn, Fe, Cu, Zn, Co, Ni, Mo, Cr आणि इतर काही धातू असतात.
प्रौढांच्या शरीरात सरासरी 140 ग्रॅम पोटॅशियम आयन आणि सुमारे 100 ग्रॅम सोडियम आयन असतात. अन्नासह, आम्ही दररोज 1.5 ग्रॅम ते 7 ग्रॅम पोटॅशियम आयन आणि 2 ग्रॅम ते 15 ग्रॅम सोडियम आयन घेतो. सोडियम आयनांची गरज इतकी मोठी आहे की ते विशेषत: अन्नामध्ये जोडले जाणे आवश्यक आहे. सोडियम आयनचे लक्षणीय नुकसान (लघवी आणि घामामध्ये NaCl स्वरूपात) मानवी आरोग्यावर विपरित परिणाम करते. म्हणून, गरम हवामानात, डॉक्टर पिण्याची शिफारस करतात शुद्ध पाणी. तथापि, अन्नातील अतिरिक्त मीठ सामग्री देखील आपल्या कार्यावर नकारात्मक परिणाम करते अंतर्गत अवयव(प्रामुख्याने हृदय आणि मूत्रपिंड).
मत देण्यासाठी तुम्हाला JavaScript सक्षम करणे आवश्यक आहेआणि इतर रासायनिक संयुगे. शुद्ध धातू मिळविण्यासाठी आणि त्यांचा पुढील वापर करण्यासाठी, त्यांना धातूपासून वेगळे करणे आणि शुद्धीकरण करणे आवश्यक आहे. आवश्यक असल्यास, अमलात आणा डोपिंगआणि इतर धातू प्रक्रिया. विज्ञान याचा अभ्यास करत आहे धातू शास्त्र. धातूशास्त्र फेरस धातूंच्या धातूंमध्ये फरक करते (आधारीत ग्रंथी) आणि नॉन-फेरस (त्यात लोह नसतात, फक्त 70 घटक असतात). सोने, चांदी आणि प्लॅटिनमला देखील लागू करा मौल्यवान (उदात्त) धातू . याव्यतिरिक्त, ते समुद्राचे पाणी, वनस्पती आणि सजीवांमध्ये (महत्त्वाची भूमिका बजावत) कमी प्रमाणात उपस्थित असतात.
हे ज्ञात आहे की मानवी शरीरात 3% असते. धातू. सगळ्यात जास्त आमच्यात पेशी कॅल्शियमआणि सोडियम, मध्ये केंद्रित लिम्फॅटिक प्रणाली. मॅग्नेशियममध्ये जमा होते स्नायूआणि मज्जासंस्था , तांबे- व्ही यकृत , लोखंड- व्ही रक्त.
उत्पादन
धातू बहुतेक वेळा खाणकामाद्वारे पृथ्वीवरून काढले जातात आणि परिणामी धातू आवश्यक घटकांचा तुलनेने समृद्ध स्त्रोत प्रदान करतात. धातूंचे स्थान निश्चित करण्यासाठी, विशेष शोध पद्धती वापरल्या जातात, ज्यात धातूचा शोध आणि ठेव संशोधन समाविष्ट आहे. ठेवी सहसा विभागल्या जातात करिअर(पृष्ठभागावरील धातूंचे उत्खनन), ज्यामध्ये जड उपकरणे वापरून तसेच भूमिगत माती काढून खाणकाम केले जाते. खाणी.
धातू सामान्यतः रासायनिक किंवा इलेक्ट्रोलाइटिक घट वापरून खणलेल्या धातूपासून काढले जातात. IN पायरोमेटलर्जीधातूच्या कच्च्या मालामध्ये धातूचे रूपांतर करण्यासाठी वापरले जाते उच्च तापमान, व्ही हायड्रोमेटलर्जीत्याच उद्देशांसाठी जलीय रसायन वापरले जाते. वापरलेल्या पद्धती धातूच्या प्रकारावर आणि दूषिततेच्या प्रकारावर अवलंबून असतात.
जेव्हा धातूचा धातू धातू आणि नॉन-मेटलचा आयनिक कंपाऊंड असतो, तेव्हा शुद्ध धातू काढण्यासाठी ते सामान्यतः स्मेल्टिंग - कमी करणाऱ्या एजंटसह गरम केले जाते. अनेक सामान्य धातू जसे की लोखंड, कमी करणारे एजंट म्हणून वापरून वितळले कार्बन(जळत्या कोळशापासून मिळविलेले). काही धातू जसे ॲल्युमिनियमआणि सोडियम, एकच आर्थिकदृष्ट्या न्याय्य कमी करणारे एजंट नाही आणि वापरून काढले जातात इलेक्ट्रोलिसिस.
मोह स्केलवर काही धातूंची कडकपणा:
| कडकपणा | धातू |
|---|---|
| 0.2 | सिझियम |
| 0.3 | रुबिडियम |
| 0.4 | पोटॅशियम |
| 0.5 | सोडियम |
| 0.6 | लिथियम |
| 1.2 | इंडियम |
| 1.2 | थॅलियम |
| 1.25 | बेरियम |
| 1.5 | स्ट्रॉन्टियम |
| 1.5 | गॅलियम |
| 1.5 | कथील |
| 1.5 | आघाडी |
| 1.5 | |
| 1.75 | कॅल्शियम |
| 2.0 | कॅडमियम |
| 2.25 | बिस्मथ |
| 2.5 | मॅग्नेशियम |
| 2.5 | जस्त |
| 2.5 | लॅन्थॅनम |
| 2.5 | चांदी |
| 2.5 | सोने |
| 2.59 | यत्रियम |
| 2.75 | ॲल्युमिनियम |
| 3.0 | तांबे |
| 3.0 | अँटिमनी |
| 3.0 | थोरियम |
| 3.17 | स्कँडियम |
| 3.5 | प्लॅटिनम |
| 3.75 | कोबाल्ट |
| 3.75 | पॅलेडियम |
| 3.75 | झिरकोनिअम |
| 4.0 | लोखंड |
| 4.0 | निकेल |
| 4.0 | हॅफनियम |
| 4.0 | मँगनीज |
| 4.5 | व्हॅनेडियम |
| 4.5 | मॉलिब्डेनम |
| 4.5 | रोडियम |
| 4.5 | टायटॅनियम |
| 4.75 | निओबियम |
| 5.0 | इरिडियम |
| 5.0 | रुथेनियम |
| 5.0 | टँटलम |
| 5.0 | टेक्नेटियम |
| 5.0 | क्रोमियम |
| 5.5 | बेरिलियम |
| 5.5 | ऑस्मियम |
| 5.5 | रेनिअम |
| 6.0 | टंगस्टन |
| 6.0 | β-युरेनियम |
इलेक्ट्रॉनच्या सहज नुकसानीमुळे, धातूंचे ऑक्सीकरण शक्य आहे, ज्यामुळे होऊ शकते गंजआणि गुणधर्मांचे आणखी ऱ्हास. ऑक्सिडाइझ करण्याची क्षमता धातूंच्या मानक क्रियाकलाप मालिकेद्वारे ओळखली जाऊ शकते. हे तथ्य इतर घटकांच्या संयोजनात धातू वापरण्याची आवश्यकता पुष्टी करते ( मिश्रधातू, त्यापैकी सर्वात महत्वाचे आहे स्टील), त्यांचे मिश्र धातु आणि विविध कोटिंग्जचा वापर.
धातूंच्या इलेक्ट्रॉनिक गुणधर्मांच्या अधिक अचूक वर्णनासाठी, ते वापरणे आवश्यक आहे क्वांटम यांत्रिकी. पुरेशी सर्व घन पदार्थांमध्ये सममितीवैयक्तिक अणूंच्या इलेक्ट्रॉन्सची ऊर्जा पातळी ओव्हरलॅप होऊन अनुमत बँड बनवतात आणि व्हॅलेन्स इलेक्ट्रॉन्सने तयार केलेल्या बँडला म्हणतात व्हॅलेन्स बँड. धातूंमधील व्हॅलेन्स इलेक्ट्रॉनचे कमकुवत कनेक्शन हे वस्तुस्थितीकडे नेत आहे की धातूंमधील व्हॅलेन्स बँड खूप विस्तृत आहे आणि सर्व व्हॅलेन्स इलेक्ट्रॉन ते पूर्णपणे भरण्यासाठी पुरेसे नाहीत.
अशा अर्धवट भरलेल्या झोनचे मूलभूत वैशिष्ट्य म्हणजे किमान लागू केलेल्या व्होल्टेजवरही, नमुन्यामध्ये व्हॅलेन्स इलेक्ट्रॉनची पुनर्रचना सुरू होते, म्हणजे प्रवाह. वीज.
इलेक्ट्रॉनच्या समान उच्च गतिशीलतेमुळे उच्च थर्मल चालकता, तसेच इलेक्ट्रोमॅग्नेटिक रेडिएशन (जे धातूंना त्यांची वैशिष्ट्यपूर्ण चमक देते) स्पेक्युलरपणे परावर्तित करण्याची क्षमता देते.
काही धातू
- फुफ्फुसे:
- इतर:
धातू अर्ज
बांधकामाचे सामान
साधन साहित्य
धातूंबद्दलच्या कल्पनांच्या विकासाचा इतिहास
माणसाचा धातूंशी परिचय सुरू झाला सोने , चांदीआणि तांबे, म्हणजे, पृथ्वीच्या पृष्ठभागावर मुक्त स्थितीत सापडलेल्या धातूंपासून; त्यानंतर ते धातूंनी जोडले गेले जे निसर्गात मोठ्या प्रमाणात वितरीत केले जातात आणि त्यांच्या संयुगांपासून सहजपणे वेगळे केले जातात: कथील , आघाडी , लोखंडआणि . हे सात धातू प्राचीन काळी मानवजातीला परिचित होते. प्राचीन इजिप्शियन कलाकृतींमध्ये सोने आणि तांब्याच्या वस्तू आहेत, ज्या काही डेटानुसार, सध्याच्या युगापासून काढलेल्या 3000-4000 वर्षांच्या काळातील आहेत. e
सात ज्ञात धातू आधीच फक्त आत आहेत मध्यम युगवाढले जस्त , बिस्मथ , सुरमाआणि 18 व्या शतकाच्या सुरूवातीस आर्सेनिक. 18 व्या शतकाच्या मध्यापासून, शोधलेल्या धातूंची संख्या वेगाने वाढली आणि 20 व्या शतकाच्या सुरूवातीस ते 65 पर्यंत पोहोचले, आणि 21 व्या शतकाच्या सुरूवातीस - 96 पर्यंत.
कोणत्याही रासायनिक उद्योगाने रासायनिक ज्ञानाच्या विकासात जेवढे योगदान दिले तेवढे योगदान धातूंचे उत्पादन आणि प्रक्रिया यांच्याशी संबंधित आहे; रसायनशास्त्राच्या इतिहासातील सर्वात महत्त्वाचे क्षण त्यांच्या इतिहासाशी जोडलेले आहेत. धातूंचे गुणधर्म इतके वैशिष्ट्यपूर्ण आहेत की अगदी सुरुवातीच्या काळात सोने, चांदी, तांबे, शिसे, कथील, लोखंड आणि पारा हे एकसंध पदार्थांचे एक नैसर्गिक गट बनले होते आणि "धातू" ही संकल्पना सर्वात प्राचीन रासायनिक संकल्पनांना सूचित करते. तथापि, त्यांच्या स्वभावाबद्दलची मते कमी-अधिक आहेत एक विशिष्ट फॉर्मफक्त मध्ययुगात दिसतात अल्केमिस्ट. सत्य, कल्पना ऍरिस्टॉटलनिसर्गाविषयी: चार घटकांपासून (अग्नी, पृथ्वी, पाणी आणि हवा) अस्तित्वात असलेल्या प्रत्येक गोष्टीची निर्मिती ज्यामुळे आधीच धातूची जटिलता दर्शविली जाते; पण या कल्पना खूप अस्पष्ट आणि अमूर्त होत्या. किमयाशास्त्रज्ञांसाठी, धातूंच्या जटिलतेची संकल्पना आणि त्याचा परिणाम म्हणून, काही धातूंचे इतरांमध्ये रूपांतर करण्याच्या क्षमतेवर विश्वास, त्यांना कृत्रिमरित्या तयार करणे, ही त्यांच्या विश्वदृष्टीची मुख्य संकल्पना आहे. ही संकल्पना त्यावेळेस जमा झालेल्या धातूंच्या रासायनिक परिवर्तनांशी संबंधित वस्तुस्थितीच्या वस्तुमानातून एक नैसर्गिक निष्कर्ष आहे. वस्तुतः, हवेतील साध्या कॅल्सीनेशनद्वारे आणि ऑक्साईडमधून धातूचे परत येणे, काही धातू इतरांपासून वेगळे करणे, मूळतः घेतलेल्या धातूंपेक्षा भिन्न गुणधर्म असलेल्या मिश्रधातूंची निर्मिती याद्वारे धातूचे त्यांच्यापेक्षा पूर्णपणे भिन्न ऑक्साईडमध्ये रूपांतर होते. , आणि असेच - हे सर्व त्यांच्या स्वभावाची जटिलता दर्शवण्यासाठी होते.
धातूंचे सोन्यामध्ये प्रत्यक्ष रूपांतर होण्याच्या बाबतीत, या शक्यतेवरचा विश्वास अनेक दृश्यमान तथ्यांवर आधारित होता. सुरुवातीला, सोन्यासारख्या रंगाच्या मिश्रधातूंची निर्मिती, उदाहरणार्थ तांबे आणि जस्तपासून, किमयाशास्त्रज्ञांच्या दृष्टीने त्यांचे सोन्यात रूपांतर आधीच झाले होते. त्यांना असे वाटले की फक्त रंग बदलणे आवश्यक आहे आणि धातूचे गुणधर्म देखील भिन्न होतील. विशेषतः, खराबपणे चालवलेले प्रयोग, जेव्हा या सोन्याचे मिश्रण असलेले पदार्थ बेस मेटलचे सोन्यात रूपांतर करण्यासाठी वापरले गेले, तेव्हा या विश्वासाला मोठा हातभार लागला. उदाहरणार्थ, 18 व्या शतकाच्या शेवटी, कोपनहेगनच्या एका फार्मासिस्टने खात्री दिली की रासायनिक शुद्ध चांदी, आर्सेनिकसह मिश्रित झाल्यावर, अंशतः सोन्यात बदलते. प्रसिद्ध रसायनशास्त्रज्ञाने या वस्तुस्थितीची पुष्टी केली गिटोन डी मॉर्व्यूआणि खूप आवाज केला. प्रयोगासाठी वापरण्यात आलेल्या आर्सेनिकमध्ये चांदी आणि सोन्याचे अंश असल्याचे लवकरच दिसून आले.
त्या वेळी ज्ञात असलेल्या सात धातूंपैकी काही रासायनिक रूपांतरे करणे सोपे होते, तर इतर अधिक कठीण, किमयाशास्त्रज्ञांनी त्यांना उदात्त - परिपूर्ण आणि अज्ञानी - अपूर्ण असे विभागले. पूर्वीचे सोने आणि चांदी, नंतरचे तांबे, कथील, शिसे, लोखंड आणि पारा यांचा समावेश होता. नंतरचे, उदात्त धातूंचे गुणधर्म असलेले, परंतु त्याच वेळी त्याच्या द्रव स्थितीत आणि अस्थिरतेमध्ये सर्व धातूंपेक्षा झपाट्याने भिन्न, त्या काळातील शास्त्रज्ञांसाठी अत्यंत मनोरंजक होते आणि काहींनी ते एका विशेष गटात वेगळे केले; त्याकडे आकर्षित केलेले लक्ष इतके मोठे होते की ज्या घटकांपासून धातू स्वतः तयार होतात त्या घटकांमध्ये पाराचा विचार केला जाऊ लागला आणि तो धातू गुणधर्मांचा वाहक म्हणून पाहिला गेला. काही धातूंच्या संक्रमणाचे निसर्गातील अस्तित्व स्वीकारून, अपूर्ण ते परिपूर्ण, किमयाशास्त्रज्ञांनी असे गृहीत धरले की सामान्य परिस्थितीत हे परिवर्तन अत्यंत संथ गतीने, शतकानुशतके, आणि कदाचित, स्वर्गीय पिंडांच्या रहस्यमय सहभागाशिवाय होत नाही, ज्यामध्ये अशा त्या वेळी आणि माणसाच्या नशिबात मोठी भूमिका दिली गेली. योगायोगाने, त्या वेळी सात ज्ञात धातू, तसेच सात ज्ञात ग्रह होते आणि यामुळे त्यांच्यातील एक रहस्यमय संबंध सूचित झाला. किमयाशास्त्रज्ञांमध्ये, धातूंना अनेकदा ग्रह म्हणतात; त्याला सोने म्हणतात रवि, चांदी - चंद्र, तांबे - शुक्र, कथील - बृहस्पति, आघाडी - शनि, लोह - मंगळआणि पारा - बुध. जेव्हा झिंक, बिस्मथ, अँटीमनी आणि आर्सेनिक सापडले, तेव्हा शरीरे सर्व बाबतीत धातूंशी सारखीच होती, परंतु ज्यामध्ये धातूच्या सर्वात वैशिष्ट्यपूर्ण गुणधर्मांपैकी एक, लवचिकता, खराब विकसित झाली होती, त्यांना एका विशेष गटात वाटप केले गेले - अर्धधातू. 18 व्या शतकाच्या मध्यात धातूंचे योग्य आणि अर्धधातूंमध्ये धातूंचे विभाजन अस्तित्वात होते.
धातूच्या रचनेचे निर्धारण सुरुवातीला पूर्णपणे अनुमानात्मक होते. सुरुवातीला, किमयाशास्त्रज्ञांनी स्वीकारले की ते दोन घटकांपासून तयार झाले आहेत - आणि सल्फर. या दृश्याचे मूळ अज्ञात आहे; ते 8 व्या शतकात आधीपासूनच अस्तित्वात आहे. द्वारे गेबरधातूंमध्ये पाराच्या उपस्थितीचा पुरावा हा आहे की ते त्यांना विरघळते आणि या द्रावणांमध्ये त्यांचे व्यक्तिमत्व नाहीसे होते, पाराद्वारे शोषले जाते, जे त्यांच्यात पारासह एक समान तत्त्व नसल्यास असे होणार नाही. याव्यतिरिक्त, पारा आणि शिसे टिनसारखे काहीतरी तयार करतात. सल्फरसाठी म्हणून, कदाचित ते घेतले गेले कारण सल्फर संयुगे ज्ञात होते, त्यानुसार देखावा धातू सारखे. भविष्यात, या साध्या कल्पना, कदाचित कृत्रिमरित्या धातू मिळविण्याच्या अयशस्वी प्रयत्नांमुळे, अत्यंत क्लिष्ट आणि गोंधळात टाकल्या जातात. किमयाशास्त्रज्ञांच्या संकल्पनांमध्ये, उदाहरणार्थ, X-XIII शतके, पारा आणि सल्फर ज्यापासून धातू तयार झाले होते तेच पारा आणि गंधक किमयाशास्त्रज्ञांच्या हातात नव्हते. हे त्यांच्यासारखेच काहीतरी होते, विशेष गुणधर्म असलेले; सामान्य सल्फर आणि पारामध्ये अस्तित्त्वात असलेले काहीतरी त्यांच्यामध्ये इतर शरीरांपेक्षा जास्त प्रमाणात व्यक्त होते. पारा अंतर्गत, जो धातूंचा एक भाग आहे, त्यांनी काहीतरी प्रतिनिधित्व केले जे त्यांची अपरिवर्तनीयता, धातूची चमक, लवचिकता, एका शब्दात, धातूचे स्वरूप वाहक ठरवते; सल्फरचा अर्थ धातूंच्या परिवर्तनशीलता, विघटन आणि ज्वलनशीलतेचा वाहक होता. ही दोन मूलद्रव्ये धातूंमध्ये वेगवेगळ्या प्रमाणात आढळून आली आणि त्यांनी म्हटल्याप्रमाणे, वेगवेगळ्या प्रकारे निश्चित केले गेले; याव्यतिरिक्त, ते वेगवेगळ्या प्रमाणात शुद्धतेचे असू शकतात. गेबरच्या मते, उदाहरणार्थ, सोन्यामध्ये मोठ्या प्रमाणात पारा आणि थोड्या प्रमाणात सल्फर, उच्च शुद्धता आणि सर्वात स्थिर; कथील मध्ये, त्याउलट, त्यांनी भरपूर गंधक आणि थोडे पारा गृहीत धरले, जे शुद्ध नव्हते, खराब स्थिर इ. या सर्वांसह, अर्थातच, त्यांना त्यावेळच्या एकमेव शक्तिशाली रासायनिक एजंट - अग्नीकडे धातूची भिन्न वृत्ती व्यक्त करायची होती. या मतांच्या पुढील विकासासह, दोन घटक - पारा आणि गंधक - धातूंची रचना स्पष्ट करण्यासाठी रसायनशास्त्रज्ञांना अपुरी वाटली; त्यात मीठ आणि काही आर्सेनिक जोडले गेले. याद्वारे त्यांना हे सूचित करायचे होते की धातूंच्या सर्व परिवर्तनांदरम्यान, काहीतरी अस्थिर आणि कायमस्वरूपी राहते. जर निसर्गात "मूळ धातूंचे उदात्त धातूंमध्ये रूपांतर होण्यास शतके लागतात," तर किमयाशास्त्रज्ञांनी अशी परिस्थिती निर्माण करण्याचा प्रयत्न केला ज्यामध्ये सुधारणा आणि परिपक्वताची ही प्रक्रिया जलद आणि सहजतेने पुढे जाईल. त्या काळातील औषध आणि जीवशास्त्र यांच्या रसायनशास्त्राच्या जवळच्या संबंधामुळे, धातूंच्या परिवर्तनाची कल्पना नैसर्गिकरित्या संघटित शरीरांच्या वाढ आणि विकासाच्या कल्पनेने ओळखली गेली: संक्रमण, साठी उदाहरणार्थ, सोन्यामध्ये शिशाचे, जमिनीत टाकलेल्या धान्यापासून वनस्पती तयार करणे आणि जसे की ते कुजणे, आंबणे, एखाद्या व्यक्तीमध्ये रोगग्रस्त अवयव बरे करणे - या सर्व एका सामान्य रहस्यमय जीवन प्रक्रियेच्या खाजगी घटना होत्या, सुधारणा. , आणि त्याच उत्तेजनामुळे होते. येथून हे स्पष्ट होते की रहस्यमय तत्त्व, ज्यामुळे सोने मिळवणे शक्य होते, रोग बरे करणे, वृद्ध मानवी शरीराचे तरुण शरीरात रूपांतर करणे इ. अद्भूत तत्वज्ञानी दगडाची संकल्पना यातूनच निर्माण झाली.
भूमिकेबाबत तत्वज्ञानी दगडमूळ धातूंचे उदात्त धातूंमध्ये रूपांतर करताना, त्यानंतर बहुतेक सर्व त्यांच्या सोन्यामध्ये रूपांतर करण्याच्या सूचना आहेत; चांदीच्या उत्पादनाबद्दल थोडेसे सांगितले जाते. काही लेखकांच्या मते, त्याच तत्वज्ञानी दगड धातूंचे रूपांतर चांदी आणि सोन्यामध्ये करतात; इतरांच्या मते, या पदार्थाचे दोन प्रकार आहेत: एक परिपूर्ण, दुसरा कमी परिपूर्ण आणि तो नंतरचा आहे जो चांदीची निर्मिती करतो. परिवर्तनासाठी आवश्यक असलेल्या तत्त्वज्ञानाच्या दगडाच्या प्रमाणाबाबत, सूचना देखील भिन्न आहेत. काहींच्या मते, त्यातील 1 भाग धातूचे 10,000,000 भाग सोन्यात बदलण्यास सक्षम आहे, इतरांच्या मते - 100 भाग आणि अगदी फक्त 2 भाग. सोने मिळविण्यासाठी, त्यांनी काही बेस मेटल वितळले किंवा पारा घेतला आणि तत्वज्ञानी दगड तेथे फेकून दिला; काहींनी आश्वासन दिले की परिवर्तन त्वरित होते, तर काहींनी - हळूहळू. धातूंचे स्वरूप आणि त्यांची परिवर्तन करण्याची क्षमता याविषयीची ही मते साधारणपणे 17 व्या शतकापर्यंत अनेक शतके ठेवली गेली, जेव्हा त्यांनी हे सर्व तीव्रपणे नाकारण्यास सुरुवात केली, विशेषत: या मतांमुळे अनेक चार्लॅटन्सचा उदय झाला ज्यांनी त्यांच्या आशेचे शोषण केले. सोने मिळविण्यासाठी योग्य. मी विशेषतः अल्केमिस्टच्या कल्पनांशी संघर्ष केला बॉयल“मला जाणून घ्यायचे आहे,” तो एका ठिकाणी म्हणतो, “सोन्याचे पारा, गंधक आणि मीठ कसे मोडले जाऊ शकते; या अनुभवाची किंमत मी भरायला तयार आहे; माझ्यासाठी, मी हे कधीच साध्य करू शकत नाही.”
शतकानुशतके कृत्रिमरित्या धातू मिळविण्याच्या निष्फळ प्रयत्नांनंतर आणि 17 व्या शतकापर्यंत जमा झालेल्या वस्तुस्थितीसह, उदाहरणार्थ, ज्वलनातील हवेच्या भूमिकेबद्दल, ऑक्सिडेशन दरम्यान धातूचे वजन वाढणे, जे अजूनही होते. ज्ञात गेबर 8 व्या शतकात, धातूच्या मूलभूत रचनेचा प्रश्न संपण्याच्या अगदी जवळ असल्याचे दिसत होते; परंतु रसायनशास्त्रात एक नवीन प्रवृत्ती दिसून आली, ज्याचा परिणाम म्हणजे फ्लोगिस्टन सिद्धांत आणि या समस्येचे निराकरण बराच काळ लांबले.
त्या काळातील शास्त्रज्ञांना ज्वलनाच्या घटनेत खूप रस होता. त्या काळातील तत्त्वज्ञानाच्या मूलभूत कल्पनेवर आधारित, शरीराच्या गुणधर्मांमधील समानता त्यांच्या रचनेत समाविष्ट असलेल्या तत्त्वे आणि घटकांच्या समानतेतून आली पाहिजे, हे मान्य केले गेले की ज्वलनशील शरीरांमध्ये एक समान घटक असतो. ज्वलनाची क्रिया घटकांमध्ये विघटन, विघटन ही क्रिया मानली जात होती; या प्रकरणात, ज्वलनशीलता घटक ज्वालाच्या रूपात सोडला गेला, तर इतर राहिले. पारा, गंधक आणि मीठ या तीन घटकांपासून धातूंच्या निर्मितीबद्दलचा किमयाशास्त्रज्ञांचा दृष्टिकोन ओळखून आणि धातूमध्ये त्यांचे खरे अस्तित्व मान्य करून, सल्फर हे त्यातील ज्वलनशील तत्त्व म्हणून ओळखावे लागले. मग धातूचा आणखी एक घटक स्पष्टपणे धातूच्या कॅल्सिनेशनचे अवशेष म्हणून ओळखले जाणे आवश्यक होते - “पृथ्वी”, त्यांनी तेव्हा म्हटल्याप्रमाणे; त्यामुळे पाराचा त्याच्याशी काहीही संबंध नाही. दुसरीकडे, सल्फर आत जळते गंधकयुक्त आम्ल, ज्याला वरील कारणांमुळे, अनेकांनी सल्फरपेक्षा सोपे शरीर मानले आणि ते प्राथमिक शरीरांमध्ये समाविष्ट केले. गोंधळ आणि विरोधाभास होता. बेचर, जुन्या संकल्पनांना नवीन कल्पनांशी सुसंगत करण्यासाठी, धातूमध्ये तीन प्रकारच्या पृथ्वीचे अस्तित्व स्वीकारले: “पृथ्वी” स्वतः, “ज्वलनशील पृथ्वी” आणि “पारा पृथ्वी”. या परिस्थितीत स्टॅहलत्याचा सिद्धांत मांडला. त्याच्या मते, ज्वलनशीलतेचा स्त्रोत सल्फर किंवा इतर ज्ञात पदार्थ नसून काहीतरी अज्ञात आहे, ज्याला त्याने म्हटले आहे. phlogiston. फ्लोगिस्टन आणि पृथ्वीपासून धातू तयार होतात; हवेतील धातूचे कॅलसिनेशन फ्लोगिस्टनच्या प्रकाशनासह होते; कोळशाच्या साहाय्याने त्याच्या पृथ्वीवरील धातूंचे पुनरागमन - फ्लोगिस्टनमध्ये समृद्ध पदार्थ - फ्लोगिस्टनला पृथ्वीशी जोडण्याची क्रिया आहे. जरी तेथे अनेक धातू होते आणि प्रज्वलित झाल्यावर त्यातील प्रत्येकाने स्वतःची पृथ्वी दिली, परंतु नंतरचे, एक घटक म्हणून, एक होते, ज्यामुळे धातूचा हा घटक फ्लोगिस्टन सारखाच काल्पनिक स्वरूपाचा होता; तथापि, स्टॅहलच्या अनुयायांनी कधीकधी धातूंइतकेच "प्राथमिक पृथ्वी" स्वीकारले. कधी कॅव्हेंडिशप्राप्त झालेल्या ऍसिडमध्ये धातू विरघळताना हायड्रोजनआणि त्याचे गुणधर्म तपासले (ज्वलनास समर्थन देण्यास असमर्थता, हवेत मिसळल्यावर त्याची स्फोटकता इ.), त्याने ते स्टॅलचे फ्लोगिस्टन म्हणून ओळखले; धातू, त्याच्या संकल्पनेनुसार, हायड्रोजन आणि "पृथ्वी" असतात. हे मत फ्लोगिस्टन सिद्धांताच्या अनेक अनुयायांनी स्वीकारले.
फ्लोगिस्टन सिद्धांताची स्पष्ट सुसंवाद असूनही, त्याच्याशी जोडले जाऊ शकत नाही अशी प्रमुख तथ्ये होती. गेबरला हे देखील माहित होते की गोळीबार केल्यावर धातूंचे वजन वाढते; दरम्यान, स्टॅहलच्या म्हणण्यानुसार, त्यांनी फ्लोगिस्टन गमावले पाहिजे: जेव्हा फ्लोगिस्टन पुन्हा "पृथ्वीवर" जोडला जातो तेव्हा परिणामी धातूचे वजन "पृथ्वीच्या" वजनापेक्षा कमी असते. अशा प्रकारे, हे निष्पन्न झाले की फ्लोगिस्टनमध्ये काही विशेष गुणधर्म असणे आवश्यक आहे - नकारात्मक गुरुत्व. या घटनेचे स्पष्टीकरण देण्यासाठी सर्व कल्पक गृहितके मांडली गेली असली तरी ती अनाकलनीय आणि गोंधळात टाकणारी होती.
कधी Lavoisierज्वलनाच्या वेळी हवेची भूमिका स्पष्ट केली आणि दर्शविले की गोळीबाराच्या वेळी धातूंच्या वजनात वाढ हा हवेतून धातूंमध्ये ऑक्सिजनच्या जोडणीमुळे होतो आणि अशा प्रकारे हे सिद्ध केले की धातू जाळण्याची क्रिया घटकांमध्ये विघटन होत नाही, परंतु, त्याउलट, कनेक्शनची एक कृती, धातूंच्या जटिलतेबद्दलच्या प्रश्नावर नकारात्मक निर्णय घेण्यात आला. साध्या शरीरे म्हणजे ज्यापासून इतर शरीरे वेगळे करणे शक्य नव्हते या लव्हॉइसियरच्या मूलभूत कल्पनेमुळे धातूंचे वर्गीकरण साधे रासायनिक घटक म्हणून केले गेले. निर्मितीसह रासायनिक घटकांची नियतकालिक सारणी मेंडेलीव्हधातू घटकांनी त्यामध्ये त्यांचे योग्य स्थान घेतले.
देखील पहा
नोट्स
दुवे
- एस. पी. वुकोलोव्ह: // ब्रोकहॉस आणि एफ्रॉनचा विश्वकोशीय शब्दकोश: 86 खंडांमध्ये (82 खंड आणि 4 अतिरिक्त). - सेंट पीटर्सबर्ग. , 1890-1907.(ऐतिहासिक भाग)
| आवर्तसारणी | |
|---|---|
| दिमित्री इव्हानोविच मेंडेलीव्ह · नियतकालिक कायदा · घटकांचे गट | |
| स्वरूप | लहानब्लॉकद्वारे · विस्तारित· वाढवलेला · इलेक्ट्रॉनिक कॉन्फिगरेशन · विद्युत ऋणात्मकता · पर्यायी · घटकांचे समस्थानिक |
| घटकांच्या याद्याद्वारे | नाव ·
व्युत्पत्ती(स्थळांच्या सन्मानार्थ, शोधकांच्या सन्मानार्थ) · उघडण्याची वेळ ऑक्सिडेशन अवस्था · व्यापकता (माणसामध्ये) समस्थानिक स्थिरता |


