27.07.2019
1 अल्कली धातू. तुम्हाला कसे माहीत आहे
विषयावरील 9व्या वर्गातील रसायनशास्त्राच्या धड्याचा सारांश:
« जोडण्या अल्कली धातूआणि त्यांचा अर्ज."
गोल: अल्कली धातू आणि त्यांच्या संयुगांबद्दलचे ज्ञान सारांशित आणि व्यवस्थित करा; दैनंदिन जीवनात आणि उत्पादनात या संयुगांचा वापर, जीवांच्या जीवनात त्यांचे महत्त्व जाणून घ्या
धड्याची उद्दिष्टे:
1. धड्यादरम्यान, अल्कली धातूच्या संयुगांचे रासायनिक गुणधर्म, दैनंदिन जीवनात आणि उत्पादनात त्यांचा वापर आणि जीवांच्या जीवनात त्यांचे महत्त्व याची खात्री करा.
रासायनिक अभिकर्मकांसह कार्य करण्यासाठी सामान्य शैक्षणिक कौशल्ये आणि कौशल्ये विकसित करणे सुरू ठेवा.
2. अल्कली धातूच्या अणूच्या संरचनेच्या घटनांमधील कारण-आणि-प्रभाव संबंधांच्या मूलभूत वैचारिक कल्पनांची निर्मिती - साध्या पदार्थाचे गुणधर्म - अल्कली धातूच्या संयुगांचे गुणधर्म आणि गुणधर्मांवर आधारित त्यांचा वापर.
3. तुलना करण्याची क्षमता विकसित करा, अभ्यासात असलेल्या तथ्यांचे सामान्यीकरण करा आणि उत्तर देताना तुमचे विचार तर्कशुद्धपणे व्यक्त करा. त्यांच्या सभोवतालच्या जीवनात अभ्यासल्या जाणाऱ्या घटनांच्या अनुप्रयोगावरील डेटा वापरून शाळकरी मुलांची संज्ञानात्मक आवड विकसित करणे.
धडा प्रकार: एकत्रित - ICT वापरून नवीन साहित्य शिकणे.
उपकरणे: पाठ्यपुस्तक, खडू, ब्लॅकबोर्ड, संगणक, मीडिया प्रोजेक्टर, स्क्रीन, धड्याच्या विषयाचे सादरीकरण, विद्यार्थ्यांसाठी पाठ तंत्रज्ञान कार्ड, रासायनिक अभिकर्मक (उत्तरणे: सोडियम हायड्रॉक्साईड, हायड्रोक्लोरिक ॲसिड, कॉपर सल्फेट, झिंक हायड्रॉक्साइड, फेनोल्फथालीन) आणि प्रयोगशाळेतील काचेच्या वस्तू (रॅक) चाचणी ट्यूबसह).
वर्ग दरम्यान
आय .वेळ आयोजित करणे.
II . नवीन साहित्य शिकणे.
1. “अल्कली मेटल” या विषयावर पूर्वी अभ्यासलेली सामग्री तपासणे.
कोड्यांचा अंदाज लावा:
1. ते सहसा रॉकेलमध्ये साठवले जातात, आणि ते पाण्यावर चालते,
निसर्गात, आतापासून लक्षात ठेवा,
तो कुठेही मोकळा नाही
लवणांमध्ये ते उघडणे शक्य आहे
त्यातून ज्योत पिवळी पडते
आणि आपण ते मीठ पासून मिळवू शकता
डेव्हीला ते कसे मिळाले.
आम्ही कोणत्या घटकाबद्दल बोलत आहोत? (ना)
2. तो जोरदारपणे दडपतो.
ओलावा पासून - शुद्ध हायड्रोजन,
द्वारे बदलले जाते
आणि ऑक्सिजन घट्ट बांधतो.
हा घटक वनस्पतींमध्ये लपलेला असतो
जांभळा रंग करून
हे क्षारांमध्ये खुले असू शकते.
आम्ही कोणत्या घटकाबद्दल बोलत आहोत? (TO).
1.गेल्या धड्यात आपल्याला कोणत्या धातूंची ओळख झाली?
2. त्यांना असे का म्हणतात?
3. सर्व अल्कली धातूंच्या अणूंच्या संरचनेत एक सामान्य वैशिष्ट्य काय आहे?
विषयावरील चाचणी: अल्कली धातू.
1. अल्कली धातूंना खालील गोष्टी लागू होत नाहीत: अ) रुबिडियम; c) पोटॅशियम; ब) सीझियम; ड) तांबे.
2.इलेक्ट्रॉनिक सूत्र) 2) 8) 8) 1 घटकाशी संबंधित आहे: अ) लिथियम; c) पोटॅशियम; ब) सोडियम;
3. वाढत्या आण्विक चार्जसह मुख्य उपसमूहाच्या गट I च्या घटकांसाठी अणु त्रिज्या:
अ) वेळोवेळी बदल; c) बदलत नाही; ब) वाढते;
4. अल्कली धातू खूप मजबूत असतात:
अ) ऑक्सिडायझिंग गुणधर्म; c) पुनर्संचयित गुणधर्म; b) amphoteric गुणधर्म;
5..अल्कली धातूंच्या भौतिक गुणधर्मांमध्ये हे समाविष्ट नाही:
अ) चांदी-पांढरा; ब) मऊ आणि हलका; ड) रीफ्रॅक्टरी.
6. मुख्य उपसमूहातील गट I चे घटक पाण्याशी संवाद साधतात तेव्हा खालील घटक तयार होतात:
अ) आम्ल; ब) अल्कली आणि हायड्रोजन सोडले जाते; ड) मीठ.
7. सोडियम आणि पोटॅशियम रॉकेलमध्ये साठवले जातात कारण ते:
अ) तीव्र गंध आहे; ब) हवेत सहजपणे ऑक्सिडाइझ केले जातात;
स्व-नियंत्रण: त्रुटी नाहीत – “5”, 1.2 त्रुटी – “4”, 3 त्रुटी – “3”, अधिक – “2”
उत्तरे: 1- d 2 - c 3 - b 4 - c 5 - d 6 - b 7 - b.
स्व-नियंत्रण: त्रुटी नाहीत – “5”, 1.2 त्रुटी – “4”, 3.4 त्रुटी – “3”, अधिक – “2”
2. ज्ञान अद्ययावत करणे.
निसर्गात मुक्त स्वरूपात अल्कली धातू शोधणे शक्य आहे का? का?
ते निसर्गात कोणत्या संयुगेच्या स्वरूपात आढळतात याचा अंदाज लावता येईल का?
निसर्गात, अल्कली धातू केवळ संयुगेच्या स्वरूपात आढळतात.
Na आणि K क्लोराईड्स, सल्फेट्स, सिलिकेट्स इत्यादी स्वरूपात निसर्गात आढळतात.
Li, Rb, Cs ही विविध खनिजे आढळतात.
Fr किरणोत्सर्गी धातू Ac आणि U मध्ये उद्भवते.
टेबलवर: अल्कली धातूची संयुगे असलेली वस्तू (सोडा, मीठ, एए बॅटरी, साबण) आणि प्रश्न विचारतो.
या वस्तू पहा. त्यांच्यात काय साम्य आहे असे तुम्हाला वाटते?
1 अनुवांशिक दुवा म्हणजे काय?
2. सोडियमची अनुवांशिक मालिका बनवू.
Na → Na 2 O → 2NaOH → Na 2 CO 3
3. संयुगांचे कोणते वर्ग अल्कली धातू बनवतात? चला त्यांच्या गुणधर्मांचा विचार करूया.
जसजसे विद्यार्थी सामग्रीचे स्पष्टीकरण देतात आणि स्लाइड्स पाहतात, ते प्लॅनसह नोट्स घेतात, गुणधर्म आणि अनुप्रयोग उघड करतात.
अल्कली मेटल ऑक्साईड्स
कडक, पांढरा, सहज विरघळणारा.
ब) रासायनिक गुणधर्म; विद्यार्थी त्यांच्या नोटबुकमध्ये लिहितात: अल्कली मेटल ऑक्साइड हे वैशिष्ट्यपूर्ण मूलभूत ऑक्साइड आहेत. सर्व मूलभूत ऑक्साईड्सप्रमाणे, अल्कली धातूचे ऑक्साईड पाण्यावर, अम्लीय ऑक्साईडसह, ऍसिडसह प्रतिक्रिया देतात.
मुले सोडियम ऑक्साईड वापरून रासायनिक अभिक्रियांची समीकरणे बोर्डवर आणि त्यांच्या नोटबुकमध्ये उदाहरण म्हणून लिहितात:
Na 2 O + H 2 O → 2NaOH;
Na 2 O + CO 2 → Na 2 CO 3 ;
Na 2 O + H 2 CO 3 → Na 2 CO 3 + H 2 O
अल्कली मेटल हायड्रॉक्साइड्स
.
अ) भौतिक गुणधर्म; विद्यार्थी त्यांच्या नोटबुकमध्ये खालील गुणधर्म लिहून ठेवतात: कठोर, पांढरा, अत्यंत विद्रव्य, उष्णता-प्रतिरोधक, कापड आणि कागद.
ब) रासायनिक गुणधर्म
सुरक्षा ब्रीफिंगप्रयोगशाळेचे काम करताना.
सोडियम हायड्रॉक्साईडचे रासायनिक गुणधर्म.
ध्येय: हायड्रॉक्साईडचे उदाहरण वापरून अल्कली धातूंचे रासायनिक गुणधर्म प्रायोगिकपणे सिद्ध करासोडियम
सूचना
सोडियम हायड्रॉक्साईड स्वच्छ चाचणी ट्यूबमध्ये घाला आणि फेनोल्फथालीनचे काही थेंब घाला. तुम्ही काय निरीक्षण करत आहात?
त्याच टेस्ट ट्यूबमध्ये द्रावण जोडा हायड्रोक्लोरिक ऍसिडचे. तुम्ही काय निरीक्षण करत आहात? प्रतिक्रिया समीकरण लिहा.
NaOH + HCl → NaCl + H 2 O मुले फलकावर आणि त्यांच्या वहीत आयनिक स्वरूपात रासायनिक अभिक्रियाची समीकरणे लिहितात.
सोडियम हायड्रॉक्साईड स्वच्छ चाचणी ट्यूबमध्ये घाला आणि कॉपर सल्फेटचे द्रावण घाला. तुम्ही काय निरीक्षण करत आहात? प्रतिक्रिया समीकरण लिहा.
2NaOH + CuSO 4 → Na 2 SO 4 + Cu (OH) 2 मुले फलकावर आणि त्यांच्या वहीत आयनिक स्वरूपात रासायनिक अभिक्रियाची समीकरणे लिहितात.
अल्कली मेटल हायड्रॉक्साईड्सच्या रासायनिक गुणधर्मांबद्दल निष्कर्ष काढा.
अल्कली मेटल हायड्रॉक्साईड्स ऍसिड, क्षारांसह प्रतिक्रिया देतात) अर्ज - स्लाइड क्रमांक 5.
सोडियम हायड्रॉक्साइड - NaOH - कॉस्टिक सोडा, कॉस्टिक सोडा, कॉस्टिक सोडा.
पोटॅशियम हायड्रॉक्साईड - KOH - कॉस्टिक पोटॅश.
NaOHआणि KOH हे कॉस्टिक अल्कली आहेत जे कापड आणि कागद खराब करतात. विद्यार्थी लिहा:अर्ज: कृत्रिम रेशीम उत्पादनासाठी , व्ही साबण आणि एसएमएस, सौंदर्य प्रसाधने, औषधे इ.
अल्कली धातूचे क्षार
.
भौतिक गुणधर्म
. विद्यार्थी त्यांच्या वहीत गुणधर्म लिहितात. क्रिस्टलीय घन पदार्थ, जवळजवळ सर्व पाण्यात विरघळणारे.
पाठ्यपुस्तकांच्या मजकुरासह स्वतंत्र कार्य.
अर्ज: स्लाइड क्रमांक 5 वरून टेबल भरणे. पाठ्यपुस्तक pp. 56 – 57 वरून कार्य करा
मीठ सूत्र
नाव
अर्ज
NaHCO3
K2CO3
NaCl
Na 2 SO 4 ∙ 10 H 2 O
Na 2 CO 3 ∙ 10 H 2 O
जीवांच्या जीवनातील क्रियाकलापांचे महत्त्व - स्लाइड क्रमांक 6.
या विषयावरील विद्यार्थ्यांचा संदेश: "जीवांच्या जीवनात अल्कली धातूच्या संयुगांचे महत्त्व."
सोडियम आणि पोटॅशियम आयन महत्वाची जैविक भूमिका बजावतात: Na + हा मुख्य बाह्य पेशी आयन आहे, जो रक्त आणि लिम्फमध्ये आढळतो आणि K + हा मुख्य इंट्रासेल्युलर आयन आहे. "एकत्र काम करा. या आयनांच्या एकाग्रतेचे प्रमाण सजीवामध्ये रक्तदाब नियंत्रित करते आणि झाडांच्या मुळांपासून पानांपर्यंत मीठ द्रावणाची हालचाल सुनिश्चित करते. पोटॅशियम आयन - हृदयाच्या स्नायूंच्या कार्यास समर्थन देतात, संधिवात होण्यास मदत करतात आणि आतड्यांसंबंधी कार्य सुधारतात. पोटॅशियम संयुगे - सूज दूर करते.
व्ही. एकत्रीकरण
सहावा. धडा सारांश. गुण तयार करणे.
धड्याचा सारांश:
अल्कली धातूंच्या ऑक्साईड्स आणि हायड्रॉक्साइड्सचे कोणते भौतिक आणि रासायनिक गुणधर्म वैशिष्ट्यपूर्ण आहेत?
अल्कली धातूचे हायड्रॉक्साइड आणि क्षार कुठे वापरले जातात?
अतिरिक्त साहित्य. हे मनोरंजक आहे.
कार्य: का मध्ये प्राचीन ग्रीसउष्ण हवामानात लांबच्या मोहिमेपूर्वी, सैनिकांना भाकरीचा तुकडा खाण्याची, जास्त प्रमाणात मीठ घालून पाणी पिण्याची शिफारस करण्यात आली होती का?
इलेक्ट्रोलाइट आयन सहजपणे हायड्रेट करतात, त्यामुळे टेबल मीठ शरीरात पाणी टिकवून ठेवते.
समस्या: एस्किमो खूप कमी मीठ का खातात?
एका वैज्ञानिक सिद्धांतानुसार, मानवासह पृथ्वीवर राहणारे सर्व प्राणी हे समुद्रात दिसलेल्या आणि राहणाऱ्या जीवांचे वंशज आहेत. या प्राण्यांच्या शरीरातील द्रवपदार्थ समुद्राचे पाणी होते. जमिनीवर गेल्यानंतर त्यांनी समुद्राचे पाणी शरीरातील द्रवपदार्थ म्हणून ठेवले. परंतु निसर्ग सजीवांना त्याच्या नैसर्गिक स्वरूपात पुरेसे मीठ प्रदान करण्यास सक्षम नाही. मीठ पाण्यात विरघळत असल्याने, त्याचा बराचसा भाग पावसाच्या पाण्याने नद्या, समुद्र आणि महासागरांमध्ये वाहून जातो. परिणामी, जमिनीवर वाढणाऱ्या वनस्पतींमध्ये पुरेसे मीठ नसते. त्यामुळे वनस्पती खाणाऱ्या प्राण्यांना मीठ लागते. शरीर दररोज मीठ असलेले ठराविक प्रमाणात द्रव गमावते आणि वनस्पतींचे अन्न ते भरून काढत नाही. जे प्राणी इतर प्राण्यांना खातात त्यांना अतिरिक्त मीठ आवश्यक नसते. त्यांना आवश्यक असलेले मीठ ते त्यांच्या पीडितांच्या शरीरातून मिळवतात. एस्किमो प्रामुख्याने मांस खातात, म्हणून त्यांची मिठाची गरज फारच कमी असते.
उद्दिष्ट: इंग्लंडमध्ये अलिकडच्या दशकात सेरेब्रोव्हस्कुलर रोगांमुळे मृत्यूचे प्रमाण का कमी झाले आहे?
हे ताजी फळे आणि भाज्यांच्या वाढत्या वापरामुळे होते. ताज्या भाज्या आणि फळांमध्ये नेहमी पोटॅशियम जास्त आणि सोडियम कमी असते. सोडियम शरीरात पाणी टिकवून ठेवते, वाढते धमनी दाब, आणि पोटॅशियम, उलटपक्षी, ते कमी करण्यास मदत करते. म्हणूनच सेरेब्रोव्हस्कुलर रोग टाळण्यासाठी भाज्या आणि फळांचा वापर वाढवणे, विशेषतः सफरचंद, हे एक आवश्यक उपाय मानले जाऊ शकते.
लोकांचे मिठाचे प्रेम कोठून येते? .
मीठ अन्न खराब होण्यापासून आणि सडण्यापासून वाचवते. अन्न जपण्यासाठी (जेव्हा रेफ्रिजरेटर आणि फ्रीजर नव्हते तेव्हा), मीठ वापरले जात असे. समुद्रातील भाज्या चाखल्यानंतर, लोक ताज्या भाज्या लोणचे, आंबायला आणि भिजवू लागले. एखाद्या व्यक्तीला सर्व काही खारट करण्याची सवय असते की तो काही आजारांना तोंड देण्यास तयार असतो, फक्त मीठ-मुक्त आहाराकडे वळू नये. हळुहळू मला सर्व प्रकारचे अन्न न वापरता मीठ घालण्याची सवय लागली.
भरपूर मीठ - थोडे पोटॅशियम, थोडे पोटॅशियम - भरपूर रोग
मिठाचा प्रश्न पोटॅशियम-सोडियम संतुलनाचा प्रश्न आहे. शरीरात ते अत्यंत महत्वाचे आहे. पोटॅशियम आणि सोडियम पेशींमध्ये त्यांच्या उपस्थितीसाठी सतत स्पर्धा करतात. टेबल सॉल्टमध्ये पोटॅशियम नसते, ते पूर्णपणे सोडियम असते. आपल्या शरीराला पोटॅशियमची तातडीने गरज असते, जे सोडियमपेक्षा 4 पट जास्त असावे. शरीर सर्वत्र पोटॅशियम गोळा करते, परंतु टेबल सॉल्टचा जास्त वापर केल्याने त्याचे सर्व प्रयत्न निष्फळ होतात. म्हणून, जास्त मीठ वापरल्याने, पोटॅशियमची कमतरता उद्भवते, ज्यामुळे कालांतराने अनेक आजार होतात: शारीरिक आणि मानसिक थकवा, खराब झोप, पेटके, सांधेदुखी.
जास्त सोडियम (मीठ) हृदयावर ओव्हरलोड करते. तुम्ही जास्त मीठ खात आहात का हे जाणून घ्यायचे आहे का? आरशात जा: डोळ्याच्या बुबुळाभोवती एक पांढरे वर्तुळ जास्त प्रमाणात मिठाचे सेवन दर्शवते.
कॉस्टिक पोटॅशियम
कॉस्टिक पोटॅशियमचा वापर खते, सिंथेटिक रबर, बॅटरीसाठी इलेक्ट्रोलाइट्स, अभिकर्मकांच्या उत्पादनासाठी केला जातो आणि औषध उद्योग आणि राष्ट्रीय अर्थव्यवस्थेच्या इतर क्षेत्रांमध्ये वापरला जातो.
या प्रकारच्या वाहतुकीसाठी लागू असलेल्या मालाच्या वाहतुकीच्या नियमांनुसार कॉस्टिक पोटॅशियमची वाहतूक रेल्वे आणि रस्त्याने केली जाते.
कॉस्टिक पोटॅशियम हर्मेटिकली सीलबंद कंटेनरमध्ये साठवले जाते, कारण ते हवेत “पसरते”, त्यातून ओलावा शोषून घेते.
त्याचे पारंपारिक नाव "कॉस्टिक पोटॅशियम" जिवंत ऊतींवर या पदार्थाचा संक्षारक प्रभाव प्रतिबिंबित करते. कॉस्टिक पोटॅशियम त्वचेच्या संपर्कात आल्यास, रासायनिक बर्न शक्य आहे.
कॉस्टिक पोटॅशियमसह तेल आणि चरबी सॅपोनिफायिंग करून मऊ साबण मिळवले जातात. या सर्व साबणांमध्ये मऊ, मलईदार सुसंगतता असते.
सोडियम हायड्रॉक्साइड.
सर्वात सामान्य अल्कली. जगात दरवर्षी 57 दशलक्ष टन पेक्षा जास्त कॉस्टिक अल्कली तयार केली जाते आणि वापरली जाते.
कॉस्टिक सोडा विविध प्रकारच्या उद्योगांमध्ये आणि घरगुती गरजांसाठी वापरला जातो:
लगदा आणि कागद उद्योगात कागद, पुठ्ठा, कृत्रिम तंतू, लाकूड-फायबर बोर्ड उत्पादनात.
साबण, शैम्पू आणि इतर डिटर्जंट्सच्या उत्पादनात चरबीच्या सॅपोनिफिकेशनसाठी.
रासायनिक उद्योगांमध्ये - अभिकर्मक किंवा उत्प्रेरक म्हणून ऍसिड आणि ऍसिड ऑक्साईड्सचे तटस्थ करणे रासायनिक प्रतिक्रियाआणि इ.
कॉस्टिक सोडा (सोडियम हायड्रॉक्साइड) हा एक कास्टिक आणि संक्षारक पदार्थ आहे. हे 2 रा धोका वर्गातील पदार्थांचे आहे. म्हणून, त्याच्याबरोबर काम करताना काळजी घेणे आवश्यक आहे.
त्वचा, श्लेष्मल त्वचा आणि डोळे यांच्याशी संपर्क झाल्यास गंभीर रासायनिक बर्न्स तयार होतात. जर श्लेष्मल पृष्ठभाग कॉस्टिक अल्कलीच्या संपर्कात आले तर प्रभावित क्षेत्र पाण्याच्या प्रवाहाने आणि त्वचेच्या संपर्कात आल्यास एसिटिक ऍसिडच्या कमकुवत द्रावणाने स्वच्छ धुवावे लागेल.
लिथियम वर - तारे
मोबाईल फोन, पॉकेट गॅजेट्स आणि लॅपटॉपच्या उत्पादकांना या धातूची नितांत गरज आहे. अणुऊर्जा मोठ्या प्रमाणात लिथियम (Li) वापरते; सिद्धांतकारांच्या मते, हा अल्कली धातू थर्मोन्यूक्लियर उर्जेची गुरुकिल्ली प्रदान करू शकतो. सर्वात शक्तिशाली असणे सायकोट्रॉपिक पदार्थ, लीचा वापर लष्करी आणि उपयोजित मानसोपचारात केला जातो (आणि मानवी मानसावर लीच्या प्रभावाचे स्वरूप पूर्णपणे समजलेले नाही). लिथियम ड्युटराइड हा हायड्रोजन बॉम्बमध्ये कार्यरत पदार्थ आणि स्फोट शक्ती नियामक म्हणून वापरला जातो.
खोल अंतराळ संशोधनासाठीही या धातूची गरज आहे.
राउटिंगधड्यासाठी विद्यार्थ्यांसाठी
विषय: अल्कली धातूंची संयुगे.
चाचणी
हायड्राइड्स.सर्वात स्थिर लिथियम हायड्राइड आहे, जे गरम केलेल्या लिथियमवर हायड्रोजन पास करून सहजपणे प्राप्त केले जाते. LiH एक पांढरा स्फटिक पावडर आहे ज्याचा वितळण्याचा बिंदू 680 o C. तेव्हा उच्च तापमान LiH अत्यंत प्रतिक्रियाशील आहे. पाण्याने जोरदारपणे विघटित होते:
LiH + H 2 O = LiOH + H 2
ऑक्साइड.सर्वात स्थिर Li 2 O. लिथियम आणि सोडियम ऑक्साईड पांढरे आहेत, बाकीचे पिवळे आहेत. शिवाय, घटकाच्या वाढत्या अणू संख्येसह रंगाची तीव्रता वाढते.
पेरोक्साइड्स.अतिरीक्त ऑक्सिजनमध्ये धातू जाळल्याने तयार होते. अल्कली मेटल पेरोक्साइड हे हायड्रोजन पेरोक्साइडचे डेरिव्हेटिव्ह मानले जाऊ शकतात कारण हायड्रोजन पेरॉक्साइड तयार करण्यासाठी ते ऍसिड आणि पाण्याशी संवाद साधतात:
M 2 O 2 + H 2 SO 4 = M 2 SO 4 + H 2 O 2
M 2 O 2 + 2H 2 O = 2MOH + H 2 O 2
सर्वात महत्वाचे म्हणजे सोडियम पेरोक्साइड, ज्याचा वापर बंदिस्त जागेत ऑक्सिजन तयार करण्यासाठी केला जातो (उदाहरणार्थ, पाणबुडी):
2Na 2 O 2 + 2CO 2 = 2Na 2 CO 3 + 2O 2
हायड्रॉक्साइड.तंत्रज्ञानामध्ये त्यांना कॉस्टिक अल्कालिस (NaOH - कॉस्टिक सोडा, KOH - कॉस्टिक पोटॅशियम) म्हणतात. हे रंगहीन, फ्युसिबल पदार्थ आहेत. वितळलेल्या अवस्थेत ते काच, पोर्सिलेन आणि प्लॅटिनमशी संवाद साधतात. म्हणून, अल्कली वितळणे चांदी किंवा लोखंडी क्रुसिबलमध्ये चालते, ज्याशी ते संवाद साधत नाहीत. हायड्रॉक्साईड्स जास्त उष्णतेसह पाण्यात विरघळतात.
हायड्रॉक्साइड खालील प्रकारे तयार केले जातात:
अ) धातू किंवा ऑक्साईड्सचा पाण्याशी परस्परसंवाद:
Li 2 O + H 2 O = 2LiOH
ही प्रतिक्रिया केवळ अत्यंत शुद्ध हायड्रॉक्साइड तयार करण्यासाठी वापरली जाते.
b) कॉस्टिकेशन रिॲक्शन ही कॉस्टिक सोडा तयार करण्यासाठी सर्वात जुनी ज्ञात पद्धत आहे. या पद्धतीमध्ये उकळताना कॅल्शियम हायड्रॉक्साईड (स्लेक केलेला चुना) सह सोडा द्रावणाचा उपचार करणे समाविष्ट आहे. परिणामी अघुलनशील कॅल्शियम कार्बोनेट फिल्टर केले जाते किंवा त्यातून एक स्पष्ट द्रव काढला जातो:
Na 2 CO 3 + Ca(OH) 2 = 2NaOH + CaCO 3
सोडियम हायड्रॉक्साईडचे परिणामी द्रावण व्हॅक्यूममध्ये बाष्पीभवनाद्वारे केंद्रित होते. पाणी पूर्णपणे काढून टाकण्यासाठी सॉलिड कॉस्टिक सोडा 500 o C वर वितळला जातो आणि 3-4% Na 2 CO 3 असलेले NaOH मिळते. अशा प्रकारे मिळणाऱ्या NaOH ला "कॉस्टिक सोडा" म्हणतात.
c) जलीय द्रावणात अल्कली मेटल क्लोराईड्सचे इलेक्ट्रोलिसिस ही क्लोरीनसह एकाच वेळी NaOH आणि KOH तयार करण्याची आधुनिक औद्योगिक पद्धत आहे. जेव्हा NaCl द्रावण जड इलेक्ट्रोड (प्लॅटिनम, ग्रेफाइट) सह इलेक्ट्रोलिसिसच्या अधीन केले जाते, तेव्हा क्लोरीन एनोडवर आणि हायड्रोजन कॅथोडमध्ये सोडले जाते. Na + आयन आणि OH - आयन कॅथोड जागेत जमा होतात, जे NaOH बनतात.
ड) अल्कली मेटल कार्बोनेटचे ऑक्साइडसह संलयन करून आणि त्यानंतरच्या मिश्रधातूला पाण्याच्या वाफेने प्रक्रिया करून:
Fe 2 O 3 + Na 2 CO 3 = 2NaFeO 2 + CO 2
2NaFeO 2 + H 2 O = 2NaOH + Fe 2 O 3
अल्कली हा सर्वात महत्वाचा कच्चा माल आहे रासायनिक उद्योगरंग, चष्मा, साबण, कागद, कृत्रिम तंतू, औषधे यांच्या उत्पादनासाठी.
मीठ. NaCl आणि KCl निसर्गात मोठ्या प्रमाणात आढळतात. NaCl (टेबल मीठ) मध्ये आढळते समुद्राचे पाणी(सरासरी 2.7%) आणि रॉक मिठाच्या स्वरूपात अनेक किलोमीटर जाडीच्या ठेवींमध्ये. त्यांच्या शुद्ध स्वरूपात, NaCl आणि KCl नैसर्गिक क्लोराईड्सपासून पुनर्क्रियीकरणाद्वारे प्राप्त केले जातात. लिथियम क्षार नैसर्गिक लिथियम कार्बोनेटपासून मिळतात. रुबिडियम आणि सीझियमचे क्षार मिळवणे अडचणींशी संबंधित आहे, कारण त्यांची विद्राव्यता पोटॅशियम क्षारांच्या अगदी जवळ असते. सामान्यत: ते कार्नालाइटच्या पुनर्क्रियीकरणानंतर उरलेल्या मदर लिकरपासून सुरू होतात आणि त्यांच्यापासून रुबिडियम आणि सीझियम तुरटी वेगळे करतात, जे पुनर्क्रियेद्वारे शुद्ध केले जातात. अल्कोहोलमधील कार्बोनेटच्या विविध विद्राव्यांचा वापर करून रुबिडियम सीझियमपासून वेगळे केले जाते.
नायट्रेट्सपैकी, NaNO 3 आणि KNO 3 व्यावहारिक महत्त्वाच्या आहेत. सोडियम नायट्रेट आणि पोटॅशियम नायट्रेट अशी तांत्रिक नावे आहेत. दोन्ही क्षारांचा वापर खनिज खते म्हणून केला जातो. KNO 3 देखील काळ्या पावडरच्या उत्पादनासाठी वापरला जातो (NaNO 3 त्याच्या हायग्रोस्कोपीसिटीमुळे वापरला जात नाही).
कार्बोनिक ऍसिड H 2 CO 3 अल्कली धातू कार्बोनेटच्या दोन मालिका देते, आम्लीय (MHCO 3) आणि मध्यम (M 2 CO 3). ऍसिड कार्बोनेट (हायड्रोकार्बोनेट्स, बायकार्बोनेट्स) लिथियम वगळता सर्व अल्कली धातूंसाठी ओळखले जातात. लिथियम कार्बोनेटचा अपवाद वगळता, सर्व तटस्थ कार्बोनेट पाण्यात अत्यंत विद्रव्य असतात. Na 2 CO 3 - सोडा, कधीकधी काही तलाव आणि खनिज झरे यांच्या पाण्यात नैसर्गिकरित्या आढळतो. अमोनिया पद्धतीचा वापर करून सोडा प्राप्त केला जातो: टेबल मीठचे द्रावण अमोनिया आणि कार्बन डायऑक्साइडसह संतृप्त केले जाते. या प्रकरणात, NaHCO 3 precipitates, कारण सोडा NH 4 Cl पेक्षा कमी विद्रव्य आहे:
NaCl + H 2 O + CO 2 + NH 3 = NaHCO 3 ¯ + NH 4 Cl
2NaHCO 3 → Na 2 CO 3 + CO 2 + H 2 O
K 2 CO 3 - पोटॅश, हायग्रोस्कोपिक पांढरी पावडर, पाण्यात अत्यंत विरघळणारी. पोटॅशियम हायड्रॉक्साईडच्या कार्बोनेशनद्वारे तयार:
2KOH + CO 2 = K 2 CO 3 + H 2 O
पोटॅशचा वापर साबण आणि काच उद्योगांमध्ये, लोकर रंगवण्यासाठी आणि ब्लीचिंगमध्ये, पोटॅशियम सायनाइडच्या निर्मितीमध्ये आणि सेंद्रिय संश्लेषणामध्ये केला जातो.
गंधकयुक्त आम्लअम्लीय आणि मध्यम - अल्कली धातूच्या सल्फेटच्या दोन मालिका देते.
सोडियम क्लोराईड आणि सल्फ्यूरिक ऍसिडपासून हायड्रोक्लोरिक ऍसिडच्या निर्मितीमध्ये Na 2 SO 4 उप-उत्पादन म्हणून प्राप्त केले जाते. जलीय द्रावणातून, सोडियम सल्फेट Na 2 SO 4 च्या स्वरूपात स्फटिक बनते. 10H 2 O, तंत्रज्ञानामध्ये या स्फटिकासारखे हायड्रेटला ग्लूबरचे मीठ म्हणतात. सूती कापड रंगविण्यासाठी आणि औषधांमध्ये वापरले जाते.
· · ·§ 96. अल्कधर्मी
अल्कली धातूंच्या गटात खालील धातूंची मालिका समाविष्ट आहे; Li, Na, K, Rb, Cs, Fr. ते आवर्त सारणीच्या गट I च्या मुख्य उपसमूहात आहेत.
हे सर्व समान आहेत की त्यांच्या बाह्य इलेक्ट्रॉनिक स्तरावर एक इलेक्ट्रॉन आहे (तक्ता 18)/.
अल्कधर्मी मूलद्रव्ये s-मूलांमध्ये आहेत. अल्कली धातूच्या अणूच्या बाह्य इलेक्ट्रॉन थराचा इलेक्ट्रॉन त्याच कालावधीतील इतर घटकांच्या तुलनेत न्यूक्लियसपासून सर्वात लांब असतो, म्हणजे, अल्कली धातूच्या अणूची त्रिज्या इतर घटकांच्या अणूंच्या त्रिज्येच्या तुलनेत सर्वात मोठी असते. समान कालावधी देय
|
कोर चार्ज |
ऊर्जा पातळीमध्ये इलेक्ट्रॉनची संख्या |
अणु त्रिज्या |
|||||||
यासह, अल्कली धातूच्या अणूंच्या बाह्य थराचा व्हॅलेन्स इलेक्ट्रॉन सहजपणे काढून टाकला जातो, ज्यामुळे ते सकारात्मक एकल चार्ज आयनमध्ये बदलतात. हे इतर घटकांसह अल्कली धातूंचे संयुगे आयनिक बाँडच्या प्रकारानुसार तयार केले जातात या वस्तुस्थितीमुळे आहे.
रेडॉक्स प्रतिक्रियांमध्ये ते मजबूत कमी करणारे एजंट म्हणून वागतात आणि ही क्षमता अणू केंद्रकांच्या वाढत्या चार्जसह धातूपासून धातूपर्यंत वाढते.
§ 97. सोडियम
सोडियम अणूचे इलेक्ट्रॉनिक कॉन्फिगरेशन ls 2 2s 2 2p 6 3s 1 आहे. त्याच्या बाह्य थराची रचना:
सोडियम निसर्गात फक्त क्षारांच्या स्वरूपात आढळतो. सर्वात सामान्य सोडियम मीठ म्हणजे टेबल सॉल्ट NaCl, तसेच खनिज सिल्विनाइट KCl · NaCl आणि काही सल्फ्यूरिक ऍसिड लवण, उदाहरणार्थ ग्लॉबरचे मीठ Na2SO4 · 10H2O, कॅस्पियन समुद्राच्या कारा-बोगाझ-गोल खाडीमध्ये मोठ्या प्रमाणात आढळतात.
टेबल मीठ NaCl पासून, सोडियम धातू वितळलेल्या मिठाच्या इलेक्ट्रोलिसिसद्वारे प्राप्त होते. इलेक्ट्रोलिसिस स्थापना अंजीर मध्ये दर्शविली आहे. 76. इलेक्ट्रोड वितळलेल्या मिठात बुडवले जातात. एनोड आणि कॅथोड स्पेस डायफ्रामद्वारे विभक्त केले जातात, जे तयार झालेल्या सोडियमला वेगळे करते जेणेकरून उलट प्रतिक्रिया उद्भवू नये. सकारात्मक सोडियम आयन कॅथोडमधून इलेक्ट्रॉन स्वीकारतो आणि एक तटस्थ सोडियम अणू बनतो. तटस्थ सोडियमचे अणू वितळलेल्या धातूच्या स्वरूपात कॅथोडमध्ये गोळा होतात. कॅथोडवर होणारी प्रक्रिया खालील चित्राद्वारे दर्शविली जाऊ शकते:
ना + + ना ० .
इलेक्ट्रॉन्सची स्वीकृती कॅथोडवर होत असल्याने आणि अणू किंवा आयनद्वारे इलेक्ट्रॉनची सर्व स्वीकृती ही घट असल्याने, कॅथोडवरील सोडियम आयन कमी होतात. एनोडवर, क्लोरीन आयन इलेक्ट्रॉन सोडतात, म्हणजे ऑक्सिडेशन आणि मुक्त सोडण्याची प्रक्रिया
क्लोरीन वायू, जो खालील चित्राद्वारे दर्शविला जाऊ शकतो:
Cl —— e— → Cl 0
परिणामी सोडियम धातूचा रंग चंदेरी-पांढरा असतो आणि चाकूने सहजपणे कापता येतो. सोडियमचा कट, कापल्यानंतर लगेच तपासला असता, त्यात चमकदार धातूची चमक असते, परंतु धातूच्या अत्यंत जलद ऑक्सिडेशनमुळे ते पटकन क्षीण होते.
![]()
तांदूळ. 76. वितळलेल्या मीठाच्या इलेक्ट्रोलिसिससाठी स्थापना आकृती.
1 - रिंग कॅथोड; 2 - एनोड स्पेसमधून क्लोरीन वायू काढून टाकण्यासाठी घंटा
जर सोडियम ऑक्सिजनच्या थोड्या प्रमाणात 180° तापमानात ऑक्सिडाइझ केले असेल तर सोडियम ऑक्साईड प्राप्त होतो:
4Na + O2 = 2Na2O.
ऑक्सिजनमध्ये जाळल्यावर सोडियम पेरोक्साइड तयार होतो:
2Na + O2 = Na2O2.
या प्रकरणात, सोडियम चमकदार पिवळ्या ज्वालाने जळतो.
सोडियमच्या सहज आणि जलद ऑक्सिडेशनमुळे, ते केरोसीन किंवा पॅराफिनच्या थराखाली साठवले जाते, जे श्रेयस्कर आहे, कारण काही प्रमाणात हवा अजूनही केरोसीन आणि सोडियम ऑक्सिडेशनमध्ये विरघळते, जरी हळूहळू, तरीही उद्भवते.
सोडियम हायड्रोजनसह एकत्र होऊ शकतो - हायड्राइड NaH, ज्यामध्ये ते 1 ची ऑक्सिडेशन स्थिती प्रदर्शित करते. हे एक मिठासारखे संयुग आहे, जे रासायनिक बंधनाच्या स्वरूपामुळे आणि ऑक्सिडेशन अवस्थेच्या परिमाणानुसार, IV गटांच्या मुख्य उपसमूहांच्या घटकांच्या अस्थिर हायड्राइड्सपेक्षा वेगळे आहे. -VII.
सोडियम धातू केवळ ऑक्सिजन आणि हायड्रोजनवरच नव्हे तर अनेक साध्या आणि जटिल पदार्थांवर देखील प्रतिक्रिया देऊ शकते. उदाहरणार्थ, सल्फरसह मोर्टारमध्ये जमिनीवर सोडल्यास, सोडियम त्याच्याशी हिंसक प्रतिक्रिया देते, तयार होते:
2Na + S = Na2S
प्रतिक्रिया उद्रेकांसह आहे, म्हणून आपण मोर्टार आपल्या डोळ्यांपासून दूर ठेवा आणि आपला हात टॉवेलमध्ये गुंडाळा. प्रतिक्रियेसाठी तुम्ही सोडियमचे छोटे तुकडे घ्यावेत.
सोडियम क्लोरीनमध्ये जोमाने जाळून सोडियम क्लोराईड तयार होतो, जे कॅल्शियम क्लोराईड ट्यूबमध्ये पाहणे विशेषतः चांगले आहे ज्यामध्ये वितळलेल्या आणि अत्यंत गरम झालेल्या सोडियममधून क्लोरीनचा प्रवाह जातो:
2Na + Cl2 = 2NaCl
सोडियम केवळ साध्याच नव्हे तर पाण्यासारख्या जटिल पदार्थांवर देखील प्रतिक्रिया देते, कारण ते खूप आहे. सक्रिय धातू, व्होल्टेज मालिकेत हायड्रोजनच्या डावीकडे जास्त आहे आणि नंतरचे पाण्यापासून सहजपणे विस्थापित करते:
2Na + 2H2O = 2NaOH + H2
अल्कली धातूची आग पाण्याने विझवता येत नाही. सोडा राख पावडरने भरणे चांगले. सोडियमच्या उपस्थितीत, गॅस बर्नरची रंगहीन ज्योत पिवळी होते.
सेंद्रिय संश्लेषणामध्ये सोडियम धातूचा उत्प्रेरक म्हणून वापर केला जाऊ शकतो, उदाहरणार्थ बुटाडीनपासून सिंथेटिक रबर निर्मितीमध्ये. हे सोडियम पेरोक्साइड सारख्या इतर सोडियम संयुगेच्या निर्मितीसाठी प्रारंभिक सामग्री म्हणून काम करते.
■ 27. मजकूरात दिलेल्या धातूच्या सोडियमचा समावेश असलेल्या प्रतिक्रियांसाठी समीकरणे वापरून, ते कमी करणारे घटक म्हणून वर्तन करते हे सिद्ध करा.
28. सोडियम हवेत का साठवता येत नाही?
29. एका विद्यार्थ्याने तांबे सल्फेटच्या द्रावणात सोडियमचा तुकडा बुडवला, मिठापासून धातूचे मीठ विस्थापित होईल. लाल धातूऐवजी, परिणाम जिलेटिनस निळा अवक्षेपण होता. झालेल्या प्रतिक्रियांचे वर्णन करा आणि त्यांची समीकरणे आण्विक आणि आयनिक स्वरूपात लिहा. प्रतिक्रियेची परिस्थिती कशी बदलली पाहिजे जेणेकरून प्रतिक्रिया इच्छित परिणामाकडे नेईल? आण्विक, पूर्ण आणि संक्षिप्त आयनिक स्वरूपात समीकरणे लिहा.
30. 2.3 ग्रॅम सोडियम धातू एका भांड्यात 45 मिली पाणी ठेवले होते. प्रतिक्रियेच्या शेवटी किती सोडियम हायड्रॉक्साईड तयार होते?
31. सोडियमची आग विझवण्यासाठी कोणते साधन वापरले जाऊ शकते? तर्कशुद्ध उत्तर द्या.
§ 98. सोडियमचे ऑक्सिजन संयुगे. सोडियम हायड्रॉक्साइड
आधीच नमूद केल्याप्रमाणे सोडियमचे ऑक्सिजन संयुगे सोडियम ऑक्साईड Na2O आणि सोडियम पेरोक्साइड Na2O2 आहेत.
सोडियम ऑक्साईड Na2O विशेषतः महत्वाचे नाही. ते पाण्यावर जोरदारपणे प्रतिक्रिया देते, कॉस्टिक सोडा तयार करते:
Na2O + H2O = 2NaOH
सोडियम पेरोक्साइड Na202 एक पिवळसर पावडर आहे. हे हायड्रोजन पेरोक्साइडचे एक प्रकारचे मीठ मानले जाऊ शकते, कारण त्याची रचना H2O2 सारखीच आहे. सोडियम पेरोक्साइड प्रमाणे, हे एक मजबूत ऑक्सिडायझिंग एजंट आहे. पाण्याच्या संपर्कात आल्यावर ते अल्कली बनते आणि:
Na2O2 + H2O = H2O2 + 2NaOH
सोडियम पेरोक्साइडवर सौम्य ऍसिडच्या क्रियेद्वारे देखील तयार होते:
Na2O2 + H2SO4 = H2O2 + Na2SO4
सोडियम पेरोक्साइडचे वरील सर्व गुणधर्म हे सर्व संभाव्य सामग्री ब्लीचिंगसाठी वापरण्याची परवानगी देतात.
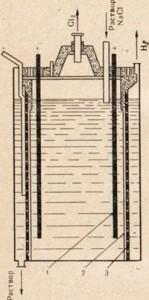
तांदूळ. 77. टेबल सॉल्टच्या द्रावणाच्या इलेक्ट्रोलिसिससाठी स्थापनेचे आकृती.
1 - एनोड; 2 - एनोड आणि कॅथोड स्पेस वेगळे करणारे डायाफ्राम; 3-कॅथोड
सोडियम हायड्रॉक्साइड किंवा सोडियम हायड्रॉक्साइड, NaOH हे एक अतिशय महत्त्वाचे सोडियम कंपाऊंड आहे. त्याला कॉस्टिक सोडा किंवा फक्त कॉस्टिक असेही म्हणतात.
कॉस्टिक सोडा मिळविण्यासाठी, टेबल मीठ, सर्वात स्वस्त नैसर्गिक सोडियम कंपाऊंड, ते इलेक्ट्रोलिसिसच्या अधीन करून वापरले जाते, परंतु या प्रकरणात, वितळत नाही, परंतु मीठ द्रावण वापरले जाते (चित्र 77). टेबल सॉल्टच्या द्रावणाच्या इलेक्ट्रोलिसिसच्या प्रक्रियेच्या वर्णनासाठी, अंजीर मध्ये § 33 पहा. 77 दाखवते की एनोड आणि कॅथोड स्पेस डायफ्रामद्वारे विभक्त आहेत. हे केले जाते जेणेकरून परिणामी उत्पादने एकमेकांशी संवाद साधत नाहीत, उदाहरणार्थ Cl2 + 2NaOH = NaClO + NaCl + H2O.
कास्टिक सोडा हा एक पांढरा स्फटिकासारखा घन आहे, जो पाण्यात अत्यंत विरघळतो. कॉस्टिक सोडा पाण्यात विरघळल्यावर तो बाहेर पडतो मोठ्या संख्येनेउष्णता आणि द्रावण खूप गरम होते. कॉस्टिक सोडा पाण्याच्या वाफेच्या आत प्रवेश करण्यापासून संरक्षित करण्यासाठी सीलबंद कंटेनरमध्ये साठवला जाणे आवश्यक आहे, ज्याच्या प्रभावाखाली ते खूप मॉइश्चरायझ्ड होऊ शकते, तसेच कार्बन डायऑक्साइड, ज्याच्या प्रभावाखाली कॉस्टिक सोडा हळूहळू सोडियम कार्बोनेटमध्ये बदलू शकतो. :
2NaOH + CO2 = Na2CO3+ H2O.
कॉस्टिक सोडा हा एक सामान्य अल्कली आहे, त्यामुळे त्याच्यासोबत काम करताना घ्यावयाची खबरदारी इतर अल्कलीसोबत काम करताना सारखीच असते.
कॉस्टिक सोडा बऱ्याच उद्योगांमध्ये वापरला जातो, उदाहरणार्थ, पेट्रोलियम उत्पादनांच्या शुद्धीकरणासाठी, चरबीपासून साबण तयार करण्यासाठी, कागद उद्योगात, कृत्रिम तंतू आणि रंग तयार करण्यासाठी, औषधांच्या निर्मितीमध्ये इ. (चित्र. ७८).
तुमच्या वहीत कॉस्टिक सोडा वापरण्याची क्षेत्रे लिहा.
सोडियम क्षारांपैकी, सर्व प्रथम टेबल मीठ NaCl हे लक्षात घेतले पाहिजे, जे कॉस्टिक सोडा आणि धातूचा सोडियम तयार करण्यासाठी मुख्य कच्चा माल म्हणून काम करते (या मीठाबद्दल अधिक माहितीसाठी, पृष्ठ 164 पहा), सोडा Na2CO3 (पृष्ठ पहा. 278), Na2SO4 (पृष्ठ 224 पहा), NaNO3 (पृष्ठ 250 पहा), इ.
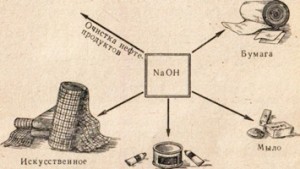
तांदूळ. 78. कॉस्टिक सोडाचा वापर
■ 32. टेबल सॉल्टच्या इलेक्ट्रोलिसिसद्वारे सोडियम हायड्रॉक्साईड तयार करण्याच्या पद्धतीचे वर्णन करा.
33. कास्टिक सोडा सोडियम कार्बोनेटवर स्लेक्ड चुना वापरून तयार करता येतो. या प्रतिक्रियेसाठी समीकरणाचे आण्विक आणि आयनिक स्वरूप लिहा आणि 40 किलो सोडियम हायड्रॉक्साईड तयार करण्यासाठी 95% कार्बोनेट असलेल्या सोडा किती आवश्यक असतील याची गणना करा.
34. ग्राउंड-इन स्टॉपर्ससह फ्लास्कमध्ये कॉस्टिक सोडा द्रावण साठवताना, स्टॉपर्स "चिकट" का आणि काढले जाऊ शकत नाहीत? जर तुम्ही बाटली काही काळ पाण्यात उलटून ठेवली तर स्टॉपर सहज काढता येतो. या प्रकरणात कोणत्या प्रकारच्या प्रक्रिया घडतात, प्रतिक्रिया समीकरणे देऊन स्पष्ट करा.
35. आण्विक आणि आयनिक स्वरूपात प्रतिक्रिया समीकरणे लिहा जे कॉस्टिक सोडाचे गुणधर्म वैशिष्ट्यपूर्ण अल्कली म्हणून दर्शवतात.
36. कॉस्टिक सोडासोबत काम करताना कोणती खबरदारी घ्यावी? कॉस्टिक सोडा बर्न्ससाठी कोणते प्रथमोपचार उपाय केले पाहिजेत?
§ 99. पोटॅशियम
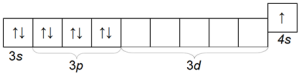
पोटॅशियम के हा देखील एक सामान्य अल्कली धातू आहे, जो सोडियमपेक्षा त्याच्या अणु त्रिज्या (चौथ्या कालावधी) च्या आकारात भिन्न आहे आणि त्यामुळे सोडियमपेक्षा जास्त रासायनिक क्रिया आहे. पोटॅशियम अणूचे इलेक्ट्रॉनिक कॉन्फिगरेशन 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 आहे.
त्याच्या बाह्य इलेक्ट्रॉनिक स्तराची रचना
पोटॅशियम हा एक मऊ धातू आहे जो चाकूने चांगला कापला जाऊ शकतो. ऑक्सिडेशन टाळण्यासाठी, ते, सोडियमप्रमाणे, केरोसीनच्या थराखाली साठवले जाते.
पोटॅशियम सोडियमपेक्षाही जास्त हिंसकपणे पाण्यावर प्रतिक्रिया देते, अल्कली तयार करते आणि हायड्रोजन सोडते, जे प्रज्वलित करते:
2K + 2H2O = 2KOH + H2.
जेव्हा ऑक्सिजनमध्ये जाळले जाते (आणि सोडियम जाळण्यापेक्षा ज्वलनासाठी धातूचे अगदी लहान तुकडे घेण्याची शिफारस केली जाते), ते सोडियमप्रमाणेच, पोटॅशियम पेरोक्साइड तयार करण्यासाठी खूप जोमाने जळते.
हे लक्षात घ्यावे की पोटॅशियम रक्ताभिसरणातील सोडियमपेक्षा जास्त धोकादायक आहे. पोटॅशियम कापताना देखील एक मजबूत स्फोट होऊ शकतो, म्हणून आपल्याला ते अधिक काळजीपूर्वक हाताळण्याची आवश्यकता आहे.
पोटॅशियम हायड्रॉक्साईड, किंवा पोटॅशियम हायड्रॉक्साइड KOH, एक पांढरा स्फटिकासारखे पदार्थ आहे. कॉस्टिक पोटॅशियम सर्व बाबतीत कॉस्टिक सोडासारखेच आहे. ते साबण उद्योगात मोठ्या प्रमाणावर वापरले जातात, परंतु त्याचे उत्पादन काहीसे महाग आहे, म्हणून ते NaOH प्रमाणे वापरले जात नाही.
पोटॅशियम ग्लायकोकॉलेट विशेषतः लक्षात घेतले पाहिजे कारण त्यापैकी काही मोठ्या प्रमाणावर खत म्हणून वापरले जातात. हे पोटॅशियम क्लोराईड KCl, पोटॅशियम नायट्रेट KNO3 आहेत, जे नायट्रोजन खत देखील आहे.
■ 37. कॉस्टिक सोडा पेक्षा कॉस्टिक पोटॅशियम अधिक रासायनिक क्रियाशील आहे हे आपण कसे स्पष्ट करू शकतो?
38. पोटॅशियमचा तुकडा पाण्याने क्रिस्टलायझरमध्ये कमी केला. प्रतिक्रिया पूर्ण झाल्यानंतर, तेथे पांढर्या जिलेटिनस प्रिसिपिटेटच्या स्वरूपात थोडे जस्त ठेवले गेले. अवक्षेपण नाहीसे झाले आणि जेव्हा द्रावणाची फेनोल्फथालीनने चाचणी केली तेव्हा ते किरमिजी रंगाचे झाले. येथे कोणत्या रासायनिक प्रक्रिया झाल्या?
कोणते उपाय आहेत? तर्कशुद्ध उत्तर द्या.
39. पोटॅशियम, सर्व अल्कली धातूंप्रमाणे, एस-एलिमेंट्स कुटुंबातील सदस्य म्हणून वर्गीकृत का केले जाते?
अल्कली धातू नॉन-मेटल्सवर सहज प्रतिक्रिया देतात:
2K + I 2 = 2KI
2Na + H 2 = 2NaH
6Li + N 2 = 2Li 3 N (प्रतिक्रिया खोलीच्या तपमानावर होते)
2Na + S = Na 2 S
2Na + 2C = Na 2 C 2
ऑक्सिजनसह प्रतिक्रियांमध्ये, प्रत्येक अल्कली धातू स्वतःचे व्यक्तिमत्व दर्शवते: जेव्हा हवेत जाळले जाते तेव्हा लिथियम ऑक्साईड, सोडियम - पेरोक्साइड, पोटॅशियम - सुपरऑक्साइड बनवते.
4Li + O 2 = 2Li 2 O
2Na + O 2 = Na 2 O 2
K + O 2 = KO 2
सोडियम ऑक्साईड तयार करणे:
10Na + 2NaNO 3 = 6Na 2 O + N 2
2Na + Na 2 O 2 = 2Na 2 O
2Na + 2NaON = 2Na 2 O + H 2
पाण्याच्या परस्परसंवादामुळे अल्कली आणि हायड्रोजनची निर्मिती होते.
2Na + 2H 2 O = 2NaOH + H 2
आम्लांशी संवाद:
2Na + 2HCl = 2NaCl + H2
8Na + 5H 2 SO 4 (conc.) = 4Na 2 SO 4 + H 2 S + 4H 2 O
2Li + 3H 2 SO 4 (conc.) = 2LiHSO 4 + SO 2 + 2H 2 O
8Na + 10HNO 3 = 8NaNO 3 + NH 4 NO 3 + 3H 2 O
अमोनियाशी संवाद साधताना, एमाइड्स आणि हायड्रोजन तयार होतात:
2Li + 2NH 3 = 2LiNH 2 + H 2
सेंद्रिय यौगिकांशी संवाद:
H ─ C ≡ C ─ H + 2Na → Na ─ C≡C ─ Na + H 2
2CH 3 Cl + 2Na → C 2 H 6 + 2NaCl
2C 6 H 5 OH + 2Na → 2C 6 H 5 ONa + H 2
2CH 3 OH + 2Na → 2 CH 3 ONa + H 2
2СH 3 COOH + 2Na → 2CH 3 COOOONa + H 2
अल्कली धातूंची गुणात्मक प्रतिक्रिया म्हणजे त्यांच्या केशन्सद्वारे ज्योत रंगवणे. ली + आयन ज्वालाचा रंग लाल, ना + आयन - पिवळा, के + - व्हायलेट.
अल्कली धातू संयुगे
ऑक्साइड.
अल्कली मेटल ऑक्साइड हे वैशिष्ट्यपूर्ण मूलभूत ऑक्साइड आहेत. ते अम्लीय आणि एम्फोटेरिक ऑक्साईड, ऍसिड आणि पाण्यावर प्रतिक्रिया देतात.
3Na 2 O + P 2 O 5 = 2Na 3 PO 4
Na 2 O + Al 2 O 3 = 2NaAlO 2
Na 2 O + 2HCl = 2NaCl + H 2 O
Na 2 O + 2H + = 2Na + + H 2 O
Na 2 O + H 2 O = 2NaOH
पेरोक्साइड्स.
2Na 2 O 2 + CO 2 = 2Na 2 CO 3 + O 2
Na 2 O 2 + CO = Na 2 CO 3
Na 2 O 2 + SO 2 = Na 2 SO 4
2Na 2 O + O 2 = 2Na 2 O 2
Na 2 O + NO + NO 2 = 2NaNO 2
2Na 2 O 2 = 2Na 2 O + O 2
Na 2 O 2 + 2H 2 O (थंड) = 2NaOH + H 2 O 2
2Na 2 O 2 + 2H 2 O (hor.) = 4NaOH + O 2
Na 2 O 2 + 2HCl = 2NaCl + H 2 O 2
2Na 2 O 2 + 2H 2 SO 4 (विभाजित क्षितिज) = 2Na 2 SO 4 + 2H 2 O + O 2
2Na 2 O 2 + S = Na 2 SO 3 + Na 2 O
5Na 2 O 2 + 8H 2 SO 4 + 2KMnO 4 = 5O 2 + 2MnSO 4 + 8H 2 O + 5Na 2 SO 4 + K 2 SO 4
Na 2 O 2 + 2H 2 SO 4 + 2NaI = I 2 + 2Na 2 SO 4 + 2H 2 O
Na 2 O 2 + 2H 2 SO 4 + 2FeSO 4 = Fe 2 (SO 4) 3 + Na 2 SO 4 + 2H 2 O
3Na 2 O 2 + 2Na 3 = 2Na 2 CrO 4 + 8NaOH + 2H 2 O
बेस (क्षार).
2NaOH (अतिरिक्त) + CO 2 = Na 2 CO 3 + H 2 O
NaOH + CO 2 (अतिरिक्त) = NaHCO 3
SO 2 + 2NaOH (अतिरिक्त) = Na 2 SO 3 + H 2 O
SiO 2 + 2NaOH Na 2 SiO 3 + H 2 O
2NaOH + Al 2 O 3 2NaAlO 2 + H 2 O
2NaOH + Al 2 O 3 + 3H 2 O = 2Na
NaOH + Al(OH) 3 = Na
2NaOH + 2Al + 6H 2 O = 2Na + 3H 2
2KOH + 2NO2 + O2 = 2KNO3 + H2O
KOH + KHCO 3 = K 2 CO 3 + H 2 O
2NaOH + Si + H 2 O = Na 2 SiO 3 + H 2
3KOH + P 4 + 3H 2 O = 3KH 2 PO 2 + PH 3
2KOH (थंड) + Cl 2 = KClO + KCl + H 2 O
6KOH (गरम) + 3Cl 2 = KClO 3 + 5KCl + 3H 2 O
6NaOH + 3S = 2Na2S + Na2SO3 + 3H2O
2NaNO 3 2NaNO 2 + O 2
NaHCO 3 + HNO 3 = NaNO 3 + CO 2 + H 2 O
NaI → Na + + I –
कॅथोडवर: 2H 2 O + 2e → H 2 + 2OH – 1
एनोडवर: 2I – – 2e → I 2 1
2H 2 O + 2I – ![]() H 2 + 2OH – + I 2
H 2 + 2OH – + I 2
2H2O + 2NaI ![]() H 2 + 2NaOH + I 2
H 2 + 2NaOH + I 2
2NaCl ![]() 2Na + Cl2
2Na + Cl2
एनोड येथे कॅथोड येथे
2Na 2 HPO 4 Na 4 P 2 O 7 + H 2 O
KNO 3 + 4Mg + 6H 2 O = NH 3 + 4Mg(OH) 2 + KOH
4KClO 3 KCl + 3KClO 4
2KClO3 ![]() 2KCl + 3O 2
2KCl + 3O 2
KClO 3 + 6HCl = KCl + 3Cl 2 + 3H 2 O
Na 2 SO 3 + S = Na 2 S 2 O 3
Na 2 S 2 O 3 + H 2 SO 4 = Na 2 SO 4 + S↓ + SO 2 + H 2 O
2NaI + Br 2 = 2NaBr + I 2
2NaBr + Cl 2 = 2NaCl + Br 2
मी अ गट.
1. फ्लास्कमध्ये ओतलेल्या कॉस्टिक सोडा सोल्यूशनच्या पृष्ठभागावर इलेक्ट्रिकल डिस्चार्ज केले गेले आणि फ्लास्कमधील हवा तपकिरी झाली, जी काही काळानंतर गायब झाली. परिणामी द्रावण काळजीपूर्वक बाष्पीभवन केले गेले आणि हे निश्चित केले गेले की घन अवशेष दोन क्षारांचे मिश्रण होते. जेव्हा हे मिश्रण गरम केले जाते तेव्हा गॅस सोडला जातो आणि फक्त पदार्थ शिल्लक राहतो. वर्णन केलेल्या प्रतिक्रियांसाठी समीकरणे लिहा.
2. वितळलेल्या सोडियम क्लोराईडच्या इलेक्ट्रोलिसिस दरम्यान कॅथोडमध्ये सोडलेला पदार्थ ऑक्सिजनमध्ये जाळला गेला. परिणामी उत्पादन कार्बन डायऑक्साइडने भरलेल्या गॅसोमीटरमध्ये ठेवले होते. परिणामी पदार्थ अमोनियम क्लोराईडच्या द्रावणात जोडला गेला आणि द्रावण गरम केले गेले. वर्णन केलेल्या प्रतिक्रियांसाठी समीकरणे लिहा.
3) नायट्रिक ऍसिड बेकिंग सोडासह तटस्थ केले गेले, तटस्थ द्रावण काळजीपूर्वक बाष्पीभवन केले गेले आणि अवशेष कॅल्साइन केले गेले. परिणामी पदार्थ पोटॅशियम परमँगनेटच्या द्रावणात जोडला गेला ज्यामध्ये सल्फ्यूरिक ऍसिडसह ऍसिडिफिकेशन केले गेले आणि द्रावण रंगहीन झाले. नायट्रोजन-युक्त प्रतिक्रिया उत्पादन सोडियम हायड्रॉक्साईडच्या द्रावणात ठेवले आणि जस्त धूळ जोडली गेली आणि तीव्र गंध असलेला वायू सोडला गेला. वर्णन केलेल्या प्रतिक्रियांसाठी समीकरणे लिहा.
4) निष्क्रिय इलेक्ट्रोडसह सोडियम आयोडाइड द्रावणाच्या इलेक्ट्रोलिसिसच्या वेळी एनोडवर प्राप्त झालेल्या पदार्थाची पोटॅशियमसह प्रतिक्रिया होते. प्रतिक्रिया उत्पादन एकाग्र सल्फ्यूरिक ऍसिडसह गरम केले गेले आणि पोटॅशियम क्रोमेटच्या गरम द्रावणातून मुक्त वायू पास केला गेला. वर्णन केलेल्या प्रतिक्रियांसाठी समीकरणे लिहा
5) वितळलेल्या सोडियम क्लोराईडच्या इलेक्ट्रोलिसिस दरम्यान कॅथोडवर प्राप्त केलेला पदार्थ ऑक्सिजनमध्ये जाळला गेला. परिणामी उत्पादनावर सल्फर डायऑक्साइड आणि बेरियम हायड्रॉक्साईडच्या द्रावणाने क्रमाक्रमाने उपचार केले गेले. वर्णन केलेल्या प्रतिक्रियांसाठी समीकरणे लिहा
6) पांढरा फॉस्फरस पोटॅशियम हायड्रॉक्साईडच्या द्रावणात विरघळतो, लसणीच्या गंधासह वायू सोडतो, जो उत्स्फूर्तपणे हवेत प्रज्वलित होतो. दहन प्रतिक्रियेचे घन उत्पादन कॉस्टिक सोडासह अशा प्रमाणात प्रतिक्रिया देते की परिणामी पांढर्या पदार्थात एक हायड्रोजन अणू असतो; जेव्हा नंतरचा पदार्थ कॅलक्लाइंड केला जातो तेव्हा सोडियम पायरोफॉस्फेट तयार होतो. वर्णन केलेल्या प्रतिक्रियांसाठी समीकरणे लिहा
7) ऑक्सिजनमध्ये अज्ञात धातू जळला. प्रतिक्रिया उत्पादन कार्बन डायऑक्साइडशी संवाद साधून दोन पदार्थ तयार करतात: एक घन जो कार्बन डायऑक्साइड सोडण्यासाठी हायड्रोक्लोरिक ऍसिडच्या द्रावणासह प्रतिक्रिया देतो आणि ज्वलनास समर्थन देणारा वायूयुक्त साधा पदार्थ. वर्णन केलेल्या प्रतिक्रियांसाठी समीकरणे लिहा.
8) तपकिरी वायू जास्त प्रमाणात कॉस्टिक पोटॅशियम द्रावणातून जास्त प्रमाणात हवेच्या उपस्थितीत जातो. परिणामी द्रावणात मॅग्नेशियम शेव्हिंग्ज जोडले गेले आणि गरम केले गेले आणि परिणामी वायूने नायट्रिक ऍसिडचे तटस्थ केले. परिणामी द्रावण काळजीपूर्वक बाष्पीभवन केले गेले आणि घन प्रतिक्रिया उत्पादन कॅलक्लाइंड केले गेले. वर्णन केलेल्या प्रतिक्रियांसाठी समीकरणे लिहा.
9) केव्हा थर्मल विघटनमँगनीज डायऑक्साइडच्या उपस्थितीत क्षार A, बायनरी मीठ B आणि ज्वलनास समर्थन देणारा वायू तयार होतो आणि हवेचा भाग असतो; जेव्हा हे मीठ उत्प्रेरकाशिवाय गरम केले जाते तेव्हा मीठ B आणि जास्त ऑक्सिजनयुक्त ऍसिड तयार होते. जेव्हा मीठ A हा हायड्रोक्लोरिक ऍसिडशी संवाद साधतो तेव्हा एक पिवळा-हिरवा वायू (साधा पदार्थ) बाहेर पडतो आणि मीठ B तयार होतो. मीठ B ज्वाला जांभळा बनवते आणि जेव्हा ते चांदीच्या नायट्रेटच्या द्रावणाशी संवाद साधते तेव्हा पांढरा अवक्षेप तयार होतो. वर्णन केलेल्या प्रतिक्रियांसाठी समीकरणे लिहा.
10) तांब्याचे शेविंग गरम केलेल्या एकाग्र सल्फ्यूरिक ऍसिडमध्ये जोडले गेले आणि सोडलेला वायू कॉस्टिक सोडा (अतिरिक्त) च्या द्रावणातून पार केला गेला. प्रतिक्रिया उत्पादन वेगळे केले गेले, पाण्यात विरघळले आणि सल्फरने गरम केले, जे प्रतिक्रियेच्या परिणामी विरघळले. परिणामी द्रावणात पातळ सल्फ्यूरिक ऍसिड जोडले गेले. वर्णन केलेल्या प्रतिक्रियांसाठी समीकरणे लिहा.
11) टेबल मीठ एकाग्र सल्फ्यूरिक ऍसिडसह उपचार केले गेले. परिणामी मीठ सोडियम हायड्रॉक्साईडने हाताळले गेले. परिणामी उत्पादन अतिरिक्त कोळसा सह calcined होते. सोडलेल्या वायूने क्लोरीनसह उत्प्रेरकाच्या उपस्थितीत प्रतिक्रिया दिली. वर्णन केलेल्या प्रतिक्रियांसाठी समीकरणे लिहा.
12) सोडियमची हायड्रोजनवर प्रतिक्रिया होते. प्रतिक्रिया उत्पादन पाण्यात विरघळले, ज्यामुळे क्लोरीनसह प्रतिक्रिया देणारा वायू तयार झाला आणि परिणामी द्रावण गरम झाल्यावर क्लोरीनवर प्रतिक्रिया देऊन दोन क्षारांचे मिश्रण तयार केले. वर्णन केलेल्या प्रतिक्रियांसाठी समीकरणे लिहा.
13) सोडियम जादा ऑक्सिजनमध्ये जाळला गेला, परिणामी स्फटिकासारखे पदार्थ काचेच्या नळीमध्ये ठेवले गेले आणि त्यातून कार्बन डायऑक्साइड पार केला गेला. नळीतून बाहेर पडणारा वायू गोळा करून त्याच्या वातावरणात फॉस्फरस जाळला जात असे. परिणामी पदार्थ सोडियम हायड्रॉक्साईड द्रावणाच्या जास्तीसह तटस्थ केले गेले. वर्णन केलेल्या प्रतिक्रियांसाठी समीकरणे लिहा.
14) हायड्रोक्लोरिक ऍसिडचे द्रावण सोडियम पेरोक्साईडची पाण्याने प्रतिक्रिया पूर्ण होईपर्यंत गरम झाल्यावर प्राप्त केलेल्या द्रावणात जोडले गेले. परिणामी मीठाचे द्रावण निष्क्रिय इलेक्ट्रोडसह इलेक्ट्रोलिसिसच्या अधीन होते. एनोडवर इलेक्ट्रोलिसिसच्या परिणामी तयार झालेला वायू कॅल्शियम हायड्रॉक्साईडच्या निलंबनाद्वारे पार केला गेला. वर्णन केलेल्या प्रतिक्रियांसाठी समीकरणे लिहा.
15) एक मध्यम मीठ तयार होईपर्यंत सल्फर डायऑक्साइड सोडियम हायड्रॉक्साईडच्या द्रावणातून जात असे. परिणामी द्रावणात पोटॅशियम परमँगनेटचे जलीय द्रावण जोडले गेले. परिणामी अवक्षेपण वेगळे केले गेले आणि हायड्रोक्लोरिक ऍसिडने उपचार केले गेले. सोडलेला वायू पोटॅशियम हायड्रॉक्साईडच्या थंड द्रावणातून जातो. वर्णन केलेल्या प्रतिक्रियांसाठी समीकरणे लिहा.
16) सिलिकॉन (IV) ऑक्साईड आणि मॅग्नेशियम धातूचे मिश्रण कॅल्साइन केलेले होते. प्रतिक्रियेच्या परिणामी प्राप्त झालेल्या साध्या पदार्थावर सोडियम हायड्रॉक्साईडच्या एकाग्र द्रावणाने उपचार केले गेले. सोडलेला वायू गरम झालेल्या सोडियमवर गेला. परिणामी पदार्थ पाण्यात ठेवले होते. वर्णन केलेल्या प्रतिक्रियांसाठी समीकरणे लिहा.
17) नायट्रोजनसह लिथियमच्या अभिक्रियाचे उत्पादन पाण्याने प्रक्रिया केली गेली. रासायनिक अभिक्रिया थांबेपर्यंत परिणामी वायू सल्फ्यूरिक ऍसिडच्या द्रावणातून पार केला गेला. परिणामी द्रावणाचा उपचार बेरियम क्लोराईडच्या द्रावणाने केला जातो. द्रावण फिल्टर केले गेले आणि फिल्टर सोडियम नायट्रेट द्रावणात मिसळले आणि गरम केले. वर्णन केलेल्या प्रतिक्रियांसाठी समीकरणे लिहा.
18) सोडियम हायड्रोजन वातावरणात गरम होते. जेव्हा परिणामी पदार्थात पाणी जोडले गेले तेव्हा वायूची उत्क्रांती आणि स्पष्ट द्रावणाची निर्मिती दिसून आली. या द्रावणातून तपकिरी वायू पार केला गेला, जो एकाग्र द्रावणासह तांब्याच्या परस्परसंवादाच्या परिणामी प्राप्त झाला. नायट्रिक आम्ल. वर्णन केलेल्या प्रतिक्रियांसाठी समीकरणे लिहा.
19) सोडियम बायकार्बोनेट कॅलक्लाइंड होते. परिणामी मीठ पाण्यात विरघळले आणि ॲल्युमिनियमच्या द्रावणात मिसळले, परिणामी एक वर्षाव तयार झाला आणि रंगहीन वायू बाहेर पडला. नायट्रिक ऍसिडच्या जास्तीच्या द्रावणाने अवक्षेपण प्रक्रिया केली गेली आणि पोटॅशियम सिलिकेटच्या द्रावणातून वायू पार केला गेला. वर्णन केलेल्या प्रतिक्रियांसाठी समीकरणे लिहा.
20) सोडियम सल्फरमध्ये मिसळले होते. परिणामी कंपाऊंडवर हायड्रोक्लोरिक ऍसिडचा उपचार केला गेला, सोडलेला वायू सल्फर (IV) ऑक्साईडसह पूर्णपणे प्रतिक्रिया देतो. परिणामी पदार्थावर केंद्रित नायट्रिक ऍसिडने उपचार केले गेले. वर्णन केलेल्या प्रतिक्रियांसाठी समीकरणे लिहा.
21) अतिरिक्त ऑक्सिजनमध्ये सोडियम जाळला जातो. परिणामी पदार्थ पाण्याने उपचार केला गेला. परिणामी मिश्रण उकडलेले होते, त्यानंतर गरम द्रावणात क्लोरीन जोडले गेले. वर्णन केलेल्या प्रतिक्रियांसाठी समीकरणे लिहा.
22) पोटॅशियम नायट्रोजन वातावरणात गरम होते. परिणामी पदार्थावर हायड्रोक्लोरिक ऍसिडच्या जास्त प्रमाणात उपचार केले गेले, त्यानंतर कॅल्शियम हायड्रॉक्साईडचे निलंबन क्षारांच्या परिणामी मिश्रणात जोडले गेले आणि गरम केले गेले. परिणामी वायू गरम तांबे (II) ऑक्साईडमधून पार केला गेला. वर्णन केलेल्या प्रतिक्रियांसाठी समीकरणे लिहा.
23) क्लोरीनच्या वातावरणात पोटॅशियम जाळले गेले, परिणामी मीठ सिल्व्हर नायट्रेटच्या जलीय द्रावणाने उपचार केले गेले. तयार होणारे अवक्षेपण फिल्टर केले गेले, फिल्टरचे बाष्पीभवन केले गेले आणि काळजीपूर्वक गरम केले गेले. परिणामी मीठ प्रक्रिया होते जलीय द्रावणब्रोमिन वर्णन केलेल्या प्रतिक्रियांसाठी समीकरणे लिहा.
24) लिथियमची हायड्रोजनवर प्रतिक्रिया होते. प्रतिक्रिया उत्पादन पाण्यात विरघळले, ज्यामुळे ब्रोमिनसह प्रतिक्रिया देणारा वायू तयार झाला आणि परिणामी द्रावण गरम झाल्यावर क्लोरीनवर प्रतिक्रिया देऊन दोन क्षारांचे मिश्रण तयार केले. वर्णन केलेल्या प्रतिक्रियांसाठी समीकरणे लिहा.
25) सोडियम हवेत जाळले. परिणामी घन कार्बन डायऑक्साइड शोषून घेते, ऑक्सिजन आणि मीठ सोडते. शेवटचे मीठ हायड्रोक्लोरिक ऍसिडमध्ये विरघळले गेले आणि परिणामी द्रावणात सिल्व्हर नायट्रेटचे द्रावण जोडले गेले. एक पांढरा वर्षाव तयार झाला. वर्णन केलेल्या प्रतिक्रियांसाठी समीकरणे लिहा.
26) ओझोनायझरमध्ये ऑक्सिजन इलेक्ट्रिक डिस्चार्जच्या संपर्कात होता. परिणामी वायू पोटॅशियम आयोडाइडच्या जलीय द्रावणातून जातो आणि एक नवीन वायू, रंगहीन आणि गंधहीन, बाहेर पडतो, ज्वलन आणि श्वासोच्छवासास आधार देतो. नंतरच्या वायूच्या वातावरणात, सोडियम जाळला गेला आणि परिणामी घन कार्बन डाय ऑक्साईडवर प्रतिक्रिया देत असे. वर्णन केलेल्या प्रतिक्रियांसाठी समीकरणे लिहा.
मी अ गट.
1. N 2 + O 2 ![]() २ नाही
२ नाही
2NO + O 2 = 2NO 2
2NO 2 + 2NaOH = NaNO 3 + NaNO 2 + H 2 O
2NaNO 3 2NaNO 2 + O 2
2. 2NaCl ![]() 2Na + Cl2
2Na + Cl2
एनोड येथे कॅथोड येथे
2Na + O 2 = Na 2 O 2
2Na 2 O 2 + 2CO 2 = 2Na 2 CO 3 + O 2
Na 2 CO 3 + 2NH 4 Cl = 2NaCl + CO 2 + 2NH 3 + H 2 O
3. NaHCO 3 + HNO 3 = NaNO 3 + CO 2 + H 2 O
2NaNO 3 2NaNO 2 + O 2
5NaNO 2 + 2KMnO 4 + 3H 2 SO 4 = 5NaNO 3 + 2MnSO 4 + K 2 SO 4 + 3H 2 O
NaNO 3 + 4Zn + 7NaOH + 6H 2 O = 4Na 2 + NH 3
4. 2H2O + 2NaI ![]() H 2 + 2NaOH + I 2
H 2 + 2NaOH + I 2
2K + I 2 = 2KI
8KI + 5H 2 SO 4 (conc.) = 4K 2 SO 4 + H 2 S + 4I 2 + 4H 2 O
3H 2 S + 2K 2 CrO 4 + 2H 2 O = 2Cr(OH) 3 ↓ + 3S↓ + 4KOH
5. 2NaCl ![]() 2Na + Cl2
2Na + Cl2
एनोड येथे कॅथोड येथे
2Na + O 2 = Na 2 O 2
Na 2 O 2 + SO 2 = Na 2 SO 4
Na 2 SO 4 + Ba(OH) 2 = BaSO 4 ↓ + 2NaOH
6. P 4 + 3KOH + 3H 2 O = 3KH 2 PO 2 + PH 3
2PH 3 + 4O 2 = P 2 O 5 + 3H 2 O
P 2 O 5 + 4NaOH = 2Na 2 HPO 4 + H 2 O


