14.08.2019
Kādas vispārīgās īpašības piemīt metālu ķīmiskajiem elementiem? Metāli kā ķīmiskie elementi
Jau no agras bērnības saskaramies ar frāzi, ka tāds un tāds priekšmets ir no metāla. Kas ir metāls?
Metāli ir noteikta ķīmisko elementu grupa (kā arī to sakausējumi), kam piemīt visai grupai kopīgas īpašības, piemēram, paaugstināta izturība, laba siltumvadītspēja un elektrovadītspēja, kaļamība, lokanība un metālisks spīdums.
Gandrīz 80% no visiem zināmajiem ķīmiskajiem elementiem (96 no 118) pieder pie metāliem.
Metālu fizikālās īpašības
Visi metāli, izņemot dzīvsudrabu, normālos apstākļos ir cietā stāvoklī. Cietības ziņā mīkstākais metāls ir cēzijs (0,2 punkti pēc 10 ballu Mosa skalas). Visgrūtākais ir volframs. Tās cietība ir 6 punkti. Dzelzs cietība - 4 balles.
Metālu kušanas temperatūra (pāreja uz šķidru stāvokli) atšķiras: no -39º dzīvsudrabam līdz 3410º volframam. Visiem sārmu metāliem ir zems kušanas punkts, un izplatītākie ir alva un svins. Tos var izkausēt pat mājās uz gāzes degļa. Lielākā daļa metālu tiek izkausēti īpašās krāsnīs augstā temperatūrā.
Tā kā metālu kristālrežģos ir brīvi mobilie elektroni, tie visi ļoti labi vada elektrību un siltumu. Labākie metāla elektrības vadītāji ir sudrabs, varš un alumīnijs. Nav nejaušība, ka elektrības vadi ir izgatavoti no pēdējiem diviem metāliem.
Arī ikdienā bieži sastopamies ar metālu lielisko siltumvadītspēju. Lai uzvārītu ūdeni, mēs to ielejam metāla pannā un novietojam uz plīts. Sildelements silda metālu, un metāls gandrīz visu siltumenerģiju nodod ūdenim.
Metālu ķīmiskās īpašības
Ķīmisko reakciju laikā visi metāli viegli atsakās no elektroniem un darbojas kā reducētāji.
Gandrīz visi metāli tiek oksidēti ar skābekli. Sārmu metāli (litijs, kalcijs) normālos apstākļos mijiedarbojas ar skābekli. Citu metālu oksidēšanai ar skābekli nepieciešama paaugstināta temperatūra. Piemēram, ja karsējat vara stiepli virs uguns, varš reaģēs ar skābekli no gaisa un pārklājas ar melnu plēvi (vara oksīdu):
- 2Сu +O 2 → 2CuO
Zelts un platīns nereaģē ar skābekli.
Citi oksidētāji ir hlors un sērs, kas reaģē ar metāliem. Ja sajaucat dzelzs skaidas un sēra pulveri un karsējat maisījumu, mūsu acu priekšā jūs saņemsit dzelzs sulfīdu:
- Fe +S → FeS
Dažādu metālu reducējošā aktivitāte ir atšķirīga. Atbilstoši to darbībai metāli tiek sadalīti šādi:
- Li - K - Ba - Sr - Ca - Na - Mg - Al - Mn - Zn - Cr - Fe - Ca - Co - Ni - Sn - Pb - (H2) - Cu - Hg - Ag - Pt - Au.
Jo tālāk pa kreisi metāls atrodas šajā rindā, jo aktīvāks tas ir. Iepriekšējais elements var izspiest metālu, kas atrodas pa labi. Piemēram, ja dzelzs gabalu ievieto mēģenē ar vara sulfāta šķīdumu, tas tiks pārklāts ar brūnu pārklājumu (vara plēvi):
- Fe + CuSO4 → FeSO4 + Cu
Metāli, kas atrodas pa kreisi no ūdeņraža (H2), var to izspiest no sālsskābes. Iemetot cinka gabalu sālsskābē, sāks izdalīties ūdeņradis:
- HCl + Zn → ZnCl2 + H2
Sārmu metāli viegli reaģē ar ūdeni. Ja jūs ievietojat nātrija gabalu ūdens traukā, ūdeņradis sāks aktīvi attīstīties un veidosies sārms:
- 2Na + 2H2O → 2NaOH + H2
Metālu pielietojums
Pateicoties jūsu labvēlīgās īpašības metāli ir stingri ienākuši cilvēka dzīvē. Cilvēks izmanto metālu stiprību, veidojot no tiem ēku karkasus (no maziem paviljoniem līdz milzīgiem debesskrāpjiem), mašīnu korpusus (mašīnas, karietes, kuģus, darbgaldus), kā arī dažādu instrumentu darba daļas.
Definīcija
Atrodoties dabā
Metālu īpašības
Raksturīgās īpašības metāli
Fizikālās īpašības metāli
Metālu ķīmiskās īpašības
Mikroskopiskā struktūra
Sārmu metāli
Sārmu metālu vispārīgās īpašības
Sārmu metālu ķīmiskās īpašības
Sārmu metālu sagatavošana
Hidroksīdi
Karbonāti
Rubidijs
Sārmzemju metāli
Kalcijs
Stroncijs
Pārejas metāli
Pārejas elementu vispārīgie raksturojumi
Metālu pielietojums
Būvmateriāli
Elektriskie materiāli
Instrumentu materiāli
Stāsts
Kalnrūpniecība metalurģija
Metāls ir(nosaukums cēlies no latīņu valodas metalum - raktuves) - elementu grupa ar raksturīgām metāliskām īpašībām, piemēram, augstu siltumvadītspēju un elektrisko vadītspēju, pozitīvu temperatūras pretestības koeficientu, augstu elastību utt. Aptuveni 70% no visiem ķīmiskajiem elementiem pieder pie metāliem .
Metāls ir











![]()





















![]()


![]()





Atrodoties dabā
Lielākā daļa metālu dabā atrodas rūdu un savienojumu veidā. Tie veido oksīdus, sulfīdus, karbonātus un citus ķīmiskus savienojumus. Lai iegūtu tīrus metālus un to tālāku izmantošanu, nepieciešams tos izolēt no rūdām un veikt attīrīšanu. Ja nepieciešams, tiek veikta metālu leģēšana un cita apstrāde. Zinātne to pēta metalurģija. Metalurģija izšķir melno metālu rūdas (pamatojoties uz dziedzeris) un krāsains (tie neietver dzelzs, kopā aptuveni 70 elementi). , un platīns arī ir dārgmetāli. Turklāt tie ir sastopami nelielos daudzumos jūras ūdens, augi, dzīvi organismi (spēlē nozīmīgu lomu).
Ir zināms, ka cilvēka ķermenis sastāv no 3% metālu. Lielākā daļa mūsu šūnu satur koncentrētu kalciju un nātriju limfātiskās sistēmas. Magnijs uzkrājas muskuļos un nervu sistēma, varš- aknās, - asinīs.
Metālu īpašības
Metāls ir
Metālu raksturīgās īpašības
Metāla spīdums (izņemot jodu un oglekli grafīta formā. Neskatoties uz metālisko spīdumu, kristāliskais jods un grafīts ir nemetāli.)
Laba elektrovadītspēja (izņemot oglekli.)
Vienkāršas apstrādes iespēja.
Augsts blīvums (parasti metāli ir smagāki par nemetāliem).
Augsta kušanas temperatūra (izņēmumi: dzīvsudrabs, gallijs un sārmu metāli.)
Lieliska siltumvadītspēja
Tie vienmēr ir reducējoši aģenti reakcijās.
Metālu fizikālās īpašības
Visi metāli (izņemot dzīvsudrabu un nosacīti) normālos apstākļos ir cietā stāvoklī, taču tiem ir atšķirīga cietība. Tādējādi sārmu metālus viegli sagriež ar virtuves nazi, un tādi metāli kā vanādijs, volframs un hroms viegli saskrāpē cietāko stiklu. Zemāk ir dažu metālu cietība pēc Mosa skalas.
Kušanas temperatūras diapazons ir no –39 °C (dzīvsudrabs) līdz 3410 °C (volframam). Lielākajai daļai metālu (izņemot sārmus) kušanas temperatūra ir augsta, bet daži "parastie" metāli, piem. skārda Un svins, var izkausēt uz parastās elektriskās vai gāzes plīts.
Atkarībā no to blīvuma metālus iedala vieglajos (blīvums 0,53 h 5 g/cm³) un smagajos (5 h 22,5 g/cm³). Vieglākais metāls ir litijs (blīvums 0,53 g/cm³). Pašlaik nav iespējams nosaukt smagāko metālu, jo osmija un irīdija - divu smagāko metālu - blīvums ir gandrīz vienāds (apmēram 22,6 g/cm3 - tieši divreiz lielāks blīvums). svins), un aprēķināt to precīzu blīvumu ir ārkārtīgi grūti: lai to izdarītu, metāli ir pilnībā jāattīra, jo visi piemaisījumi samazina to blīvumu.
Lielākā daļa metālu ir kaļami, kas nozīmē, ka metāla stiepli var saliekt, nesalaužot. Tas notiek metāla atomu slāņu pārvietošanās dēļ, nepārtraucot saikni starp tiem. Elastīgākie ir zelts, Sudrabs Un varš. No zelts iespējams izgatavot 0,003 mm biezu foliju, ko izmanto komercpreču apzeltīšanai. Tomēr ne visi metāli ir kaļami. Vads no cinks vai skārda kraukšķina, kad saliekts; Deformējoties, mangāns un bismuts gandrīz nemaz neliecas, bet uzreiz saplīst. Plastiskums ir atkarīgs arī no metāla tīrības; Tādējādi ļoti tīrs hroms ir ļoti elastīgs, bet, piesārņots ar pat nelieliem piemaisījumiem, tas kļūst trausls un cietāks.
Visi metāli labi vada elektrību; tas ir saistīts ar mobilo elektronu klātbūtni to kristālrežģos, kas pārvietojas elektriskā lauka ietekmē. Sudrabs, vara un alumīnija ir visaugstākā elektriskā vadītspēja; šī iemesla dēļ pēdējie divi metāli visbiežāk tiek izmantoti kā stiepļu materiāli. Nātrijam ir arī ļoti augsta elektrovadītspēja; eksperimentālajās iekārtās ir zināmi mēģinājumi izmantot nātrija vadītājus plānsienu cauruļu veidā, kas izgatavotas no no nerūsējošā tērauda pildīts ar nātriju. Nātrija zemā īpatnējā svara dēļ ar vienādu pretestību nātrija “vadi” ir daudz vieglāki par varu un pat nedaudz vieglāki par alumīniju.
Metālu augstā siltumvadītspēja ir atkarīga arī no brīvo elektronu mobilitātes. Tāpēc siltumvadītspējas virkne ir līdzīga elektrovadītspējas virknei, un ir labākais siltuma, kā arī elektrības vadītājs. Nātrijs tiek izmantots arī kā labs siltuma vadītājs; Plaši zināms, piemēram, ka nātriju izmanto automobiļu dzinēju vārstos, lai uzlabotu to dzesēšanu.
Metālu gludā virsma atstaro daudz gaismas – šo parādību sauc par metālisku spīdumu. Tomēr, kad tie ir pulvera veidā, lielākā daļa metālu zaudē savu spīdumu; alumīnija un magnijs tomēr saglabā savu spīdumu pat pulverī. Sudrabs un sudrabs vislabāk atstaro gaismu - no šiem metāliem tiek izgatavoti spoguļi. Rodiju dažreiz izmanto spoguļu izgatavošanai, neskatoties uz tā ārkārtīgi augsto cenu: tā daudz lielākas cietības un ķīmiskās izturības dēļ nekā sudrabam vai pat pallādijam, rodija slānis var būt daudz plānāks nekā sudraba slānis.
Lielākajai daļai metālu krāsa ir aptuveni vienāda - gaiši pelēka ar zilganu nokrāsu. , varš un cēzijs ir attiecīgi dzelteni, sarkani un gaiši dzelteni.
Metālu ķīmiskās īpašības
Metāls ir
Lielākajai daļai metālu ārējā elektronu slānī ir neliels skaits elektronu (1-3), tāpēc lielākajā daļā reakciju tie darbojas kā reducējoši aģenti (tas ir, tie “ziedo” savus elektronus).
1. Reakcijas ar vienkāršām vielām
Visi metāli, izņemot zeltu un platīnu, reaģē ar skābekli. Reakcija ar sudrabu notiek augstā temperatūrā, bet sudraba (II) oksīds praktiski neveidojas, jo tas ir termiski nestabils. Atkarībā no metāla izvade var ietvert oksīdus, peroksīdus un superoksīdus:
4Li + O2 = 2Li2O litija oksīds
2Na + O2 = Na2O2 nātrija peroksīds
K + O2 = KO2 kālija superoksīds
Lai no peroksīda iegūtu oksīdu, peroksīdu reducē ar metālu:
Na2O2 + 2Na = 2Na2O
Ar vidēji un zemi aktīviem metāliem reakcija notiek karsējot:
3Fe + 2O2 = Fe3O4
Ar slāpekli reaģē tikai aktīvākie metāli; istabas temperatūrā reaģē tikai litijs, veidojot nitrīdus:
6Li + N2 = 2Li3N
Sildot:
3Ca + N2 = Ca3N2
Visi metāli reaģē ar sēru, izņemot zeltu un platīns:
Dzelzs mijiedarbojas ar pelēks karsējot, veidojas sulfīds:
Tikai aktīvākie metāli, tas ir, IA un IIA grupu metāli, izņemot Be, reaģē ar ūdeņradi. Sildot, notiek reakcijas un veidojas hidrīdi. Reakcijās metāls darbojas kā reducētājs, ūdeņraža oksidācijas pakāpe ir –1:
Tikai aktīvākie metāli reaģē ar oglekli. Šajā gadījumā veidojas acetilēni vai metanīdi. Reaģējot ar ūdeni, acetilidi dod acetilēnu, metanīdi dod metānu.
2Na + 2C = Na2C2
Na2C2 + 2H2O = 2NaOH + C2H2
Leģēšana ir papildu elementu ievadīšana kausējumā, kas maina mehānisko, fizisko un Ķīmiskās īpašības galvenais materiāls.
Mikroskopiskā struktūra
Metālu raksturīgās īpašības var saprast, pamatojoties uz to iekšējā struktūra. Visiem tiem ir vājš ārējā enerģijas līmeņa elektronu (citiem vārdiem sakot, valences elektronu) savienojums ar kodolu. Sakarā ar to radītā potenciālu starpība vadītājā izraisa lavīnai līdzīgu elektronu (ko sauc par vadīšanas elektroniem) kustību kristāla režģī. Šādu elektronu kopumu bieži sauc par elektronu gāzi. Papildus elektroniem siltumvadītspēju veicina fononi (režģa vibrācijas). Plastiskums ir saistīts ar zemu enerģijas barjeru dislokāciju kustībai un kristalogrāfisko plakņu bīdei. Cietība ir izskaidrojama ar lielu skaitu struktūras defektu (intersticiālie atomi utt.).
Pateicoties vieglai elektronu atbrīvošanai, iespējama metālu oksidēšanās, kas var izraisīt koroziju un turpmāku īpašību pasliktināšanos. Oksidēšanās spēju var atpazīt pēc metālu standarta aktivitāšu sērijas. Šis fakts apstiprina nepieciešamību izmantot metālus kombinācijā ar citiem elementiem (sakausējums, no kuriem vissvarīgākais ir tērauda), to sakausēšana un dažādu pārklājumu izmantošana.
Pareizākam metālu elektronisko īpašību aprakstam ir jāizmanto kvantu mehānika. Visās cietās vielās ar pietiekamu simetriju atsevišķu atomu elektronu enerģijas līmeņi pārklājas un veido atļautās joslas, un valences elektronu veidoto joslu sauc par valences joslu. Vājais valences elektronu savienojums metālos noved pie tā, ka valences josla metālos ir ļoti plaša, un ar visiem valences elektroniem nepietiek, lai to pilnībā aizpildītu.
Šādas daļēji piepildītas zonas galvenā iezīme ir tāda, ka pat pie minimāla pielietotā sprieguma paraugā sākas valences elektronu pārkārtošanās, t.i., plūst elektriskā strāva.
Tā pati augstā elektronu mobilitāte rada augstu siltumvadītspēju, kā arī spēju spoži atspoguļot elektromagnētisko starojumu (kas piešķir metāliem raksturīgo spīdumu).
Sārmu metāli
Metāls ir
Sārmu metāli ir D. I. Dmitrija Ivanoviča Mendeļejeva ķīmisko elementu periodiskās tabulas I grupas galvenās apakšgrupas elementi: litijs Li, nātrijs Na, kālijs K, rubīdijs Rb, cēzijs Cs un francijs Fr. Šos metālus sauc par sārma metāliem, jo lielākā daļa to savienojumu šķīst ūdenī. Slāvu valodā “izskalošanās” nozīmē “izšķīdināt”, kas noteica šīs metālu grupas nosaukumu. Kad sārmu metāli tiek izšķīdināti ūdenī, veidojas šķīstoši hidroksīdi, ko sauc par sārmiem.
Sārmu metālu vispārīgās īpašības
Periodiskajā tabulā tie uzreiz seko cēlgāzēm, tāpēc sārmu metālu atomu struktūras īpatnība ir tāda, ka tie satur vienu elektronu jaunā enerģijas līmenī: to elektronu konfigurācija ns1. Acīmredzot sārmu metālu valences elektronus var viegli noņemt, jo atomam ir enerģētiski labvēlīgi atteikties no elektrona un iegūt inertās gāzes konfigurāciju. Tāpēc visiem sārmu metāliem ir raksturīgas reducējošas īpašības. To apstiprina to zemās jonizācijas potenciāla vērtības (cēzija atoma jonizācijas potenciāls ir viens no zemākajiem) un elektronegativitāte (EO).
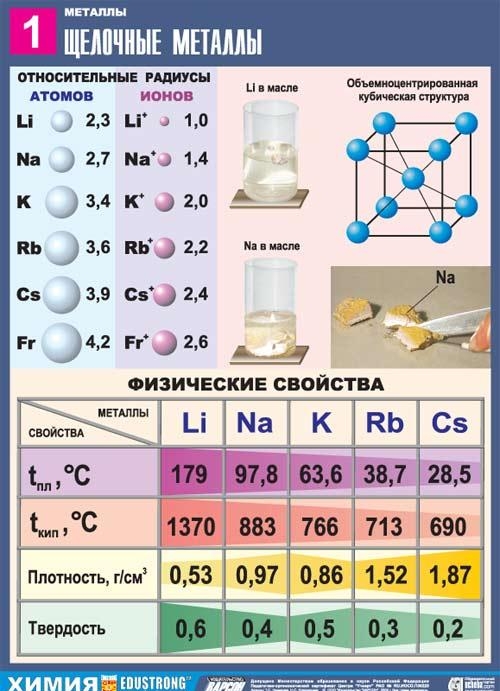
Visi šīs apakšgrupas metāli ir sudrabaini baltā krāsā (izņemot sudrabaini dzelteno cēziju), tie ir ļoti mīksti, tos var griezt ar skalpeli. Litijs, nātrijs un kālijs ir vieglāki par ūdeni un peld uz tā virsmas, reaģējot ar to.
Sārmu metāli dabā sastopami savienojumu veidā, kas satur atsevišķi lādētus katjonus. Daudzi minerāli satur I grupas galvenās apakšgrupas metālus. Piemēram, ortoklāze jeb laukšpats sastāv no kālija aluminosilikāta K2, līdzīga minerāls kas satur nātriju - albītu - satur Na2 sastāvu. Jūras ūdens satur nātrija hlorīdu NaCl, un augsnē ir kālija sāļi - silvins KCl, silvinīts NaCl. KCl, karnalīts KCl. MgCl2. 6H2O, polihalīts K2SO4. MgSO4. CaSO4. 2H2O.
Sārmu metālu ķīmiskās īpašības
Metāls ir
Tā kā sārmu metāliem ir augsta ķīmiskā aktivitāte attiecībā pret ūdeni, skābekli un slāpekli, tie tiek uzglabāti zem petrolejas slāņa. Lai veiktu reakciju ar sārmu metālu, zem slāņa rūpīgi nogriež vajadzīgā izmēra gabalu ar skalpeli. petroleja, argona atmosfērā metāla virsmu rūpīgi attīra no tā mijiedarbības produktiem ar gaisu un tikai tad paraugu ievieto reakcijas traukā.
1. Mijiedarbība ar ūdeni. Svarīga sārmu metālu īpašība ir to augstā aktivitāte pret ūdeni. Litijs vismierīgāk (bez sprādziena) reaģē ar ūdeni.
Veicot līdzīgu reakciju, nātrijs sadedzina ar dzeltenu liesmu un notiek neliels sprādziens. Kālijs ir vēl aktīvāks: šajā gadījumā sprādziens ir daudz spēcīgāks, un liesma ir violeta.
2. Mijiedarbība ar skābekli. Sārmu metālu sadegšanas produktiem gaisā ir dažāds sastāvs atkarībā no metāla aktivitātes.
Tikai litijs sadeg gaisā, veidojot stehiometriska sastāva oksīdu.
Nātrija degšanas laikā Na2O2 peroksīds galvenokārt veidojas ar nelielu NaO2 superoksīda piejaukumu.
Kālija, rubīdija un cēzija sadegšanas produkti satur galvenokārt superoksīdus.
Lai iegūtu nātrija un kālija oksīdus, hidroksīda, peroksīda vai superoksīda maisījumus ar metāla pārpalikumu karsē bez skābekļa.
Sārmu metālu skābekļa savienojumiem raksturīgs šāds modelis: palielinoties sārmu metālu katjona rādiusam, palielinās peroksīda jonu O22 un superoksīda jonu O2- saturošu skābekļa savienojumu stabilitāte.
Smagajiem sārmu metāliem ir raksturīga diezgan stabilu ozonīdu veidošanās ar sastāvu EO3. Visiem skābekļa savienojumiem ir dažādas krāsas, kuru intensitāte padziļinās sērijā no Li līdz Cs.
Sārmu metālu oksīdiem piemīt visas bāzes oksīdu īpašības: tie reaģē ar ūdeni, skābiem oksīdiem un skābēm.
Peroksīdiem un superoksīdiem piemīt spēcīgu oksidētāju īpašības.
Peroksīdi un superoksīdi intensīvi mijiedarbojas ar ūdeni, veidojot hidroksīdus.
3. Mijiedarbība ar citām vielām. Sārmu metāli reaģē ar daudziem nemetāliem. Sildot, tie savienojas ar ūdeņradi, veidojot hidrīdus, halogēnus, pelēks, slāpekli, fosforu, oglekli un silīciju, lai veidotu attiecīgi halogenīdus, sulfīdus, nitrīdus, fosfīdus, karbīdus un silicīdus.
Sildot, sārmu metāli spēj reaģēt ar citiem metāliem, veidojot intermetāliskus savienojumus. Sārmu metāli aktīvi (sprādzienbīstami) reaģē ar skābēm.
Sārmu metāli izšķīst šķidrā amonjakā un tā atvasinājumi - amīni un amīdi.
Izšķīdinot šķidrā amonjakā sārmu metāls zaudē elektronu, ko solvatē amonjaka molekulas un piešķir šķīdumam zilu krāsu. Iegūtos amīdus viegli sadala ūdens, veidojot sārmu un amonjaku.
Sārmu metāli mijiedarbojas ar organiskām vielām, spirtiem (veidojot alkoholātus) un karbonskābēm (veidojot sāļus).
4. Sārmu metālu kvalitatīva noteikšana. Tā kā sārmu metālu jonizācijas potenciāls ir mazs, metālu vai tā savienojumus karsējot liesmā, atoms tiek jonizēts, iekrāsojot liesmu noteiktā krāsā.
Sārmu metālu sagatavošana
1. Sārmu metālu iegūšanai viņi galvenokārt izmanto to halogenīdu kausējumu elektrolīzi, visbiežāk hlorīdus, kas veido dabiskos minerālvielas:
katods: Li+ + e → Li
anods: 2Cl- — 2e → Cl2
2. Dažreiz, lai iegūtu sārmu metālus, tiek veikta to hidroksīdu kausējumu elektrolīze:
katods: Na+ + e → Na
anods: 4OH- – 4e → 2H2O + O2
Tā kā sārmu metāli atrodas pa kreisi no ūdeņraža elektroķīmiskā sprieguma rindā, to elektrolītiskā sagatavošana no sāls šķīdumiem nav iespējama; šajā gadījumā veidojas attiecīgie sārmi un ūdeņradis.
Hidroksīdi
Sārmu metālu hidroksīdu iegūšanai galvenokārt izmanto elektrolītiskās metodes. Vislielākā apjoma ražošana ir nātrija hidroksīda ražošana ar koncentrēta galda sāls ūdens šķīduma elektrolīzi.
Iepriekš sārmi tika iegūti apmaiņas reakcijā.
Šādā veidā iegūtais sārms bija stipri piesārņots ar Na2CO3 soda.
Sārmu metālu hidroksīdi ir baltas higroskopiskas vielas, kuru ūdens šķīdumi ir spēcīgas bāzes. Tās piedalās visās bāzēm raksturīgajās reakcijās – reaģē ar skābēm, skābiem un amfoteriskajiem oksīdiem un amfoteriskajiem hidroksīdiem.
Sildot, sārmu metālu hidroksīdi sublimējas bez sadalīšanās, izņemot litija hidroksīdu, kas, tāpat kā II grupas galvenās apakšgrupas metālu hidroksīdi, kalcinējot sadalās oksīdā un ūdenī.
Nātrija hidroksīdu izmanto ziepju, sintētisko mazgāšanas līdzekļu, mākslīgo šķiedru un organisko savienojumu, piemēram, fenola, ražošanai.
Karbonāti
Svarīgs produkts, kas satur sārmu metālu, ir soda Na2CO3. Lielākā daļa sodas visā pasaulē tiek ražota, izmantojot Solvay metodi, kas tika ierosināta 20. gadsimta sākumā. Metodes būtība ir šāda: NaCl ūdens šķīdums, kuram pievienots amonjaks, tiek piesātināts ar oglekļa dioksīdu 26 - 30 °C temperatūrā. Tas rada nedaudz šķīstošu nātrija bikarbonātu, ko sauc par cepamo sodu.
Amonjaks tiek pievienots, lai neitralizētu skābo vidi, kas rodas, kad šķīdumā tiek ievadīts oglekļa dioksīds, un lai iegūtu bikarbonāta jonu HCO3, kas nepieciešams nātrija bikarbonāta nogulsnēšanai. Pēc cepamās sodas atdalīšanas amonija hlorīdu saturošo šķīdumu karsē ar kaļķi un izdalās amonjaks, kas tiek atgriezts reakcijas zonā.
Tādējādi ar amonjaka metodi sodas iegūšanai vienīgais atkritums ir kalcija hlorīds, kas paliek šķīdumā un kam ir ierobežota izmantošana.
Nātrija bikarbonātu kalcinējot, rodas sodas jeb mazgāšanas soda, Na2CO3 un oglekļa dioksīds, ko izmanto nātrija bikarbonāta ražošanas procesā.
Galvenais sodas pircējs ir stikls.
Atšķirībā no slikti šķīstošā skābes sāls NaHCO3, kālija bikarbonāts KHCO3 labi šķīst ūdenī, tāpēc kālija karbonāts jeb potašs K2CO3 tiek iegūts, oglekļa dioksīdam iedarbojoties uz kālija hidroksīda šķīdumu.
Potašu izmanto stikla un šķidro ziepju ražošanā.
Litijs ir vienīgais sārmu metāls, kuram nav iegūts bikarbonāts. Šīs parādības iemesls ir ļoti mazais litija jona rādiuss, kas neļauj tam saglabāt diezgan lielo HCO3- jonu.
Litijs
Metāls ir
Litijs ir pirmās grupas galvenās apakšgrupas elements, ķīmisko elementu periodiskās tabulas otrais periods D.I. Mendeļejevs Dmitrijs Ivanovičs, ar atomskaitli 3. Apzīmē ar simbolu Li (lat. Lithium). Elementārā viela litijs (CAS numurs: 7439-93-2) ir mīksts sārmu metāls ar sudrabaini baltu krāsu.
Litiju 1817. gadā atklāja zviedru ķīmiķis un mineralogs A. Arfvedsons, vispirms minerālā petalītā (Li,Na), pēc tam spodumēnā LiAl un lepidolītā KLi1.5Al1.5(F,OH)2. Litija metālu pirmo reizi atklāja Hamfrijs Deivijs 1825. gadā.
Litijs saņēma savu nosaukumu tāpēc, ka tas tika atklāts “akmeņos” (grieķu λίθος - akmens). Sākotnēji saukts par "lition", mūsdienu nosaukumu ierosināja Berzēliuss.
Litijs ir sudrabaini balts metāls, mīksts un elastīgs, cietāks par nātriju, bet mīkstāks par svinu. To var apstrādāt presējot un velmējot.
Istabas temperatūrā litija metālam ir uz ķermeni centrēts kubiskais režģis (koordinācijas numurs 8), kas aukstā apstrādē pārvēršas kubiskā cieši saspiestā režģī, kur katru atomu, kuram ir dubultā kuboktaedriska koordinācija, ieskauj 12 citi. Zem 78 K stabilā kristāla forma ir sešstūraina cieši iesaiņota struktūra, kurā katram litija atomam ir 12 tuvākie kaimiņi, kas atrodas kuboktaedra virsotnēs.
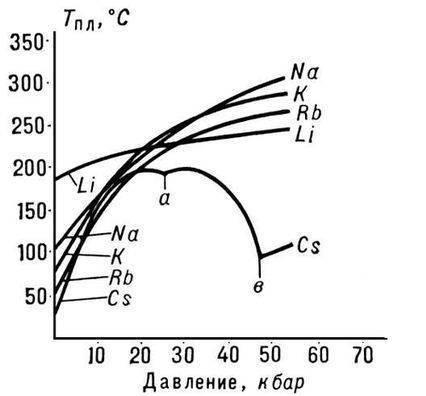
No visiem sārmu metāliem litijam ir visaugstākā kušanas un viršanas temperatūra (attiecīgi 180,54 un 1340 °C), un tam ir viszemākais blīvums istabas temperatūrā no visiem metāliem (0,533 g/cm3, gandrīz puse no ūdens blīvuma).
Litija atoma mazais izmērs izraisa īpašu metāla īpašību parādīšanos. Piemēram, tas sajaucas ar nātriju tikai temperatūrā, kas zemāka par 380 ° C, un nesajaucas ar izkausētu kāliju, rubīdiju un cēziju, savukārt citi sārmu metālu pāri sajaucas savā starpā jebkurā attiecībā.
Sārmu metāls, nestabils gaisā. Litijs ir vismazāk aktīvais sārmu metāls, tas praktiski nereaģē ar sausu gaisu (un pat sausu skābekli) istabas temperatūrā.
Mitrā gaisā tas lēnām oksidējas, pārvēršoties Li3N nitrīdā, LiOH hidroksīdā un Li2CO3 karbonātā. Karsējot skābeklī, tas sadeg, pārvēršoties oksīdā Li2O. Interesanta ir tā, ka temperatūras diapazonā no 100 °C līdz 300 °C litijs pārklājas ar blīvu oksīda plēvi un tālāk neoksidējas.
1818. gadā vācu ķīmiķis Leopolds Gmelins konstatēja, ka litijs un tā sāļi iekrāso liesmu karmīna sarkanā krāsā, kas ir kvalitatīva zīme litija noteikšanai. Degšanas temperatūra ir aptuveni 300 °C. Degšanas produkti kairina nazofarneksa gļotādu.
Mierīgi, bez sprādziena vai uguns reaģē ar ūdeni, veidojot LiOH un H2. Tas reaģē arī ar etilspirtu, veidojot alkoholātu, ar amonjaku un halogēniem (ar jodu - tikai karsējot).
Litijs tiek uzglabāts petrolēterī, parafīnā, benzīnā un/vai minerāleļļā hermētiski noslēgtās skārda kastēs. Litija metāls izraisa apdegumus, ja tas nonāk saskarē ar ādu, gļotādām un acīm.
Melnajā un krāsainajā metalurģijā litiju izmanto, lai deoksidētu un palielinātu sakausējumu elastību un izturību. Litiju dažreiz izmanto retu metālu atgūšanai, izmantojot metalotermijas metodes.
Litija karbonāts ir nozīmīgākā palīgviela (pievienota elektrolītam) alumīnija kausēšanā un tās patēriņš katru gadu pieaug proporcionāli pasaules alumīnija ražošanas apjomam (litija karbonāta patēriņš ir 2,5-3,5 kg uz tonnu kausētā alumīnija).
Litija sakausējumi ar sudrabu un zeltu, kā arī vara ir ļoti efektīvi lodmetāli. Litija sakausējumi ar magniju, skandiju, vara, kadmiju un alumīniju ir jauni daudzsološi materiāli aviācijā un astronautikā. Pamatojoties uz litija aluminātu un silikātu, ir radīta keramika, kas sacietē istabas temperatūrā un tiek izmantota militārajā tehnoloģijā, metalurģijā un nākotnē arī kodolenerģētikā. Stiklam, kas izgatavots no litija alumīnija silikāta, kas stiprināts ar silīcija karbīda šķiedrām, ir milzīga izturība. Litijs ļoti efektīvi stiprina svina sakausējumus un piešķir tiem elastību un izturību pret koroziju.
Litija sāļiem ir psihotropa iedarbība, un tos izmanto medicīnā vairāku garīgu slimību profilaksei un ārstēšanai. Visizplatītākais šī materiāla veids ir litija karbonāts. izmanto psihiatrijā, lai stabilizētu garastāvokli cilvēkiem, kuri cieš no bipolāriem traucējumiem un biežām garastāvokļa svārstībām. Tas ir efektīvs mānijas depresijas profilaksē un samazina pašnāvību.Ārsti vairākkārt ir novērojuši, ka atsevišķi litija savienojumi (protams, atbilstošās devās) pozitīvi ietekmē pacientus, kuri cieš no maniakālās depresijas. Šo efektu var izskaidrot divējādi. No vienas puses, ir konstatēts, ka litijs spēj regulēt dažu enzīmu darbību, kas iesaistīti nātrija un kālija jonu pārnešanā no starpšūnu šķidruma uz smadzeņu šūnām. No otras puses, ir atzīmēts, ka litija joni tieši ietekmē šūnas jonu līdzsvaru. Un pacienta stāvoklis lielā mērā ir atkarīgs no nātrija un kālija līdzsvara: nātrija pārpalikums šūnās ir raksturīgs depresijas pacientiem, deficīts - tiem, kas cieš no mānijas. Izlīdzinot nātrija-kālija līdzsvaru, litija sāļi pozitīvi ietekmē abus.
Nātrijs
Metāls ir
Nātrijs ir pirmās, trešās grupas galvenās apakšgrupas elements periodāķīmisko elementu periodiskā tabula D.I. Dmitrijs Ivanovičs Mendeļejevs, ar atomskaitli 11. Apzīmē ar simbolu Na (lat. Natrium). Vienkāršā viela nātrijs (CAS numurs: 7440-23-5) ir mīksts sārmu metāls ar sudrabaini baltu krāsu.
Ūdenī nātrijs uzvedas gandrīz tāpat kā litijs: reakcija notiek ar ātru ūdeņraža izdalīšanos, un šķīdumā veidojas nātrija hidroksīds.
Nātrijs (pareizāk sakot, tā savienojumi) ir izmantots kopš seniem laikiem. Piemēram, soda (nātrons), kas dabiski atrodama sodas ezeru ūdeņos Ēģiptē. Senie ēģiptieši izmantoja dabisko sodu balzamēšanai, audekla balināšanai, ēdiena gatavošanai, kā arī krāsu un glazūru izgatavošanai. Plīnijs Vecākais raksta, ka Nīlas deltā soda (tā saturēja pietiekamu daudzumu piemaisījumu) tika izolēta no upes ūdens. Tas tika pārdots lielos gabaliņos, kas krāsoti pelēkā vai pat melnā krāsā ogļu piejaukuma dēļ.
Pirmo reizi nātriju ieguva angļu ķīmiķis Hamfrijs Deivijs 1807. gadā ar cieta NaOH elektrolīzi.
Nosaukums "nātrijs" (nātrijs) cēlies no arābu valodas natrun (grieķu valodā - nitron), un sākotnēji tas apzīmēja dabisko soda. Pats elements iepriekš tika saukts par nātriju (lat. Sodium).

Nātrijs ir sudrabaini balts metāls, plānās kārtās ar purpursarkanu nokrāsu, plastmasas, pat mīksts (viegli griežams ar nazi), svaigs nātrija griezums ir spīdīgs. Nātrija elektrovadītspējas un siltumvadītspējas vērtības ir diezgan augstas, blīvums ir 0,96842 g/cm3 (pie 19,7 ° C), kušanas temperatūra ir 97,86 ° C, viršanas temperatūra ir 883,15 ° C.
Sārmu metāls, kas viegli oksidējas gaisā. Lai aizsargātu pret atmosfēras skābekli, metāliskais nātrijs tiek uzglabāts zem slāņa petroleja. Nātrijs ir mazāk aktīvs nekā litijs, tāpēc tas reaģē ar slāpekli tikai karsējot:
Ja ir liels skābekļa pārpalikums, veidojas nātrija peroksīds
2Na + O2 = Na2O2
Nātrija metālu plaši izmanto preparatīvajā ķīmijā un nozare kā spēcīgs reducētājs, arī metalurģijā. Nātriju izmanto ļoti energoietilpīgu nātrija sēra akumulatoru ražošanā. To izmanto arī kravas automašīnu izplūdes vārstos kā siltuma izlietni. Reizēm nātrija metālu izmanto kā materiālu elektriskajiem vadiem, kas paredzēti ļoti lielu strāvu pārvadīšanai.
Sakausējumā ar kāliju, kā arī ar rubīdiju un cēziju to izmanto kā ļoti efektīvu dzesēšanas šķidrumu. Jo īpaši sakausējumam, kas sastāv no nātrija 12%, kālija 47%, cēzija 41%, ir rekordzems kušanas punkts –78 °C, un tas tika ierosināts kā darba šķidrums jonu raķešu dzinējiem un dzesēšanas šķidrums atomelektrostacijām.
Nātriju izmanto arī augstas un augstas gāzizlādes lampās. zems spiediens(NLVD un NLND). Ielu apgaismojumā ļoti plaši tiek izmantotas DNaT (Arc Sodium Tubular) tipa NLVD lampas. Tie izdala spilgti dzeltenu gaismu. HPS lampu kalpošanas laiks ir 12-24 tūkstoši stundu. Tāpēc HPS tipa gāzizlādes spuldzes ir neaizstājamas pilsētas, arhitektūras un rūpnieciskajā apgaismojumā. Ir arī lampas DNaS, DNaMT (Arc Sodium Matte), DNaZ (Arc Sodium Mirror) un DNaTBR (Arc Sodium Tubular bez dzīvsudraba).
Nātrija metāls tiek izmantots kvalitatīvajā analīzē organisko vielu. Nātrija un testējamās vielas sakausējumu neitralizē ar etanolu, pievieno dažus mililitrus destilēta ūdens un sadala 3 daļās, J. Lassenya (1843), kuras mērķis ir noteikt slāpekli, sēru un halogēnus ( mēģināt Beilšteins)
Nātrija hlorīds (galda sāls) ir vecākais izmantotais aromatizētājs un konservants.
Nātrija azīds (Na3N) tiek izmantots kā nitrīdēšanas līdzeklis metalurģijā un svina azīda ražošanā.
Nātrija cianīdu (NaCN) izmanto hidrometalurģiskajā metodē zelta izskalošanai no akmeņiem, kā arī tērauda nitrokarburizācijā un galvanizēšanā (sudrabošana, zeltīšana).
Nātrija hlorātu (NaClO3) izmanto, lai iznīcinātu nevēlamu veģetāciju uz dzelzceļa sliedēm.
Kālijs
Kālijs ir pirmās, ceturtās grupas galvenās apakšgrupas elements periodā periodiskā D.I.Mendeļejeva Dmitrija Ivanoviča ķīmisko elementu sistēma ar atomskaitli 19. Apzīmē ar simbolu K (lat. Kalium). Vienkāršā viela kālijs (CAS numurs: 7440-09-7) ir mīksts sārmu metāls ar sudrabaini baltu krāsu.
Dabā kālijs ir atrodams tikai kombinācijā ar citiem elementiem, piemēram, jūras ūdenī, kā arī daudzos minerālos. Tas ļoti ātri oksidējas gaisā un ļoti viegli nonāk ķīmiskās reakcijās, īpaši ar ūdeni, veidojot sārmu. Daudzos aspektos kālija ķīmiskās īpašības ir ļoti līdzīgas nātrijam, bet attiecībā uz bioloģiskā funkcija un kā tos izmanto dzīvo organismu šūnas, tie tomēr atšķiras.
Kālijs (precīzāk, tā savienojumi) ir izmantots kopš seniem laikiem. Tātad potaša (kas tika izmantots kā mazgāšanas līdzeklis) ražošana pastāvēja jau 11. gadsimtā. Pelni, kas radās, dedzinot salmus vai malku, tika apstrādāti ar ūdeni, un iegūtais šķīdums (sārms) pēc filtrēšanas tika iztvaicēts. Sausais atlikums papildus kālija karbonātam saturēja kālija sulfātu K2SO4, soda un kālija hlorīdu KCl.
1807. gadā angļu ķīmiķis Deivijs izolēja kāliju ar cietā kālija hidroksīda (KOH) elektrolīzi un nosauca to par "kāliju" (latīņu kālijs; šis nosaukums joprojām tiek lietots angļu, franču, spāņu, portugāļu un poļu valodā). 1809. gadā L. V. Gilberts ierosināja nosaukumu “kālijs” (latīņu kalium, no arābu valodas al-kali — potašs). Šis vārds tika iekļauts vācu, no turienes uz lielāko daļu Ziemeļeiropas un Austrumeiropas valodu (ieskaitot krievu valodu) un “uzvarēja”, izvēloties simbolu šim elementam - K.
Kālijs ir sudrabota viela ar raksturīgu spīdumu uz tikko izveidotas virsmas. Ļoti viegls un kausējams. Tas salīdzinoši labi šķīst dzīvsudrabā, veidojot amalgamas. Kad kāliju (kā arī tā savienojumus) pievieno degļa liesmai, tas iekrāso liesmu raksturīgā rozā violetā krāsā.
Kālijam, tāpat kā citiem sārmu metāliem, piemīt tipiskas metāliskas īpašības un tas ir ļoti ķīmiski aktīvs, viegli nododot elektronus.
Ir spēcīgs reducētājs. Tas tik aktīvi savienojas ar skābekli, ka veidojas nevis oksīds, bet gan kālija superoksīds KO2 (vai K2O4). Sildot ūdeņraža atmosfērā, veidojas kālija hidrīds KH. Tas labi mijiedarbojas ar visiem nemetāliem, veidojot halogenīdus, sulfīdus, nitrīdus, fosfīdus u.c., kā arī ar sarežģītām vielām, piemēram, ūdeni (reakcija notiek sprādzienbīstami), dažādiem oksīdiem un sāļiem. Šajā gadījumā tie reducē citus metālus brīvā stāvoklī.
Kālijs tiek uzglabāts zem petrolejas slāņa.
Kālija un nātrija sakausējums, šķidrs istabas temperatūrā, tiek izmantots kā dzesēšanas šķidrums slēgtās sistēmās, piemēram, ātro neitronu atomelektrostacijās. Turklāt plaši tiek izmantoti tā šķidrie sakausējumi ar rubīdiju un cēziju. Sakausējumam, kas sastāv no nātrija 12%, kālija 47%, cēzija 41%, ir rekordzema kušanas temperatūra -78 °C.
Kālija savienojumi ir vissvarīgākais biogēnais elements, un tāpēc tos izmanto kā mēslojumu.
Kālija sāļus plaši izmanto galvanizēšanā, jo, neskatoties uz to salīdzinoši augstajām izmaksām, tie bieži vien ir labāk šķīstoši nekā attiecīgie nātrija sāļi un tādējādi nodrošina intensīvu elektrolītu darbību pie palielināta strāvas blīvuma.
Kālijs ir vissvarīgākais biogēnais elements, īpaši augu pasaulē. Tā kā augsnē trūkst kālija, augi attīstās ļoti slikti un samazinās, tāpēc apmēram 90% iegūto kālija sāļu izmanto kā mēslojumu.
Kālijs kopā ar slāpekli un fosforu ir viena no galvenajām augu barības vielām. Kālija funkcija augos, tāpat kā citi tiem nepieciešamie elementi, ir stingri specifiska. Augos kālijs ir jonu formā. Kālijs galvenokārt atrodams šūnu citoplazmā un vakuolos. Apmēram 80% kālija ir atrodami šūnu sulā.
Kālija funkcijas ir ļoti dažādas. Konstatēts, ka tas stimulē normālu fotosintēzes gaitu, pastiprina ogļhidrātu aizplūšanu no lapu plāksnēm uz citiem orgāniem, kā arī cukuru sintēzi.
Kālijs veicina monosaharīdu uzkrāšanos augļu un dārzeņu kultūrās, palielina cukura saturu sakņu dārzeņos, cieti kartupeļos, sabiezina labības kultūru salmu šūnu sieniņas un palielina maizes izturību pret nogulsnēšanos, kā arī uzlabo šķiedrvielu kvalitāti lini un kaņepes.
Veicinot ogļhidrātu uzkrāšanos augu šūnās, kālijs paaugstina šūnu sulas osmotisko spiedienu un tādējādi paaugstina augu aukstumizturību un salizturību.
Kāliju augi uzsūc katjonu veidā un, protams, šādā veidā paliek šūnās, aktivizējot svarīgāko bioķīmisko vielu. procesi augu šūnās kālijs palielina to izturību pret dažādas slimības, gan veģetācijas periodā, gan pēc ražas novākšanas būtiski uzlabo augļu un dārzeņu turēšanas kvalitāti.
Kālija trūkums izraisa daudzus vielmaiņas traucējumus augos, tiek novājināta vairāku enzīmu darbība, tiek traucēta ogļhidrātu un olbaltumvielu vielmaiņa, izmaksas ogļhidrāti elpošanai. Tā rezultātā samazinās augu produktivitāte un samazinās produktu kvalitāte.



Rubidijs
Rubidijs ir D. I. Dmitrija Ivanoviča Mendeļejeva ķīmisko elementu periodiskās tabulas pirmās grupas galvenās apakšgrupas elements ar atomskaitli 37. To apzīmē ar simbolu Rb (lat. Rubidium). Vienkāršā viela rubīdijs (CAS numurs: 7440-17-7) ir mīksts sārmu metāls ar sudrabaini baltu krāsu.
1861. gadā vācu zinātnieki Roberts Vilhelms Bunsens un Gustavs Roberts Kirhhofs, pētot dabiskos aluminosilikātus, izmantojot spektrālo analīzi, atklāja tajos jaunu elementu, ko vēlāk nosauca par rubīdiju, pamatojoties uz spektra spēcīgāko līniju krāsu.
Rubidijs veido sudrabaini baltus mīkstus kristālus, kuriem pēc tikko griezta ir metālisks spīdums. Brinela cietība 0,2 MN/mI (0,02 kgf/mmI). Rubidija kristāliskais režģis ir kubiskā ķermeņa centrā, a = 5,71 E (istabas temperatūrā). Atomu rādiuss 2,48 E, Rb+ jonu rādiuss 1,49 E. Blīvums 1,525 g/cm (0 °C), kušanas temperatūra 38,9 °C, viršanas temperatūra 703 °C. Īpatnējā siltumietilpība 335,2 J/(kg K), lineārās izplešanās termiskais koeficients 9,0·10-5 deg-1 (0-38 °C), elastības modulis 2,4 H/mІ (240 kgf/mmI), īpatnējā tilpuma elektriskā pretestība 11,29 ·10-6 omi·cm (20 °C); Rubidijs ir paramagnētisks.
Sārmu metāls, ārkārtīgi nestabils gaisā (aizdedzinot reaģē ar gaisu ūdens pēdu klātbūtnē). Veido visu veidu sāļus - pārsvarā viegli šķīstošos (hlorāti un perhlorāti nedaudz šķīst). Rubidija hidroksīds ir ļoti agresīva viela pret stiklu un citiem konstrukcijas un konteineru materiāliem, un kausējot tas iznīcina lielāko daļu metālu (pat platīnu).
Rubīdija lietojums ir daudzveidīgs, un, neskatoties uz to, ka vairākās tā pielietošanas jomās tas pēc svarīgākajām fizikālajām īpašībām ir zemāks par cēziju, šim retajam sārmu metālam tomēr ir svarīga loma. modernās tehnoloģijas. Var atzīmēt šādas rubīdija pielietošanas jomas: katalīze, elektroniskā nozare, speciālā optika, kodolenerģija, medicīna.
Rubidiju izmanto ne tikai tīrā veidā, bet arī vairāku sakausējumu un ķīmisku savienojumu veidā. Svarīgi atzīmēt, ka rubīdijam ir ļoti laba un labvēlīga izejvielu bāze, taču tajā pašā laikā situācija ar resursu pieejamību ir daudz labvēlīgāka nekā cēzija gadījumā un rubīdijs var ieņemt vēl nozīmīgāku lomu, piemēram, katalīzē (kur tas ir veiksmīgi sevi pierādījis).
Rubīdija-86 izotops tiek plaši izmantots gamma defektu noteikšanā, mērīšanas tehnoloģijā, kā arī vairāku svarīgu zāļu un zāļu sterilizācijā. pārtikas produkti. Rubidijs un tā sakausējumi ar cēziju ir ļoti perspektīvs dzesēšanas šķidrums un darba vide augstas temperatūras turbīnu blokiem (šajā ziņā rubidijs un cēzijs ir kļuvuši nozīmīgi pēdējos gados, un metālu ārkārtīgi augstās izmaksas atkāpjas no iespējām krasi palielinot turbīnu bloku efektivitāti un līdz ar to arī samazināt izdevumiem degviela un vides piesārņojums). Sistēmas, kuru pamatā ir rubīdijs, visplašāk izmanto kā dzesēšanas šķidrumus, ir trīskāršie sakausējumi: nātrija-kālija-rubidija un nātrija-rubidija-cēzija.
Katalīzē rubīdiju izmanto gan organiskajā, gan neorganiskajā sintēzē. Rubidija katalītisko aktivitāti galvenokārt izmanto naftas rafinēšanai vairākos svarīgos produktos. Rubidija acetātu, piemēram, izmanto metanola un vairāku augstāku spirtu sintēzei no ūdens gāzes, kas savukārt ir ārkārtīgi svarīgi saistībā ar ogļu pazemes gazifikāciju un mākslīgās šķidrās degvielas ražošanu automašīnām un reaktīvo dzinēju degvielu. Vairākiem rubīdija sakausējumiem ar telūru spektra ultravioletajā apgabalā ir augstāka jutība nekā cēzija savienojumiem, un tāpēc šajā gadījumā tas var konkurēt ar cēziju-133 kā fotokonverteru materiālu. Kā daļu no īpašām eļļošanas kompozīcijām (sakausējumiem) rubīdijs tiek izmantots kā ļoti efektīva smērviela vakuumā (raķešu un kosmosa tehnoloģija).
Rubidija hidroksīdu izmanto, lai sagatavotu elektrolītu zemas temperatūras ķīmiskajiem reaktoriem, kā arī kā piedevu kālija hidroksīda šķīdumam, lai uzlabotu tā veiktspēju pie zemas temperatūras un elektrolīta elektriskās vadītspējas palielināšana. Rubīdija metālu izmanto hidrīda kurināmā elementos.
Augstas temperatūras (līdz 400 °C) mērīšanai izmanto rubīdija hlorīdu, kas sakausēts ar vara hlorīdu.
Rubidija plazmu izmanto lāzera starojuma ierosināšanai.
Rubidija hlorīds tiek izmantots kurināmā elementos kā elektrolīts, un to pašu var teikt par rubīdija hidroksīdu, kas ir ļoti efektīvs kā elektrolīts kurināmā elementos, izmantojot tiešu ogļu oksidēšanu.
Cēzijs
Cēzijs ir pirmās grupas, D.I.Mendeļejeva Dmitrija Ivanoviča ķīmisko elementu periodiskās sistēmas sestā perioda galvenās apakšgrupas elements ar atomskaitli 55. Apzīmē ar simbolu Cs (lat. Cēzijs). Vienkāršā viela cēzijs (CAS numurs: 7440-46-2) ir mīksts sārmu metāls sudrabaini dzeltenā krāsā. Cēzijs savu nosaukumu ieguva par divu spilgti zilu līniju klātbūtni emisijas spektrā (no latīņu caesius - debeszils).
Cēziju 1860. gadā atklāja vācu zinātnieki R. W. Bunsens un G. R. Kirhhofs Darhheimas minerālavota ūdeņos Vācijas Republikā, izmantojot optisko spektroskopiju, tādējādi kļūstot par pirmo elementu, kas atklāts, izmantojot spektrālo analīzi. Pirmo reizi cēziju tīrā veidā 1882. gadā izdalīja zviedru ķīmiķis K. Seterbergs izkausēta cēzija cianīda (CsCN) un bārija maisījuma elektrolīzes laikā.
Galvenie cēzija minerāli ir pollucīts un ļoti reti sastopamais avogadrīts (K, Cs). Turklāt piemaisījumu veidā cēzijs ir iekļauts vairākos aluminosilikātos: lepidolīts, flogopīts, biotīts, amazonīts, petalīts, berils, zinvaldīts, leicīts, karnalīts. Kā rūpnieciskās izejvielas izmanto pollucītu un lepidolītu.
Rūpnieciskajā ražošanā cēzijs savienojumu veidā tiek iegūts no minerāla pollucīta. To veic ar hlorīda vai sulfāta atvēršanu. Pirmais ietver avota minerāla apstrādi ar karsētu sālsskābi, antimona hlorīda SbCl3 pievienošanu, lai izgulsnētu Cs3 savienojumu, un mazgāšanu ar karstu ūdeni vai amonjaka šķīdumu, lai izveidotu cēzija hlorīdu CsCl. Otrajā gadījumā to apstrādā ar karsētu sērskābi, veidojot cēzija alanu CsAl(SO4)2 · 12H2O.
IN Krievijas Federācija Pēc PSRS sabrukuma pollucīta rūpnieciskā ieguve netika veikta, lai gan padomju laikos Voronjas tundrā pie Murmanskas tika atklātas kolosālas minerāla rezerves. Līdz brīdim, kad Krievijas rūpniecība spēja nostāties uz kājām, izrādījās, ka Kanādas uzņēmums ir iegādājies licenci šīs jomas attīstībai. Pašlaik cēzija sāļu apstrāde un ekstrakcija no pollucīta tiek veikta Novosibirskā ZAO Reto metālu rūpnīcā.
Ir vairāki laboratorijas metodes cēzija iegūšana. To var iegūt:
karsējot vakuumā cēzija hromāta vai dihromāta maisījumu ar cirkoniju;
cēzija azīda sadalīšanās vakuumā;
karsējot cēzija hlorīda un īpaši sagatavota kalcija maisījumu.
Visas metodes ir darbietilpīgas. Otrais ļauj iegūt augstas tīrības pakāpes metālu, taču ir sprādzienbīstams, un tā ieviešanai ir nepieciešamas vairākas dienas.
Cēzijs atrada pielietojumu tikai 20. gadsimta sākumā, kad tika atklāti tā minerāli un izstrādāta tehnoloģija tā iegūšanai tīrā veidā. Pašlaik cēziju un tā savienojumus izmanto elektronikā, radio, elektrotehnikā, rentgena inženierijā, ķīmiskajā rūpniecībā, optikā, medicīnā un kodolenerģētikā. Galvenokārt tiek izmantots stabilais dabiskais cēzijs-133 un ierobežotā mērā tā radioaktīvais izotops cēzijs-137, kas izolēts no urāna, plutonija un torija dalīšanās fragmentu summas atomelektrostaciju reaktoros.
Sārmzemju metāli
Sārmzemju metāli - ķīmiskie elementi: kalcijs Ca, stroncijs Sr, bārijs Ba, rādijs Ra (dažkārt arī berilijs Be un magnijs Mg tiek kļūdaini klasificēti kā sārmzemju metāli). Tie ir nosaukti tā, jo to oksīdi - "zemes" (alķīmiķu terminoloģijā) - piešķir ūdenim sārmainu reakciju. Sārmzemju metālu sāļi, izņemot rādiju, ir plaši izplatīti dabā minerālu veidā.
Kalcijs
Kalcijs ir D. I. Dmitrija Ivanoviča Mendeļejeva ķīmisko elementu periodiskās sistēmas ceturtā perioda otrās grupas galvenās apakšgrupas elements ar atomskaitli 20. To apzīmē ar simbolu Ca (lat. Kalcijs). Vienkārša viela kalcijs (CAS numurs: 7440-70-2) - mīksts, ķīmiski aktīvs sārmzemju metāls sudraba-balta krāsa.
Kalcija metāls pastāv divās allotropās modifikācijās. Līdz 443 °C α-Ca ar kubisku seju centrētu režģi (parametrs a = 0,558 nm) ir stabils; β-Ca ar kubisku ķermeni centrētu α-Fe tipa režģi (parametrs a = 0,448 nm) ir stabils. stabilāks. α → β pārejas standarta entalpija ΔH0 ir 0,93 kJ/mol.
Kalcijs ir tipisks sārmzemju metāls. Kalcija ķīmiskā aktivitāte ir augsta, bet zemāka nekā visiem citiem sārmzemju metāliem. Tas viegli reaģē ar skābekli, oglekļa dioksīdu un mitrumu gaisā, tāpēc kalcija metāla virsma parasti ir blāvi pelēka, tāpēc laboratorijā kalcijs parasti tiek uzglabāts, tāpat kā citi sārmzemju metāli, cieši noslēgtā burkā zem slāņa. petrolejas vai šķidrā parafīna.
Standarta potenciālu sērijā kalcijs atrodas pa kreisi no ūdeņraža. Ca2+/Ca0 pāra standarta elektrodu potenciāls ir –2,84 V, tāpēc kalcijs aktīvi reaģē ar ūdeni, bet bez aizdegšanās:
Ca + 2H2O = Ca(OH)2 + H2 + Q.
Normālos apstākļos kalcijs reaģē ar aktīviem nemetāliem (skābekli, hloru, bromu):
2Ca + O2 = 2CaO, Ca + Br2 = CaBr2.
Sildot gaisā vai skābeklī, kalcijs aizdegas. Kalcijs karsējot reaģē ar mazāk aktīviem nemetāliem (ūdeņradi, boru, oglekli, silīciju, slāpekli, fosforu un citiem), piemēram:
Ca + H2 = CaH2, Ca + 6B = CaB6,
3Ca + N2 = Ca3N2, Ca + 2C = CaC2,
3Ca + 2P = Ca3P2 (kalcija fosfīds), zināmi arī kalcija fosfīdi sastāvos CaP un CaP5;
2Ca + Si = Ca2Si (kalcija silicīds), zināmi arī kalcija silicīdi sastāvos CaSi, Ca3Si4 un CaSi2.
Iepriekš minēto reakciju rašanos parasti pavada izdalīšanās liels daudzums siltums (tas ir, šīs reakcijas ir eksotermiskas). Visos savienojumos ar nemetāliem kalcija oksidācijas pakāpe ir +2. Lielāko daļu kalcija savienojumu ar nemetāliem viegli sadala ūdens, piemēram:
CaH2 + 2H2O = Ca(OH)2 + 2H2,
Ca3N2 + 3H2O = 3Ca(OH)2 + 2NH3.
Ca2+ jons ir bezkrāsains. Kad liesmai pievieno šķīstošos kalcija sāļus, liesma kļūst ķieģeļsarkana.
Kalcija sāļi, piemēram, CaCl2 hlorīds, CaBr2 bromīds, CaI2 jodīds un Ca(NO3)2 nitrāts, labi šķīst ūdenī. Ūdenī nešķīst fluorīds CaF2, karbonāts CaCO3, sulfāts CaSO4, ortofosfāts Ca3(PO4)2, oksalāts CaC2O4 un daži citi.
Ir svarīgi, lai atšķirībā no kalcija karbonāta CaCO3 skābais kalcija karbonāts (bikarbonāts) Ca(HCO3)2 šķīst ūdenī. Dabā tas noved pie šādiem procesiem. Kad auksts lietus vai upes ūdens, kas piesātināts ar oglekļa dioksīdu, iekļūst pazemē un nokrīt uz kaļķakmens, tiek novērota to izšķīšana:
CaCO3 + CO2 + H2O = Ca(HCO3)2.
Tajās pašās vietās, kur ūdens, kas piesātināts ar kalcija bikarbonātu, nonāk uz zemes virsmas un tiek uzkarsēts ar saules stariem, notiek apgriezta reakcija:
Ca(HCO3)2 = CaCO3 + CO2 + H2O.
Tā dabā tiek pārnestas lielas vielu masas. Rezultātā pazemē var veidoties milzīgas spraugas, un alās veidojas skaistas akmens “lāstekas” – stalaktīti un stalagmīti.
Izšķīdušā kalcija bikarbonāta klātbūtne ūdenī lielā mērā nosaka ūdens pagaidu cietību. To sauc par pagaidu, jo, ūdenim vāroties, sadalās bikarbonāts un izgulsnējas CaCO3. Šī parādība, piemēram, noved pie tā, ka laika gaitā tējkannā veidojas katlakmens.
Stroncijs
Stroncijs ir D.I.Mendeļejeva Dmitrija Ivanoviča ķīmisko elementu periodiskās sistēmas piektā perioda otrās grupas galvenās apakšgrupas elements ar atomskaitli 38. To apzīmē ar simbolu Sr (lat. Stroncijs). Vienkāršā viela stroncijs (CAS numurs: 7440-24-6) ir mīksts, kaļams un kaļams sārmzemju metāls sudrabaini baltā krāsā. Tam ir augsta ķīmiskā aktivitāte, gaisā tas ātri reaģē ar mitrumu un skābekli, pārklājoties ar dzeltenu oksīda plēvi.
Jaunais elements tika atklāts minerālā strontianīts, kas tika atrasts 1764. gadā svina raktuvēs netālu no Skotijas ciema Stronšjanas, kas vēlāk deva nosaukumu jaunajam elementam. Jauna metāla oksīda klātbūtni šajā minerālā gandrīz 30 gadus vēlāk atklāja William Cruickshank un Ader Crawford. Tīrā veidā to 1808. gadā izolēja sers Hamfrijs Deivijs.
Stroncijs ir mīksts, sudrabaini balts metāls, kas ir kaļams un elastīgs, un to var viegli sagriezt ar nazi.
Polimorfs - ir zināmas trīs tā modifikācijas. Līdz 215°C kubiskā seju centrēta modifikācija (α-Sr) ir stabila, no 215 līdz 605°C stabila ir sešstūra modifikācija (β-Sr) un virs 605°C kubiskā ķermeņa centrēta modifikācija (γ- Sr) ir stabils.
Kušanas temperatūra - 768oC, Vārīšanās temperatūra - 1390oC.
Stroncija savienojumos vienmēr ir +2 valence. Stroncija īpašības ir tuvu kalcijam un bārijam, ieņemot starpposmu starp tiem.
Elektroķīmiskajā sprieguma sērijā stroncijs ir viens no visvairāk aktīvie metāli(tā parastais elektroda potenciāls ir –2,89 V. Spēcīgi reaģē ar ūdeni, veidojot hidroksīdu:
Sr + 2H2O = Sr(OH)2 + H2
Mijiedarbojas ar skābēm, izspiež smagos metālus no to sāļiem. Tas vāji reaģē ar koncentrētām skābēm (H2SO4, HNO3).
Metāla stroncijs ātri oksidējas gaisā, veidojot dzeltenīgu plēvi, kurā bez SrO oksīda vienmēr ir SrO2 peroksīds un Sr3N2 nitrīds. Sildot gaisā, tas aizdegas; pulverveida stroncijs gaisā ir pakļauts pašaizdegšanās procesam.
Spēcīgi reaģē ar nemetāliem - sēru, fosforu, halogēniem. Mijiedarbojas ar ūdeņradi (virs 200°C), slāpekli (virs 400°C). Praktiski nereaģē ar sārmiem.
Augstā temperatūrā tas reaģē ar CO2, veidojot karbīdu:
5Sr + 2CO2 = SrC2 + 4SrO
Viegli šķīstoši stroncija sāļi ar Cl-, I-, NO3- anjoniem. Sāļi ar anjoniem F-, SO42-, CO32-, PO43- ir nedaudz šķīstoši.
Stronciju izmanto vara un dažu tā sakausējumu leģēšanai, ievadīšanai akumulatoru svina sakausējumos, čuguna, vara un čuguna atsērošanai. tēraudi.
Bārijs
Bārijs ir D. I. Dmitrija Ivanoviča Mendeļejeva ķīmisko elementu periodiskās sistēmas sestā perioda otrās grupas galvenās apakšgrupas elements ar atomskaitli 56. To apzīmē ar simbolu Ba (lat. Bārijs). Vienkāršā viela bārijs (CAS numurs: 7440-39-3) ir mīksts, kaļams sārmzemju metāls sudrabaini baltā krāsā. Ir augsta ķīmiskā aktivitāte.
Kārlis Šēle bāriju kā BaO oksīdu atklāja 1774. gadā. 1808. gadā angļu ķīmiķis Hamfrijs Deivijs ieguva ar slapja bārija hidroksīda elektrolīzi ar dzīvsudraba katodu. amalgama bārijs; Pēc tam, kad dzīvsudrabs karsējot iztvaikoja, tas atbrīvoja bārija metālu.
Bārijs ir sudrabaini balts kaļams metāls. Ja sit strauji, tas saplīst. Ir divas bārija alotropās modifikācijas: α-Ba ar kubisku ķermeni centrētu režģi (parametrs a = 0,501 nm) ir stabils līdz 375 °C; β-Ba ir stabils virs tā.
Cietība pēc mineraloģijas skalas 1,25; Mosa skala 2.
Uzglabājiet bārija metālu petrolejā vai zem parafīna slāņa.
Bārijs ir sārmzemju metāls. Tas intensīvi oksidējas gaisā, veidojot bārija oksīdu BaO un bārija nitrīdu Ba3N2, un aizdegas ar nelielu karsēšanu. Spēcīgi reaģē ar ūdeni, veidojot bārija hidroksīdu Ba(OH)2:
Ba + 2H2O = Ba(OH)2 + H2
Aktīvi mijiedarbojas ar atšķaidītām skābēm. Daudzi bārija sāļi nešķīst vai nedaudz šķīst ūdenī: bārija sulfāts BaSO4, bārija sulfīts BaSO3, bārija karbonāts BaCO3, bārija fosfāts Ba3(PO4)2. Bārija sulfīds BaS atšķirībā no kalcija sulfīda CaS labi šķīst ūdenī.
Viegli reaģē ar halogēniem, veidojot halogenīdus.
Sildot ar ūdeņradi, veidojas bārija hidrīds BaH2, kas savukārt ar litija hidrīdu LiH dod Li kompleksu.
Reaģē, karsējot ar amonjaku:
6Ba + 2NH3 = 3BaH2 + Ba3N2
Karsējot, bārija nitrīds Ba3N2 reaģē ar CO, veidojot cianīdu:
Ba3N2 + 2CO = Ba(CN)2 + 2BaO
Ar šķidru amonjaku iegūst tumši zilu šķīdumu, no kura var izdalīt amonjaku, kuram ir zeltains spīdums un kas viegli sadalās, izdalot NH3. Platīna katalizatora klātbūtnē amonjaks sadalās, veidojot bārija amīdu:
Ba(NH2)2 + 4NH3 + H2
Bārija karbīdu BaC2 var iegūt, karsējot BaO ar akmeņoglēm loka krāsnī.
Ar fosforu tas veido fosfīdu Ba3P2.
Bārijs reducē daudzu metālu oksīdus, halogenīdus un sulfīdus līdz attiecīgajiem metāliem.
Metāla bārijs, bieži vien sakausējumā ar alumīniju, tiek izmantots kā gāzu absorbētājs (geters) augsta vakuuma elektroniskajās ierīcēs, kā arī tiek pievienots kopā ar cirkoniju šķidriem metālu dzesēšanas šķidrumiem (nātrija, kālija, rubīdija, litija, cēzija sakausējumiem). lai samazinātu agresivitāti pret cauruļvadiem un metalurģijā.
Pārejas metāli
Pārejas metāli (pārejas elementi) ir D. I. Mendeļejeva Dmitrija Ivanoviča ķīmisko elementu periodiskās tabulas sekundāro apakšgrupu elementi, kuru atomos elektroni parādās d- un f-orbitālē. IN vispārējs skats Pārejas elementu elektronisko struktūru var attēlot šādi: . ns orbitāle satur vienu vai divus elektronus, atlikušie valences elektroni atrodas -orbitālē. Tā kā valences elektronu skaits ir ievērojami mazāks par orbitāļu skaitu, vienkāršas vielas, ko veido pārejas elementi, ir metāli.
Pārejas elementu vispārīgie raksturojumi
Visiem pārejas elementiem ir šādas kopīgas īpašības:
Mazas elektronegativitātes vērtības.
Mainīgi oksidācijas stāvokļi. Gandrīz visiem d-elementiem, kuru atomiem ir 2 valences elektroni ārējā ns-apakšlīmenī, ir zināms oksidācijas stāvoklis +2.
Sākot ar D. I. Dmitrija Ivanoviča Mendeļejeva ķīmisko elementu periodiskās tabulas III grupas d-elementiem, elementi zemākajā oksidācijas pakāpē veido savienojumus, kuriem piemīt bāzes īpašības, augstākajā - skābos, vidējā - amfotēriski.
Dzelzs
Dzelzs ir D.I.Mendeļejeva Dmitrija Ivanoviča ķīmisko elementu periodiskās sistēmas ceturtā perioda astotās grupas sānu apakšgrupas elements, atomskaitlis 26. To apzīmē ar simbolu Fe (lat. Ferrum). Viens no visizplatītākajiem metāliem zemes garozā (otrā vieta aiz alumīnija).
Vienkāršā viela dzelzs (CAS numurs: 7439-89-6) ir kaļams sudrabbalts metāls ar augstu ķīmisko reaktivitāti: dzelzs ātri korodē augstā temperatūrā vai augsta mitruma apstākļos gaisā. Dzelzs sadeg tīrā skābeklī un smalki izkliedētā stāvoklī spontāni uzliesmo gaisā.
Faktiski dzelzi parasti sauc par tā sakausējumiem ar zemu piemaisījumu saturu (līdz 0,8%), kas saglabā tīra metāla mīkstumu un elastību. Bet praksē biežāk tiek izmantoti dzelzs sakausējumi ar oglekli: (līdz 2% oglekļa) un (vairāk nekā 2% oglekļa), kā arī nerūsējošais (leģētais) tērauds ar leģējošu metālu piedevām (hromu, mangānu, Ni, utt.). Kopums specifiskas īpašības dzelzs un tā sakausējumi padara to par “metālu Nr. 1” pēc nozīmes cilvēkiem.
Dabā dzelzs tīrā veidā ir sastopams reti, visbiežāk tas ir atrodams dzelzs-niķeļa meteorītos. Dzelzs daudzums zemes garozā ir 4,65% (4. vieta aiz O, Si, Al). Tiek uzskatīts, ka arī dzelzs veido lielāko daļu Zemes kodola.




Dzelzs ir tipisks metāls, brīvā stāvoklī tas ir sudrabaini baltā krāsā ar pelēcīgu nokrāsu. Tīrs metāls ir plastisks, dažādi piemaisījumi (īpaši ogleklis) palielina tā cietību un trauslumu. Tam ir izteiktas magnētiskās īpašības. Bieži tiek izdalīta tā sauktā "dzelzs triāde" - trīs metālu grupa (dzelzs Fe, kobalts Co, Ni Ni), kam ir līdzīgas fizikālās īpašības, atomu rādiusi un elektronegativitātes vērtības.
Dzelzi raksturo polimorfisms, tai ir četras kristāliskas modifikācijas:
līdz 769 °C ir α-Fe (ferīts) ar uz ķermeni centrētu kubisko režģi un feromagnētiskām īpašībām (769 °C ≈ 1043 K — dzelzs Kirī punkts)
temperatūras diapazonā 769–917 °C ir β-Fe, kas no α-Fe atšķiras tikai ar ķermeni centrētā kubiskā režģa parametriem un paramagnēta magnētiskajām īpašībām.
temperatūras diapazonā 917–1394 °C ir γ-Fe (austenīts) ar seju centrētu kubisko režģi
virs 1394 °C δ-Fe ar ķermeni centrētu kubisko režģi ir stabils
Metalurģija neatšķir β-Fe kā atsevišķu fāzi un uzskata to par α-Fe šķirni. Karsējot dzelzi vai tēraudu virs Kirī punkta (769 °C ≈ 1043 K), jonu termiskā kustība izjauc elektronu spina magnētisko momentu orientāciju, feromagnēts kļūst paramagnētisks – notiek otrās kārtas fāzes pāreja, bet nenotiek pirmās kārtas fāzes pāreja ar kristālu pamata fizikālo parametru izmaiņām.
Tīram dzelzs normālā spiedienā no metalurģijas viedokļa ir šādas stabilas modifikācijas:
No absolūtās nulles līdz 910 єC α-modifikācija ar ķermeni centrētu kubisko (bcc) kristāla režģi ir stabila. Cietu oglekļa šķīdumu α-dzelzs sauc par ferītu.
No 910 līdz 1400 єC γ modifikācija ar seju centrētu kubisko (fcc) kristāla režģi ir stabila. Cietu oglekļa šķīdumu γ-dzelzs sauc par austenītu.
No 910 līdz 1539 єC δ modifikācija ar ķermeni centrētu kubisko (bcc) kristāla režģi ir stabila. Cietu oglekļa šķīdumu δ-dzelzs (kā arī α-dzelzs) sauc par ferītu. Dažreiz tiek nošķirts augstas temperatūras δ-ferīts un zemas temperatūras α-ferīts (vai vienkārši ferīts), lai gan to atomu struktūras ir vienādas.
Oglekļa un leģējošo elementu klātbūtne tēraudā būtiski maina fāzu pāreju temperatūras.
Teritorijā augsts spiediens(virs 104 MPa, 100 tūkst. atm.) parādās ε-dzelzs modifikācija ar sešstūrveida cieši saspiestu (hcp) režģi.
Polimorfisma fenomens ir ārkārtīgi svarīgs tērauda metalurģijā. Pateicoties kristāla režģa α-γ pārejām, notiek tērauda termiskā apstrāde. Bez šīs parādības dzelzs kā tērauda pamats nebūtu tik plaši izmantots.
Dzelzs ir ugunsizturīgs un pieder pie vidējas aktivitātes metāliem. Dzelzs kušanas temperatūra ir 1539 °C, viršanas temperatūra ir aptuveni 3200 °C.
Dzelzs ir viens no visvairāk izmantotajiem metāliem, kas veido līdz pat 95% no pasaules metalurģijas ražošanas.
Dzelzs ir galvenā tēraudu un čuguna sastāvdaļa - svarīgākie konstrukcijas materiāli.
Dzelzs var būt daļa no sakausējumiem, kuru pamatā ir citi metāli, piemēram, niķelis.
Magnētiskais dzelzs oksīds (magnetīts) ir svarīgs materiāls datoru ilgtermiņa atmiņas ierīču ražošanā: cietie diski, disketes utt.
Īpaši smalks magnetīta pulveris tiek izmantots melnbaltos lāzerprinteros kā toneris.
Vairāku dzelzs sakausējumu unikālās feromagnētiskās īpašības veicina to plašo izmantošanu elektrotehnikā transformatoru un elektromotoru magnētiskajiem serdeņiem.
Dzelzs(III) hlorīds (dzelzs hlorīds) tiek izmantots radioamatieru praksē iespiedshēmu plates kodināšanai.
Dzelzs sulfāta heptātu (dzelzs sulfātu), kas sajaukts ar vara sulfātu, izmanto kaitīgo sēņu apkarošanai dārzkopībā un celtniecībā.
Dzelzs tiek izmantots kā anods dzelzs-niķeļa akumulatoros un dzelzs-gaisa akumulatoros.
Varš
Varš ir D. I. Dmitrija Ivanoviča Mendeļejeva ķīmisko elementu periodiskās tabulas pirmās grupas sānu apakšgrupas elements ar atomskaitli 29. To apzīmē ar simbolu Cu (lat. Cuprum). Elements varš (CAS numurs: 7440-50-8) ir elastīgs pārejas metāls ar zeltaini rozā krāsu (rozā, ja nav oksīda plēves). Cilvēki to plaši izmanto jau ilgu laiku.



Varš ir zeltaini rozā kaļamais metāls, gaisā tas ātri pārklājas ar oksīda plēvi, kas piešķir tam raksturīgu intensīvu dzeltenīgi sarkanu nokrāsu. Varam ir augsta siltumvadītspēja un elektriskā vadītspēja (tas ieņem otro vietu pēc elektrovadītspējas aiz sudraba). Tam ir divi stabili izotopi - 63Cu un 65Cu, un vairāki radioaktīvie izotopi. Visilgāk nodzīvotā, 64 Cu, pussabrukšanas periods ir 12,7 stundas un divi sabrukšanas režīmi ar dažādiem produktiem.
Blīvums - 8,94*10i kg/m
Īpatnējā siltumietilpība pie 20 °C - 390 J/kg*K
Elektriskā pretestība pie 20-100 °C - 1,78·10-8 Ohm m
Kušanas temperatūra - 1083 °C
Vārīšanās temperatūra - 2600 °C
Ir vairāki vara sakausējumi: misiņš - vara sakausējums ar cinku, vara un alvas sakausējums, cupronickel - vara un niķeļa sakausējums un daži citi.
Cinks
Cinks ir D.I.Mendeļejeva Dmitrija Ivanoviča ķīmisko elementu periodiskās sistēmas ceturtā perioda otrās grupas sekundārās apakšgrupas elements ar atomskaitli 30. To apzīmē ar simbolu Zn (lat. Zinkum). Vienkāršā viela (CAS numurs: 7440-66-6) normālos apstākļos ir trausls pārejas metāls zilgani baltā krāsā (gaisā notraipās, pārklājoties ar plānu cinka oksīda kārtu).
Tīrā veidā tas ir diezgan plastisks sudrabaini balts metāls. Tam ir sešstūra režģis ar parametriem a = 0,26649 nm, c = 0,49468 nm. Istabas temperatūrā tas ir trausls, plāksni saliekot, no kristalītu berzes atskan krakšķoša skaņa (parasti spēcīgāka par “alvas kliedzienu”). 100-150°C temperatūrā cinks ir plastmasa. Piemaisījumi, pat nelieli, ievērojami palielina cinka trauslumu.
Tipisks amfotērisks metāls. Standarta elektroda potenciāls ir –0,76 V, standarta potenciālu virknē tas atrodas līdz dzelzs.
Gaisā cinks ir pārklāts ar plānu ZnO oksīda kārtiņu. Spēcīgi karsējot, tas sadeg, veidojot amfoterisku balto oksīdu ZnO:
2Zn + O2 = 2ZnO.
Cinka oksīds reaģē gan ar skābes šķīdumiem:
ZnO + 2HNO3 = Zn(NO3)2 + H2O
un ar sārmiem:
ZnO + 2NaOH = Na2ZnO2 + H2O,
Parastās tīrības cinks aktīvi reaģē ar skābes šķīdumiem:
Zn + 2HCl = ZnCl2 + H2,
Zn + H2SO4(dil.) = ZnSO4 + H2
un sārmu šķīdumi:
Zn + 2NaOH + 2H2O = Na2 + H2,
veidojot hidroksinātus. Ļoti tīrs cinks nereaģē ar skābju un sārmu šķīdumiem. Mijiedarbība sākas, kad tiek pievienoti daži pilieni vara sulfāta šķīduma CuSO4.
Sildot, cinks reaģē ar halogēniem, veidojot halogenīdus ZnHal2. Kopā ar fosforu cinks veido fosfīdus Zn3P2 un ZnP2. Ar sēru un tā analogiem - selēnu un telūru - dažādi halkogenīdi, ZnS, ZnSe, ZnSe2 un ZnTe.
Cinks tieši nereaģē ar ūdeņradi, slāpekli, oglekli, silīciju un boru. Zn3N2 nitrīdu iegūst, cinkam reaģējot ar amonjaku 550-600°C temperatūrā.
IN ūdens šķīdumi Cinka joni Zn2+ veido ūdens kompleksus 2+ un 2+.
Tīru cinka metālu izmanto, lai atgūtu dārgmetālus, kas iegūti pazemes izskalošanās ceļā (zelts, sudrabs). Turklāt cinku izmanto, lai iegūtu sudrabu, zeltu (un citus metālus) no neapstrādāta svina cinka-sudraba-zelta intermetālisku savienojumu veidā (tā saukto "sudraba putu"), ko pēc tam apstrādā ar tradicionālajām attīrīšanas metodēm.
To izmanto, lai aizsargātu tēraudu no korozijas (mehāniskajam spriegumam nepakļautu virsmu cinkošana vai metalizācija - tiltiem, tvertnēm, metāla konstrukcijām). Izmanto arī kā materiālu negatīvajam elektrodam ķīmiskās strāvas avotos, tas ir, baterijās un akumulatoros, piemēram: mangāna-cinka šūnā, sudraba-cinka akumulatorā (EMF 1,85 V, 150 Wh/kg, 650 Wh/dmі, zems). pretestības un kolosālas izlādes strāvas, dzīvsudraba-cinka elements (EMF 1,35 V, 135 Wh/kg, 550-650 Wh/dmі), dioksisulfāta-dzīvsudraba elements, cinka jodāta elements, vara oksīda galvaniskais elements (EMF 0,7-1,6 volti, 84- 127 Wh/kg, 410-570 Wh/dmI), hroma-cinka šūna, cinka-sudraba hlorīda šūna, niķeļa-cinka akumulators (EMF 1, 82 volti, 95-118 Wh/kg, 230-295 Wh/dmI), svina-cinka elementu, cinka-hlora akumulatoru, cinka-broma akumulatoru utt.). Cinka loma cinka-gaisa akumulatoros ir ļoti svarīga, pēdējos gados intensīvi tiek attīstītas uz cinka-gaisa sistēmas bāzes veidotās datoru (klēpjdatoru) baterijas un šajā jomā gūti ievērojami panākumi (lielākas par litija akumulatoriem, ietilpība un resurss, 3 reizes mazākas izmaksas), šī sistēma ir ļoti perspektīva arī dzinēju iedarbināšanai (svina akumulators - 55 Wh/kg, cinka-gaiss - 220-300 Wh/kg) un elektriskajiem transportlīdzekļiem (darbības diapazons līdz 900 km ). Iekļauts daudzos cietlodmetālos, lai samazinātu to kušanas temperatūru. Cinks ir svarīga misiņa sastāvdaļa. Cinka oksīdu plaši izmanto medicīnā kā antiseptisku un pretiekaisuma līdzekli. Cinka oksīds tiek izmantots arī krāsas - cinka balta - ražošanai.
Cinka hlorīds ir svarīga plūsma metāla lodēšanai un šķiedru ražošanas sastāvdaļa.
Cinka telurīds, selenīds, fosfīds un sulfīds ir plaši izmantoti pusvadītāji.
Cinka selenīds tiek izmantots, lai izgatavotu optiskās brilles ar ļoti zemu absorbcijas koeficientu vidējā infrasarkanajā reģionā, piemēram, oglekļa dioksīda lāzeros.
Merkurs
Dzīvsudrabs ir D. I. Dmitrija Ivanoviča Mendeļejeva ķīmisko elementu periodiskās tabulas sestā perioda otrās grupas sekundārās apakšgrupas elements ar atomskaitli 80. To apzīmē ar simbolu Hg (lat. Hydrargyrum). Vienkāršā viela dzīvsudrabs (CAS numurs: 7439-97-6) ir pārejas metāls, istabas temperatūrā tas ir smags, sudrabaini balts, manāmi gaistošs šķidrums, kura tvaiki ir ārkārtīgi indīgi. Dzīvsudrabs ir viens no diviem ķīmiskajiem elementiem (un vienīgais metāls), kura vienkāršās vielas normālos apstākļos atrodas šķidrā agregācijas stāvoklī (otrais elements ir broms). Dabā tas ir sastopams gan vietējā formā, gan veido vairākus minerālus. Dzīvsudrabu visbiežāk iegūst, reducējot no tā visizplatītākā minerāla, cinobra. To izmanto mērinstrumentu, vakuumsūkņu, gaismas avotu ražošanā un citās zinātnes un tehnikas jomās.
Dzīvsudrabs ir vienīgais metāls, kas istabas temperatūrā ir šķidrs. Tam ir diamagnētiskas īpašības. Veido šķidrus sakausējumus ar daudziem metāliem - amalgamas. Tikai dzelzs, mangāns un Ni.
Dzīvsudrabs ir zemas reakcijas metāls.
Sildot līdz 300 °C, dzīvsudrabs reaģē ar skābekli: 2Hg + O2 → 2HgO veidojas sarkanais dzīvsudraba(II) oksīds. Šī reakcija ir atgriezeniska: karsējot virs 340 °C, oksīds sadalās vienkāršās vielās. Dzīvsudraba oksīda sadalīšanās reakcija vēsturiski ir viens no pirmajiem skābekļa ražošanas veidiem.
Karsējot dzīvsudrabu ar sēru, veidojas dzīvsudraba(II) sulfīds.
Dzīvsudrabs nešķīst skābju šķīdumos, kuriem nav oksidējošās īpašības, bet izšķīst akva regia un slāpekļskābe, veidojot divvērtīgus dzīvsudraba sāļus. Kad dzīvsudraba pārpalikums aukstumā tiek izšķīdināts slāpekļskābē, veidojas nitrāts Hg2(NO3)2.
No IIB grupas elementiem tieši dzīvsudrabam ir iespēja iznīcināt ļoti stabilo 6d10 - elektronu apvalku, kas noved pie dzīvsudraba savienojumu pastāvēšanas iespējamības (+4). Tādējādi papildus slikti šķīstošajam Hg2F2 un ūdenī sadalošajam HgF2 ir arī HgF4, kas iegūts, mijiedarbojoties dzīvsudraba atomiem un neona un fluora maisījumam 4K temperatūrā.
Dzīvsudrabu izmanto termometru ražošanā, dzīvsudraba kvarca un dienasgaismas spuldzes pilda ar dzīvsudraba tvaikiem. Dzīvsudraba kontakti kalpo kā pozīcijas sensori. Turklāt metālisko dzīvsudrabu izmanto, lai ražotu vairākus svarīgus sakausējumus.
Iepriekš dažādas metālu amalgamas, īpaši zelta un sudraba amalgamas, tika plaši izmantotas juvelierizstrādājumos, spoguļos un zobu plombēs. Tehnoloģijā dzīvsudrabu plaši izmantoja barometriem un manometriem. Dzīvsudraba savienojumus izmantoja kā antiseptisku līdzekli (sublimātu), caureju (kalomelu), cepuru ražošanā u.c., taču augstās toksicitātes dēļ līdz 20. gadsimta beigām tie praktiski tika izspiesti no šīm vietām (amalgamāciju aizstājot ar izsmidzināšanu). un metālu elektrodepozīcija, polimēru plombēšana zobārstniecībā).
Zemas temperatūras termometriem izmanto dzīvsudraba un tallija sakausējumu.
Metāliskais dzīvsudrabs kalpo kā katods vairāku aktīvo metālu, hlora un sārmu elektrolītiskajai ražošanai dažos ķīmiskos strāvas avotos (piemēram, dzīvsudrabs-cinks - RC tips), atsauces sprieguma avotos (Vestona elements). Dzīvsudraba-cinka elementam (emf 1,35 volti) ir ļoti liela enerģija tilpuma un masas ziņā (130 W/stunda/kg, 550 W/stunda/dm).
Dzīvsudrabu izmanto pārstrādātā alumīnija apstrādē un zelta ieguvē (sk. amalgamu).
Dzīvsudrabu dažreiz izmanto arī kā darba šķidrumu smagi noslogotos hidrodinamiskos gultņos.
Dzīvsudrabs ir iekļauts dažās biocīdajās krāsās, lai novērstu kuģu korpusu piesārņošanu jūras ūdenī.
Dzīvsudrabs-203 (T1/2 = 53 sek) tiek izmantots radiofarmakoloģijā.
Dzīvsudraba sāļus izmanto arī:
Dzīvsudraba jodīdu izmanto kā pusvadītāju starojuma detektoru.
Dzīvsudraba fulmināts (“Mercury fulminate”) jau sen ir izmantots kā sprāgstviela, kas ierosina (detonatori).
Dzīvsudraba bromīdu izmanto ūdens termoķīmiskā sadalīšanā ūdeņradi un skābeklī (atomu ūdeņraža enerģijā).
Daži dzīvsudraba savienojumi tiek izmantoti kā zāles (piemēram, mertiolāts vakcīnu konservēšanai), taču galvenokārt toksicitātes dēļ dzīvsudrabs tika izspiests no medicīnas (sublimāts, dzīvsudraba oksicianīds - antiseptiķi, kalomels - caurejas līdzeklis u.c.) 20. gadsimta vidū un beigās. gadsimtā.

Alumīnijs
Alumīnijs ir D. I. Mendeļejeva Dmitrija Ivanoviča ķīmisko elementu periodiskās sistēmas trešā perioda trešās grupas galvenās apakšgrupas elements, atomskaitlis 13. Apzīmē ar simbolu Al (lat. Alumīnijs). Pieder vieglo metālu grupai. Visizplatītākais metāls un trešais visbiežāk sastopamais (pēc skābekļa un silīcija) ķīmiskais elements zemes garozā.
Vienkāršā viela alumīnijs (CAS numurs: 7429-90-5) ir viegls, nemagnētisks sudrabbalts metāls, ko var viegli veidot, izliet un apstrādāt. Alumīnijam ir augsta siltuma un elektriskā vadītspēja un izturība pret koroziju, jo ātri veidojas spēcīgas oksīda plēves, kas aizsargā virsmu no turpmākas mijiedarbības.
Kā liecina daži bioloģiskie pētījumi, Alumīnija nonākšana cilvēka organismā tika uzskatīta par Alcheimera slimības attīstības faktoru, taču vēlāk šie pētījumi tika kritizēti un secinājums par saistību starp vienu un otru tika atspēkots.
Metāls ir sudrabbalts, viegls, blīvums 2,7 g/cm³, kušanas temperatūra tehniskai 658 °C, augstas tīrības pakāpes alumīnijs 660 °C, viršanas temperatūra 2500 °C, lējuma stiepes izturība 10-12 kg/mm², deformējama 18 -25 kg/mm2, sakausējumi 38-42 kg/mm².
Brinela cietība ir 24-32 kgf/mm², augsta elastība: tehniskā 35%, tīrība 50%, velmēta plānās loksnēs un vienmērīgā folijā.
Alumīnijam ir augsta elektriskā un siltuma vadītspēja, 65% no Cuprum elektriskās vadītspējas, un tam ir augsta gaismas atstarošanas spēja.
Alumīnijs veido sakausējumus ar gandrīz visiem metāliem.
Normālos apstākļos alumīnijs ir pārklāts ar plānu un izturīgu oksīda plēvi un tāpēc nereaģē ar klasiskajiem oksidētājiem: ar H2O (t°); O2, HNO3 (bez karsēšanas). Pateicoties tam, alumīnijs praktiski nav pakļauts korozijai un tāpēc ir plaši pieprasīts mūsdienu rūpniecībā. Tomēr, ja oksīda plēve tiek iznīcināta (piemēram, saskaroties ar amonija sāļu NH4+ šķīdumiem, karstiem sārmiem vai amalgamācijas rezultātā), alumīnijs darbojas kā aktīvs reducējošais metāls.
Viegli reaģē ar vienkāršām vielām:
ar skābekli:
4Al + 3O2 = 2Al2O3
ar halogēniem:
2Al + 3Br2 = 2AlBr3
karsējot reaģē ar citiem nemetāliem:
ar sēru, veidojot alumīnija sulfīdu:
2Al + 3S = Al2S3
ar slāpekli, veidojot alumīnija nitrīdu:
ar oglekli, veidojot alumīnija karbīdu:
4Al + 3C = Al4C3
Alumīnija sulfīds un karbīds tiek pilnībā hidrolizēti:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
Al4C3 + 12H2O = 4Al(OH)3+ 3CH4
Ar sarežģītām vielām:
ar ūdeni (pēc oksīda aizsargplēves noņemšanas, piemēram, amalgamācijas vai karstu sārmu šķīdumi):
2Al + 6H2O = 2Al(OH)3 + 3H2
ar sārmiem (veidojot tetrahidroksoaluminātus un citus aluminātus):
2Al + 2NaOH + 6H2O = 2Na + 3H2
2(NaOH.H2O) + 2Al = 2NaAlO2 + 3H2
Viegli šķīst sālsskābē un atšķaidītā sērskābē:
2Al + 6HCl = 2AlCl3 + 3H2
2Al + 3H2SO4(dil) = Al2(SO4)3 + 3H2
Sildot, tas izšķīst skābēs - oksidētājos, kas veido šķīstošus alumīnija sāļus:
2Al + 6H2SO4 (konc.) = Al2(SO4)3 + 3SO2 + 6H2O
Al + 6HNO3(konc.) = Al(NO3)3 + 3NO2 + 3H2O
atjauno metālus no to oksīdiem (aluminotermija):
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
2Al + Cr2O3 = Al2O3 + 2Cr
Plaši izmanto kā celtniecības materiālu. Galvenās alumīnija priekšrocības šajā kvalitātē ir vieglums, kaļamība štancēšanai, izturība pret koroziju (gaisā alumīnijs uzreiz tiek pārklāts ar izturīgu Al2O3 plēvi, kas novērš tā tālāku oksidēšanos), augsta siltumvadītspēja un tā savienojumu netoksiskums. Jo īpaši šīs īpašības ir padarījušas alumīniju ļoti populāru virtuves piederumu, alumīnija folijas ražošanā pārtikas rūpniecībā un iepakošanai.
Alumīnija kā konstrukcijas materiāla galvenais trūkums ir tā zemā izturība, tāpēc to parasti sakausē ar nelielu daudzumu Cuprum un magnija (sakausējumu sauc par duralumīniju).
Alumīnija elektrovadītspēja ir tikai 1,7 reizes mazāka nekā Cuprum, savukārt alumīnijam ir aptuveni 2 reizes lētāks. Tāpēc to plaši izmanto elektrotehnikā vadu ražošanai, to ekranēšanai un pat mikroelektronikā vadītāju ražošanai mikroshēmās. Alumīnija zemākā elektrovadītspēja (37 1/omi), salīdzinot ar Cuprum (63 1/omi), tiek kompensēta ar alumīnija vadītāju šķērsgriezuma palielināšanos. Alumīnija kā elektriskā materiāla trūkums ir tā spēcīgā oksīda plēve, kas apgrūtina lodēšanu.
Pateicoties tā īpašību kompleksam, to plaši izmanto apkures iekārtās.
Alumīnijs un tā sakausējumi saglabā izturību īpaši zemās temperatūrās. Pateicoties tam, to plaši izmanto kriogēnajā tehnoloģijā.
Augsta atstarošanas spēja apvienojumā ar zemām izmaksām un vieglu nogulsnēšanos padara alumīniju par ideālu materiālu spoguļu izgatavošanai.
Būvmateriālu ražošanā kā gāzi veidojošs līdzeklis.
Aluminizēšana nodrošina tērauda un citu sakausējumu izturību pret koroziju un katlakmens izturību, piemēram, virzuļu iekšdedzes dzinēju vārstiem, turbīnu lāpstiņām, eļļas ieguves platformām, siltuma apmaiņas iekārtām, kā arī aizstāj cinkošanu.
Alumīnija sulfīdu izmanto sērūdeņraža ražošanai.
Tiek veikti pētījumi, lai izstrādātu putu alumīniju kā īpaši spēcīgu un vieglu materiālu.
Kad alumīnijs bija ļoti dārgs, no tā tika izgatavotas dažādas rotaslietas. Mode viņiem uzreiz pārgāja, kad parādījās jaunas tehnoloģijas (izstrādes) tās ražošanai, daudzkārt samazinot. Mūsdienās alumīniju dažreiz izmanto bižutērijas ražošanā.


Citi metāli
Svins
Svins ir ceturtās grupas, D. I. Dmitrija Ivanoviča Mendeļejeva ķīmisko elementu periodiskās sistēmas sestā perioda galvenās apakšgrupas elements ar atomskaitli 82. To apzīmē ar simbolu Pb (latīņu: Plumbum). Vienkāršā viela svins (CAS numurs: 7439-92-1) ir kaļams, salīdzinoši kausējams pelēks metāls.
Svinam ir diezgan zema siltumvadītspēja, tā ir 35,1 W/(m K) 0 °C temperatūrā. Metāls ir mīksts un viegli sagriežams ar nazi. Uz virsmas to parasti klāj vairāk vai mazāk bieza oksīdu plēve, griežot atklājas spīdīga virsma, kas laika gaitā gaisā izgaist.
Kušanas temperatūra: 327,4 °C
Vārīšanās temperatūra: 1740 °C
Svina nitrātu izmanto spēcīgu jauktu sprāgstvielu ražošanai. Svina azīds tiek izmantots kā visplašāk izmantotais detonators (izraisošā sprāgstviela). Svina perhlorātu izmanto, lai sagatavotu smagu šķidrumu (blīvums 2,6 g/cm3), ko izmanto rūdu flotācijas bagātināšanai; dažreiz to izmanto spēcīgās jauktās sprāgstvielās kā oksidētāju. Svina fluorīds atsevišķi, kā arī kopā ar bismutu, vara un sudraba fluorīdu tiek izmantots kā katoda materiāls ķīmiskos strāvas avotos. Svina bismutāts, svina sulfīds PbS, svina jodīds tiek izmantoti kā katoda materiāls litija baterijās. Svina hlorīds PbCl2 kā katoda materiāls rezerves strāvas avotos. Svina telurīds PbTe tiek plaši izmantots kā termoelektrisks materiāls (termo-emf ar 350 μV/K), visplašāk izmantotais materiāls termoelektrisko ģeneratoru un termoelektrisko ledusskapju ražošanā. Svina dioksīds PbO2 tiek plaši izmantots ne tikai svina akumulatoros, bet arī uz tā bāzes tiek ražoti daudzi rezerves ķīmiskie strāvas avoti, piemēram, svina-hlora šūna, svina-fluorescējoša šūna utt.
Svina balts, bāzisks karbonāts Pb(OH)2.PbCO3, blīvs balts pulveris, tiek iegūts no Svina gaisā oglekļa dioksīda un etiķskābes ietekmē. Baltā svina kā krāsojoša pigmenta izmantošana vairs nav tik izplatīta kā kādreiz, jo to sadala sērūdeņradis H2S. Svina baltumu izmanto arī špakteles ražošanai, cementa un svina karbonāta papīra tehnoloģijā.
Svina arsenātu un arsenītu izmanto insekticīdu tehnoloģijā, lai iznīcinātu lauksaimniecības kaitēkļus (čigānu kodes un kokvilnas smeceri). Svina borāts Pb(BO2)2·H2O, nešķīstošs balts pulveris, tiek izmantots gleznu un laku žāvēšanai, kā arī kopā ar citiem metāliem kā stikla un porcelāna pārklājumus. Svina hlorīds PbCl2, balts kristālisks pulveris, šķīst karsts ūdens, citu hlorīdu un īpaši amonija hlorīda NH4Cl šķīdumi. To lieto, lai sagatavotu ziedes audzēju ārstēšanai.
Svina hromāts PbCrO4 ir pazīstams kā hroma dzeltenā krāsviela, un tas ir svarīgs pigments krāsu ražošanā, porcelāna un audumu krāsošanai. Rūpniecībā hromātu galvenokārt izmanto dzelteno pigmentu ražošanā. Svina nitrāts Pb(NO3)2 ir balta kristāliska viela, labi šķīst ūdenī. Šī ir ierobežota izmantošanas saistviela. Rūpniecībā to izmanto sērkociņu ražošanā, tekstilizstrādājumu krāsošanā un apdrukā, ragu krāsošanā un gravēšanā. Svina sulfāts Pb(SO4)2, ūdenī nešķīstošs balts pulveris, tiek izmantots kā pigments baterijās, litogrāfijā un apdrukāto audumu tehnoloģijā.
Svina sulfīds PbS, melns, ūdenī nešķīstošs pulveris, tiek izmantots keramikas apdedzināšanai un svina jonu noteikšanai.
Tā kā svins labi absorbē γ starojumu, to izmanto aizsardzībai pret radiāciju rentgena iekārtās un kodolreaktoros. Turklāt svins tiek uzskatīts par dzesēšanas šķidrumu progresīvu ātro neitronu kodolreaktoru projektos.
Svina sakausējumi tiek plaši izmantoti. Alva (alvas un svina sakausējums), kas satur 85–90% alvas metāla un 15–10% Pb, ir formējama, lēta un tiek izmantota mājsaimniecības piederumu ražošanā. Elektrotehnikā izmanto lodmetālu, kas satur 67% Pb un 33% alvas. Svina sakausējumi ar antimonu tiek izmantoti ložu un tipogrāfisko fontu ražošanā, bet svina, antimona un alvas sakausējumi tiek izmantoti figūru liešanai un gultņiem. Svina-antimona sakausējumus parasti izmanto kabeļu apvalkiem un elektrisko akumulatoru plāksnēm. Svina savienojumus izmanto krāsvielu, krāsu, insekticīdu, stikla ražošanā Tirdzniecības preces un kā piedeva benzīnam tetraetilsvina (C2H5)4Pb veidā (mēreni gaistošs šķidrums, tvaikiem nelielā koncentrācijā ir saldens augļu aromāts, lielā koncentrācijā tiem ir nepatīkama smaka; kušanas temperatūra = 130 °C, viršanas temperatūra = 80°C/13 mm Hg .st.; blīvums 1,650 g/cm; nD2v = 1,5198; nešķīst ūdenī, sajaucas ar organiskiem šķīdinātājiem; ļoti toksisks, viegli iekļūst ādā; MPC = 0,005 mg/m; LD50 = 12,7 mg / kg (žurkām, iekšķīgi)), lai palielinātu oktānskaitli.

Alva
Alva ir ceturtās grupas, D.I.Mendeļejeva Dmitrija Ivanoviča ķīmisko elementu periodiskās sistēmas piektā perioda galvenās apakšgrupas elements ar atomskaitli 50. To apzīmē ar simbolu Alvas metāls (latīņu Stannum). Normālos apstākļos vienkārša viela ir plastmasas, kaļams un kausējams spīdīgs metāls sudrabaini baltā krāsā. Alva veido vairākas allotropas modifikācijas: zem 13,2 °C stabila ir α-alva (pelēkā Alva) ar kubiskā dimanta tipa režģi, virs 13,2 °C stabila ir β-alva (baltā alva) ar tetragonālu kristālrežģi.
Alvu galvenokārt izmanto kā drošu, netoksisku, korozijizturīgu pārklājumu tīrā veidā vai sakausējumos ar citiem metāliem. Galvenie alvas rūpnieciskie lietojumi ir pārtikas tvertņu skārdā (alvotā dzelzs), elektronikas lodmetālos, mājsaimniecības cauruļvados, gultņu sakausējumos un alvas un tās sakausējumu pārklājumos. Vissvarīgākais alvas sakausējums ir Bronza(ar Cuprum). Trauku izgatavošanai izmanto citu labi zināmu sakausējumu – alvu. IN Nesen tiek atjaunota interese par Metāla izmantošanu, jo tas ir “ekoloģiski draudzīgākais” starp smagajiem krāsainajiem metāliem. Izmanto, lai izveidotu supravadošus vadus, kuru pamatā ir Nb3Sn intermetāliskais savienojums.
Cenas metāliskajai alvai 2006. gadā vidēji bija 12-18 dolāri/kg, augstas tīrības pakāpes alvas dioksīdam aptuveni 25 dolāri/kg, vienkristāliskai augstas tīrības pakāpes alvai aptuveni 210 dolāri/kg.
Alvas un cirkonija intermetāliskajiem savienojumiem ir augsta kušanas temperatūra (līdz 2000 °C) un izturība pret oksidēšanu, karsējot gaisā, un tiem ir vairāki pielietojumi.
Alva ir vissvarīgākā leģējošā sastāvdaļa strukturālo titāna sakausējumu ražošanā.
Alvas dioksīds ir ļoti efektīvs abrazīvs materiāls, ko izmanto optiskā stikla virsmas “apdarināšanai”.
Alvas sāļu maisījums - "dzeltenais sastāvs" - iepriekš tika izmantots kā krāsviela vilnai.
Alvu izmanto arī ķīmiskos strāvas avotos kā anoda materiālu, piemēram: mangāna-alvas elements, dzīvsudraba-alvas oksīda elements. Alvas izmantošana svina-alvas akumulatorā ir daudzsološa; piemēram, pie tāda paša sprieguma kā svina akumulatoram, svina-alvas akumulatoram ir 2,5 reizes lielāka kapacitāte un 5 reizes lielāks enerģijas blīvums uz tilpuma vienību, tā iekšējā pretestība ir daudz mazāka.
Alvas metāls ir netoksisks, kas ļauj to izmantot pārtikas rūpniecībā. Alvā esošie kaitīgie piemaisījumi normālos uzglabāšanas un lietošanas apstākļos, tostarp kausējumā temperatūrā līdz 600 °C, netiek izvadīti darba zonas gaisā apjomā, kas pārsniedz maksimāli pieļaujamo koncentrāciju saskaņā ar GOST. Ilgtermiņa (15-20 gadi) alvas putekļu iedarbībai ir fibrogēna iedarbība uz plaušām un tas var izraisīt strādnieku pneimokoniozi.
Metālu pielietojums
Būvmateriāli
Metāli un to sakausējumi ir viens no galvenajiem mūsdienu civilizācijas strukturālajiem materiāliem. To galvenokārt nosaka to augstā izturība, viendabīgums un šķidrumu un gāzu necaurlaidība. Turklāt, mainot sakausējuma sastāvu, ir iespējams mainīt to īpašības ļoti plašā diapazonā.
Elektriskie materiāli
Metālus izmanto gan kā labus vadītājus Elektrība(Varš, alumīnijs) un kā materiāli ar paaugstinātu pretestību rezistoriem un elektriskajiem sildelementiem (nihroms utt.).
Instrumentu materiāli
Metālus un to sakausējumus plaši izmanto instrumentu (to darba daļu) ražošanā. Tie galvenokārt ir instrumentu tēraudi un cietie sakausējumi. Kā instrumentu materiāli tiek izmantoti arī dimants, bora nitrīds un keramika.
Metalurģija
Metalurģija jeb metalurģija ir materiālu zinātnes joma, kas pēta metālu, starpmetālu savienojumu un sakausējumu fizikālo un ķīmisko uzvedību. Metalurģija ietver arī esošo zināšanu par metāliem praktisku pielietojumu - no izejvielu ieguves līdz gatavās produkcijas monetārajai izdošanai.
Metālu un oksīdu kausējumu un cieto šķīdumu uzbūves un fizikāli ķīmisko īpašību izpēte, vielas kondensētā stāvokļa teorijas izstrāde;
Metalurģisko reakciju termodinamikas, kinētikas un mehānisma izpēte;
Zinātniski tehnisko un ekonomisko pamatu izstrāde polimetālu minerālu izejvielu un tehnogēno atkritumu integrētai izmantošanai ar vides problēmu risināšanu;
Pirometalurģijas, elektrotermiskās, hidrometalurģijas un gāzes fāzes pamatu teorijas izstrāde Procesi metālu, sakausējumu, metāla pulveru un kompozītmateriālu un pārklājumu ražošana.
Melnie metāli ietver dzelzi, mangānu, hromu, vanādiju. Viss pārējais ir krāsains. Pamatojoties uz to fizikālajām īpašībām un mērķi, krāsainos metālus parasti iedala smagajos (varš, svins, cinks, alva, niķis) un vieglajos (alumīnijs, magnijs).
Saskaņā ar galveno Tehnoloģiskais process iedala pirometalurģijā (kausēšana) un hidrometalurģijā (metālu ekstrakcija ķīmiskos šķīdumos). Pirometalurģijas veids ir plazmas metalurģija.
Plazmas metalurģija - ieguve no rūdām, metālu un sakausējumu kausēšana un apstrāde plazmas ietekmē.
Rūdu (oksīdu u.c.) apstrāde tiek veikta, to termiski sadaloties plazmā. Lai novērstu reversās reakcijas, tiek izmantots reducētājs (ogleklis, ūdeņradis, metāns utt.) vai strauja plazmas plūsmas dzesēšana, kas izjauc termodinamisko līdzsvaru.
Plazmas metalurģija ļauj tieši reducēt Metālu no rūdas, ievērojami paātrinot metalurģiskos procesus, iegūstot tīrus materiālus un samazinot degvielas (reducētāja) izmaksas. Plazmas metalurģijas trūkums ir lielais plazmas ražošanai izmantotās elektroenerģijas patēriņš.

Stāsts
Pirmās liecības, ka cilvēks nodarbojies ar metalurģiju, ir datētas ar 5.-6. gadu tūkstoti pirms mūsu ēras. e. un tika atrasti Majdanpekā, Pločnikā un citās vietās Serbijā (ieskaitot vara cirvi no 5500. g. p.m.ē., kas piederēja Vinca kultūrai), Bulgārijā (5000. g. p.m.ē.), Palmelā (), Spānijā, Stounhendžā (). Tomēr, kā tas bieži notiek ar šādām senām parādībām, vecumu ne vienmēr var precīzi noteikt.
Agrāko laiku kultūrā bija sudrabs, varš, alva un meteorīts dzelzs, kas ļāva ierobežot metālapstrādi. Tādējādi tika augstu novērtēti “Debesu dunči” - ēģiptiešu ieroči, kas radīti no meteorīta dzelzs 3000. g.pmē. e. Bet, iemācījies iegūt varu un alvu no akmens un cilvēki ražoja sakausējumu, ko sauc par bronzu 3500. gadā pirms mūsu ēras. e. iegāja bronzas laikmetā.
Daudz grūtāk bija iegūt dzelzi no rūdas un kausēt metālu. Tiek uzskatīts, ka šo tehnoloģiju izgudroja hetiti ap 1200. gadu pirms mūsu ēras. e., kas kļuva par dzelzs laikmeta sākumu. Dzelzs ieguves un ražošanas noslēpums kļuva par galveno faktoru filistiešu valdījumā.
Melnās metalurģijas attīstības pēdas var izsekot daudzās pagātnes kultūrās un civilizācijās. Tas ietver senās un viduslaiku karaļvalstis un impērijas Tuvajos Austrumos un Tuvajos Austrumos, Senajā Ēģiptē un Anatolijā (), Kartāgu, seno un viduslaiku grieķus un romiešus. Eiropā, Ķīna utt. Jāatzīmē, ka daudzas metalurģijas metodes, ierīces un tehnoloģijas sākotnēji tika izgudrotas Senajā Ķīnā, un pēc tam eiropieši apguva šo amatu (izgudrojot domnas, Čuguns, Tērauds, hidrauliskie āmuri utt.). Tomēr jaunākie pētījumi liecina, ka romiešu tehnoloģija bija daudz progresīvāka, nekā tika uzskatīts iepriekš, īpaši ieguves un kalšanas jomā.
Kalnrūpniecības metalurģija
Ieguves metalurģija ietver vērtīgu metālu ieguvi no rūdas un iegūto izejvielu kausēšanu tīrā metālā. Lai metāla oksīdu vai sulfīdu pārvērstu tīrā metālā, rūda ir jāatdala ar fizikāliem, ķīmiskiem vai elektrolītiskiem līdzekļiem.
Metalurgi strādā ar trim galvenajām sastāvdaļām: izejvielām, koncentrātu (vērtīgu metāla oksīdu vai sulfīdu) un atkritumiem. Pēc ieguves lieli rūdas gabali tiek sasmalcināti līdz vietai, kur katra daļiņa ir vai nu vērtīgs koncentrāts, vai atkritumi.
Kalns Darbojas nav nepieciešams, ja rūda un vide pieļauj izskalošanos. Tādā veidā jūs varat izšķīdināt un iegūt ar Minerālu bagātinātu šķīdumu.
Bieži vien rūda satur vairākus vērtīgus metālus. Šādā gadījumā viena procesa atkritumus var izmantot kā izejvielu citam procesam.
Sakausējums
Sakausējums ir makroskopiski viendabīgs divu vai vairāku ķīmisko elementu maisījums, kurā pārsvarā ir metāliskas sastāvdaļas. Galvenā vai vienīgā sakausējuma fāze, kā likums, ir ciets sakausējuma elementu šķīdums metālā, kas ir sakausējuma pamatā.
Sakausējumiem ir metāliskas īpašības, piemēram: metālisks spīdums, augsta elektrovadītspēja un siltumvadītspēja. Dažreiz sakausējuma sastāvdaļas var būt ne tikai ķīmiskie elementi, bet arī ķīmiski savienojumi, kuriem piemīt metāliskas īpašības. Piemēram, cieto sakausējumu galvenās sastāvdaļas ir volframa vai titāna karbīdi. Sakausējumu makroskopiskās īpašības vienmēr atšķiras no to komponentu īpašībām, un daudzfāzu (heterogēno) sakausējumu makroskopiskā viendabība tiek panākta, pateicoties vienmērīgam piemaisījumu fāžu sadalījumam metāla matricā.
Sakausējumus parasti ražo, sajaucot sastāvdaļas izkausētā stāvoklī un pēc tam atdzesējot. Sastāvdaļu augstās kušanas temperatūrās sakausējumus ražo, sajaucot metāla pulverus, kam seko saķepināšana (tādā veidā tiek iegūti, piemēram, daudzi volframa sakausējumi).
Sakausējumi ir viens no galvenajiem konstrukcijas materiāliem. Starp tiem vislielākā nozīme ir sakausējumiem, kuru pamatā ir dzelzs un alumīnijs. Daudzu sakausējumu sastāvā var ievadīt arī nemetālus, piemēram, oglekli, silīciju, boru u.c.. Tehnoloģijā tiek izmantoti vairāk nekā 5 tūkstoši sakausējumu.
Avoti
http://ru.wikipedia.org/
Investoru enciklopēdija. 2013 .
Sinonīmi:- - METĀLS, metāla tēviņš, lat. Krushec; un mazā formā, kausēšanā: karaliene. Ikdienā vērtīgi, dārgi metāli: zelts, platīns, sudrabs; vienkārši: dzelzs, varš, cinks, alva, svins; ķīmija ir atklājusi šādus principus gandrīz visām fosilijām, kas sastāv no... ... Dāla skaidrojošā vārdnīca
Lielākā daļa (93 no 117) šobrīd zināmo ķīmisko elementu ir metāli.
Dažādu metālu atomiem ir daudz kopīgas struktūras, un to veidotajām vienkāršajām un sarežģītajām vielām ir līdzīgas īpašības (fizikālās un ķīmiskās).
Metālu atomu atrašanās vieta periodiskajā tabulā un struktūra.
Periodiskajā tabulā metāli atrodas pa kreisi un zem parastās lauztās līnijas, kas iet no bora līdz astatīnam (skatīt tabulu zemāk). Gandrīz visi s elementi (izņemot H, He) ir metāli, apmēram puse R- elementi, visi d- Un f- elementi ( lantanīdi Un aktinīdi).
Lielākajai daļai metālu atomu ārējā enerģijas līmenī ir neliels skaits (līdz 3) elektronu, tikai dažiem p-elementu atomiem (Sn, Pb, Bi, Po) ir vairāk (no četriem līdz sešiem). Metālu atomu valences elektroni ir vāji (salīdzinājumā ar nemetālu atomiem) saistīti ar kodolu. Tāpēc metālu atomi salīdzinoši viegli atdod šos elektronus citiem atomiem, darbojoties kā ķīmiskās reakcijas tikai kā reducējošās vielas un tajā pašā laikā pārvēršas pozitīvi lādētos katjonos:
Es - ne - = Me n+.
Atšķirībā no nemetāliem, metālu atomiem ir raksturīgi tikai pozitīvi oksidācijas stāvokļi no +1 līdz +8.
Vieglums, ar kādu metālu atomi atdod savus valences elektronus citiem atomiem, raksturo šī metāla reducējošo aktivitāti. Jo vieglāk metāla atoms atdod savus elektronus, jo spēcīgāks tas ir reducētājs. Ja mēs sakārtojam metālus pēc kārtas, lai samazinātu to reducējošo spēju ūdens šķīdumos, mēs iegūstam zināmo metālu nobīdes sērija, ko sauc arī par elektroķīmisko sprieguma sēriju (vai tuvumā esošās aktivitātes) metāli (skatīt tabulu zemāk).
Izplatība mmetāli dabā.
Trīs visbiežāk sastopamie metāli zemes garozā (tas ir mūsu planētas virsmas slānis, apmēram 16 km biezs) ir alumīnijs, dzelzs un kalcijs. Retāk sastopams nātrijs, kālijs un magnijs. Zemāk esošajā tabulā parādītas dažu metālu masas daļas zemes garozā.
dzelzs un kalcijs. Retāk sastopams nātrijs, kālijs un magnijs. Zemāk esošajā tabulā parādītas dažu metālu masas daļas zemes garozā.
Metālu rašanās zemes garozā
| Metāls | Metāls | Masas daļa zemes garozā, % | |
|---|---|---|---|
| Al | 8,8 | Kr | 8,3 ∙ 10 -3 |
| Fe | 4,65 | Zn | 8,3 ∙ 10 -3 |
| Ca | 3,38 | Ni | 8 ∙ 10 -3 |
| Na | 2,65 | Cu | 4,7 ∙ 10 -3 |
| K | 2,41 | Pb | 1,6 ∙ 10 -3 |
| Mg | 2,35 | Ag | 7 ∙ 10 -6 |
| Ti | 0,57 | Hg | 1,35 ∙ 10 -6 |
| Mn | 0,10 | Au | 5 ∙ 10 -8 |
Tiek saukti elementi, kuru masas daļa zemes garozā ir mazāka par 0,01%. reti. Pie retajiem metāliem pieder, piemēram, visi lantanīdi. Ja elements nespēj koncentrēties zemes garozā, tas ir, tas neveido savas rūdas, bet tiek atrasts kā piemaisījums ar citiem elementiem, tad to klasificē kā izklaidīgs elementi. Piemēram, ir izkliedēti šādi metāli: Sc, Ga, In, Tl, Hf.
XX gadsimta 40. gados. Vācu zinātnieki Valters un Ida Nolla izteica ideju. ka katrs bruģakmens uz ietves satur visus periodiskās tabulas ķīmiskos elementus. Sākotnēji šie vārdi nebija vienprātīgi no kolēģu puses. Tomēr, parādoties arvien precīzākām analīzes metodēm, zinātnieki arvien vairāk pārliecinās par šo vārdu patiesumu.
Tā kā visi dzīvie organismi ir ciešā saskarē ar vidi, tad katrā no tiem jāsatur, ja ne visi, tad lielākā daļa periodiskās tabulas ķīmisko elementu. Piemēram, pieauguša cilvēka ķermenī masas daļa neorganiskās vielas ir 6%. No metāliem šie savienojumi satur Mg, Ca, Na, K. Daudzi fermenti un citi bioloģiski aktīvi organiskie savienojumi mūsu organismā satur V, Mn, Fe, Cu, Zn, Co, Ni, Mo, Cr un dažus citus metālus.
Pieaugušā organismā vidēji ir aptuveni 140 g kālija jonu un aptuveni 100 g nātrija jonu. Ar pārtiku mēs ikdienā uzņemam no 1,5 g līdz 7 g kālija jonu un no 2 g līdz 15 g nātrija jonu. Vajadzība pēc nātrija joniem ir tik liela, ka tie īpaši jāpievieno pārtikai. Ievērojams nātrija jonu zudums (NaCl veidā urīnā un sviedros) negatīvi ietekmē cilvēka veselību. Tāpēc karstā laikā ārsti iesaka dzert minerālūdens. Tomēr pārmērīgs sāls saturs pārtikā negatīvi ietekmē arī mūsu darbību iekšējie orgāni(galvenokārt sirds un nieres).
Lai balsotu, jums ir jāiespējo JavaScriptUn citi ķīmiskie savienojumi. Lai iegūtu tīrus metālus un to tālāku izmantošanu, nepieciešams tos izolēt no rūdām un veikt attīrīšanu. Ja nepieciešams, veiciet dopings un cita veida metālapstrāde. Zinātne to pēta metalurģija. Metalurģija izšķir melno metālu rūdas (pamatojoties uz dziedzeris) un krāsaino metālu (tie nesatur dzelzi, tikai aptuveni 70 elementus). Zelts, sudrabs un platīns attiecas arī uz dārgmetāli (cēlmetāli). . Turklāt tie nelielā daudzumā atrodas jūras ūdenī, augos un dzīvos organismos (spēlējot svarīgu lomu).
Ir zināms, ka cilvēka ķermenis sastāv no 3% metāli. Visvairāk mūsu šūnas kalcijs Un nātrijs, koncentrēts iekšā limfātiskās sistēmas. Magnijs uzkrājas iekšā muskuļus Un nervu sistēma , varš- V aknas , dzelzs- V asinis.
Ražošana
Metālus bieži iegūst no zemes, veicot ieguvi, un iegūtās rūdas nodrošina salīdzinoši bagātīgu būtisku elementu avotu. Rūdu atrašanās vietas noteikšanai tiek izmantotas īpašas meklēšanas metodes, tostarp rūdas izpēte un atradņu izpēte. Noguldījumi parasti tiek sadalīti karjeras(rūdu ieguve uz virsmas), kurā ieguve tiek veikta, iegūstot augsni, izmantojot smago aprīkojumu, kā arī pazemē raktuves.
Metālus parasti iegūst no iegūtās rūdas, izmantojot ķīmisko vai elektrolītisko reducēšanu. IN pirometalurģija izmanto, lai pārvērstu rūdu par metāla izejvielām augstas temperatūras, V hidrometalurģija Tiem pašiem mērķiem tiek izmantota ūdens ķīmija. Izmantotās metodes ir atkarīgas no metāla veida un piesārņojuma veida.
Ja metāla rūda ir metāla un nemetāla jonu savienojums, to parasti pakļauj kausēšanai - karsēšanai ar reducētāju, lai iegūtu tīru metālu. Daudzi parastie metāli, piemēram, dzelzs, izkausēts, izmantojot kā reducētāju ogleklis(iegūta, sadedzinot ogles). Daži metāli, piemēram, alumīnija Un nātrijs, nav viena ekonomiski pamatota reducētāja un tiek iegūtas, izmantojot elektrolīze.
Dažu metālu cietība pēc Mosa skalas:
| Cietība | Metāls |
|---|---|
| 0.2 | Cēzijs |
| 0.3 | Rubidijs |
| 0.4 | Kālijs |
| 0.5 | Nātrijs |
| 0.6 | Litijs |
| 1.2 | Indijs |
| 1.2 | Tallijs |
| 1.25 | Bārijs |
| 1.5 | Stroncijs |
| 1.5 | Gallijs |
| 1.5 | Alva |
| 1.5 | Svins |
| 1.5 | |
| 1.75 | Kalcijs |
| 2.0 | Kadmijs |
| 2.25 | Bismuts |
| 2.5 | Magnijs |
| 2.5 | Cinks |
| 2.5 | Lantāns |
| 2.5 | Sudrabs |
| 2.5 | Zelts |
| 2.59 | Itrijs |
| 2.75 | Alumīnijs |
| 3.0 | Varš |
| 3.0 | Antimons |
| 3.0 | Torijs |
| 3.17 | Skandijs |
| 3.5 | Platīns |
| 3.75 | Kobalts |
| 3.75 | Palādijs |
| 3.75 | Cirkonijs |
| 4.0 | Dzelzs |
| 4.0 | Niķelis |
| 4.0 | Hafnijs |
| 4.0 | Mangāns |
| 4.5 | Vanādijs |
| 4.5 | Molibdēns |
| 4.5 | Rodijs |
| 4.5 | Titāns |
| 4.75 | niobijs |
| 5.0 | Iridijs |
| 5.0 | Rutēnijs |
| 5.0 | Tantals |
| 5.0 | Tehnēcijs |
| 5.0 | Chromium |
| 5.5 | Berilijs |
| 5.5 | Osmijs |
| 5.5 | Rēnijs |
| 6.0 | Volframs |
| 6.0 | β-urāns |
Sakarā ar vieglu elektronu zudumu ir iespējama metālu oksidēšanās, kas var izraisīt korozija un turpmāka īpašību pasliktināšanās. Oksidēšanās spēju var atpazīt pēc metālu standarta aktivitāšu sērijas. Šis fakts apstiprina nepieciešamību izmantot metālus kopā ar citiem elementiem ( sakausējums, no kuriem svarīgākais ir tērauda), to sakausēšana un dažādu pārklājumu izmantošana.
Pareizākam metālu elektronisko īpašību aprakstam ir jāizmanto kvantu mehānika. Visās cietās vielās ar pietiekamu daudzumu simetrija atsevišķu atomu elektronu enerģijas līmeņi pārklājas un veido atļautās joslas, un valences elektronu veidoto joslu sauc valences josla. Vājais valences elektronu savienojums metālos noved pie tā, ka valences josla metālos ir ļoti plaša, un ar visiem valences elektroniem nepietiek, lai to pilnībā aizpildītu.
Šādas daļēji piepildītas zonas galvenā iezīme ir tāda, ka pat pie minimāla pielietotā sprieguma paraugā sākas valences elektronu pārkārtošanās, t.i., plūsma. elektrība.
Tā pati augstā elektronu mobilitāte rada augstu siltumvadītspēju, kā arī spēju spoži atspoguļot elektromagnētisko starojumu (kas piešķir metāliem raksturīgo spīdumu).
Daži metāli
- Plaušas:
- Cits:
Metālu pielietojums
Būvmateriāli
Instrumentu materiāli
Priekšstatu par metāliem attīstības vēsture
Cilvēka iepazīšanās ar metāliem sākās ar zelts , Sudrabs Un varš, tas ir, no metāliem, kas brīvā stāvoklī atrodas uz zemes virsmas; pēc tam tiem pievienojās metāli, kas ir plaši izplatīti dabā un ir viegli izolējami no to savienojumiem: skārda , svins , dzelzs Un . Šie septiņi metāli bija pazīstami cilvēcei senos laikos. Starp seno ēģiptiešu artefaktiem ir zelta un vara priekšmeti, kas saskaņā ar dažiem datiem ir datēti ar laikmetu, kas ir 3000-4000 gadus vecs no pašreizējā laikmeta. e.
Septiņi zināmie metāli jau ir tikai iekšā viduslaiki palielinājies cinks , bismuts , antimons un 18. gadsimta sākumā arsēns. No 18. gadsimta vidus atklāto metālu skaits strauji pieauga un līdz 20. gadsimta sākumam sasniedza 65, bet līdz 21. gadsimta sākumam - līdz 96.
Neviena no ķīmiskajām nozarēm nedeva tik lielu ieguldījumu ķīmijas zināšanu attīstībā kā procesi, kas saistīti ar metālu ražošanu un apstrādi; Nozīmīgākie momenti ķīmijas vēsturē ir saistīti ar to vēsturi. Metālu īpašības ir tik raksturīgas, ka jau senākajā laikmetā zelts, sudrabs, varš, svins, alva, dzelzs un dzīvsudrabs veidoja vienu dabisku viendabīgu vielu grupu, un jēdziens “metāls” attiecas uz senākajiem ķīmiskajiem jēdzieniem. Tomēr viedokļi par to būtību ir vairāk vai mazāk noteikta forma parādījās tikai viduslaikos alķīmiķi. Patiesība, idejas Aristotelis par dabu: visa esošā veidošanās no četriem elementiem (uguns, zeme, ūdens un gaiss), tādējādi jau norādot uz metālu sarežģītību; taču šīs idejas bija pārāk neskaidras un abstraktas. Alķīmiķiem metālu sarežģītības jēdziens un līdz ar to ticība spējai pārveidot vienus metālus citos, radīt tos mākslīgi, ir viņu pasaules uzskata galvenais jēdziens. Šis jēdziens ir dabisks secinājums no faktu masas par metālu ķīmiskajām pārvērtībām, kas līdz tam laikam bija uzkrājušās. Faktiski metāla pārvēršana oksīdā, kas pilnīgi atšķiras no tiem, izmantojot vienkāršu kalcinēšanu gaisā un metāla atgriešanos no oksīda, dažu metālu atdalīšanu no citiem, sakausējumu veidošanās ar atšķirīgām īpašībām nekā sākotnēji ņemtajiem metāliem. , un tā tālāk – šķiet, ka tam visam bija jānorāda uz to būtības sarežģītību.
Runājot par metālu faktisko pārtapšanu zeltā, pārliecība par tās iespējamību balstījās uz daudziem redzamiem faktiem. Sākumā zelta krāsā līdzīgu sakausējumu veidošanās, piemēram, no vara un cinka, alķīmiķu acīs jau bija to pārtapšana zeltā. Viņiem šķita, ka jāmaina tikai krāsa, un arī metāla īpašības kļūs citas. Konkrēti, slikti veikti eksperimenti, kad parastā metāla pārveidošanai zeltā tika izmantotas vielas, kas saturēja šī zelta piejaukumu, lielā mērā veicināja šo pārliecību. Piemēram, jau 18. gadsimta beigās kāds Kopenhāgenas farmaceits apliecināja, ka ķīmiski tīrs sudrabs, sakausējot ar arsēnu, daļēji pārvēršas zeltā. Šo faktu apstiprināja slavenais ķīmiķis Gitons de Morvo un sacēla lielu troksni. Drīz vien tika pierādīts, ka eksperimentam izmantotajā arsēnā ir sudraba un zelta pēdas.
Tā kā daži no septiņiem tolaik zināmajiem metāliem ķīmiskās pārvērtības bija vieglāk pakļauti, citi grūtāk, alķīmiķi tos iedalīja cēlos – perfektos un necilos – nepilnīgos. Pirmajā ietilpa zelts un sudrabs, otrajā varš, alva, svins, dzelzs un dzīvsudrabs. Pēdējais, kam piemīt cēlmetālu īpašības, bet tajā pašā laikā krasi atšķiras no visiem metāliem šķidrā agregātstāvokļa un nepastāvības ziņā, bija ārkārtīgi interesants tā laika zinātniekiem, un daži to izdalīja īpašā grupā; uzmanība, ko tas piesaistīja, bija tik liela, ka dzīvsudrabu sāka uzskatīt par elementiem, no kuriem veidojas paši metāli, un to uzskatīja par metālisko īpašību nesēju. Pieņemot, ka dabā pastāv dažu metālu pāreja uz citiem, nepilnīgiem uz perfektiem, alķīmiķi pieņēma, ka parastos apstākļos šī transformācija notiek ārkārtīgi lēni, gadsimtu gaitā un, iespējams, ne bez debesu ķermeņu noslēpumainas līdzdalības, kurā tajā laikā un cilvēka liktenī tika piešķirta liela loma. Nejauši tajā laikā bija zināmi septiņi metāli, kā arī septiņas zināmas planētas, un tas vēl vairāk norādīja uz noslēpumainu saikni starp tiem. Alķīmiķu vidū metālus bieži sauc par planētām; to sauc par zeltu Sv, Sudrabs - Mēness, varš - Venera, alva - Jupiters, svins - Saturns, dzelzs - Marss un dzīvsudrabs - Merkurs. Kad tika atklāts cinks, bismuts, antimons un arsēns, ķermeņi, kas visādā ziņā līdzīgi metāliem, bet kuros viena no metāla raksturīgākajām īpašībām bija vāji attīstīta kaļamība, tie tika iedalīti īpašā grupā - pusmetāli. Metālu iedalījums īstajos metālos un pusmetālos pastāvēja jau 18. gadsimta vidū.
Metāla sastāva noteikšana sākotnēji bija tīri spekulatīva. Sākumā alķīmiķi pieņēma, ka tie ir veidoti no diviem elementiem - un sērs. Šī uzskata izcelsme nav zināma, tas pastāv jau 8. gadsimtā. Autors Gebers pierādījums dzīvsudraba klātbūtnei metālos ir tas, ka tas tos izšķīdina, un šajos šķīdumos izzūd to individualitāte, dzīvsudrabs tiek absorbēts, kas nenotiktu, ja tiem nebūtu vienota principa ar dzīvsudrabu. Turklāt dzīvsudrabs un svins radīja kaut ko līdzīgu alvai. Kas attiecas uz sēru, varbūt tas tika ņemts tāpēc, ka sēra savienojumi bija zināmi, saskaņā ar izskats līdzīgi metāliem. Nākotnē šīs vienkāršās idejas, iespējams, neveiksmīgo mēģinājumu dēļ mākslīgi iegūt metālus, kļūst ārkārtīgi sarežģītas un juceklīgas. Alķīmiķu koncepcijās, piemēram, X-XIII gadsimts, dzīvsudrabs un sērs, no kuriem veidojās metāli, nebija tas pats dzīvsudrabs un sērs, kas bija alķīmiķu rokās. Tas bija tikai kaut kas līdzīgs viņiem, kam piemīt īpašas īpašības; kaut kas, kas patiešām pastāvēja parastajā sērā un dzīvsudrabā, tajās izpaudās lielākā mērā nekā citos ķermeņos. Zem dzīvsudraba, kas ir daļa no metālu sastāva, tie pārstāvēja kaut ko tādu, kas nosaka to nemainīgumu, metālisku spīdumu, elastību, vārdu sakot, metāliska izskata nesēju; sērs bija domāts kā metālu mainīguma, sadalīšanās un uzliesmojamības nesējs. Šie divi elementi metālos tika atrasti dažādās proporcijās un, kā toreiz teica, tika fiksēti dažādos veidos; turklāt tiem var būt dažādas tīrības pakāpes. Pēc Gebera domām, piemēram, zelts sastāvēja no liela daudzuma dzīvsudraba un neliela daudzuma sēra, ar visaugstāko tīrības pakāpi un visvairāk fiksēto; alvā, gluži pretēji, viņi pieņēma daudz sēra un maz dzīvsudraba, kas nebija tīri, slikti nostiprināti utt. Ar visu to, protams, gribējās paust metālu atšķirīgo attieksmi pret tobrīd vienīgo jaudīgo ķīmisko līdzekli – uguni. Tālāk attīstoties šiem uzskatiem, divi elementi – dzīvsudrabs un sērs – alķīmiķiem šķita nepietiekami, lai izskaidrotu metālu sastāvu; tiem tika pievienots sāls un nedaudz arsēna. Ar to viņi gribēja norādīt, ka visās metālu pārvērtībās paliek kaut kas negaistošs un paliekošs. Ja dabā “parasto metālu pārveide par cēliem prasa gadsimtus”, tad alķīmiķi centās radīt apstākļus, kuros šis uzlabošanās un nobriešanas process noritētu ātri un viegli. Tā kā ķīmija bija cieši saistīta ar tā laika medicīnu un bioloģiju, ideja par metālu pārveidi dabiski tika identificēta ar ideju par organizēto ķermeņu augšanu un attīstību: pāreju, piemēram, svina pārveidošana zeltā, auga veidošanās no zemē iemestiem un it kā sadalīšiem graudiem, fermentācija, slima orgāna dziedināšana cilvēkā - tās visas bija viena kopīga noslēpumaina dzīves procesa privātas parādības, uzlabošanās. , un tos izraisīja tie paši stimuli. No šejienes ir pašsaprotami, ka noslēpumainajam principam, kas ļauj iegūt zeltu, vajadzēja dziedēt slimības, pārveidot veco cilvēka ķermeni par jaunu utt. Tā radās ideja par brīnišķīgo filozofu akmeni.
Attiecībā uz lomu filozofu akmens parasto metālu pārveidošanā par cēliem, tad visvairāk ir norādījumi par to pārvēršanu zeltā, maz runāts par sudraba ražošanu. Pēc dažu autoru domām, viens un tas pats filozofu akmens pārvērš metālus sudrabā un zeltā; saskaņā ar citiem šīs vielas veidi ir divu veidu: viens ideāls, otrs mazāk ideāls, un tas ir pēdējais, kas kalpo sudraba iegūšanai. Attiecībā uz transformācijai nepieciešamo filozofu akmens daudzumu arī norādījumi atšķiras. Pēc dažu domām, 1 daļa no tā spēj pārvērst zeltā 10 000 000 metāla daļas, pēc citiem - 100 daļas un pat tikai 2 daļas. Lai iegūtu zeltu, viņi izkausēja kādu parasto metālu vai paņēma dzīvsudrabu un iemeta tur filozofa akmeni; Daži apliecināja, ka pārvērtības notiek uzreiz, bet citi – pamazām. Šie uzskati par metālu dabu un spēju pārveidoties kopumā pastāvēja daudzus gadsimtus līdz pat 17. gadsimtam, kad tie sāka to visu krasi noliegt, jo īpaši tāpēc, ka šie uzskati izraisīja daudzu šarlatānu rašanos, kuri izmantoja cerību lētticīgi dabūt zeltu. Īpaši cīnījos ar alķīmiķu idejām Boils"Es gribētu zināt," viņš vienā vietā saka, "kā zeltu var sadalīt dzīvsudrabā, sērā un sālī; Esmu gatavs apmaksāt šīs pieredzes izmaksas; kas attiecas uz mani, es nekad to nevarētu sasniegt.
Pēc gadsimtiem ilgiem neauglīgiem mēģinājumiem mākslīgi iegūt metālus un ar faktu daudzumu, kas bija sakrājies līdz 17. gadsimtam, piemēram, par gaisa lomu sadegšanā, metāla masas palielināšanos oksidēšanās laikā, kas tomēr joprojām bija zināms Gebers 8. gadsimtā jautājums par metāla elementāro sastāvu šķita ļoti tuvu beigām; bet ķīmijā parādījās jauna tendence, kuras rezultāts bija flogistona teorija, un šī jautājuma risinājums vēl ilgāk aizkavējās.
Tā laika zinātniekus ļoti interesēja degšanas parādības. Pamatojoties uz tā laika filozofijas pamatideju, ka ķermeņu īpašību līdzībai jārodas no to sastāvā iekļauto principu un elementu līdzības, tika pieņemts, ka degošie ķermeņi satur kopīgu elementu. Degšanas aktu uzskatīja par sadalīšanās, sadalīšanās elementos aktu; šajā gadījumā uzliesmojamības elements izdalījās liesmas veidā, bet pārējie palika. Atzīstot alķīmiķu uzskatu par metālu veidošanos no trim elementiem dzīvsudraba, sēra un sāls un pieņemot to patieso esamību metālā, sērs tajos bija jāatzīst par degšanas principu. Tad par metāla kalcinēšanas atlikumu acīmredzot bija jāatzīst cita metāla sastāvdaļa - “zeme”, kā toreiz teica; tāpēc dzīvsudrabam ar to nav nekāda sakara. No otras puses, sērs sadeg sērskābe, ko daudzi iepriekšminētā uzskatīja par vienkāršāku ķermeni par sēru un iekļāva to elementārķermeņu skaitā. Bija neskaidrības un pretrunas. Behers, lai saskaņotu vecos jēdzienus ar jaunajiem, pieņēma trīs veidu zemes esamību metālā: pati “zeme”, “uzliesmojoša zeme” un “dzīvsudraba zeme”. Šajos apstākļos Štāls ierosināja savu teoriju. Viņaprāt, uzliesmošanas avots nav sērs vai kāda cita zināma viela, bet gan kaut kas nezināms, ko viņš nosauca flogistons. Tiek uzskatīts, ka metāli veidojas no flogistona un zemes; metāla kalcinēšanu gaisā pavada flogistona izdalīšanās; metālu atgriešanās no viņa zemes ar ogļu palīdzību - ar flogistonu bagātu vielu - ir flogistona savienošanas ar zemi darbība. Lai gan metāli bija vairāki un katrs no tiem aizdedzinot deva savu zemi, pēdējais kā elements bija viens, tāpēc šī metāla sastāvdaļa bija tāda paša hipotētiska rakstura kā flogistons; tomēr Štāla sekotāji dažkārt pieņēma tik daudz “elementāru zemju”, cik metālu. Kad Kavendišs izšķīdinot metālus saņemtajās skābēs ūdeņradis un pārbaudīja tā īpašības (nespēja uzturēt degšanu, sprādzienbīstamība, sajaucoties ar gaisu utt.), viņš to atzina par Štāla flogistonu; metāli, pēc viņa koncepcijām, sastāv no ūdeņraža un "zemes". Šo uzskatu pieņēma daudzi flogistona teorijas piekritēji.
Neskatoties uz šķietamo flogistona teorijas harmoniju, bija svarīgi fakti, kurus ar to nevarēja saistīt. Gebers arī zināja, ka metālu svars palielinās, tos apdedzinot; Tikmēr, pēc Štāla domām, viņiem ir jāzaudē flogistons: kad flogistons atkal tiek pievienots “zemei”, iegūtā metāla svars ir mazāks par “zemes” svaru. Tādējādi izrādījās, ka flogistonam ir jābūt kādai īpašai īpašībai - negatīvai gravitācijai. Neskatoties uz visām ģeniālajām hipotēzēm, kas izvirzītas, lai izskaidrotu šo fenomenu, tā bija nesaprotama un mulsinoša.
Kad Lavuazjē noskaidroja gaisa lomu sadegšanas laikā un parādīja, ka metālu svara pieaugums apdedzināšanas laikā rodas no skābekļa pievienošanas no gaisa metāliem, un tādējādi tika noskaidrots, ka metālu sadegšanas akts nav sadalīšanās elementos, bet gan gluži pretēji, saistīšanas akts, jautājums par metālu sarežģītību tika izlemts negatīvi. Metāli tika klasificēti kā vienkārši ķīmiskie elementi, pateicoties Lavuazjē pamatidejai, ka vienkārši ķermeņi ir tādi, no kuriem nebija iespējams izolēt citus ķermeņus. Ar radīšanu ķīmisko elementu periodiskā tabula Mendeļejevs metāla elementi tajā ieņēma savu īsto vietu.
Skatīt arī
Piezīmes
Saites
- S. P. Vukolovs: // Brokhausa un Efrona enciklopēdiskā vārdnīca: 86 sējumos (82 sējumi un 4 piedevas). - Sanktpēterburga. , 1890-1907.(vēsturiskā daļa)
| Periodiskā tabula | |
|---|---|
| Dmitrijs Ivanovičs Mendeļejevs · Periodiskais likums · Elementu grupas | |
| Formāti | Īss· Pēc blokiem · Pagarināts· Palielināts · Elektroniskās konfigurācijas · Elektronegativitāte · Alternatīva · Elementu izotopi |
| Elementu saraksti Autors | Vārds ·
Etimoloģijas(par godu vietām, par godu atklājējiem) · Atvēršanas laiks Oksidācijas stāvokļi · Izplatība (cilvēkā) Izotopu stabilitāte |


