27.07.2019
1 sārmu metāli. Vai jūs zināt, kā
9. klases ķīmijas stundas kopsavilkums par tēmu:
« Savienojumi sārmu metāli un to pielietojums."
Mērķi: Apkopot un sistematizēt zināšanas par sārmu metāliem un to savienojumiem; iepazīties ar šo savienojumu izmantošanu sadzīvē un ražošanā, to nozīmi organismu dzīvē
Nodarbības mērķi:
1. Nodarbības laikā nodrošināt sārmu metālu savienojumu ķīmisko īpašību asimilāciju, to izmantošanu sadzīvē un ražošanā un nozīmi organismu dzīvē.
Turpināt attīstīt vispārizglītojošās prasmes un prasmes darbā ar ķīmiskajiem reaģentiem.
2. Ideoloģisko pamatideju veidošanās par cēloņsakarībām starp sārmu metāla atoma uzbūves parādībām - vienkāršas vielas īpašībām - sārmu metālu savienojumu īpašībām un to pielietojumu, pamatojoties uz īpašībām.
3.Attīstīt spēju salīdzināt, vispārināt pētāmos faktus un loģiski izteikt savas domas atbildot. Attīstīt skolēnu izziņas interesi, izmantojot datus par pētāmo parādību pielietojumu apkārtējā dzīvē.
Nodarbības veids: kombinēts - jaunu materiālu apgūšana, izmantojot IKT.
Aprīkojums: mācību grāmata, krīts, tāfele, dators, mediju projektors, ekrāns, stundas tēmas prezentācija, stundu tehnoloģiju kartītes skolēniem, ķīmiskie reaģenti (šķīdumi: nātrija hidroksīds, sālsskābe, vara sulfāts, cinka hidroksīds, fenolftaleīns) un laboratorijas trauki (statīva ar mēģenēm).
Nodarbību laikā
es .Organizējot laiku.
II . Jauna materiāla apgūšana.
1. Iepriekš pētītā materiāla pārbaude par tēmu “Sārmu metāli”.
Uzmini mīklas:
1. Tos parasti uzglabā petrolejā, un tā darbojas ar ūdeni,
Atcerieties, ka dabā no šī brīža
Viņš nekur nav brīvs
Ir iespējams to atvērt sāļos
Liesma no tā kļūst dzeltena
Un jūs to varat iegūt no sāls
Kā Dāvijam tas izdevās.
Par kādu elementu mēs runājam? (Na)
2. Viņš enerģiski apspiež.
No mitruma - tīrs ūdeņradis,
To aizstāj ar
Un cieši saista skābekli.
Šis elements ir paslēpts augos
Pēc violetas krāsas
Tas var būt atvērts sāļos.
Par kādu elementu mēs runājam? (KĀM).
1.Ar kādiem metāliem mēs iepazināmies pēdējā nodarbībā?
2.Kāpēc viņus tā sauc?
3. Kāda ir kopīga iezīme visu sārmu metālu atomu struktūrā?
Tests par tēmu: Sārmu metāli.
1. Uz sārmu metāliem neattiecas: a) rubīdijs; c) kālijs; b) cēzijs; d) varš.
2.Elektroniskā formula) 2) 8) 8) 1 atbilst elementam: a) litijs; c) kālijs; b) nātrijs;
3. Atomu rādiuss galvenās apakšgrupas I grupas elementiem ar pieaugošu kodollādiņu:
a) periodiski mainās; c) nemainās; b) palielinās;
4. Sārmu metāli ir ļoti spēcīgi:
A) oksidējošās īpašības; c) atjaunojošas īpašības; b) amfoteriskās īpašības;
5. Sārmu metālu fizikālās īpašības neietver:
a) sudrabaini balts; b) mīksts un viegls; d) ugunsizturīgs.
6. Galvenās apakšgrupas I grupas elementiem mijiedarbojoties ar ūdeni, veidojas:
a) skābe; b) izdalās sārms un ūdeņradis; d) sāls.
7. Nātrijs un kālijs tiek uzglabāti petrolejā, jo tie:
a) ir asa smaka; b) viegli oksidējas gaisā;
Paškontrole: nav kļūdu – “5”, 1,2 kļūdas – “4”, 3 kļūdas – “3”, vairāk – “2”
Atbildes: 1- d 2 - c 3 - b 4 - c 5 - d 6 - b 7 - b.
Paškontrole: nav kļūdu – “5”, 1,2 kļūdas – “4”, 3,4 kļūdas – “3”, vairāk – “2”
2. Zināšanu atjaunošana.
Vai dabā ir iespējams atrast sārmu metālus brīvā formā? Kāpēc?
Vai varat uzminēt, kādā savienojumu veidā tie ir sastopami dabā?
Dabā sārmu metāli ir sastopami tikai savienojumu veidā.
Na un K dabā sastopami hlorīdu, sulfātu, silikātu utt.
Li, Rb, Cs ir atrodami dažādos minerālos.
Fr sastopams radioaktīvajās rūdās Ac un U.
Uz galda: priekšmeti, kas satur sārmu metālu savienojumus (soda, sāls, AA baterijas, ziepes) un uzdod jautājumu.
Apskatiet šos objektus. Kas, jūsuprāt, viņiem ir kopīgs?
1 Kas ir ģenētiskā saikne?
2. Izveidosim nātrija ģenētisko sēriju.
Na → Na 2 O → 2NaOH → Na 2 CO 3
3. Kādas savienojumu klases veido sārmu metālus? Apskatīsim to īpašības.
Kad skolēni skaidro materiālu un skata slaidus, viņi veic piezīmes par plānu, atklājot īpašības un pielietojumu.
Sārmu metālu oksīdi
ciets, balts, viegli šķīstošs.
b) Ķīmiskās īpašības; Skolēni savā piezīmju grāmatiņā ieraksta: Sārmu metālu oksīdi ir tipiski pamata oksīdi. Tāpat kā visi pamata oksīdi, sārmu metālu oksīdi reaģē ar ūdeni, ar skābiem oksīdiem, ar skābēm.
Puiši uz tāfeles un savās piezīmju grāmatiņās pieraksta ķīmisko reakciju vienādojumus, kā piemēru izmantojot nātrija oksīdu:
Na2O + H2O → 2NaOH;
Na 2 O + CO 2 → Na 2 CO 3 ;
Na 2 O + H 2 CO 3 → Na 2 CO 3 + H 2 O
Sārmu metālu hidroksīdi
.
a) fizikālās īpašības; Studenti savās piezīmju grāmatiņās pieraksta šādas īpašības: ciets, balts, labi šķīstošs, karstumizturīgs, korodē audumus un papīru.
b) ķīmiskās īpašības
Drošības instruktāža veicot laboratorijas darbus.
Nātrija hidroksīda ķīmiskās īpašības.
Mērķis: eksperimentāli pierādīt sārmu metālu ķīmiskās īpašības, izmantojot hidroksīda piemēru nātrijs
Instrukcijas
Tīrā mēģenē ielej nātrija hidroksīdu un pievieno dažus pilienus fenolftaleīna. Ko jūs novērojat?
Pievienojiet šķīdumu tajā pašā mēģenē sālsskābes. Ko jūs novērojat? Pierakstiet reakcijas vienādojumu.
NaOH + HCl → NaCl + H 2 O Puiši uz tāfeles un piezīmju grāmatiņās pieraksta ķīmiskās reakcijas vienādojumus jonu formā.
Tīrā mēģenē ielej nātrija hidroksīdu un pievieno vara sulfāta šķīdumu. Ko jūs novērojat? Pierakstiet reakcijas vienādojumu.
2NaOH + CuSO 4 → Na 2 SO 4 + Cu (OH) 2 Puiši uz tāfeles un piezīmju grāmatiņās pieraksta ķīmiskās reakcijas vienādojumus jonu formā.
Izdariet secinājumu par sārmu metālu hidroksīdu ķīmiskajām īpašībām.
Sārmu metālu hidroksīdi reaģē ar skābēm, sāļiem) pielietojums - priekšmetstikliņa numurs 5.
Nātrija hidroksīds – NaOH – kaustiskā soda, kaustiskā soda, kaustiskā soda.
Kālija hidroksīds - KOH - kodīgais potašs.
NaOHun KOH ir kodīgi sārmi, kas korodē audumus un papīru. Studenti pieraksta:Pielietojums: mākslīgā zīda ražošanai , V ziepju un SMS ražošana, kosmētika, medikamenti u.c.
Sārmu metālu sāļi
.
Fizikālās īpašības
. Studenti ieraksta rekvizītus savās piezīmju grāmatiņās. kristāliskas cietas vielas, gandrīz visas šķīst ūdenī.
Patstāvīgais darbs ar mācību grāmatas tekstu.
Pieteikšanās: tabulas aizpildīšana no slaida Nr.5. Darbs no mācību grāmatas 56. – 57. lpp.
Sāls formula
Vārds
pieteikumu
NaHCO3
K2CO3
NaCl
Na 2 SO 4 ∙ 10 H 2 O
Na2CO3∙10H2O
Nozīme organismu dzīvības aktivitātē - slaids Nr.6.
Studentu vēstījums par tēmu: "Sārmu metālu savienojumu nozīme organismu dzīvē."
Nātrija un kālija joniem ir svarīga bioloģiskā loma: Na + ir galvenais ekstracelulārais jons, kas atrodams asinīs un limfā, un K + ir galvenais intracelulārais jons. "Strādāt kopā. Šo jonu koncentrācijas attiecība regulē asinsspiedienu dzīvā organismā un nodrošina sāls šķīdumu kustību no augu saknēm uz lapām. Kālija joni - atbalsta sirds muskuļa darbību, palīdz reimatisma gadījumā un uzlabo zarnu darbību. Kālija savienojumi – novērš pietūkumu.
V. Konsolidācija
VI. Nodarbības kopsavilkums. Atzīmju veidošana.
Nodarbības kopsavilkums:
Kādas fizikālās un ķīmiskās īpašības ir raksturīgas sārmu metālu oksīdiem un hidroksīdiem?
Kur izmanto sārmu metālu hidroksīdus un sāļus?
Papildu materiāls. Tas ir interesanti.
Uzdevums: Kāpēc iekšā Senā Grieķija Vai pirms ilgām kampaņām karstā laikā karavīriem tika ieteikts apēst maizes gabalu, stipri sālītu, un dzert ūdeni?
Elektrolītu joni viegli hidratējas, tāpēc galda sāls saglabā ūdeni organismā.
Problēma: kāpēc eskimosi ēd ļoti maz sāls?
Saskaņā ar vienu zinātnisku teoriju visi dzīvnieki, kas dzīvo uz zemes, ieskaitot cilvēkus, ir organismu pēcteči, kas parādījās un dzīvoja jūrā. Šo radījumu ķermeņa šķidrums pēc sastāva bija jūras ūdens. Pārcēlušies uz sauszemi, viņi saglabāja jūras ūdeni kā ķermeņa šķidrumu. Bet daba nespēj nodrošināt dzīvos organismus ar pietiekamu daudzumu sāls tās dabiskajā formā. Tā kā sāls izšķīst ūdenī, liela daļa no tā ar lietus ūdeni tiek izskalota no augsnes upēs, jūrās un okeānos. Tā rezultātā augi, kas aug uz zemes, nesatur pietiekami daudz sāls. Tāpēc dzīvniekiem, kas ēd augus, ir nepieciešama sāls. Organisms katru dienu zaudē noteiktu daudzumu sāli saturoša šķidruma, un augu barība to nepapildina. Dzīvniekiem, kas barojas ar citiem dzīvniekiem, nav nepieciešama papildu sāls. Viņi iegūst nepieciešamo sāli no savu upuru ķermeņiem. Eskimosi ēd galvenokārt gaļu, tāpēc viņu nepieciešamība pēc sāls ir ļoti maza.
Mērķis: kāpēc Anglijā pēdējo desmitgažu laikā ir samazinājusies mirstība no smadzeņu asinsvadu slimībām?
Tas ir saistīts ar palielinātu svaigu augļu un dārzeņu patēriņu. Svaigos dārzeņos un augļos vienmēr ir daudz kālija un maz nātrija. Nātrijs saglabā ūdeni organismā, palielinot arteriālais spiediens, un kālijs, gluži pretēji, palīdz to samazināt. Tāpēc dārzeņu un augļu, īpaši ābolu, patēriņa palielināšanu var uzskatīt par būtisku pasākumu cerebrovaskulāro slimību profilaksei.
KUR IR CILVĒKU MĪLESTĪBA UZ SĀLI? .
Sāls kalpo, lai saglabātu pārtiku no bojāšanās un puves. Pārtikas konservēšanai (kad vēl nebija ledusskapju un saldētavu) izmantoja sāli. Pēc dārzeņu nogaršošanas no sālījuma cilvēki sāka marinēt, raudzēt un mērcēt svaigus dārzeņus. Cilvēks ir tik ļoti pieradis visu sālīt, ka ir gatavs pat samierināties ar dažām slimībām, lai tikai nepārietu uz bezsāls diētu. Pamazām man radās ieradums sālīt visādus ēdienus, to pat nemēģinot.
DAUDZ SĀLS - MAZĀ KĀLIJA, MAZĀ KĀLIJA - DAUDZ SLIMĪBU
Jautājums par sāli ir jautājums par kālija un nātrija līdzsvaru. Tas ir ārkārtīgi svarīgi organismā. Kālijs un nātrijs pastāvīgi sacenšas par savu klātbūtni šūnās. Galda sālī nav kālija, tas ir pilnībā nātrijs. Mūsu ķermenim steidzami nepieciešams kālijs, kam vajadzētu būt 4 reizes vairāk nekā nātrija. Ķermenis savāc kāliju visur, bet pārmērīga galda sāls lietošana atceļ visus tā centienus. Tāpēc ar pārmērīgu sāls patēriņu rodas kālija trūkums, kas laika gaitā izraisa vairākas kaites: fizisku un garīgu nogurumu, sliktu miegu, krampjus, locītavu sāpes.
Pārmērīgs nātrija (sāls) daudzums pārslogo sirdi. Vai vēlaties uzzināt, vai patērējat pārāk daudz sāls? Iet pie spoguļa: balts aplis ap acs varavīksneni norāda uz pārmērīgu sāls uzņemšanu.
Kaustiskais kālijs
Kaustiskais kālijs tiek izmantots mēslošanas līdzekļu, sintētiskā kaučuka, akumulatoru elektrolītu, reaģentu ražošanai, kā arī tiek izmantots farmācijas rūpniecībā un citās tautsaimniecības nozarēs.
Kaustiskais kālijs tiek transportēts pa dzelzceļu un autotransportu saskaņā ar spēkā esošajiem preču pārvadāšanas noteikumiem, kas attiecas uz šāda veida transportu.
Kaustiskais kālijs tiek uzglabāts hermētiski noslēgtā traukā, jo tas “izplatās” gaisā, absorbējot no tā mitrumu.
Tās tradicionālais nosaukums "kaustiskais kālijs" atspoguļo šīs vielas korozīvo ietekmi uz dzīviem audiem. Ja kodīgais kālijs nonāk saskarē ar ādu, ir iespējami ķīmiski apdegumi.
Mīkstās ziepes iegūst, pārziepojot eļļas un taukus ar kodīgo kāliju. Visām šīm ziepēm ir maiga, krēmīga konsistence.
Nātrija hidroksīds.
Visizplatītākais sārms. Pasaulē ik gadu tiek saražoti un patērēti vairāk nekā 57 miljoni tonnu kodīgo sārmu.
Kaustiskā soda tiek izmantota ļoti dažādās nozarēs un sadzīves vajadzībām:
Celulozes un papīra rūpniecībā papīra, kartona, mākslīgo šķiedru, kokšķiedras plātņu ražošanā.
Tauku pārziepjošanai ziepju, šampūnu un citu mazgāšanas līdzekļu ražošanā.
Ķīmiskajā rūpniecībā - skābes un skābju oksīdu neitralizācijai, kā reaģentu vai katalizatoru ķīmiskās reakcijas un utt.
Kaustiskā soda (nātrija hidroksīds) ir kodīga un kodīga viela. Tas pieder pie 2. bīstamības klases vielām. Tāpēc, strādājot ar to, jābūt uzmanīgiem.
Saskaroties ar ādu, gļotādām un acīm, veidojas nopietni ķīmiski apdegumi. Ja gļotādas virsmas nonāk saskarē ar kodīgu sārmu, skarto vietu nepieciešams noskalot ar ūdens strūklu, bet saskares ar ādu gadījumā – ar vāju etiķskābes šķīdumu.
Uz litija - uz zvaigznēm
Mobilo tālruņu, kabatas gadžetu un klēpjdatoru ražotājiem šis metāls ir ļoti nepieciešams. Kodolenerģija lielos daudzumos patērē litiju (Li), pēc teorētiķu domām, tieši šis sārmu metāls var nodrošināt kodoltermiskās enerģijas atslēgu. Būt visspēcīgākajam psihotropā viela, Li izmanto militārajā un lietišķajā psihiatrijā (un Li ietekmes būtība uz cilvēka psihi nav pilnībā izprotama). Litija deiterīds tiek izmantots ūdeņraža bumbā kā darba viela un sprādziena jaudas regulators.
Šis metāls ir nepieciešams arī dziļas kosmosa izpētei.
Maršrutēšana skolēniem uz stundu
Tēma: Sārmu metālu savienojumi.
Pārbaude
Hidrīdi. Visstabilākais ir litija hidrīds, ko viegli iegūt, laižot ūdeņradi virs sakarsēta litija. LiH ir balts kristālisks pulveris ar kušanas temperatūru 680 o C. Kad paaugstināta temperatūra LiH ir ārkārtīgi reaktīvs. Spēcīgi sadalās ar ūdeni:
LiH + H2O = LiOH + H2
Oksīdi. Visstabilākais ir Li 2 O. Litija un nātrija oksīdi ir balti, pārējie ir dzelteni. Turklāt krāsas intensitāte palielinās, palielinoties elementa atomu skaitam.
Peroksīdi. Izgatavots, sadedzinot metālus skābekļa pārpalikumā. Sārmu metālu peroksīdus var uzskatīt par ūdeņraža peroksīda atvasinājumiem, jo Tie mijiedarbojas ar skābēm un ūdeni, veidojot ūdeņraža peroksīdu:
M 2 O 2 + H 2 SO 4 = M 2 SO 4 + H 2 O 2
M2O2 + 2H2O = 2MOH + H2O2
Vissvarīgākais ir nātrija peroksīds, ko izmanto skābekļa ražošanai slēgtās telpās (piemēram, Zemūdene):
2Na 2O 2 + 2CO 2 = 2Na 2CO 3 + 2O 2
Hidroksīdi. Tehnoloģijā tos sauc par kodīgajiem sārmiem (NaOH - kaustiskā soda, KOH - kaustiskā kālija). Tās ir bezkrāsainas, kūstošas vielas. Izkausētā stāvoklī tie mijiedarbojas ar stiklu, porcelānu un platīnu. Tāpēc sārmu kausēšana tiek veikta sudraba vai dzelzs tīģeļos, ar kuriem tie nesadarbojas. Hidroksīdi labi šķīst ūdenī ar augstu siltuma izdalīšanos.
Hidroksīdus sagatavo šādos veidos:
a) metālu vai oksīdu mijiedarbība ar ūdeni:
Li 2 O + H 2 O = 2 LiOH
Šo reakciju izmanto tikai ļoti tīru hidroksīdu iegūšanai.
b) Kaustizācijas reakcija ir vecākā zināmā kaustiskās soda iegūšanas metode. Šī metode sastāv no sodas šķīduma apstrādes ar kalcija hidroksīdu (dzēstiem kaļķiem) vārīšanas laikā. Iegūto nešķīstošo kalcija karbonātu filtrē vai no tā dekantē dzidru šķidrumu:
Na 2 CO 3 + Ca(OH) 2 = 2NaOH + CaCO 3
Iegūto nātrija hidroksīda šķīdumu koncentrē, iztvaicējot vakuumā. Cietā kaustiskā soda tiek izkausēta 500 o C temperatūrā, lai pilnībā noņemtu ūdeni, un iegūst NaOH, kas satur 3-4% Na 2 CO 3. Šādā veidā iegūto NaOH sauc par "kaustisko sodu".
c) Sārmu metālu hlorīdu elektrolīze ūdens šķīdumā ir moderna rūpnieciska metode NaOH un KOH iegūšanai vienlaikus ar hloru. Kad NaCl šķīdums tiek pakļauts elektrolīzei ar inertiem elektrodiem (platīns, grafīts), pie anoda izdalās hlors un pie katoda – ūdeņradis. Katoda telpā uzkrājas Na + joni un OH - joni, kas veido NaOH.
d) Sakausējot sārmu metālu karbonātus ar oksīdiem un pēc tam apstrādājot sakausējumu ar ūdens tvaiku:
Fe 2 O 3 + Na 2 CO 3 = 2NaFeO 2 + CO 2
2NaFeO2 + H2O = 2NaOH + Fe2O3
Sārmi ir vissvarīgākās izejvielas ķīmiskā rūpniecība krāsvielu, glāžu, ziepju, papīra, mākslīgo šķiedru, medikamentu ražošanai.
Sāls. NaCl un KCl dabā sastopami lielos daudzumos. NaCl (galda sāls) ir atrodams jūras ūdens(vidēji 2,7%) un akmeņsāls veidā nogulumos līdz pat vairāku kilometru biezumā. Tīrā veidā NaCl un KCl iegūst no dabīgiem hlorīdiem, pārkristalizējot. Litija sāļus iegūst no dabīgā litija karbonāta. Rubidija un cēzija sāļu iegūšana ir saistīta ar grūtībām, jo to šķīdība ir ļoti tuva kālija sāļu šķīdībai. Parasti tie sākas no mātes šķidrumiem, kas paliek pēc karnalīta pārkristalizācijas, un no tiem izolē rubidiju un cēzija alaunu, kas tiek attīrīts pārkristalizācijas ceļā. Rubidijs tiek atdalīts no cēzija, izmantojot to karbonātu dažādās šķīdības spirtā.
No nitrātiem praktiska nozīme ir NaNO 3 un KNO 3. Tehniskie nosaukumi ir nātrija nitrāts un kālija nitrāts. Abi sāļi tiek izmantoti kā minerālmēsli. KNO 3 izmanto arī melnā pulvera ražošanai (NaNO 3 neizmanto tā higroskopiskuma dēļ).
Ogļskābe H 2 CO 3 dod divas sārmu metālu karbonātu sērijas, skābos (MHCO 3) un vidējos (M 2 CO 3).Skābie karbonāti (ogļūdeņraži, bikarbonāti) ir zināmi visiem sārmu metāliem, izņemot litiju. Visi neitrālie karbonāti, izņemot litija karbonātu, labi šķīst ūdenī. Na 2 CO 3 – soda, dažkārt dabiski sastopama dažu ezeru un minerālavotu ūdeņos. Sodu iegūst, izmantojot amonjaka metodi: galda sāls šķīdumu piesātina ar amonjaku un oglekļa dioksīdu. Šajā gadījumā NaHCO 3 izgulsnējas, jo soda ir mazāk šķīstoša nekā NH4Cl:
NaCl + H 2 O + CO 2 + NH 3 = NaHCO 3 ¯ + NH 4 Cl
2NaHCO 3 → Na 2 CO 3 + CO 2 + H 2 O
K 2 CO 3 – potašs, higroskopisks balts pulveris, labi šķīst ūdenī. Sagatavots, karbonizējot kālija hidroksīdu:
2KOH + CO 2 = K 2 CO 3 + H 2 O
Potašu izmanto ziepju un stikla rūpniecībā, vates krāsošanā un balināšanā, kālija cianīda ražošanā un organiskajā sintēzē.
Sērskābe dod divas sārmu metālu sulfātu sērijas - skābu un vidēju.
Na 2 SO 4 iegūst kā blakusproduktu sālsskābes ražošanā no nātrija hlorīda un sērskābes. No ūdens šķīdumiem nātrija sulfāts kristalizējas Na 2 SO 4 formā. 10H 2 O, tehnoloģijā šo kristālisko hidrātu sauc par Glaubera sāli. Izmanto kokvilnas audumu krāsošanā un medicīnā.
· · ·§ 96. Sārmains
Sārmu metālu grupā ietilpst šādas metālu sērijas; Li, Na, K, Rb, Cs, Fr. Tie ir periodiskās tabulas I grupas galvenajā apakšgrupā.
Tie visi ir līdzīgi ar to, ka uz to ārējā elektroniskā slāņa ir viens elektrons (18. tabula)/.
Sārma elementi ir starp s-elementiem. Sārmu metālu atoma ārējā elektronu slāņa elektrons atrodas vistālāk no kodola, salīdzinot ar citiem tā paša perioda elementiem, t.i., sārmu metāla atoma rādiuss ir lielākais, salīdzinot ar citu elementu atomu rādiusiem. tajā pašā periodā. Pienākas
|
Pamatmaksa |
Elektronu skaits enerģijas līmeņos |
Atomu rādiuss |
|||||||
ar to sārmu metālu atomu ārējā slāņa valences elektrons tiek viegli noņemts, pārvēršot tos pozitīvos atsevišķi lādētos jonos. Tas ir saistīts ar faktu, ka sārmu metālu savienojumi ar citiem elementiem tiek veidoti atbilstoši jonu saites veidam.
Redoksreakcijās tie darbojas kā spēcīgi reducējoši aģenti, un šī spēja palielinās no metāla uz metālu, palielinoties atoma kodola lādiņam.
§ 97. Nātrijs
Nātrija atoma elektroniskā konfigurācija ir ls 2 2s 2 2p 6 3s 1. Tā ārējā slāņa struktūra:
Nātrijs dabā sastopams tikai sāļu veidā. Visizplatītākais nātrija sāls ir galda sāls NaCl, kā arī minerāls silvinīts KCl · NaCl un daži sērskābes sāļi, piemēram, Glaubera sāls Na2SO4 · 10H2O, kas lielos daudzumos atrodams Kaspijas jūras Kara-Bogaz-Gol līcī.
No galda sāls NaCl nātrija metālu iegūst izkausētā sāls elektrolīzē. Elektrolīzes uzstādīšana ir parādīta attēlā. 76. Elektrodus iemērc izkausētā sālī. Anoda un katoda telpas ir atdalītas ar diafragmu, kas izolē izveidoto nātriju, lai nenotiktu apgrieztā reakcija. Pozitīvais nātrija jons pieņem elektronu no katoda un kļūst par neitrālu nātrija atomu. Neitrālie nātrija atomi sakrājas pie katoda izkausēta metāla veidā. Katodā notiekošo procesu var attēlot ar šādu diagrammu:
Na++Na0.
Tā kā elektronu pieņemšana notiek pie katoda un visa elektronu pieņemšana ar atomu vai jonu ir samazinājums, nātrija joni katoda tiek samazināti. Pie anoda hlora joni atdod elektronus, t.i., notiek oksidēšanās un brīvo vielu izdalīšanās process.
hlora gāze, ko var attēlot ar šādu diagrammu:
Cl — — e— → Cl 0
Iegūtais nātrija metāls ir sudrabaini baltā krāsā, un to var viegli sagriezt ar nazi. Nātrija griezumam, ja to pārbauda uzreiz pēc griezuma, ir spilgts metālisks spīdums, taču tas ātri izbalinās, pateicoties īpaši ātrai metāla oksidēšanai.
![]()
Rīsi. 76. Izkausētā sāls elektrolīzes uzstādīšanas shēma.
1 - gredzena katods; 2 - zvans hlora gāzes noņemšanai no anoda telpas
Ja nātriju oksidē nelielā skābekļa daudzumā aptuveni 180° temperatūrā, iegūst nātrija oksīdu:
4Na + O2 = 2Na2O.
Dedzinot skābeklī, rodas nātrija peroksīds:
2Na + O2 = Na2O2.
Šajā gadījumā nātrijs deg ar žilbinoši dzeltenu liesmu.
Pateicoties vieglai un ātrai nātrija oksidācijai, tas tiek uzglabāts zem petrolejas vai parafīna slāņa, kas ir vēlams, jo noteikts gaisa daudzums joprojām izšķīst petrolejā un nātrija oksidēšanās, kaut arī lēni, tomēr notiek.
Nātrijs var apvienoties ar ūdeņradi - hidrīds NaH, kurā tā oksidācijas pakāpe ir 1. Šis ir sāļiem līdzīgs savienojums, kas ķīmiskās saites rakstura un oksidācijas pakāpes lieluma dēļ atšķiras no IV grupas galveno apakšgrupu elementu gaistošajiem hidrīdiem. -VII.
Nātrija metāls var reaģēt ne tikai ar skābekli un ūdeņradi, bet arī ar daudzām vienkāršām un sarežģītām vielām. Piemēram, javā ar sēru samaļ nātrijs spēcīgi reaģē ar to, veidojot:
2Na + S = Na2S
Reakciju pavada uzliesmojumi, tāpēc javu vajadzētu turēt prom no acīm un ietīt roku dvielī. Reakcijai jālieto mazi nātrija gabaliņi.
Nātrijs enerģiski sadedzina hlorā, veidojot nātrija hlorīdu, ko īpaši labi novērot kalcija hlorīda caurulē, kurā hlora strāva tiek izlaista caur izkausētu un ļoti uzkarsētu nātriju:
2Na + Cl2 = 2NaCl
Nātrijs reaģē ne tikai ar vienkāršām, bet arī sarežģītām vielām, piemēram, ūdeni, izspiežot to no tā, jo tas ir ļoti aktīvs metāls, sprieguma sērijā ir daudz pa kreisi no ūdeņraža un viegli izspiež pēdējo no ūdens:
2Na + 2H2O = 2NaOH + H2
Sārmu metālu ugunsgrēku nevar nodzēst ar ūdeni. Vislabāk to piepildīt ar sodas pelnu pulveri. Nātrija klātbūtnē gāzes degļa bezkrāsainā liesma kļūst dzeltena.
Nātrija metālu var izmantot kā katalizatoru organiskajā sintēzē, piemēram, sintētiskā kaučuka ražošanā no butadiēna. Tas kalpo kā izejmateriāls citu nātrija savienojumu, piemēram, nātrija peroksīda, ražošanai.
■ 27. Izmantojot tekstā dotos vienādojumus reakcijām, kurās iesaistīts metālisks nātrijs, pierādiet, ka tas darbojas kā reducētājs.
28. Kāpēc nātriju nevar uzglabāt gaisā?
29. Students iemērca nātrija gabalu vara sulfāta šķīdumā, cerot izspiest no sāls metāla sāli. Sarkanā metāla vietā rezultāts bija želatīnzilas nogulsnes. Aprakstiet notikušās reakcijas un uzrakstiet to vienādojumus molekulārā un jonu formā. Kā jāmaina reakcijas apstākļi, lai reakcija novestu pie vēlamā rezultāta? Uzrakstiet vienādojumus molekulārās, pilnās un saīsinātās jonu formās.
30. 2,3 g nātrija metāla ievietoja traukā ar 45 ml ūdens. Kāds ir nātrija hidroksīda daudzums, kas veidojas reakcijas beigās?
31. Ar kādiem līdzekļiem var dzēst nātrija ugunsgrēku? Sniedziet argumentētu atbildi.
§ 98. Nātrija skābekļa savienojumi. Nātrija hidroksīds
Nātrija skābekļa savienojumi, kā jau minēts, ir nātrija oksīds Na2O un nātrija peroksīds Na2O2.
Nātrija oksīds Na2O nav īpaši svarīgs. Tas enerģiski reaģē ar ūdeni, veidojot kodīgu soda:
Na2O + H2O = 2NaOH
Nātrija peroksīds Na202 ir dzeltenīgs pulveris. To var uzskatīt par sava veida ūdeņraža peroksīda sāli, jo tā struktūra ir tāda pati kā H2O2. Tāpat kā nātrija peroksīds, tas ir spēcīgs oksidētājs. Saskaroties ar ūdeni, tas veido sārmu un:
Na2O2 + H2O = H2O2 + 2NaOH
veidojas arī atšķaidītām skābēm iedarbojoties uz nātrija peroksīdu:
Na2O2 + H2SO4 = H2O2 + Na2SO4
Visas iepriekš minētās nātrija peroksīda īpašības ļauj to izmantot visu iespējamo materiālu balināšanai.
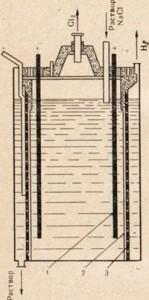
Rīsi. 77. Galda sāls šķīduma elektrolīzes iekārtas shēma.
1 - anods; 2 - diafragma, kas atdala anoda un katoda telpas; 3-katods
Ļoti svarīgs nātrija savienojums ir nātrija hidroksīds jeb nātrija hidroksīds, NaOH. To sauc arī par kaustisko sodu vai vienkārši kodīgu.
Kaustiskās soda iegūšanai izmanto galda sāli, lētāko dabīgo nātrija savienojumu, pakļaujot to elektrolīzei, taču šajā gadījumā izmanto nevis kausējumu, bet gan sāls šķīdumu (77. att.). Galda sāls šķīduma elektrolīzes procesa aprakstu skatīt § 33. Zīm. 77 parāda, ka anoda un katoda telpas ir atdalītas ar diafragmu. Tas tiek darīts tā, lai iegūtie produkti nesaskartos viens ar otru, piemēram, Cl2 + 2NaOH = NaClO + NaCl + H2O.
Kaustiskā soda ir balta kristāliska cieta viela, labi šķīst ūdenī. Kad kaustiskā soda tiek izšķīdināta ūdenī, tā izdalās liels skaits uzkarsē un šķīdums kļūst ļoti karsts. Kaustiskā soda jāuzglabā labi noslēgtos traukos, lai pasargātu to no ūdens tvaiku iekļūšanas, kuru ietekmē tā var ļoti samitrināt, kā arī no oglekļa dioksīda, kura ietekmē kaustiskā soda var pakāpeniski pārvērsties par nātrija karbonātu. :
2NaOH + CO2 = Na2CO3+ H2O.
Kaustiskā soda ir tipisks sārms, tāpēc piesardzības pasākumi, strādājot ar to, ir tādi paši kā strādājot ar citiem sārmiem.
Kaustiskā soda tiek izmantota daudzās nozarēs, piemēram, naftas produktu attīrīšanai, ziepju ražošanai no taukiem, papīra rūpniecībā, mākslīgo šķiedru un krāsvielu ražošanā, zāļu ražošanā utt. 78).
Pierakstiet piezīmju grāmatiņā kaustiskās sodas lietošanas vietas.
No nātrija sāļiem pirmām kārtām jāatzīmē galda sāls NaCl, kas kalpo kā galvenā izejviela kaustiskās sodas un metāliskā nātrija ražošanai (vairāk par šo sāli skatīt 164. lpp.), sodas Na2CO3 (skat. lpp. 278), Na2SO4 (skat. 224. lpp.), NaNO3 (skat. 250. lpp.) utt.
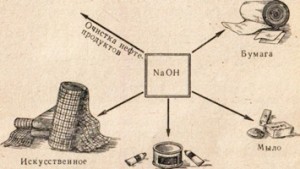
Rīsi. 78. Kaustiskās sodas lietošana
■ 32. Aprakstiet nātrija hidroksīda iegūšanas metodi ar galda sāls elektrolīzi.
33. Kaustisko sodu var pagatavot, apstrādājot nātrija karbonātu ar dzēstiem kaļķiem. Pierakstiet šīs reakcijas vienādojuma molekulārās un jonu formas, kā arī aprēķiniet, cik daudz sodas, kas satur 95% karbonātu, būs nepieciešams, lai iegūtu 40 kg nātrija hidroksīda.
34. Kāpēc, uzglabājot kaustiskās sodas šķīdumu kolbās ar iezemētiem aizbāžņiem, aizbāžņi “pielīp” un tos nevar noņemt? Ja kādu laiku pudeli turat apgāztu ūdenī, aizbāzni var viegli noņemt. Paskaidrojiet, sniedzot reakciju vienādojumus, kādi procesi notiek šajā gadījumā.
35. Uzrakstiet molekulārās un jonu formās reakcijas vienādojumus, kas raksturo kaustiskās sodas kā tipiska sārma īpašības.
36. Kādi piesardzības pasākumi jāievēro, strādājot ar kodīgo sodu? Kādi pirmās palīdzības pasākumi jāveic kaustiskās sodas apdegumiem?
§ 99. Kālijs
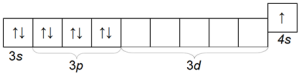
Kālijs K ir arī diezgan izplatīts sārmu metāls, kas no nātrija atšķiras ar atomu rādiusa lielumu (ceturtais periods) un tāpēc tam ir lielāka ķīmiskā aktivitāte nekā nātrijam. Kālija atoma elektroniskā konfigurācija ir 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1.
Tā ārējā elektroniskā slāņa struktūra
Kālijs ir mīksts metāls, ko var labi sagriezt ar nazi. Lai izvairītos no oksidēšanās, tas, tāpat kā nātrijs, tiek uzglabāts zem petrolejas slāņa.
Kālijs reaģē ar ūdeni vēl spēcīgāk nekā nātrijs, veidojot sārmu un izdalot ūdeņradi, kas aizdegas:
2K + 2H2O = 2KOH + H2.
Dedzinot skābeklī (un sadegšanai ieteicams ņemt pat mazākus metāla gabalus nekā nātrija dedzināšanai), tas, tāpat kā nātrijs, ļoti spēcīgi deg, veidojot kālija peroksīdu.
Jāatzīmē, ka kālijs ir daudz bīstamāks par nātriju, kas atrodas apritē. Spēcīgs sprādziens var notikt pat griežot kāliju, tāpēc jums ir jārīkojas vēl uzmanīgāk.
Kālija hidroksīds jeb kālija hidroksīds KOH ir balta kristāliska viela. Kaustiskais kālijs visos aspektos ir līdzīgs kaustiskajai sodai. Tos plaši izmanto ziepju rūpniecībā, taču to ražošana ir nedaudz dārgāka, tāpēc to neizmanto tāpat kā NaOH.
Īpaši jāatzīmē kālija sāļi, jo daži no tiem tiek plaši izmantoti kā mēslojums. Tie ir kālija hlorīds KCl, kālija nitrāts KNO3, kas arī ir slāpekļa mēslojums.
■ 37. Kā mēs varam izskaidrot faktu, ka kaustiskais kālijs ir ķīmiski aktīvāks nekā kaustiskā soda?
38. Kālija gabals tika pazemināts kristalizētājā ar ūdeni. Kad reakcija bija pabeigta, tur ievietoja nedaudz cinka baltu želatīna nogulšņu veidā. Nogulsnes pazuda, un, kad šķīdums tika pārbaudīts ar fenolftaleīnu, pēdējais kļuva sārtināts. Kādi ķīmiskie procesi šeit notika?
Kuri no tiem ir šķīdumā? Sniedziet argumentētu atbildi.
39. Kāpēc kālijs, tāpat kā visi sārmu metāli, ir klasificēts kā s-elementu saimes pārstāvis?
Sārmu metāli viegli reaģē ar nemetāliem:
2K + I 2 = 2KI
2Na + H2 = 2NaH
6Li + N 2 = 2Li 3 N (reakcija notiek istabas temperatūrā)
2Na + S = Na 2 S
2Na + 2C = Na 2 C 2
Reakcijās ar skābekli katrs sārmu metāls parāda savu individualitāti: sadedzinot gaisā, litijs veido oksīdu, nātrijs - peroksīdu, kālijs - superoksīdu.
4Li + O 2 = 2 Li 2 O
2Na + O 2 = Na 2 O 2
K + O 2 = KO 2
Nātrija oksīda sagatavošana:
10Na + 2NaNO3 = 6Na2O + N2
2Na + Na2O2 = 2Na2O
2Na + 2NaON = 2Na2O + H2
Mijiedarbība ar ūdeni izraisa sārmu un ūdeņraža veidošanos.
2Na + 2H2O = 2NaOH + H2
Mijiedarbība ar skābēm:
2Na + 2HCl = 2NaCl + H2
8Na + 5H2SO4 (konc.) = 4Na2SO4 + H2S + 4H2O
2Li + 3H2SO4 (konc.) = 2LiHSO4 + SO2 + 2H2O
8Na + 10HNO3 = 8NaNO3 + NH4NO3 + 3H2O
Mijiedarbojoties ar amonjaku, veidojas amīdi un ūdeņradis:
2Li + 2NH3 = 2LiNH2 + H2
Mijiedarbība ar organiskiem savienojumiem:
H ─ C ≡ C ─ H + 2Na → Na ─ C≡C ─ Na + H 2
2CH 3 Cl + 2Na → C 2 H 6 + 2 NaCl
2C 6 H 5 OH + 2 Na → 2C 6 H 5 ONa + H 2
2CH3OH + 2Na → 2CH3ONa +H2
2СH 3 COOH + 2Na → 2CH 3 COOOONa + H 2
Kvalitatīva reakcija uz sārmu metāliem ir liesmas iekrāsošanās ar to katjoniem. Li + jons krāso liesmu karmīna sarkanā krāsā, Na + jons - dzeltenā, K + - violetā krāsā.
Sārmu metālu savienojumi
Oksīdi.
Sārmu metālu oksīdi ir tipiski pamata oksīdi. Tie reaģē ar skābiem un amfoteriskiem oksīdiem, skābēm un ūdeni.
3Na 2 O + P 2 O 5 = 2Na 3 PO 4
Na 2 O + Al 2 O 3 = 2 NaAlO 2
Na 2 O + 2 HCl = 2 NaCl + H 2 O
Na2O + 2H+ = 2Na + + H2O
Na 2 O + H 2 O = 2NaOH
Peroksīdi.
2Na 2 O 2 + CO 2 = 2Na 2 CO 3 + O 2
Na 2 O 2 + CO = Na 2 CO 3
Na 2 O 2 + SO 2 = Na 2 SO 4
2Na 2O + O 2 = 2Na 2O 2
Na 2 O + NO + NO 2 = 2 NaNO 2
2Na 2O 2 = 2Na 2O + O 2
Na 2 O 2 + 2 H 2 O (auksts) = 2 NaOH + H 2 O 2
2Na2O2 + 2H2O (hor.) = 4NaOH + O 2
Na 2 O 2 + 2 HCl = 2 NaCl + H 2 O 2
2Na 2 O 2 + 2H 2 SO 4 (dalīts horizonts) = 2Na 2 SO 4 + 2H 2 O + O 2
2Na 2 O 2 + S = Na 2 SO 3 + Na 2 O
5Na 2 O 2 + 8H 2 SO 4 + 2 KMnO 4 = 5O 2 + 2 MnSO 4 + 8H 2 O + 5Na 2 SO 4 + K 2 SO 4
Na 2 O 2 + 2H 2 SO 4 + 2 NaI = I 2 + 2 Na 2 SO 4 + 2 H 2 O
Na 2 O 2 + 2H 2 SO 4 + 2FeSO 4 = Fe 2 (SO 4) 3 + Na 2 SO 4 + 2H 2 O
3Na2O2 + 2Na3 = 2Na2CrO4 + 8NaOH + 2H2O
Bāzes (sārmi).
2NaOH (pārmērīgs) + CO 2 = Na 2 CO 3 + H 2 O
NaOH + CO 2 (pārpalikums) = NaHCO 3
SO 2 + 2NaOH (pārpalikums) = Na 2 SO 3 + H 2 O
SiO 2 + 2NaOH Na 2 SiO 3 + H 2 O
2NaOH + Al 2 O 3 2 NaAlO 2 + H 2 O
2NaOH + Al 2 O 3 + 3H 2 O = 2Na
NaOH + Al(OH) 3 = Na
2NaOH + 2Al + 6H2O = 2Na + 3H2
2KOH + 2NO2 + O2 = 2KNO3 + H2O
KOH + KHCO 3 = K 2 CO 3 + H 2 O
2NaOH + Si + H2O = Na2SiO3 + H2
3KOH + P 4 + 3H 2 O = 3KH 2 PO 2 + PH 3
2KOH (auksts) + Cl 2 = KClO + KCl + H 2 O
6KOH (karsts) + 3Cl 2 = KClO 3 + 5KCl + 3H 2 O
6NaOH + 3S = 2Na2S + Na2SO3 + 3H2O
2NaNO 3 2NaNO 2 + O 2
NaHCO 3 + HNO 3 = NaNO 3 + CO 2 + H 2 O
NaI → Na + + I –
pie katoda: 2H 2 O + 2e → H 2 + 2OH – 1
pie anoda: 2I – – 2e → I 2 1
2H 2O + 2I – ![]() H 2 + 2OH – + I 2
H 2 + 2OH – + I 2
2H2O + 2NaI ![]() H2 + 2NaOH + I 2
H2 + 2NaOH + I 2
2 NaCl ![]() 2Na + Cl2
2Na + Cl2
pie katoda pie anoda
2Na2HPO4Na4P2O7+H2O
KNO 3 + 4Mg + 6H2O = NH3 + 4Mg(OH)2 + KOH
4KClO 3 KCl + 3KClO 4
2KClO3 ![]() 2KCl + 3O 2
2KCl + 3O 2
KClO 3 + 6HCl = KCl + 3Cl 2 + 3H 2 O
Na 2 SO 3 + S = Na 2 S 2 O 3
Na 2 S 2 O 3 + H 2 SO 4 = Na 2 SO 4 + S↓ + SO 2 + H 2 O
2NaI + Br2 = 2NaBr + I 2
2NaBr + Cl2 = 2NaCl + Br 2
I A grupa.
1. Elektriskās izlādes tika izvadītas virs kolbā ielieta kaustiskās sodas šķīduma virsmas, un gaiss kolbā kļuva brūns, kas pēc kāda laika pazuda. Iegūtais šķīdums tika rūpīgi iztvaicēts un tika noteikts, ka cietais atlikums ir divu sāļu maisījums. Karsējot šo maisījumu, izdalās gāze un paliek vienīgā viela. Uzrakstiet aprakstīto reakciju vienādojumus.
2. Viela, kas izdalījās pie katoda izkausēta nātrija hlorīda elektrolīzes laikā, tika sadedzināta skābeklī. Iegūtais produkts tika ievietots gazometrā, kas piepildīts ar oglekļa dioksīdu. Iegūto vielu pievieno amonija hlorīda šķīdumam un šķīdumu karsēja. Uzrakstiet aprakstīto reakciju vienādojumus.
3) Slāpekļskābe tika neitralizēta ar cepamo sodu, neitrālais šķīdums tika rūpīgi iztvaicēts un atlikums tika kalcinēts. Iegūto vielu pievienoja ar sērskābi paskābinātam kālija permanganāta šķīdumam, un šķīdums kļuva bezkrāsains. Slāpekli saturošais reakcijas produkts tika ievietots nātrija hidroksīda šķīdumā un tika pievienoti cinka putekļi, un tika atbrīvota gāze ar asu smaku. Uzrakstiet aprakstīto reakciju vienādojumus.
4) Viela, kas iegūta pie anoda nātrija jodīda šķīduma elektrolīzes laikā ar inertiem elektrodiem, tika reaģēta ar kāliju. Reakcijas produkts tika uzkarsēts ar koncentrētu sērskābi, un atbrīvotā gāze tika izlaista caur karstu kālija hromāta šķīdumu. Uzrakstiet aprakstīto reakciju vienādojumus
5) Viela, kas iegūta pie katoda izkausēta nātrija hlorīda elektrolīzes laikā, tika sadedzināta skābeklī. Iegūtais produkts tika secīgi apstrādāts ar sēra dioksīdu un bārija hidroksīda šķīdumu. Uzrakstiet aprakstīto reakciju vienādojumus
6) Baltais fosfors izšķīst kālija hidroksīda šķīdumā, izdalot gāzi ar ķiploku smaržu, kas gaisā spontāni aizdegas. Degšanas reakcijas cietais produkts reaģēja ar kaustisko sodu tādā proporcijā, ka iegūtā baltā viela satur vienu ūdeņraža atomu; kad pēdējo vielu kalcinē, veidojas nātrija pirofosfāts. Uzrakstiet aprakstīto reakciju vienādojumus
7) Nezināms metāls tika sadedzināts skābeklī. Reakcijas produkts mijiedarbojas ar oglekļa dioksīdu, veidojot divas vielas: cietu vielu, kas reaģē ar sālsskābes šķīdumu, izdalot oglekļa dioksīdu, un gāzveida vienkāršu vielu, kas veicina degšanu. Uzrakstiet aprakstīto reakciju vienādojumus.
8) Brūna gāze tika izlaista caur pārmērīgu kaustiskā kālija šķīduma daudzumu liela gaisa pārpalikuma klātbūtnē. Iegūtajam šķīdumam pievienoja magnija skaidas un karsēja, un iegūtā gāze neitralizēja slāpekļskābi. Iegūtais šķīdums tika rūpīgi iztvaicēts, un cietais reakcijas produkts tika kalcinēts. Uzrakstiet aprakstīto reakciju vienādojumus.
9) Kad termiskā sadalīšanās sāļi A mangāna dioksīda klātbūtnē veido bināro sāli B un gāzi, kas veicina degšanu un ir daļa no gaisa; Karsējot šo sāli bez katalizatora, veidojas sāls B un skābekli saturošas skābes sāls. Sālim A mijiedarbojoties ar sālsskābi, izdalās dzeltenzaļa gāze (vienkārša viela) un veidojas sāls B. Sāls B pārvērš liesmu purpursarkanā krāsā, un, mijiedarbojoties ar sudraba nitrāta šķīdumu, veidojas baltas nogulsnes. Uzrakstiet aprakstīto reakciju vienādojumus.
10) Karsētai koncentrētai sērskābei pievienoja vara skaidas, un izdalītā gāze tika izlaista caur kaustiskās sodas šķīdumu (pārpalikums). Reakcijas produkts tika izolēts, izšķīdināts ūdenī un karsēts ar sēru, kas reakcijas rezultātā izšķīdis. Iegūtajam šķīdumam pievienoja atšķaidītu sērskābi. Uzrakstiet aprakstīto reakciju vienādojumus.
11) Galda sāli apstrādāja ar koncentrētu sērskābi. Iegūto sāli apstrādāja ar nātrija hidroksīdu. Iegūtais produkts tika kalcinēts ar lieko akmeņogļu daudzumu. Atbrīvotā gāze katalizatora klātbūtnē reaģēja ar hloru. Uzrakstiet aprakstīto reakciju vienādojumus.
12) Nātrijs reaģēja ar ūdeņradi. Reakcijas produkts tika izšķīdināts ūdenī, kas veidoja gāzi, kas reaģēja ar hloru, un iegūtais šķīdums, karsējot, reaģēja ar hloru, veidojot divu sāļu maisījumu. Uzrakstiet aprakstīto reakciju vienādojumus.
13) Skābekļa pārpalikumā tika sadedzināts nātrijs, iegūtā kristāliskā viela tika ievietota stikla mēģenē un caur to tika izlaista oglekļa dioksīds. Gāze, kas izplūst no caurules, tika savākta, un tās atmosfērā tika sadedzināts fosfors. Iegūtā viela tika neitralizēta ar nātrija hidroksīda šķīduma pārpalikumu. Uzrakstiet aprakstīto reakciju vienādojumus.
14) Sālsskābes šķīdumu pievienoja šķīdumam, kas iegūts, nātrija peroksīdam reaģējot ar ūdeni, karsējot līdz reakcijas beigām. Iegūtā sāls šķīdums tika pakļauts elektrolīzei ar inertiem elektrodiem. Gāze, kas veidojas elektrolīzes rezultātā pie anoda, tika izlaista caur kalcija hidroksīda suspensiju. Uzrakstiet aprakstīto reakciju vienādojumus.
15) Sēra dioksīds tika izlaists caur nātrija hidroksīda šķīdumu, līdz izveidojās vidējs sāls. Iegūtajam šķīdumam pievienoja kālija permanganāta ūdens šķīdumu. Iegūtās nogulsnes atdala un apstrādāja ar sālsskābi. Atbrīvotā gāze tika izlaista caur aukstu kālija hidroksīda šķīdumu. Uzrakstiet aprakstīto reakciju vienādojumus.
16) Silīcija (IV) oksīda un magnija metāla maisījums tika kalcinēts. Reakcijas rezultātā iegūto vienkāršo vielu apstrādāja ar koncentrētu nātrija hidroksīda šķīdumu. Atbrīvotā gāze tika izvadīta virs uzkarsēta nātrija. Iegūtā viela tika ievietota ūdenī. Uzrakstiet aprakstīto reakciju vienādojumus.
17) Litija reakcijas produkts ar slāpekli tika apstrādāts ar ūdeni. Iegūtā gāze tika izlaista caur sērskābes šķīdumu, līdz ķīmiskās reakcijas apstājās. Iegūto šķīdumu apstrādāja ar bārija hlorīda šķīdumu. Šķīdumu filtrēja, filtrātu sajauc ar nātrija nitrāta šķīdumu un karsēja. Uzrakstiet aprakstīto reakciju vienādojumus.
18) Nātriju karsēja ūdeņraža atmosfērā. Pievienojot iegūtajai vielai ūdeni, tika novērota gāzes izdalīšanās un dzidra šķīduma veidošanās. Caur šo šķīdumu tika izlaista brūnā gāze, kas iegūta vara mijiedarbības rezultātā ar koncentrētu šķīdumu slāpekļskābe. Uzrakstiet aprakstīto reakciju vienādojumus.
19) Nātrija bikarbonāts tika kalcinēts. Iegūtais sāls tika izšķīdināts ūdenī un sajaukts ar alumīnija šķīdumu, kā rezultātā veidojās nogulsnes un izdalījās bezkrāsaina gāze. Nogulsnes apstrādāja ar slāpekļskābes šķīduma pārpalikumu, un gāze tika izlaista caur kālija silikāta šķīdumu. Uzrakstiet aprakstīto reakciju vienādojumus.
20) Nātrijs tika sakausēts ar sēru. Iegūtais savienojums tika apstrādāts ar sālsskābi, atbrīvotā gāze pilnībā reaģēja ar sēra (IV) oksīdu. Iegūto vielu apstrādāja ar koncentrētu slāpekļskābi. Uzrakstiet aprakstīto reakciju vienādojumus.
21) Nātrijs tiek sadedzināts skābekļa pārpalikumā. Iegūto vielu apstrādāja ar ūdeni. Iegūtais maisījums tika uzvārīts, pēc tam karstajam šķīdumam pievienoja hloru. Uzrakstiet aprakstīto reakciju vienādojumus.
22) Kāliju karsēja slāpekļa atmosfērā. Iegūto vielu apstrādāja ar sālsskābes pārākumu, pēc tam iegūtajam sāļu maisījumam pievienoja kalcija hidroksīda suspensiju un karsēja. Iegūtā gāze tika izlaista caur karstu vara (II) oksīdu Uzrakstiet aprakstīto reakciju vienādojumus.
23) Kāliju sadedzināja hlora atmosfērā, iegūto sāli apstrādāja ar sudraba nitrāta ūdens šķīduma pārpalikumu. Izveidojušās nogulsnes filtrēja, filtrātu iztvaicē un uzmanīgi karsēja. Iegūtais sāls tika apstrādāts ūdens šķīdums broms Uzrakstiet aprakstīto reakciju vienādojumus.
24) Litijs reaģēja ar ūdeņradi. Reakcijas produkts tika izšķīdināts ūdenī, kas veidoja gāzi, kas reaģēja ar bromu, un iegūtais šķīdums, karsējot, reaģēja ar hloru, veidojot divu sāļu maisījumu. Uzrakstiet aprakstīto reakciju vienādojumus.
25) Nātrijs tika sadedzināts gaisā. Iegūtā cietā viela absorbē oglekļa dioksīdu, atbrīvojot skābekli un sāli. Pēdējais sāls tika izšķīdināts sālsskābē, un iegūtajam šķīdumam pievienoja sudraba nitrāta šķīdumu. Izveidojās baltas nogulsnes. Uzrakstiet aprakstīto reakciju vienādojumus.
26) Skābeklis tika pakļauts elektriskās izlādes iedarbībai ozonizatorā. Iegūtā gāze tika izlaista caur kālija jodīda ūdens šķīdumu, un tika atbrīvota jauna gāze, bezkrāsains un bez smaržas, veicinot degšanu un elpošanu. Pēdējās gāzes atmosfērā nātrijs tika sadedzināts, un iegūtā cietā viela reaģēja ar oglekļa dioksīdu. Uzrakstiet aprakstīto reakciju vienādojumus.
I A grupa.
1. N 2 + O 2 ![]() 2NĒ
2NĒ
2NO + O 2 = 2NO 2
2NO 2 + 2NaOH = NaNO 3 + NaNO 2 + H 2 O
2NaNO 3 2NaNO 2 + O 2
2. 2NaCl ![]() 2Na + Cl2
2Na + Cl2
pie katoda pie anoda
2Na + O 2 = Na 2 O 2
2Na 2 O 2 + 2CO 2 = 2Na 2 CO 3 + O 2
Na 2 CO 3 + 2NH 4 Cl = 2NaCl + CO 2 + 2NH 3 + H 2 O
3. NaHCO 3 + HNO 3 = NaNO 3 + CO 2 + H 2 O
2NaNO 3 2NaNO 2 + O 2
5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O
NaNO 3 + 4Zn + 7NaOH + 6H 2 O = 4Na 2 + NH 3
4. 2H2O + 2NaI ![]() H2 + 2NaOH + I 2
H2 + 2NaOH + I 2
2K + I 2 = 2KI
8KI + 5H 2 SO 4 (konc.) = 4K 2 SO 4 + H 2 S + 4I 2 + 4H 2 O
3H 2S + 2K 2 CrO 4 + 2H 2 O = 2Cr(OH) 3 ↓ + 3S↓ + 4KOH
5. 2NaCl ![]() 2Na + Cl2
2Na + Cl2
pie katoda pie anoda
2Na + O 2 = Na 2 O 2
Na 2 O 2 + SO 2 = Na 2 SO 4
Na 2 SO 4 + Ba(OH) 2 = BaSO 4 ↓ + 2NaOH
6. P 4 + 3KOH + 3H 2 O = 3KH 2 PO 2 + PH 3
2PH 3 + 4O 2 = P 2 O 5 + 3H 2 O
P 2 O 5 + 4 NaOH = 2 Na 2 HPO 4 + H 2 O


