14.08.2019
金属元素にはどのような一般的な特性がありますか? 化学元素としての金属
私たちは幼い頃から、これこれの物体は金属でできているという言葉に直面します。 金属とは何ですか?
金属は、強度の向上、優れた熱伝導性と電気伝導性、展性、延性、金属光沢など、グループ全体に共通する特性を持つ特定の化学元素 (およびその合金) のグループです。
既知の化学元素すべてのほぼ 80% (118 個中 96 個) は金属に属します。
金属の物性
水銀を除くすべての金属は、通常の状態では固体状態です。 硬度の観点から見ると、最も柔らかい金属はセシウムです (10 ポイント モース スケールで 0.2 ポイント)。 最も硬いのはタングステンです。 硬度は6ポイントです。 鉄の硬度 - 4 ポイント。
金属の融点(液体状態への転移)は、水銀の -39 度からタングステンの 3,410 度までさまざまです。 すべてのアルカリ金属は融点が低く、一般的なものにはスズや鉛が含まれます。 ご家庭でもガスバーナーで溶かすことができます。 ほとんどの金属は特殊な炉で高温で溶解されます。
金属の結晶格子には自由に移動できる電子が存在するため、それらはすべて電気と熱を非常によく伝導します。 電気の最良の金属導体は銀、銅、アルミニウムです。 電気配線が最後の 2 つの金属で作られているのは偶然ではありません。
金属の優れた熱伝導性は日常生活でもよく目にします。 水を沸騰させるには、金属製の鍋に水を注ぎ、ストーブの上に置きます。 発熱体は金属を加熱し、金属はほぼすべての熱エネルギーを水に伝達します。
金属の化学的性質
化学反応中、すべての金属は容易に電子を放出し、還元剤として機能します。
ほとんどすべての金属は酸素によって酸化されます。 アルカリ金属 (リチウム、カルシウム) は、通常の状態では酸素と相互作用します。 酸素による他の金属の酸化には高温が必要です。 たとえば、銅線を火で加熱すると、銅は空気中の酸素と反応し、黒い膜 (酸化銅) で覆われます。
- 2Сu +O 2 → 2CuO
金やプラチナは酸素と反応しません。
他の酸化剤には、金属と反応する塩素や硫黄が含まれます。 鉄やすりと硫黄の粉末を混ぜて加熱すると、私たちの目の前で硫化鉄が得られます。
- Fe +S → FeS
金属が異なれば還元活性も異なります。 金属はその活動に応じて次のように分布します。
- Li - K - Ba - Sr - Ca - Na - Mg - Al - Mn - Zn - Cr - Fe - Ca - Co - Ni - Sn - Pb - (H2) - Cu - Hg - Ag - Pt - Au。
この列の金属が左にあるほど、活性が高くなります。 前の要素は、右側にある金属を置き換えることができます。 たとえば、鉄片を硫酸銅の溶液の入った試験管に入れると、茶色のコーティング (銅膜) で覆われます。
- Fe + CuSO4 → FeSO4 + Cu
水素 (H2) の左側にある金属は、水素を塩酸から置き換えることができます。 亜鉛片を塩酸に落とすと、水素が放出され始めます。
- HCl + 亜鉛 → ZnCl2 + H2
アルカリ金属は水と容易に反応します。 水の入った容器にナトリウムを入れると、水素が活発に発生し始め、アルカリが形成されます。
- 2Na + 2H2O → 2NaOH + H2
金属の応用
あなたのおかげで 有益な特性金属は人間の生活にしっかりと浸透しています。 人間は金属の強度を利用して、金属から建物の骨組み(小さなパビリオンから巨大な超高層ビルまで)、機械の本体(自動車、馬車、船、工作機械)、およびさまざまな道具の作動部品を作ります。
意味
自然の中にいること
金属の性質
特徴的な特性 金属
物理的特性 金属
金属の化学的性質
微細構造
アルカリ金属
アルカリ金属の一般的な性質
アルカリ金属の化学的性質
アルカリ金属の調製
水酸化物
炭酸塩
ルビジウム
アルカリ土類金属
カルシウム
ストロンチウム
遷移金属
遷移元素の一般的な特徴
金属の応用
建設資材
電気材料
工具材料
話
マイニング 冶金
メタルは(名前はラテン語の metallum (鉱山) に由来します) - 高い熱伝導率と電気伝導率、正の抵抗温度係数、高い延性などの特徴的な金属特性を持つ元素のグループ。すべての化学元素の約 70% が金属に属します。 。
メタルは











![]()





















![]()


![]()





自然の中にいること
ほとんどの金属は、鉱石や化合物の形で自然界に存在します。 それらは酸化物、硫化物、炭酸塩、その他の化合物を形成します。 純粋な金属を入手し、さらに使用するには、鉱石から金属を分離し、精製を行う必要があります。 必要に応じて金属の合金化等の加工を行います。 科学はこれを研究しています 冶金。 冶金学では鉄金属の鉱石を区別します(に基づいて) 腺)および色付き(含まれていません) 鉄、合計約 70 要素)。 、プラチナも貴金属です。 さらに、それらは微量に存在します。 海水、植物、生物(重要な役割を果たしています)。
人間の体には3%の金属が含まれていることが知られています。 私たちの細胞のほとんどには、カルシウムとナトリウムが濃縮されています。 リンパ系。 マグネシウムは筋肉に蓄積され、 神経系, 銅- 肝臓で、 - 血液で。
金属の性質
メタルは
金属の特性
金属光沢(ヨウ素と黒鉛の形の炭素を除く。金属光沢にもかかわらず、結晶質のヨウ素と黒鉛は非金属です。)
良好な導電性(カーボンを除く)
容易な加工が可能。
高密度 (通常、金属は非金属より重い)。
高融点(例外:水銀、ガリウム、アルカリ金属)
優れた熱伝導性
これらは反応において常に還元剤です。
金属の物性
通常の状態ではすべての金属 (水銀と条件付きを除く) は固体ですが、硬度は異なります。 したがって、アルカリ金属は包丁で簡単に切れますが、バナジウム、タングステン、クロムなどの金属は最も硬いガラスを簡単に傷つけます。 以下は、モース硬度でのいくつかの金属の硬度です。
融点の範囲は、-39 °C (水銀) ~ 3410 °C (タングステン) です。 ほとんどの金属(アルカリを除く)の融点は高いですが、一部の「通常の」金属、例えば融点は高いです。 錫そして 鉛、通常の電気またはガスコンロで溶かすことができます。
密度に応じて、金属は軽いもの(密度 0.53 h 5 g/cm3)と重い金属(5 h 22.5 g/cm3)に分けられます。 最も軽い金属はリチウム (密度 0.53 g/cm3) です。 最も重い金属であるオスミウムとイリジウムの密度はほぼ等しいため(約 22.6 g/cm3 - 密度のちょうど 2 倍)、最も重い金属に名前を付けることは現時点では不可能です。 鉛)、正確な密度を計算することは非常に困難です。不純物があると密度が低下するため、これを行うには金属を完全に精製する必要があります。
ほとんどの金属は延性があるため、金属ワイヤーは破損することなく曲げることができます。 これは、金属原子間の結合を破壊することなく、金属原子の層が移動することによって起こります。 最も柔軟なものは、 金, 銀そして 銅。 から 金市販品の金メッキに使用される厚さ0.003mmの箔も製造可能です。 ただし、すべての金属が延性があるわけではありません。 からの配線 亜鉛または 錫曲げるとカクカク音がする。 マンガンやビスマスは変形するとほとんど曲がりませんが、すぐに折れてしまいます。 可塑性は金属の純度にも依存します。 したがって、非常に純粋なクロムは非常に延性がありますが、わずかな不純物で汚染されてもろくなり、硬くなります。
すべての金属はよく電気を伝導します。 これは、電場の影響下で移動する可動電子が結晶格子内に存在するためです。 銀、銅および アルミニウム最も高い導電率を持っています。 このため、後者の 2 つの金属がワイヤ材料として最もよく使用されます。 ナトリウムは非常に高い電気伝導率も持っており、実験装置では、次のような薄肉のパイプの形でナトリウム導体を使用する試みが知られています。 ステンレス鋼のナトリウムで満たされています。 ナトリウムの比重が低く、抵抗が等しいため、ナトリウム「ワイヤ」は銅よりもはるかに軽く、アルミニウムよりもわずかに軽い場合さえあります。
金属の高い熱伝導率は、自由電子の移動度にも依存します。 したがって、一連の熱伝導率は一連の電気伝導率と類似しており、電気と同様に熱の最良の伝導体は熱伝導率です。 ナトリウムは熱の良伝導体としても使用されます。 例えば、自動車エンジンの冷却を改善するためにナトリウムがバルブに使用されていることは広く知られています。
金属の滑らかな表面は多くの光を反射します。この現象は金属光沢と呼ばれます。 しかし、粉末状になると、ほとんどの金属は光沢を失います。 アルミニウムしかし、マグネシウムは粉末の中でも輝きを保ちます。 銀と銀は光を最もよく反射します - 鏡はこれらの金属から作られています。 ロジウムは、非常に高価であるにもかかわらず、鏡の製造に使用されることがあります。銀やパラジウムよりもはるかに高い硬度と耐薬品性があるため、ロジウム層は銀層よりもはるかに薄くできます。
ほとんどの金属の色はほぼ同じで、青みがかった明るい灰色です。 , 銅とセシウムはそれぞれ黄色、赤、淡黄色です。
金属の化学的性質
メタルは
ほとんどの金属は外側の電子層に少数の電子 (1 ~ 3 個) を持っているため、ほとんどの反応で還元剤として機能します (つまり、電子を「供与」します)。
1. 単体との反応
金とプラチナを除くすべての金属は酸素と反応します。 銀との反応は高温で起こりますが、酸化銀(II)は熱的に不安定であるため、実際には形成されません。 金属に応じて、出力には酸化物、過酸化物、および超酸化物が含まれる場合があります。
4Li + O2 = 2Li2O 酸化リチウム
2Na + O2 = Na2O2 過酸化ナトリウム
K + O2 = KO2 超酸化カリウム
過酸化物から酸化物を得るには、過酸化物を金属で還元します。
Na2O2 + 2Na = 2Na2O
中活性および低活性の金属では、加熱すると反応が起こります。
3Fe + 2O2 = Fe3O4
最も活性な金属のみが窒素と反応し、室温ではリチウムのみが反応して窒化物を形成します。
6Li + N2 = 2Li3N
加熱時:
3Ca + N2 = Ca3N2
金を除くすべての金属は硫黄と反応します。 白金:
鉄は相互作用します グレー加熱すると硫化物が生成します。
最も活性な金属、つまりBeを除くIA族およびIIA族の金属のみが水素と反応します。 加熱すると反応が起こり、水素化物が形成されます。 反応において、金属は還元剤として作用し、水素の酸化状態は -1 です。
最も活性の高い金属のみが炭素と反応します。 この場合、アセチレニドまたはメタン化物が形成されます。 水と反応すると、アセチリドはアセチレンを生成し、メタン化物はメタンを生成します。
2Na + 2C = Na2C2
Na2C2 + 2H2O = 2NaOH + C2H2
合金化とは、機械的、物理的、および特性を変更する追加の元素を溶解物に導入することです。 化学的特性主原料。
微細構造
金属の特徴は、金属の性質から理解できます。 内部構造。 それらはすべて、外側のエネルギー準位の電子 (言い換えれば、価電子) と原子核との弱い結合を持っています。 このため、導体内に生じた電位差により、結晶格子内で電子(伝導電子と呼ばれます)が雪崩のような動きを引き起こします。 このような電子の集合は、電子ガスと呼ばれることがよくあります。 電子に加えて、フォノン(格子振動)も熱伝導率に寄与します。 可塑性は、転位の移動と結晶面のせん断に対するエネルギー障壁が低いためです。 硬度は、多数の構造欠陥 (格子間原子など) によって説明できます。
電子が放出されやすいため、金属が酸化する可能性があり、腐食や特性のさらなる劣化につながる可能性があります。 酸化する能力は、金属の標準的な活性シリーズによって認識できます。 この事実は、金属を他の元素(合金、その中で最も重要なもの)と組み合わせて使用する必要性を裏付けています。 鋼鉄)、合金化、およびさまざまなコーティングの使用。
金属の電子的性質をより正確に説明するには、量子力学を使用する必要があります。 十分な対称性を持つすべての固体では、個々の原子の電子のエネルギー準位が重なり合って許容バンドを形成し、価電子によって形成されるバンドは価電子バンドと呼ばれます。 金属中の価電子の結合が弱いため、金属の価電子帯は非常に広く、すべての価電子が価電子帯を完全に埋めるのに十分ではないという事実が生じます。
このような部分的に充填されたゾーンの基本的な特徴は、印加電圧が最小であっても、サンプル内で価電子の再配列が始まる、つまり電流が流れることです。
電子の高い移動度は、高い熱伝導率と、電磁放射を鏡面反射する能力 (金属に特有の輝きを与えます) につながります。
アルカリ金属
メタルは
アルカリ金属は、D.I.ドミトリー・イワノビッチ・メンデレーエフの化学元素周期表のグループIの主なサブグループの元素です:リチウムLi、ナトリウムNa、カリウムK、ルビジウムRb、セシウムCsおよびフランシウムFr。 これらの金属は、その化合物のほとんどが水に溶けるため、アルカリ金属と呼ばれます。 スラブ語で「浸出」は「溶解」を意味し、これがこの金属グループの名前の由来となっています。 アルカリ金属が水に溶解すると、アルカリと呼ばれる可溶性水酸化物が形成されます。
アルカリ金属の一般的な性質
周期表では、アルカリ金属原子は希ガスのすぐ後に続くため、アルカリ金属原子の構造の特徴は、新しいエネルギー レベル、つまり電子配置 ns1 で 1 つの電子を含むことです。 明らかに、アルカリ金属の価電子は簡単に除去できます。これは、原子が電子を放棄して不活性ガスの配置を獲得することがエネルギー的に好ましいためです。 したがって、すべてのアルカリ金属は還元性を特徴とします。 これは、イオン化ポテンシャルの低い値(セシウム原子のイオン化ポテンシャルは最も低いものの1つです)と電気陰性度(EO)によって確認されます。
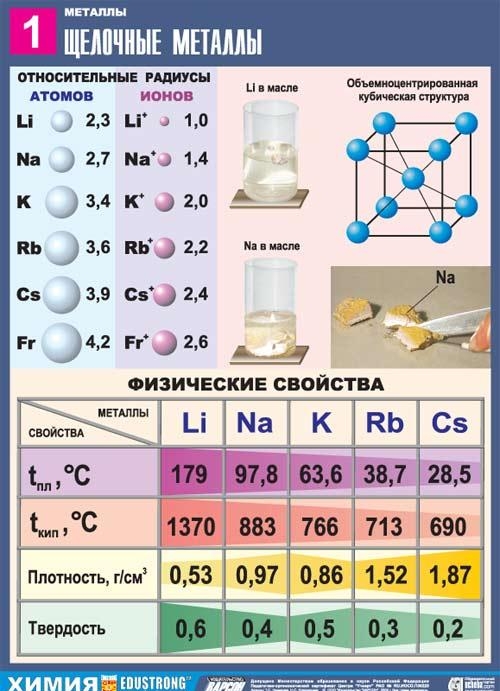
このサブグループの金属はすべて銀白色で (銀黄色のセシウムを除く)、非常に柔らかく、メスで切断できます。 リチウム、ナトリウム、カリウムは水より軽いため、水の表面に浮いて水と反応します。
アルカリ金属は、自然界では一価の陽イオンを含む化合物の形で存在します。 多くの鉱物には、グループ I の主要なサブグループの金属が含まれています。 たとえば、正長石または長石は、同様のアルミノケイ酸カリウム K2 で構成されています。 ミネラルナトリウムを含む - 曹長石 - 組成は Na2 です。 海水には塩化ナトリウムNaClが含まれており、土壌にはカリウム塩(シルビンKCl、シルビナイトNaCl)が含まれています。 KCl、カーナライトKCl。 MgCl2。 6H2O、ポリハライトK2SO4。 MgSO4。 CaSO4。 2H2O。
アルカリ金属の化学的性質
メタルは
アルカリ金属は水、酸素、窒素に対して化学的活性が高いため、灯油の層の下に保管されます。 アルカリ金属との反応を実行するには、層の下から目的のサイズの部分をメスで慎重に切り取ります。 灯油アルゴン雰囲気下では、金属の表面から空気との相互作用による生成物が完全に除去されてから、サンプルが反応容器に入れられます。
1. 水との相互作用。 アルカリ金属の重要な特性は、水に対する高い活性です。 リチウムは水と最も穏やかに(爆発せずに)反応します。
同様の反応が起こると、ナトリウムが黄色い炎をあげて燃え、小さな爆発が起こります。 カリウムはさらに活性が高く、この場合、爆発はさらに強くなり、炎は紫色になります。
2. 酸素との相互作用。 空気中のアルカリ金属の燃焼生成物は、金属の活性に応じて異なる組成を持ちます。
リチウムのみが空気中で燃焼し、化学量論組成の酸化物を形成します。
ナトリウムが燃焼すると、主に NaO2 過酸化物が少量混合されて形成されます。
カリウム、ルビジウム、セシウムの燃焼生成物には主に超酸化物が含まれています。
酸化ナトリウムおよび酸化カリウムを得るには、水酸化物、過酸化物または超酸化物と過剰の金属との混合物を酸素の非存在下で加熱します。
次のパターンはアルカリ金属の酸素化合物の特徴です。アルカリ金属カチオンの半径が増加するにつれて、過酸化物イオン O22 とスーパーオキシド イオン O2- を含む酸素化合物の安定性が増加します。
重アルカリ金属は、EO3 組成を持つかなり安定したオゾニドの形成を特徴としています。 すべての酸素化合物は異なる色を持っており、Li から Cs に向かうにつれてその色は濃くなっています。
アルカリ金属酸化物は塩基性酸化物のすべての特性を備えており、水、酸性酸化物、酸と反応します。
過酸化物と超酸化物は、強力な酸化剤の特性を示します。
過酸化物と超酸化物は水と激しく相互作用し、水酸化物を形成します。
3. 他の物質との相互作用。 アルカリ金属は多くの非金属と反応します。 加熱すると、水素と結合して水素化物、ハロゲン、 グレー、窒素、リン、炭素、ケイ素は、それぞれハロゲン化物、硫化物、窒化物、リン化物、炭化物、ケイ化物を形成します。
加熱すると、アルカリ金属は他の金属と反応して金属間化合物を形成することができます。 アルカリ金属は酸と活発に(爆発的に)反応します。
アルカリ金属は液体アンモニアとその誘導体であるアミンやアミドに溶解します。
液体アンモニアに溶かした場合 アルカリ金属電子を失い、アンモニア分子によって溶媒和され、溶液が青色になります。 得られたアミドは水により容易に分解されてアルカリとアンモニアを生成します。
アルカリ金属は、有機物質、アルコール(アルコラートを形成する)およびカルボン酸(塩を形成する)と相互作用します。
4. アルカリ金属の定性測定。 アルカリ金属はイオン化ポテンシャルが小さいため、金属やその化合物を炎の中で加熱すると原子がイオン化して炎が一定の色に発色します。
アルカリ金属の調製
1. アルカリ金属を得るには、主に、天然物を形成するハロゲン化物、ほとんどの場合は塩化物の溶融物の電気分解を使用します。 ミネラル:
カソード: Li+ + e → Li
アノード: 2Cl- — 2e → Cl2
2. アルカリ金属を得るために、その水酸化物の溶融物の電気分解が行われる場合があります。
陰極:Na++e→Na
アノード: 4OH- – 4e → 2H2O + O2
アルカリ金属は電気化学的電圧系列において水素の左側に位置するため、塩溶液から電解的に調製することは不可能です。 この場合、対応するアルカリと水素が生成されます。
水酸化物
アルカリ金属水酸化物を得るには、主に電解法が使用されます。 最も大規模な製造は、食塩の濃縮水溶液の電気分解による水酸化ナトリウムの製造です。
従来、アルカリは交換反応によって得られていました。
このようにして得られたアルカリは、Na2CO3 ソーダでひどく汚染されていました。
アルカリ金属水酸化物は白色の吸湿性物質であり、その水溶液は強塩基です。 これらは塩基に特徴的なすべての反応に関与します。酸、酸性酸化物および両性酸化物、両性水酸化物と反応します。
加熱すると、アルカリ金属水酸化物は分解せずに昇華しますが、水酸化リチウムは例外で、II 族の主な亜族の金属の水酸化物と同様、焼成すると酸化物と水に分解されます。
水酸化ナトリウムは、石鹸、合成洗剤、人造繊維、フェノールなどの有機化合物の製造に使用されます。
炭酸塩
アルカリ金属を含む重要な製品はソーダ Na2CO3 です。 世界中のソーダの大部分は、20 世紀初頭に提案されたソルベイ法を使用して製造されています。 この方法の本質は次のとおりです。NaCl 水溶液にアンモニアを加え、26 ~ 30 °C の温度で二酸化炭素で飽和させます。 これにより、重曹と呼ばれる難溶性の重炭酸ナトリウムが生成されます。
アンモニアは、二酸化炭素を溶液に通すときに発生する酸性環境を中和し、重炭酸ナトリウムの沈殿に必要な重炭酸イオン HCO3- を生成するために添加されます。 重曹を分離した後、塩化アンモニウムを含む溶液を石灰と一緒に加熱するとアンモニアが放出され、反応ゾーンに戻されます。
したがって、アンモニア法によるソーダ製造では、唯一の廃棄物は塩化カルシウムであり、塩化カルシウムは溶液中に残り、用途が限られています。
重炭酸ナトリウムを焼成すると、ソーダ灰、つまり洗浄ソーダ、Na2CO3、および二酸化炭素が生成され、これらは重炭酸ナトリウムの製造プロセスで使用されます。
ソーダの主な購入者はガラスです。
難溶性の酸塩であるNaHCO3、重炭酸カリウムとは異なり、KHCO3は水によく溶けるため、炭酸カリウムまたはカリ、K2CO3は水酸化カリウムの溶液に二酸化炭素を作用させることによって得られます。
カリはガラス石鹸や液体石鹸の製造に使用されます。
リチウムは、重炭酸塩が得られていない唯一のアルカリ金属です。 この現象の理由は、リチウムイオンの半径が非常に小さいため、かなり大きな HCO3- イオンを保持できないためです。
リチウム
メタルは
リチウムは、化学元素の周期表の第 2 周期である第 1 グループの主要なサブグループの元素です。 メンデレーエフ・ドミトリー・イワノビッチ、原子番号3。記号Li(緯度リチウム)で示されます。 単体物質であるリチウム (CAS 番号: 7439-93-2) は、銀白色の軟アルカリ金属です。
リチウムは、1817 年にスウェーデンの化学者兼鉱物学者 A. Arfvedson によって、最初は鉱物ペタライト (Li,Na) で、次にスポジュメン LiAl、レピドライト KLi1.5Al1.5(F,OH)2 で発見されました。 リチウム金属は、1825 年にハンフリー デイビーによって初めて発見されました。
リチウムは、「石」(ギリシャ語で λίθος - 石)の中で発見されたことからその名前が付けられました。 元々は「リチウム」と呼ばれていましたが、現在の名前はベルゼリウスによって提案されました。
リチウムは銀白色の金属で、柔らかく延性があり、ナトリウムより硬く、鉛よりは柔らかいです。 プレスや圧延などの加工が可能です。
室温では、リチウム金属は体心立方格子 (配位番号 8) を持ちますが、冷間加工すると立方最密充填格子に変化し、二重立方八面体配位を持つ各原子が 12 個の他の原子に囲まれています。 78 K 未満では、安定な結晶形は六方最密構造であり、各リチウム原子は立方八面体の頂点に位置する 12 個の最近接原子を持ちます。
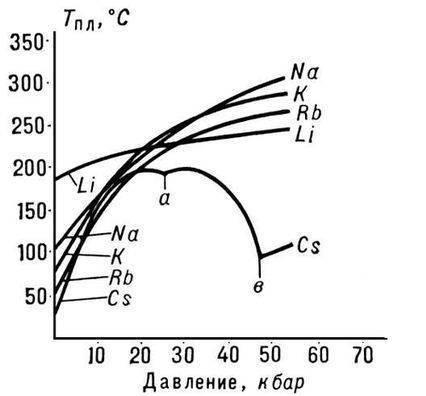
すべてのアルカリ金属の中で、リチウムは融点と沸点が最も高く (それぞれ 180.54 ℃と 1340 ℃)、室温での密度はすべての金属の中で最も低くなります (0.533 g/cm3、水の密度のほぼ半分)。
リチウム原子のサイズが小さいため、金属の特別な特性が現れます。 例えば、それは380℃以下の温度でのみナトリウムと混合し、溶融カリウム、ルビジウム、セシウムとは混合しませんが、他のアルカリ金属ペアは任意の比率で互いに混合します。
アルカリ金属、空気中では不安定。 リチウムはアルカリ金属の中で最も活性が低く、室温では乾燥空気(さらには乾燥酸素)とも実質的に反応しません。
湿った空気中ではゆっくりと酸化し、Li3N 窒化物、LiOH 水酸化物、Li2CO3 炭酸塩に変わります。 酸素中で加熱すると燃焼し、酸化物Li2Oになります。 リチウムは100℃から300℃の温度範囲では緻密な酸化膜で覆われ、それ以上酸化しないという興味深い特徴があります。
1818年、ドイツの化学者レオポルド・グメリンは、リチウムとその塩が炎をカーマインレッドに着色し、これがリチウムの定量の定性的な兆候であることを確立しました。 燃焼温度は約300℃です。 燃焼生成物は鼻咽頭の粘膜を刺激します。
爆発や火災を伴わずに水と静かに反応し、LiOH と H2 を生成します。 また、エチルアルコールとも反応してアルコラートを形成し、アンモニアやハロゲン(ヨウ素と - 加熱時のみ)とも反応します。
リチウムは、密封されたブリキ箱内の石油エーテル、パラフィン、ガソリンおよび/または鉱油の中に保管されます。 リチウム金属は、皮膚、粘膜、目に接触すると火傷を引き起こします。
鉄および非鉄冶金では、合金の脱酸および延性と強度の向上にリチウムが使用されます。 リチウムは、金属熱法を使用してレアメタルを回収するために使用されることがあります。
炭酸リチウムは、アルミニウム製錬において最も重要な補助物質(電解液に添加される)であり、その消費量は世界のアルミニウム生産量に比例して毎年増加しています(炭酸リチウムの消費量は、製錬されたアルミニウム1トンあたり2.5〜3.5kgです)。
銅と同様に、銀や金を含むリチウム合金は、非常に効果的なはんだです。 マグネシウム、スカンジウム、銅、カドミウム、アルミニウムを含むリチウム合金は、航空および宇宙分野で有望な新しい材料です。 アルミン酸リチウムとケイ酸リチウムをベースに、室温で硬化するセラミックスが作成され、軍事技術、冶金学、そして将来的には熱核エネルギーにも使用されています。 炭化ケイ素繊維で強化されたケイ酸リチウムアルミニウムから作られたガラスは、非常に高い強度を持っています。 リチウムは、鉛合金を強化し、延性と耐腐食性を与えるのに非常に効果的です。
リチウム塩には向精神作用があり、多くの精神疾患の予防と治療のための医学で使用されています。 この材料の最も一般的なタイプは炭酸リチウムです。 双極性障害や頻繁な気分の変動に苦しむ人々の気分を安定させるために精神医学で使用されます。 躁うつ病の予防と自殺の減少に効果があり、医師らは特定のリチウム化合物が(もちろん適切な用量で)躁うつ病患者に良い影響を与えることを繰り返し観察しています。 この効果は 2 つの方法で説明できます。 一方で、リチウムは細胞間液から脳細胞へのナトリウムおよびカリウムイオンの移動に関与するいくつかの酵素の活性を調節できることが確立されている。 一方で、リチウムイオンは電池のイオンバランスに直接影響を与えることが注目されています。 そして、患者の状態はナトリウムとカリウムのバランスに大きく依存します。細胞内のナトリウム過剰はうつ病患者に典型的であり、躁病患者には不足します。 リチウム塩は、ナトリウムとカリウムのバランスを平準化することにより、両方にプラスの効果をもたらします。
ナトリウム
メタルは
ナトリウムは、第 1 グループ、第 3 グループの主要なサブグループの元素です。 期間化学元素の周期表 D.I. ドミトリー・イワノビッチ・メンデレーエフ、原子番号 11。記号 Na (緯度ナトリウム) で示されます。 ナトリウム単体(CAS番号:7440-23-5)は銀白色の軟アルカリ金属です。
水中では、ナトリウムはリチウムとほぼ同じ挙動を示します。反応は急速に水素を放出しながら進行し、溶液中に水酸化ナトリウムが形成されます。
ナトリウム(あるいはその化合物)は古代から使用されてきました。 たとえば、エジプトのソーダ湖の水中に自然に存在するソーダ (ナトロン) です。 古代エジプト人は、防腐処理、キャンバスの漂白、食品の調理、絵の具や釉薬の製造に天然ソーダを使用していました。 大プリニウスは、ナイルデルタではソーダ(十分な割合の不純物が含まれていた)が川の水から分離されたと書いています。 石炭が混入されているため、灰色または黒色に着色された大きな塊の形で販売されました。
ナトリウムは、1807 年に英国の化学者ハンフリー デイビーによって固体 NaOH の電気分解によって初めて得られました。
「ナトリウム」(ナトリウム)という名前はアラビア語のナトラン(ギリシャ語でニトロン)に由来しており、元々は天然ソーダを指しました。 この元素自体は、以前はソディア(緯度ナトリウム)と呼ばれていました。

ナトリウムは銀白色の金属で、紫がかった薄い層を形成しており、プラスチックでありながら柔らかく(ナイフで簡単に切れます)、切りたてのナトリウムは光沢があります。 ナトリウムの電気伝導率と熱伝導率の値は非常に高く、密度は0.96842 g/cm3 (19.7℃で)、融点は97.86℃、沸点は883.15℃です。
空気中で酸化しやすいアルカリ金属。 大気中の酸素から保護するために、金属ナトリウムは層の下に保管されます。 灯油。 ナトリウムはリチウムよりも活性が低いため、加熱された場合にのみ窒素と反応します。
酸素が過剰になると過酸化ナトリウムが生成されます
2Na + O2 = Na2O2
金属ナトリウムは分取化学で広く使用されており、 業界冶金学などの強力な還元剤として。 ナトリウムは、エネルギー集約型のナトリウム硫黄電池の製造に使用されます。 トラックの排気バルブにもヒートシンクとして使用されています。 場合によっては、非常に大きな電流を流すための電線の材料としてナトリウム金属が使用されることがあります。
カリウム、ルビジウム、セシウムとの合金で、高効率の冷却剤として使用されます。 特に、ナトリウム12%、カリウム47%、セシウム41%の組成の合金は、-78℃という記録的な低融点を有し、イオンロケットエンジンの作動流体や原子力発電所の冷却材として提案されました。
ナトリウムは、高ガス放電ランプや高ガス放電ランプにも使用されます。 低圧(NLVD および NLND)。 DNAT (アークナトリウム管) タイプの NLVD ランプは、街路照明に非常に広く使用されています。 明るい黄色の光を放ちます。 HPS ランプの耐用年数は 12 ~ 24,000 時間です。 したがって、HPS タイプのガス放電ランプは都市照明、建築照明、産業照明に不可欠です。 また、DNaS、DNaMT (アーク ナトリウム マット)、DNaZ (アーク ナトリウム ミラー)、および DNaTBR (水銀なしのアーク ナトリウム管) のランプもあります。
金属ナトリウムは定性分析に使用されます 有機物。 ナトリウムと試験物質の合金をエタノールで中和し、数ミリリットルの蒸留水を加えて 3 部に分けます。J. Lassenya (1843) は、窒素、硫黄、ハロゲンの測定を目的としています ( 試すバイルシュタイン)
塩化ナトリウム (食塩) は、最も古くから使用されている香料および保存料です。
アジ化ナトリウム (Na3N) は、冶金およびアジ化鉛の製造において窒化剤として使用されます。
シアン化ナトリウム (NaCN) は、岩石から金を浸出させる湿式冶金法のほか、鋼の軟窒化や電気めっき (銀めっき、金めっき) にも使用されます。
塩素酸ナトリウム (NaClO3) は、線路上の不要な植生を破壊するために使用されます。
カリウム
カリウムは、第 1 グループ、第 4 グループの主要なサブグループの元素です。 期間 D.I.メンデレーエフ・ドミトリー・イワノビッチによる原子番号19の化学元素の周期系。記号K(緯度カリウム)で示されます。 カリウム単体(CAS番号:7440-09-7)は銀白色の軟アルカリ金属です。
自然界では、カリウムは、海水や多くのミネラルなど、他の元素と組み合わせてのみ存在します。 空気中では非常に急速に酸化し、特に水と非常に簡単に化学反応を起こしてアルカリを形成します。 多くの点で、カリウムの化学的性質はナトリウムと非常によく似ていますが、 生体機能そしてそれらが生物の細胞によってどのように使用されるかについても、依然として異なります。
カリウム(より正確にはその化合物)は古代から使用されてきました。 したがって、カリ(洗剤として使用される)の生産は 11 世紀にすでに存在していました。 わらや木材を燃やしたときに発生する灰を水で処理し、得られた溶液(灰汁)を濾過した後蒸発させます。 乾燥残渣には、炭酸カリウムに加えて、硫酸カリウムK2SO4、ソーダおよび塩化カリウムKClが含まれていた。
1807年、英国の化学者デイビーは固体の水酸化カリウム(KOH)の電気分解によってカリウムを単離し、それを「カリウム」(ラテン語でカリウム。この名前は英語、フランス語、スペイン語、ポルトガル語、ポーランド語で今でも使用されています)と名付けました。 1809 年、L. V. ギルバートは「カリウム」(ラテン語でカリウム、アラビア語の al-kali - カリから)という名前を提案しました。 この名前が含まれていたのは、 ドイツ人、そこから北ヨーロッパと東ヨーロッパのほとんどの言語(ロシア語を含む)に変換され、この要素の記号を選択するときに「勝ちました」 - K.
カリウムは銀色の物質で、形成されたばかりの表面には特徴的な輝きがあります。 非常に軽くて溶けやすい。 水銀に比較的よく溶け、アマルガムを形成します。 カリウム(およびその化合物)をバーナーの炎に加えると、炎が特徴的なピンク紫色に染まります。
カリウムは、他のアルカリ金属と同様に、典型的な金属特性を示し、非常に化学的に活性であり、容易に電子を供与します。
強力な還元剤です。 酸素と非常に活発に結合するため、酸化物ではなく超酸化カリウム KO2 (または K2O4) が形成されます。 水素雰囲気中で加熱すると、水素化カリウムKHが生成します。 あらゆる非金属と良好に相互作用し、ハロゲン化物、硫化物、窒化物、リン化物などを形成するほか、水(反応は爆発的に起こる)、さまざまな酸化物、塩などの複雑な物質とも反応します。 この場合、他の金属を還元して遊離状態にします。
カリウムは灯油の層の下に保管されます。
室温で液体のカリウムとナトリウムの合金は、高速中性子原子力発電所などの閉鎖系の冷却材として使用されます。 さらに、ルビジウムとセシウムを含む液体合金が広く使用されています。 ナトリウム 12%、カリウム 47%、セシウム 41% の組成の合金は、-78 °C という記録的な低い融点を持っています。
カリウム化合物は最も重要な生体元素であるため、肥料として使用されます。
カリウム塩は、比較的高価であるにもかかわらず、多くの場合、対応するナトリウム塩よりも溶解性が高いため、増加した電流密度で電解液を集中的に動作させることができるため、電気めっきで広く使用されています。
カリウムは、特に植物界において最も重要な生体元素です。 土壌中のカリウムが不足すると、植物の発育が非常に悪くなり、減少します。そのため、採掘されたカリウム塩の約 90% が肥料として使用されています。
カリウムは、窒素やリンとともに、植物の主要栄養素の 1 つです。 植物におけるカリウムの機能は、植物に必要な他の元素と同様、厳密に特異的です。 植物では、カリウムはイオンの形です。 カリウムは主に細胞の細胞質と液胞に存在します。 カリウムの約80%は細胞液に含まれています。
カリウムの働きは非常に多様です。 光合成の通常の過程を刺激し、葉身から他の器官への炭水化物の流出と糖の合成を促進することが確立されています。
カリウムは、果物や野菜の単糖類の蓄積を促進し、根菜の糖分やジャガイモのデンプンを増加させ、穀物のわらの細胞壁を厚くし、パンの耐倒伏性を高め、食物繊維の質を改善します。亜麻と麻。
カリウムは植物細胞内の炭水化物の蓄積を促進することにより、細胞液の浸透圧を高め、それによって植物の耐寒性と耐霜性を高めます。
カリウムはカチオンの形で植物に吸収され、明らかにこの形で細胞内に残り、最も重要な生化学物質を活性化します。 プロセス植物細胞では、カリウムは細胞の抵抗力を高めます。 さまざまな病気成長期と収穫後の両方で、果物や野菜の保存品質が大幅に向上します。
カリウム欠乏は植物に多くの代謝障害を引き起こし、多くの酵素の活性が弱まり、炭水化物とタンパク質の代謝が混乱し、 費用呼吸のための炭水化物。 その結果、工場の生産性が低下し、製品の品質が低下します。



ルビジウム
ルビジウムは、D.I. ドミトリー・イワノビッチ・メンデレーエフの化学元素周期表の第 5 周期である第 1 族の主亜族の元素で、原子番号 37 です。記号 Rb (緯度ルビジウム) で示されます。 ルビジウム単体(CAS番号:7440-17-7)は銀白色の軟アルカリ金属です。
1861年、ドイツの科学者ロバート・ヴィルヘルム・ブンゼンとグスタフ・ロベルト・キルヒホッフは、スペクトル分析を使用して天然アルミノケイ酸塩を研究し、その中に新しい元素を発見しました。後にスペクトルの最も強い線の色に基づいてルビジウムと名付けられました。
ルビジウムは、切りたてのときに金属光沢のある銀白色の柔らかい結晶を形成します。 ブリネル硬度0.2MN/ml(0.02kgf/mmI)。 ルビジウムの結晶格子は体心立方体で、a = 5.71 E (室温で) です。 原子半径 2.48 E、Rb+ イオン半径 1.49 E。密度 1.525 g/cm (0 °C)、融点 38.9 °C、沸点 703 °C。 比熱容量 335.2 J/(kg K)、熱線膨張係数 9.0・10-5 deg-1 (0~38 ℃)、弾性率 2.4 H/mІ (240 kgf/mmI)、体積固有電気抵抗率 11.29・10-6オーム・センチメートル(20℃); ルビジウムは常磁性体です。
アルカリ金属。空気中では非常に不安定である(微量の水の存在下で空気と反応して発火する)。 あらゆる種類の塩を形成します - ほとんどが溶けやすい(塩素酸塩と過塩素酸塩はわずかに溶けます)。 水酸化ルビジウムは、ガラスやその他の構造材料や容器材料に対して非常に攻撃的な物質であり、溶融するとほとんどの金属(プラチナも)を破壊します。
ルビジウムの用途は多様であり、多くの応用分野では最も重要な物理的特性がセシウムより劣っているにもかかわらず、この希少なアルカリ金属は重要な役割を果たしています。 現代のテクノロジー。 ルビジウムの応用分野としては、触媒作用、電子作用が挙げられます。 業界、特殊光学、原子力、医学。
ルビジウムは、純粋な形だけでなく、多くの合金や化合物の形でも使用されます。 ルビジウムは非常に優れた有利な原料基盤を持っているが、同時に資源の入手可能性の状況はセシウムの場合よりもはるかに有利であり、ルビジウムはさらに重要な役割を占める可能性があることに注意することが重要です。触媒作用(それ自体がうまく証明されている場合)。
同位体ルビジウム 86 は、ガンマ線探傷、測定技術のほか、多くの重要な薬剤や薬品の滅菌にも広く使用されています。 食品。 ルビジウムおよびそのセシウムとの合金は、高温タービンユニットの冷却材および作動媒体として非常に有望です(この点で、ルビジウムとセシウムは近年重要になっており、金属の非常に高価なため、その可能性は後回しになっています)タービンユニットの効率を劇的に向上させ、その結果、 経費燃料と環境汚染)。 冷却剤として最も広く使用されているルビジウムベースのシステムは、ナトリウム - カリウム - ルビジウム、およびナトリウム - ルビジウム - セシウムの三元合金です。
触媒では、ルビジウムは有機合成と無機合成の両方で使用されます。 ルビジウムの触媒活性は、主に石油を精製して多くの重要な製品を得るために使用されます。 たとえば、酢酸ルビジウムは、水ガスからメタノールや多くの高級アルコールを合成するために使用されます。これは、地下での石炭のガス化や、自動車やジェット燃料用の人工液体燃料の製造に関連して非常に重要です。 多くのルビジウムとテルルの合金は、スペクトルの紫外領域でセシウム化合物よりも感度が高いため、この場合、光変換器の材料としてセシウム133と競合する可能性があります。 ルビジウムは、特殊な潤滑組成物 (合金) の一部として、真空 (ロケットおよび宇宙技術) で非常に効果的な潤滑剤として使用されます。
水酸化ルビジウムは、低温化学反応器用の電解質の調製に使用され、また、水酸化カリウム溶液の添加剤としても使用され、低温での性能を向上させます。 低温そして電解質の電気伝導率を増加させます。 ルビジウム金属は水素化物燃料電池に使用されます。
塩化ルビジウムと塩化銅の合金は、高温 (最大 400 °C) の測定に使用されます。
ルビジウム プラズマはレーザー放射の励起に使用されます。
塩化ルビジウムは燃料電池の電解質として使用されていますが、水酸化ルビジウムについても同様のことが言えます。水酸化ルビジウムは石炭の直接酸化を利用した燃料電池の電解質として非常に有効です。
セシウム
セシウムは、D.I.メンデレーエフ・ドミトリー・イワノビッチによる化学元素の周期系の第6周期である第1グループの主要サブグループの元素であり、原子番号は55です。記号Cs(緯度セシウム)で表されます。 単体セシウム (CAS 番号: 7440-46-2) は、銀黄色の軟アルカリ金属です。 セシウムは、発光スペクトルに 2 本の明るい青色の線が存在することからその名前が付けられました (ラテン語の caesius (空色) に由来)。
セシウムは、1860 年にドイツの科学者 R.W. ブンゼンと G.R. キルヒホッフによって光学分光法を使用してドイツ共和国のデュルヒハイム鉱泉の水中で発見され、スペクトル分析を使用して発見された最初の元素となりました。 セシウムは、1882 年にスウェーデンの化学者 K. Setterberg によって、シアン化セシウム (CsCN) とバリウムの溶融混合物の電気分解中に純粋な形で初めて分離されました。
主なセシウム鉱物はポルサイトと非常に珍しいアボガドライト (K、Cs) です。 さらに、セシウムは不純物の形で、レピドライト、金雲母、黒雲母、アマゾナイト、ペタライト、ベリル、亜鉛ワルダイト、リューサイト、カーナライトなどの多くのアルミノケイ酸塩に含まれています。 ポルサイトやレピドライトは工業原料として利用されています。
工業生産では、化合物の形でセシウムが鉱物ポルサイトから抽出されます。 これは、塩化物または硫酸塩の開環によって行われます。 1つ目は、原料鉱物を加熱した塩酸で処理し、塩化アンチモンSbCl3を加えてCs3化合物を沈殿させ、熱水またはアンモニア溶液で洗浄して塩化セシウムCsClを形成することを含む。 2番目のケースでは、加熱した硫酸で処理してセシウムミョウバンCsAl(SO4)2・12H2Oを形成します。
で ロシア連邦ソ連崩壊後、ポルサイトの工業採掘は行われなかったが、ソ連時代にムルマンスク近くのヴォローニャ・ツンドラでこの鉱物の膨大な埋蔵量が発見された。 ロシアの産業が立ち直るまでに、カナダの会社がこの分野を開発するライセンスを購入していたことが判明した。 現在、ポルサイトからのセシウム塩の処理と抽出は、ノボシビルスクのZAOレアメタル工場で行われています。
いくつかあります 実験方法セシウムを入手する。 それは取得できます:
クロム酸セシウムまたは重クロム酸セシウムとジルコニウムとの混合物を真空中で加熱する。
真空中でのアジ化セシウムの分解。
塩化セシウムと特別に調製されたカルシウムの混合物を加熱する。
すべての方法は労働集約的です。 2 番目の方法では、高純度の金属を入手できますが、爆発性があり、実装には数日を要します。
セシウムが応用されるようになったのは、その鉱物が発見され、純粋な形で入手する技術が開発された 20 世紀初頭になってからです。 現在、セシウムとその化合物は、エレクトロニクス、ラジオ、電気、X線工学、化学産業、光学、医学、原子力エネルギーの分野で使用されています。 主に安定な天然セシウム 133 が使用され、限られた範囲でその放射性同位体セシウム 137 が使用され、原子力発電所の原子炉内のウラン、プルトニウム、トリウムの核分裂破片の合計から分離されます。
アルカリ土類金属
アルカリ土類金属 - 化学元素: カルシウム Ca、ストロンチウム Sr、バリウム Ba、ラジウム Ra (ベリリウム Be およびマグネシウム Mg も誤ってアルカリ土類金属として分類される場合があります)。 酸化物(錬金術師の用語では「土」)が水にアルカリ反応を与えるため、そのように呼ばれています。 ラジウムを除くアルカリ土類金属の塩は、鉱物の形で自然界に広く分布しています。
カルシウム
カルシウムは、D.I. ドミトリー・イワノビッチ・メンデレーエフによる化学元素の周期系の第 4 周期である第 2 グループの主要なサブグループの元素であり、原子番号は 20 です。記号 Ca (緯度カルシウム) で示されます。 単体カルシウム (CAS 番号: 7440-70-2) - 柔らかく、化学的に活性 アルカリ土類金属銀白色。
金属カルシウムは 2 つの同素体修飾で存在します。 443 °C までは、立方体の面心格子を持つ α-Ca (パラメータ a = 0.558 nm) は安定ですが、α-Fe 型の立方体心格子を持つ β-Ca (パラメータ a = 0.448 nm) は安定です。より安定した。 α → β 転移の標準エンタルピー ΔH0 は 0.93 kJ/mol です。
カルシウムは代表的なアルカリ土類金属です。 カルシウムの化学活性は高いですが、他のすべてのアルカリ土類金属よりも低いです。 酸素、二酸化炭素、空気中の水分と容易に反応するため、カルシウム金属の表面は通常くすんだ灰色になります。そのため、実験室では通常、カルシウムは他のアルカリ土類金属と同様、密閉された瓶の中に層の下に保管されます。灯油や流動パラフィンなど。
一連の標準ポテンシャルでは、カルシウムは水素の左側に位置します。 Ca2+/Ca0 ペアの標準電極電位は -2.84 V であるため、カルシウムは水と活発に反応しますが、発火はしません。
Ca + 2H2O = Ca(OH)2 + H2 + Q。
カルシウムは、通常の条件下で活性非金属(酸素、塩素、臭素)と反応します。
2Ca + O2 = 2CaO、Ca + Br2 = CaBr2。
空気または酸素中で加熱されると、カルシウムは発火します。 カルシウムは、加熱されると、活性の低い非金属 (水素、ホウ素、炭素、ケイ素、窒素、リンなど) と反応します。例:
Ca + H2 = CaH2、Ca + 6B = CaB6、
3Ca + N2 = Ca3N2、Ca + 2C = CaC2、
3Ca + 2P = Ca3P2 (リン化カルシウム)、CaP および CaP5 という組成のリン化カルシウムも知られています。
2Ca+Si=Ca2Si(ケイ化カルシウム);組成がCaSi、Ca3Si4、およびCaSi2のケイ化カルシウムも知られている。
上記の反応の発生には、通常、次のような物質の放出が伴います。 大量熱(つまり、これらの反応は発熱です)。 非金属を含むすべての化合物において、カルシウムの酸化状態は +2 です。 非金属とのカルシウム化合物のほとんどは、水によって容易に分解されます。たとえば、次のとおりです。
CaH2 + 2H2O = Ca(OH)2 + 2H2、
Ca3N2 + 3H2O = 3Ca(OH)2 + 2NH3。
Ca2+ イオンは無色です。 可溶性カルシウム塩を炎に加えると、炎はレンガ色に変わります。
塩化 CaCl2、臭化 CaBr2、ヨウ化 CaI2、硝酸 Ca(NO3)2 などのカルシウム塩は、水によく溶けます。 水に不溶なものは、フッ化物 CaF2、炭酸 CaCO3、硫酸 CaSO4、オルトリン酸 Ca3(PO4)2、シュウ酸 CaC2O4 などです。
炭酸カルシウム CaCO3 とは異なり、酸性炭酸カルシウム (重炭酸塩) Ca(HCO3)2 は水に可溶であることが重要です。 自然界では、これは次のプロセスにつながります。 二酸化炭素で飽和した冷たい雨や川の水が地下に浸透し、石灰岩に落ちると、それらの溶解が観察されます。
CaCO3 + CO2 + H2O = Ca(HCO3)2。
重炭酸カルシウムで飽和した水が地表に来て太陽光線で加熱される同じ場所で、逆の反応が起こります。
Ca(HCO3)2 = CaCO3 + CO2 + H2O。
これが、自然界で大量の物質が移動する仕組みです。 その結果、地下に巨大な隙間が形成され、洞窟内に鍾乳石や石筍などの美しい石の「つらら」が形成されます。
水中に溶解した重炭酸カルシウムの存在は、水の一時的な硬度を大きく決定します。 水が沸騰すると重炭酸塩が分解し、CaCO3 が沈殿するため、一時的と呼ばれます。 この現象は、たとえば、時間の経過とともにケトル内にスケールが形成されるという事実につながります。
ストロンチウム
ストロンチウムは、D.I. メンデレーエフ・ドミトリー・イワノビッチによる化学元素の周期系の第 5 周期である第 2 グループの主なサブグループの元素で、原子番号 38 です。記号 Sr (緯度ストロンチウム) で指定されます。 単体のストロンチウム (CAS 番号: 7440-24-6) は、柔らかく、可鍛性があり延性のある銀白色のアルカリ土類金属です。 化学活性が高く、空気中では水分や酸素と急速に反応し、黄色の酸化膜で覆われます。
この新元素は、1764 年にスコットランドのストロンシアン村近くの鉛鉱山で発見された鉱物ストロンチアナイトから発見され、後にこの新元素にその名前が付けられました。 この鉱物に新しい金属酸化物が存在することは、ほぼ 30 年後、ウィリアム クルックシャンクとエイダー クロフォードによって発見されました。 1808 年にハンフリー デイビー卿によって純粋な形で単離されました。
ストロンチウムは銀白色の柔らかい金属で、可鍛性と延性があり、ナイフで簡単に切断できます。
多態性 - その変更のうち 3 つが知られています。 215℃までは立方晶面心変態(α-Sr)が安定、215~605℃では六方晶変態(β-Sr)が安定、605℃以上では立方晶体心変態(γ- Sr)は安定しています。
融点 - 768oC、沸点 - 1390oC。
化合物中のストロンチウムは常に +2 の価数を示します。 ストロンチウムの性質はカルシウムとバリウムに近く、それらの中間の位置を占めます。
電気化学電圧シリーズでは、ストロンチウムが最も多く含まれます。 活性金属(通常の電極電位は -2.89 V です。水と激しく反応して水酸化物を形成します。
Sr + 2H2O = Sr(OH)2 + H2
酸と相互作用し、塩から重金属を置き換えます。 濃酸 (H2SO4、HNO3) と弱く反応します。
金属ストロンチウムは空気中で急速に酸化し、黄色がかった膜を形成します。この膜には、SrO 酸化物に加えて、SrO2 過酸化物および Sr3N2 窒化物が常に存在します。 空気中で加熱すると発火しますが、空気中の粉末ストロンチウムは自己発火しやすいです。
非金属(硫黄、リン、ハロゲン)と激しく反応する。 水素(200℃以上)、窒素(400℃以上)と相互作用します。 アルカリとはほとんど反応しません。
高温では CO2 と反応して炭化物を形成します。
5Sr + 2CO2 = SrC2 + 4SrO
Cl-、I-、NO3- アニオンを含む易溶性のストロンチウム塩。 アニオン F-、SO42-、CO32-、PO43- を含む塩はわずかに溶けます。
ストロンチウムは、銅とその一部の合金の合金化、バッテリー鉛合金への導入、鋳鉄、銅、銅の脱硫に使用されます。 鋼.
バリウム
バリウムは、D.I. ドミトリー・イワノビッチ・メンデレーエフによる化学元素の周期系の第 6 周期である第 2 族の主亜族の元素であり、原子番号は 56 です。記号 Ba (緯度バリウム) で指定されます。 単体バリウム (CAS 番号: 7440-39-3) は、銀白色の柔らかく展性のあるアルカリ土類金属です。 高い化学活性を持っています。
バリウムは、1774 年にカール シェーレによって酸化物 BaO として発見されました。 1808年、英国の化学者ハンフリー・デイビーは、水銀陰極を用いた湿った水酸化バリウムの電気分解によって得た。 アマルガムバリウム; 水銀が加熱されると蒸発した後、バリウム金属が放出されました。
バリウムは銀白色の可鍛性金属です。 鋭く叩くと壊れます。 バリウムには 2 つの同素体修飾があり、立方体の体心格子を持つ α-Ba (パラメータ a = 0.501 nm) は 375 °C まで安定で、β-Ba はそれ以上で安定です。
鉱物学的スケールでの硬度は1.25。 モーススケール 2。
バリウム金属は灯油の中に入れるか、パラフィンの層の下に保管してください。
バリウムはアルカリ土類金属です。 空気中で激しく酸化し、酸化バリウムBaOと窒化バリウムBa3N2を形成し、わずかに加熱すると発火します。 水と激しく反応して、水酸化バリウム Ba(OH)2 を形成します。
Ba + 2H2O = Ba(OH)2 + H2
希酸と活発に相互作用します。 多くのバリウム塩は水に不溶性またはわずかに溶けます: 硫酸バリウム BaSO4、亜硫酸バリウム BaSO3、炭酸バリウム BaCO3、リン酸バリウム Ba3(PO4)2。 硫化バリウム BaS は、硫化カルシウム CaS とは異なり、水によく溶けます。
ハロゲンと容易に反応してハロゲン化物を形成します。
水素と一緒に加熱すると水素化バリウム BaH2 が形成され、さらに水素化リチウム LiH と結合して Li 錯体が形成されます。
アンモニアで加熱すると反応します。
6Ba + 2NH3 = 3BaH2 + Ba3N2
加熱すると、窒化バリウム Ba3N2 が CO と反応してシアン化物を形成します。
Ba3N2 + 2CO = Ba(CN)2 + 2BaO
液体アンモニアを使用すると濃い青色の溶液が得られ、そこからアンモニアを分離できます。アンモニアは金色の光沢を持ち、NH3 が除去されて容易に分解します。 白金触媒の存在下では、アンモニアが分解してバリウムアミドを形成します。
Ba(NH2)2 + 4NH3 + H2
炭化バリウム BaC2 は、アーク炉内で石炭とともに BaO を加熱することによって得られます。
リンと一緒にリン化物Ba3P2を形成します。
バリウムは、多くの金属の酸化物、ハロゲン化物、硫化物を対応する金属に還元します。
金属バリウムはアルミニウムとの合金であることが多く、高真空電子機器のガス吸収剤 (ゲッター) として使用され、ジルコニウムとともに液体金属冷却剤 (ナトリウム、カリウム、ルビジウム、リチウム、セシウムの合金) にも添加されます。パイプラインや冶金への攻撃性を軽減します。
遷移金属
遷移金属(遷移元素)は、D.I.メンデレーエフ・ドミトリー・イワノビッチの化学元素周期表の二次サブグループの元素であり、その原子では電子がd軌道とf軌道に現れます。 で 一般的な見解遷移元素の電子構造は次のように表すことができます。 ns 軌道には 1 つまたは 2 つの電子が含まれており、残りの価電子は - 軌道にあります。 価電子の数は軌道の数に比べて著しく少ないため、遷移元素によって形成される単体の物質は金属です。
遷移元素の一般的な特徴
すべての遷移要素には次の共通のプロパティがあります。
電気陰性度の値が小さい。
さまざまな酸化状態。 ほとんどすべての d 元素 (原子の外側の ns サブレベルに 2 つの価電子があります) では、酸化状態 +2 が知られています。
D.I.ドミトリー・イワノビッチ・メンデレーエフによる化学元素周期表のIII族のd元素から始めて、最も低い酸化状態にある元素は、最も高い酸化状態で塩基性、中間の両性状態で塩基性の特性を示す化合物を形成します。
鉄
鉄は、D.I.メンデレーエフ・ドミトリー・イワノビッチによる原子番号26の化学元素周期系の第4周期の第8族の側亜族の元素であり、記号Fe(緯度鉄)で表されます。 地殻内で最も一般的な金属の 1 つ (アルミニウムに次ぐ第 2 位)。
単体の鉄 (CAS 番号: 7439-89-6) は、高い化学反応性を備えた展性のある銀白色の金属です。鉄は空気中の高温または高湿度で急速に腐食します。 鉄は純酸素中で燃焼し、細かく分散した状態では空気中で自然発火します。
実際、鉄は通常、不純物含有量が低く(最大 0.8%)、純粋な金属の柔らかさと延性を保持した合金と呼ばれます。 しかし実際には、鉄と炭素の合金(最大 2% の炭素)および(2% を超える炭素)、および合金金属(クロム、マンガン、ニッケル、等。)。 全体性 特定のプロパティ鉄とその合金により、鉄は人間にとって重要な「No.1 金属」となります。
自然界では、鉄が純粋な形で見つかることはほとんどなく、ほとんどの場合、鉄ニッケル隕石として見つかります。 地殻中の鉄の存在量は4.65%(O、Si、Alに次いで4位)です。 鉄は地球の核の大部分を占めているとも考えられています。




鉄は典型的な金属であり、遊離状態では灰色がかった銀白色をしています。 純粋な金属は延性がありますが、さまざまな不純物 (特に炭素) により硬度と脆さが増大します。 顕著な磁気特性を持っています。 いわゆる「鉄のトライアド」はしばしば区別されます - 3つの金属(鉄Fe、コバルトCo、 ニ Ni)、同様の物理的特性、原子半径、電気陰性度値を持っています。
鉄は多形性を特徴としており、次の 4 つの結晶変態があります。
769 °C までは、体心立方格子と強磁性特性を持つ α-Fe (フェライト) が存在します (769 °C ≈ 1043 K - 鉄のキュリー点)
769 ~ 917 °C の温度範囲では β-Fe が存在します。これは、体心立方格子のパラメーターと常磁性体の磁気特性においてのみ α-Fe と異なります。
917 ~ 1394 °C の温度範囲では、面心立方格子を持つ γ-Fe (オーステナイト) が存在します。
1394 °C 以上では、体心立方格子を持つδ-Fe は安定です
冶金学では β-Fe を別相として区別せず、α-Fe の一種と考えています。 鉄または鋼がキュリー点 (769 °C ≈ 1043 K) を超えて加熱されると、イオンの熱運動により電子のスピン磁気モーメントの向きが崩れ、強磁性体は常磁性になり、二次相転移が起こりますが、結晶の基本的な物理パラメータの変化を伴う一次相転移は起こりません。
常圧における純鉄の場合、冶金学の観点からは、次のような安定した変態が存在します。
絶対零度から 910 µC まで、体心立方 (bcc) 結晶格子による α 修飾は安定です。 α鉄に炭素が固溶したものをフェライトといいます。
910 ~ 1400 єC では、面心立方 (fcc) 結晶格子による γ 修飾が安定しています。 γ鉄に炭素が固溶したものをオーステナイトといいます。
910 ~ 1539 єC では、体心立方晶 (bcc) 結晶格子によるδ変態が安定です。 δ鉄(およびα鉄)中の炭素の固溶体はフェライトと呼ばれます。 原子構造は同じですが、高温δフェライトと低温αフェライト(または単にフェライト)が区別されることがあります。
鋼中の炭素および合金元素の存在は、相転移の温度を大きく変化させます。
エリア内 高圧(104 MPa、10 万気圧以上) 六方最密 (hcp) 格子をもつ ε 鉄の変形が現れます。
多形性の現象は鋼冶金にとって非常に重要です。 鋼の熱処理は結晶格子の α-γ 転移のおかげで起こります。 この現象がなければ、鉄は鋼の基礎としてこれほど広く使用されることはなかったでしょう。
鉄は耐火性があり、中程度の活性の金属に属します。 鉄の融点は1539℃、沸点は約3200℃です。
鉄は最も使用される金属の 1 つであり、世界の冶金生産量の最大 95% を占めています。
鉄は鋼および鋳鉄の主成分であり、最も重要な構造材料です。
鉄は、ニッケルなどの他の金属をベースとした合金の一部である場合があります。
磁性酸化鉄 (マグネタイト) は、ハードドライブやフロッピー ディスクなどの長期使用可能なコンピュータ メモリ デバイスの製造において重要な材料です。
超微粒子マグネタイト粉末は、白黒レーザー プリンタのトナーとして使用されます。
多くの鉄基合金の独特の強磁性特性は、電気工学における変圧器や電気モーターの磁気コアとしての広範な使用に貢献しています。
塩化鉄(III) (塩化第二鉄) は、アマチュア無線の練習でプリント基板をエッチングするために使用されます。
硫酸銅と混合した七硫酸第一鉄(硫酸第一鉄)は、園芸や建設における有害な菌類と戦うために使用されます。
鉄は、鉄ニッケル電池や鉄空気電池の負極として使用されます。
銅
銅は、D.I. ドミトリー・イワノビッチ・メンデレーエフの化学元素周期表の第 4 周期の第 1 族の側亜族の元素で、原子番号 29 です。記号 Cu (緯度銅) で示されます。 銅元素 (CAS 番号: 7440-50-8) は、金色がかったピンク色 (酸化膜が存在しない場合はピンク色) の延性遷移金属です。 古くから人々に広く愛用されてきました。



銅は金色のピンク色の延性のある金属で、空気中ではすぐに酸化膜で覆われ、特徴的な強い黄赤色の色合いになります。 銅は高い熱伝導率と電気伝導率を持っています(電気伝導率では銀に次いで第2位です)。 63Cu と 65Cu の 2 つの安定同位体と、いくつかの放射性同位体を持っています。 これらの中で最も長寿命の 64Cu は、半減期が 12.7 時間で、生成物が異なると 2 つの減衰モードがあります。
密度 - 8.94*10i kg/m
20℃における比熱容量 - 390 J/kg*K
20 ~ 100 °C での電気抵抗率 - 1.78·10−8 Ohm m
融点 - 1083 °C
沸点 - 2600 °C
銅合金にはいくつかあります。真鍮 - 銅と亜鉛の合金、銅と錫の合金、白銅 - 銅とニッケルの合金、その他いくつかあります。
亜鉛
亜鉛は、D.I.メンデレーエフ・ドミトリー・イワノビッチによる化学元素の周期系の第4周期である第2グループの二次サブグループの元素であり、原子番号は30です。記号Zn(緯度ジンクム)で示されます。 通常の状態では、単体 (CAS 番号: 7440-66-6) は青白色の脆い遷移金属です (空気中で変色し、酸化亜鉛の薄い層で覆われます)。
純粋な形では、それはかなり延性のある銀白色の金属です。 これはパラメータ a = 0.26649 nm、c = 0.49468 nm の六方格子を持っています。 室温では脆く、プレートを曲げると、微結晶の摩擦によりパチパチという音が聞こえます(通常、「ブリキの鳴き声」よりも強い音です)。 100~150℃では亜鉛は可塑性になります。 不純物は、たとえ微量であっても、亜鉛のもろさを劇的に増加させます。
典型的な両性金属。 標準電極電位は−0.76Vであり、一連の標準電位の中では鉄までに位置する。
空気中では、亜鉛は酸化ZnOの薄膜で覆われます。 強く加熱すると、燃焼して両性白色酸化物 ZnO が形成されます。
2Zn + O2 = 2ZnO。
酸化亜鉛は酸性溶液の両方と反応します。
ZnO + 2HNO3 = Zn(NO3)2 + H2O
そしてアルカリの場合:
ZnO + 2NaOH = Na2ZnO2 + H2O、
通常の純度の亜鉛は酸溶液と活発に反応します。
Zn + 2HCl = ZnCl2 + H2、
Zn + H2SO4(希釈) = ZnSO4 + H2
およびアルカリ溶液:
Zn + 2NaOH + 2H2O = Na2 + H2、
ヒドロキシネートを形成します。 非常に純粋な亜鉛は、酸やアルカリの溶液とは反応しません。 相互作用は、硫酸銅溶液 CuSO4 を数滴添加すると始まります。
加熱すると、亜鉛はハロゲンと反応してハロゲン化物 ZnHal2 を形成します。 亜鉛はリンとともにリン化物 Zn3P2 および ZnP2 を形成します。 硫黄とその類似体であるセレンやテルルを使用すると、さまざまなカルコゲニド、ZnS、ZnSe、ZnSe2、ZnTeが生成します。
亜鉛は、水素、窒素、炭素、ケイ素、ホウ素と直接反応しません。 Zn3N2窒化物は、亜鉛とアンモニアを550〜600℃で反応させることによって得られます。
で 水溶液亜鉛イオン Zn2+ はアクア錯体 2+ および 2+ を形成します。
純粋な亜鉛金属は、地下浸出によって採掘された貴金属(金、銀)を回収するために使用されます。 さらに、亜鉛は、粗鉛から銀、金(およびその他の金属)を亜鉛-銀-金金属間化合物(いわゆる「銀発泡体」)の形で抽出するために使用され、その後、従来の精製方法で処理されます。
鋼を腐食から保護するために使用されます(機械的ストレスを受けない表面の亜鉛メッキ、または橋、タンク、金属構造物の金属化)。 化学電流源、つまり電池や蓄電池の負極の材料としても使用されます。例: マンガン亜鉛電池、銀亜鉛電池 (EMF 1.85 V、150 Wh/kg、650 Wh/dmі、低抵抗と巨大な放電電流、水銀-亜鉛元素 (EMF 1.35 V、135 Wh/kg、550-650 Wh/dmі)、ジオキシ硫酸水銀元素、ヨウ素酸亜鉛元素、酸化銅ガルバニ電池 (EMF 0.7-1.6 ボルト、84- 127 Wh/kg、410-570 Wh/dml)、クロム亜鉛電池、亜鉛塩化銀電池、ニッケル亜鉛電池 (EMF 1、82 ボルト、95-118 Wh/kg、230-295 Wh/dml)、鉛亜鉛電池、亜鉛塩素電池、亜鉛臭素電池など)。 空気亜鉛電池における亜鉛の役割は非常に重要であり、近年、空気亜鉛システムに基づくコンピュータ(ラップトップ)用電池が集中的に開発され、この分野で大きな成功を収めている(リチウム電池よりも容量が大きく、容量も大きい)このシステムは、エンジンの始動 (鉛バッテリー - 55 Wh/kg、亜鉛空気 - 220 ~ 300 Wh/kg) および電気自動車 (航続距離 900 km) にも非常に有望です。 )。 融点を下げるために多くの硬はんだに含まれています。 亜鉛は真鍮の重要な成分です。 酸化亜鉛は、防腐剤および抗炎症剤として医療で広く使用されています。 酸化亜鉛は、亜鉛華という塗料の製造にも使用されます。
塩化亜鉛は金属はんだ付け用の重要なフラックスであり、繊維製造の成分でもあります。
テルル化亜鉛、セレン化亜鉛、リン化亜鉛、硫化亜鉛は広く使用されている半導体です。
セレン化亜鉛は、炭酸ガスレーザーなど、中赤外領域での吸収係数が非常に低い光学ガラスの製造に使用されます。
水星
水銀は、D.I. ドミトリー・イワノビッチ・メンデレーエフの化学元素周期表の第 6 周期である第 2 グループの二次亜群の元素であり、原子番号は 80 です。記号 Hg (緯度水銀) で指定されます。 単体の水銀 (CAS 番号: 7439-97-6) は遷移金属であり、室温では重くて銀白色の目に見えて揮発性の液体であり、その蒸気は非常に有毒です。 水銀は 2 つの化学元素 (そして唯一の金属) のうちの 1 つであり、その単体物質は通常の条件下では凝集して液体の状態にあります (2 番目の元素は臭素です)。 自然界では、天然の形で存在し、多くの鉱物を形成します。 水銀は、最も一般的な鉱物である辰砂からの還元によって得られることがほとんどです。 計測器、真空ポンプ、光源などの科学技術分野で使用されています。
水銀は室温で液体である唯一の金属です。 反磁性を持っています。 多くの金属と液体合金を形成します - アマルガム。 鉄、マンガンのみ ニ.
水銀は反応性の低い金属です。
300 °C に加熱すると、水銀は酸素と反応します: 2Hg + O2 → 2HgO 赤色酸化水銀(II) が形成されます。 この反応は可逆的です。340 °C 以上に加熱すると、酸化物は単体に分解します。 酸化水銀の分解反応は、歴史的に酸素を生成する最初の方法の 1 つです。
水銀を硫黄と一緒に加熱すると、硫化水銀(II)が生成します。
水銀は、次の性質を持たない酸の溶液には溶解しません。 酸化特性が、王水に溶けて、 硝酸、二価水銀塩を形成します。 過剰な水銀が低温で硝酸に溶解すると、硝酸塩 Hg2(NO3)2 が形成されます。
IIB 族元素のうち、非常に安定な 6d10 - 電子殻を破壊する可能性があるのは水銀であり、これにより水銀化合物 (+4) が存在する可能性が生じます。 したがって、難溶性の Hg2F2 と水分解性の HgF2 に加えて、4K の温度で水銀原子とネオンとフッ素の混合物との相互作用によって得られる HgF4 も存在します。
水銀は体温計の製造に使用され、水銀石英や蛍光灯には水銀蒸気が充填されています。 水銀接点は位置センサーとして機能します。 さらに、金属水銀は多くの重要な合金の製造に使用されます。
以前は、さまざまな金属アマルガム、特に金と銀のアマルガムが宝飾品、鏡、歯科の詰め物に広く使用されていました。 技術分野では、水銀は気圧計や圧力計に広く使用されていました。 水銀化合物は防腐剤(昇華剤)、下剤(カロメル)、帽子の製造などに使用されていましたが、毒性が強いため、20世紀末までにこれらの分野から事実上排除されました(アマルガムの代わりにスパッタリングが使用されました)歯科における金属、ポリマー充填物の電着など)。
水銀とタリウムの合金は低温温度計に使用されます。
金属水銀は、一部の化学電流源 (たとえば、水銀亜鉛型 RC) や基準電圧源 (ウェストン素子) において、多くの活性金属、塩素、アルカリを電解生成するための陰極として機能します。 水銀亜鉛要素 (emf 1.35 ボルト) は、体積と質量において非常に高いエネルギー (130 W/時間/kg、550 W/時間/dm) を持っています。
水銀は、リサイクルアルミニウムの加工や金の採掘に使用されます(アマルガムを参照)。
水銀は、重負荷の流体軸受の作動流体として使用されることもあります。
海水中での船体の汚れを防ぐために、一部の殺生物性塗料には水銀が含まれています。
水銀 203 (T1/2 = 53 秒) は放射性薬理学で使用されます。
水銀塩も使用されます。
ヨウ化水銀は半導体放射線検出器として使用されます。
雷管水銀(「雷管水銀」)は、起爆剤(起爆装置)として長い間使用されてきました。
臭化水銀は、水を水素と酸素に熱化学的に分解する(原子状水素エネルギー)のに使用されます。
一部の水銀化合物は医薬品として使用されていますが(ワクチンの保存用メルチオレートなど)、主に毒性のため、水銀は 20 世紀半ばから後半に医薬品(昇華物、オキシシアン化第二水銀 - 防腐剤、カロメル - 下剤など)から使用されなくなりました。世紀。

アルミニウム
アルミニウムは、D. I. メンデレーエフ・ドミトリー・イワノビッチによる化学元素周期表の第 3 周期の第 3 群の主亜群の元素であり、原子番号 13 です。記号 Al (緯度アルミニウム) で表されます。 軽金属のグループに属します。 地殻内で最も一般的な金属であり、(酸素とシリコンに次いで) 3 番目に豊富な化学元素。
単体のアルミニウム (CAS 番号: 7429-90-5) は、軽量で非磁性の銀白色の金属で、容易に形成、鋳造、機械加工することができます。 アルミニウムは、表面をさらなる相互作用から保護する強力な酸化膜を急速に形成するため、高い熱伝導率と電気伝導率、および耐腐食性を備えています。
いくつかの生物学的研究によると、人体へのアルミニウムの摂取はアルツハイマー病の発症の一因であると考えられていましたが、これらの研究は後に批判され、両者の関係についての結論は否定されました。
金属は銀白色、軽量、密度 2.7 g/cm3、工業用融点 658 °C、高純度アルミニウム 660 °C、沸点 2500 °C、鋳造引張強度 10 ~ 12 kg/mm2、変形可能 18 -25 kg/mm2、合金 38 ~ 42 kg/mm2。
ブリネル硬度は 24 ~ 32 kgf/mm²、高い延性: テクニカル 35%、純度 50%、薄いシートや均一なフォイルに圧延されます。
アルミニウムは電気伝導率、熱伝導率が銅の65%と高く、光反射率も高い。
アルミニウムは、ほぼすべての金属と合金を形成します。
通常の条件下では、アルミニウムは薄く耐久性のある酸化膜で覆われているため、従来の酸化剤、つまり H2O (t°)、O2、HNO3 (加熱なし) とは反応しません。 このおかげで、アルミニウムは事実上腐食を受けにくいため、現代の産業で広く需要が高まっています。 しかし、酸化膜が破壊されると(例えば、アンモニウム塩 NH4+ 溶液、熱アルカリとの接触時、またはアマルガム化の結果として)、アルミニウムは活性な還元金属として作用します。
単純な物質と容易に反応します。
酸素を使用すると:
4Al + 3O2 = 2Al2O3
ハロゲンの場合:
2Al + 3Br2 = 2AlBr3
加熱すると他の非金属と反応します。
硫黄を加えて硫化アルミニウムを形成:
2Al + 3S = Al2S3
窒素を加えて窒化アルミニウムを形成:
カーボンを使用し、炭化アルミニウムを形成:
4Al + 3C = Al4C3
硫化アルミニウムと炭化アルミニウムは完全に加水分解されます。
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
複雑な物質の場合:
水(アマルガム溶液や熱アルカリ溶液などで保護酸化膜を除去した後):
2Al + 6H2O = 2Al(OH)3 + 3H2
アルカリとの併用(テトラヒドロキソアルミン酸塩および他のアルミン酸塩の生成を伴う):
2Al + 2NaOH + 6H2O = 2Na + 3H2
2(NaOH・H2O) + 2Al = 2NaAlO2 + 3H2
塩酸および希硫酸に容易に溶解します。
2Al + 6HCl = 2AlCl3 + 3H2
2Al + 3H2SO4(dil) = Al2(SO4)3 + 3H2
加熱すると、可溶性アルミニウム塩を形成する酸化剤である酸に溶解します。
2Al + 6H2SO4(濃) = Al2(SO4)3 + 3SO2 + 6H2O
Al + 6HNO3(濃) = Al(NO3)3 + 3NO2 + 3H2O
酸化物から金属を復元します (アルミノテルミー):
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
2Al + Cr2O3 = Al2O3 + 2Cr
建築資材として広く使用されています。 この品質のアルミニウムの主な利点は、軽さ、スタンピングに適した展性、耐食性(空気中では、アルミニウムは耐久性のある Al2O3 膜で瞬時に覆われ、さらなる酸化を防ぎます)、高い熱伝導率、およびその化合物の非毒性です。 特に、これらの特性により、アルミニウムは調理器具、食品業界のアルミ箔、および包装の製造において非常に人気があります。
構造材料としてのアルミニウムの主な欠点は強度が低いため、通常は少量の銅とマグネシウムを加えた合金(ジュラルミンと呼ばれます)が使用されます。
アルミニウムの電気伝導率は銅の1.7倍しかありませんが、アルミニウムの方が約2倍安価です。 したがって、ワイヤやそのシールドの製造のための電気工学、さらにはチップ内の導体の製造のためのマイクロエレクトロニクスにおいても広く使用されています。 銅 (63 1/オーム) と比較してアルミニウム (37 1/オーム) の低い導電率は、アルミニウム導体の断面積の増加によって補われます。 電気材料としてのアルミニウムの欠点は、酸化皮膜が強く、はんだ付けが難しいことです。
その複雑な特性により、加熱装置に広く使用されています。
アルミニウムとその合金は超低温でも強度を維持します。 このため、極低温技術で広く使用されています。
アルミニウムは、反射率が高く、低コストで蒸着が容易であるため、ミラーの製造に理想的な材料となっています。
ガス発生剤としての建材の製造。
アルミニウムめっきは、ピストン内燃機関のバルブ、タービンブレード、石油生産リグ、熱交換装置などの鋼やその他の合金に耐食性と耐スケール性を与え、また亜鉛めっきの代わりにもなります。
硫化アルミニウムは硫化水素を生成するために使用されます。
特に強力で軽量な材料として発泡アルミニウムを開発する研究が進行中です。
アルミニウムが非常に高価だった頃、アルミニウムからさまざまな宝飾品が作られていました。 その生産のための新しい技術(開発)が登場すると、彼らの流行はすぐに過ぎ去り、それを何度も減らしました。 現在、アルミニウムはコスチュームジュエリーの製造に使用されることがあります。


その他の金属
鉛
鉛は、原子番号 82 の、D.I. ドミトリー・イワノビッチ・メンデレーエフの化学元素の周期系の第 6 周期である第 4 族の主亜族の元素であり、記号 Pb (ラテン語: Plumbum) で示されます。 単体の鉛 (CAS 番号: 7439-92-1) は、展性があり、比較的可融性の灰色の金属です。
鉛の熱伝導率はかなり低く、0 °C の温度で 35.1 W/(m K) です。 金属は柔らかいのでナイフで簡単に切れます。 通常、表面は多かれ少なかれ厚い酸化膜で覆われており、切断すると光沢のある表面が現れ、時間の経過とともに空気中で消えます。
融点: 327.4 °C
沸点: 1740 °C
硝酸鉛は強力な混合爆薬の製造に使用されます。 アジ化鉛は、最も広く使用されている起爆剤 (起爆剤) として使用されます。 過塩素酸鉛は、鉱石の浮選選鉱に使用される重液(密度 2.6 g/cm3)の調製に使用され、強力な混合爆薬の酸化剤として使用されることもあります。 フッ化鉛は、単独で、あるいはビスマス、銅、フッ化銀とともに、化学電流源の陰極材料として使用されます。 ビスマス酸鉛、硫化鉛 PbS、ヨウ化鉛は、リチウム電池の正極材料として使用されます。 バックアップ電流源のカソード材料としての塩化鉛 PbCl2。 テルル化鉛 PbTe は、熱電材料 (350 μV/K の熱起電力) として広く使用されており、熱電発電機や熱電冷凍機の製造に最も広く使用されている材料です。 二酸化鉛 PbO2 は鉛蓄電池で広く使用されているだけでなく、これに基づいて塩素鉛電池、鉛蛍光電池などの多くの予備化学電流源も製造されています。
鉛白色、塩基性炭酸塩 Pb(OH)2.PbCO3、緻密な白色粉末は、二酸化炭素と酢酸の影響下で空気中の鉛から得られます。 硫化水素 H2S による分解のため、着色顔料として鉛白を使用することは、かつてほど一般的ではなくなりました。 鉛白は、セメントや炭酸鉛紙の技術におけるパテの製造にも使用されます。
ヒ酸鉛と亜ヒ酸鉛は、農業害虫 (マイマイガやワタゾウムシ) を殺すための殺虫剤技術に使用されています。 不溶性の白色粉末であるホウ酸鉛 Pb(BO2)2・H2O は、絵画やワニスの乾燥に使用され、他の金属とともにガラスや磁器のコーティングとして使用されます。 塩化鉛 PbCl2、白色の結晶性粉末、次のものに可溶 お湯、他の塩化物、特に塩化アンモニウム NH4Cl の溶液。 腫瘍を治療するための軟膏を調製するために使用されます。
クロム酸鉛 PbCrO4 はクロムイエロー染料として知られており、塗料の製造や磁器や布地の染色に重要な顔料です。 産業界では、クロム酸塩は主に黄色顔料の製造に使用されます。 硝酸鉛 Pb(NO3)2 は白色の結晶性物質で、水によく溶けます。 これは用途が限定されたバインダーです。 産業では、マッチの製造、繊維の染色と印刷、角の染色と彫刻に使用されます。 硫酸鉛 Pb(SO4)2 は水に不溶性の白色粉末で、電池、リソグラフィー、および印刷布地技術の顔料として使用されます。
硫化鉛 PbS は黒色の水不溶性粉末で、陶器の焼成や鉛イオンの検出に使用されます。
鉛はγ線をよく吸収するため、X線施設や原子炉の放射線防護に使用されています。 さらに、鉛は先進的な高速中性子原子炉のプロジェクトにおける冷却材としても考慮されています。
鉛合金は広く使用されています。 ピューター (錫と鉛の合金) は、85 ~ 90% の錫金属と 15 ~ 10% の鉛を含み、成形可能で安価であり、家庭用器具の製造に使用されます。 67% の鉛と 33% の錫金属を含むはんだは、電気工学で使用されます。 鉛とアンチモンの合金は弾丸や活版印刷フォントの製造に使用され、鉛、アンチモン、錫の合金は鋳物や軸受に使用されます。 鉛アンチモン合金は通常、ケーブルの外装や電池のプレートに使用されます。 鉛化合物は、染料、塗料、殺虫剤、ガラスの製造に使用されます。 トレードアイテムテトラエチル鉛 (C2H5)4Pb の形でガソリンへの添加剤として使用されます (中程度に揮発性の液体、蒸気は低濃度では甘いフルーティーな香りがあり、高濃度では不快な臭気があります。融点 = 130 °C、沸点 = 80°C/13 mm Hg .st.; 密度 1.650 g/cm; nD2v = 1.5198; 水に不溶、有機溶媒と混和; 毒性が高く、皮膚に容易に浸透; MPC = 0.005 mg/m; LD50 = 12.7 mg / kg (ラット、経口)) オクタン価を増加させます。

錫
スズは、D.I. メンデレーエフ・ドミトリー・イワノビッチによる化学元素の周期系の第 5 周期である第 4 族の主亜族の元素で、原子番号 50 です。記号スズ金属 (ラテン語スタンナム) で指定されます。 通常の状態では、単体は可鍛性があり可融性のある銀白色の光沢のある金属です。 スズはいくつかの同素体修飾を形成します。13.2 °C 未満では、立方晶ダイヤモンド型格子をもつ α-スズ (灰色のスズ) が安定し、13.2 °C を超えると、正方晶系の結晶格子をもつ β-スズ (白色のスズ) が安定します。
錫は主に、純粋な形で、または他の金属との合金で、安全で毒性のない耐食性のコーティングとして使用されます。 錫の主な工業用途は、食品容器用のブリキ(錫メッキ鉄)、電子機器用のはんだ、家庭用配管、軸受合金、錫とその合金のコーティングなどです。 最も重要な錫合金は、 ブロンズ(カプラム付き)。 もう 1 つのよく知られた合金であるピューターは、食器の製造に使用されます。 で 最近金属は非鉄重金属の中で最も「環境に優しい」金属であるため、その使用に対する関心が再び高まっています。 Nb3Sn 金属間化合物をベースにした超電導線材の作成に使用されます。
価格 2006 年の金属スズは平均 12 ~ 18 ドル/kg、高純度二酸化スズは約 25 ドル/kg、単結晶高純度スズは約 210 ドル/kg でした。
スズとジルコニウムの金属間化合物は、融点が高く(最高 2000 °C)、空気中で加熱しても酸化しにくいため、多くの用途があります。
スズは、構造用チタン合金の製造において最も重要な合金成分です。
二酸化スズは、光学ガラスの表面を「仕上げる」ために使用される非常に効果的な研磨材です。
スズ塩の混合物、つまり「黄色の組成物」は、以前は羊毛の染料として使用されていました。
スズは、マンガン - スズ元素、水銀 - スズ酸化物元素など、化学電流源のアノード材料としても使用されます。 鉛-錫電池での錫の使用は有望です。 たとえば、鉛バッテリーと同じ電圧では、鉛錫バッテリーは 2.5 倍の容量と 5 倍の単位体積あたりのエネルギー密度を持ち、内部抵抗ははるかに低くなります。
金属スズは毒性がないため、食品産業で使用できます。 最高 600 °C の温度での溶融物を含む、通常の保管および使用条件下で錫に含まれる有害な不純物は、GOST に準拠した最大許容濃度を超える量で作業エリアの空気中に放出されません。 錫粉塵に長期間(15~20年)曝露すると、肺に線維形成効果があり、労働者にじん肺を引き起こす可能性があります。
金属の応用
建設資材
金属およびその合金は、現代文明の主要な構造材料の 1 つです。 これは主に、その高い強度、均一性、および液体や気体に対する不浸透性によって決まります。 さらに、合金の配合を変えることにより、非常に広い範囲で特性を変えることが可能です。
電気材料
金属は良導体としても使用されます 電気(銅、アルミニウム)、抵抗器や電熱体の抵抗値を高める材料(ニクロムなど)として使用されます。
工具材料
金属およびその合金は、工具 (その作動部品) の製造に広く使用されています。 これらは主に工具鋼と超硬合金です。 ダイヤモンド、窒化ホウ素、セラミックスなども工具材料として使用されます。
冶金
冶金学または冶金学は、金属、金属間化合物、合金の物理的および化学的挙動を研究する材料科学の分野です。 冶金学には、原材料の抽出から完成品の金銭問題に至るまで、金属に関する既存の知識の実践的な応用も含まれます。
金属および酸化物の溶融物および固溶体の構造および物理化学的性質の研究、物質の凝縮状態の理論の開発。
冶金反応の熱力学、反応速度論および機構の研究。
環境問題の解決と多金属鉱物原料および技術廃棄物の統合利用のための科学的、技術的、経済的基盤の開発。
乾式冶金、電熱、湿式冶金および気相の基礎理論の開発 プロセス金属、合金、金属粉末、複合材料およびコーティングの製造。
鉄金属には、鉄、マンガン、クロム、バナジウムが含まれます。 残りはすべて色付きです。 非鉄金属は、その物理的特性と目的に基づいて、通常、重金属(銅、鉛、亜鉛、錫、ニッケル)と軽金属(アルミニウム、マグネシウム)に分類されます。
メインによると 技術プロセス乾式冶金(製錬)と湿式冶金(化学溶液中の金属の抽出)に分けられます。 乾式冶金の一種はプラズマ冶金です。
プラズマ冶金 - プラズマの影響下での鉱石からの抽出、金属および合金の製錬および加工。
鉱石(酸化物など)の加工は、プラズマ中での熱分解によって行われます。 逆反応を防ぐには、還元剤 (炭素、水素、メタンなど) を使用するか、プラズマ流を急激に冷却することで熱力学的平衡が崩れます。
プラズマ冶金は、鉱石から金属を直接還元することを可能にし、冶金プロセスを大幅に加速し、純粋な材料を取得し、燃料(還元剤)コストを削減します。 プラズマ冶金法の欠点は、プラズマの生成に使用される電力の消費量が多いことです。

話
人類が冶金学に関わっていたことを示す最初の証拠は、紀元前 5 ~ 6 千年紀に遡ります。 e. そしてマイダンペク、プロチニク、およびセルビアの他の場所(ビンカ文化に属する紀元前5500年の銅の斧を含む)、ブルガリア(紀元前5000年)、パルメラ()、スペイン、ストーンヘンジ()で発見されました。 ただし、このような古代の現象ではよくあることですが、その年代を常に正確に特定できるわけではありません。
初期の文化には銀、銅、錫、隕鉄が含まれていたため、金属加工は限られていました。 したがって、紀元前3000年に鉄の隕石から作られたエジプトの武器である「天の短剣」が高く評価されました。 e. しかし、銅と錫を抽出する方法を学んだ後、 ロックそして人々は紀元前 3500 年に青銅と呼ばれる合金を作りました。 e. 青銅器時代に入った。
鉱石から鉄を入手し、金属を製錬することははるかに困難でした。 この技術は紀元前 1200 年頃にヒッタイト人によって発明されたと考えられています。 すなわち、鉄器時代の始まりとなった。 鉄の採掘と製造の秘密は、ペリシテ人の支配における重要な要素となりました。
鉄冶金の発展の痕跡は、過去の多くの文化や文明に見ることができます。 これには、中東と近東の古代および中世の王国と帝国、古代エジプトとアナトリア()、カルタゴ、古代および中世のギリシャ人およびローマ人が含まれます。 ヨーロッパ冶金の多くの方法、装置、技術はもともと古代中国で発明され、その後ヨーロッパ人がこの技術を習得した(溶鉱炉を発明し、 鋳鉄、スチール、油圧ハンマーなど)。 しかし、最近の研究では、ローマの技術、特に採掘と鍛造の分野では、これまで考えられていたよりもはるかに進んでいたことが示唆されています。
鉱山冶金学
抽出冶金には、鉱石から貴重な金属を抽出し、抽出された原材料を純粋な金属に製錬することが含まれます。 金属酸化物または硫化物を純粋な金属に変換するには、鉱石を物理的、化学的、または電気分解的な手段で分離する必要があります。
冶金学者は、原材料、精鉱 (金属の貴重な酸化物または硫化物)、および廃棄物の 3 つの主要な要素を扱います。 採掘されると、大きな鉱石の塊は、各粒子が貴重な精鉱または廃棄物になるまで粉砕されます。
山 作品鉱石と環境が浸出を許容する場合は必要ありません。 このようにして、溶解し、ミネラルが豊富な溶液を得ることができます。
多くの場合、鉱石には複数の貴重な金属が含まれています。 このような場合、あるプロセスからの廃棄物を別のプロセスの原料として使用できます。
合金
合金は、金属成分が優勢な、2 つ以上の化学元素の巨視的に均質な混合物です。 合金の主相または唯一の相は、通常、合金の基礎となる金属中の合金元素の固溶体です。
合金は、金属光沢、高い電気伝導性、熱伝導性などの金属特性を備えています。 場合によっては、合金の成分が化学元素だけでなく、金属特性を持つ化合物である場合もあります。 たとえば、超硬合金の主成分はタングステンまたは炭化チタンです。 合金の巨視的特性は、その成分の特性とは常に異なり、多相 (異種) 合金の巨視的均一性は、金属マトリックス中の不純物相の均一な分布によって達成されます。
合金は通常、溶融状態で成分を混合し、冷却することによって製造されます。 部品の高い融解温度で、金属粉末を混合し、その後焼結することによって合金が製造されます (これにより、たとえば、多くのタングステン合金が得られます)。
合金は主要な構造材料の 1 つです。 中でも、鉄とアルミニウムをベースとした合金が最も重要です。 カーボン、シリコン、ホウ素などの非金属も多くの合金の組成に導入することができ、5,000 を超える合金が技術的に使用されています。
情報源
http://ru.wikipedia.org/
投資家百科事典. 2013 .
同義語:- - メタル、メタル男性、緯度。 クルシェック; そして精錬中の小さな形:キングレット。 日常生活では、貴重で高価な金属:金、プラチナ、銀。 単純: 鉄、銅、亜鉛、錫、鉛。 化学は、以下からなるほぼすべての化石についてそのような原理を発見しました。 ... ... ダールの解説辞典
現在知られている化学元素の大部分 (117 個中 93 個) は金属です。
さまざまな金属の原子は構造的に多くの共通点を持ち、それらが形成する単純な物質と複雑な物質は類似した特性 (物理的および化学的) を持っています。
金属原子の周期表上の位置と構造。
周期表では、金属はホウ素からアスタチンまでの従来の破線の左側と下に位置します (下の表を参照)。 ほとんどすべての s 元素 (H、He を除く) は金属であり、約半分 R-要素、すべて d- そして f-要素 ( ランタニドそして アクチニド).
ほとんどの金属原子は、その外側のエネルギー準位に少数 (最大 3 個) の電子を持ちますが、p 元素 (Sn、Pb、Bi、Po) の一部の原子だけがそれより多い (4 ~ 6 個) 電子を持ちます。 金属原子の価電子は、(非金属原子と比較して)原子核に弱く結合しています。 したがって、金属原子はこれらの電子を比較的容易に他の原子に渡し、次のように作用します。 化学反応還元剤としてのみ機能し、同時に正に帯電したカチオンに変わります。
Me - ne - = Me n+。
非金属とは異なり、金属原子は +1 ~ +8 の正の酸化状態のみによって特徴付けられます。
金属原子がその価電子を他の原子に与える容易さは、その金属の還元活性を特徴づけます。 金属原子が電子を放出しやすいほど、その還元剤は強力になります。 水溶液中での還元力が小さい順に金属を一列に並べると、 金属の変位系列、電気化学電圧系列 (または 近くのアクティビティ) 金属 (以下の表を参照)。
有病率m自然界の金属.
地殻 (これは地球の表層で、厚さは約 16 km) で最も一般的な金属のトップ 3 は、アルミニウム、鉄、カルシウムです。 あまり一般的ではないのは、ナトリウム、カリウム、マグネシウムです。 以下の表は、地殻中のいくつかの金属の質量分率を示しています。
鉄とカルシウム。 あまり一般的ではないのは、ナトリウム、カリウム、マグネシウムです。 以下の表は、地殻中のいくつかの金属の質量分率を示しています。
地殻中の金属の発生
| 金属 | 金属 | 地殻中の質量分率、% | |
|---|---|---|---|
| アル | 8,8 | Cr | 8,3 ∙ 10 -3 |
| 鉄 | 4,65 | 亜鉛 | 8,3 ∙ 10 -3 |
| Ca | 3,38 | ニ | 8 ∙ 10 -3 |
| ナ | 2,65 | 銅 | 4,7 ∙ 10 -3 |
| K | 2,41 | 鉛 | 1,6 ∙ 10 -3 |
| マグネシウム | 2,35 | 銀 | 7 ∙ 10 -6 |
| ティ | 0,57 | 水銀 | 1,35 ∙ 10 -6 |
| ん | 0,10 | アウ | 5 ∙ 10 -8 |
地殻中の質量分率が0.01%未満の元素を次のように呼びます。 レア。 レアメタルには、たとえば、すべてのランタニドが含まれます。 ある元素が地殻内で集中できない場合、つまり、それ自身の鉱石を形成せず、他の元素とともに不純物として見つかった場合、その元素は次のように分類されます。 ぼんやりした要素。 たとえば、Sc、Ga、In、Tl、Hf などの金属が分散されています。
XX世紀の40年代。 ドイツの科学者ウォルターとアイダ・ノーラがこの考えを表明した。 舗道にあるすべての石畳には、周期表のすべての化学元素が含まれています。 当初、これらの言葉は同僚たちから全会一致の承認を得られませんでした。 しかし、より正確な分析方法が登場するにつれて、科学者たちはこれらの言葉の真実性をますます確信するようになりました。
あらゆる生物は密接に関わっているので、 環境、すると、それらのそれぞれには、すべてではないにしても、周期表のほとんどの化学元素が含まれているはずです。 たとえば、成人の人体の場合、質量分率は 無機物質は6%です。 金属の中でも、これらの化合物には Mg、Ca、Na、K が含まれています。私たちの体内の多くの酵素やその他の生物学的に活性な有機化合物には、V、Mn、Fe、Cu、Zn、Co、Ni、Mo、Cr、およびその他の金属が含まれています。
成人の身体には、平均して約 140 g のカリウムイオンと約 100 g のナトリウムイオンが含まれています。 私たちは食事で毎日 1.5 g ~ 7 g のカリウムイオンと 2 g ~ 15 g のナトリウムイオンを摂取します。 ナトリウムイオンの必要性が非常に高いため、食品に特別に添加する必要があります。 ナトリウムイオン(尿や汗中のNaClの形)が大幅に失われると、人間の健康に悪影響を及ぼします。 したがって、暑い季節には医師は飲酒を推奨します ミネラルウォーター。 しかし、食品中の過剰な塩分も私たちの機能に悪影響を及ぼします。 内臓(主に心臓と腎臓)。
投票するにはJavaScriptを有効にする必要がありますその他の化合物も。 純粋な金属を入手し、さらに使用するには、鉱石から金属を分離し、精製を行う必要があります。 必要に応じて実行してください ドーピングその他金属加工も承ります。 科学はこれを研究しています 冶金。 冶金学では鉄金属の鉱石を区別します(に基づいて) 腺)および非鉄(鉄は含まず、約70元素のみ)。 ゴールド、シルバー、そして 白金にも適用されます 貴金属 。 また、海水、植物、生物中にも微量に存在しています(重要な役割を果たしています)。
人間の体は3%で構成されていることがわかっています。 金属。 何よりも私たちの中では、 細胞 カルシウムそして ナトリウム、に集中 リンパ系. マグネシウムに蓄積する 筋肉そして 神経系 , 銅-V 肝臓 , 鉄-V 血.
生産
金属は採掘によって地球から抽出されることが多く、得られた鉱石は必須元素の比較的豊富な供給源となります。 鉱石の位置を特定するには、鉱石探査や鉱床調査などの特別な検索方法が使用されます。 通常、預金は次のように分けられます。 キャリア(地表での鉱石の採掘)。地下だけでなく、重機を使用して土壌を採取して採掘も行われます。 鉱山.
金属は通常、化学還元または電解還元を使用して採掘された鉱石から抽出されます。 で 乾式冶金鉱石を金属原料に変換するために使用されます 高温、V 湿式冶金水性化学も同じ目的に使用されます。 使用される方法は金属の種類と汚染の種類によって異なります。
金属鉱石が金属と非金属のイオン性化合物である場合、通常、還元剤を使用して加熱する製錬を行って、純粋な金属を抽出します。 などの多くの一般的な金属 鉄、還元剤として使用して溶解 炭素(石炭を燃やすことで得られます)。 一部の金属など アルミニウムそして ナトリウム、経済的に正当化される単一の還元剤は存在せず、次の方法を使用して抽出されます。 電解.
一部の金属のモース硬度:
| 硬度 | 金属 |
|---|---|
| 0.2 | セシウム |
| 0.3 | ルビジウム |
| 0.4 | カリウム |
| 0.5 | ナトリウム |
| 0.6 | リチウム |
| 1.2 | インジウム |
| 1.2 | タリウム |
| 1.25 | バリウム |
| 1.5 | ストロンチウム |
| 1.5 | ガリウム |
| 1.5 | 錫 |
| 1.5 | 鉛 |
| 1.5 | |
| 1.75 | カルシウム |
| 2.0 | カドミウム |
| 2.25 | ビスマス |
| 2.5 | マグネシウム |
| 2.5 | 亜鉛 |
| 2.5 | ランタン |
| 2.5 | 銀 |
| 2.5 | 金 |
| 2.59 | イットリウム |
| 2.75 | アルミニウム |
| 3.0 | 銅 |
| 3.0 | アンチモン |
| 3.0 | トリウム |
| 3.17 | スカンジウム |
| 3.5 | 白金 |
| 3.75 | コバルト |
| 3.75 | パラジウム |
| 3.75 | ジルコニウム |
| 4.0 | 鉄 |
| 4.0 | ニッケル |
| 4.0 | ハフニウム |
| 4.0 | マンガン |
| 4.5 | バナジウム |
| 4.5 | モリブデン |
| 4.5 | ロジウム |
| 4.5 | チタン |
| 4.75 | ニオブ |
| 5.0 | イリジウム |
| 5.0 | ルテニウム |
| 5.0 | タンタル |
| 5.0 | テクネチウム |
| 5.0 | クロム |
| 5.5 | ベリリウム |
| 5.5 | オスミウム |
| 5.5 | レニウム |
| 6.0 | タングステン |
| 6.0 | β-ウラン |
電子が失われやすいため、金属は酸化する可能性があり、それが原因となる可能性があります。 腐食そして特性のさらなる劣化。 酸化する能力は、金属の標準的な活性シリーズによって認識できます。 この事実は、金属を他の元素と組み合わせて使用する必要があることを裏付けています( 合金、その中で最も重要なのは 鋼鉄)、合金化、およびさまざまなコーティングの使用。
金属の電子的性質をより正確に記述するには、次を使用する必要があります。 量子力学。 すべての固体において十分な 対称個々の原子の電子のエネルギー準位が重なり合って許容バンドを形成し、価電子によって形成されるバンドはと呼ばれます。 価電子帯。 金属中の価電子の結合が弱いため、金属の価電子帯は非常に広く、すべての価電子が価電子帯を完全に埋めるのに十分ではないという事実が生じます。
このような部分的に充填されたゾーンの基本的な特徴は、印加電圧が最小であっても、サンプル内で価電子の再配列が始まる、つまり流れが始まることです。 電気.
電子の高い移動度は、高い熱伝導率と、電磁放射を鏡面反射する能力 (金属に特有の輝きを与えます) につながります。
一部の金属
- 肺:
- 他の:
金属の応用
建設資材
工具材料
金属に関する思想の発展の歴史
人間の金属との出会いは次のようなことから始まりました。 金 , 銀そして 銅つまり、地表で自由な状態で見つかった金属からのものです。 その後、それらは自然界に広く分布し、その化合物から容易に分離できる金属によって結合されました。 錫 , 鉛 , 鉄そして 。 これら 7 つの金属は古代から人類に親しまれていました。 古代エジプトの工芸品の中には金や銅の品物があり、いくつかのデータによると、それらは現代から3000~4000年も離れた時代にまで遡るという。 e.
既知の 7 つの金属はすでに 中世増加した 亜鉛 , ビスマス , アンチモンそして18世紀初頭には 砒素。 18世紀半ば以降、発見された金属の数は急速に増加し、20世紀初頭までに65種類に達し、21世紀初頭までには96種類に達しました。
金属の生産と加工に関連するプロセスほど、化学知識の発展に貢献した化学産業はありません。 化学の歴史における最も重要な瞬間は、その歴史と結びついています。 金属の特性は非常に特徴的であるため、最も初期の時代にはすでに金、銀、銅、鉛、錫、鉄、水銀が均質な物質の 1 つの自然なグループを構成しており、「金属」の概念は最も古い化学概念を指します。 しかし、それらの性質に関する見解は多かれ少なかれ ある形中世にのみ現れる 錬金術師。 真実、アイデア アリストテレス自然について:存在するすべてのものは4つの要素(火、土、水、空気)から形成されており、それによってすでに金属の複雑さを示しています。 しかし、これらの考えはあまりにも曖昧で抽象的でした。 錬金術師にとって、金属の複雑さの概念と、その結果として、ある金属を別の金属に変換し、人工的に作り出す能力への信念が、彼らの世界観の主要な概念です。 この概念は、それまでに蓄積された金属の化学変化に関する大量の事実からの自然な結論です。 実際、空気中での単純な焼成によって、金属をそれらとはまったく異なる酸化物に変化させ、酸化物から金属を戻し、一部の金属を他の金属から分離し、元の金属とは異なる特性を持つ合金を形成します。 、などなど - これらすべては、その性質の複雑さを指摘する必要があるように見えました。
金属が金に実際に変化することに関しては、その可能性に対する信念は多くの目に見える事実に基づいていました。 当初、錬金術師の目には、銅と亜鉛など、金に似た色の合金が形成されることが、すでに金への変化でした。 色を変えるだけで金属の性質も変わるように思えたのです。 特に、卑金属を金に変えるためにこの金の混合物を含む物質が使用されたときの、不十分に行われた実験が、この考えに大きく貢献しました。 例えば、すでに18世紀末、あるコペンハーゲンの薬剤師は、化学的に純粋な銀はヒ素と合金化されると部分的に金に変わると断言した。 この事実は有名な化学者によって確認されました ギトン・ドゥ・モルヴォーと大騒ぎしました。 すぐに、実験に使用されたヒ素には微量の銀と金が含まれていることが判明しました。
当時知られていた 7 つの金属のうち、化学変化を起こしやすいものと、より難しいものがあるため、錬金術師はそれらを高貴な金属 (完全な金属) と卑劣な金属 (不完全な金属) に分けました。 前者には金と銀が含まれ、後者には銅、錫、鉛、鉄、水銀が含まれていました。 後者は、貴金属の特性を備えていますが、同時に液体状態と揮発性において他の金属とは大きく異なり、当時の科学者にとって非常に興味深いものであり、これを特別なグループに選び出す人もいました。 注目を集めたので、水銀は金属そのものを形成する元素の一つとみなされるようになり、金属の性質を担うものとみなされました。 錬金術師たちは、不完全から完全へ、ある金属から他の金属への変化が自然界に存在することを受け入れ、通常の条件下では、この変化は何世紀にもわたって非常にゆっくりと進行し、おそらく、そのような変化に関与する天体の神秘的な参加なしには進行しないと仮定した。当時、そして人類の運命に大きな役割があったと考えられています。 偶然にも、当時は 7 つの既知の金属と 7 つの惑星が存在しており、このことはそれらの間に神秘的な関係があることをさらに示していました。 錬金術師の間では、金属はしばしば惑星と呼ばれます。 それは金と呼ばれます 太陽、シルバー - 月、銅 - 金星、ブリキ - 木星、 鉛 - 土星、 鉄 - 火星そして水銀 - 水星。 亜鉛、ビスマス、アンチモン、ヒ素が発見されたとき、これらの物体はあらゆる点で金属に似ていましたが、金属の最も特徴的な特性の 1 つである展性が十分に発達していなかったので、それらは特別なグループに割り当てられました。 半金属。 金属を本来の金属と半金属に分類することは、18 世紀半ばに存在しました。
金属の組成の決定は、当初は純粋に推測的なものでした。 当初、錬金術師たちは自分たちが 2 つの要素から形成されていることを受け入れました - そして 硫黄。 この見解の起源は不明ですが、8 世紀にはすでに存在していました。 による ゲベル金属中に水銀が存在する証拠は、水銀が金属を溶解し、これらの溶液中ではその個性が消え、水銀に吸収されるということですが、水銀との共通原理がなければ、このようなことは起こらないでしょう。 さらに、水銀と鉛からは錫に似たものが生成されました。 硫黄については、おそらく硫黄化合物が知られていたため採取されたものと思われる。 外観 金属に似ています。 将来的には、これらの単純なアイデアは、おそらく金属を人工的に入手する試みの失敗により、非常に複雑で混乱するものになります。 たとえば、X ~ XIII 世紀の錬金術師の概念では、金属を形成する水銀と硫黄は、錬金術師が手にしていた水銀と硫黄と同じではありませんでした。 それは彼らに似ていて、特別な性質を持っているだけです。 通常の硫黄や水銀に実際に存在する何かが、他の物体よりも広範囲に表現されていました。 金属の組成の一部である水銀の下で、それらは不変性、金属光沢、延性を決定するもの、つまり金属の外観の担体を表します。 硫黄は、金属の変動性、分解性、可燃性を媒介するものとして意味されていました。 これら 2 つの元素は金属中に異なる割合で存在し、当時言われていたように、異なる方法で固定されました。 さらに、それらの純度はさまざまである可能性があります。 たとえば、Geber によれば、金は大量の水銀と少量の硫黄で構成されており、純度が最も高く、最も固定されています。 逆に、錫では、硫黄が多く、水銀はほとんど含まれておらず、これらは純粋ではなく、固定が不十分であるなどと考えられていました。 もちろん、これらすべてを踏まえて、当時の唯一の強力な化学物質である火に対する金属の異なる態度を表現したかったのです。 これらの見解がさらに発展すると、錬金術師にとって水銀と硫黄という 2 つの元素だけでは金属の組成を説明するのに不十分であるように思えました。 塩とヒ素が加えられました。 これによって彼らは、金属のすべての変化の間に、何か不揮発性で永続的なものが残ることを示したかったのです。 自然界において「卑金属が高貴な金属に変化するには何世紀もかかる」とすれば、錬金術師はこの改良と成熟のプロセスが迅速かつ容易に進む条件を作り出そうと努めた。 当時の化学と医学および生物学との密接な関係により、金属の変態という考え方は、自然に組織体の成長と発展という考え方と同一視されました。たとえば、鉛から金になること、地面に投げ込まれた穀物から植物が形成されること、そしていわば分解、発酵、人の病気の臓器の治癒、これらすべては共通の神秘的な生命プロセス、改善のプライベートな現象でした。 、同じ刺激によって引き起こされました。 ここから、金の獲得を可能にする神秘的な原理が、病気を治したり、年老いた人間の体を若々しい体に変えたりするなどの効果があると考えられていたことは自明のことです。 こうして、素晴らしい賢者の石のコンセプトが生まれました。
役柄に関しては 賢者の石卑金属から貴金属への変化については、何よりも金への変化に関する指示があり、銀の製造についてはほとんど言及されていません。 一部の著者によると、同じ賢者の石が金属を銀や金に変えるそうです。 他の人によると、この物質には 2 つのタイプがあり、1 つは完全なもの、もう 1 つは完全ではないもので、銀を生成するのは後者です。 変身に必要な賢者の石の量についても説明書が異なります。 一部の人によると、その1部で10,000,000部の金属を金に変えることができるという人もいますが、100部、さらにはわずか2部という人もいます。 金を得るために、彼らは卑金属を溶かすか、水銀を取り出してそこに賢者の石を投げました。 変化が即座に起こると保証する人もいれば、少しずつ変化する人もいます。 金属の性質と金属の変形能力に関するこれらの見解は、一般に 17 世紀まで何世紀にもわたって保持されてきましたが、特にこれらの見解が社会の希望を利用する多くのペテン師の出現を引き起こしたため、金属はこれらすべてを鋭く否定し始めました。金を手に入れるためにだまされやすい。 特に錬金術師のアイデアには苦労しました ボイル「私は金がどのようにして水銀、硫黄、塩に分解されるのかを知りたいのです」と彼はある場所で言いました。 私はこの経験にかかる費用を支払う用意があります。 私の場合、これを達成することは決してできませんでした。」
金属を人工的に入手しようとする何世紀にもわたる無駄な試みの後、たとえば燃焼における空気の役割や酸化中の金属の重量増加など、17世紀までに多くの事実が蓄積されたが、それでもなお、知られている ゲベル 8 世紀には、金属の元素組成の問題は終わりに近づいているように見えました。 しかし、化学に新しい傾向が現れ、その結果としてフロギストン理論が生まれ、この問題の解決はさらに長い間遅れました。
当時の科学者は燃焼現象に大きな興味を持っていました。 物体の性質の類似性は、その組成に含まれる原理と元素の同一性から生じるという当時の哲学の基本的な考え方に基づいて、可燃性の物体には共通の元素が含まれていることが認められました。 燃焼行為は、分解、要素への崩壊の行為と考えられていました。 この場合、可燃性要素は炎の形で放出されましたが、他の要素は残りました。 水銀、硫黄、塩の 3 つの元素から金属が形成されるという錬金術師の見解を認識し、金属の中にそれらが実際に存在することを認めると、硫黄は彼らの可燃性の原理として認識されなければなりませんでした。 その場合、金属の別の成分は明らかに金属の焼成による残留物として認識されなければなりませんでした。当時彼らが言ったように「土」です。 したがって、水銀はそれとは何の関係もありません。 一方、硫黄は燃えます。 硫酸、上記の理由から、多くの人は硫黄よりも単純な物体と考え、それを素体の中に含めました。 混乱と矛盾がありました。 ベッチャーは、古い概念と新しい概念を調和させるために、金属の中に「土」そのもの、「可燃性の土」、「水銀土」の 3 種類の土の存在を認めました。 このような状況下では スタールと彼の理論を提案した。 彼の意見では、可燃性の原因は硫黄やその他の既知の物質ではなく、未知のものであると彼は呼んでいます。 フロギストン。 金属はフロギストンと土から形成されると考えられています。 空気中での金属の焼成にはフロギストンの放出が伴います。 フロギストンが豊富な物質である石炭の助けを借りて地球から金属を取り戻すことは、フロギストンと地球を組み合わせる行為です。 いくつかの金属があり、それぞれが発火すると独自の土を生成しましたが、後者は元素としては1つであるため、金属のこの成分はフロギストンと同じ仮想的な性質を持っていました。 しかし、スタールの信奉者たちは、金属と同じ数の「元素の土」を受け入れることもありました。 いつ キャベンディッシュ受け取った酸に金属を溶解するとき 水素そしてその特性(燃焼をサポートできないこと、空気と混合したときの爆発性など)を調べたところ、彼はそれがスタールのフロギストンであると認識しました。 彼の概念によれば、金属は水素と「土」で構成されています。 この見解はフロギストン理論の多くの信奉者によって受け入れられました。
フロギストン理論は一見調和しているように見えますが、それと結びつけられない重要な事実がありました。 ゲーバーはまた、金属は焼成されると重量が増加することを知っていました。 一方、スタールによれば、彼らはフロギストンを失う必要がある。フロギストンが「地球」に再付着すると、結果として生じる金属の重量は「地球」の重量よりも小さくなる。 したがって、フロギストンは何らかの特別な特性、つまり負の重力を持っているに違いないことが判明しました。 この現象を説明するためにあらゆる独創的な仮説が提案されたにもかかわらず、それは理解できず、困惑させるものでした。
いつ ラヴォアジエ燃焼中の空気の役割を明らかにし、焼成中の金属の重量増加は空気中の酸素が金属に加えられることによって生じることを示し、金属を燃やす行為が元素に分解されるわけではないことを証明しました。それどころか、接続の行為、金属の複雑さに関する問題は否定的に決定されました。 単純な物体とは他の物体を分離することができないものであるというラヴォアジエの基本的な考えにより、金属は単純な化学元素として分類されました。 創造とともに 化学元素の周期表 メンデレーエフ金属要素がその中で正当な位置を占めました。
こちらも参照
ノート
リンク
- S.P.ヴコロフ: // ブロックハウスとエフロンの百科事典:全86巻(82巻+番外編4巻)。 - サンクトペテルブルク。 、1890年から1907年。(歴史的な部分)
| 周期表 | |
|---|---|
| ドミトリ・イワノビッチ・メンデレーエフ · 周期律 · 要素のグループ | |
| フォーマット | 短い・ブロックごと・ 拡張された・拡大・ 電子構成 · 電気陰性度 · 代替 · 元素の同位体 |
| 要素のリストによる | 名前 ·
語源(場所に敬意を表して、発見者に敬意を表して) · 開始時間 酸化状態 · 有病率 (人間の中で) 同位体安定性 |


