27.07.2019
1 アルカリ金属。 どのようにするか知っていますか
このテーマに関する 9 年生の化学の授業の要約:
« 接続 アルカリ金属とその応用例。」
目標: アルカリ金属とその化合物に関する知識をまとめ、体系化します。 日常生活や生産におけるこれらの化合物の使用、生物の生活におけるそれらの重要性について知る
レッスンの目的:
1. レッスン中に、アルカリ金属化合物の化学的性質、日常生活や生産におけるそれらの使用、生物の生活におけるそれらの重要性を確実に理解できるようにします。
一般的な教育スキルと化学試薬を扱うスキルを引き続き開発します。
2. アルカリ金属の原子の構造、単体の性質、アルカリ金属化合物の性質などの現象の因果関係についての基本的な思想の形成とそれに基づく応用。
3.研究対象の事実を比較し、一般化し、回答する際に自分の考えを論理的に表現する能力を養います。 周囲の生活で研究されている現象の応用に関するデータを使用して、学童の認知的興味を発展させること。
レッスンタイプ: 組み合わせ - ICT を使用した新しい教材の学習。
装置: 教科書、チョーク、黒板、コンピュータ、メディアプロジェクター、スクリーン、授業テーマのプレゼンテーション、生徒用授業技術カード、化学試薬(溶液:水酸化ナトリウム、塩酸、硫酸銅、水酸化亜鉛、フェノールフタレイン)および実験用ガラス器具(ラック)試験管付き)。
授業中
私 .整理時間.
Ⅱ 。 新しい教材を学ぶ。
1.「アルカリ金属」というトピックについて以前に学習した資料を確認します。
なぞなぞを推測してください:
1. 通常は灯油に入れて保管し、水で動かします。
自然の中で、覚えておいてください、これからは、
彼はどこにも自由ではない
塩で開けることも可能です
そこから炎が黄色に変わります
そしてそれは塩から得ることができます
デイビーがどうやってそれを理解したか。
どの要素について話しているのでしょうか? (な)
2. 彼は激しく抑圧します。
水分から純粋な水素、
置き換えられるのは、
そして酸素をしっかりと結びつけます。
植物にはその要素が隠されている
紫色で
塩で開いている可能性があります。
どの要素について話しているのでしょうか? (に)。
1.前回のレッスンではどのような金属について学びましたか?
2.なぜそう呼ばれるのでしょうか?
3. すべてのアルカリ金属の原子の構造に共通する特徴は何ですか?
トピックに関するテスト: アルカリ金属.
1. 以下はアルカリ金属には適用されません。 a) ルビジウム。 c) カリウム。 b) セシウム。 d) 銅。
2.電子式) 2) 8) 8) 1 は次の元素に対応します。 c) カリウム。 b) ナトリウム。
3. 核電荷が増加した場合の主要サブグループのグループ I の元素の原子半径:
a) 定期的に変更します。 c) 変化しない。 b) 増加する。
4. アルカリ金属は非常に強い性質を示します。
A) 酸化特性; c) 修復特性。 b) 両性特性;
5..アルカリ金属の物理的特性には以下は含まれません。
a) 銀白色。 b) 柔らかくて軽い。 d) 耐火性。
6. 主要サブグループのグループ I の元素が水と相互作用すると、次のものが形成されます。
a) 酸。 b) アルカリと水素が放出されます。 d) 塩。
7. ナトリウムとカリウムは次の理由で灯油中に保管されます。
a) 刺激臭がある。 b) 空気中で容易に酸化される。
自己管理: エラーなし – 「5」、エラー 1.2 件 – 「4」、エラー 3 件 – 「3」、それ以上 – 「2」
答え: 1- d 2 - c 3 - b 4 - c 5 - d 6 - b 7 - b。
自己管理: エラーなし - 「5」、1.2 エラー - 「4」、3.4 エラー - 「3」、それ以上 - 「2」
2.知識のアップデート.
自然界で遊離形態のアルカリ金属を見つけることは可能ですか? なぜ?
自然界ではそれらがどのような化合物の形で見つかるか推測できますか?
自然界では、アルカリ金属は化合物の形でのみ存在します。
Na と K は、自然界では塩化物、硫酸塩、ケイ酸塩などの形で存在します。
Li、Rb、Cs はさまざまな鉱物に含まれています。
Fr は放射性鉱石 Ac および U に含まれます。
テーブルの上: アルカリ金属化合物を含む物体 (ソーダ、塩、単三電池、石鹸) と質問。
これらのオブジェクトを見てください。 彼らの共通点は何だと思いますか?
1 遺伝的つながりとは何ですか?
2. ナトリウムの遺伝系列を作りましょう。
Na → Na 2 O → 2NaOH → Na 2 CO 3
3. アルカリ金属を形成する化合物の種類は何ですか? それらの特性を考えてみましょう。
学生は材料について説明し、スライドを見ながら、計画に沿ってメモを取り、特性や用途を明らかにします。
アルカリ金属酸化物
硬く、白く、溶けやすい。
b) 化学的特性; 生徒たちはノートに次のように書きます。アルカリ金属酸化物は典型的な塩基性酸化物です。 すべての塩基性酸化物と同様に、アルカリ金属酸化物は水、酸性酸化物、酸と反応します。
彼らは、酸化ナトリウムを例として化学反応の方程式を黒板とノートに書き留めます。
Na 2 O + H 2 O → 2NaOH;
Na 2 O + CO 2 → Na 2 CO 3 ;
Na 2 O + H 2 CO 3 → Na 2 CO 3 + H 2 O
アルカリ金属水酸化物
.
a) 物理的特性。 生徒は次の特性をノートに書き留めます。 硬く、白く、溶解性が高く、耐熱性があり、布地や紙を腐食します。
b) 化学的性質
安全説明会研究室での作業を行うとき。
水酸化ナトリウムの化学的性質。
目標: 水酸化物の例を使用して、アルカリ金属の化学的性質を実験的に証明するナトリウム
説明書
清潔な試験管に水酸化ナトリウムを注ぎ、フェノールフタレインを数滴加えます。 何を観察しているのですか?
溶液を同じ試験管に加えます 塩酸の。 何を観察しているのですか? 反応式を書きます。
NaOH + HCl → NaCl + H 2 O 彼らは、化学反応の方程式をイオンの形で黒板とノートに書き留めます。
清潔な試験管に水酸化ナトリウムを注ぎ、硫酸銅溶液を加えます。 何を観察しているのですか? 反応式を書きます。
2NaOH + CuSO 4 → Na 2 SO 4 + Cu (OH) 2 彼らは、化学反応の方程式をイオンの形で黒板とノートに書き留めます。
アルカリ金属水酸化物の化学的性質について結論を導き出します。
アルカリ金属水酸化物は酸、塩と反応します) 適用 - スライド番号 5。
水酸化ナトリウム – NaOH – 苛性ソーダ、苛性ソーダ、苛性ソーダ。
水酸化カリウム - KOH - 苛性カリ。
NaOHKOH と KOH は布地や紙を腐食させる苛性アルカリです。 生徒は次のように書き留めます。用途: 人造絹の製造用 、V 石鹸、SMS、化粧品、医薬品などの製造
アルカリ金属塩
.
物理的特性
。 学生はノートにプロパティを書き込みます。 結晶性固体で、ほとんど水に溶けます。
教科書のテキストを使った自主制作。
応用: スライド No. 5 の表に記入します。教科書 pp. 56 – 57 から学習します。
塩の配合
名前
応用
NaHCO3
K2CO3
塩化ナトリウム
Na 2 SO 4 ∙ 10 H 2 O
Na 2 CO 3 ∙ 10 H 2 O
生物の生命活動における重要性 - スライド No. 6。
「生物の生活におけるアルカリ金属化合物の重要性」というテーマに関する学生のメッセージ。
ナトリウムイオンとカリウムイオンは重要な生物学的役割を果たします。Na + は血液とリンパに含まれる主要な細胞外イオンであり、K + は主要な細胞内イオンです。 "共に働く。 これらのイオンの濃度比によって生体内の血圧が調節され、植物の根から葉への塩水の移動が確保されます。 カリウムイオン - 心筋の機能をサポートし、リウマチを助け、腸の機能を改善します。 カリウム化合物 – むくみを解消します。
V. 統合
VI. レッスンのまとめ。 マークを付ける。
レッスンの概要:
アルカリ金属の酸化物および水酸化物にはどのような物理的および化学的特性が特徴的ですか?
アルカリ金属水酸化物および塩はどこで使用されますか?
追加資料。 これは面白い。
タスク: なぜ参加するのか 古代ギリシャ炎天下での作戦が始まる前に、兵士たちは塩分たっぷりのパンを一切れ食べて水を飲むように勧められましたか?
電解質イオンは容易に水和するため、食塩は体内に水分を保持します。
問題: なぜエスキモーは塩分をほとんど食べないのでしょうか?
ある科学的理論によれば、人間を含む地球上に生息するすべての動物は、海に現れて海に住んでいた生物の子孫です。 これらの生物の体液の組成は海水でした。 陸に上がった彼らは体液として海水を保持していた。 しかし、自然は生物に自然な形で十分な量の塩を提供することができません。 塩は水に溶けるため、その多くは雨水によって土壌から川、海、海洋に洗い流されます。 その結果、地上で育つ植物には十分な塩分が含まれなくなります。 植物を食べる動物に塩が必要なのはこのためです。 体は毎日一定量の塩分を含む体液を失いますが、植物性食品では塩分を補充できません。 他の動物を食べる動物には追加の塩は必要ありません。 彼らは犠牲者の遺体から必要な塩を入手します。 エスキモーは主に肉を食べるため、塩の必要量は非常に少ないです。
目的: ここ数十年、イギリスで脳血管疾患による死亡率が減少したのはなぜですか?
これは、新鮮な果物や野菜の消費量が増加したためです。 新鮮な野菜や果物は常にカリウムが多く、ナトリウムは少ないです。 ナトリウムは体内に水分を蓄え、増加します。 動脈圧、そしてカリウムは逆に、それを減らすのに役立ちます。 このため、野菜や果物、特にリンゴの摂取量を増やすことが、脳血管疾患を予防するための必須の対策と考えられます。
人々の塩への愛はどこから来るのでしょうか? .
塩は食べ物を腐敗や腐敗から守る働きがあります。 食品を保存するために(まだ冷蔵庫や冷凍庫がなかった時代)、塩が使用されました。 塩水から野菜を味わった後、人々は新鮮な野菜を漬け、発酵させ、浸し始めました。 人は何にでも塩漬けすることに慣れているため、塩抜きの食事に切り替えないだけで、いくつかの病気に耐えることさえできます。 徐々に、私は試しもせずにあらゆる種類の食べ物に塩を加える習慣を身につけました。
塩分が多い - カリウムが少ない、カリウムが少ない - 多くの病気
塩の問題はカリウムとナトリウムのバランスの問題です。 体内では非常に重要です。 カリウムとナトリウムは細胞内での存在をめぐって常に競合します。 食卓塩にはカリウムは含まれておらず、すべてナトリウムです。 私たちの体はカリウムを緊急に必要としていますが、これはナトリウムの4倍である必要があります。 体はどこからでもカリウムを集めますが、食卓塩を過剰に使用すると、その努力がすべて無効になります。 したがって、塩分を過剰に摂取するとカリウムが不足し、時間が経つと肉体的および精神的疲労、睡眠不足、けいれん、関節痛などのさまざまな病気が引き起こされます。
過剰なナトリウム(塩分)は心臓に負担をかけます。 塩分を過剰に摂取していないか知りたいですか? 鏡に行きましょう。目の虹彩の周りにある白い円は、塩分の過剰摂取を示しています。
苛性カリウム
苛性カリウムは、肥料、合成ゴム、電池用電解質、試薬の製造に使用され、製薬産業や国民経済のその他の分野でも使用されます。
苛性カリウムは、この種の輸送に有効な物品輸送規則に従って、鉄道および道路で輸送されます。
苛性カリウムは密閉容器に保管されています。 空気中に「広がり」、そこから湿気を吸収します。
その伝統的な名前「苛性カリウム」は、この物質が生体組織に及ぼす腐食作用を反映しています。 苛性カリウムが皮膚に接触すると、化学火傷を起こす可能性があります。
軟石けんは、油脂を苛性カリウムでケン化して得られます。 これらの石鹸はすべて、柔らかくクリーミーな粘稠度を持っています。
水酸化ナトリウム。
最も一般的なアルカリ。 世界中で年間 5,700 万トンを超える苛性アルカリが生産および消費されています。
苛性ソーダは、さまざまな産業や家庭のニーズに合わせて使用されています。
紙パルプ産業における紙、ボール紙、人造繊維、木質繊維ボードの製造。
石鹸、シャンプー、その他の洗剤の製造における脂肪のけん化用。
化学工業 - 酸および酸酸化物を中和するため、試薬または触媒として使用されます。 化学反応や。。など。
苛性ソーダ(水酸化ナトリウム)は、腐食性のある腐食性物質です。 これは第 2 危険有害性クラスの物質に属します。 したがって、作業するときは注意が必要です。
皮膚、粘膜および目に接触した場合、重篤な化学火傷が形成されます。 粘膜表面が苛性アルカリと接触した場合は、患部を水流で洗い流す必要があり、皮膚に接触した場合は弱い酢酸溶液で洗い流す必要があります。
リチウムで - 星へ
携帯電話、ポケット機器、ラップトップのメーカーはこの金属を切実に必要としています。 原子力エネルギーはリチウム (Li) を大量に消費しますが、理論家によれば、熱核エネルギーの鍵となるのはこのアルカリ金属です。 最強であること 向精神薬, Liは軍事や応用精神医学で使用されています(そしてLiが人間の精神に及ぼす影響の性質は完全には理解されていません)。 重水素化リチウムは、水爆の作動物質および爆発力調整器として使用されます。
この金属は深宇宙探査にも必要です。
ルーティングレッスン用の生徒用
トピック: アルカリ金属の化合物。
テスト
水素化物。最も安定しているのは水素化リチウムで、加熱したリチウムに水素を通すことで簡単に得られます。 LiH は白色の結晶性粉末で、融点は 680℃です。 高温 LiH は非常に反応性が高いです。 水により激しく分解します。
LiH + H 2 O = LiOH + H 2
酸化物。最も安定しているのは Li 2 O です。リチウムと酸化ナトリウムは白色で、残りは黄色です。 さらに、色の強度は元素の原子番号が増加するにつれて増加します。
過酸化物。過剰な酸素中で金属を燃焼させることによって生成されます。 アルカリ金属過酸化物は、過酸化水素の誘導体と見なすことができます。 これらは酸および水と相互作用して過酸化水素を形成します。
M 2 O 2 + H 2 SO 4 = M 2 SO 4 + H 2 O 2
M 2 O 2 + 2H 2 O = 2MOH + H 2 O 2
最も重要なのは過酸化ナトリウムで、密閉空間で酸素を生成するために使用されます(たとえば、 潜水艦):
2Na 2 O 2 + 2CO 2 = 2Na 2 CO 3 + 2O 2
水酸化物。技術的には、それらは苛性アルカリ(NaOH - 苛性ソーダ、KOH - 苛性カリウム)と呼ばれます。 これらは無色の可融性物質です。 溶融状態では、ガラス、磁器、プラチナと相互作用します。 したがって、アルカリの溶解は相互作用しない銀または鉄のるつぼ内で行われます。 水酸化物は水によく溶け、熱を放出します。
水酸化物は次の方法で調製されます。
a) 金属または酸化物と水との相互作用:
Li 2 O + H 2 O = 2LiOH
この反応は、非常に純粋な水酸化物を生成するためにのみ使用されます。
b) 苛性化反応は、苛性ソーダを製造するための最も古い既知の方法です。 ソーダ溶液を沸騰させながら水酸化カルシウム(消石灰)で処理する方法です。 生じた不溶性炭酸カルシウムを濾別するか、透明な液体をデカントします。
Na 2 CO 3 + Ca(OH) 2 = 2NaOH + CaCO 3
得られた水酸化ナトリウム溶液を真空蒸発により濃縮する。 固体苛性ソーダを500℃で溶かして水を完全に除去すると、3~4%のNa 2 CO 3 を含むNaOHが得られます。 このようにして得られたNaOHを「か性ソーダ」といいます。
c) 水溶液中でのアルカリ金属塩化物の電気分解は、塩素と同時に NaOH と KOH を生成する現代の工業的方法です。 NaCl 溶液を不活性電極 (白金、グラファイト) で電気分解すると、陽極で塩素が放出され、陰極で水素が放出されます。 Na + イオンと OH - イオンは陰極空間に蓄積し、NaOH を形成します。
d) アルカリ金属炭酸塩と酸化物を融合し、その後水蒸気で合金を処理することにより:
Fe 2 O 3 + Na 2 CO 3 = 2NaFeO 2 + CO 2
2NaFeO 2 + H 2 O = 2NaOH + Fe 2 O 3
アルカリは最も重要な原料です。 化学工業染料、ガラス、石鹸、紙、人工繊維、医薬品の製造用。
塩。 NaCl と KCl は自然界に大量に存在します。 NaCl(食塩)は以下のものに含まれます。 海水(平均2.7%)そして最大数キロメートルの厚さの堆積物中に岩塩の形で存在します。 NaCl と KCl は、再結晶によって天然塩化物から純粋な形で得られます。 リチウム塩は天然炭酸リチウムから得られます。 ルビジウムとセシウムの塩の入手には困難が伴います。 その溶解度はカリウム塩の溶解度に非常に近いです。 通常、カーナライトの再結晶後に残った母液からルビジウムとセシウムミョウバンを分離し、再結晶により精製します。 ルビジウムは、アルコール中の炭酸塩の異なる溶解度を利用してセシウムから分離されます。
硝酸塩のうち、NaNO 3 と KNO 3 は実用上重要です。 技術名は硝酸ナトリウム、硝酸カリウムです。 どちらの塩もミネラル肥料として使用されます。 KNO 3 は黒色粉末の製造にも使用されます (NaNO 3 は吸湿性があるため使用されません)。
炭酸 H 2 CO 3 は、酸性 (MHCO 3) と中性 (M 2 CO 3) の 2 つの系列のアルカリ金属炭酸塩を生成します。酸性炭酸塩 (炭化水素塩、重炭酸塩) は、リチウムを除くすべてのアルカリ金属について知られています。 炭酸リチウムを除いて、すべての中性炭酸塩は水によく溶けます。 Na 2 CO 3 – ソーダ。一部の湖や鉱泉の水中に自然に存在することがあります。 ソーダはアンモニア法を使用して得られます。食塩の溶液をアンモニアと二酸化炭素で飽和させます。 この場合、NaHCO 3 が沈殿します。 ソーダはNH 4 Clよりも溶解度が低いです。
NaCl + H 2 O + CO 2 + NH 3 = NaHCO 3  ̄ + NH 4 Cl
2NaHCO 3 → Na 2 CO 3 + CO 2 + H 2 O
K 2 CO 3 – カリ、吸湿性の白い粉末、水によく溶けます。 水酸化カリウムの炭酸化により調製:
2KOH + CO 2 = K 2 CO 3 + H 2 O
カリは石鹸やガラス産業、羊毛の染色や漂白、シアン化カリウムの製造、有機合成に使用されます。
硫酸酸性と中性の 2 つのシリーズのアルカリ金属硫酸塩が得られます。
Na 2 SO 4 は、塩化ナトリウムと硫酸から塩酸を製造する際の副生成物として得られます。 水溶液から、硫酸ナトリウムは Na 2 SO 4 の形で結晶化します。 10H 2 O、技術的には、この結晶水和物は芒硝と呼ばれます。 綿織物の染色や医療に使用されます。
· · ·§96. アルカリ性
アルカリ金属のグループには、次の一連の金属が含まれます。 Li、Na、K、Rb、Cs、Fr. それらは周期表のグループ I の主要なサブグループに属します。
これらはすべて、外側の電子層に 1 つの電子があるという点で似ています (表 18)/。
s元素にはアルカリ元素が含まれます。 アルカリ金属原子の外側電子層の電子は、同じ時代の他の元素と比較して原子核から最も遠い、つまり、アルカリ金属原子の半径は、他の元素の原子の半径と比較して最大です。同じ時期。 期限
|
コアチャージ |
エネルギー準位内の電子の数 |
原子半径 |
|||||||
これにより、アルカリ金属原子の外層の価電子が簡単に剥がされ、正の一価イオンに変わります。 これは、アルカリ金属と他の元素の化合物がイオン結合の種類に応じて構築されるという事実によるものです。
酸化還元反応では、それらは強力な還元剤として作用し、この能力は原子核の電荷が増加するにつれて金属から金属へと増加します。
§97. ナトリウム
ナトリウム原子の電子配置は、ls 2 2s 2 2p 6 3s 1 です。 その外層の構造は次のとおりです。
ナトリウムは自然界では塩の形でのみ存在します。 最も一般的なナトリウム塩は食塩 NaCl、鉱物のシルビナイト KCl・NaCl、および一部の硫酸塩、たとえばカスピ海のカラ・ボガズ・ゴル湾で大量に見つかる芒硝塩 Na2SO4・10H2O です。
食塩NaClから、溶融塩の電気分解により金属ナトリウムが得られます。 電気分解装置を図に示します。 76. 電極を溶融塩に浸します。 アノード空間とカソード空間は隔膜によって分離されており、生成されたナトリウムは逆反応が起こらないように隔離されています。 正のナトリウムイオンは陰極から電子を受け取り、中性のナトリウム原子になります。 中性のナトリウム原子は溶融金属の形で陰極に集まります。 カソードで発生するプロセスは、次の図で表すことができます。
Na ++ Na 0 。
電子の受け取りは陰極で起こり、原子またはイオンによる電子の受け取りはすべて還元であるため、陰極のナトリウムイオンは還元されます。 アノードでは、塩素イオンが電子を放出します。つまり、酸化と遊離イオンの放出のプロセスです。
塩素ガスは次の図で表すことができます。
Cl — — e— → Cl0
得られたナトリウム金属は銀白色で、ナイフで簡単に切断できます。 ナトリウムの切断物を切断直後に検査すると、明るい金属光沢がありますが、金属の非常に急速な酸化によりすぐに色あせてしまいます。
![]()
米。 76. 溶融塩の電気分解の設置図。
1 - リングカソード。 2 - アノード空間から塩素ガスを除去するためのベル
ナトリウムが少量の酸素中で約 180°の温度で酸化されると、酸化ナトリウムが得られます。
4Na + O2 = 2Na2O。
酸素中で燃焼すると、過酸化ナトリウムが生成されます。
2Na + O2 = Na2O2。
この場合、ナトリウムはまばゆい黄色の炎をあげて燃えます。
ナトリウムは容易かつ急速に酸化するため、灯油またはパラフィンの層の下で保管されます。これは、ある程度の量の空気が依然として灯油に溶解しており、ナトリウムの酸化がゆっくりとはいえ起こるため、好ましい方法です。
ナトリウムは水素と結合することができます - 水素化物NaH、酸化状態 1 を示します。これは塩状の化合物であり、化学結合の性質と酸化状態の大きさにより、グループ IV の主要なサブグループの元素の揮発性水素化物とは異なります。 -VII.
金属ナトリウムは、酸素や水素だけでなく、多くの単純物質や複雑な物質とも反応します。 たとえば、乳鉢で硫黄と一緒に粉砕すると、ナトリウムが硫黄と激しく反応して次のものが形成されます。
2Na + S = Na2S
反応には爆発が伴うため、モルタルを目から遠ざけ、手をタオルで包む必要があります。 反応のためにはナトリウムの小片を摂取する必要があります。
ナトリウムは塩素中で激しく燃焼して塩化ナトリウムを形成します。これは、溶けた高温のナトリウムに塩素の流れが流れる塩化カルシウム管で観察すると特に効果的です。
2Na + Cl2 = 2NaCl
ナトリウムは単純な物質だけでなく、水などの複雑な物質とも反応し、ナトリウムを置換します。 活性金属、電圧系列では、水素のかなり左側にあり、後者を水から簡単に置き換えます。
2Na + 2H2O = 2NaOH + H2
アルカリ金属火災は水では消すことができません。 ソーダ灰の粉末を入れるのが最善です。 ナトリウムが存在すると、ガスバーナーの無色の炎が黄色に変わります。
金属ナトリウムは、ブタジエンから合成ゴムを製造する場合など、有機合成における触媒として使用できます。 これは、過酸化ナトリウムなどの他のナトリウム化合物を製造するための出発物質として機能します。
■ 27. テキストに示されている金属ナトリウムに関する反応式を使用して、金属ナトリウムが還元剤として振る舞うことを証明してください。
28. ナトリウムはなぜ空気中に保存できないのですか?
29. ある学生が、塩から金属塩を置き換えることを期待して、硫酸銅の溶液にナトリウム片を浸しました。 赤い金属の代わりに、ゼラチン状の青い沈殿物が得られました。 起こった反応を説明し、その方程式を分子およびイオンの形式で書きます。 反応が望ましい結果をもたらすためには、反応条件をどのように変更する必要がありますか? 方程式は分子、完全イオン、および省略形のイオン形式で記述します。
30.2.3gのナトリウム金属を45mlの水の入った容器に入れた。 反応の最後に生成される水酸化ナトリウムの量はどれくらいですか?
31. ナトリウム火災を消すにはどのような手段が使用できますか? 論理的に答えてください。
§ 98. ナトリウムの酸素化合物。 水酸化ナトリウム
ナトリウムの酸素化合物は、すでに述べたように、酸化ナトリウム Na2O と過酸化ナトリウム Na2O2 です。
酸化ナトリウム Na2O は特に重要ではありません。 水と激しく反応して苛性ソーダを形成します。
Na2O + H2O = 2NaOH
過酸化ナトリウム Na2O2 は黄色がかった粉末です。 H2O2と構造が同じであるため、過酸化水素の塩の一種と考えることができます。 過酸化ナトリウムと同様に、強力な酸化剤です。 水にさらされるとアルカリが生成され、次のことが起こります。
Na2O2 + H2O = H2O2 + 2NaOH
過酸化ナトリウムに対する希酸の作用によっても生成されます。
Na2O2 + H2SO4 = H2O2 + Na2SO4
過酸化ナトリウムの上記の特性により、あらゆる材料の漂白に使用できます。
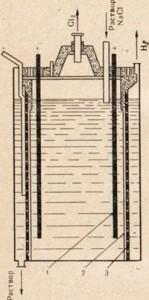
米。 77. 食塩溶液の電気分解のための設備の図。
1 - アノード; 2 - アノード空間とカソード空間を分離する隔膜。 3カソード
非常に重要なナトリウム化合物は、水酸化ナトリウム、または水酸化ナトリウム、NaOH です。 苛性ソーダ、または単に苛性ソーダとも呼ばれます。
苛性ソーダを得るには、最も安価な天然ナトリウム化合物である食塩を電気分解して使用しますが、この場合は溶融物ではなく食塩溶液を使用します(図77)。 食塩溶液の電気分解プロセスの説明については、§ 33 を参照してください。 図77は、アノード空間とカソード空間が隔膜によって分離されていることを示す。 これは、得られる生成物が互いに相互作用しないようにするためです (例: Cl2 + 2NaOH = NaClO + NaCl + H2O)。
苛性ソーダは白色の結晶固体で、水によく溶けます。 苛性ソーダは水に溶けると放出されます たくさんの加熱すると溶液は非常に熱くなります。 苛性ソーダは、水蒸気の影響で湿気が多くなる可能性があるほか、二酸化炭素の影響で苛性ソーダが徐々に炭酸ナトリウムに変化する可能性があるため、密閉した容器に保管する必要があります。 :
2NaOH + CO2 = Na2CO3 + H2O。
苛性ソーダは代表的なアルカリであるため、作業時の注意点は他のアルカリと同様です。
苛性ソーダは、石油製品の精製、脂肪から石鹸の製造、製紙産業、人造繊維や染料の製造、医薬品の製造など、多くの産業で使用されています(図1)。 78)。
苛性ソーダの適用範囲をノートに書き留めてください。
ナトリウム塩のうち、まず注目すべきは、苛性ソーダと金属ナトリウムの製造の主原料となる食塩 NaCl (この塩の詳細については、164 ページを参照)、ソーダ Na2CO3 (164 ページを参照) 278)、Na2SO4 (224 ページを参照)、NaNO3 (250 ページを参照) など。
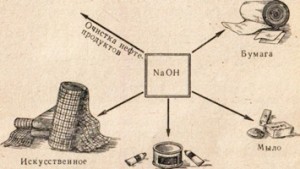
米。 78. 苛性ソーダの使用
■ 32. 食塩の電気分解による水酸化ナトリウムの製造方法を説明してください。
33. 苛性ソーダは、炭酸ナトリウムを消石灰で処理することによって調製できます。 この反応の方程式の分子形式とイオン形式を書き留め、40 kg の水酸化ナトリウムを製造するのに 95% の炭酸塩を含むソーダがどのくらい必要になるかを計算します。
34. すり込み栓をしたフラスコに苛性ソーダ溶液を保存すると、栓が「くっついて」外せなくなるのはなぜですか? ボトルを水の中にひっくり返してしばらく放置しておくと、栓が簡単に外れます。 この場合どのような過程が起こるかを反応方程式をあげて説明せよ。
35. 典型的なアルカリとしての苛性ソーダの特性を特徴付ける反応方程式を分子およびイオンの形で書きます。
36. 苛性ソーダを扱うときはどのような注意が必要ですか? 苛性ソーダ火傷の応急処置は何ですか?
§99. カリウム
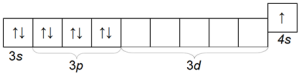
カリウム K もかなり一般的なアルカリ金属であり、原子半径 (第 4 周期) のサイズがナトリウムとは異なるため、ナトリウムよりも大きな化学活性を持っています。 カリウム原子の電子配置は、1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 です。
外側の電子層の構造
カリウムはナイフでよく切れる柔らかい金属です。 酸化を避けるため、ナトリウムと同様に灯油の層の下に保管されます。
カリウムはナトリウムよりもさらに激しく水と反応し、アルカリを形成して水素を放出し、発火します。
2K + 2H2O = 2KOH + H2。
酸素中で燃焼すると(ナトリウムを燃焼させる場合よりもさらに小さな金属片を燃焼に使用することをお勧めします)、ナトリウムと同様に非常に激しく燃焼して過酸化カリウムを形成します。
循環中のカリウムはナトリウムよりもはるかに危険であることに注意する必要があります。 カリウムを切断する際にも強い爆発が起こる可能性があるため、より慎重に取り扱う必要があります。
水酸化カリウム、または水酸化カリウム KOH は、白色の結晶性物質です。 苛性カリウムはあらゆる点で苛性ソーダに似ています。 これらは石鹸業界で広く使用されていますが、製造コストが若干高いため、NaOH と同じようには使用されません。
カリウム塩の一部は肥料として広く使用されているため、特に注意が必要です。 これらは、塩化カリウムKCl、硝酸カリウムKNO3であり、窒素肥料でもあります。
■ 37. 苛性カリウムが苛性ソーダよりも化学的に活性であるという事実はどのように説明できますか?
38. カリウム片を水とともに晶析装置に入れました。 反応が完了した後、少量の亜鉛を白色のゼラチン状沈殿の形でそこに置きました。 沈殿物は消え、溶液をフェノールフタレインでテストすると、フェノールフタレインは深紅色に変わりました。 ここではどのような化学プロセスが起こったのでしょうか?
どれが解決中ですか? 論理的に答えてください。
39. カリウムは、すべてのアルカリ金属と同様に、s 元素ファミリーのメンバーとして分類されるのはなぜですか?
アルカリ金属は非金属と容易に反応します。
2K + I 2 = 2KI
2Na + H2 = 2NaH
6Li + N 2 = 2Li 3 N (反応は室温で起こります)
2Na + S = Na 2 S
2Na + 2C = Na 2 C 2
酸素との反応では、各アルカリ金属は独自の個性を示します。空気中で燃焼すると、リチウムは酸化物、ナトリウム - 過酸化物、カリウム - 超酸化物を形成します。
4Li + O 2 = 2Li 2 O
2Na + O 2 = Na 2 O 2
K + O 2 = KO 2
酸化ナトリウムの調製:
10Na + 2NaNO 3 = 6Na 2 O + N 2
2Na + Na2O2 = 2Na2O
2Na + 2NaON = 2Na 2 O + H 2
水との相互作用により、アルカリと水素が生成されます。
2Na + 2H2O = 2NaOH + H2
酸との相互作用:
2Na + 2HCl = 2NaCl + H2
8Na + 5H 2 SO 4 (濃) = 4Na 2 SO 4 + H 2 S + 4H 2 O
2Li + 3H 2 SO 4 (濃) = 2LiHSO 4 + SO 2 + 2H 2 O
8Na + 10HNO 3 = 8NaNO 3 + NH 4 NO 3 + 3H 2 O
アンモニアと相互作用すると、アミドと水素が形成されます。
2Li + 2NH 3 = 2LiNH 2 + H 2
有機化合物との相互作用:
H ─ C ≡ C ─ H + 2Na → Na ─ C≡C ─ Na + H 2
2CH 3 Cl + 2Na → C 2 H 6 + 2NaCl
2C 6 H 5 OH + 2Na → 2C 6 H 5 ONa + H 2
2CH 3 OH + 2Na → 2CH 3 ONa + H 2
2СH3COOH + 2Na → 2CH3COOOONa + H2
アルカリ金属に対する定性的な反応は、その陽イオンによる炎の着色です。 Li + イオンは炎をカーマインレッドに着色し、Na + イオンは黄色、K + は紫に着色します。
アルカリ金属化合物
酸化物。
アルカリ金属酸化物は代表的な塩基性酸化物です。 これらは、酸性および両性酸化物、酸、および水と反応します。
3Na 2 O + P 2 O 5 = 2Na 3 PO 4
Na 2 O + Al 2 O 3 = 2NaAlO 2
Na2O + 2HCl = 2NaCl + H2O
Na 2 O + 2H + = 2Na + + H 2 O
Na 2 O + H 2 O = 2NaOH
過酸化物.
2Na 2 O 2 + CO 2 = 2Na 2 CO 3 + O 2
Na 2 O 2 + CO = Na 2 CO 3
Na 2 O 2 + SO 2 = Na 2 SO 4
2Na 2 O + O 2 = 2Na 2 O 2
Na 2 O + NO + NO 2 = 2NaNO 2
2Na 2 O 2 = 2Na 2 O + O 2
Na 2 O 2 + 2H 2 O (冷) = 2NaOH + H 2 O 2
2Na 2 O 2 + 2H 2 O (横) = 4NaOH + O 2
Na 2 O 2 + 2HCl = 2NaCl + H 2 O 2
2Na 2 O 2 + 2H 2 SO 4 (分割水平線) = 2Na 2 SO 4 + 2H 2 O + O 2
2Na 2 O 2 + S = Na 2 SO 3 + Na 2 O
5Na 2 O 2 + 8H 2 SO 4 + 2KMnO 4 = 5O 2 + 2MnSO 4 + 8H 2 O + 5Na 2 SO 4 + K 2 SO 4
Na 2 O 2 + 2H 2 SO 4 + 2NaI = I 2 + 2Na 2 SO 4 + 2H 2 O
Na 2 O 2 + 2H 2 SO 4 + 2FeSO 4 = Fe 2 (SO 4) 3 + Na 2 SO 4 + 2H 2 O
3Na 2 O 2 + 2Na 3 = 2Na 2 CrO 4 + 8NaOH + 2H 2 O
塩基(アルカリ)。
2NaOH (過剰) + CO 2 = Na 2 CO 3 + H 2 O
NaOH + CO 2 (過剰) = NaHCO 3
SO 2 + 2NaOH (過剰) = Na 2 SO 3 + H 2 O
SiO 2 + 2NaOH Na 2 SiO 3 + H 2 O
2NaOH + Al 2 O 3 2NaAlO 2 + H 2 O
2NaOH + Al 2 O 3 + 3H 2 O = 2Na
NaOH + Al(OH) 3 = Na
2NaOH + 2Al + 6H 2 O = 2Na + 3H 2
2KOH + 2NO2 + O2 = 2KNO3 + H2O
KOH + KHCO 3 = K 2 CO 3 + H 2 O
2NaOH + Si + H 2 O = Na 2 SiO 3 + H 2
3KOH + P 4 + 3H 2 O = 3KH 2 PO 2 + PH 3
2KOH (冷) + Cl 2 = KClO + KCl + H 2 O
6KOH (熱) + 3Cl 2 = KClO 3 + 5KCl + 3H 2 O
6NaOH + 3S = 2Na2S + Na2SO3 + 3H2O
2NaNO 3 2NaNO 2 + O 2
NaHCO 3 + HNO 3 = NaNO 3 + CO 2 + H 2 O
NaI → Na + + I –
カソード: 2H 2 O + 2e → H 2 + 2OH – 1
アノード: 2I – – 2e → I 2 1
2H 2 O + 2I – ![]() H 2 + 2OH – + I 2
H 2 + 2OH – + I 2
2H2O + 2NaI ![]() H 2 + 2NaOH + I 2
H 2 + 2NaOH + I 2
2NaCl ![]() 2Na + Cl2
2Na + Cl2
カソードで アノードで
2Na 2 HPO 4 Na 4 P 2 O 7 + H 2 O
KNO 3 + 4Mg + 6H 2 O = NH 3 + 4Mg(OH) 2 + KOH
4KClO 3 KCl + 3KClO 4
2KClO3 ![]() 2KCl + 3O2
2KCl + 3O2
KClO 3 + 6HCl = KCl + 3Cl 2 + 3H 2 O
Na 2 SO 3 + S = Na 2 S 2 O 3
Na 2 S 2 O 3 + H 2 SO 4 = Na 2 SO 4 + S↓ + SO 2 + H 2 O
2NaI + Br2 = 2NaBr + I2
2NaBr + Cl 2 = 2NaCl + Br 2
私はグループです。
1. フラスコに注いだ苛性ソーダ溶液の表面に放電が流れると、フラスコ内の空気が茶色になり、しばらくすると消えます。 得られた溶液を注意深く蒸発させ、固体残留物が2つの塩の混合物であることが判明した。 この混合物を加熱するとガスが発生し、物質のみが残ります。 説明した反応の方程式を書きます。
2. 溶融塩化ナトリウムの電気分解中に陰極で放出された物質は酸素中で燃焼しました。 得られた生成物を、二酸化炭素で満たされたガスメーターに入れた。 得られた物質を塩化アンモニウム溶液に加え、溶液を加熱した。 説明した反応の方程式を書きます。
3)硝酸を重曹で中和し、中性溶液を注意深く蒸発させ、残留物を焼成した。 得られた物質を硫酸で酸性とした過マンガン酸カリウム溶液に添加すると、溶液は無色になった。 窒素含有反応生成物を水酸化ナトリウム溶液に入れ、亜鉛末を加えると、刺激臭のあるガスが放出された。 説明した反応の方程式を書きます。
4)不活性電極を用いたヨウ化ナトリウム溶液の電気分解中に陽極で得られた物質をカリウムと反応させた。 反応生成物を濃硫酸で加熱し、放出されたガスをクロム酸カリウムの熱溶液に通した。 説明されている反応の方程式を書きます
5)溶融塩化ナトリウムの電気分解中に陰極で得られた物質を酸素中で燃焼させた。 得られた生成物を二酸化硫黄および水酸化バリウム溶液で連続的に処理した。 説明されている反応の方程式を書きます
6) 白リンは水酸化カリウムの溶液に溶解し、ニンニクのような臭いを持つガスを放出し、空気中で自然発火します。 燃焼反応の固体生成物は、得られた白色物質が 1 個の水素原子を含むような比率で苛性ソーダと反応しました。 後者の物質が焼成されると、ピロリン酸ナトリウムが形成されます。 説明されている反応の方程式を書きます
7) 未知の金属が酸素中で燃焼した。 反応生成物は二酸化炭素と相互作用して 2 つの物質を形成します。塩酸溶液と反応して二酸化炭素を放出する固体と、燃焼を促進するガス状の単体物質です。 説明した反応の方程式を書きます。
8)大過剰の空気の存在下で、褐色ガスを過剰の苛性カリウム溶液に通した。 得られた溶液にマグネシウムの削りくずを加えて加熱すると、生じたガスが硝酸を中和しました。 得られた溶液を注意深く蒸発させ、固体の反応生成物を焼成した。 説明した反応の方程式を書きます。
9) いつ 熱分解二酸化マンガンの存在下で塩 A は二元塩 B と、燃焼を促進し空気の一部となるガスを形成します。 この塩を触媒なしで加熱すると、塩Bと高級酸素含有酸の塩が形成される。 塩Aが塩酸と反応すると黄緑色のガス(単体)が発生して塩Bが形成され、塩Bは炎を紫色に変え、硝酸銀溶液と反応すると白色の沈殿が生成します。 説明した反応の方程式を書きます。
10)銅の削りくずを加熱した濃硫酸に加え、放出されたガスを苛性ソーダ(過剰)の溶液に通した。 反応生成物を単離し、水に溶解し、硫黄とともに加熱し、反応の結果として硫黄が溶解した。 得られた溶液に希硫酸を加えた。 説明した反応の方程式を書きます。
11)食塩を濃硫酸で処理した。 得られた塩を水酸化ナトリウムで処理した。 得られた生成物を過剰の石炭で焼成した。 放出されたガスは触媒の存在下で塩素と反応しました。 説明した反応の方程式を書きます。
12) ナトリウムは水素と反応しました。 反応生成物を水に溶解すると、塩素と反応するガスが形成され、得られた溶液を加熱すると塩素と反応して2つの塩の混合物が形成された。 説明した反応の方程式を書きます。
13)ナトリウムを過剰酸素中で燃焼させ、得られた結晶物質をガラス管に入れ、二酸化炭素を通過させた。 管から出てくるガスを収集し、大気中でリンを燃焼させました。 得られた物質を過剰の水酸化ナトリウム溶液で中和した。 説明した反応の方程式を書きます。
14)過酸化ナトリウムと水とを反応させて得られた溶液に塩酸溶液を加え、反応が完了するまで加熱した。 得られた塩の溶液を不活性電極を用いて電気分解した。 アノードでの電気分解の結果として形成されたガスを、水酸化カルシウムの懸濁液に通した。 説明した反応の方程式を書きます。
15)中程度の塩が形成されるまで、二酸化硫黄を水酸化ナトリウム溶液に通した。 得られた溶液に過マンガン酸カリウム水溶液を加えた。 得られた沈殿を分離し、塩酸で処理した。 放出されたガスを水酸化カリウムの冷溶液に通した。 説明した反応の方程式を書きます。
16)酸化ケイ素(IV)と金属マグネシウムの混合物を焼成した。 反応の結果得られた単体を濃水酸化ナトリウム溶液で処理した。 放出されたガスを加熱したナトリウム上に通した。 得られた物質を水中に入れた。 説明した反応の方程式を書きます。
17)リチウムと窒素との反応生成物を水で処理した。 化学反応が停止するまで、得られたガスを硫酸溶液に通しました。 得られた溶液を塩化バリウム溶液で処理した。 溶液を濾過し、濾液を硝酸ナトリウム溶液と混合し、加熱した。 説明した反応の方程式を書きます。
18)ナトリウムを水素雰囲気中で加熱した。 得られた物質に水を加えると、ガスの発生と透明な溶液の形成が観察された。 この溶液に褐色のガスを通過させました。これは、銅と濃縮溶液の相互作用の結果として得られました。 硝酸。 説明した反応の方程式を書きます。
19)重炭酸ナトリウムを焼成した。 得られた塩を水に溶解し、アルミニウム溶液と混合すると、沈殿が形成され、無色のガスが放出されました。 沈殿物を過剰の硝酸溶液で処理し、ガスをケイ酸カリウムの溶液に通した。 説明した反応の方程式を書きます。
20) ナトリウムは硫黄と融合しました。 得られた化合物を塩酸で処理すると、放出されたガスは酸化硫黄(IV)と完全に反応した。 得られた物質を濃硝酸で処理した。 説明した反応の方程式を書きます。
21) ナトリウムは酸素が過剰になると燃焼します。 得られた物質を水で処理した。 得られた混合物を沸騰させ、その後、熱溶液に塩素を加えた。 説明した反応の方程式を書きます。
22)カリウムを窒素雰囲気中で加熱した。 得られた物質を過剰の塩酸で処理し、その後、得られた塩の混合物に水酸化カルシウムの懸濁液を加え、加熱した。 得られたガスを熱した酸化銅 (II) に通過させた。記載されている反応の方程式を書きなさい。
23)カリウムを塩素雰囲気中で燃焼させ、得られた塩を過剰の硝酸銀水溶液で処理した。 形成された沈殿を濾別し、濾液を蒸発させ、注意深く加熱した。 得られた塩を加工した 水溶液臭素 説明した反応の方程式を書きます。
24) リチウムは水素と反応した。 反応生成物を水に溶解すると、臭素と反応するガスが形成され、得られた溶液を加熱すると塩素と反応して2つの塩の混合物が形成された。 説明した反応の方程式を書きます。
25) ナトリウムは空気中で燃焼した。 得られた固体は二酸化炭素を吸収し、酸素と塩を放出します。 最後の塩を塩酸に溶解し、得られた溶液に硝酸銀の溶液を加えた。 白色の沈殿物が形成された。 説明した反応の方程式を書きます。
26) オゾン発生器内で酸素が放電にさらされた。 生じたガスをヨウ化カリウム水溶液に通すと、無色無臭の新しいガスが放出され、燃焼と呼吸が促進されました。 後者のガス雰囲気中でナトリウムが燃焼し、得られた固体が二酸化炭素と反応した。 説明した反応の方程式を書きます。
私はグループです。
1. N 2 + O 2 ![]() 2NO
2NO
2NO + O 2 = 2NO 2
2NO 2 + 2NaOH = NaNO 3 + NaNO 2 + H 2 O
2NaNO 3 2NaNO 2 + O 2
2. 2NaCl ![]() 2Na + Cl2
2Na + Cl2
カソードで アノードで
2Na + O 2 = Na 2 O 2
2Na 2 O 2 + 2CO 2 = 2Na 2 CO 3 + O 2
Na 2 CO 3 + 2NH 4 Cl = 2NaCl + CO 2 + 2NH 3 + H 2 O
3. NaHCO 3 + HNO 3 = NaNO 3 + CO 2 + H 2 O
2NaNO 3 2NaNO 2 + O 2
5NaNO 2 + 2KMnO 4 + 3H 2 SO 4 = 5NaNO 3 + 2MnSO 4 + K 2 SO 4 + 3H 2 O
NaNO 3 + 4Zn + 7NaOH + 6H 2 O = 4Na 2 + NH 3
4. 2H2O + 2NaI ![]() H 2 + 2NaOH + I 2
H 2 + 2NaOH + I 2
2K + I 2 = 2KI
8KI + 5H 2 SO 4 (濃) = 4K 2 SO 4 + H 2 S + 4I 2 + 4H 2 O
3H 2 S + 2K 2 CrO 4 + 2H 2 O = 2Cr(OH) 3 ↓ + 3S↓ + 4KOH
5. 2NaCl ![]() 2Na + Cl2
2Na + Cl2
カソードで アノードで
2Na + O 2 = Na 2 O 2
Na 2 O 2 + SO 2 = Na 2 SO 4
Na 2 SO 4 + Ba(OH) 2 = BaSO 4 ↓ + 2NaOH
6. P 4 + 3KOH + 3H 2 O = 3KH 2 PO 2 + PH 3
2PH3 + 4O2 = P2O5 + 3H2O
P 2 O 5 + 4NaOH = 2Na 2 HPO 4 + H 2 O


