14.08.2019
Sifat umum apa yang dimiliki unsur kimia logam? Logam sebagai unsur kimia
Sejak kecil kita dihadapkan pada ungkapan bahwa benda ini dan itu terbuat dari logam. Apa itu logam?
Logam adalah sekelompok unsur kimia tertentu (beserta paduannya) yang memiliki sifat-sifat yang sama pada seluruh kelompoknya, seperti peningkatan kekuatan, konduktivitas termal dan listrik yang baik, kelenturan, keuletan, dan kilau logam.
Hampir 80% dari semua unsur kimia yang diketahui (96 dari 118) adalah logam.
Sifat fisik logam
Semua logam, kecuali merkuri, berada dalam keadaan padat dalam kondisi normal. Dalam hal kekerasan, logam yang paling lunak adalah sesium (0,2 poin pada skala 10 poin Mohs). Yang paling sulit adalah tungsten. Kekerasannya adalah 6 poin. Kekerasan besi - 4 poin.
Titik leleh (transisi ke wujud cair) logam bervariasi: dari - 39º untuk merkuri hingga 3,410º untuk tungsten. Semua logam alkali memiliki titik leleh yang rendah, dan logam alkali yang umum termasuk timah dan timbal. Mereka dapat dicairkan bahkan di rumah dengan kompor gas. Kebanyakan logam dilebur dalam tungku khusus pada suhu tinggi.
Karena adanya elektron bergerak bebas dalam kisi kristal logam, semuanya menghantarkan listrik dan panas dengan sangat baik. Logam penghantar listrik terbaik adalah perak, tembaga dan aluminium. Bukan suatu kebetulan jika kabel listrik terbuat dari dua logam terakhir.
Kita juga sering menjumpai konduktivitas termal logam yang sangat baik dalam kehidupan sehari-hari. Untuk merebus air, tuangkan ke dalam panci logam dan letakkan di atas kompor. Elemen pemanas memanaskan logam, dan logam mentransfer hampir seluruh energi panas ke air.
Sifat kimia logam
Selama reaksi kimia, semua logam dengan mudah melepaskan elektronnya dan bertindak sebagai zat pereduksi.
Hampir semua logam dioksidasi oleh oksigen. Logam alkali (litium, kalsium) berinteraksi dengan oksigen dalam kondisi normal. Oksidasi logam lain oleh oksigen memerlukan suhu tinggi. Misalnya, jika Anda memanaskan kawat tembaga di atas api, tembaga akan bereaksi dengan oksigen dari udara dan menjadi tertutup lapisan hitam (tembaga oksida):
- 2Cu +O 2 → 2CuO
Emas dan platinum tidak bereaksi dengan oksigen.
Agen pengoksidasi lainnya termasuk klorin dan belerang yang bereaksi dengan logam. Jika Anda mencampur serbuk besi dan bubuk belerang dan memanaskan campuran tersebut, maka di depan mata kita Anda akan mendapatkan besi sulfida:
- Fe +S → FeS
Aktivitas reduksi logam yang berbeda berbeda-beda. Menurut aktivitasnya, logam terbagi sebagai berikut:
- Li - K - Ba - Sr - Ca - Na - Mg - Al - Mn - Zn - Cr - Fe - Ca - Co - Ni - Sn - Pb - (H2) - Cu - Hg - Ag - Pt - Au.
Semakin jauh ke kiri logam pada baris ini, semakin aktif logam tersebut. Elemen sebelumnya dapat menggeser logam yang terletak di sebelah kanan. Misalnya, jika sepotong besi dimasukkan ke dalam tabung reaksi dengan larutan tembaga sulfat, maka akan tertutup lapisan coklat (lapisan tembaga):
- Fe + CuSO4 → FeSO4 + Cu
Logam yang terletak di sebelah kiri hidrogen (H2) dapat menggantikannya dari asam klorida. Jika Anda memasukkan sepotong seng ke dalam asam klorida, hidrogen akan mulai dilepaskan:
- HCl + Zn → ZnCl2 + H2
Logam alkali mudah bereaksi dengan air. Jika Anda memasukkan sepotong natrium ke dalam wadah berisi air, hidrogen akan mulai berevolusi secara aktif dan basa akan terbentuk:
- 2Na + 2H2O → 2NaOH + H2
Penerapan logam
Terima kasih untuk Anda sifat-sifat yang bermanfaat logam telah dengan kuat memasuki kehidupan manusia. Manusia menggunakan kekuatan logam untuk membuat rangka bangunan (dari paviliun kecil hingga gedung pencakar langit besar), badan mesin (mobil, gerbong, kapal, peralatan mesin), serta bagian kerja berbagai perkakas.
Definisi
Berada di alam
Sifat-sifat logam
Sifat karakteristik logam
Properti fisik logam
Sifat kimia logam
Struktur mikroskopis
Logam alkali
Ciri-ciri umum logam alkali
Sifat kimia logam alkali
Persiapan logam alkali
Hidroksida
Karbonat
Rubidium
Logam alkali tanah
Kalsium
Strontium
Logam transisi
Ciri-ciri umum unsur transisi
Penerapan logam
Bahan bangunan
Bahan listrik
Bahan alat
Cerita
Pertambangan metalurgi
Logam adalah(namanya berasal dari bahasa Latin metallum - tambang) - sekelompok unsur dengan sifat logam yang khas, seperti konduktivitas termal dan listrik yang tinggi, koefisien resistansi suhu positif, keuletan tinggi, dll. Sekitar 70% dari semua unsur kimia termasuk dalam logam .
Logam adalah











![]()





















![]()


![]()





Berada di alam
Kebanyakan logam terdapat di alam dalam bentuk bijih dan senyawa. Mereka membentuk oksida, sulfida, karbonat dan senyawa kimia lainnya. Untuk memperoleh logam murni dan penggunaan lebih lanjut, logam tersebut perlu diisolasi dari bijihnya dan dimurnikan. Jika perlu, paduan dan pemrosesan logam lainnya dilakukan. Sains sedang mempelajari hal ini metalurgi. Metalurgi membedakan bijih logam besi (berdasarkan kelenjar) dan berwarna (tidak termasuk besi, total sekitar 70 elemen). , dan platinum juga merupakan logam mulia. Selain itu, mereka hadir dalam jumlah kecil di air laut, tumbuhan, organisme hidup (memainkan peran penting).
Diketahui bahwa tubuh manusia terdiri dari 3% logam. Sebagian besar sel kita mengandung kalsium dan natrium, terkonsentrasi di dalamnya sistem limfatik. Magnesium terakumulasi di otot dan sistem saraf, tembaga- di hati, - di dalam darah.
Sifat-sifat logam
Logam adalah
Sifat karakteristik logam
Kilau logam (kecuali yodium dan karbon dalam bentuk grafit. Meskipun berkilau logam, kristal yodium dan grafit bukanlah logam.)
Konduktivitas listrik yang baik (kecuali karbon.)
Kemungkinan pemesinan yang mudah.
Kepadatan tinggi (biasanya logam lebih berat daripada nonlogam.)
Titik leleh tinggi (pengecualian: merkuri, galium, dan logam alkali.)
Konduktivitas termal yang besar
Mereka selalu menjadi agen pereduksi dalam reaksi.
Sifat fisik logam
Semua logam (kecuali merkuri dan, secara kondisional,) berada dalam keadaan padat dalam kondisi normal, tetapi memiliki kekerasan yang berbeda. Jadi, logam alkali mudah dipotong dengan pisau dapur, dan logam seperti vanadium, tungsten, dan kromium dengan mudah menggores kaca yang paling keras. Di bawah ini adalah kekerasan beberapa logam pada skala Mohs.
Titik leleh berkisar antara −39 °C (merkuri) hingga 3410 °C (tungsten). Titik lebur sebagian besar logam (kecuali alkali) tinggi, tetapi beberapa logam "normal", misalnya alkali. timah Dan memimpin, bisa dicairkan di atas kompor listrik atau gas biasa.
Tergantung pada massa jenisnya, logam dibagi menjadi ringan (massa jenis 0,53 jam 5 g/cm³) dan berat (5 jam 22,5 g/cm³). Logam paling ringan adalah litium (massa jenis 0,53 g/cm³). Saat ini tidak mungkin untuk menyebutkan logam terberat, karena massa jenis osmium dan iridium - dua logam terberat - hampir sama (sekitar 22,6 g/cm3 - tepat dua kali massa jenisnya). memimpin), dan menghitung kepadatan pastinya sangatlah sulit: untuk melakukan ini, logam harus dimurnikan sepenuhnya, karena kotoran apa pun mengurangi kepadatannya.
Kebanyakan logam bersifat ulet, artinya kawat logam dapat ditekuk tanpa putus. Hal ini terjadi karena adanya perpindahan lapisan atom logam tanpa memutus ikatan antar atom. Yang paling fleksibel adalah emas, perak Dan tembaga. Dari emas dimungkinkan untuk menghasilkan foil setebal 0,003 mm, yang digunakan untuk menyepuh barang komersial. Namun, tidak semua logam bersifat ulet. Kawat dari seng atau timah berderak saat ditekuk; Ketika berubah bentuk, mangan dan bismut hampir tidak bengkok sama sekali, tetapi langsung patah. Plastisitas juga bergantung pada kemurnian logam; Jadi, kromium yang sangat murni sangat ulet, tetapi jika terkontaminasi dengan pengotor kecil sekalipun, kromium menjadi rapuh dan keras.
Semua logam menghantarkan listrik dengan baik; hal ini disebabkan oleh adanya elektron bergerak dalam kisi kristalnya yang bergerak di bawah pengaruh medan listrik. Perak, tembaga dan aluminium memiliki konduktivitas listrik tertinggi; Oleh karena itu, dua logam terakhir paling sering digunakan sebagai bahan kawat. Natrium juga mempunyai daya hantar listrik yang sangat tinggi; pada peralatan percobaan diketahui adanya percobaan yang menggunakan penghantar natrium berupa pipa berdinding tipis yang terbuat dari bahan kimia. dari baja tahan karat diisi dengan natrium. Karena berat jenis natrium yang rendah, dengan resistansi yang sama, “kabel” natrium jauh lebih ringan daripada tembaga dan bahkan lebih ringan dari aluminium.
Konduktivitas termal logam yang tinggi juga bergantung pada mobilitas elektron bebas. Oleh karena itu, rangkaian konduktivitas termal mirip dengan rangkaian konduktivitas listrik dan merupakan konduktor panas dan listrik terbaik. Natrium juga digunakan sebagai penghantar panas yang baik; Misalnya, telah diketahui secara luas bahwa natrium digunakan dalam katup mesin mobil untuk meningkatkan pendinginannya.
Permukaan logam yang halus memantulkan banyak cahaya - fenomena ini disebut kilau logam. Namun, jika berbentuk bubuk, sebagian besar logam kehilangan kilaunya; aluminium dan magnesium, namun tetap bersinar bahkan dalam bentuk bubuk. Perak dan perak memantulkan cahaya paling baik - cermin terbuat dari logam ini. Rhodium kadang-kadang digunakan untuk membuat cermin, meskipun harganya sangat mahal: karena kekerasan dan ketahanan kimianya yang jauh lebih besar dibandingkan perak atau bahkan paladium, lapisan rhodium bisa jauh lebih tipis daripada lapisan perak.
Warna sebagian besar logam kira-kira sama - abu-abu muda dengan semburat kebiruan. , tembaga dan cesium masing-masing berwarna kuning, merah dan kuning muda.
Sifat kimia logam
Logam adalah
Sebagian besar logam mempunyai sejumlah kecil elektron (1-3) pada lapisan elektron terluarnya, sehingga dalam sebagian besar reaksi, logam bertindak sebagai zat pereduksi (yaitu, mereka “menyumbangkan” elektronnya)
1. Reaksi dengan zat sederhana
Semua logam kecuali emas dan platinum bereaksi dengan oksigen. Reaksi dengan perak terjadi pada suhu tinggi, tetapi perak(II) oksida praktis tidak terbentuk karena tidak stabil secara termal. Tergantung pada logamnya, keluarannya mungkin termasuk oksida, peroksida, dan superoksida:
4Li + O2 = 2Li2O litium oksida
2Na + O2 = Na2O2 natrium peroksida
K + O2 = KO2 kalium superoksida
Untuk mendapatkan oksida dari peroksida, peroksida direduksi dengan logam:
Na2O2 + 2Na = 2Na2O
Dengan logam dengan aktivitas sedang dan rendah, reaksi terjadi ketika dipanaskan:
3Fe + 2O2 = Fe3O4
Hanya logam paling aktif yang bereaksi dengan nitrogen; pada suhu kamar hanya litium yang bereaksi, membentuk nitrida:
6Li + N2 = 2Li3N
Saat dipanaskan:
3Ca + N2 = Ca3N2
Semua logam bereaksi dengan belerang kecuali emas dan platinum:
Besi berinteraksi dengan abu-abu ketika dipanaskan, membentuk sulfida:
Hanya logam yang paling aktif, yaitu logam golongan IA dan IIA kecuali Be, yang bereaksi dengan hidrogen. Reaksi terjadi ketika dipanaskan, dan hidrida terbentuk. Dalam reaksi, logam bertindak sebagai zat pereduksi, bilangan oksidasi hidrogen adalah −1:
Hanya logam paling aktif yang bereaksi dengan karbon. Dalam hal ini, asetilenida atau metanida terbentuk. Ketika bereaksi dengan air, asetilida menghasilkan asetilena, metana menghasilkan metana.
2Na + 2C = Na2C2
Na2C2 + 2H2O = 2NaOH + C2H2
Paduan adalah pengenalan elemen tambahan ke dalam lelehan yang mengubah sifat mekanik, fisik dan Sifat kimia bahan utama.
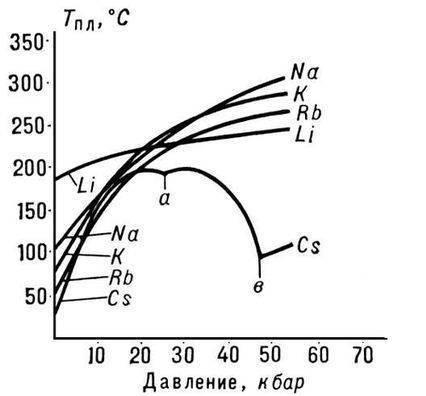
Struktur mikroskopis
Sifat-sifat khas logam dapat dipahami berdasarkan sifat-sifatnya struktur internal. Semuanya memiliki ikatan lemah antara elektron pada tingkat energi terluar (dengan kata lain, elektron valensi) dengan inti. Oleh karena itu, perbedaan potensial yang tercipta pada konduktor menyebabkan pergerakan elektron seperti longsoran (disebut elektron konduksi) dalam kisi kristal. Kumpulan elektron tersebut sering disebut gas elektron. Selain elektron, fonon (getaran kisi) berkontribusi terhadap konduktivitas termal. Plastisitas disebabkan oleh rendahnya penghalang energi terhadap pergerakan dislokasi dan pergeseran bidang kristalografi. Kekerasan dapat dijelaskan oleh banyaknya cacat struktural (atom interstisial, dll.).
Karena pelepasan elektron yang mudah, oksidasi logam dapat terjadi, yang dapat menyebabkan korosi dan penurunan sifat lebih lanjut. Kemampuan untuk mengoksidasi dapat dikenali dari rangkaian aktivitas standar logam. Fakta ini menegaskan perlunya penggunaan logam dalam kombinasi dengan unsur lain (paduan, yang paling penting adalah baja), paduannya dan penggunaan berbagai pelapis.
Untuk gambaran yang lebih tepat tentang sifat elektronik logam, perlu menggunakan mekanika kuantum. Dalam semua padatan dengan simetri yang cukup, tingkat energi elektron atom individu tumpang tindih dan membentuk pita yang diperbolehkan, dan pita yang dibentuk oleh elektron valensi disebut pita valensi. Lemahnya ikatan elektron valensi pada logam menyebabkan pita valensi pada logam sangat lebar, dan semua elektron valensi tidak cukup untuk mengisinya sepenuhnya.
Ciri mendasar dari zona yang terisi sebagian adalah bahwa bahkan pada tegangan minimum yang diberikan, penataan ulang elektron valensi dimulai dalam sampel, yaitu arus listrik mengalir.
Mobilitas elektron yang tinggi menyebabkan konduktivitas termal yang tinggi, serta kemampuan untuk memantulkan radiasi elektromagnetik secara spekuler (yang memberikan karakteristik kilau pada logam).
Logam alkali
Logam adalah
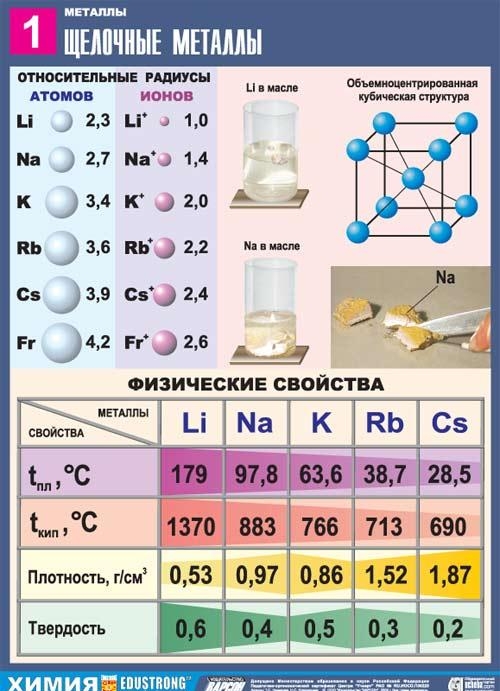
Logam alkali adalah unsur subkelompok utama golongan I Tabel Periodik Unsur Kimia DI Dmitry Ivanovich Mendeleev: litium Li, natrium Na, kalium K, rubidium Rb, cesium Cs, dan fransium Fr. Logam-logam ini disebut logam alkali karena sebagian besar senyawanya larut dalam air. Dalam bahasa Slavia, “leach” berarti “larut”, yang menentukan nama kelompok logam ini. Ketika logam alkali dilarutkan dalam air, hidroksida larut yang disebut basa akan terbentuk.
Ciri-ciri umum logam alkali
Dalam Tabel Periodik unsur-unsur tersebut langsung mengikuti gas mulia, sehingga kekhasan struktur atom logam alkali adalah bahwa unsur-unsur tersebut mengandung satu elektron pada tingkat energi baru: konfigurasi elektronnya ns1. Jelasnya, elektron valensi logam alkali dapat dengan mudah dihilangkan karena secara energetik menguntungkan bagi atom untuk melepaskan elektronnya dan memperoleh konfigurasi gas inert. Oleh karena itu, semua logam alkali mempunyai sifat pereduksi. Hal ini dibuktikan dengan rendahnya nilai potensial ionisasinya (potensi ionisasi atom cesium termasuk yang terendah) dan elektronegativitas (EO).
Semua logam dalam subkelompok ini berwarna putih keperakan (kecuali cesium kuning keperakan), sangat lunak, dan dapat dipotong dengan pisau bedah. Litium, natrium, dan kalium lebih ringan dari air dan mengapung di permukaannya, bereaksi dengannya.
Logam alkali terdapat di alam dalam bentuk senyawa yang mengandung kation bermuatan tunggal. Banyak mineral mengandung logam dari subkelompok utama kelompok I. Misalnya, ortoklas, atau feldspar, terdiri dari kalium aluminosilikat K2, sejenisnya mineral mengandung natrium - albit - memiliki komposisi Na2. Air laut mengandung natrium klorida NaCl, dan tanah mengandung garam kalium - sylvin KCl, sylvinite NaCl. KCl, karnalit KCl. MgCl2. 6H2O, polihalit K2SO4. MgSO4. CaSO4. 2H2O.
Sifat kimia logam alkali
Logam adalah
Karena tingginya aktivitas kimia logam alkali dalam kaitannya dengan air, oksigen, dan nitrogen, logam alkali disimpan di bawah lapisan minyak tanah. Untuk melakukan reaksi dengan logam alkali, sepotong dengan ukuran yang diinginkan dipotong dengan hati-hati di bawah lapisan dengan pisau bedah minyak tanah, dalam atmosfer argon, permukaan logam dibersihkan secara menyeluruh dari produk interaksinya dengan udara dan baru kemudian sampel ditempatkan dalam bejana reaksi.
1. Interaksi dengan air. Sifat penting logam alkali adalah aktivitasnya yang tinggi terhadap air. Litium bereaksi paling tenang (tanpa ledakan) dengan air.
Ketika reaksi serupa dilakukan, natrium terbakar dengan nyala kuning dan terjadi ledakan kecil. Kalium bahkan lebih aktif: dalam hal ini, ledakannya jauh lebih kuat, dan nyala api berwarna ungu.
2. Interaksi dengan oksigen. Hasil pembakaran logam alkali di udara mempunyai komposisi yang berbeda-beda tergantung aktivitas logamnya.
Hanya litium yang terbakar di udara untuk membentuk oksida dengan komposisi stoikiometri.
Ketika natrium terbakar, Na2O2 peroksida terutama terbentuk dengan sedikit campuran superoksida NaO2.
Produk pembakaran kalium, rubidium dan cesium sebagian besar mengandung superoksida.
Untuk mendapatkan natrium dan kalium oksida, campuran hidroksida, peroksida atau superoksida dengan logam berlebih dipanaskan tanpa adanya oksigen.
Pola berikut merupakan ciri senyawa oksigen logam alkali: dengan bertambahnya jari-jari kation logam alkali, stabilitas senyawa oksigen yang mengandung ion peroksida O22 dan ion superoksida O2- meningkat.
Logam alkali berat dicirikan oleh terbentuknya ozonida yang cukup stabil dengan komposisi EO3. Semua senyawa oksigen memiliki warna berbeda, yang intensitasnya semakin dalam dalam rangkaian dari Li hingga Cs.
Oksida logam alkali memiliki semua sifat oksida basa: bereaksi dengan air, oksida asam, dan asam.
Peroksida dan superoksida menunjukkan sifat-sifat zat pengoksidasi kuat.
Peroksida dan superoksida berinteraksi secara intensif dengan air, membentuk hidroksida.
3. Interaksi dengan zat lain. Logam alkali bereaksi dengan banyak nonlogam. Ketika dipanaskan, mereka bergabung dengan hidrogen untuk membentuk hidrida, halogen, abu-abu, nitrogen, fosfor, karbon dan silikon masing-masing membentuk halida, sulfida, nitrida, fosfida, karbida, dan silisida.
Ketika dipanaskan, logam alkali mampu bereaksi dengan logam lain membentuk senyawa intermetalik. Logam alkali bereaksi secara aktif (eksplosif) dengan asam.
Logam alkali larut dalam amonia cair dan turunannya - amina dan Amida.
Ketika dilarutkan dalam amonia cair logam alkali kehilangan elektron, yang dilarutkan oleh molekul amonia dan memberi larutan warna biru. Amida yang dihasilkan mudah terurai oleh air membentuk alkali dan amonia.
Logam alkali berinteraksi dengan zat organik, alkohol (membentuk alkoholat) dan asam karboksilat (membentuk garam).
4. Penentuan kualitatif logam alkali. Karena potensi ionisasi logam alkali kecil, ketika logam atau senyawanya dipanaskan dalam nyala api, atomnya terionisasi, sehingga mewarnai nyala api dengan warna tertentu.
Persiapan logam alkali
1. Untuk memperoleh logam alkali, mereka terutama menggunakan elektrolisis lelehan halidanya, paling sering klorida, yang membentuk alami mineral:
katoda: Li+ + e → Li
anoda: 2Cl- — 2e → Cl2
2. Kadang-kadang, untuk memperoleh logam alkali, elektrolisis lelehan hidroksidanya dilakukan:
katoda: Na+ + e → Na
anoda: 4OH- – 4e → 2H2O + O2
Karena logam alkali terletak di sebelah kiri hidrogen dalam rangkaian tegangan elektrokimia, pembuatan elektrolitiknya dari larutan garam tidak mungkin dilakukan; dalam hal ini, basa dan hidrogen yang sesuai terbentuk.
Hidroksida
Untuk memperoleh hidroksida logam alkali, metode elektrolitik terutama digunakan. Produksi skala paling besar adalah produksi natrium hidroksida dengan elektrolisis larutan garam meja dalam air pekat.
Sebelumnya, alkali diperoleh melalui reaksi pertukaran.
Alkali yang diperoleh dengan cara ini sangat terkontaminasi dengan soda Na2CO3.
Hidroksida logam alkali adalah zat higroskopis berwarna putih, larutan berairnya merupakan basa kuat. Mereka berpartisipasi dalam semua reaksi khas basa - mereka bereaksi dengan asam, oksida asam dan amfoter, dan hidroksida amfoter.
Ketika dipanaskan, hidroksida logam alkali menyublim tanpa dekomposisi, kecuali litium hidroksida, yang, seperti hidroksida logam dari subkelompok utama kelompok II, terurai menjadi oksida dan air ketika dikalsinasi.
Natrium hidroksida digunakan untuk membuat sabun, deterjen sintetis, serat buatan, dan senyawa organik seperti fenol.
Karbonat
Produk penting yang mengandung logam alkali adalah soda Na2CO3. Sebagian besar soda di seluruh dunia diproduksi menggunakan metode Solvay, yang diusulkan pada awal abad ke-20. Inti dari metode ini adalah sebagai berikut: larutan NaCl berair, yang ditambahkan amonia, dijenuhkan dengan karbon dioksida pada suhu 26 - 30 °C. Ini menghasilkan natrium bikarbonat yang sedikit larut, yang disebut soda kue.
Amonia ditambahkan untuk menetralkan lingkungan asam yang terjadi ketika karbon dioksida dimasukkan ke dalam larutan dan untuk menghasilkan ion bikarbonat HCO3- yang diperlukan untuk pengendapan natrium bikarbonat. Setelah soda kue dipisahkan, larutan yang mengandung amonium klorida dipanaskan dengan kapur dan amonia dilepaskan, yang dikembalikan ke zona reaksi.
Jadi, dengan metode amonia dalam memproduksi soda, satu-satunya limbah adalah kalsium klorida, yang tetap berada dalam larutan dan penggunaannya terbatas.
Ketika natrium bikarbonat dikalsinasi, menghasilkan soda abu, atau soda cuci, Na2CO3, dan karbon dioksida, yang digunakan dalam proses produksi natrium bikarbonat.
Pembeli utama soda adalah gelas.
Berbeda dengan garam asam NaHCO3 yang sedikit larut, kalium bikarbonat KHCO3 sangat larut dalam air, oleh karena itu kalium karbonat, atau kalium, K2CO3 diperoleh melalui aksi karbon dioksida pada larutan kalium hidroksida.
Kalium digunakan dalam produksi kaca dan sabun cair.
Litium adalah satu-satunya logam alkali yang bikarbonatnya belum diperoleh. Alasan fenomena ini adalah radius ion litium yang sangat kecil, sehingga tidak memungkinkannya menahan ion HCO3- yang cukup besar.
Litium
Logam adalah
Litium adalah suatu unsur dari subkelompok utama golongan pertama, periode kedua dari tabel periodik unsur kimia D.I. Mendeleev Dmitry Ivanovich, dengan nomor atom 3. Dilambangkan dengan simbol Li (lat. Lithium). Unsur unsur litium (nomor CAS: 7439-93-2) merupakan logam alkali lunak dengan warna putih keperakan.
Litium ditemukan pada tahun 1817 oleh ahli kimia dan mineralogi Swedia A. Arfvedson, pertama dalam mineral petalit (Li,Na), kemudian dalam spodumene LiAl dan dalam lepidolit KLi1.5Al1.5(F,OH)2. Logam litium pertama kali ditemukan oleh Humphry Davy pada tahun 1825.
Litium mendapatkan namanya karena ditemukan di "batu" (Yunani λίθος - batu). Awalnya disebut "lithion", nama modern disarankan oleh Berzelius.
Litium adalah logam berwarna putih keperakan, lunak dan ulet, lebih keras dari natrium tetapi lebih lunak dari timbal. Dapat diolah dengan cara ditekan dan digulung.
Pada suhu kamar, logam litium memiliki kisi kubik berpusat pada benda (bilangan koordinasi 8), yang setelah pemrosesan dingin berubah menjadi kisi kubik padat, di mana setiap atom yang memiliki koordinasi kuboktahedral ganda dikelilingi oleh 12 atom lainnya. Di bawah 78 K, bentuk kristal stabil adalah struktur padat heksagonal di mana setiap atom litium memiliki 12 tetangga terdekat yang terletak di simpul kuboctahedron.
Dari semua logam alkali, litium memiliki titik leleh dan titik didih tertinggi (masing-masing 180,54 dan 1340 °C), dan memiliki massa jenis terendah pada suhu kamar dibandingkan semua logam (0,533 g/cm3, hampir setengah massa jenis air).
Ukuran kecil atom litium menyebabkan munculnya sifat khusus logam. Misalnya, ia bercampur dengan natrium hanya pada suhu di bawah 380 ° C dan tidak bercampur dengan lelehan kalium, rubidium, dan cesium, sedangkan pasangan logam alkali lainnya bercampur satu sama lain dalam perbandingan berapa pun.
Logam alkali, tidak stabil di udara. Litium adalah logam alkali yang paling tidak aktif, praktis tidak bereaksi dengan udara kering (dan bahkan oksigen kering) pada suhu kamar.
Di udara lembab ia teroksidasi perlahan, berubah menjadi Li3N nitrida, LiOH hidroksida, dan Li2CO3 karbonat. Ketika dipanaskan dalam oksigen, ia terbakar, berubah menjadi oksida Li2O. Ada fitur menarik bahwa dalam kisaran suhu dari 100 °C hingga 300 °C, litium ditutupi dengan lapisan oksida padat dan tidak teroksidasi lebih lanjut.
Pada tahun 1818, ahli kimia Jerman Leopold Gmelin menemukan bahwa litium dan garamnya mewarnai nyala api menjadi merah tua, yang merupakan tanda kualitatif untuk penentuan litium. Suhu pembakaran sekitar 300 °C. Produk pembakaran mengiritasi selaput lendir nasofaring.
Bereaksi dengan tenang, tanpa ledakan atau api, dengan air, membentuk LiOH dan H2. Ia juga bereaksi dengan etil alkohol, membentuk alkoholat, dengan amonia dan halogen (dengan yodium - hanya jika dipanaskan).
Litium disimpan dalam petroleum eter, parafin, bensin dan/atau minyak mineral dalam kotak timah yang tertutup rapat. Logam litium menyebabkan luka bakar jika terkena kulit, selaput lendir, dan mata.
Dalam metalurgi besi dan non-besi, litium digunakan untuk mendeoksidasi dan meningkatkan keuletan dan kekuatan paduan. Litium terkadang digunakan untuk memulihkan logam langka menggunakan metode metalotermi.
Litium karbonat merupakan bahan pembantu terpenting (ditambahkan ke elektrolit) dalam peleburan aluminium dan konsumsinya meningkat setiap tahun sebanding dengan volume produksi aluminium global (konsumsi litium karbonat adalah 2,5-3,5 kg per ton aluminium peleburan).
Paduan litium dengan perak dan emas, serta tembaga, merupakan solder yang sangat efektif. Paduan litium dengan magnesium, skandium, tembaga, kadmium, dan aluminium merupakan material baru yang menjanjikan dalam penerbangan dan astronotika. Berdasarkan litium aluminat dan silikat, telah dibuat keramik yang mengeras pada suhu kamar dan digunakan dalam teknologi militer, metalurgi, dan, di masa depan, dalam energi termonuklir. Kaca yang terbuat dari litium aluminium silikat, diperkuat dengan serat silikon karbida, memiliki kekuatan yang sangat besar. Litium sangat efektif dalam memperkuat paduan timbal dan memberikan keuletan serta ketahanan terhadap korosi.
Garam litium memiliki efek psikotropika dan digunakan dalam pengobatan untuk pencegahan dan pengobatan sejumlah penyakit mental. Jenis bahan yang paling umum adalah litium karbonat. digunakan dalam psikiatri untuk menstabilkan suasana hati orang yang menderita gangguan bipolar dan seringnya perubahan suasana hati. Ini efektif dalam mencegah manik depresi dan mengurangi bunuh diri.Dokter telah berulang kali mengamati bahwa senyawa litium tertentu (tentu saja dalam dosis yang tepat) memiliki efek positif pada pasien yang menderita manik depresi. Efek ini dapat dijelaskan dalam dua cara. Di satu sisi, litium mampu mengatur aktivitas enzim tertentu yang terlibat dalam transfer ion natrium dan kalium dari cairan antar sel ke sel otak. Di sisi lain, ion litium telah diketahui secara langsung mempengaruhi keseimbangan ion sel. Dan kondisi pasien sangat bergantung pada keseimbangan natrium dan kalium: kelebihan natrium dalam sel merupakan ciri khas pasien depresi, kekurangan - bagi mereka yang menderita mania. Dengan menyamakan keseimbangan natrium-kalium, garam litium memiliki efek positif pada keduanya.
Sodium
Logam adalah
Natrium adalah unsur dari subkelompok utama dari kelompok pertama, kelompok ketiga periode tabel periodik unsur kimia D.I. Dmitry Ivanovich Mendeleev, dengan nomor atom 11. Dilambangkan dengan simbol Na (lat. Natrium). Zat sederhana natrium (nomor CAS: 7440-23-5) merupakan logam alkali lunak dengan warna putih keperakan.
Dalam air, natrium berperilaku hampir sama dengan litium: reaksi berlangsung dengan pelepasan hidrogen yang cepat, dan natrium hidroksida terbentuk dalam larutan.
Natrium (atau lebih tepatnya, senyawanya) telah digunakan sejak zaman kuno. Misalnya soda (natron), yang ditemukan secara alami di perairan danau soda di Mesir. Orang Mesir kuno menggunakan soda alami untuk pembalseman, memutihkan kanvas, memasak makanan, dan membuat cat dan glasir. Pliny the Elder menulis bahwa di Delta Nil, soda (mengandung cukup banyak kotoran) diisolasi dari air sungai. Dijual dalam bentuk potongan besar, berwarna abu-abu atau bahkan hitam karena adanya campuran batu bara.
Natrium pertama kali diperoleh oleh ahli kimia Inggris Humphry Davy pada tahun 1807 dengan elektrolisis NaOH padat.
Nama "natrium" (natrium) berasal dari bahasa Arab natrun (dalam bahasa Yunani - nitron) dan aslinya mengacu pada soda alami. Unsur itu sendiri sebelumnya disebut natrium (lat. Natrium).

Natrium adalah logam berwarna putih keperakan, berlapis tipis dengan warna ungu, plastik, bahkan lunak (mudah dipotong dengan pisau), potongan natrium segar mengkilat. Nilai daya hantar listrik dan daya hantar panas natrium cukup tinggi, massa jenis 0,96842 g/cm3 (pada 19,7°C), titik leleh 97,86°C, titik didih 883,15°C.
Logam alkali yang mudah teroksidasi di udara. Untuk melindungi dari oksigen atmosfer, natrium logam disimpan di bawah lapisan minyak tanah. Natrium kurang aktif dibandingkan litium, oleh karena itu ia bereaksi dengan nitrogen hanya jika dipanaskan:
Ketika ada kelebihan oksigen dalam jumlah besar, natrium peroksida akan terbentuk
2Na + O2 = Na2O2
Logam natrium banyak digunakan dalam kimia preparatif dan industri sebagai agen pereduksi kuat, termasuk dalam metalurgi. Natrium digunakan dalam produksi baterai natrium-sulfur yang sangat boros energi. Ini juga digunakan pada katup buang truk sebagai heat sink. Kadang-kadang, logam natrium digunakan sebagai bahan kabel listrik yang dimaksudkan untuk mengalirkan arus yang sangat tinggi.
Dalam paduan dengan kalium, serta rubidium dan cesium, digunakan sebagai pendingin yang sangat efisien. Secara khusus, paduan komposisi natrium 12%, kalium 47%, cesium 41% memiliki rekor titik leleh rendah yaitu −78 °C dan diusulkan sebagai fluida kerja untuk mesin roket ion dan pendingin untuk pembangkit listrik tenaga nuklir.
Natrium juga digunakan pada lampu pelepasan gas tinggi dan tinggi. tekanan rendah(NLVD dan NLND). Lampu NLVD jenis DNaT (Arc Sodium Tubular) sangat banyak digunakan pada penerangan jalan raya. Mereka mengeluarkan cahaya kuning terang. Masa pakai lampu HPS 12-24 ribu jam. Oleh karena itu, lampu pelepasan gas tipe HPS sangat diperlukan untuk penerangan perkotaan, arsitektur, dan industri. Ada juga lampu DNaS, DNaMT (Arc Sodium Matte), DNaZ (Arc Sodium Mirror) dan DNaTBR (Arc Sodium Tubular Without Mercury).
Logam natrium digunakan dalam analisis kualitatif bahan organik. Paduan natrium dan zat uji dinetralkan dengan etanol, ditambahkan beberapa mililiter air suling dan dibagi menjadi 3 bagian, J. Lassenya (1843), bertujuan untuk menentukan nitrogen, belerang dan halogen ( mencoba Beilstein)
Natrium klorida (garam meja) adalah penyedap dan pengawet tertua yang digunakan.
Natrium azida (Na3N) digunakan sebagai zat nitridasi dalam metalurgi dan produksi timbal azida.
Natrium sianida (NaCN) digunakan dalam metode hidrometalurgi untuk pelindian emas dari batuan, serta dalam nitrokarburisasi baja dan pelapisan listrik (perak, penyepuhan).
Natrium klorat (NaClO3) digunakan untuk menghancurkan vegetasi yang tidak diinginkan di rel kereta api.
Kalium
Kalium merupakan unsur subkelompok utama dari kelompok pertama, kelompok keempat periode sistem periodik unsur kimia oleh D.I.Mendeleev Dmitry Ivanovich, dengan nomor atom 19. Dilambangkan dengan simbol K (lat. Kalium). Zat sederhana kalium (nomor CAS: 7440-09-7) merupakan logam alkali lunak dengan warna putih keperakan.
Di alam, kalium hanya ditemukan dalam kombinasi dengan unsur lain, misalnya pada air laut, dan juga pada banyak mineral. Ia teroksidasi dengan sangat cepat di udara dan sangat mudah masuk ke dalam reaksi kimia, terutama dengan air, membentuk alkali. Dalam banyak hal, sifat kimia kalium sangat mirip dengan natrium, tetapi dalam hal fungsi biologis dan cara penggunaannya oleh sel-sel organisme hidup, masih berbeda-beda.
Kalium (lebih tepatnya senyawanya) telah digunakan sejak zaman kuno. Dengan demikian, produksi kalium (yang digunakan sebagai deterjen) sudah ada pada abad ke-11. Abu yang terbentuk dari pembakaran jerami atau kayu diolah dengan air, dan larutan yang dihasilkan (alkali) diuapkan setelah disaring. Residu kering, selain kalium karbonat, mengandung kalium sulfat K2SO4, soda dan kalium klorida KCl.
Pada tahun 1807, ahli kimia Inggris Davy mengisolasi kalium melalui elektrolisis kalium hidroksida padat (KOH) dan menamakannya “kalium” (kalium Latin; nama ini masih digunakan dalam bahasa Inggris, Prancis, Spanyol, Portugis, dan Polandia). Pada tahun 1809, L. V. Gilbert mengusulkan nama “kalium” (Latin kalium, dari bahasa Arab al-kali - kalium). Nama ini termasuk di dalamnya Jerman, dari sana ke sebagian besar bahasa di Eropa Utara dan Timur (termasuk Rusia) dan “menang” ketika memilih simbol untuk elemen ini - K.
Kalium merupakan zat berwarna keperakan dengan ciri khas mengkilat pada permukaan yang baru terbentuk. Sangat ringan dan dapat melebur. Ini larut dengan baik dalam merkuri, membentuk amalgam. Ketika kalium (serta senyawanya) ditambahkan ke nyala api pembakar, ia mewarnai nyala api dengan warna merah jambu-ungu yang khas.
Kalium, seperti logam alkali lainnya, menunjukkan sifat logam yang khas dan sangat aktif secara kimia, sehingga mudah menyumbangkan elektron.
Merupakan agen pereduksi kuat. Ia bergabung begitu aktif dengan oksigen sehingga bukan oksida yang terbentuk, tetapi kalium superoksida KO2 (atau K2O4). Ketika dipanaskan dalam atmosfer hidrogen, kalium hidrida KH terbentuk. Ia berinteraksi dengan baik dengan semua non-logam, membentuk halida, sulfida, nitrida, fosfida, dll., serta dengan zat kompleks seperti air (reaksi terjadi secara eksplosif), berbagai oksida dan garam. Dalam hal ini, mereka mereduksi logam lain ke keadaan bebas.
Kalium disimpan di bawah lapisan minyak tanah.
Paduan kalium dan natrium, cair pada suhu kamar, digunakan sebagai pendingin dalam sistem tertutup, misalnya di pembangkit listrik tenaga nuklir neutron cepat. Selain itu, paduan cairnya dengan rubidium dan cesium banyak digunakan. Paduan komposisi natrium 12%, kalium 47%, sesium 41% memiliki rekor titik leleh rendah yaitu −78 °C.
Senyawa kalium merupakan unsur biogenik terpenting dan oleh karena itu digunakan sebagai pupuk.
Garam kalium banyak digunakan dalam pelapisan listrik karena, meskipun biayanya relatif tinggi, garam tersebut seringkali lebih larut daripada garam natrium, dan oleh karena itu memberikan kerja elektrolit yang intensif pada kepadatan arus yang meningkat.
Kalium merupakan unsur biogenik terpenting, terutama di dunia tumbuhan. Dengan kekurangan kalium di dalam tanah, tanaman berkembang sangat buruk dan berkurang, itulah sebabnya sekitar 90% garam kalium yang ditambang digunakan sebagai pupuk.
Kalium, bersama dengan nitrogen dan fosfor, merupakan nutrisi utama tanaman. Fungsi kalium pada tanaman, seperti unsur-unsur lain yang diperlukannya, sangat spesifik. Pada tumbuhan, kalium berbentuk ionik. Kalium ditemukan terutama di sitoplasma dan vakuola sel. Sekitar 80% kalium ditemukan dalam getah sel.
Fungsi kalium sangat beragam. Telah ditetapkan bahwa ini merangsang jalannya fotosintesis normal, meningkatkan aliran karbohidrat dari helaian daun ke organ lain, serta sintesis gula.
Kalium meningkatkan akumulasi monosakarida pada tanaman buah-buahan dan sayuran, meningkatkan kandungan gula pada umbi-umbian, pati pada kentang, mengentalkan dinding sel jerami tanaman serealia dan meningkatkan ketahanan roti terhadap rebah, serta meningkatkan kualitas serat pada tanaman. rami dan rami.
Dengan mendorong akumulasi karbohidrat dalam sel tumbuhan, kalium meningkatkan tekanan osmotik getah sel dan dengan demikian meningkatkan ketahanan tanaman terhadap dingin dan beku.
Kalium diserap oleh tanaman dalam bentuk kation dan, tentu saja, tetap dalam bentuk ini di dalam sel, mengaktifkan biokimia yang paling penting. proses dalam sel tumbuhan, kalium meningkatkan ketahanannya terhadap berbagai penyakit, baik selama musim tanam maupun pasca panen, secara signifikan meningkatkan kualitas penyimpanan buah dan sayuran.
Kekurangan kalium banyak menyebabkan gangguan metabolisme pada tanaman, aktivitas sejumlah enzim melemah, metabolisme karbohidrat dan protein terganggu, dan biaya karbohidrat untuk bernafas. Akibatnya produktivitas tanaman menurun dan kualitas produk menurun.



Rubidium
Rubidium adalah unsur dari subkelompok utama golongan pertama, periode kelima tabel periodik unsur kimia DI Dmitry Ivanovich Mendeleev, dengan nomor atom 37. Dilambangkan dengan simbol Rb (lat. Rubidium). Bahan sederhana rubidium (nomor CAS: 7440-17-7) merupakan logam alkali lunak dengan warna putih keperakan.
Pada tahun 1861, ilmuwan Jerman Robert Wilhelm Bunsen dan Gustav Robert Kirchhoff, mempelajari aluminosilikat alami menggunakan analisis spektral, menemukan unsur baru di dalamnya, yang kemudian diberi nama rubidium berdasarkan warna garis terkuat dalam spektrum.
Rubidium membentuk kristal lembut berwarna putih keperakan yang memiliki kilau metalik saat baru dipotong. Kekerasan Brinell 0,2 MN/mI (0,02 kgf/mmI). Kisi kristal Rubidium berpusat pada benda kubik, a = 5,71 E (pada suhu kamar). Jari-jari atom 2,48 E, jari-jari ion Rb+ 1,49 E. Massa jenis 1,525 g/cm (0 °C), titik leleh 38,9 °C, titik didih 703 °C. Kapasitas panas spesifik 335,2 J/(kg K), koefisien termal ekspansi linier 9,0·10-5 derajat-1 (0-38 °C), modulus elastisitas 2,4 H/mІ (240 kgf/mmI), resistivitas listrik volume spesifik 11,29 ·10-6 ohm·cm (20 °C); Rubidium bersifat paramagnetik.
Logam alkali, sangat tidak stabil di udara (bereaksi dengan udara dengan adanya jejak air dengan penyalaan). Membentuk semua jenis garam - sebagian besar mudah larut (klorat dan perklorat sedikit larut). Rubidium hidroksida adalah zat yang sangat agresif terhadap kaca dan bahan struktural serta wadah lainnya, dan ketika dicairkan akan menghancurkan sebagian besar logam (bahkan platinum).
Penggunaan rubidium beragam dan, meskipun dalam beberapa bidang penerapannya, rubidium memiliki karakteristik fisik yang lebih rendah daripada cesium, namun logam alkali langka ini memainkan peran penting dalam teknologi modern. Bidang penerapan rubidium berikut dapat diperhatikan: katalisis, elektronik industri, optik khusus, nuklir, kedokteran.
Rubidium digunakan tidak hanya dalam bentuk murni, tetapi juga dalam bentuk sejumlah paduan dan senyawa kimia. Penting untuk dicatat bahwa rubidium memiliki basis bahan mentah yang sangat baik dan menguntungkan, namun pada saat yang sama situasi ketersediaan sumber daya jauh lebih menguntungkan dibandingkan dengan kasus cesium dan rubidium yang dapat menempati peran yang lebih penting, misalnya, dalam katalisis (yang telah berhasil membuktikan dirinya).
Isotop rubidium-86 banyak digunakan dalam deteksi cacat gamma, teknologi pengukuran, serta dalam sterilisasi sejumlah obat-obatan penting dan produk makanan. Rubidium dan paduannya dengan cesium merupakan media pendingin dan kerja yang sangat menjanjikan untuk unit turbin suhu tinggi (dalam hal ini, rubidium dan cesium telah menjadi penting dalam beberapa tahun terakhir, dan harga logam yang sangat mahal menggantikan kemungkinan tersebut. secara dramatis meningkatkan efisiensi unit turbin, dan karenanya mengurangi pengeluaran bahan bakar dan pencemaran lingkungan). Sistem berbasis rubidium yang paling banyak digunakan sebagai pendingin adalah paduan terner: natrium-kalium-rubidium, dan natrium-rubidium-cesium.
Dalam katalisis, rubidium digunakan dalam sintesis organik dan anorganik. Aktivitas katalitik rubidium digunakan terutama untuk penyulingan minyak bumi menjadi sejumlah produk penting. Rubidium asetat, misalnya, digunakan untuk sintesis metanol dan sejumlah alkohol tinggi dari gas air, yang pada gilirannya sangat penting dalam kaitannya dengan gasifikasi batubara bawah tanah dan produksi bahan bakar cair buatan untuk mobil dan bahan bakar jet. Sejumlah paduan rubidium dengan telurium memiliki sensitivitas yang lebih tinggi pada wilayah spektrum ultraviolet dibandingkan senyawa cesium, sehingga dalam hal ini dapat bersaing dengan cesium-133 sebagai bahan fotokonverter. Sebagai bagian dari komposisi pelumas khusus (paduan), rubidium digunakan sebagai pelumas yang sangat efektif dalam ruang hampa (teknologi roket dan luar angkasa).
Rubidium hidroksida digunakan untuk menyiapkan elektrolit untuk reaktor kimia suhu rendah, dan juga sebagai bahan tambahan pada larutan kalium hidroksida untuk meningkatkan kinerjanya pada suhu rendah dan meningkatkan konduktivitas listrik elektrolit. Logam rubidium digunakan dalam sel bahan bakar hidrida.
Paduan rubidium klorida dengan tembaga klorida digunakan untuk mengukur suhu tinggi (hingga 400 °C).
Plasma rubidium digunakan untuk merangsang radiasi laser.
Rubidium klorida digunakan dalam sel bahan bakar sebagai elektrolit, dan hal yang sama berlaku untuk rubidium hidroksida, yang sangat efektif sebagai elektrolit dalam sel bahan bakar menggunakan oksidasi langsung batubara.
sesium
Cesium adalah unsur subkelompok utama golongan pertama, periode keenam sistem periodik unsur kimia oleh DI Mendeleev Dmitry Ivanovich, dengan nomor atom 55. Dilambangkan dengan simbol Cs (lat. Caesium). Zat sederhana cesium (nomor CAS: 7440-46-2) adalah logam alkali lunak berwarna kuning keperakan. Cesium mendapatkan namanya karena adanya dua garis biru terang dalam spektrum emisi (dari bahasa Latin caesius - biru langit).
Cesium ditemukan pada tahun 1860 oleh ilmuwan Jerman R.W. Bunsen dan G.R. Kirchhoff di perairan mata air mineral Durchheim di Republik Jerman menggunakan spektroskopi optik, sehingga menjadi unsur pertama yang ditemukan menggunakan analisis spektral. Cesium pertama kali diisolasi dalam bentuk murni pada tahun 1882 oleh ahli kimia Swedia K. Setterberg selama elektrolisis campuran cair cesium sianida (CsCN) dan barium.
Mineral cesium utama adalah pollucite dan avogadrite (K,Cs) yang sangat langka. Selain itu, dalam bentuk pengotor, cesium termasuk dalam sejumlah aluminosilikat: lepidolite, phlogopite, biotite, amazonite, petalite, beryl, zinnwaldite, leucite, carnallite. Pollucite dan lepidolite digunakan sebagai bahan baku industri.
Dalam produksi industri, cesium dalam bentuk senyawa diekstraksi dari mineral pollucite. Hal ini dilakukan dengan pembukaan klorida atau sulfat. Yang pertama melibatkan pengolahan mineral sumber dengan asam klorida yang dipanaskan, menambahkan antimon klorida SbCl3 untuk mengendapkan senyawa Cs3, dan mencuci dengan air panas atau larutan amonia untuk membentuk sesium klorida CsCl. Dalam kasus kedua, ia diolah dengan asam sulfat yang dipanaskan untuk membentuk cesium tawas CsAl(SO4)2 · 12H2O.
DI DALAM Federasi Rusia Setelah runtuhnya Uni Soviet, penambangan industri polusi tidak dilakukan, meskipun cadangan mineral yang sangat besar ditemukan di tundra Voronya dekat Murmansk pada masa Soviet. Pada saat industri Rusia mampu bangkit kembali, ternyata perusahaan asal Kanada tersebut telah membeli izin untuk mengembangkan bidang ini. Saat ini, pemrosesan dan ekstraksi garam cesium dari pollucite dilakukan di Novosibirsk di Pabrik Logam Langka ZAO.
Ada beberapa metode laboratorium memperoleh sesium. Itu bisa diperoleh:
pemanasan dalam ruang hampa campuran cesium kromat atau dikromat dengan zirkonium;
penguraian cesium azida dalam ruang hampa;
memanaskan campuran cesium klorida dan kalsium yang disiapkan khusus.
Semua metode bersifat padat karya. Yang kedua memungkinkan Anda memperoleh logam dengan kemurnian tinggi, tetapi bersifat eksplosif dan memerlukan beberapa hari untuk implementasinya.
Cesium baru diterapkan pada awal abad ke-20, ketika mineralnya ditemukan dan teknologi untuk memperolehnya dalam bentuk murni dikembangkan. Saat ini, cesium dan senyawanya digunakan dalam bidang elektronik, radio, kelistrikan, teknik sinar-X, industri kimia, optik, kedokteran, dan energi nuklir. Sebagian besar cesium-133 alami yang stabil digunakan, dan sampai batas tertentu isotop radioaktif cesium-137, diisolasi dari jumlah fragmen fisi uranium, plutonium, dan torium dalam reaktor pembangkit listrik tenaga nuklir.
Logam alkali tanah
Logam alkali tanah - unsur kimia: kalsium Ca, strontium Sr, barium Ba, radium Ra (terkadang berilium Be dan magnesium Mg juga secara keliru diklasifikasikan sebagai logam alkali tanah). Dinamakan demikian karena oksidanya - "bumi" (dalam terminologi alkemis) - memberikan reaksi basa terhadap air. Garam logam alkali tanah, kecuali radium, tersebar luas di alam dalam bentuk mineral.
Kalsium
Kalsium adalah unsur dari subkelompok utama golongan kedua, periode keempat sistem periodik unsur kimia oleh DI Dmitry Ivanovich Mendeleev, dengan nomor atom 20. Dilambangkan dengan simbol Ca (lat. Kalsium). Zat sederhana kalsium (nomor CAS: 7440-70-2) - lunak, aktif secara kimia logam alkali tanah warna putih keperakan.
Logam kalsium ada dalam dua modifikasi alotropik. Hingga 443 °C, α-Ca dengan kisi berpusat muka kubik (parameter a = 0,558 nm) stabil; β-Ca dengan kisi berpusat badan kubik tipe α-Fe (parameter a = 0,448 nm) stabil lebih stabil. Entalpi standar ΔH0 transisi α → β adalah 0,93 kJ/mol.
Kalsium adalah logam alkali tanah yang khas. Aktivitas kimia kalsium tinggi, tetapi lebih rendah dibandingkan semua logam alkali tanah lainnya. Mudah bereaksi dengan oksigen, karbon dioksida dan uap air di udara, itulah sebabnya permukaan logam kalsium biasanya berwarna abu-abu kusam, sehingga di laboratorium kalsium biasanya disimpan, seperti logam alkali tanah lainnya, dalam toples tertutup rapat di bawah lapisan. minyak tanah atau parafin cair.
Dalam rangkaian potensial standar, kalsium terletak di sebelah kiri hidrogen. Potensial elektroda standar dari pasangan Ca2+/Ca0 adalah −2,84 V, sehingga kalsium bereaksi aktif dengan air, tetapi tanpa penyalaan:
Ca + 2H2O = Ca(OH)2 + H2 + Q.
Kalsium bereaksi dengan non-logam aktif (oksigen, klor, brom) dalam kondisi normal:
2Ca + O2 = 2CaO, Ca + Br2 = CaBr2.
Saat dipanaskan di udara atau oksigen, kalsium terbakar. Kalsium bereaksi dengan nonlogam yang kurang aktif (hidrogen, boron, karbon, silikon, nitrogen, fosfor dan lain-lain) jika dipanaskan, misalnya:
Ca + H2 = CaH2, Ca + 6B = CaB6,
3Ca + N2 = Ca3N2, Ca + 2C = CaC2,
3Ca + 2P = Ca3P2 (kalsium fosfida), kalsium fosfida dengan komposisi CaP dan CaP5 juga diketahui;
2Ca + Si = Ca2Si (kalsium silisida); kalsium silisida dengan komposisi CaSi, Ca3Si4 dan CaSi2 juga dikenal.
Terjadinya reaksi-reaksi di atas biasanya disertai dengan keluarnya jumlah besar panas (yaitu, reaksi ini bersifat eksotermik). Dalam semua senyawa dengan nonlogam, bilangan oksidasi kalsium adalah +2. Sebagian besar senyawa kalsium dengan nonlogam mudah terurai oleh air, misalnya:
CaH2 + 2H2O = Ca(OH)2 + 2H2,
Ca3N2 + 3H2O = 3Ca(OH)2 + 2NH3.
Ion Ca2+ tidak berwarna. Ketika garam kalsium larut ditambahkan ke dalam nyala api, nyala api berubah menjadi merah bata.
Garam kalsium seperti CaCl2 klorida, CaBr2 bromida, CaI2 iodida dan Ca(NO3)2 nitrat sangat larut dalam air. Yang tidak larut dalam air adalah fluorida CaF2, karbonat CaCO3, sulfat CaSO4, ortofosfat Ca3(PO4)2, oksalat CaC2O4 dan beberapa lainnya.
Berbeda dengan kalsium karbonat CaCO3, kalsium karbonat asam (bikarbonat) Ca(HCO3)2 harus larut dalam air. Secara alami, hal ini mengarah pada proses berikut. Ketika hujan dingin atau air sungai, jenuh dengan karbon dioksida, menembus bawah tanah dan jatuh di atas batu kapur, pelarutannya diamati:
CaCO3 + CO2 + H2O = Ca(HCO3)2.
Di tempat yang sama di mana air jenuh dengan kalsium bikarbonat muncul ke permukaan bumi dan dipanaskan oleh sinar matahari, terjadi reaksi sebaliknya:
Ca(HCO3)2 = CaCO3 + CO2 + H2O.
Beginilah perpindahan sejumlah besar zat di alam. Akibatnya, celah besar dapat terbentuk di bawah tanah, dan “es” batu yang indah - stalaktit dan stalagmit - terbentuk di dalam gua.
Kehadiran kalsium bikarbonat terlarut dalam air sangat menentukan kesadahan sementara air. Disebut sementara karena ketika air mendidih, bikarbonat terurai dan CaCO3 mengendap. Fenomena ini, misalnya, mengarah pada fakta bahwa kerak terbentuk di dalam ketel seiring waktu.
Strontium
Strontium adalah unsur dari subkelompok utama golongan kedua, periode kelima sistem periodik unsur kimia oleh DI Mendeleev Dmitry Ivanovich, dengan nomor atom 38. Dilambangkan dengan simbol Sr (lat. Strontium). Strontium zat sederhana (nomor CAS: 7440-24-6) adalah logam alkali tanah yang lunak, mudah dibentuk, dan ulet, berwarna putih keperakan. Ia memiliki aktivitas kimia yang tinggi, di udara ia cepat bereaksi dengan uap air dan oksigen, ditutupi dengan lapisan oksida kuning.
Unsur baru ini ditemukan dalam mineral strontianit, ditemukan pada tahun 1764 di sebuah tambang timah dekat desa Stronshian di Skotlandia, yang kemudian memberi nama pada unsur baru tersebut. Kehadiran oksida logam baru dalam mineral ini ditemukan hampir 30 tahun kemudian oleh William Cruickshank dan Ader Crawford. Diisolasi dalam bentuk murni oleh Sir Humphry Davy pada tahun 1808.
Strontium adalah logam lunak berwarna putih keperakan yang mudah dibentuk dan ulet serta mudah dipotong dengan pisau.
Polimorfik - tiga modifikasinya diketahui. Hingga 215°C modifikasi berpusat muka kubik (α-Sr) stabil, antara 215 dan 605°C modifikasi heksagonal (β-Sr) stabil, dan di atas 605°C modifikasi berpusat badan kubik (γ- Sr) stabil.
Titik lebur - 768oC, titik didih - 1390oC.
Strontium dalam senyawanya selalu menunjukkan valensi +2. Sifat strontium mirip dengan kalsium dan barium, menempati posisi perantara di antara keduanya.
Dalam rangkaian tegangan elektrokimia, strontium termasuk yang paling banyak logam aktif(potensial elektroda normalnya adalah −2,89 V. Bereaksi kuat dengan air, membentuk hidroksida:
Sr + 2H2O = Sr(OH)2 + H2
Berinteraksi dengan asam, menggantikan logam berat dari garamnya. Bereaksi lemah dengan asam pekat (H2SO4, HNO3).
Strontium logam dengan cepat teroksidasi di udara, membentuk lapisan kekuningan, yang selain SrO oksida, selalu ada SrO2 peroksida dan Sr3N2 nitrida. Ketika dipanaskan di udara, ia akan menyala; bubuk strontium di udara rentan terhadap penyalaan sendiri.
Bereaksi kuat dengan non-logam - belerang, fosfor, halogen. Berinteraksi dengan hidrogen (di atas 200°C), nitrogen (di atas 400°C). Praktis tidak bereaksi dengan basa.
Pada suhu tinggi ia bereaksi dengan CO2 membentuk karbida:
5Sr + 2CO2 = SrC2 + 4SrO
Garam strontium yang mudah larut dengan anion Cl-, I-, NO3-. Garam dengan anion F-, SO42-, CO32-, PO43- sedikit larut.
Strontium digunakan untuk paduan tembaga dan beberapa paduannya, untuk dimasukkan ke dalam paduan timbal baterai, untuk desulfurisasi besi tuang, tembaga dan baja.
Barium
Barium adalah unsur dari subkelompok utama golongan kedua, periode keenam sistem periodik unsur kimia oleh DI Dmitry Ivanovich Mendeleev, dengan nomor atom 56. Dilambangkan dengan simbol Ba (lat. Barium). Bahan sederhana barium (nomor CAS: 7440-39-3) adalah logam alkali tanah yang lunak dan mudah dibentuk, berwarna putih keperakan. Memiliki aktivitas kimia yang tinggi.
Barium ditemukan sebagai oksida BaO pada tahun 1774 oleh Karl Scheele. Pada tahun 1808, ahli kimia Inggris Humphry Davy memperoleh elektrolisis barium hidroksida basah dengan katoda merkuri. campuran barium; Setelah merkuri menguap saat dipanaskan, ia melepaskan logam barium.
Barium adalah logam lunak berwarna putih keperakan. Jika dipukul dengan tajam, ia akan patah. Ada dua modifikasi alotropik barium: α-Ba dengan kisi berpusat badan kubik (parameter a = 0,501 nm) stabil hingga 375 °C; β-Ba stabil di atasnya.
Kekerasan pada skala mineralogi 1,25; Skala Mohs 2.
Simpan logam barium dalam minyak tanah atau di bawah lapisan parafin.
Barium adalah logam alkali tanah. Ini teroksidasi secara intensif di udara, membentuk barium oksida BaO dan barium nitrida Ba3N2, dan menyala dengan sedikit pemanasan. Bereaksi hebat dengan air membentuk barium hidroksida Ba(OH)2:
Ba + 2H2O = Ba(OH)2 + H2
Berinteraksi aktif dengan asam encer. Banyak garam barium yang tidak larut atau sedikit larut dalam air: barium sulfat BaSO4, barium sulfit BaSO3, barium karbonat BaCO3, barium fosfat Ba3(PO4)2. Barium sulfida BaS, tidak seperti kalsium sulfida CaS, sangat larut dalam air.
Mudah bereaksi dengan halogen membentuk halida.
Ketika dipanaskan dengan hidrogen, ia membentuk barium hidrida BaH2, yang selanjutnya dengan litium hidrida LiH menghasilkan kompleks Li.
Bereaksi ketika dipanaskan dengan amonia:
6Ba + 2NH3 = 3BaH2 + Ba3N2
Saat dipanaskan, barium nitrida Ba3N2 bereaksi dengan CO membentuk sianida:
Ba3N2 + 2CO = Ba(CN)2 + 2BaO
Dengan amonia cair menghasilkan larutan berwarna biru tua, dari mana amonia dapat diisolasi, yang memiliki kilau keemasan dan mudah terurai dengan eliminasi NH3. Dengan adanya katalis platina, amonia terurai membentuk barium tengah:
Ba(NH2)2 + 4NH3 + H2
Barium karbida BaC2 dapat diperoleh dengan memanaskan BaO dengan batubara dalam tungku busur.
Dengan fosfor membentuk fosfida Ba3P2.
Barium mereduksi oksida, halida, dan sulfida dari banyak logam menjadi logam yang sesuai.
Barium logam, seringkali dalam paduan dengan aluminium, digunakan sebagai penyerap gas (pengambil) pada perangkat elektronik dengan vakum tinggi, dan juga ditambahkan bersama dengan zirkonium ke cairan pendingin logam (paduan natrium, kalium, rubidium, litium, cesium) untuk mengurangi agresivitas terhadap jaringan pipa, dan dalam metalurgi.
Logam transisi
Logam transisi (unsur transisi) adalah unsur-unsur subkelompok sekunder dari Tabel Periodik Unsur Kimia D. I. Mendeleev Dmitry Ivanovich, yang atomnya elektronnya muncul pada orbital d dan f. DI DALAM pandangan umum Struktur elektronik unsur transisi dapat direpresentasikan sebagai berikut: . Orbital ns mengandung satu atau dua elektron, sisa elektron valensi berada di orbital -. Karena jumlah elektron valensi jauh lebih sedikit daripada jumlah orbital, zat sederhana yang dibentuk oleh unsur transisi adalah logam.
Ciri-ciri umum unsur transisi
Semua unsur transisi mempunyai sifat umum sebagai berikut:
Nilai keelektronegatifan kecil.
Keadaan oksidasi variabel. Untuk hampir semua unsur d, yang atomnya memiliki 2 elektron valensi pada sublevel ns terluar, bilangan oksidasi +2 diketahui.
Dimulai dengan unsur d golongan III Tabel Periodik Unsur Kimia oleh D.I.Dmitry Ivanovich Mendeleev, unsur-unsur dengan bilangan oksidasi terendah membentuk senyawa yang menunjukkan sifat basa, dalam bilangan oksidasi tertinggi - asam, dalam bilangan oksidasi menengah - amfoter.
Besi
Besi adalah unsur subkelompok samping golongan kedelapan periode keempat sistem periodik unsur kimia oleh DI Mendeleev Dmitry Ivanovich, nomor atom 26. Dilambangkan dengan simbol Fe (lat. Ferrum). Salah satu logam yang paling melimpah di kerak bumi (tempat kedua setelah aluminium).
Zat sederhana besi (nomor CAS: 7439-89-6) adalah logam putih keperakan yang mudah ditempa dengan reaktivitas kimia yang tinggi: besi cepat terkorosi pada suhu tinggi atau kelembaban tinggi di udara. Besi terbakar dalam oksigen murni, dan dalam keadaan terdispersi halus, besi akan terbakar secara spontan di udara.
Faktanya, besi biasanya disebut paduannya dengan kandungan pengotor rendah (hingga 0,8%), yang mempertahankan kelembutan dan keuletan logam murni. Namun dalam praktiknya, paduan besi dengan karbon lebih sering digunakan: (hingga 2% karbon) dan (lebih dari 2% karbon), serta baja tahan karat (paduan) dengan tambahan logam paduan (krom, mangan, Ni, dll.). Keseluruhan properti tertentu besi dan paduannya menjadikannya “logam nomor 1” yang penting bagi manusia.
Di alam, besi jarang ditemukan dalam bentuk murni, paling sering ditemukan pada meteorit besi-nikel. Kelimpahan besi di kerak bumi adalah 4,65% (peringkat ke-4 setelah O, Si, Al). Besi juga diyakini menyusun sebagian besar inti bumi.




Besi adalah logam yang khas, dalam keadaan bebasnya berwarna putih keperakan dengan semburat keabu-abuan. Logam murni bersifat ulet; berbagai pengotor (khususnya karbon) meningkatkan kekerasan dan kerapuhannya. Ini telah menyatakan sifat magnetik. Yang sering disebut "triad besi" - sekelompok tiga logam (besi Fe, kobalt Co, Tidak Ni), mempunyai sifat fisika, jari-jari atom dan nilai keelektronegatifan yang serupa.
Besi dicirikan oleh polimorfisme; ia memiliki empat modifikasi kristal:
hingga 769 °C terdapat α-Fe (ferit) dengan kisi kubik berpusat pada benda dan sifat feromagnetik (769 °C ≈ 1043 K - titik Curie untuk besi)
pada kisaran suhu 769–917 °C terdapat β-Fe, yang berbeda dari α-Fe hanya pada parameter kisi kubik berpusat tubuh dan sifat magnetik paramagnet
pada kisaran suhu 917–1394 °C terdapat γ-Fe (austenit) dengan kisi kubik berpusat pada muka
di atas 1394 °C δ-Fe dengan kisi kubik berpusat pada benda stabil
Metalurgi tidak membedakan β-Fe sebagai fase terpisah, dan menganggapnya sebagai variasi dari α-Fe. Ketika besi atau baja dipanaskan di atas titik Curie (769 °C ≈ 1043 K), pergerakan termal ion mengganggu orientasi momen magnet putaran elektron, feromagnet menjadi paramagnetik - terjadi transisi fase orde kedua, tetapi transisi fase orde pertama dengan perubahan parameter fisik dasar kristal tidak terjadi.
Untuk besi murni pada tekanan normal, dari sudut pandang metalurgi, terdapat modifikasi stabil berikut:
Dari nol mutlak hingga 910 єC, modifikasi α dengan kisi kristal kubik berpusat badan (bcc) stabil. Larutan padat karbon dalam besi α disebut ferit.
Dari 910 hingga 1400 єC, modifikasi γ dengan kisi kristal kubik berpusat muka (fcc) stabil. Larutan karbon padat dalam besi-γ disebut austenit.
Dari 910 hingga 1539 єC, modifikasi δ dengan kisi kristal kubik berpusat badan (bcc) stabil. Larutan karbon padat dalam besi δ (dan juga besi α) disebut ferit. Kadang-kadang dibuat perbedaan antara δ-ferit suhu tinggi dan α-ferit suhu rendah (atau sekadar ferit), meskipun struktur atomnya sama.
Kehadiran unsur karbon dan paduan dalam baja secara signifikan mengubah suhu transisi fasa.
Di daerah tekanan tinggi(lebih dari 104 MPa, 100 ribu atm.) muncul modifikasi besi-ε dengan kisi-kisi padat heksagonal (hcp).
Fenomena polimorfisme sangat penting dalam metalurgi baja. Berkat transisi α-γ dari kisi kristal, perlakuan panas pada baja terjadi. Tanpa fenomena ini, besi, sebagai bahan dasar baja, tidak akan digunakan secara luas.
Besi bersifat tahan api dan termasuk logam dengan aktivitas sedang. Titik leleh besi adalah 1539 °C, titik didihnya sekitar 3200 °C.
Besi adalah salah satu logam yang paling banyak digunakan, menyumbang hingga 95% produksi metalurgi global.
Besi adalah komponen utama baja dan besi tuang merupakan bahan struktural terpenting.
Besi dapat menjadi bagian dari paduan berdasarkan logam lain - misalnya nikel.
Oksida besi magnetik (magnetit) adalah bahan penting dalam produksi perangkat memori komputer jangka panjang: hard drive, floppy disk, dll.
Bubuk magnetit ultrahalus digunakan pada printer laser hitam putih sebagai toner.
Sifat feromagnetik yang unik dari sejumlah paduan berbasis besi berkontribusi pada penggunaannya secara luas dalam teknik kelistrikan untuk inti magnetik transformator dan motor listrik.
Besi(III) klorida (besi klorida) digunakan dalam praktik radio amatir untuk mengetsa papan sirkuit cetak.
Ferrous sulfate heptate (ferrous sulfate) dicampur dengan tembaga sulfat digunakan untuk memerangi jamur berbahaya dalam berkebun dan konstruksi.
Besi digunakan sebagai anoda pada baterai besi-nikel dan baterai besi-udara.
Tembaga
Tembaga adalah unsur subkelompok samping golongan pertama, periode keempat tabel periodik unsur kimia DI Dmitry Ivanovich Mendeleev, dengan nomor atom 29. Dilambangkan dengan simbol Cu (lat. Cuprum). Unsur tembaga (nomor CAS: 7440-50-8) adalah logam transisi ulet dengan warna merah jambu keemasan (merah muda tanpa adanya lapisan oksida). Ini telah banyak digunakan oleh orang-orang sejak lama.



Tembaga adalah logam ulet berwarna merah muda keemasan; di udara dengan cepat ditutupi dengan lapisan oksida, yang memberikan karakteristik warna merah kekuningan yang intens. Tembaga memiliki konduktivitas termal dan listrik yang tinggi (menempati peringkat kedua dalam konduktivitas listrik setelah perak). Ia memiliki dua isotop stabil - 63Cu dan 65Cu, dan beberapa isotop radioaktif. Yang paling lama berumur, 64Cu, memiliki waktu paruh 12,7 jam dan dua mode peluruhan dengan produk berbeda.
Kepadatan - 8,94*10i kg/m
Kapasitas panas spesifik pada 20 °C - 390 J/kg*K
Resistivitas listrik pada 20-100 °C - 1,78·10−8 Ohm·m
Titik lebur - 1083 °C
Titik didih - 2600 °C
Ada beberapa paduan tembaga: kuningan - paduan tembaga dengan seng, paduan tembaga dan timah, tembaganikel - paduan tembaga dan nikel, dan beberapa lainnya.
Seng
Seng adalah unsur subkelompok sekunder golongan kedua, periode keempat sistem periodik unsur kimia oleh DI Mendeleev Dmitry Ivanovich, dengan nomor atom 30. Dilambangkan dengan simbol Zn (lat. Zinkum). Zat sederhana (nomor CAS: 7440-66-6) dalam kondisi normal adalah logam transisi rapuh berwarna putih kebiruan (menodai di udara, ditutupi lapisan tipis seng oksida).
Dalam bentuknya yang murni, logam ini merupakan logam berwarna putih keperakan yang agak ulet. Ia memiliki kisi heksagonal dengan parameter a = 0,26649 nm, c = 0,49468 nm. Pada suhu kamar rapuh, ketika pelat dibengkokkan, terdengar bunyi retak akibat gesekan kristalit (biasanya lebih kuat dari “jeritan timah”). Pada suhu 100-150°C seng berbentuk plastik. Kotoran, bahkan yang kecil sekalipun, secara dramatis meningkatkan kerapuhan seng.
Logam amfoter yang khas. Potensial elektroda standar adalah −0,76 V, dalam rangkaian potensial standar terletak hingga besi.
Di udara, seng dilapisi dengan lapisan tipis ZnO oksida. Ketika dipanaskan dengan kuat, ia terbakar membentuk oksida putih amfoter ZnO:
2Zn + O2 = 2ZnO.
Seng oksida bereaksi dengan larutan asam:
ZnO + 2HNO3 = Zn(NO3)2 + H2O
dan dengan basa:
ZnO + 2NaOH = Na2ZnO2 + H2O,
Seng dengan kemurnian biasa bereaksi aktif dengan larutan asam:
Zn + 2HCl = ZnCl2 + H2,
Zn + H2SO4(dil.) = ZnSO4 + H2
dan larutan alkali:
Zn + 2NaOH + 2H2O = Na2 + H2,
membentuk hidroksinat. Seng yang sangat murni tidak bereaksi dengan larutan asam dan basa. Interaksi dimulai ketika beberapa tetes larutan tembaga sulfat CuSO4 ditambahkan.
Ketika dipanaskan, seng bereaksi dengan halogen membentuk halida ZnHal2. Dengan fosfor, seng membentuk fosfida Zn3P2 dan ZnP2. Dengan belerang dan analognya - selenium dan telurium - berbagai kalkogenida, ZnS, ZnSe, ZnSe2 dan ZnTe.
Seng tidak bereaksi langsung dengan hidrogen, nitrogen, karbon, silikon dan boron. Zn3N2 nitrida diperoleh dengan mereaksikan seng dengan amonia pada suhu 550-600°C.
DI DALAM larutan berair Ion seng Zn2+ membentuk kompleks aqua 2+ dan 2+.
Logam seng murni digunakan untuk memulihkan logam mulia yang ditambang melalui pencucian bawah tanah (emas, perak). Selain itu, seng digunakan untuk mengekstraksi perak, emas (dan logam lainnya) dari timbal mentah dalam bentuk senyawa intermetalik seng-perak-emas (disebut “busa perak”), yang kemudian diproses dengan metode pemurnian konvensional.
Ini digunakan untuk melindungi baja dari korosi (galvanisasi permukaan yang tidak terkena tekanan mekanis, atau metalisasi - untuk jembatan, tangki, struktur logam). Juga digunakan sebagai bahan elektroda negatif pada sumber arus kimia yaitu pada baterai dan akumulator, misalnya: sel mangan-seng, baterai perak-seng (EMF 1,85 V, 150 Wh/kg, 650 Wh/ dmі, rendah hambatan dan arus pelepasan yang sangat besar, unsur merkuri-seng (EMF 1,35 V, 135 Wh/kg, 550-650 Wh/dmі), unsur dioksisulfat-merkuri, unsur seng iodat, sel galvanik tembaga oksida (EMF 0,7-1,6 Volt, 84- 127 Wh/kg, 410-570 Wh/dmI), sel kromium-seng, sel seng-perak klorida, baterai nikel-seng (EMF 1, 82 Volt, 95-118 Wh/kg, 230-295 Wh/dmI), sel timbal-seng, baterai seng-klorin, baterai seng-bromin, dll.). Peran zinc dalam baterai zinc-air sangat penting; dalam beberapa tahun terakhir, baterai untuk komputer (laptop) berdasarkan sistem zinc-air telah dikembangkan secara intensif dan keberhasilan yang signifikan telah dicapai di bidang ini (lebih besar dari baterai lithium, kapasitas dan sumber daya, 3 kali lebih hemat biaya), sistem ini juga sangat menjanjikan untuk menghidupkan mesin (baterai timbal - 55 Wh/kg, zinc-air - 220-300 Wh/kg) dan untuk kendaraan listrik (jarak tempuh hingga 900 km ). Termasuk dalam banyak solder keras untuk mengurangi titik lelehnya. Seng merupakan komponen penting dari kuningan. Seng oksida banyak digunakan dalam pengobatan sebagai agen antiseptik dan anti-inflamasi. Seng oksida juga digunakan untuk menghasilkan cat - seng putih.
Seng klorida merupakan fluks penting untuk penyolderan logam dan komponen dalam produksi serat.
Seng telurida, selenida, fosfida, dan sulfida adalah semikonduktor yang banyak digunakan.
Seng selenida digunakan untuk membuat kacamata optik dengan koefisien penyerapan yang sangat rendah di wilayah inframerah tengah, seperti pada laser karbon dioksida.
Air raksa
Merkuri adalah unsur subkelompok sekunder golongan kedua, periode keenam tabel periodik unsur kimia DI Dmitry Ivanovich Mendeleev, dengan nomor atom 80. Dilambangkan dengan simbol Hg (lat. Hydrargyrum). Zat sederhana merkuri (nomor CAS: 7439-97-6) adalah logam transisi, pada suhu kamar berbentuk cairan berat, berwarna putih keperakan, mudah menguap, yang uapnya sangat beracun. Merkuri adalah salah satu dari dua unsur kimia (dan satu-satunya logam), yang zat sederhananya, dalam kondisi normal, berada dalam keadaan agregasi cair (unsur kedua adalah brom). Di alam, ditemukan dalam bentuk asli dan membentuk sejumlah mineral. Merkuri paling sering diperoleh melalui reduksi dari mineral paling umum, cinnabar. Ini digunakan untuk pembuatan alat ukur, pompa vakum, sumber cahaya dan bidang ilmu pengetahuan dan teknologi lainnya.
Merkuri adalah satu-satunya logam yang berbentuk cair pada suhu kamar. Ia memiliki sifat diamagnetik. Membentuk paduan cair dengan banyak logam - amalgam. Hanya besi, mangan dan Tidak.
Merkuri adalah logam dengan reaktif rendah.
Ketika dipanaskan hingga 300 °C, merkuri bereaksi dengan oksigen: 2Hg + O2 → 2HgO Merkuri(II) oksida merah terbentuk. Reaksi ini bersifat reversibel: ketika dipanaskan di atas 340 °C, oksida terurai menjadi zat sederhana. Reaksi penguraian merkuri oksida secara historis merupakan salah satu cara pertama untuk menghasilkan oksigen.
Ketika merkuri dipanaskan dengan belerang, merkuri(II) sulfida akan terbentuk.
Merkuri tidak larut dalam larutan asam yang tidak memilikinya sifat pengoksidasi, tetapi larut dalam aqua regia dan asam sendawa, membentuk garam merkuri divalen. Ketika kelebihan merkuri dilarutkan dalam asam nitrat dalam suhu dingin, nitrat Hg2(NO3)2 terbentuk.
Dari unsur-unsur golongan IIB, merkurilah yang mempunyai kemungkinan menghancurkan kulit elektron 6d10 yang sangat stabil, sehingga memungkinkan adanya senyawa merkuri (+4). Jadi, selain Hg2F2 yang sukar larut dan HgF2 pengurai air, ada juga HgF4, yang diperoleh dari interaksi atom merkuri dan campuran neon dan fluor pada suhu 4K.
Merkuri digunakan dalam pembuatan termometer; merkuri-kuarsa dan lampu neon diisi dengan uap merkuri. Kontak merkuri berfungsi sebagai sensor posisi. Selain itu, logam merkuri digunakan untuk memproduksi sejumlah paduan penting.
Sebelumnya, berbagai amalgam logam, terutama amalgam emas dan perak, banyak digunakan pada perhiasan, cermin, dan tambalan gigi. Dalam bidang teknologi, merkuri banyak digunakan untuk barometer dan pengukur tekanan. Senyawa merkuri digunakan sebagai antiseptik (sublimat), pencahar (kalomel), dalam produksi topi, dll., namun karena toksisitasnya yang tinggi, pada akhir abad ke-20 senyawa tersebut praktis dipaksa keluar dari area ini (mengganti amalgamasi dengan sputtering). dan elektrodeposisi logam, tambalan polimer dalam kedokteran gigi).
Paduan merkuri dan talium digunakan untuk termometer suhu rendah.
Merkuri logam berfungsi sebagai katoda untuk produksi elektrolitik sejumlah logam aktif, klorin dan alkali, dalam beberapa sumber arus kimia (misalnya, merkuri-seng - tipe RC), dalam sumber tegangan referensi (elemen Weston). Unsur merkuri-seng (ggl 1,35 Volt) memiliki energi volume dan massa yang sangat tinggi (130 W/jam/kg, 550 W/jam/dm).
Merkuri digunakan dalam pengolahan aluminium daur ulang dan penambangan emas (lihat amalgam).
Merkuri juga terkadang digunakan sebagai fluida kerja pada bantalan hidrodinamik dengan beban berat.
Merkuri dimasukkan dalam beberapa cat biosidal untuk mencegah pengotoran lambung kapal di air laut.
Mercury-203 (T1/2 = 53 detik) digunakan dalam radiofarmakologi.
Garam merkuri juga digunakan:
Merkuri iodida digunakan sebagai detektor radiasi semikonduktor.
Merkuri fulminat (“Merkurius fulminat”) telah lama digunakan sebagai bahan peledak pemicu (Detonator).
Merkuri bromida digunakan dalam dekomposisi termokimia air menjadi hidrogen dan oksigen (energi atom hidrogen).
Beberapa senyawa merkuri digunakan sebagai obat (misalnya, merthiolate untuk mengawetkan vaksin), tetapi terutama karena toksisitasnya, merkuri terpaksa dikeluarkan dari pengobatan (sublimasi, merkuri oksisianida - antiseptik, kalomel - pencahar, dll.) pada pertengahan akhir abad ke-20. abad.

Aluminium
Aluminium adalah unsur subkelompok utama golongan ketiga Periode ketiga sistem periodik unsur kimia oleh D. I. Mendeleev Dmitry Ivanovich, nomor atom 13. Dilambangkan dengan simbol Al (lat. Aluminium). Termasuk dalam kelompok logam ringan. Logam yang paling umum dan unsur kimia ketiga yang paling melimpah (setelah oksigen dan silikon) di kerak bumi.
Bahan sederhana Aluminium (nomor CAS: 7429-90-5) adalah logam ringan berwarna putih keperakan non-magnetik yang mudah dibentuk, dituang, dan dikerjakan. Aluminium memiliki konduktivitas termal dan listrik yang tinggi serta ketahanan terhadap korosi karena pembentukan lapisan oksida kuat yang cepat yang melindungi permukaan dari interaksi lebih lanjut.
Menurut beberapa penelitian biologi, asupan Aluminium ke dalam tubuh manusia dianggap sebagai faktor berkembangnya penyakit Alzheimer, namun penelitian tersebut kemudian dikritik dan kesimpulan tentang hubungan antara satu dengan yang lain terbantahkan.
Logam berwarna putih keperakan, ringan, massa jenis 2,7 g/cm³, titik leleh teknis 658 °C, Aluminium dengan kemurnian tinggi 660 °C, titik didih 2500 °C, kuat tarik cor 10-12 kg/mm², dapat berubah bentuk 18 -25 kg/mm2, paduan 38-42 kg/mm².
Kekerasan Brinell adalah 24-32 kgf/mm², keuletan tinggi: teknis 35%, murni 50%, digulung menjadi lembaran tipis dan bahkan foil.
Aluminium memiliki konduktivitas listrik dan termal yang tinggi, 65% konduktivitas listrik Cuprum, dan memiliki reflektifitas cahaya yang tinggi.
Aluminium membentuk paduan dengan hampir semua logam.
Dalam kondisi normal, aluminium ditutupi dengan lapisan oksida yang tipis dan tahan lama sehingga tidak bereaksi dengan zat pengoksidasi klasik: dengan H2O (t°); O2, HNO3 (tanpa pemanasan). Berkat ini, Aluminium praktis tidak mengalami korosi dan oleh karena itu banyak diminati di industri modern. Namun, ketika lapisan oksida dihancurkan (misalnya, saat kontak dengan larutan garam amonium NH4+, alkali panas, atau akibat amalgamasi), Aluminium bertindak sebagai logam pereduksi aktif.
Bereaksi dengan mudah dengan zat sederhana:
dengan oksigen:
4Al + 3O2 = 2Al2O3
dengan halogen:
2Al + 3Br2 = 2AlBr3
bereaksi dengan non-logam lainnya ketika dipanaskan:
dengan Sulfur, membentuk Aluminium sulfida:
2Al + 3S = Al2S3
dengan nitrogen, membentuk aluminium nitrida:
dengan karbon, membentuk aluminium karbida:
4Al + 3C = Al4C3
Aluminium sulfida dan karbida terhidrolisis sempurna:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
Al4C3 + 12H2O = 4Al(OH)3+ 3CH4
Dengan zat kompleks:
dengan air (setelah menghilangkan lapisan oksida pelindung, misalnya amalgamasi atau larutan alkali panas):
2Al + 6H2O = 2Al(OH)3 + 3H2
dengan basa (dengan pembentukan tetrahidroksoaluminat dan aluminat lainnya):
2Al + 2NaOH + 6H2O = 2Na + 3H2
2(NaOH.H2O) + 2Al = 2NaAlO2 + 3H2
Mudah larut dalam asam klorida dan asam sulfat encer:
2Al + 6HCl = 2AlCl3 + 3H2
2Al + 3H2SO4(dil) = Al2(SO4)3 + 3H2
Ketika dipanaskan, ia larut dalam asam - zat pengoksidasi yang membentuk garam aluminium larut:
2Al + 6H2SO4(konsentrasi) = Al2(SO4)3 + 3SO2 + 6H2O
Al + 6HNO3(konsentrasi) = Al(NO3)3 + 3NO2 + 3H2O
memulihkan Logam dari oksidanya (aluminothermy):
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
2Al + Cr2O3 = Al2O3 + 2Cr
Banyak digunakan sebagai bahan konstruksi. Keunggulan utama Aluminium dalam kualitas ini adalah ringan, mudah ditempa, tahan korosi (di udara, Aluminium langsung dilapisi dengan film Al2O3 yang tahan lama, yang mencegah oksidasi lebih lanjut), konduktivitas termal yang tinggi, dan tidak beracunnya senyawanya. Secara khusus, sifat-sifat ini menjadikan Aluminium sangat populer dalam produksi peralatan masak, aluminium foil dalam industri makanan, dan untuk pengemasan.
Kerugian utama Aluminium sebagai bahan struktural adalah kekuatannya yang rendah, sehingga biasanya dicampur dengan sedikit Cuprum dan magnesium (paduan ini disebut duralumin).
Daya hantar listrik Aluminium hanya 1,7 kali lebih kecil dibandingkan Tembaga, sedangkan Aluminium kira-kira 2 kali lebih murah. Oleh karena itu, banyak digunakan dalam teknik elektro untuk pembuatan kabel, pelindungnya, dan bahkan dalam mikroelektronika untuk pembuatan konduktor dalam chip. Konduktivitas listrik Aluminium yang lebih rendah (37 1/ohm) dibandingkan dengan Cuprum (63 1/ohm) diimbangi dengan peningkatan penampang konduktor aluminium. Kerugian Aluminium sebagai bahan listrik adalah lapisan oksidanya yang kuat sehingga menyulitkan penyolderan.
Karena sifatnya yang kompleks, ia banyak digunakan dalam peralatan pemanas.
Aluminium dan paduannya mempertahankan kekuatan pada suhu sangat rendah. Oleh karena itu, banyak digunakan dalam teknologi kriogenik.
Reflektivitas tinggi, dipadukan dengan biaya rendah dan kemudahan pengendapan, menjadikan Aluminium bahan yang ideal untuk membuat cermin.
Dalam produksi bahan bangunan sebagai bahan pembentuk gas.
Aluminisasi memberikan ketahanan korosi dan kerak pada baja dan paduan lainnya, misalnya katup mesin pembakaran internal piston, bilah turbin, rig produksi minyak, peralatan pertukaran panas, dan juga menggantikan galvanisasi.
Aluminium sulfida digunakan untuk menghasilkan hidrogen sulfida.
Penelitian sedang dilakukan untuk mengembangkan aluminium berbusa sebagai bahan yang sangat kuat dan ringan.
Ketika harga Aluminium sangat mahal, berbagai macam perhiasan dibuat darinya. Mode bagi mereka segera berlalu ketika teknologi (perkembangan) baru untuk produksinya muncul, yang menguranginya berkali-kali lipat. Saat ini Aluminium terkadang digunakan dalam produksi perhiasan imitasi.


Logam Lainnya
Memimpin
Timbal adalah unsur dari subkelompok utama golongan keempat, Periode keenam sistem periodik unsur kimia DI Dmitry Ivanovich Mendeleev, dengan nomor atom 82. Dilambangkan dengan simbol Pb (Latin: Plumbum). Zat sederhana Timbal (nomor CAS: 7439-92-1) adalah logam abu-abu yang relatif dapat ditempa dan dapat melebur.
Timbal memiliki konduktivitas termal yang agak rendah, yaitu 35,1 W/(m K) pada suhu 0 °C. Logamnya lunak dan mudah dipotong dengan pisau. Di permukaan biasanya ditutupi dengan lapisan oksida yang kurang lebih tebal, ketika dipotong, permukaan mengkilap terlihat, yang seiring waktu memudar di udara.
Titik lebur: 327.4 °C
Titik didih: 1740 °C
Timbal nitrat digunakan untuk menghasilkan bahan peledak campuran yang kuat. Timbal azida digunakan sebagai detonator (pemula ledakan) yang paling banyak digunakan. Timbal perklorat digunakan untuk menyiapkan cairan berat (kepadatan 2,6 g/cm3) yang digunakan dalam benefisiasi flotasi bijih; kadang-kadang digunakan dalam bahan peledak campuran kuat sebagai zat pengoksidasi. Timbal fluorida sendiri, serta bersama dengan bismut, tembaga, dan perak fluorida, digunakan sebagai bahan katoda dalam sumber arus kimia. Timbal bismut, Timbal sulfida PbS, Timbal iodida digunakan sebagai bahan katoda pada baterai litium. Timbal Klorida PbCl2 sebagai bahan katoda pada sumber arus cadangan. Timbal telurida PbTe banyak digunakan sebagai bahan termoelektrik (termo-ggl dengan 350 μV/K), bahan yang paling banyak digunakan dalam produksi generator termoelektrik dan lemari es termoelektrik. Timbal dioksida PbO2 banyak digunakan tidak hanya dalam baterai timbal, tetapi juga banyak sumber arus kimia cadangan yang dihasilkan, misalnya, sel timbal-klorin, sel timbal-fluoresen, dll.
Timbal putih, karbonat basa Pb(OH)2.PbCO3, bubuk putih padat, diperoleh dari Timbal di udara di bawah pengaruh karbon dioksida dan asam asetat. Penggunaan timbal putih sebagai pigmen pewarna tidak lagi umum karena terurai oleh hidrogen sulfida H2S. Timbal putih juga digunakan untuk produksi dempul, dalam teknologi semen dan kertas karbonat timbal.
Timbal arsenat dan arsenit digunakan dalam teknologi insektisida untuk membunuh hama pertanian (ngengat gipsi dan kumbang kapas). Timbal Borat Pb(BO2)2·H2O, merupakan bubuk putih yang tidak larut, digunakan untuk mengeringkan lukisan dan pernis, dan, bersama dengan Logam lainnya, sebagai pelapis kaca dan porselen. Timbal Klorida PbCl2, bubuk kristal putih, larut dalam air panas, larutan klorida lain dan khususnya amonium klorida NH4Cl. Ini digunakan untuk menyiapkan salep untuk mengobati tumor.
Timbal Kromat PbCrO4 dikenal sebagai pewarna kuning krom dan merupakan pigmen penting untuk membuat cat, untuk mewarnai porselen dan kain. Dalam industri, kromat digunakan terutama dalam produksi pigmen kuning. Timbal Nitrat Pb(NO3)2 adalah zat kristal putih, sangat larut dalam air. Ini adalah pengikat dengan penggunaan terbatas. Dalam industri, digunakan dalam produksi korek api, pencelupan dan pencetakan tekstil, pencelupan dan pengukiran tanduk. Timbal sulfat Pb(SO4)2, bubuk putih yang tidak larut dalam air, digunakan sebagai pigmen dalam baterai, litografi, dan teknologi kain cetak.
Timbal sulfida PbS, bubuk hitam yang tidak larut dalam air, digunakan dalam pembakaran tembikar dan untuk mendeteksi ion Timbal.
Karena Timbal menyerap radiasi dengan baik, Timbal digunakan untuk proteksi radiasi di fasilitas sinar-X dan reaktor nuklir. Selain itu, Timbal dianggap sebagai pendingin dalam proyek reaktor nuklir neutron cepat yang canggih.
Paduan timbal banyak digunakan. Timah (paduan Timah dan Timah), mengandung 85-90% logam Timah dan 15-10% Pb, dapat dicetak, murah dan digunakan dalam pembuatan peralatan rumah tangga. Solder yang mengandung 67% Pb dan 33% logam Timah digunakan dalam teknik kelistrikan. Paduan Timbal dengan antimon digunakan dalam produksi peluru dan font tipografi, dan paduan Timbal, antimon, dan Timah digunakan untuk pengecoran dan bantalan berpola. Paduan timbal-antimon biasanya digunakan untuk selubung kabel dan pelat baterai listrik. Senyawa timbal digunakan dalam produksi pewarna, cat, insektisida, kaca Barang Dagang dan sebagai bahan tambahan Bensin dalam bentuk tetraetil timbal (C2H5)4Pb (cairan agak mudah menguap, uap dalam konsentrasi kecil berbau buah manis, dalam konsentrasi besar berbau tidak sedap; titik leleh = 130 °C, titik didih = 80°C/13 mm Hg .st.; kepadatan 1,650 g/cm; nD2v = 1,5198; tidak larut dalam air, dapat larut dengan pelarut organik; sangat beracun, mudah menembus kulit; MPC = 0,005 mg/m; LD50 = 12,7 mg /kg (tikus, secara oral)) untuk meningkatkan angka oktan.

Timah
Timah adalah suatu unsur dari subkelompok utama golongan keempat, Periode kelima sistem periodik unsur kimia oleh DI Mendeleev Dmitry Ivanovich, dengan nomor atom 50. Dilambangkan dengan simbol logam Timah (Latin Stannum). Dalam kondisi normal, zat sederhana adalah logam mengkilap plastik, mudah dibentuk dan melebur dengan warna putih keperakan. Timah membentuk beberapa modifikasi alotropik: di bawah 13,2 °C, α-timah (Timah abu-abu) dengan kisi berbentuk berlian kubik stabil; di atas 13,2 °C, β-timah (Timah putih) dengan kisi kristal tetragonal stabil.
Timah digunakan terutama sebagai pelapis yang aman, tidak beracun, dan tahan korosi dalam bentuk murni atau dalam paduan dengan Logam lain. Kegunaan utama Timah dalam industri adalah untuk pelat timah (besi kaleng) untuk wadah makanan, untuk solder elektronik, untuk pipa rumah tangga, untuk bantalan paduan, dan untuk pelapis Timah dan paduannya. Paduan Timah yang paling penting adalah Perunggu(dengan Cuprum). Paduan terkenal lainnya, timah, digunakan untuk membuat peralatan makan. DI DALAM Akhir-akhir ini minat terhadap penggunaan Logam sedang dihidupkan kembali, karena merupakan yang paling “ramah lingkungan” di antara Logam non-besi berat. Digunakan untuk membuat kabel superkonduktor berdasarkan senyawa intermetalik Nb3Sn.
Harga untuk Timah logam pada tahun 2006 rata-rata berharga 12-18 dolar/kg, timah dioksida dengan kemurnian tinggi sekitar 25 dolar/kg, timah kristal tunggal dengan kemurnian tinggi sekitar 210 dolar/kg.
Senyawa intermetalik dari timah dan zirkonium memiliki titik leleh yang tinggi (hingga 2000 °C) dan ketahanan terhadap oksidasi bila dipanaskan di udara dan memiliki sejumlah kegunaan.
Timah adalah komponen paduan terpenting dalam produksi paduan titanium struktural.
Timah dioksida adalah bahan abrasif yang sangat efektif digunakan untuk “menyelesaikan” permukaan kaca optik.
Campuran garam timah - "komposisi kuning" - sebelumnya digunakan sebagai pewarna wol.
Timah juga digunakan pada sumber arus kimia sebagai bahan anoda, misalnya: unsur mangan-timah, unsur merkuri-timah oksida. Penggunaan Timah dalam baterai timah cukup menjanjikan; misalnya, pada tegangan yang sama dengan baterai timbal, baterai timah memiliki kapasitas 2,5 kali lebih besar dan kepadatan energi per satuan volume 5 kali lebih besar, resistansi internalnya jauh lebih rendah.
Logam timah tidak beracun sehingga dapat digunakan dalam industri makanan. Kotoran berbahaya yang terkandung dalam Timah dalam kondisi penyimpanan dan penggunaan normal, termasuk dalam lelehan pada suhu hingga 600 °C, tidak dilepaskan ke udara di area kerja dalam volume yang melebihi konsentrasi maksimum yang diizinkan menurut GOST. Paparan debu timah dalam jangka panjang (15-20 tahun) mempunyai efek fibrogenik pada paru-paru dan dapat menyebabkan pneumokoniosis pada pekerja.
Penerapan Logam
Bahan bangunan
Logam dan paduannya merupakan salah satu bahan struktural utama peradaban modern. Hal ini terutama ditentukan oleh kekuatannya yang tinggi, keseragaman dan impermeabilitasnya terhadap cairan dan gas. Selain itu, dengan mengubah formulasi paduan, sifat-sifatnya dapat diubah dalam rentang yang sangat luas.
Bahan listrik
Logam digunakan keduanya sebagai konduktor yang baik Listrik(Tembaga, Aluminium), dan sebagai bahan dengan peningkatan ketahanan terhadap resistor dan elemen pemanas listrik (nichrome, dll.).
Bahan alat
Logam dan paduannya banyak digunakan untuk pembuatan perkakas (bagian kerjanya). Ini terutama baja perkakas dan paduan keras. Intan, boron nitrida, dan keramik juga digunakan sebagai bahan perkakas.
Metalurgi
Metalurgi atau metalurgi adalah bidang ilmu material yang mempelajari perilaku fisik dan kimia logam, senyawa intermetalik, dan paduannya. Metalurgi juga mencakup penerapan praktis dari pengetahuan yang ada tentang Logam - mulai dari ekstraksi bahan mentah hingga masalah moneter produk jadi.
Studi tentang struktur dan sifat fisikokimia lelehan logam dan oksida serta larutan padat, pengembangan teori wujud materi yang terkondensasi;
Studi termodinamika, kinetika dan mekanisme reaksi metalurgi;
Pengembangan landasan ilmiah, teknis dan ekonomi untuk pemanfaatan terpadu bahan baku mineral polimetalik dan limbah teknogenik untuk mengatasi permasalahan lingkungan;
Perkembangan teori dasar-dasar pirometalurgi, elektrotermal, hidrometalurgi dan fasa gas Proses produksi logam, paduan, serbuk logam dan material komposit serta pelapis.
Logam Besi termasuk Besi, mangan, kromium, vanadium. Sisanya berwarna. Berdasarkan sifat fisik dan tujuannya, logam non-ferrous secara kondisional dibagi menjadi berat (Tembaga, Timbal, Seng, Timah, Ni) dan ringan (Aluminium, magnesium).
Menurut yang utama Proses teknologi dibagi menjadi pirometalurgi (peleburan) dan hidrometalurgi (ekstraksi logam dalam larutan kimia). Salah satu jenis pirometalurgi adalah metalurgi plasma.
Metalurgi Plasma - ekstraksi dari bijih, peleburan dan pemrosesan Logam dan paduan di bawah pengaruh plasma.
Pemrosesan bijih (oksida, dll.) dilakukan dengan dekomposisi termal dalam plasma. Untuk mencegah reaksi sebaliknya, digunakan zat pereduksi (karbon, hidrogen, metana, dll.) atau pendinginan tajam aliran plasma, yang mengganggu keseimbangan termodinamika.
Metalurgi Plasma memungkinkan reduksi langsung Logam dari bijih, mempercepat proses metalurgi secara signifikan, memperoleh bahan murni, dan mengurangi biaya bahan bakar (zat pereduksi). Kerugian dari metalurgi plasma adalah tingginya konsumsi listrik yang digunakan untuk menghasilkan plasma.

Cerita
Bukti pertama bahwa manusia terlibat dalam metalurgi berasal dari milenium ke 5-6 SM. e. dan ditemukan di Majdanpek, Pločnik dan tempat lain di Serbia (termasuk kapak tembaga dari tahun 5500 SM, milik budaya Vinca), Bulgaria (5000 SM), Palmela (), Spanyol, Stonehenge (). Namun, seperti yang sering terjadi pada fenomena purbakala seperti itu, usianya tidak selalu dapat ditentukan secara akurat.
Kebudayaan pada masa awal mengandung Perak, Tembaga, Timah, dan Besi meteorit, yang memungkinkan pengerjaan logam secara terbatas. Oleh karena itu, "Belati Surgawi" sangat dihargai - senjata Mesir yang dibuat dari besi meteorit 3000 SM. e. Tapi, setelah belajar mengekstraksi Tembaga dan Timah batu dan orang-orang memproduksi paduan yang disebut perunggu pada 3500 SM. e. memasuki Zaman Perunggu.
Mendapatkan Besi dari bijih dan peleburan Logam jauh lebih sulit. Teknologi tersebut diyakini telah ditemukan oleh bangsa Het sekitar tahun 1200 SM. e., yang menjadi awal Zaman Besi. Rahasia menambang dan membuat Besi menjadi faktor kunci dalam Kekuasaan Bangsa Filistin.
Jejak perkembangan metalurgi besi dapat ditelusuri di banyak budaya dan peradaban masa lalu. Ini termasuk kerajaan dan kerajaan kuno dan abad pertengahan di Timur Tengah dan Timur Dekat, Mesir kuno dan Anatolia (), Kartago, Yunani dan Romawi kuno dan abad pertengahan. Eropa, Cina, dll. Perlu dicatat bahwa banyak metode, perangkat, dan teknologi Metalurgi awalnya ditemukan di Tiongkok Kuno, dan kemudian orang Eropa menguasai keahlian ini (setelah menemukan tanur tiup, Besi cor, Baja, palu hidrolik, dll.). Namun, penelitian terbaru menunjukkan bahwa teknologi Romawi jauh lebih maju dari perkiraan sebelumnya, terutama di bidang pertambangan dan penempaan.
Metalurgi Pertambangan
Metalurgi Ekstraktif melibatkan ekstraksi Logam berharga dari bijih dan peleburan bahan mentah yang diekstraksi menjadi Logam murni. Untuk mengubah oksida Logam atau sulfida menjadi Logam murni, bijih harus dipisahkan secara fisik, kimia, atau elektrolitik.
Ahli metalurgi bekerja dengan tiga komponen utama: bahan mentah, konsentrat (oksida atau sulfida Logam yang berharga) dan limbah. Setelah ditambang, bongkahan besar bijih dihancurkan hingga setiap partikelnya menjadi konsentrat atau limbah yang berharga.
Gunung Bekerja tidak diperlukan jika bijih dan lingkungan memungkinkan pencucian. Dengan cara ini, Anda dapat melarutkan dan memperoleh larutan yang diperkaya dengan Mineral.
Seringkali bijihnya mengandung beberapa Logam berharga. Dalam kasus seperti ini, limbah dari satu Proses dapat digunakan sebagai bahan mentah untuk Proses lainnya.
Paduan
Paduan adalah campuran dua atau lebih unsur kimia yang homogen secara makroskopis dengan dominasi komponen logam. Fase utama atau satu-satunya dari paduan, sebagai suatu peraturan, adalah larutan padat dari unsur-unsur paduan dalam logam yang menjadi dasar paduan tersebut.
Paduan mempunyai sifat logam, misalnya: kilau logam, daya hantar listrik yang tinggi, dan daya hantar panas. Terkadang komponen suatu paduan tidak hanya berupa unsur kimia, tetapi juga senyawa kimia yang memiliki sifat logam. Misalnya, komponen utama paduan keras adalah tungsten atau titanium karbida. Sifat makroskopik paduan selalu berbeda dari sifat komponennya, dan homogenitas makroskopik paduan multifase (heterogen) dicapai karena distribusi fase pengotor yang seragam dalam matriks logam.
Paduan biasanya diproduksi dengan mencampurkan komponen dalam keadaan cair dan kemudian didinginkan. Pada suhu leleh komponen yang tinggi, paduan diproduksi dengan mencampurkan bubuk logam diikuti dengan sintering (inilah cara, misalnya, banyak paduan tungsten diperoleh).
Paduan adalah salah satu bahan struktural utama. Diantaranya, paduan berbahan dasar Besi dan Aluminium adalah yang paling penting. Non-logam, seperti karbon, silikon, boron, dll., juga dapat dimasukkan ke dalam komposisi banyak paduan.Lebih dari 5 ribu paduan digunakan dalam teknologi.
Sumber
http://ru.wikipedia.org/
Ensiklopedia Investor. 2013 .
Sinonim:- - LOGAM, logam jantan, lat. Krushec; dan dalam bentuk kecil, dalam peleburan: kinglet. Dalam kehidupan sehari-hari, logam berharga dan mahal: emas, platinum, perak; sederhana: besi, tembaga, seng, timah, timah; kimia telah menemukan prinsip-prinsip seperti itu untuk hampir semua fosil yang terdiri dari... ... Kamus Penjelasan Dahl
Sebagian besar (93 dari 117) unsur kimia yang diketahui saat ini adalah logam.
Atom-atom dari berbagai logam memiliki banyak kesamaan dalam strukturnya, dan zat sederhana dan kompleks yang dibentuknya memiliki sifat yang serupa (fisika dan kimia).
Posisi dalam tabel periodik dan struktur atom logam.
Dalam tabel periodik, logam terletak di kiri dan di bawah garis putus-putus konvensional dari boron hingga astatin (lihat tabel di bawah). Hampir semua unsur s (kecuali H, He) adalah logam, kira-kira setengahnya R-elemen, semuanya D- Dan F-elemen ( lantanida Dan aktinida).
Kebanyakan atom logam mempunyai jumlah elektron yang kecil (sampai 3) elektron pada tingkat energi terluarnya; hanya beberapa atom unsur p (Sn, Pb, Bi, Po) yang mempunyai lebih banyak (dari empat sampai enam). Elektron valensi atom logam terikat lemah (dibandingkan dengan atom non-logam) pada nukleus. Oleh karena itu, atom logam relatif mudah menyerahkan elektron ini ke atom lain, bertindak sebagai reaksi kimia hanya sebagai zat pereduksi dan sekaligus berubah menjadi kation bermuatan positif:
Saya - ne – = Saya n+.
Berbeda dengan non-logam, atom logam hanya mempunyai bilangan oksidasi positif dari +1 hingga +8.
Kemudahan atom logam melepaskan elektron valensinya ke atom lain mencirikan aktivitas reduksi logam tersebut. Semakin mudah suatu atom logam melepaskan elektronnya, semakin kuat zat pereduksinya. Jika kita mengurutkan logam-logam tersebut dalam satu baris berdasarkan penurunan daya reduksinya dalam larutan air, kita mendapatkan persamaan yang diketahui: rangkaian perpindahan logam, yang juga disebut seri tegangan elektrokimia (atau aktivitas di dekatnya) logam (lihat tabel di bawah).
Prevalensi mlogam di alam.
Tiga logam teratas yang paling umum di kerak bumi (ini adalah lapisan permukaan planet kita, tebalnya sekitar 16 km) adalah aluminium, besi, dan kalsium. Yang kurang umum adalah natrium, kalium, dan magnesium. Tabel di bawah menunjukkan fraksi massa beberapa logam di kerak bumi.
zat besi dan kalsium. Yang kurang umum adalah natrium, kalium, dan magnesium. Tabel di bawah menunjukkan fraksi massa beberapa logam di kerak bumi.
Keberadaan logam di kerak bumi
| Logam | Logam | Fraksi massa di kerak bumi, % | |
|---|---|---|---|
| Al | 8,8 | Kr | 8,3 ∙ 10 -3 |
| Fe | 4,65 | Zn | 8,3 ∙ 10 -3 |
| Ca | 3,38 | Tidak | 8 ∙ 10 -3 |
| Tidak | 2,65 | Cu | 4,7 ∙ 10 -3 |
| K | 2,41 | hal | 1,6 ∙ 10 -3 |
| mg | 2,35 | Agustus | 7 ∙ 10 -6 |
| Ti | 0,57 | HG | 1,35 ∙ 10 -6 |
| M N | 0,10 | Au | 5 ∙ 10 -8 |
Unsur yang fraksi massanya di kerak bumi kurang dari 0,01% disebut langka. Logam langka mencakup, misalnya, semua lantanida. Jika suatu unsur tidak dapat terkonsentrasi di kerak bumi, yaitu tidak membentuk bijihnya sendiri, tetapi ditemukan sebagai pengotor bersama unsur lain, maka unsur tersebut diklasifikasikan sebagai linglung elemen. Misalnya, logam-logam berikut ini terdispersi: Sc, Ga, In, Tl, Hf.
Pada tahun 40-an abad XX. Ilmuwan Jerman Walter dan Ida Nolla mengutarakan gagasan tersebut. bahwa setiap batu bulat di trotoar mengandung semua unsur kimia dalam tabel periodik. Pada awalnya, kata-kata ini tidak mendapat persetujuan bulat dari rekan-rekan mereka. Namun, seiring bermunculannya metode analisis yang lebih akurat, para ilmuwan semakin yakin akan kebenaran kata-kata tersebut.
Karena semua organisme hidup berada dalam kontak dekat lingkungan, maka masing-masing unsur harus mengandung, jika tidak semua, sebagian besar unsur kimia dalam tabel periodik. Misalnya pada tubuh manusia dewasa fraksi massa zat anorganik adalah 6%. Di antara logam-logam tersebut, senyawa-senyawa tersebut mengandung Mg, Ca, Na, K. Banyak enzim dan senyawa organik aktif biologis lainnya dalam tubuh kita mengandung V, Mn, Fe, Cu, Zn, Co, Ni, Mo, Cr dan beberapa logam lainnya.
Tubuh orang dewasa rata-rata mengandung sekitar 140 g ion kalium dan sekitar 100 g ion natrium. Dengan makanan, kita mengonsumsi setiap hari dari 1,5 g hingga 7 g ion kalium dan dari 2 g hingga 15 g ion natrium. Kebutuhan ion natrium begitu besar sehingga harus ditambahkan secara khusus pada makanan. Hilangnya ion natrium secara signifikan (dalam bentuk NaCl dalam urin dan keringat) berdampak buruk bagi kesehatan manusia. Karena itu, saat cuaca panas, dokter menganjurkan minum air mineral. Namun, kandungan garam berlebih dalam makanan juga berdampak negatif terhadap fungsi kita organ dalam(terutama jantung dan ginjal).
Anda harus mengaktifkan JavaScript untuk memilihDan senyawa kimia lainnya. Untuk memperoleh logam murni dan penggunaan lebih lanjut, logam tersebut perlu diisolasi dari bijihnya dan dimurnikan. Jika perlu, lakukan doping dan pengolahan logam lainnya. Sains sedang mempelajari hal ini metalurgi. Metalurgi membedakan bijih logam besi (berdasarkan kelenjar) dan non-ferrous (tidak mengandung besi, hanya sekitar 70 unsur). Emas, perak dan platinum juga berlaku untuk logam mulia (mulia). . Selain itu, mereka terdapat dalam jumlah kecil di air laut, tumbuhan, dan organisme hidup (memainkan peran penting).
Diketahui bahwa tubuh manusia terdiri dari 3% logam. Yang terpenting di kami sel kalsium Dan sodium, terkonsentrasi di sistem limfatik. Magnesium terakumulasi di otot Dan sistem saraf , tembaga- V hati , besi- V darah.
Produksi
Logam sering kali diekstraksi dari bumi melalui penambangan, dan bijih yang dihasilkan menyediakan sumber unsur-unsur penting yang relatif kaya. Untuk menentukan lokasi bijih digunakan metode pencarian khusus, termasuk eksplorasi bijih dan penelitian deposit. Deposito biasanya dibagi menjadi karir(penambangan bijih di permukaan), dimana penambangan dilakukan dengan cara mengekstraksi tanah menggunakan alat berat, serta di bawah tanah tambang.
Logam biasanya diekstraksi dari bijih yang ditambang menggunakan reduksi kimia atau elektrolitik. DI DALAM pirometalurgi digunakan untuk mengubah bijih menjadi bahan baku logam suhu tinggi, V hidrometalurgi Kimia berair digunakan untuk tujuan yang sama. Metode yang digunakan bergantung pada jenis logam dan jenis kontaminasi.
Ketika bijih logam merupakan senyawa ionik dari logam dan non-logam, biasanya bijih tersebut dilebur - dipanaskan dengan zat pereduksi - untuk mengekstraksi logam murni. Banyak logam umum seperti besi, dicairkan menggunakan sebagai zat pereduksi karbon(diperoleh dari pembakaran batu bara). Beberapa logam seperti aluminium Dan sodium, tidak memiliki satu pun zat pereduksi yang dapat dibenarkan secara ekonomi dan diekstraksi menggunakan elektrolisa.
Kekerasan beberapa logam pada skala Mohs:
| Kekerasan | Logam |
|---|---|
| 0.2 | sesium |
| 0.3 | Rubidium |
| 0.4 | Kalium |
| 0.5 | Sodium |
| 0.6 | Litium |
| 1.2 | India |
| 1.2 | Talium |
| 1.25 | Barium |
| 1.5 | Strontium |
| 1.5 | galium |
| 1.5 | Timah |
| 1.5 | Memimpin |
| 1.5 | |
| 1.75 | Kalsium |
| 2.0 | Kadmium |
| 2.25 | Bismut |
| 2.5 | Magnesium |
| 2.5 | Seng |
| 2.5 | Lantanum |
| 2.5 | Perak |
| 2.5 | Emas |
| 2.59 | Itrium |
| 2.75 | Aluminium |
| 3.0 | Tembaga |
| 3.0 | Antimon |
| 3.0 | Torium |
| 3.17 | Skandium |
| 3.5 | Platinum |
| 3.75 | Kobalt |
| 3.75 | Paladium |
| 3.75 | Zirkonium |
| 4.0 | Besi |
| 4.0 | Nikel |
| 4.0 | Hafnium |
| 4.0 | mangan |
| 4.5 | Vanadium |
| 4.5 | Molibdenum |
| 4.5 | Rhodium |
| 4.5 | titanium |
| 4.75 | Niobium |
| 5.0 | Iridium |
| 5.0 | Rutenium |
| 5.0 | Tantalum |
| 5.0 | teknesium |
| 5.0 | Kromium |
| 5.5 | Berilium |
| 5.5 | Osmium |
| 5.5 | renium |
| 6.0 | Tungsten |
| 6.0 | β-Uranium |
Karena mudahnya kehilangan elektron, oksidasi logam dapat terjadi, yang dapat menyebabkan korosi dan degradasi properti lebih lanjut. Kemampuan untuk mengoksidasi dapat dikenali dari rangkaian aktivitas standar logam. Fakta ini menegaskan perlunya penggunaan logam dalam kombinasi dengan unsur lain ( paduan, yang paling penting adalah baja), paduannya dan penggunaan berbagai pelapis.
Untuk gambaran yang lebih tepat tentang sifat elektronik logam, perlu digunakan mekanika kuantum. Pada semua padatan dengan secukupnya simetri tingkat energi elektron masing-masing atom tumpang tindih dan membentuk pita yang diperbolehkan, dan pita yang dibentuk oleh elektron valensi disebut pita valensi. Lemahnya ikatan elektron valensi pada logam menyebabkan pita valensi pada logam sangat lebar, dan semua elektron valensi tidak cukup untuk mengisinya sepenuhnya.
Ciri mendasar dari zona yang terisi sebagian adalah bahwa bahkan pada tegangan minimum yang diterapkan, penataan ulang elektron valensi dimulai dalam sampel, yaitu aliran listrik.
Mobilitas elektron yang tinggi menyebabkan konduktivitas termal yang tinggi, serta kemampuan untuk memantulkan radiasi elektromagnetik secara spekuler (yang memberikan karakteristik kilau pada logam).
Beberapa logam
- Paru-paru:
- Lainnya:
Penerapan logam
Bahan bangunan
Bahan alat
Sejarah perkembangan gagasan tentang logam
Perkenalan manusia dengan logam dimulai dengan emas , perak Dan tembaga, yaitu dari logam-logam yang terdapat dalam keadaan bebas di permukaan bumi; kemudian mereka disatukan oleh logam-logam yang tersebar luas di alam dan mudah diisolasi dari senyawanya: timah , memimpin , besi Dan . Ketujuh logam ini sudah tidak asing lagi bagi umat manusia pada zaman dahulu. Di antara artefak Mesir kuno terdapat barang-barang emas dan tembaga, yang menurut beberapa data, berasal dari zaman 3000-4000 tahun yang jauh dari zaman sekarang. e.
Tujuh logam yang diketahui hanya ada di dalamnya Abad Pertengahan ditingkatkan seng , bismut , antimon dan pada awal abad ke-18 arsenik. Sejak pertengahan abad ke-18, jumlah logam yang ditemukan meningkat pesat dan pada awal abad ke-20 mencapai 65, dan pada awal abad ke-21 - hingga 96.
Tak satu pun dari industri kimia memberikan kontribusi yang besar terhadap pengembangan pengetahuan kimia seperti proses yang terkait dengan produksi dan pengolahan logam; Momen terpenting dalam sejarah kimia berhubungan dengan sejarahnya. Sifat-sifat logam sangat khas sehingga pada zaman paling awal emas, perak, tembaga, timah, timah, besi dan merkuri merupakan satu kelompok alami zat homogen, dan konsep “logam” mengacu pada konsep kimia paling kuno. Namun, pandangan tentang sifatnya kurang lebih suatu bentuk tertentu hanya muncul pada Abad Pertengahan alkemis. Kebenaran, ide Aristoteles tentang alam: terbentuknya segala sesuatu yang ada dari empat unsur (api, tanah, air dan udara) dengan demikian sudah menunjukkan kompleksitas logam; namun ide-ide ini terlalu kabur dan abstrak. Bagi para alkemis, konsep kompleksitas logam dan, sebagai akibatnya, keyakinan akan kemampuan untuk mengubah beberapa logam menjadi logam lain, untuk membuatnya secara artifisial, adalah konsep utama pandangan dunia mereka. Konsep ini merupakan kesimpulan alami dari sekian banyak fakta mengenai transformasi kimia logam yang telah terakumulasi pada saat itu. Faktanya, transformasi logam menjadi oksida yang sama sekali berbeda melalui kalsinasi sederhana di udara dan kembalinya logam dari oksida, pemisahan beberapa logam dari logam lain, pembentukan paduan dengan sifat berbeda dari logam aslinya. , dan seterusnya - semua ini sepertinya menunjukkan kompleksitas sifatnya.
Adapun sebenarnya transformasi logam menjadi emas, keyakinan akan kemungkinan hal ini didasarkan pada banyak fakta yang terlihat. Pada mulanya terbentuknya paduan yang warnanya mirip dengan emas, misalnya dari tembaga dan seng, di mata para alkemis sudah merupakan transformasi menjadi emas. Bagi mereka, tampaknya hanya warnanya yang perlu diubah, dan sifat logamnya juga akan berbeda. Secara khusus, eksperimen yang dilakukan dengan buruk, ketika zat yang mengandung campuran emas ini digunakan untuk mengubah logam dasar menjadi emas, berkontribusi besar terhadap keyakinan ini. Misalnya, pada akhir abad ke-18, seorang apoteker Kopenhagen meyakinkan bahwa perak murni secara kimia, jika dicampur dengan arsenik, sebagian akan berubah menjadi emas. Fakta ini dikonfirmasi oleh ahli kimia terkenal Guiton de Morveau dan menimbulkan banyak keributan. Segera diketahui bahwa arsenik yang digunakan untuk percobaan tersebut mengandung jejak perak dan emas.
Karena beberapa dari tujuh logam yang dikenal pada waktu itu lebih mudah mengalami transformasi kimia, yang lain lebih sulit, para alkemis membaginya menjadi mulia - sempurna, dan tercela - tidak sempurna. Yang pertama termasuk emas dan perak, yang terakhir termasuk tembaga, timah, timah, besi dan merkuri. Yang terakhir, yang memiliki sifat-sifat logam mulia, tetapi pada saat yang sama sangat berbeda dari semua logam dalam keadaan cair dan volatilitasnya, sangat menarik bagi para ilmuwan pada waktu itu, dan beberapa memisahkannya ke dalam kelompok khusus; perhatian yang ditariknya begitu besar sehingga merkuri mulai dianggap sebagai salah satu unsur pembentuk logam, dan dipandang sebagai pembawa sifat logam. Menerima keberadaan transisi dari beberapa logam ke logam lain, dari ketidaksempurnaan ke kesempurnaan, para alkemis berasumsi bahwa dalam kondisi biasa transformasi ini berlangsung sangat lambat, selama berabad-abad, dan, mungkin, bukan tanpa partisipasi misterius dari benda-benda langit, yang mana hal tersebut peran besar diberikan pada waktu itu dan dalam nasib manusia. Secara kebetulan, ada tujuh logam yang diketahui pada saat itu, serta tujuh planet yang diketahui, dan ini semakin menunjukkan adanya hubungan misterius di antara keduanya. Di kalangan alkemis, logam sering disebut planet; itu disebut emas Matahari, perak - Bulan, tembaga - Venus, timah - Jupiter, memimpin - Saturnus, besi - Mars dan merkuri - Air raksa. Ketika seng, bismut, antimon, dan arsenik ditemukan, benda-benda yang dalam segala hal mirip dengan logam, tetapi salah satu sifat paling khas dari logam, kelenturan, kurang berkembang, mereka dialokasikan ke dalam kelompok khusus - semimetal. Pembagian logam menjadi logam biasa dan semilogam sudah ada sejak pertengahan abad ke-18.
Penentuan komposisi logam pada awalnya hanya bersifat spekulatif. Pada awalnya, para alkemis menerima bahwa mereka terbentuk dari dua elemen - dan sulfur. Asal usul pandangan ini tidak diketahui; sudah ada pada abad ke-8. Oleh Geber bukti adanya merkuri dalam logam adalah ia melarutkannya, dan dalam larutan ini individualitasnya hilang, diserap oleh merkuri, yang tidak akan terjadi jika mereka tidak memiliki satu prinsip yang sama dengan merkuri. Selain itu, merkuri dan timbal menghasilkan sesuatu yang mirip dengan timah. Sedangkan untuk belerang, mungkin diambil karena diketahui senyawa belerang, menurut penampilan mirip dengan logam. Di masa depan, ide-ide sederhana ini, mungkin karena upaya yang gagal untuk memperoleh logam secara artifisial, menjadi sangat rumit dan membingungkan. Dalam konsep para alkemis, misalnya abad X-XIII, merkuri dan belerang yang membentuk logam tidak sama dengan merkuri dan belerang yang dimiliki para alkemis. Itu hanyalah sesuatu yang mirip dengan mereka, memiliki sifat khusus; sesuatu yang benar-benar ada dalam belerang dan merkuri biasa diekspresikan lebih banyak di dalamnya daripada di benda lain. Di bawah merkuri, yang merupakan bagian dari logam, mereka mewakili sesuatu yang menentukan kekekalannya, kilau logam, keuletannya, dengan kata lain, pembawa penampilan logam; belerang dimaksudkan sebagai pembawa variabilitas, dekomposisi, dan sifat mudah terbakar logam. Kedua unsur ini ditemukan dalam logam dalam proporsi yang berbeda dan, seperti yang dikatakan kemudian, difiksasi dengan cara yang berbeda; selain itu, tingkat kemurniannya bisa berbeda-beda. Menurut Geber, misalnya, emas terdiri dari sejumlah besar merkuri dan sejumlah kecil belerang, dengan kemurnian tertinggi dan paling tetap; sebaliknya dalam timah, mereka mengandung banyak belerang dan sedikit merkuri, yang tidak murni, tidak terfiksasi dengan baik, dll. Dengan semua ini, tentu saja, mereka ingin mengungkapkan perbedaan sikap logam terhadap satu-satunya bahan kimia yang kuat pada saat itu - api. Dengan berkembangnya lebih lanjut pandangan ini, dua unsur - merkuri dan belerang - tampaknya tidak cukup bagi para alkemis untuk menjelaskan komposisi logam; garam ditambahkan ke dalamnya, dan sedikit arsenik. Dengan ini mereka ingin menunjukkan bahwa selama semua transformasi logam, sesuatu yang tidak mudah menguap dan permanen tetap ada. Jika di alam “transformasi logam dasar menjadi logam mulia membutuhkan waktu berabad-abad”, maka para alkemis berusaha menciptakan kondisi di mana proses perbaikan dan pematangan ini akan berlangsung dengan cepat dan mudah. Karena hubungan erat kimia dengan kedokteran dan biologi pada waktu itu, gagasan tentang transformasi logam secara alami diidentikkan dengan gagasan tentang pertumbuhan dan perkembangan benda-benda yang terorganisir: transisi, misalnya misalnya, timah menjadi emas, pembentukan tanaman dari biji-bijian yang dibuang ke tanah dan, seolah-olah, membusuk, fermentasi, penyembuhan organ yang sakit pada seseorang - semua ini adalah fenomena pribadi dari satu proses kehidupan misterius yang umum, peningkatan , dan disebabkan oleh rangsangan yang sama. Oleh karena itu jelaslah bahwa prinsip misterius yang memungkinkan diperolehnya emas adalah menyembuhkan penyakit, mengubah tubuh manusia tua menjadi muda, dan seterusnya. Dari sinilah konsep batu bertuah yang indah muncul.
Mengenai perannya batu filsuf dalam transformasi logam dasar menjadi logam mulia, maka yang paling penting adalah instruksi mengenai transformasinya menjadi emas; sedikit yang dikatakan tentang produksi perak. Menurut beberapa penulis, batu bertuah yang sama mengubah logam menjadi perak dan emas; menurut yang lain, ada dua jenis zat ini: yang satu sempurna, yang lain kurang sempurna, dan yang terakhir berfungsi untuk menghasilkan perak. Mengenai jumlah batu bertuah yang dibutuhkan untuk transformasi, petunjuknya juga berbeda. Menurut beberapa orang, 1 bagiannya mampu mengubah 10.000.000 bagian logam menjadi emas, menurut yang lain - 100 bagian atau bahkan hanya 2 bagian. Untuk mendapatkan emas, mereka melebur sejumlah logam tidak mulia atau mengambil merkuri dan melemparkan batu bertuah ke sana; Beberapa meyakinkan bahwa transformasi terjadi secara instan, sementara yang lain - sedikit demi sedikit. Pandangan mengenai sifat logam dan kemampuan mereka untuk bertransformasi umumnya dianut selama berabad-abad hingga abad ke-17, ketika mereka mulai menyangkal semua ini dengan tajam, terutama karena pandangan ini memunculkan munculnya banyak penipu yang mengeksploitasi harapan dunia. mudah tertipu untuk mendapatkan emas. Saya terutama bergumul dengan ide-ide para alkemis Boyle“Saya ingin tahu,” katanya di suatu tempat, “bagaimana emas dapat dipecah menjadi merkuri, belerang, dan garam; Saya siap membayar biaya pengalaman ini; sedangkan bagiku, aku tidak akan pernah bisa mencapai hal ini.”
Setelah berabad-abad upaya yang sia-sia untuk memperoleh logam secara artifisial dan dengan banyaknya fakta yang terkumpul pada abad ke-17, misalnya, tentang peran udara dalam pembakaran, peningkatan berat logam selama oksidasi, yang, bagaimanapun, masih terjadi. diketahui Geber pada abad ke-8, pertanyaan tentang komposisi unsur logam tampaknya hampir berakhir; tetapi tren baru muncul dalam kimia, yang menghasilkan teori flogiston, dan solusi untuk masalah ini semakin tertunda untuk waktu yang lama.
Para ilmuwan pada masa itu sangat tertarik dengan fenomena pembakaran. Berdasarkan gagasan dasar filsafat pada masa itu, bahwa kesamaan sifat-sifat suatu benda harus bersumber dari kesamaan prinsip dan unsur-unsur penyusunnya, maka diterima bahwa benda-benda yang mudah terbakar mengandung unsur yang sama. Tindakan pembakaran dianggap sebagai tindakan penguraian, penguraian menjadi unsur-unsur; dalam hal ini unsur mudah terbakar dilepaskan dalam bentuk nyala api, sedangkan unsur lainnya tetap ada. Menyadari pandangan para alkemis tentang pembentukan logam dari tiga unsur, merkuri, belerang dan garam, dan menerima keberadaan nyata mereka dalam logam, belerang harus diakui sebagai prinsip yang mudah terbakar di dalamnya. Kemudian komponen lain dari logam tersebut jelas harus dikenali sebagai residu dari kalsinasi logam - “tanah”, seperti yang mereka katakan saat itu; oleh karena itu, merkuri tidak ada hubungannya dengan itu. Di sisi lain, belerang terbakar asam sulfat, yang oleh banyak orang, karena hal di atas, dianggap sebagai benda yang lebih sederhana daripada belerang, dan memasukkannya ke dalam benda dasar. Terjadi kebingungan dan kontradiksi. Bekher, untuk menyelaraskan konsep lama dengan konsep baru, menerima keberadaan tiga jenis bumi dalam logam: “bumi” itu sendiri, “bumi yang mudah terbakar” dan “tanah merkuri”. Dalam kondisi ini Stahl mengajukan teorinya. Menurutnya, sumber mudah terbakar bukanlah belerang atau zat lain yang diketahui, melainkan sesuatu yang tidak diketahui, yang disebutnya flogiston. Logam diduga terbentuk dari flogiston dan tanah; kalsinasi logam di udara disertai dengan pelepasan flogiston; kembalinya logam dari bumi dengan bantuan batu bara – zat yang kaya akan flogiston – adalah tindakan menggabungkan flogiston dengan bumi. Meskipun ada beberapa logam dan masing-masing logam menghasilkan tanahnya sendiri ketika dinyalakan, logam tersebut, sebagai suatu unsur, adalah satu, sehingga komponen logam ini memiliki sifat hipotetis yang sama dengan flogiston; namun, para pengikut Stahl terkadang menerima “elemen tanah” sebanyak jumlah logam. Kapan Cavendish ketika melarutkan logam dalam asam yang diperoleh hidrogen dan memeriksa sifat-sifatnya (ketidakmampuan untuk mendukung pembakaran, sifat mudah meledak bila bercampur dengan udara, dll.), ia mengenalinya sebagai flogiston Stahl; logam, menurut konsepnya, terdiri dari hidrogen dan “bumi”. Pandangan ini diterima oleh banyak pengikut teori flogiston.
Meskipun teori flogiston tampak selaras, ada fakta-fakta penting yang tidak dapat dikaitkan dengannya. Geber juga mengetahui bahwa berat logam bertambah ketika dibakar; Sedangkan menurut Stahl, mereka harus kehilangan flogiston: ketika flogiston disambungkan kembali ke “bumi”, berat logam yang dihasilkan akan lebih kecil dari berat “bumi”. Jadi, ternyata flogiston pasti memiliki sifat khusus - gravitasi negatif. Terlepas dari semua hipotesis cerdik yang diajukan untuk menjelaskan fenomena ini, hal itu tidak dapat dipahami dan membingungkan.
Kapan Lavoisier memperjelas peran udara selama pembakaran dan menunjukkan bahwa penambahan berat logam selama pembakaran berasal dari penambahan oksigen dari udara ke logam, dan dengan demikian menetapkan bahwa tindakan pembakaran logam bukanlah penguraian menjadi unsur-unsur, tetapi, sebaliknya, suatu tindakan koneksi, pertanyaan tentang kompleksitas logam diputuskan secara negatif. Logam diklasifikasikan sebagai unsur kimia sederhana, karena gagasan dasar Lavoisier bahwa benda sederhana adalah benda yang tidak mungkin diisolasi dari benda lain. Dengan penciptaan tabel periodik unsur kimia Mendeleev elemen logam mengambil tempat yang selayaknya di dalamnya.
Lihat juga
Catatan
Tautan
- S.P.Vukolov: // Kamus Ensiklopedis Brockhaus dan Efron: Dalam 86 volume (82 volume dan 4 tambahan). - Sankt Peterburg. , 1890-1907.(bagian sejarah)
| Tabel periodik | |
|---|---|
| Dmitri Ivanovich Mendeleev · hukum periodik · Kelompok elemen | |
| Format | Pendek· Berdasarkan blok · Diperpanjang· Diperbesar · Konfigurasi elektronik · Keelektronegatifan · Alternatif · Isotop unsur |
| Daftar elemen Oleh | Nama ·
Etimologi(untuk menghormati tempat, untuk menghormati penemunya) · Waktu pembukaan Keadaan oksidasi · Prevalensi (pada manusia) Stabilitas isotop |


