27.07.2019
1 métaux alcalins. Savez-vous comment
Résumé d'un cours de chimie de 9e sur le sujet :
" Connexions métaux alcalins et leur application."
Objectifs: Résumer et systématiser les connaissances sur les métaux alcalins et leurs composés ; se familiariser avec l'utilisation de ces composés dans la vie quotidienne et la production, leur importance dans la vie des organismes
Objectifs de la leçon:
1. Pendant le cours, assurer l'assimilation des propriétés chimiques des composés de métaux alcalins, de leur utilisation dans la vie quotidienne et dans la production, et de leur importance dans la vie des organismes.
Continuer à développer des compétences pédagogiques générales et des compétences liées au travail avec des réactifs chimiques.
2. Formation d'idées idéologiques de base sur les relations de cause à effet entre les phénomènes de la structure de l'atome d'un métal alcalin - les propriétés d'une substance simple - les propriétés des composés de métaux alcalins et leur application basée sur les propriétés.
3.Développez la capacité de comparer, de généraliser les faits étudiés et d'exprimer logiquement vos pensées lorsque vous répondez. Développer l'intérêt cognitif des écoliers en utilisant des données sur l'application des phénomènes étudiés dans la vie qui les entoure.
Type de cours: combiné - apprendre de nouveaux matériels à l'aide des TIC.
Équipement: manuel, craie, tableau noir, ordinateur, projecteur multimédia, écran, présentation du sujet de cours, fiches technologiques de cours pour les élèves, réactifs chimiques (solutions : soude, acide chlorhydrique, sulfate de cuivre, hydroxyde de zinc, phénolphtaléine) et verrerie de laboratoire (support avec des tubes à essai).
Pendant les cours
je .Organisation du temps.
II . Apprendre du nouveau matériel.
1.Vérification du matériel précédemment étudié sur le thème « Métaux alcalins ».
Devinez les énigmes :
1. Ils sont généralement stockés dans du kérosène et fonctionnent à l’eau,
Dans la nature, souviens-toi, désormais,
Il n'est nulle part libre
Il est possible de l'ouvrir dans les sels
La flamme en devient jaune
Et tu peux l'obtenir à partir du sel
Comment Davy l'a eu.
De quel élément parle-t-on ? (N / A)
2. Il réprime vigoureusement.
De l'humidité - hydrogène pur,
Il est remplacé par
Et lie étroitement l’oxygène.
Cet élément est caché dans les plantes
Par couleur violette
Il peut être ouvert dans les sels.
De quel élément parle-t-on ? (À).
1.Quels métaux avons-nous découvert lors de la dernière leçon ?
2.Pourquoi s’appellent-ils ainsi ?
3. Quelle est la caractéristique commune de la structure des atomes de tous les métaux alcalins ?
Test sur le thème : Métaux alcalins.
1. Les éléments suivants ne s'appliquent pas aux métaux alcalins : a) rubidium ; c) potassium; b) le césium ; d) le cuivre.
2.Formule électronique) 2) 8) 8) 1 correspond à l'élément : a) lithium ; c) potassium ; b) sodium;
3. Rayon atomique pour les éléments du groupe I du sous-groupe principal à charge nucléaire croissante :
a) change périodiquement ; c) ne change pas ; b) augmente ;
4. Les métaux alcalins présentent des caractéristiques très fortes :
UN) propriétés oxydantes; c) propriétés réparatrices ; b) propriétés amphotères ;
5..Les propriétés physiques des métaux alcalins n'incluent pas :
a) blanc argenté ; b) doux et léger ; d) réfractaire.
6. Lorsque les éléments du groupe I du sous-groupe principal interagissent avec l'eau, il se forme :
a) acide ; b) un alcali et de l'hydrogène sont libérés ; d) le sel.
7. Le sodium et le potassium sont stockés dans le kérosène car ils :
a) avoir une odeur âcre ; b) sont facilement oxydés à l'air ;
Maîtrise de soi : aucune erreur – « 5 », 1,2 erreurs – « 4 », 3 erreurs – « 3 », plus – « 2 »
Réponses : 1- d 2 - c 3 - b 4 - c 5 - d 6 – b 7 - b.
Maîtrise de soi : aucune erreur – « 5 », 1,2 erreurs – « 4 », 3,4 erreurs – « 3 », plus – « 2 »
2.Mise à jour des connaissances.
Est-il possible de trouver des métaux alcalins sous forme libre dans la nature ? Pourquoi?
Pouvez-vous deviner sous quelle forme de composés on les trouve dans la nature ?
Dans la nature, les métaux alcalins se trouvent uniquement sous forme de composés.
Na et K sont présents dans la nature sous forme de chlorures, sulfates, silicates, etc.
Li, Rb, Cs se trouvent dans divers minéraux.
Fr se produit dans les minerais radioactifs Ac et U.
Sur la table : des objets contenant des composés alcalins (soude, sel, piles AA, savon) et pose une question.
Regardez ces objets. Selon vous, qu’est-ce qu’ils ont en commun ?
1Qu’est-ce qu’un lien génétique ?
2. Faisons une série génétique de sodium.
Na → Na 2 O → 2NaOH → Na 2 CO 3
3. Quelles classes de composés forment les métaux alcalins ? Considérons leurs propriétés.
Pendant que les élèves expliquent le matériel et visionnent les diapositives, ils prennent des notes le long du plan, révélant les propriétés et les applications.
Oxydes de métaux alcalins
dur, blanc, facilement soluble.
b) Propriétés chimiques; Les élèves écrivent dans leur cahier : Les oxydes de métaux alcalins sont des oxydes basiques typiques. Comme tous les oxydes basiques, les oxydes de métaux alcalins réagissent avec l'eau, avec les oxydes acides, avec les acides.
Les gars écrivent les équations des réactions chimiques en utilisant l'oxyde de sodium comme exemple au tableau et dans leurs cahiers :
Na 2 O + H 2 O → 2NaOH;
Na 2 O + CO 2 → Na 2 CO 3 ;
Na 2 O + H 2 CO 3 → Na 2 CO 3 + H 2 O
Hydroxydes de métaux alcalins
.
a) propriétés physiques ; Les élèves notent les propriétés suivantes dans leur cahier : dur, blanc, très soluble, résistant à la chaleur, corrode les tissus et le papier.
b) propriétés chimiques
Briefing de sécurité lors de l'exécution de travaux de laboratoire.
Propriétés chimiques de l'hydroxyde de sodium.
Objectif : prouver expérimentalement les propriétés chimiques des métaux alcalins en utilisant l'exemple de l'hydroxyde sodium
Instructions
Versez de l'hydroxyde de sodium dans un tube à essai propre et ajoutez quelques gouttes de phénolphtaléine. Qu'observez-vous ?
Ajouter la solution dans le même tube à essai d'acide chlorhydrique. Qu'observez-vous ? Écrivez l’équation de la réaction.
NaOH + HCl → NaCl + H 2 O Les gars notent les équations d'une réaction chimique sous forme ionique au tableau et dans leurs cahiers.
Versez de l'hydroxyde de sodium dans un tube à essai propre et ajoutez une solution de sulfate de cuivre. Qu'observez-vous ? Écrivez l’équation de la réaction.
2NaOH + CuSO 4 → Na 2 SO 4 + Cu (OH) 2 Les gars notent les équations d'une réaction chimique sous forme ionique au tableau et dans leurs cahiers.
Tirez une conclusion sur les propriétés chimiques des hydroxydes de métaux alcalins.
Les hydroxydes de métaux alcalins réagissent avec les acides, les sels) (application - diapositive numéro 5.
Hydroxyde de sodium – NaOH – soude caustique, soude caustique, soude caustique.
Hydroxyde de potassium - KOH - potasse caustique.
NaOHet KOH sont des alcalis caustiques qui corrodent les tissus et le papier. Les élèves écrivent :Application : pour la production de soie artificielle , V production de savon et SMS, cosmétiques, médicaments, etc.
Sels de métaux alcalins
.
Propriétés physiques
. Les élèves écrivent les propriétés dans leur cahier. solides cristallins, presque tous solubles dans l’eau.
Travail indépendant avec le texte du manuel.
Application : remplir le tableau à partir de la diapositive n°5. Travail du manuel pp. 56 – 57
Formule de sel
Nom
application
NaHCO3
K2CO3
NaCl
Na 2 SO 4 ∙ 10 H 2 O
Na 2 CO 3 ∙ 10 H 2 O
Importance dans l'activité vitale des organismes - diapositive n°6.
Message étudiant sur le thème : « L'importance des composés de métaux alcalins dans la vie des organismes ».
Les ions sodium et potassium jouent un rôle biologique important : Na+ est le principal ion extracellulaire, présent dans le sang et la lymphe, et K+ est le principal ion intracellulaire. "Travailler ensemble. Le rapport de concentration de ces ions régule la pression artérielle dans un organisme vivant et assure le mouvement des solutions salines des racines vers les feuilles des plantes. Ions potassium - soutiennent le fonctionnement du muscle cardiaque, aident à lutter contre les rhumatismes et améliorent la fonction intestinale. Composés de potassium – éliminent le gonflement.
V. Consolidation
VI. Résumé de la leçon. Faire des marques.
Résumé de la leçon :
Quelles propriétés physiques et chimiques sont caractéristiques des oxydes et hydroxydes de métaux alcalins ?
Où sont utilisés les hydroxydes et les sels de métaux alcalins ?
Matériels supplémentaires. C'est intéressant.
Tâche : Pourquoi dans La Grèce ancienne Avant les longues campagnes par temps chaud, recommandait-on aux soldats de manger un morceau de pain très salé et de boire de l'eau ?
Les ions électrolytes s'hydratent facilement, de sorte que le sel de table retient l'eau dans le corps.
Problème : Pourquoi les Esquimaux mangent-ils très peu de sel ?
Selon une théorie scientifique, tous les animaux vivant sur terre, y compris les humains, descendent d’organismes apparus et vivant dans la mer. Le fluide corporel de ces créatures était composé d’eau de mer. Après avoir déménagé sur terre, ils ont conservé l’eau de mer comme fluide corporel. Mais la nature n’est pas en mesure de fournir aux organismes vivants une quantité suffisante de sel sous sa forme naturelle. Étant donné que le sel se dissout dans l’eau, une grande partie est éliminée du sol par l’eau de pluie et se déverse dans les rivières, les mers et les océans. De ce fait, les plantes poussant au sol ne contiennent pas suffisamment de sel. C’est pourquoi les animaux herbivores ont besoin de sel. Le corps perd chaque jour une certaine quantité de liquide contenant du sel et les aliments végétaux ne le reconstituent pas. Les animaux qui se nourrissent d’autres animaux n’ont pas besoin de sel supplémentaire. Ils obtiennent le sel dont ils ont besoin sur les corps de leurs victimes. Les Esquimaux mangent principalement de la viande, leurs besoins en sel sont donc très faibles.
Objectif : Pourquoi y a-t-il eu une baisse de la mortalité due aux maladies cérébrovasculaires en Angleterre au cours des dernières décennies ?
Cela est dû à une consommation accrue de fruits et légumes frais. Les fruits et légumes frais sont toujours riches en potassium et pauvres en sodium. Le sodium retient l'eau dans le corps, augmentant ainsi la pression artérielle, et le potassium, au contraire, contribue à le réduire. C'est pourquoi l'augmentation de la consommation de légumes et de fruits, en particulier de pommes, peut être considérée comme une mesure essentielle pour prévenir les maladies cérébrovasculaires.
D'OÙ VIENT L'AMOUR DES GENS POUR LE SEL ? .
Le sel sert à préserver les aliments de la détérioration et de la pourriture. Pour conserver les aliments (à l’époque où il n’y avait pas encore de réfrigérateurs ni de congélateurs), on utilisait du sel. Après avoir goûté des légumes en saumure, les gens ont commencé à mariner, fermenter et faire tremper les légumes frais. Une personne est tellement habituée à tout saler qu'elle est même prête à supporter certaines maladies, mais à ne pas passer à un régime sans sel. Peu à peu, j’ai pris l’habitude de saler toutes sortes d’aliments sans même les essayer.
BEAUCOUP DE SEL - PEU DE POTASSIUM, PEU DE POTASSIUM - BEAUCOUP DE MALADIES
La question du sel est une question d’équilibre potassium-sodium. C’est extrêmement important dans le corps. Le potassium et le sodium sont constamment en compétition pour leur présence dans les cellules. Le sel de table ne contient pas de potassium, il est entièrement composé de sodium. Notre corps a un besoin urgent de potassium, qui devrait être 4 fois plus élevé que le sodium. Le corps collecte du potassium partout, mais une consommation excessive de sel de table annule tous ses efforts. Par conséquent, avec une consommation excessive de sel, un manque de potassium se produit, ce qui entraîne avec le temps un certain nombre de maux : fatigue physique et mentale, manque de sommeil, crampes, douleurs articulaires.
L'excès de sodium (sel) surcharge le cœur. Vous voulez savoir si vous consommez trop de sel ? Allez devant le miroir : un cercle blanc autour de l’iris de l’œil indique une consommation excessive de sel.
Potassium caustique
Le potassium caustique est utilisé pour la production d'engrais, de caoutchouc synthétique, d'électrolytes pour batteries, de réactifs, et est utilisé dans l'industrie pharmaceutique et d'autres secteurs de l'économie nationale.
Le potassium caustique est transporté par rail et par route conformément aux règles de transport de marchandises en vigueur pour ce type de transport.
Le potassium caustique est stocké dans un récipient hermétiquement fermé, car il « se propage » dans l’air, en absorbant l’humidité.
Son nom traditionnel « potassium caustique » reflète l’effet corrosif de cette substance sur les tissus vivants. Si le potassium caustique entre en contact avec la peau, des brûlures chimiques sont possibles.
Les savons mous sont obtenus en saponifiant des huiles et des graisses avec du potassium caustique. Tous ces savons ont une consistance douce et crémeuse.
Hydroxyde de sodium.
L'alcali le plus courant. Plus de 57 millions de tonnes d’alcali caustique sont produites et consommées chaque année dans le monde.
La soude caustique est utilisée dans une grande variété d'industries et pour les besoins domestiques :
Dans l'industrie des pâtes et papiers dans la production de papier, carton, fibres artificielles, panneaux de fibres de bois.
Pour la saponification des graisses dans la production de savon, shampoing et autres détergents.
Dans les industries chimiques - pour neutraliser les acides et les oxydes d'acide, comme réactif ou catalyseur dans réactions chimiques et etc.
La soude caustique (hydroxyde de sodium) est une substance caustique et corrosive. Il appartient aux substances de la 2e classe de danger. Il faut donc être prudent lorsque l’on travaille avec.
En cas de contact avec la peau, les muqueuses et les yeux, de graves brûlures chimiques se forment. Si les surfaces muqueuses entrent en contact avec un alcali caustique, il est nécessaire de rincer la zone touchée avec un jet d'eau, et en cas de contact avec la peau, avec une solution faible d'acide acétique.
Sur le lithium - vers les étoiles
Les fabricants de téléphones portables, d’appareils de poche et d’ordinateurs portables ont cruellement besoin de ce métal. L’énergie nucléaire consomme du lithium (Li) en grande quantité ; selon les théoriciens, c’est ce métal alcalin qui peut fournir la clé de l’énergie thermonucléaire. Être le plus puissant substance psychotrope, Li est utilisé en psychiatrie militaire et appliquée (et la nature de l'effet de Li sur la psyché humaine n'est pas entièrement comprise). Le deutéride de lithium est utilisé dans une bombe à hydrogène comme substance active et comme régulateur de puissance d'explosion.
Ce métal est également nécessaire à l’exploration de l’espace lointain.
Routage pour les étudiants pour la leçon
Sujet : Composés de métaux alcalins.
Test
Hydrures. Le plus stable est l’hydrure de lithium, qui s’obtient facilement en faisant passer de l’hydrogène sur du lithium chauffé. LiH est une poudre cristalline blanche avec un point de fusion de 680 o C. Lorsque haute température LiH est extrêmement réactif. Se décompose vigoureusement avec de l'eau :
LiH + H 2 O = LiOH + H 2
Oxydes. Le plus stable est Li 2 O. Les oxydes de lithium et de sodium sont blancs, le reste est jaune. De plus, l’intensité de la couleur augmente avec l’augmentation du numéro atomique de l’élément.
Peroxydes. Produit en brûlant des métaux dans un excès d’oxygène. Les peroxydes de métaux alcalins peuvent être considérés comme des dérivés du peroxyde d'hydrogène car Ils interagissent avec les acides et l’eau pour former du peroxyde d’hydrogène :
M 2 O 2 + H 2 SO 4 = M 2 SO 4 + H 2 O 2
M 2 O 2 + 2H 2 O = 2MOH + H 2 O 2
Le plus important est le peroxyde de sodium, utilisé pour produire de l'oxygène dans les espaces clos (par exemple, Sous-marin):
2Na 2 O 2 + 2CO 2 = 2Na 2 CO 3 + 2O 2
Hydroxydes. En technologie, ils sont appelés alcalis caustiques (NaOH - soude caustique, KOH - potassium caustique). Ce sont des substances incolores et fusibles. À l’état fondu, ils interagissent avec le verre, la porcelaine et le platine. Ainsi, la fusion des alcalis s'effectue dans des creusets en argent ou en fer, avec lesquels ils n'interagissent pas. Les hydroxydes sont très solubles dans l’eau et dégagent une chaleur élevée.
Les hydroxydes sont préparés des manières suivantes :
a) Interaction des métaux ou oxydes avec l'eau :
Li 2 O + H 2 O = 2LiOH
Cette réaction est utilisée uniquement pour produire des hydroxydes très purs.
b) La réaction de caustication est la méthode connue la plus ancienne pour produire de la soude caustique. Cette méthode consiste à traiter une solution de soude avec de l'hydroxyde de calcium (chaux éteinte) pendant l'ébullition. Le carbonate de calcium insoluble obtenu est filtré ou un liquide clair en est décanté :
Na 2 CO 3 + Ca(OH) 2 = 2NaOH + CaCO 3
La solution d'hydroxyde de sodium obtenue est concentrée par évaporation sous vide. La soude caustique solide est fondue à 500 °C pour éliminer complètement l'eau et on obtient du NaOH contenant 3 à 4 % de Na 2 CO 3. Le NaOH ainsi obtenu est appelé « soude caustique ».
c) L'électrolyse des chlorures de métaux alcalins en solution aqueuse est une méthode industrielle moderne permettant de produire simultanément du NaOH et du KOH avec du chlore. Lorsqu'une solution de NaCl est soumise à une électrolyse avec des électrodes inertes (platine, graphite), du chlore est libéré à l'anode et de l'hydrogène à la cathode. Les ions Na + et OH - s'accumulent dans l'espace cathodique, qui forment NaOH.
d) Par fusion de carbonates de métaux alcalins avec des oxydes et traitement ultérieur de l'alliage avec de la vapeur d'eau :
Fe 2 O 3 + Na 2 CO 3 = 2NaFeO 2 + CO 2
2NaFeO 2 + H 2 O = 2NaOH + Fe 2 O 3
Les alcalis sont les matières premières les plus importantes dans industrie chimique pour la production de colorants, de verres, de savon, de papier, de fibres artificielles, de médicaments.
Sel. NaCl et KCl sont présents en grande quantité dans la nature. Le NaCl (sel de table) se trouve dans eau de mer(en moyenne 2,7%) et sous forme de sel gemme dans des dépôts pouvant atteindre plusieurs kilomètres d'épaisseur. Sous leur forme pure, NaCl et KCl sont obtenus à partir de chlorures naturels par recristallisation. Les sels de lithium sont obtenus à partir du carbonate de lithium naturel. L'obtention de sels de rubidium et de césium est associée à des difficultés, car leur solubilité est très proche de celle des sels de potassium. Habituellement, ils partent des eaux-mères restant après la recristallisation de la carnallite et en isolent le rubidium et l'alun de césium, qui sont purifiés par recristallisation. Le rubidium est séparé du césium grâce aux différentes solubilités de leurs carbonates dans l'alcool.
Parmi les nitrates, NaNO 3 et KNO 3 sont d'une importance pratique. Les noms techniques sont le nitrate de sodium et le nitrate de potassium. Les deux sels sont utilisés comme engrais minéraux. KNO 3 est également utilisé pour la production de poudre noire (NaNO 3 n'est pas utilisé en raison de son hygroscopique).
L'acide carbonique H 2 CO 3 donne deux séries de carbonates de métaux alcalins, acides (MHCO 3) et moyens (M 2 CO 3). Les carbonates acides (hydrocarbonates, bicarbonates) sont connus pour tous les métaux alcalins sauf le lithium. À l'exception du carbonate de lithium, tous les carbonates neutres sont très solubles dans l'eau. Na 2 CO 3 – soude, parfois présente naturellement dans les eaux de certains lacs et sources minérales. La soude est obtenue par la méthode à l'ammoniac : une solution de sel de table est saturée d'ammoniac et de dioxyde de carbone. Dans ce cas, NaHCO 3 précipite, car la soude est moins soluble que NH 4 Cl :
NaCl + H 2 O + CO 2 + NH 3 = NaHCO 3 ¯ + NH 4 Cl
2NaHCO 3 → Na 2 CO 3 + CO 2 + H 2 O
K 2 CO 3 – potasse, poudre blanche hygroscopique, hautement soluble dans l'eau. Préparé par carbonatation d'hydroxyde de potassium :
2KOH + CO 2 = K 2 CO 3 + H 2 O
La potasse est utilisée dans les industries du savon et du verre, dans la teinture et le blanchiment de la laine, dans la production de cyanure de potassium et dans la synthèse organique.
Acide sulfurique donne deux séries de sulfates de métaux alcalins - acides et moyens.
Na 2 SO 4 est obtenu comme sous-produit dans la production d'acide chlorhydrique à partir de chlorure de sodium et d'acide sulfurique. A partir de solutions aqueuses, le sulfate de sodium cristallise sous forme de Na 2 SO 4. 10H 2 O, en technologie cet hydrate cristallin est appelé sel de Glauber. Utilisé dans la teinture des tissus en coton et en médecine.
· · ·§ 96. Alcaline
Le groupe des métaux alcalins comprend les séries de métaux suivantes : Li, Na, K, Rb, Cs, Fr. Ils appartiennent au sous-groupe principal du groupe I du tableau périodique.
Tous ces éléments sont similaires dans la mesure où il y a un électron sur leur couche électronique externe (tableau 18)/.
Les éléments alcalins font partie des éléments s. L'électron de la couche électronique externe d'un atome de métal alcalin est le plus éloigné du noyau par rapport aux autres éléments de la même période, c'est-à-dire que le rayon d'un atome de métal alcalin est le plus grand par rapport aux rayons des atomes d'autres éléments de la même période. même période. Exigible
|
Frais de base |
Nombre d'électrons dans les niveaux d'énergie |
Rayon atomique |
|||||||
avec cela, l'électron de valence de la couche externe des atomes de métaux alcalins est facilement éliminé, les transformant en ions positifs à charge unique. Cela est dû au fait que les composés de métaux alcalins avec d'autres éléments sont construits selon le type de liaison ionique.
Dans les réactions redox, ils se comportent comme des agents réducteurs puissants, et cette capacité augmente d'un métal à l'autre avec l'augmentation de la charge du noyau atomique.
§ 97. Sodium
La configuration électronique de l'atome de sodium est ls 2 2s 2 2p 6 3s 1. La structure de sa couche externe :
Le sodium est présent dans la nature uniquement sous forme de sels. Le sel de sodium le plus courant est le sel de table NaCl, ainsi que le minéral sylvinite KCl · NaCl et certains sels d'acide sulfurique, par exemple le sel de Glauber Na2SO4 · 10H2O, trouvés en grande quantité dans le golfe Kara-Bogaz-Gol de la mer Caspienne.
A partir du sel de table NaCl, le sodium métallique est obtenu par électrolyse du sel fondu. L'installation d'électrolyse est représentée sur la Fig. 76. Les électrodes sont plongées dans du sel fondu. Les espaces anodiques et cathodiques sont séparés par un diaphragme qui isole le sodium formé afin qu'une réaction inverse ne se produise pas. L'ion sodium positif accepte un électron de la cathode et devient un atome de sodium neutre. Les atomes de sodium neutres s'accumulent à la cathode sous forme de métal fondu. Le processus se produisant à la cathode peut être représenté par le diagramme suivant :
Na + + Na 0 .
Puisque l’acceptation d’électrons se produit à la cathode et que toute acceptation d’électrons par un atome ou un ion est une réduction, les ions sodium à la cathode sont réduits. À l'anode, les ions chlore cèdent des électrons, c'est-à-dire le processus d'oxydation et de libération de substances libres.
du chlore gazeux, qui peut être représenté par le schéma suivant :
Cl — — e— → Cl0
Le sodium métallique obtenu est de couleur blanc argenté et peut être facilement coupé avec un couteau. Une coupe de sodium, si elle est examinée immédiatement après la coupe, a un éclat métallique brillant, mais s'estompe rapidement en raison de l'oxydation extrêmement rapide du métal.
![]()
Riz. 76. Schéma d'installation pour l'électrolyse du sel fondu.
1 - cathode annulaire ; 2 - cloche pour éliminer le chlore gazeux de l'espace anodique
Si le sodium est oxydé dans une petite quantité d'oxygène à une température d'environ 180°, on obtient de l'oxyde de sodium :
4Na + O2 = 2Na2O.
Lorsqu'il est brûlé dans l'oxygène, le peroxyde de sodium est produit :
2Na + O2 = Na2O2.
Dans ce cas, le sodium brûle avec une flamme jaune éblouissante.
En raison de l'oxydation facile et rapide du sodium, il est stocké sous une couche de kérosène ou de paraffine, ce qui est préférable, car une certaine quantité d'air se dissout encore dans le kérosène et l'oxydation du sodium, bien que lente, se produit toujours.
Le sodium peut se combiner avec l'hydrogène - hydrure NaH, dans lequel il présente un état d'oxydation de 1. Il s'agit d'un composé de type sel qui, par la nature de la liaison chimique et l'ampleur de l'état d'oxydation, diffère des hydrures volatils d'éléments des principaux sous-groupes des groupes IV. -VII.
Le sodium métallique peut réagir non seulement avec l'oxygène et l'hydrogène, mais également avec de nombreuses substances simples et complexes. Par exemple, broyé dans un mortier avec du soufre, le sodium réagit violemment avec celui-ci, formant :
2Na + S = Na2S
La réaction s'accompagne d'épidémies, vous devez donc garder le mortier loin de vos yeux et envelopper votre main dans une serviette. Pour la réaction, vous devez prendre de petits morceaux de sodium.
Le sodium brûle vigoureusement dans le chlore pour former du chlorure de sodium, ce qu'il est particulièrement intéressant d'observer dans un tube de chlorure de calcium dans lequel un courant de chlore traverse du sodium fondu et très chauffé :
2Na + Cl2 = 2NaCl
Le sodium réagit non seulement avec des substances simples, mais aussi avec des substances complexes, telles que l'eau, en le déplaçant, car il est très métal actif, dans la série de tensions est bien à gauche de l'hydrogène et déplace facilement ce dernier de l'eau :
2Na + 2H2O = 2NaOH + H2
Un feu de métal alcalin ne peut pas être éteint avec de l'eau. Il est préférable de le remplir de poudre de carbonate de sodium. En présence de sodium, la flamme incolore d'un brûleur à gaz devient jaune.
Le sodium métallique peut être utilisé comme catalyseur en synthèse organique, par exemple dans la production de caoutchouc synthétique à partir de butadiène. Il sert de matière première pour la production d’autres composés du sodium, tels que le peroxyde de sodium.
■ 27. À l'aide des équations des réactions impliquant le sodium métallique données dans le texte, prouver qu'il se comporte comme un agent réducteur.
28. Pourquoi le sodium ne peut-il pas être stocké dans l’air ?
29. Un étudiant a plongé un morceau de sodium dans une solution de sulfate de cuivre, dans l'espoir de déplacer le sel métallique du sel. Au lieu de métal rouge, le résultat était un précipité bleu gélatineux. Décrivez les réactions qui se sont produites et écrivez leurs équations sous formes moléculaires et ioniques. Comment les conditions de réaction doivent-elles être modifiées pour que la réaction conduise au résultat souhaité ? Écrivez les équations sous forme moléculaire, ionique complète et abrégée.
30. 2,3 g de sodium métallique ont été placés dans un récipient contenant 45 ml d'eau. Quelle est la quantité d’hydroxyde de sodium formée à la fin de la réaction ?
31. Quels moyens peut-on utiliser pour éteindre un incendie de sodium ? Donnez une réponse motivée.
§ 98. Composés oxygénés du sodium. Hydroxyde de sodium
Les composés oxygénés du sodium, comme déjà mentionné, sont l'oxyde de sodium Na2O et le peroxyde de sodium Na2O2.
L'oxyde de sodium Na2O n'est pas particulièrement important. Il réagit vigoureusement avec l'eau, formant de la soude caustique :
Na2O + H2O = 2NaOH
Le peroxyde de sodium Na202 est une poudre jaunâtre. Il peut être considéré comme une sorte de sel de peroxyde d’hydrogène, car sa structure est la même que celle du H2O2. Comme le peroxyde de sodium, c’est un puissant agent oxydant. Lorsqu'il est exposé à l'eau, il forme un alcali et :
Na2O2 + H2O = H2O2 + 2NaOH
se forme également par l'action d'acides dilués sur le peroxyde de sodium :
Na2O2 + H2SO4 = H2O2 + Na2SO4
Toutes les propriétés ci-dessus du peroxyde de sodium lui permettent d'être utilisé pour blanchir tous les matériaux possibles.
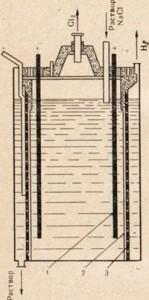
Riz. 77. Schéma d'une installation d'électrolyse d'une solution de sel de table.
1 - anode; 2 - diaphragme séparant les espaces anodique et cathodique ; 3-cathode
Un composé de sodium très important est l'hydroxyde de sodium, ou hydroxyde de sodium, NaOH. On l'appelle aussi soude caustique, ou simplement caustique.
Pour obtenir de la soude caustique, on utilise du sel de table, le composé naturel de sodium le moins cher, en le soumettant à une électrolyse, mais dans ce cas, on n'utilise pas de matière fondue, mais une solution saline (Fig. 77). Pour une description du processus d'électrolyse d'une solution de sel de table, voir § 33. Sur la Fig. 77 montre que les espaces anodiques et cathodiques sont séparés par un diaphragme. Ceci est fait pour que les produits résultants n'interagissent pas les uns avec les autres, par exemple Cl2 + 2NaOH = NaClO + NaCl + H2O.
La soude caustique est un solide cristallin blanc, hautement soluble dans l'eau. Lorsque la soude caustique est dissoute dans l'eau, elle libère un grand nombre de chauffer et la solution devient très chaude. La soude caustique doit être stockée dans des récipients bien fermés pour la protéger de la pénétration de la vapeur d'eau, sous l'influence de laquelle elle peut devenir très hydratée, ainsi que du dioxyde de carbone, sous l'influence duquel la soude caustique peut progressivement se transformer en carbonate de sodium. :
2NaOH + CO2 = Na2CO3 + H2O.
La soude caustique est un alcali typique, donc les précautions à prendre lorsque l'on travaille avec elle sont les mêmes que lorsque l'on travaille avec d'autres alcalis.
La soude caustique est utilisée dans de nombreuses industries, par exemple pour la purification des produits pétroliers, la production de savon à partir de graisses, dans l'industrie du papier, dans la production de fibres et de colorants artificiels, dans la production de médicaments, etc. 78).
Notez les domaines d'application de la soude caustique dans votre cahier.
Parmi les sels de sodium, il faut noter tout d'abord le sel de table NaCl, qui sert de matière première principale pour la production de soude caustique et de sodium métallique (pour plus d'informations sur ce sel, voir page 164), la soude Na2CO3 (voir page 278), Na2SO4 (voir page 224), NaNO3 (voir page 250), etc.
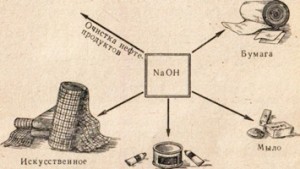
Riz. 78. Utilisation de soude caustique
■ 32. Décrire la méthode de production d'hydroxyde de sodium par électrolyse du sel de table.
33. La soude caustique peut être préparée en traitant du carbonate de sodium avec de la chaux éteinte. Notez les formes moléculaires et ioniques de l'équation de cette réaction et calculez également la quantité de soude contenant 95 % de carbonate qui sera nécessaire pour produire 40 kg d'hydroxyde de sodium.
34. Pourquoi, lors du stockage d'une solution de soude caustique dans des flacons avec des bouchons rodés, les bouchons « collent » et ne peuvent pas être retirés ? Si vous laissez la bouteille retournée dans l'eau pendant un certain temps, le bouchon peut être facilement retiré. Expliquez, en donnant des équations de réaction, quels types de processus se produisent dans ce cas.
35. Écrivez des équations de réaction sous formes moléculaires et ioniques qui caractérisent les propriétés de la soude caustique en tant qu'alcali typique.
36. Quelles précautions faut-il prendre lorsqu'on travaille avec de la soude caustique ? Quelles sont les premières mesures de secours à prendre en cas de brûlure à la soude caustique ?
§ 99. Potassium
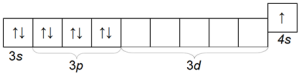
Le potassium K est également un métal alcalin assez courant, différent du sodium par la taille de son rayon atomique (quatrième période) et ayant donc une activité chimique plus grande que le sodium. La configuration électronique de l'atome de potassium est 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1.
La structure de sa couche électronique externe
Le potassium est un métal mou qui se coupe bien avec un couteau. Pour éviter l'oxydation, il est, comme le sodium, stocké sous une couche de kérosène.
Le potassium réagit avec l'eau encore plus violemment que le sodium, formant un alcali et libérant de l'hydrogène, qui enflamme :
2K + 2H2O = 2KOH + H2.
Lorsqu'il est brûlé dans l'oxygène (et il est recommandé de prendre des morceaux de métal encore plus petits pour la combustion que pour brûler du sodium), il brûle, comme le sodium, très vigoureusement pour former du peroxyde de potassium.
Il faut savoir que le potassium est bien plus dangereux que le sodium en circulation. Une forte explosion peut se produire même lors de la réduction du potassium, vous devez donc le manipuler avec encore plus de précautions.
L'hydroxyde de potassium, ou hydroxyde de potassium KOH, est une substance cristalline blanche. Le potassium caustique est en tous points similaire à la soude caustique. Ils sont largement utilisés dans l'industrie du savon, mais leur production est un peu plus coûteuse, ils ne sont donc pas utilisés de la même manière que NaOH.
Il convient de noter particulièrement les sels de potassium, car certains d'entre eux sont largement utilisés comme engrais. Il s'agit du chlorure de potassium KCl, du nitrate de potassium KNO3, qui est également un engrais azoté.
■ 37. Comment expliquer que le potassium caustique soit chimiquement plus actif que la soude caustique ?
38. Un morceau de potassium a été plongé dans un cristalliseur avec de l'eau. Une fois la réaction terminée, on y dépose un peu de zinc sous forme d'un précipité gélatineux blanc. Le précipité a disparu et lorsque la solution a été testée avec de la phénolphtaléine, cette dernière est devenue pourpre. Quels processus chimiques ont eu lieu ici ?
Lesquels sont en solution ? Donnez une réponse motivée.
39. Pourquoi le potassium, comme tous les métaux alcalins, est-il classé comme membre de la famille des éléments S ?
Les métaux alcalins réagissent facilement avec les non-métaux :
2K + I2 = 2KI
2Na + H2 = 2NaH
6Li + N 2 = 2Li 3 N (la réaction se produit à température ambiante)
2Na + S = Na 2 S
2Na + 2C = Na 2 C 2
Dans les réactions avec l'oxygène, chaque métal alcalin montre sa propre individualité : lorsqu'il est brûlé dans l'air, le lithium forme un oxyde, le sodium - le peroxyde, le potassium - le superoxyde.
4Li + O2 = 2Li2O
2Na + O 2 = Na 2 O 2
K + O 2 = KO 2
Préparation de l'oxyde de sodium :
10Na + 2NaNO 3 = 6Na 2 O + N 2
2Na + Na 2 O 2 = 2Na 2 O
2Na + 2NaON = 2Na 2 O + H 2
L'interaction avec l'eau conduit à la formation d'alcali et d'hydrogène.
2Na + 2H 2 O = 2NaOH + H 2
Interaction avec les acides :
2Na + 2HCl = 2NaCl + H2
8Na + 5H 2 SO 4 (conc.) = 4Na 2 SO 4 + H 2 S + 4H 2 O
2Li + 3H 2 SO 4 (conc.) = 2LiHSO 4 + SO 2 + 2H 2 O
8Na + 10HNO 3 = 8NaNO 3 + NH 4 NO 3 + 3H 2 O
Lors de l'interaction avec l'ammoniac, des amides et de l'hydrogène se forment :
2Li + 2NH 3 = 2LiNH 2 + H 2
Interaction avec des composés organiques :
H ─ C ≡ C ─ H + 2Na → Na ─ C≡C ─ Na + H 2
2CH 3 Cl + 2Na → C 2 H 6 + 2NaCl
2C 6 H 5 OH + 2Na → 2C 6 H 5 ONa + H 2
2CH 3 OH + 2Na → 2 CH 3 ONa + H 2
2СH 3 COOH + 2Na → 2CH 3 COOOONa + H 2
Une réaction qualitative aux métaux alcalins est la coloration de la flamme par leurs cations. L’ion Li + colore la flamme en rouge carmin, l’ion Na + – jaune, K + – violet.
Composés de métaux alcalins
Oxydes.
Les oxydes de métaux alcalins sont des oxydes basiques typiques. Ils réagissent avec les oxydes acides et amphotères, les acides et l'eau.
3Na 2 O + P 2 O 5 = 2Na 3 PO 4
Na 2 O + Al 2 O 3 = 2NaAlO 2
Na 2 O + 2HCl = 2NaCl + H 2 O
Na 2 O + 2H + = 2Na + + H 2 O
Na 2 O + H 2 O = 2NaOH
Peroxydes.
2Na 2 O 2 + CO 2 = 2Na 2 CO 3 + O 2
Na 2 O 2 + CO = Na 2 CO 3
Na 2 O 2 + SO 2 = Na 2 SO 4
2Na 2 O + O 2 = 2Na 2 O 2
Na 2 O + NON + NON 2 = 2NaNO 2
2Na 2 O 2 = 2Na 2 O + O 2
Na 2 O 2 + 2H 2 O (froid) = 2NaOH + H 2 O 2
2Na 2 O 2 + 2H 2 O (hor.) = 4NaOH + O 2
Na 2 O 2 + 2HCl = 2NaCl + H 2 O 2
2Na 2 O 2 + 2H 2 SO 4 (horizon divisé) = 2Na 2 SO 4 + 2H 2 O + O 2
2Na 2 O 2 + S = Na 2 SO 3 + Na 2 O
5Na 2 O 2 + 8H 2 SO 4 + 2KMnO 4 = 5O 2 + 2MnSO 4 + 8H 2 O + 5Na 2 SO 4 + K 2 SO 4
Na 2 O 2 + 2H 2 SO 4 + 2NaI = I 2 + 2Na 2 SO 4 + 2H 2 O
Na 2 O 2 + 2H 2 SO 4 + 2FeSO 4 = Fe 2 (SO 4) 3 + Na 2 SO 4 + 2H 2 O
3Na 2 O 2 + 2Na 3 = 2Na 2 CrO 4 + 8NaOH + 2H 2 O
Bases (alcalis).
2NaOH (excès) + CO 2 = Na 2 CO 3 + H 2 O
NaOH + CO 2 (excès) = NaHCO 3
SO 2 + 2NaOH (excès) = Na 2 SO 3 + H 2 O
SiO 2 + 2NaOH Na 2 SiO 3 + H 2 O
2NaOH + Al 2 O 3 2NaAlO 2 + H 2 O
2NaOH + Al 2 O 3 + 3H 2 O = 2Na
NaOH + Al(OH) 3 = Na
2NaOH + 2Al + 6H 2 O = 2Na + 3H 2
2KOH + 2NO2 + O2 = 2KNO3 + H2O
KOH + KHCO 3 = K 2 CO 3 + H 2 O
2NaOH + Si + H 2 O = Na 2 SiO 3 + H 2
3KOH + P 4 + 3H 2 O = 3KH 2 PO 2 + PH 3
2KOH (froid) + Cl 2 = KClO + KCl + H 2 O
6KOH (chaud) + 3Cl 2 = KClO 3 + 5KCl + 3H 2 O
6NaOH + 3S = 2Na2S + Na2SO3 + 3H2O
2NaNO 3 2NaNO 2 + O 2
NaHCO 3 + HNO 3 = NaNO 3 + CO 2 + H 2 O
NaI → Na + + I –
à la cathode : 2H 2 O + 2e → H 2 + 2OH – 1
à l'anode : 2I – – 2e → I 2 1
2H2O + 2I – ![]() H 2 + 2OH – + I 2
H 2 + 2OH – + I 2
2H2O + 2NaI ![]() H 2 + 2NaOH + I 2
H 2 + 2NaOH + I 2
2NaCl ![]() 2Na + Cl2
2Na + Cl2
à la cathode à l'anode
2Na 2 HPO 4 Na 4 P 2 O 7 + H 2 O
KNO 3 + 4Mg + 6H 2 O = NH 3 + 4Mg(OH) 2 + KOH
4KClO 3 KCl + 3KClO 4
2KClO3 ![]() 2KCl + 3O 2
2KCl + 3O 2
KClO 3 + 6HCl = KCl + 3Cl 2 + 3H 2 O
Na 2 SO 3 + S = Na 2 S 2 O 3
Na 2 S 2 O 3 + H 2 SO 4 = Na 2 SO 4 + S↓ + SO 2 + H 2 O
2NaI + Br 2 = 2NaBr + I 2
2NaBr + Cl 2 = 2NaCl + Br 2
Je Un groupe.
1. Des décharges électriques ont été transmises à la surface d'une solution de soude caustique versée dans un ballon, et l'air dans le ballon est devenu brun, qui a disparu après un certain temps. La solution résultante a été soigneusement évaporée et il a été déterminé que le résidu solide était un mélange de deux sels. Lorsque ce mélange est chauffé, du gaz est libéré et la seule substance reste. Écrivez les équations des réactions décrites.
2. La substance libérée à la cathode lors de l'électrolyse du chlorure de sodium fondu a été brûlée dans l'oxygène. Le produit résultant a été placé dans un gazomètre rempli de dioxyde de carbone. La substance résultante a été ajoutée à la solution de chlorure d'ammonium et la solution a été chauffée. Écrivez les équations des réactions décrites.
3) L'acide nitrique a été neutralisé avec du bicarbonate de soude, la solution neutre a été soigneusement évaporée et le résidu a été calciné. La substance résultante a été ajoutée à une solution de permanganate de potassium acidifiée avec de l'acide sulfurique et la solution est devenue incolore. Le produit de réaction contenant de l'azote a été placé dans une solution d'hydroxyde de sodium et de la poussière de zinc a été ajoutée, et un gaz ayant une odeur âcre a été libéré. Écrivez les équations des réactions décrites.
4) La substance obtenue à l'anode lors de l'électrolyse d'une solution d'iodure de sodium avec des électrodes inertes a réagi avec du potassium. Le produit de réaction a été chauffé avec de l'acide sulfurique concentré et le gaz libéré a été passé à travers une solution chaude de chromate de potassium. Écrivez les équations des réactions décrites
5) La substance obtenue à la cathode lors de l'électrolyse du chlorure de sodium fondu a été brûlée dans l'oxygène. Le produit résultant a été traité successivement avec du dioxyde de soufre et une solution d'hydroxyde de baryum. Écrivez les équations des réactions décrites
6) Le phosphore blanc se dissout dans une solution d'hydroxyde de potassium, libérant un gaz à l'odeur d'ail qui s'enflamme spontanément dans l'air. Le produit solide de la réaction de combustion a réagi avec la soude caustique dans un rapport tel que la substance blanche résultante contient un atome d'hydrogène ; lorsque cette dernière substance est calcinée, du pyrophosphate de sodium se forme. Écrivez les équations des réactions décrites
7) Un métal inconnu a été brûlé dans l'oxygène. Le produit de la réaction interagit avec le dioxyde de carbone pour former deux substances : un solide qui réagit avec une solution d'acide chlorhydrique pour libérer du dioxyde de carbone et une substance gazeuse simple qui entretient la combustion. Écrivez les équations des réactions décrites.
8) Du gaz brun a été passé à travers un excès de solution de potassium caustique en présence d'un large excès d'air. Des copeaux de magnésium ont été ajoutés à la solution résultante et chauffés, et le gaz résultant a neutralisé l'acide nitrique. La solution résultante a été soigneusement évaporée et le produit solide de réaction a été calciné. Écrivez les équations des réactions décrites.
9) Quand décomposition thermique les sels A en présence de dioxyde de manganèse forment le sel binaire B et un gaz qui entretient la combustion et fait partie de l'air ; Lorsque ce sel est chauffé sans catalyseur, le sel B et un sel d'un acide contenant de l'oxygène supérieur se forment. Lorsque le sel A interagit avec l'acide chlorhydrique, un gaz jaune-vert (une substance simple) est libéré et se forme du sel B. Le sel B rend la flamme violette et lorsqu'il interagit avec une solution de nitrate d'argent, un précipité blanc se forme. Écrivez les équations des réactions décrites.
10) Des copeaux de cuivre ont été ajoutés à de l'acide sulfurique concentré chauffé et le gaz libéré a été passé à travers une solution de soude caustique (en excès). Le produit de réaction a été isolé, dissous dans l'eau et chauffé avec du soufre, qui s'est dissous à la suite de la réaction. De l'acide sulfurique dilué a été ajouté à la solution résultante. Écrivez les équations des réactions décrites.
11) Le sel de table a été traité avec de l'acide sulfurique concentré. Le sel résultant a été traité avec de l'hydroxyde de sodium. Le produit résultant a été calciné avec un excès de charbon. Le gaz dégagé réagit en présence d'un catalyseur avec le chlore. Écrivez les équations des réactions décrites.
12) Le sodium a réagi avec l’hydrogène. Le produit de la réaction a été dissous dans l'eau, ce qui a formé un gaz qui a réagi avec le chlore, et la solution résultante, lorsqu'elle a été chauffée, a réagi avec le chlore pour former un mélange de deux sels. Écrivez les équations des réactions décrites.
13) Le sodium a été brûlé dans un excès d'oxygène, la substance cristalline résultante a été placée dans un tube en verre et du dioxyde de carbone y a été passé. Le gaz sortant du tube était collecté et le phosphore était brûlé dans son atmosphère. La substance résultante a été neutralisée avec un excès de solution d'hydroxyde de sodium. Écrivez les équations des réactions décrites.
14) Une solution d'acide chlorhydrique a été ajoutée à la solution obtenue en faisant réagir du peroxyde de sodium avec de l'eau lorsqu'elle était chauffée jusqu'à ce que la réaction soit terminée. La solution du sel résultant a été soumise à une électrolyse avec des électrodes inertes. Le gaz formé à la suite de l'électrolyse à l'anode a traversé une suspension d'hydroxyde de calcium. Écrivez les équations des réactions décrites.
15) Du dioxyde de soufre a été passé à travers une solution d'hydroxyde de sodium jusqu'à formation d'un sel moyen. Une solution aqueuse de permanganate de potassium a été ajoutée à la solution résultante. Le précipité résultant a été séparé et traité avec de l'acide chlorhydrique. Le gaz libéré a été passé à travers une solution froide d'hydroxyde de potassium. Écrivez les équations des réactions décrites.
16) Un mélange d'oxyde de silicium (IV) et de magnésium métallique a été calciné. La substance simple obtenue à la suite de la réaction a été traitée avec une solution concentrée d'hydroxyde de sodium. Le gaz libéré a été passé sur du sodium chauffé. La substance résultante a été placée dans l'eau. Écrivez les équations des réactions décrites.
17) Le produit de la réaction du lithium avec l'azote a été traité avec de l'eau. Le gaz résultant a été passé à travers une solution d’acide sulfurique jusqu’à l’arrêt des réactions chimiques. La solution résultante a été traitée avec une solution de chlorure de baryum. La solution a été filtrée et le filtrat a été mélangé avec une solution de nitrate de sodium et chauffé. Écrivez les équations des réactions décrites.
18) Le sodium a été chauffé dans une atmosphère d'hydrogène. Lorsque de l’eau a été ajoutée à la substance résultante, un dégagement de gaz et la formation d’une solution claire ont été observés. Du gaz brun a traversé cette solution, obtenue grâce à l'interaction du cuivre avec une solution concentrée. acide nitrique. Écrivez les équations des réactions décrites.
19) Le bicarbonate de sodium a été calciné. Le sel obtenu a été dissous dans l’eau et mélangé à une solution d’aluminium, entraînant la formation d’un précipité et la libération d’un gaz incolore. Le précipité a été traité avec un excès de solution d'acide nitrique et le gaz a été passé à travers une solution de silicate de potassium. Écrivez les équations des réactions décrites.
20) Le sodium a été fusionné avec du soufre. Le composé résultant a été traité avec de l'acide chlorhydrique, le gaz libéré a complètement réagi avec l'oxyde de soufre (IV). La substance résultante a été traitée avec de l'acide nitrique concentré. Écrivez les équations des réactions décrites.
21) Le sodium est brûlé dans un excès d’oxygène. La substance résultante a été traitée avec de l'eau. Le mélange résultant a été bouilli, après quoi du chlore a été ajouté à la solution chaude. Écrivez les équations des réactions décrites.
22) Le potassium a été chauffé dans une atmosphère d'azote. La substance résultante a été traitée avec un excès d'acide chlorhydrique, après quoi une suspension d'hydroxyde de calcium a été ajoutée au mélange de sels résultant et chauffée. Le gaz résultant a été passé à travers de l'oxyde de cuivre (II) chaud. Écrivez les équations des réactions décrites.
23) Le potassium a été brûlé dans une atmosphère de chlore, le sel obtenu a été traité avec un excès d'une solution aqueuse de nitrate d'argent. Le précipité formé est filtré, le filtrat est évaporé et soigneusement chauffé. Le sel obtenu a été traité solution aqueuse brome Écrivez les équations des réactions décrites.
24) Le lithium a réagi avec l’hydrogène. Le produit de la réaction a été dissous dans l'eau, ce qui a formé un gaz qui a réagi avec le brome, et la solution résultante, lorsqu'elle a été chauffée, a réagi avec le chlore pour former un mélange de deux sels. Écrivez les équations des réactions décrites.
25) Le sodium a été brûlé dans l'air. Le solide résultant absorbe le dioxyde de carbone, libérant de l'oxygène et du sel. Le dernier sel a été dissous dans de l'acide chlorhydrique et une solution de nitrate d'argent a été ajoutée à la solution résultante. Un précipité blanc s'est formé. Écrivez les équations des réactions décrites.
26) L'oxygène a été exposé à une décharge électrique dans un ozoniseur. Le gaz résultant a été passé à travers une solution aqueuse d'iodure de potassium et un nouveau gaz, incolore et inodore, a été libéré, favorisant la combustion et la respiration. Dans l’atmosphère de ce dernier gaz, le sodium brûlait et le solide résultant réagissait avec le dioxyde de carbone. Écrivez les équations des réactions décrites.
Je Un groupe.
1. N2 + O2 ![]() 2NON
2NON
2NO + O2 = 2NO2
2NO 2 + 2NaOH = NaNO 3 + NaNO 2 + H 2 O
2NaNO 3 2NaNO 2 + O 2
2. 2NaCl ![]() 2Na + Cl2
2Na + Cl2
à la cathode à l'anode
2Na + O 2 = Na 2 O 2
2Na 2 O 2 + 2CO 2 = 2Na 2 CO 3 + O 2
Na 2 CO 3 + 2NH 4 Cl = 2NaCl + CO 2 + 2NH 3 + H 2 O
3. NaHCO 3 + HNO 3 = NaNO 3 + CO 2 + H 2 O
2NaNO 3 2NaNO 2 + O 2
5NaNO 2 + 2KMnO 4 + 3H 2 SO 4 = 5NaNO 3 + 2MnSO 4 + K 2 SO 4 + 3H 2 O
NaNO 3 + 4Zn + 7NaOH + 6H 2 O = 4Na 2 + NH 3
4. 2H2O + 2NaI ![]() H 2 + 2NaOH + I 2
H 2 + 2NaOH + I 2
2K + I2 = 2KI
8KI + 5H 2 SO 4 (conc.) = 4K 2 SO 4 + H 2 S + 4I 2 + 4H 2 O
3H 2 S + 2K 2 CrO 4 + 2H 2 O = 2Cr(OH) 3 ↓ + 3S↓ + 4KOH
5. 2NaCl ![]() 2Na + Cl2
2Na + Cl2
à la cathode à l'anode
2Na + O 2 = Na 2 O 2
Na 2 O 2 + SO 2 = Na 2 SO 4
Na 2 SO 4 + Ba(OH) 2 = BaSO 4 ↓ + 2NaOH
6. P 4 + 3KOH + 3H 2 O = 3KH 2 PO 2 + PH 3
2PH 3 + 4O 2 = P 2 O 5 + 3H 2 O
P 2 O 5 + 4NaOH = 2Na 2 HPO 4 + H 2 O


