07.03.2019
Chemische Eigenschaften von Alkalimetallen. Weißt du wie
Alkalimetalle reagieren leicht mit Nichtmetallen:
2K + I 2 = 2KI
2Na + H 2 = 2NaH
6Li + N 2 = 2Li 3 N (die Reaktion findet bei Raumtemperatur statt)
2Na + S = Na 2 S
2Na + 2C = Na 2 C 2
Bei Reaktionen mit Sauerstoff zeigt jedes Alkalimetall seine eigene Individualität: Beim Verbrennen an der Luft bildet Lithium ein Oxid, Natrium - Peroxid, Kalium - Superoxid.
4Li + O 2 = 2Li 2 O
2Na + O 2 = Na 2 O 2
K + O 2 = KO 2
Herstellung von Natriumoxid:
10Na + 2NaNO 3 = 6Na 2 O + N 2
2Na + Na 2 O 2 = 2Na 2 O
2Na + 2NaON = 2Na 2 O + H 2
Die Wechselwirkung mit Wasser führt zur Bildung von Alkali und Wasserstoff.
2Na + 2H 2 O = 2NaOH + H 2
Wechselwirkung mit Säuren:
2Na + 2HCl = 2NaCl + H2
8Na + 5H 2 SO 4 (konz.) = 4Na 2 SO 4 + H 2 S + 4H 2 O
2Li + 3H 2 SO 4 (konz.) = 2LiHSO 4 + SO 2 + 2H 2 O
8Na + 10HNO 3 = 8NaNO 3 + NH 4 NO 3 + 3H 2 O
Bei der Wechselwirkung mit Ammoniak entstehen Amide und Wasserstoff:
2Li + 2NH 3 = 2LiNH 2 + H 2
Wechselwirkung mit organischen Verbindungen:
H ─ C ≡ C ─ H + 2Na → Na ─ C≡C ─ Na + H 2
2CH 3 Cl + 2Na → C 2 H 6 + 2NaCl
2C 6 H 5 OH + 2Na → 2C 6 H 5 ONa + H 2
2CH 3 OH + 2Na → 2 CH 3 ONa + H 2
2СH 3 COOH + 2Na → 2CH 3 COOONa + H 2
Eine qualitative Reaktion auf Alkalimetalle ist die Färbung der Flamme durch deren Kationen. Li + -Ionen färben die Flamme karminrot, Na + -Ionen – gelb, K + – violett.
Verbindungen Alkali Metalle
Oxide.
Alkalimetalloxide sind typische basische Oxide. Sie reagieren mit sauren und amphoteren Oxiden, Säuren und Wasser.
3Na 2 O + P 2 O 5 = 2Na 3 PO 4
Na 2 O + Al 2 O 3 = 2NaAlO 2
Na 2 O + 2HCl = 2NaCl + H 2 O
Na 2 O + 2H + = 2Na + + H 2 O
Na 2 O + H 2 O = 2NaOH
Peroxide.
2Na 2 O 2 + CO 2 = 2Na 2 CO 3 + O 2
Na 2 O 2 + CO = Na 2 CO 3
Na 2 O 2 + SO 2 = Na 2 SO 4
2Na 2 O + O 2 = 2Na 2 O 2
Na 2 O + NO + NO 2 = 2NaNO 2
2Na 2 O 2 = 2Na 2 O + O 2
Na 2 O 2 + 2H 2 O (kalt) = 2NaOH + H 2 O 2
2Na 2 O 2 + 2H 2 O (hor.) = 4NaOH + O 2
Na 2 O 2 + 2HCl = 2NaCl + H 2 O 2
2Na 2 O 2 + 2H 2 SO 4 (geteilter Horizont) = 2Na 2 SO 4 + 2H 2 O + O 2
2Na 2 O 2 + S = Na 2 SO 3 + Na 2 O
5Na 2 O 2 + 8H 2 SO 4 + 2KMnO 4 = 5O 2 + 2MnSO 4 + 8H 2 O + 5Na 2 SO 4 + K 2 SO 4
Na 2 O 2 + 2H 2 SO 4 + 2NaI = I 2 + 2Na 2 SO 4 + 2H 2 O
Na 2 O 2 + 2H 2 SO 4 + 2FeSO 4 = Fe 2 (SO 4) 3 + Na 2 SO 4 + 2H 2 O
3Na 2 O 2 + 2Na 3 = 2Na 2 CrO 4 + 8NaOH + 2H 2 O
Basen (Laugen).
2NaOH (Überschuss) + CO 2 = Na 2 CO 3 + H 2 O
NaOH + CO 2 (Überschuss) = NaHCO 3
SO 2 + 2NaOH (Überschuss) = Na 2 SO 3 + H 2 O
SiO 2 + 2NaOH Na 2 SiO 3 + H 2 O
2NaOH + Al 2 O 3 2NaAlO 2 + H 2 O
2NaOH + Al 2 O 3 + 3H 2 O = 2Na
NaOH + Al(OH) 3 = Na
2NaOH + 2Al + 6H 2 O = 2Na + 3H 2
2KOH + 2NO2 + O2 = 2KNO3 + H2O
KOH + KHCO 3 = K 2 CO 3 + H 2 O
2NaOH + Si + H 2 O = Na 2 SiO 3 + H 2
3KOH + P 4 + 3H 2 O = 3KH 2 PO 2 + PH 3
2KOH (kalt) + Cl 2 = KClO + KCl + H 2 O
6KOH (heiß) + 3Cl 2 = KClO 3 + 5KCl + 3H 2 O
6NaOH + 3S = 2Na2S + Na2SO3 + 3H2O
2NaNO 3 2NaNO 2 + O 2
NaHCO 3 + HNO 3 = NaNO 3 + CO 2 + H 2 O
NaI → Na + + I –
an der Kathode: 2H 2 O + 2e → H 2 + 2OH – 1
an der Anode: 2I – – 2e → I 2 1
2H 2 O + 2I – ![]() H 2 + 2OH – + I 2
H 2 + 2OH – + I 2
2H2O + 2NaI ![]() H 2 + 2NaOH + I 2
H 2 + 2NaOH + I 2
2NaCl ![]() 2Na + Cl2
2Na + Cl2
an der Kathode an der Anode
2Na 2 HPO 4 Na 4 P 2 O 7 + H 2 O
KNO 3 + 4Mg + 6H 2 O = NH 3 + 4Mg(OH) 2 + KOH
4KClO 3 KCl + 3KClO 4
2KClO3 ![]() 2KCl + 3O 2
2KCl + 3O 2
KClO 3 + 6HCl = KCl + 3Cl 2 + 3H 2 O
Na 2 SO 3 + S = Na 2 S 2 O 3
Na 2 S 2 O 3 + H 2 SO 4 = Na 2 SO 4 + S↓ + SO 2 + H 2 O
2NaI + Br 2 = 2NaBr + I 2
2NaBr + Cl 2 = 2NaCl + Br 2
I Eine Gruppe.
1. Elektrische Entladungen wurden über die Oberfläche einer in einen Kolben gegossenen Natronlauge geleitet, wodurch die Luft im Kolben braun wurde, was nach einiger Zeit verschwand. Die resultierende Lösung wurde vorsichtig eingedampft und es wurde festgestellt, dass der feste Rückstand eine Mischung aus zwei Salzen war. Beim Erhitzen dieser Mischung wird Gas freigesetzt und die einzige Substanz bleibt übrig. Schreiben Sie die Gleichungen für die beschriebenen Reaktionen.
2. Der bei der Elektrolyse von geschmolzenem Natriumchlorid an der Kathode freigesetzte Stoff wurde in Sauerstoff verbrannt. Das resultierende Produkt wurde in einen mit Kohlendioxid gefüllten Gasometer gegeben. Die resultierende Substanz wurde der Ammoniumchloridlösung zugesetzt und die Lösung erhitzt. Schreiben Sie die Gleichungen für die beschriebenen Reaktionen.
3) Salpetersäure wurde mit Backpulver neutralisiert, die neutrale Lösung vorsichtig eingedampft und der Rückstand kalziniert. Die resultierende Substanz wurde zu einer mit Schwefelsäure angesäuerten Kaliumpermanganatlösung gegeben und die Lösung wurde farblos. Das stickstoffhaltige Reaktionsprodukt wurde in eine Lösung aus Natriumhydroxid gegeben und mit Zinkstaub versetzt, wobei ein stechend riechendes Gas freigesetzt wurde. Schreiben Sie die Gleichungen für die beschriebenen Reaktionen.
4) Die an der Anode bei der Elektrolyse einer Natriumiodidlösung mit inerten Elektroden erhaltene Substanz wurde mit Kalium umgesetzt. Das Reaktionsprodukt wurde mit konzentrierter Schwefelsäure erhitzt und das freigesetzte Gas durch eine heiße Kaliumchromatlösung geleitet. Schreiben Sie die Gleichungen für die beschriebenen Reaktionen
5) Die an der Kathode bei der Elektrolyse von geschmolzenem Natriumchlorid anfallende Substanz wurde in Sauerstoff verbrannt. Das resultierende Produkt wurde nacheinander mit Schwefeldioxid und einer Bariumhydroxidlösung behandelt. Schreiben Sie die Gleichungen für die beschriebenen Reaktionen
6) Weißer Phosphor löst sich in einer Kaliumhydroxidlösung und setzt ein Gas mit Knoblauchgeruch frei, das sich an der Luft spontan entzündet. Das feste Produkt der Verbrennungsreaktion reagierte mit Natronlauge in einem solchen Verhältnis, dass die resultierende weiße Substanz ein Wasserstoffatom enthielt; Beim Kalzinieren der letzteren Substanz entsteht Natriumpyrophosphat. Schreiben Sie die Gleichungen für die beschriebenen Reaktionen
7) Ein unbekanntes Metall wurde in Sauerstoff verbrannt. Das Reaktionsprodukt interagiert mit Kohlendioxid und bildet zwei Substanzen: einen Feststoff, der mit einer Lösung interagiert Salzsäure unter Freisetzung von Kohlendioxid und einer gasförmigen einfachen Substanz, die die Verbrennung unterstützt. Schreiben Sie die Gleichungen für die beschriebenen Reaktionen.
8) Braunes Gas wurde in Gegenwart eines großen Luftüberschusses durch einen Überschuss an ätzender Kaliumlösung geleitet. Der resultierenden Lösung wurden Magnesiumspäne zugesetzt und erhitzt, und das resultierende Gas neutralisierte die Salpetersäure. Die resultierende Lösung wurde vorsichtig eingedampft und das feste Reaktionsprodukt kalziniert. Schreiben Sie die Gleichungen für die beschriebenen Reaktionen.
9) Wann thermische Zersetzung Salze A bilden in Gegenwart von Mangandioxid binäres Salz B und ein Gas, das die Verbrennung unterstützt und Teil der Luft ist; Beim Erhitzen dieses Salzes ohne Katalysator entstehen Salz B und ein Salz einer höheren Sauerstoff enthaltenden Säure. Wenn Salz A mit Salzsäure interagiert, wird ein gelbgrünes Gas (eine einfache Substanz) freigesetzt und Salz B gebildet. Salz B färbt die Flamme violett, und wenn es mit einer Silbernitratlösung interagiert, bildet sich ein weißer Niederschlag. Schreiben Sie die Gleichungen für die beschriebenen Reaktionen.
10) Kupferspäne wurden zu erhitzter konzentrierter Schwefelsäure gegeben und das freigesetzte Gas wurde durch eine Lösung von Natronlauge (Überschuss) geleitet. Das Reaktionsprodukt wurde isoliert, in Wasser gelöst und mit Schwefel erhitzt, der sich durch die Reaktion auflöste. Der resultierenden Lösung wurde verdünnte Schwefelsäure zugesetzt. Schreiben Sie die Gleichungen für die beschriebenen Reaktionen.
11) Speisesalz wurde mit konzentrierter Schwefelsäure behandelt. Das resultierende Salz wurde mit Natriumhydroxid behandelt. Das resultierende Produkt wurde mit überschüssiger Kohle kalziniert. Das freigesetzte Gas reagierte in Gegenwart eines Katalysators mit Chlor. Schreiben Sie die Gleichungen für die beschriebenen Reaktionen.
12) Natrium reagierte mit Wasserstoff. Das Reaktionsprodukt wurde in Wasser gelöst, das ein Gas bildete, das mit Chlor reagierte, und die resultierende Lösung reagierte beim Erhitzen mit Chlor, um eine Mischung aus zwei Salzen zu bilden. Schreiben Sie die Gleichungen für die beschriebenen Reaktionen.
13) Natrium wurde in überschüssigem Sauerstoff verbrannt, die resultierende kristalline Substanz in ein Glasrohr gegeben und Kohlendioxid durchgeleitet. Das aus dem Rohr austretende Gas wurde gesammelt und in seiner Atmosphäre wurde Phosphor verbrannt. Die resultierende Substanz wurde mit einem Überschuss an Natriumhydroxidlösung neutralisiert. Schreiben Sie die Gleichungen für die beschriebenen Reaktionen.
14) Eine Salzsäurelösung wurde zu der durch Reaktion von Natriumperoxid mit Wasser erhaltenen Lösung unter Erhitzen zugegeben, bis die Reaktion abgeschlossen war. Die Lösung des resultierenden Salzes wurde einer Elektrolyse mit inerten Elektroden unterzogen. Das bei der Elektrolyse an der Anode entstehende Gas wurde durch eine Calciumhydroxidsuspension geleitet. Schreiben Sie die Gleichungen für die beschriebenen Reaktionen.
15) Schwefeldioxid wurde durch eine Natriumhydroxidlösung geleitet, bis sich ein mittleres Salz bildete. Der resultierenden Lösung wurde eine wässrige Lösung von Kaliumpermanganat zugesetzt. Der resultierende Niederschlag wurde abgetrennt und mit Salzsäure behandelt. Das freigesetzte Gas wurde durch eine kalte Kaliumhydroxidlösung geleitet. Schreiben Sie die Gleichungen für die beschriebenen Reaktionen.
16) Eine Mischung aus Silizium(IV)oxid und Magnesiummetall wurde kalziniert. Die durch die Reaktion erhaltene einfache Substanz wurde mit einer konzentrierten Natriumhydroxidlösung behandelt. Das freigesetzte Gas wurde über erhitztes Natrium geleitet. Die resultierende Substanz wurde in Wasser gegeben. Schreiben Sie die Gleichungen für die beschriebenen Reaktionen.
17) Das Produkt der Reaktion von Lithium mit Stickstoff wurde mit Wasser behandelt. Das entstehende Gas wurde durch eine Schwefelsäurelösung geleitet, bis die chemischen Reaktionen aufhörten. Die resultierende Lösung wurde mit einer Bariumchloridlösung behandelt. Die Lösung wurde filtriert und das Filtrat mit Natriumnitratlösung vermischt und erhitzt. Schreiben Sie die Gleichungen für die beschriebenen Reaktionen.
18) Natrium wurde in einer Wasserstoffatmosphäre erhitzt. Bei Zugabe von Wasser zu der resultierenden Substanz wurde eine Gasentwicklung und die Bildung einer klaren Lösung beobachtet. Durch diese Lösung wurde braunes Gas geleitet, das durch die Wechselwirkung von Kupfer mit einer konzentrierten Lösung entstand Salpetersäure. Schreiben Sie die Gleichungen für die beschriebenen Reaktionen.
19) Natriumbicarbonat wurde kalziniert. Das resultierende Salz wurde in Wasser gelöst und mit einer Aluminiumlösung vermischt, was zur Bildung eines Niederschlags und zur Freisetzung eines farblosen Gases führte. Der Niederschlag wurde mit einem Überschuss an Salpetersäurelösung behandelt und das Gas durch eine Kaliumsilikatlösung geleitet. Schreiben Sie die Gleichungen für die beschriebenen Reaktionen.
20) Natrium wurde mit Schwefel verschmolzen. Die resultierende Verbindung wurde mit Salzsäure behandelt, das freigesetzte Gas reagierte vollständig mit Schwefel(IV)-oxid. Die resultierende Substanz wurde mit konzentrierter Salpetersäure behandelt. Schreiben Sie die Gleichungen für die beschriebenen Reaktionen.
21) Natrium wird in überschüssigem Sauerstoff verbrannt. Die resultierende Substanz wurde mit Wasser behandelt. Die resultierende Mischung wurde gekocht, wonach der heißen Lösung Chlor zugesetzt wurde. Schreiben Sie die Gleichungen für die beschriebenen Reaktionen.
22) Kalium wurde in einer Stickstoffatmosphäre erhitzt. Die resultierende Substanz wurde mit einem Überschuss an Salzsäure behandelt, wonach eine Suspension von Calciumhydroxid zu der resultierenden Salzmischung gegeben und erhitzt wurde. Das resultierende Gas wurde durch heißes Kupfer(II)-oxid geleitet. Schreiben Sie die Gleichungen für die beschriebenen Reaktionen.
23) Kalium wurde in einer Chloratmosphäre verbrannt, das resultierende Salz wurde mit einem Überschuss einer wässrigen Silbernitratlösung behandelt. Der gebildete Niederschlag wurde abfiltriert, das Filtrat eingedampft und vorsichtig erhitzt. Das resultierende Salz wurde mit einer wässrigen Bromlösung behandelt. Schreiben Sie die Gleichungen für die beschriebenen Reaktionen.
24) Lithium reagierte mit Wasserstoff. Das Reaktionsprodukt wurde in Wasser gelöst, das ein Gas bildete, das mit Brom reagierte, und die resultierende Lösung reagierte beim Erhitzen mit Chlor, um eine Mischung aus zwei Salzen zu bilden. Schreiben Sie die Gleichungen für die beschriebenen Reaktionen.
25) Natrium wurde in der Luft verbrannt. Der resultierende Feststoff absorbiert Kohlendioxid und setzt Sauerstoff und Salz frei. Das letzte Salz wurde in Salzsäure gelöst und der resultierenden Lösung wurde eine Lösung von Silbernitrat zugesetzt. Es bildete sich ein weißer Niederschlag. Schreiben Sie die Gleichungen für die beschriebenen Reaktionen.
26) Sauerstoff wurde in einem Ozonisator einer elektrischen Entladung ausgesetzt. Das entstehende Gas wurde durch eine wässrige Lösung von Kaliumiodid geleitet und ein neues, farb- und geruchloses Gas wurde freigesetzt, das die Verbrennung und Atmung unterstützte. In der Atmosphäre des letztgenannten Gases wurde Natrium verbrannt und der resultierende Feststoff reagierte mit Kohlendioxid. Schreiben Sie die Gleichungen für die beschriebenen Reaktionen.
I Eine Gruppe.
1. N 2 + O 2 ![]() 2NEIN
2NEIN
2NO + O 2 = 2NO 2
2NO 2 + 2NaOH = NaNO 3 + NaNO 2 + H 2 O
2NaNO 3 2NaNO 2 + O 2
2. 2NaCl ![]() 2Na + Cl2
2Na + Cl2
an der Kathode an der Anode
2Na + O 2 = Na 2 O 2
2Na 2 O 2 + 2CO 2 = 2Na 2 CO 3 + O 2
Na 2 CO 3 + 2NH 4 Cl = 2NaCl + CO 2 + 2NH 3 + H 2 O
3. NaHCO 3 + HNO 3 = NaNO 3 + CO 2 + H 2 O
2NaNO 3 2NaNO 2 + O 2
5NaNO 2 + 2KMnO 4 + 3H 2 SO 4 = 5NaNO 3 + 2MnSO 4 + K 2 SO 4 + 3H 2 O
NaNO 3 + 4Zn + 7NaOH + 6H 2 O = 4Na 2 + NH 3
4. 2H2O + 2NaI ![]() H 2 + 2NaOH + I 2
H 2 + 2NaOH + I 2
2K + I 2 = 2KI
8KI + 5H 2 SO 4 (konz.) = 4K 2 SO 4 + H 2 S + 4I 2 + 4H 2 O
3H 2 S + 2K 2 CrO 4 + 2H 2 O = 2Cr(OH) 3 ↓ + 3S↓ + 4KOH
5. 2NaCl ![]() 2Na + Cl2
2Na + Cl2
an der Kathode an der Anode
2Na + O 2 = Na 2 O 2
Na 2 O 2 + SO 2 = Na 2 SO 4
Na 2 SO 4 + Ba(OH) 2 = BaSO 4 ↓ + 2NaOH
6. P 4 + 3KOH + 3H 2 O = 3KH 2 PO 2 + PH 3
2PH 3 + 4O 2 = P 2 O 5 + 3H 2 O
P 2 O 5 + 4NaOH = 2Na 2 HPO 4 + H 2 O
· · ·§ 96. Alkalisch
Die Gruppe der Alkalimetalle umfasst die folgende Reihe von Metallen; Li, Na, K, Rb, Cs, Fr. Sie gehören zur Hauptuntergruppe der Gruppe I des Periodensystems.
Alle diese sind insofern ähnlich, als sich auf ihrer äußeren elektronischen Schicht ein Elektron befindet (Tabelle 18)/.
Alkalische Elemente zählen zu den S-Elementen. Das Elektron der äußeren Elektronenschicht eines Alkalimetallatoms ist im Vergleich zu anderen Elementen derselben Periode am weitesten vom Kern entfernt, d. h. der Radius eines Alkalimetallatoms ist im Vergleich zu den Radien von Atomen anderer Elemente der gleichen Periode am größten Gleiche Periode. In Verbindung
|
Kernladung |
Anzahl der Elektronen in Energieniveaus |
Atomradius |
|||||||
Dadurch wird das Valenzelektron der äußeren Schicht der Alkalimetallatome leicht abgestreift und diese in positive einfach geladene Ionen umgewandelt. Dies liegt daran, dass Verbindungen von Alkalimetallen mit anderen Elementen je nach Art der Ionenbindung aufgebaut werden.
Bei Redoxreaktionen verhalten sie sich wie starke Reduktionsmittel, und diese Fähigkeit nimmt von Metall zu Metall mit zunehmender Ladung des Atomkerns zu.
§ 97. Natrium
Die elektronische Konfiguration des Natriumatoms ist ls 2 2s 2 2p 6 3s 1. Der Aufbau seiner äußeren Schicht:
Natrium kommt in der Natur nur in Form von Salzen vor. Das am häufigsten vorkommende Natriumsalz ist das Speisesalz NaCl sowie das Mineral Sylvinit KCl · NaCl und einige Schwefelsäuresalze, beispielsweise Glaubersalz Na2SO4 · 10H2O, das in großen Mengen im Kara-Bogaz-Gol-Golf des Kaspischen Meeres vorkommt.
Aus Kochsalz NaCl wird durch Elektrolyse der Salzschmelze Natriummetall gewonnen. Die Elektrolyseanlage ist in Abb. dargestellt. 76. Elektroden werden in geschmolzenes Salz getaucht. Anoden- und Kathodenraum sind durch ein Diaphragma getrennt, das das gebildete Natrium isoliert, so dass es nicht zu einer Rückreaktion kommt. Das positive Natriumion nimmt ein Elektron von der Kathode auf und wird zu einem neutralen Natriumatom. An der Kathode sammeln sich neutrale Natriumatome in Form von geschmolzenem Metall. Der an der Kathode ablaufende Prozess kann durch das folgende Diagramm dargestellt werden:
Na + + Na 0 .
Da die Aufnahme von Elektronen an der Kathode erfolgt und jede Aufnahme von Elektronen durch ein Atom oder Ion eine Reduktion darstellt, werden die Natriumionen an der Kathode reduziert. An der Anode geben Chlorionen Elektronen ab, d. h. es findet der Prozess der Oxidation und Freisetzung freier Elektronen statt
Chlorgas, das durch das folgende Diagramm dargestellt werden kann:
Cl — — e— → Cl 0
Das resultierende Natriummetall hat eine silberweiße Farbe und lässt sich leicht mit einem Messer schneiden. Ein Stück Natrium hat, wenn es unmittelbar nach dem Schnitt untersucht wird, einen hellen metallischen Glanz, der jedoch aufgrund der extrem schnellen Oxidation des Metalls schnell verblasst.
![]()
Reis. 76. Installationsdiagramm für die Elektrolyse von geschmolzenem Salz.
1 - Ringkathode; 2 - Glocke zum Entfernen von Chlorgas aus dem Anodenraum
Wenn Natrium in einer kleinen Menge Sauerstoff bei einer Temperatur von etwa 180° oxidiert wird, entsteht Natriumoxid:
4Na + O2 = 2Na2O.
Beim Verbrennen in Sauerstoff entsteht Natriumperoxid:
2Na + O2 = Na2O2.
In diesem Fall brennt Natrium mit einer blendend gelben Flamme.
Aufgrund der leichten und schnellen Oxidation von Natrium wird es unter einer Kerosin- oder Paraffinschicht gespeichert, was vorzuziehen ist, da sich immer noch eine gewisse Luftmenge im Kerosin löst und die Natriumoxidation, wenn auch langsam, immer noch stattfindet.
Natrium kann sich mit Wasserstoff verbinden - Hydrid NaH, in dem es die Oxidationsstufe 1 aufweist. Dabei handelt es sich um eine salzartige Verbindung, die sich durch die Art der chemischen Bindung und die Größe der Oxidationsstufe von den flüchtigen Hydriden der Elemente der Hauptuntergruppen der Gruppen IV unterscheidet -VII.
Natriummetall kann nicht nur mit Sauerstoff und Wasserstoff, sondern auch mit vielen einfachen und komplexen Stoffen reagieren. Wenn Natrium beispielsweise in einem Mörser mit Schwefel gemahlen wird, reagiert es heftig damit und bildet:
2Na + S = Na2S
Die Reaktion geht mit Ausbrüchen einher, deshalb sollten Sie den Mörtel von Ihren Augen fernhalten und Ihre Hand in ein Handtuch wickeln. Für die Reaktion sollten Sie kleine Natriumstücke einnehmen.
Natrium verbrennt in Chlor heftig und bildet Natriumchlorid, was besonders gut in einem Calciumchloridrohr zu beobachten ist, in dem ein Chlorstrom durch geschmolzenes und stark erhitztes Natrium geleitet wird:
2Na + Cl2 = 2NaCl
Natrium reagiert nicht nur mit einfachen, sondern auch mit komplexen Stoffen, wie zum Beispiel Wasser, und verdrängt es aus diesem, da es sehr oxidativ ist aktives Metall, steht in der Spannungsreihe weit links von Wasserstoff und verdrängt diesen leicht aus Wasser:
2Na + 2H2O = 2NaOH + H2
Ein Alkalimetallbrand kann nicht mit Wasser gelöscht werden. Am besten füllen Sie es mit Soda-Pulver. In Gegenwart von Natrium verfärbt sich die farblose Flamme eines Gasbrenners gelb.
Natriummetall kann als Katalysator in der organischen Synthese eingesetzt werden, beispielsweise bei der Herstellung von Synthesekautschuk aus Butadien. Es dient als Ausgangsstoff für die Herstellung anderer Natriumverbindungen, beispielsweise Natriumperoxid.
■ 27. Beweisen Sie anhand der im Text angegebenen Gleichungen für Reaktionen mit metallischem Natrium, dass es sich wie ein Reduktionsmittel verhält.
28. Warum kann Natrium nicht in der Luft gespeichert werden?
29. Ein Student tauchte ein Stück Natrium in eine Kupfersulfatlösung, in der Hoffnung, metallisches Salz aus dem Salz zu verdrängen. Anstelle von rotem Metall entstand ein gallertartiger blauer Niederschlag. Beschreiben Sie die aufgetretenen Reaktionen und schreiben Sie ihre Gleichungen in molekularer und ionischer Form. Wie müssen die Reaktionsbedingungen verändert werden, damit die Reaktion zum gewünschten Ergebnis führt? Schreiben Sie die Gleichungen in molekularer, vollständiger und abgekürzter ionischer Form.
30. 2,3 g Natriummetall wurden in ein Gefäß mit 45 ml Wasser gegeben. Wie viel Natriumhydroxid entsteht am Ende der Reaktion?
31. Mit welchen Mitteln kann ein Natriumbrand gelöscht werden? Geben Sie eine begründete Antwort.
§ 98. Sauerstoffverbindungen von Natrium. Natriumhydroxid
Die Sauerstoffverbindungen des Natriums sind, wie bereits erwähnt, Natriumoxid Na2O und Natriumperoxid Na2O2.
Natriumoxid Na2O ist nicht besonders wichtig. Es reagiert heftig mit Wasser und bildet Natronlauge:
Na2O + H2O = 2NaOH
Natriumperoxid Na202 ist ein gelbliches Pulver. Es kann als eine Art Salz des Wasserstoffperoxids betrachtet werden, da seine Struktur der von H2O2 entspricht. Es ist wie Natriumperoxid ein starkes Oxidationsmittel. Wenn es Wasser ausgesetzt wird, bildet es ein Alkali und:
Na2O2 + H2O = H2O2 + 2NaOH
entsteht auch durch die Einwirkung verdünnter Säuren auf Natriumperoxid:
Na2O2 + H2SO4 = H2O2 + Na2SO4
Alle oben genannten Eigenschaften von Natriumperoxid ermöglichen die Verwendung zum Bleichen aller möglichen Materialien.
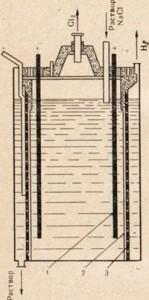
Reis. 77. Schema einer Anlage zur Elektrolyse einer Kochsalzlösung.
1 - Anode; 2 - Membran, die den Anoden- und Kathodenraum trennt; 3-Kathode
Eine sehr wichtige Natriumverbindung ist Natriumhydroxid oder Natriumhydroxid, NaOH. Es wird auch Natronlauge oder einfach Ätznatron genannt.
Zur Gewinnung von Natronlauge wird Kochsalz, die günstigste natürliche Natriumverbindung, durch Elektrolyse verwendet, allerdings wird in diesem Fall keine Schmelze, sondern eine Salzlösung verwendet (Abb. 77). Eine Beschreibung des Prozesses der Elektrolyse einer Kochsalzlösung finden Sie in § 33. In Abb. 77 zeigt, dass Anoden- und Kathodenraum durch ein Diaphragma getrennt sind. Dies geschieht, damit die resultierenden Produkte nicht miteinander interagieren, zum Beispiel Cl2 + 2NaOH = NaClO + NaCl + H2O.
Natronlauge ist ein weißer kristalliner Feststoff, der in Wasser gut löslich ist. Wenn Natronlauge in Wasser gelöst wird, wird sie freigesetzt große Menge Hitze und die Lösung wird sehr heiß. Natronlauge muss in gut verschlossenen Behältern gelagert werden, um sie vor dem Eindringen von Wasserdampf zu schützen, unter dessen Einfluss sie stark befeuchtet werden kann, sowie von Kohlendioxid, unter dessen Einfluss sich Natronlauge allmählich in Natriumcarbonat umwandeln kann :
2NaOH + CO2 = Na2CO3+ H2O.
Natronlauge ist ein typisches Alkali, daher sind die Vorsichtsmaßnahmen bei der Arbeit damit dieselben wie bei der Arbeit mit anderen Alkalien.
Natronlauge wird in vielen Industrien eingesetzt, beispielsweise zur Reinigung von Erdölprodukten, zur Herstellung von Seife aus Fetten, in der Papierindustrie, bei der Herstellung von Kunstfasern und Farbstoffen, bei der Herstellung von Arzneimitteln usw. (Abb. 78).
Notieren Sie die Einsatzgebiete von Natronlauge in Ihrem Notizbuch.
Unter den Natriumsalzen sind vor allem das Speisesalz NaCl zu erwähnen, das als Hauptrohstoff für die Herstellung von Natronlauge und metallischem Natrium dient (weitere Informationen zu diesem Salz finden Sie auf Seite 164), Soda Na2CO3 (siehe Seite). 278), Na2SO4 (siehe Seite 224), NaNO3 (siehe Seite 250) usw.
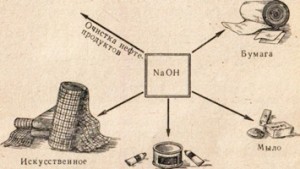
Reis. 78. Verwendung von Natronlauge
■ 32. Beschreiben Sie die Methode zur Herstellung von Natriumhydroxid durch Elektrolyse von Speisesalz.
33. Natronlauge kann durch Behandlung von Natriumcarbonat mit gelöschtem Kalk hergestellt werden. Schreiben Sie die molekulare und ionische Form der Gleichung für diese Reaktion auf und berechnen Sie außerdem, wie viel Soda mit 95 % Carbonat erforderlich ist, um 40 kg Natriumhydroxid herzustellen.
34. Warum „kleben“ bei der Lagerung von Natronlauge in Flaschen mit eingeschliffenen Stopfen die Stopfen und lassen sich nicht entfernen? Wenn Sie die Flasche längere Zeit umgedreht im Wasser lassen, lässt sich der Stopfen leicht entfernen. Erklären Sie anhand von Reaktionsgleichungen, welche Prozesse in diesem Fall ablaufen.
35. Schreiben Sie Reaktionsgleichungen in molekularer und ionischer Form, die die Eigenschaften von Natronlauge als typisches Alkali charakterisieren.
36. Welche Vorsichtsmaßnahmen sind beim Umgang mit Natronlauge zu beachten? Welche Erste-Hilfe-Maßnahmen sollten bei Verbrennungen durch Natronlauge ergriffen werden?
§ 99. Kalium
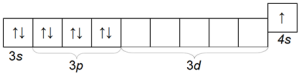
Kalium K ist ebenfalls ein recht häufiges Alkalimetall, das sich von Natrium durch die Größe seines Atomradius (vierte Periode) unterscheidet und daher eine größere chemische Aktivität als Natrium aufweist. Die elektronische Konfiguration des Kaliumatoms ist 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1.
Die Struktur seiner äußeren elektronischen Schicht
Kalium ist ein weiches Metall, das sich gut mit einem Messer schneiden lässt. Um Oxidation zu vermeiden, wird es wie Natrium unter einer Kerosinschicht gelagert.
Kalium reagiert mit Wasser noch heftiger als Natrium, bildet Alkali und setzt Wasserstoff frei, der sich entzündet:
2K + 2H2O = 2KOH + H2.
Bei der Verbrennung in Sauerstoff (und es wird empfohlen, für die Verbrennung noch kleinere Metallstücke zu verwenden als für die Verbrennung von Natrium) verbrennt es wie Natrium sehr heftig und bildet Kaliumperoxid.
Es ist zu beachten, dass Kalium im Umlauf viel gefährlicher ist als Natrium. Selbst beim Schneiden von Kalium kann es zu einer starken Explosion kommen, daher müssen Sie noch vorsichtiger damit umgehen.
Kaliumhydroxid oder Kaliumhydroxid KOH ist eine weiße kristalline Substanz. Ätzkalium ähnelt in jeder Hinsicht Ätznatron. Sie werden häufig in der Seifenindustrie verwendet, ihre Herstellung ist jedoch etwas teurer und wird daher nicht wie NaOH verwendet.
Besonders hervorzuheben sind Kaliumsalze, da einige von ihnen häufig als Düngemittel verwendet werden. Dabei handelt es sich um Kaliumchlorid KCl, Kaliumnitrat KNO3, das auch ein Stickstoffdünger ist.
■ 37. Wie lässt sich die Tatsache erklären, dass Natronlauge chemisch aktiver ist als Natronlauge?
38. Ein Stück Kalium wurde mit Wasser in einen Kristallisator gesenkt. Nachdem die Reaktion abgeschlossen war, wurde dort etwas Zink in Form eines weißen, gelatineartigen Niederschlags zugegeben. Der Niederschlag verschwand, und als die Lösung mit Phenolphthalein getestet wurde, verfärbte sich letzteres purpurrot. Welche chemischen Prozesse fanden hier statt?
Welche sind in Lösung? Geben Sie eine begründete Antwort.
39. Warum wird Kalium, wie alle Alkalimetalle, zur Familie der S-Elemente gezählt?
Hydride. Am stabilsten ist Lithiumhydrid, das leicht durch Überleiten von Wasserstoff über erhitztes Lithium gewonnen werden kann. LiH ist ein weißes kristallines Pulver mit einem Schmelzpunkt von 680 °C. Wann hohe Temperatur LiH ist äußerst reaktiv. Zersetzt sich heftig mit Wasser:
LiH + H 2 O = LiOH + H 2
Oxide. Am stabilsten ist Li 2 O. Lithium- und Natriumoxide sind weiß, der Rest gelb. Darüber hinaus nimmt die Farbintensität mit zunehmender Ordnungszahl des Elements zu.
Peroxide. Entsteht durch die Verbrennung von Metallen in überschüssigem Sauerstoff. Alkalimetallperoxide können als Derivate von Wasserstoffperoxid angesehen werden, weil Sie interagieren mit Säuren und Wasser und bilden Wasserstoffperoxid:
M 2 O 2 + H 2 SO 4 = M 2 SO 4 + H 2 O 2
M 2 O 2 + 2H 2 O = 2MOH + H 2 O 2
Am wichtigsten ist Natriumperoxid, das zur Sauerstofferzeugung in geschlossenen Räumen (z. B. U-Boot):
2Na 2 O 2 + 2CO 2 = 2Na 2 CO 3 + 2O 2
Hydroxide. In der Technik werden sie Ätzalkalien genannt (NaOH – Ätznatron, KOH – Ätzkalium). Dabei handelt es sich um farblose, schmelzbare Substanzen. Im geschmolzenen Zustand interagieren sie mit Glas, Porzellan und Platin. Daher erfolgt das Schmelzen von Alkalien in Silber- oder Eisentiegeln, mit denen sie nicht interagieren. Hydroxide sind in Wasser gut löslich und setzen eine hohe Wärmeabgabe frei.
Hydroxide werden auf folgende Weise hergestellt:
a) Wechselwirkung von Metallen oder Oxiden mit Wasser:
Li 2 O + H 2 O = 2LiOH
Diese Reaktion wird nur zur Herstellung sehr reiner Hydroxide verwendet.
b) Die Ätzreaktion ist die älteste bekannte Methode zur Herstellung von Natronlauge. Bei dieser Methode wird eine Sodalösung unter Kochen mit Calciumhydroxid (gelöschter Kalk) behandelt. Das entstehende unlösliche Calciumcarbonat wird abfiltriert oder eine klare Flüssigkeit daraus dekantiert:
Na 2 CO 3 + Ca(OH) 2 = 2NaOH + CaCO 3
Die resultierende Natriumhydroxidlösung wird durch Eindampfen im Vakuum konzentriert. Feste Natronlauge wird bei 500 °C geschmolzen, um das Wasser vollständig zu entfernen, und man erhält NaOH mit 3–4 % Na 2 CO 3 . Das auf diese Weise gewonnene NaOH wird „Natronlauge“ genannt.
c) Die Elektrolyse von Alkalimetallchloriden in wässriger Lösung ist eine moderne industrielle Methode zur gleichzeitigen Herstellung von NaOH und KOH mit Chlor. Bei der Elektrolyse einer NaCl-Lösung mit inerten Elektroden (Platin, Graphit) wird an der Anode Chlor und an der Kathode Wasserstoff freigesetzt. Im Kathodenraum reichern sich Na+-Ionen und OH--Ionen an, die NaOH bilden.
d) Durch Fusion von Alkalicarbonaten mit Oxiden und anschließende Behandlung der Legierung mit Wasserdampf:
Fe 2 O 3 + Na 2 CO 3 = 2NaFeO 2 + CO 2
2NaFeO 2 + H 2 O = 2NaOH + Fe 2 O 3
Alkalien sind die wichtigsten Rohstoffe Chemieindustrie zur Herstellung von Farbstoffen, Gläsern, Seife, Papier, Kunstfasern, Medikamenten.
Salz. NaCl und KCl kommen in der Natur in großen Mengen vor. NaCl (Speisesalz) kommt im Meerwasser (durchschnittlich 2,7 %) und als Steinsalz in bis zu mehreren Kilometer dicken Lagerstätten vor. In reiner Form werden NaCl und KCl durch Umkristallisation aus natürlichen Chloriden gewonnen. Lithiumsalze werden aus natürlichem Lithiumcarbonat gewonnen. Die Gewinnung von Rubidium- und Cäsiumsalzen ist mit Schwierigkeiten verbunden, weil ihre Löslichkeit kommt der von Kaliumsalzen sehr nahe. Normalerweise gehen sie von Mutterlaugen aus, die nach der Umkristallisation von Carnallit übrig bleiben, und isolieren daraus Rubidium und Cäsiumalaun, die durch Umkristallisation gereinigt werden. Rubidium wird von Cäsium getrennt, indem die unterschiedlichen Löslichkeiten ihrer Carbonate in Alkohol genutzt werden.
Von den Nitraten sind NaNO 3 und KNO 3 von praktischer Bedeutung. Technische Namen sind Natriumnitrat und Kaliumnitrat. Beide Salze werden als Mineraldünger verwendet. KNO 3 wird auch zur Herstellung von Schwarzpulver verwendet (NaNO 3 wird aufgrund seiner Hygroskopizität nicht verwendet).
Kohlensäure H 2 CO 3 ergibt zwei Serien von Alkalimetallcarbonaten, sauer (MHCO 3) und mittel (M 2 CO 3). Saure Carbonate (Hydrogencarbonate, Bicarbonate) sind für alle Alkalimetalle außer Lithium bekannt. Mit Ausnahme von Lithiumcarbonat sind alle neutralen Carbonate gut wasserlöslich. Na 2 CO 3 – Soda, kommt manchmal natürlicherweise im Wasser einiger Seen und Mineralquellen vor. Soda wird nach der Ammoniakmethode gewonnen: Eine Kochsalzlösung wird mit Ammoniak und Kohlendioxid gesättigt. In diesem Fall fällt NaHCO 3 aus, weil Soda ist weniger löslich als NH 4 Cl:
NaCl + H 2 O + CO 2 + NH 3 = NaHCO 3 ¯ + NH 4 Cl
2NaHCO 3 → Na 2 CO 3 + CO 2 + H 2 O
K 2 CO 3 – Kali, hygroskopisches weißes Pulver, gut wasserlöslich. Hergestellt durch Karbonisierung von Kaliumhydroxid:
2KOH + CO 2 = K 2 CO 3 + H 2 O
Kali wird in der Seifen- und Glasindustrie, beim Färben und Bleichen von Wolle, bei der Herstellung von Kaliumcyanid und in der organischen Synthese verwendet.
Schwefelsäure ergibt zwei Serien von Alkalimetallsulfaten – sauer und mittel.
Na 2 SO 4 fällt als Nebenprodukt bei der Herstellung von Salzsäure aus Natriumchlorid und Schwefelsäure an. Aus wässrige Lösungen Natriumsulfat kristallisiert als Na 2 SO 4. 10H 2 O, in der Technik wird dieses kristalline Hydrat Glaubersalz genannt. Wird zum Färben von Baumwollstoffen und in der Medizin verwendet.
Zusammenfassung einer Chemiestunde der 9. Klasse zum Thema:
„Alkalimetallverbindungen und ihre Anwendungen.“
Ziele: Wissen über Alkalimetalle und ihre Verbindungen zusammenfassen und systematisieren; Machen Sie sich mit der Verwendung dieser Verbindungen im Alltag und in der Produktion sowie ihrer Bedeutung für das Leben von Organismen vertraut
Lernziele:
1. Stellen Sie im Unterricht sicher, dass Sie sich die chemischen Eigenschaften von Alkalimetallverbindungen, ihre Verwendung im Alltag und in der Produktion sowie ihre Bedeutung im Leben von Organismen aneignen.
Entwickeln Sie weiterhin allgemeine pädagogische Fähigkeiten und Fertigkeiten im Umgang mit chemischen Reagenzien.
2. Bildung grundlegender ideologischer Vorstellungen von Ursache-Wirkungs-Beziehungen zwischen den Phänomenen der Atomstruktur eines Alkalimetalls – den Eigenschaften eines einfachen Stoffes – den Eigenschaften von Alkalimetallverbindungen und deren Anwendung auf der Grundlage der Eigenschaften.
3. Entwickeln Sie die Fähigkeit, die untersuchten Fakten zu vergleichen, zu verallgemeinern und Ihre Gedanken bei der Beantwortung logisch auszudrücken. Das kognitive Interesse von Schulkindern anhand von Daten zur Anwendung der untersuchten Phänomene im Leben um sie herum zu entwickeln.
Unterrichtsart: kombiniert - Erlernen neuer Materialien mithilfe von IKT.
Ausrüstung: Lehrbuch, Kreide, Tafel, Computer, Medienprojektor, Leinwand, Präsentation des Unterrichtsthemas, Unterrichtstechnikkarten für Schüler, chemische Reagenzien (Lösungen: Natriumhydroxid, Salzsäure, Kupfersulfat, Zinkhydroxid, Phenolphthalein) und Laborglas (Rack mit Reagenzgläsern).
Während des Unterrichts
ICH .Zeit organisieren.
II . Neues Material lernen.
1.Überprüfung zuvor untersuchten Materials zum Thema „Alkalimetalle“.
Errate die Rätsel:
1. Sie werden normalerweise in Kerosin gelagert und laufen mit Wasser.
Denken Sie in der Natur von nun an daran,
Er ist nirgendwo frei
Es ist möglich, es in Salzen zu öffnen
Die Flamme wird dadurch gelb
Und man kann es aus Salz gewinnen
Wie Davy darauf gekommen ist.
Von welchem Element reden wir? (N / A)
2. Er unterdrückt energisch.
Aus Feuchtigkeit - reiner Wasserstoff,
Es wird ersetzt durch
Und bindet Sauerstoff fest.
Dieses Element ist in Pflanzen verborgen
Durch die violette Farbe
Es kann in Salzen offen sein.
Von welchem Element reden wir? (ZU).
1.Welche Metalle haben wir in der letzten Lektion kennengelernt?
2.Warum heißen sie so?
3. Was ist ein gemeinsames Merkmal in der Struktur der Atome aller Alkalimetalle?
Test zum Thema: Alkalimetalle.
1. Für Alkalimetalle gilt nicht: a) Rubidium; c) Kalium; b) Cäsium; d) Kupfer.
2. Elektronische Formel) 2) 8) 8) 1 entspricht dem Element: a) Lithium; c) Kalium; b) Natrium;
3. Atomradius für Elemente der Gruppe I der Hauptuntergruppe mit zunehmender Kernladung:
a) ändert sich regelmäßig; c) ändert sich nicht; b) erhöht sich;
4. Alkalimetalle weisen sehr starke Eigenschaften auf:
A) oxidierende Eigenschaften; c) restaurative Eigenschaften; b) amphotere Eigenschaften;
5..Zu den physikalischen Eigenschaften von Alkalimetallen gehören nicht:
a) silberweiß; b) weich und leicht; d) feuerfest.
6. Wenn Elemente der Gruppe I der Hauptuntergruppe mit Wasser interagieren, entsteht Folgendes:
a) Säure; b) Alkali und Wasserstoff werden freigesetzt; d) Salz.
7. Natrium und Kalium werden in Kerosin gespeichert, weil sie:
a) einen stechenden Geruch haben; b) werden an der Luft leicht oxidiert;
Selbstkontrolle: keine Fehler – „5“, 1,2 Fehler – „4“, 3 Fehler – „3“, mehr – „2“
Antworten: 1- d 2 - c 3 - b 4 - c 5 - d 6 – b 7 - b.
Selbstkontrolle: keine Fehler – „5“, 1,2 Fehler – „4“, 3,4 Fehler – „3“, mehr – „2“
2. Wissen aktualisieren.
Können Alkalimetalle in freier Form in der Natur vorkommen? Warum?
Können Sie erraten, in welcher Verbindungsform sie in der Natur vorkommen?
In der Natur kommen Alkalimetalle nur in Form von Verbindungen vor.
Na und K kommen in der Natur in Form von Chloriden, Sulfaten, Silikaten usw. vor.
Li, Rb, Cs kommen in verschiedenen Mineralien vor.
Fr kommt in den radioaktiven Erzen Ac und U vor.
Auf dem Tisch: Gegenstände, die Alkalimetallverbindungen enthalten (Soda, Salz, AA-Batterien, Seife) und stellt eine Frage.
Schauen Sie sich diese Objekte an. Was haben sie Ihrer Meinung nach gemeinsam?
1Was ist eine genetische Verbindung?
2. Lassen Sie uns eine genetische Reihe von Natrium erstellen.
Na → Na 2 O → 2NaOH → Na 2 CO 3
3. Welche Verbindungsklassen bilden Alkalimetalle? Betrachten wir ihre Eigenschaften.
Während die Schüler das Material erklären und die Folien betrachten, machen sie sich Notizen zum Plan und offenbaren Eigenschaften und Anwendungen.
Alkalimetalloxide
hart, weiß, leicht löslich.
B) Chemische Eigenschaften; Die Schüler schreiben in ihr Heft: Alkalimetalloxide sind typische basische Oxide. Wie alle basischen Oxide reagieren Alkalimetalloxide mit Wasser, mit sauren Oxiden und mit Säuren.
Die Jungs schreiben die Gleichungen chemischer Reaktionen am Beispiel von Natriumoxid an die Tafel und in ihre Notizbücher:
Na 2 O + H 2 O → 2NaOH;
Na 2 O + CO 2 → Na 2 CO 3 ;
Na 2 O + H 2 CO 3 → Na 2 CO 3 + H 2 O
Alkalimetallhydroxide
.
a) physikalische Eigenschaften; Die Schüler notieren die folgenden Eigenschaften in ihren Notizbüchern: hart, weiß, gut löslich, hitzebeständig, greift Stoffe und Papier an.
b) chemische Eigenschaften
Sicherheitsbesprechung bei der Durchführung von Laborarbeiten.
Chemische Eigenschaften von Natriumhydroxid.
Ziel: Die chemischen Eigenschaften von Alkalimetallen am Beispiel von Hydroxid experimentell nachweisen
Anweisungen
Gießen Sie Natriumhydroxid in ein sauberes Reagenzglas und geben Sie ein paar Tropfen Phenolphthalein hinzu. Was beobachten Sie?
Geben Sie Salzsäurelösung in dasselbe Reagenzglas. Was beobachten Sie? Schreiben Sie die Reaktionsgleichung auf.
NaOH + HCl → NaCl + H 2 O Die Jungs schreiben die Gleichungen einer chemischen Reaktion in ionischer Form an die Tafel und in ihre Notizbücher.
Gießen Sie Natriumhydroxid in ein sauberes Reagenzglas und fügen Sie Kupfersulfatlösung hinzu. Was beobachten Sie? Schreiben Sie die Reaktionsgleichung auf.
2NaOH + CuSO 4 → Na 2 SO 4 + Cu (OH) 2 Die Jungs schreiben die Gleichungen einer chemischen Reaktion in ionischer Form an die Tafel und in ihre Notizbücher.
Ziehen Sie eine Schlussfolgerung über die chemischen Eigenschaften von Alkalimetallhydroxiden.
Alkalimetallhydroxide reagieren mit Säuren, Salzen) Anwendung – Folie Nummer 5.
Natriumhydroxid – NaOH – Natronlauge, Natronlauge, Natronlauge.
Kaliumhydroxid – KOH – Kalilauge.
NaOH
und KOH sind ätzende Laugen, die Stoffe und Papier angreifen. Die Schüler schreiben auf:Anwendung: zur Herstellung von Kunstseide , V Herstellung von Seife und SMS, Kosmetika, Medikamenten usw.Alkalimetallsalze
.
Physikalische Eigenschaften
. Die Schüler schreiben Eigenschaften in ihre Hefte. kristalline Feststoffe, fast alle wasserlöslich.
Selbstständiges Arbeiten mit dem Lehrbuchtext.
Anwendung: Ausfüllen der Tabelle aus Folie Nr. 5. Arbeit aus dem Lehrbuch S. 56 – 57
Salzformel
Name
Anwendung
NaHCO3
K2CO3
NaCl
Na 2 SO 4 ∙ 10 H 2 O
Na 2 CO 3 ∙ 10 H 2 O
Bedeutung für die Lebensaktivität von Organismen - Folie Nr. 6.
Studentenbotschaft zum Thema: „Die Bedeutung von Alkalimetallverbindungen im Leben von Organismen.“
Natrium- und Kaliumionen spielen eine wichtige biologische Rolle: Na + ist das wichtigste extrazelluläre Ion, das im Blut und in der Lymphe vorkommt, und K + ist das wichtigste intrazelluläre Ion. "Zusammenarbeiten. Das Konzentrationsverhältnis dieser Ionen reguliert den Blutdruck in einem lebenden Organismus und sorgt für die Bewegung von Salzlösungen von den Wurzeln zu den Blättern von Pflanzen. Kaliumionen – unterstützen die Funktion des Herzmuskels, helfen bei Rheuma und verbessern die Darmfunktion. Kaliumverbindungen – beseitigen Schwellungen.
V. Konsolidierung
VI. Zusammenfassung der Lektion. Zeichen setzen.
Zusammenfassung der Lektion:
Welche physikalischen und chemischen Eigenschaften sind charakteristisch für Oxide und Hydroxide von Alkalimetallen?
Wo werden Alkalihydroxide und -salze eingesetzt?
Zusätzliches Material. Das ist interessant.
Aufgabe: Warum in Antikes Griechenland Wurde den Soldaten vor langen Feldzügen bei heißem Wetter empfohlen, ein stark gesalzenes Stück Brot zu essen und Wasser zu trinken?
Elektrolytionen hydratisieren leicht, sodass Speisesalz Wasser im Körper zurückhält.
Problem: Warum essen Eskimos sehr wenig Salz?
Einer wissenschaftlichen Theorie zufolge sind alle auf der Erde lebenden Tiere, einschließlich des Menschen, Nachkommen von Organismen, die im Meer aufgetaucht sind und dort gelebt haben. Die Körperflüssigkeit dieser Lebewesen bestand aus Meerwasser. Nachdem sie an Land gezogen waren, blieben sie erhalten Meerwasser als Körperflüssigkeit. Doch die Natur ist nicht in der Lage, lebenden Organismen ausreichend Salz in seiner natürlichen Form zur Verfügung zu stellen. Da sich Salz in Wasser löst, wird ein großer Teil davon durch Regenwasser aus dem Boden in Flüsse, Meere und Ozeane gespült. Dadurch enthalten Pflanzen, die auf dem Boden wachsen, nicht genügend Salz. Deshalb brauchen pflanzenfressende Tiere Salz. Der Körper verliert jeden Tag eine gewisse Menge an salzhaltiger Flüssigkeit und kann durch pflanzliche Lebensmittel nicht wieder aufgefüllt werden. Tiere, die sich von anderen Tieren ernähren, benötigen kein zusätzliches Salz. Das benötigte Salz gewinnen sie aus den Körpern ihrer Opfer. Eskimos essen hauptsächlich Fleisch, daher ist ihr Salzbedarf sehr gering.
Ziel: Warum ist in England in den letzten Jahrzehnten ein Rückgang der Sterblichkeit aufgrund zerebrovaskulärer Erkrankungen zu verzeichnen?
Dies ist auf den erhöhten Verzehr von frischem Obst und Gemüse zurückzuführen. Frisches Gemüse und Obst enthalten immer viel Kalium und wenig Natrium. Natrium speichert Wasser im Körper und nimmt zu arterieller Druck und Kalium hingegen hilft, es zu reduzieren. Deshalb kann ein erhöhter Verzehr von Gemüse und Obst, insbesondere von Äpfeln, als wesentliche Maßnahme zur Vorbeugung zerebrovaskulärer Erkrankungen angesehen werden.
WOHER KOMMT DIE LIEBE DER MENSCHEN ZUM SALZ? .
Salz dient dazu, Lebensmittel vor Verderb und Fäulnis zu bewahren. Zur Konservierung von Lebensmitteln (als es noch keine Kühl- und Gefrierschränke gab) wurde Salz verwendet. Nachdem man Gemüse aus Salzlake probiert hatte, begann man, frisches Gemüse einzulegen, zu fermentieren und einzuweichen. Ein Mensch ist es so gewohnt, alles zu salzen, dass er sogar bereit ist, einige Krankheiten in Kauf zu nehmen, nur um nicht auf eine salzfreie Ernährung umzusteigen. Nach und nach habe ich mir angewöhnt, alle Arten von Lebensmitteln zu salzen, ohne es überhaupt probiert zu haben.
VIEL SALZ – WENIG KALIUM, WENIG KALIUM – VIELE KRANKHEITEN
Die Salzfrage ist eine Frage des Kalium-Natrium-Gleichgewichts. Es ist äußerst wichtig im Körper. Kalium und Natrium konkurrieren ständig um ihre Präsenz in den Zellen. Speisesalz enthält kein Kalium, es besteht ausschließlich aus Natrium. Unser Körper benötigt dringend Kalium, das viermal mehr als Natrium sein sollte. Der Körper sammelt überall Kalium, aber übermäßiger Konsum von Speisesalz macht alle Bemühungen zunichte. Daher kommt es bei übermäßigem Salzkonsum zu einem Kaliummangel, der mit der Zeit zu einer Reihe von Beschwerden führt: körperliche und geistige Müdigkeit, schlechter Schlaf, Krämpfe, Gelenkschmerzen.
Überschüssiges Natrium (Salz) überlastet das Herz. Möchten Sie wissen, ob Sie zu viel Salz zu sich nehmen? Gehen Sie zum Spiegel: Ein weißer Kreis um die Iris des Auges weist auf eine übermäßige Salzaufnahme hin.
Ätzendes Kalium
Ätzkalium wird zur Herstellung von Düngemitteln, synthetischem Kautschuk, Elektrolyten für Batterien und Reagenzien sowie in der Pharmaindustrie und anderen Sektoren der Volkswirtschaft verwendet.
Der Transport von Kaliumlauge erfolgt auf der Schiene und auf der Straße gemäß den für diese Transportart geltenden Vorschriften für den Gütertransport.
Ätzkalium wird in einem hermetisch verschlossenen Behälter aufbewahrt, weil es „verbreitet“ sich in der Luft und nimmt Feuchtigkeit aus ihr auf.
Sein traditioneller Name „Ätzkalium“ spiegelt die ätzende Wirkung dieser Substanz auf lebendes Gewebe wider. Kommt ätzendes Kalium mit der Haut in Berührung, sind Verätzungen möglich.
Schmierseifen werden durch Verseifung von Ölen und Fetten mit Ätzkali gewonnen. Alle diese Seifen haben eine weiche, cremige Konsistenz.
Natriumhydroxid.
Das am häufigsten vorkommende Alkali. Jährlich werden weltweit mehr als 57 Millionen Tonnen Ätzalkali produziert und verbraucht.
Natronlauge wird in den unterschiedlichsten Branchen und für den häuslichen Bedarf eingesetzt:
In der Zellstoff- und Papierindustrie bei der Herstellung von Papier, Pappe, Kunstfasern, Holzfaserplatten.
Zur Verseifung von Fetten bei der Herstellung von Seife, Shampoo und anderen Waschmitteln.
In der chemischen Industrie – zur Neutralisierung von Säuren und Säureoxiden, als Reagenz oder Katalysator in chemische Reaktionen usw.
Natronlauge (Natriumhydroxid) ist eine ätzende und ätzende Substanz. Es gehört zu Stoffen der 2. Gefahrenklasse. Daher ist bei der Arbeit damit Vorsicht geboten.
Bei Kontakt mit Haut, Schleimhäuten und Augen kommt es zu schweren Verätzungen. Bei Kontakt der Schleimhäute mit Ätzalkali ist es notwendig, die betroffene Stelle mit einem Wasserstrahl und bei Hautkontakt mit einer schwachen Essigsäurelösung abzuspülen.
Auf Lithium – zu den Sternen
Hersteller von Mobiltelefonen, Taschengeräten und Laptops benötigen dieses Metall dringend. Kernenergie verbraucht Lithium (Li) in großen Mengen; Theoretikern zufolge ist es dieses Alkalimetall, das den Schlüssel zur thermonuklearen Energie liefern kann. Der Mächtigste sein psychotrope Substanz, Li wird in der militärischen und angewandten Psychiatrie verwendet (und die Art der Wirkung von Li auf die menschliche Psyche ist nicht vollständig geklärt). Lithiumdeuterid wird in einer Wasserstoffbombe als Arbeitsstoff und Explosionskraftregler verwendet.
Dieses Metall wird auch für die Erforschung des Weltraums benötigt.
Routenführung für Schüler für den Unterricht
Thema: Verbindungen von Alkalimetallen.
Prüfen


